Первый слайд презентации: Решение задач по теме «Растворы»
Слайд 2
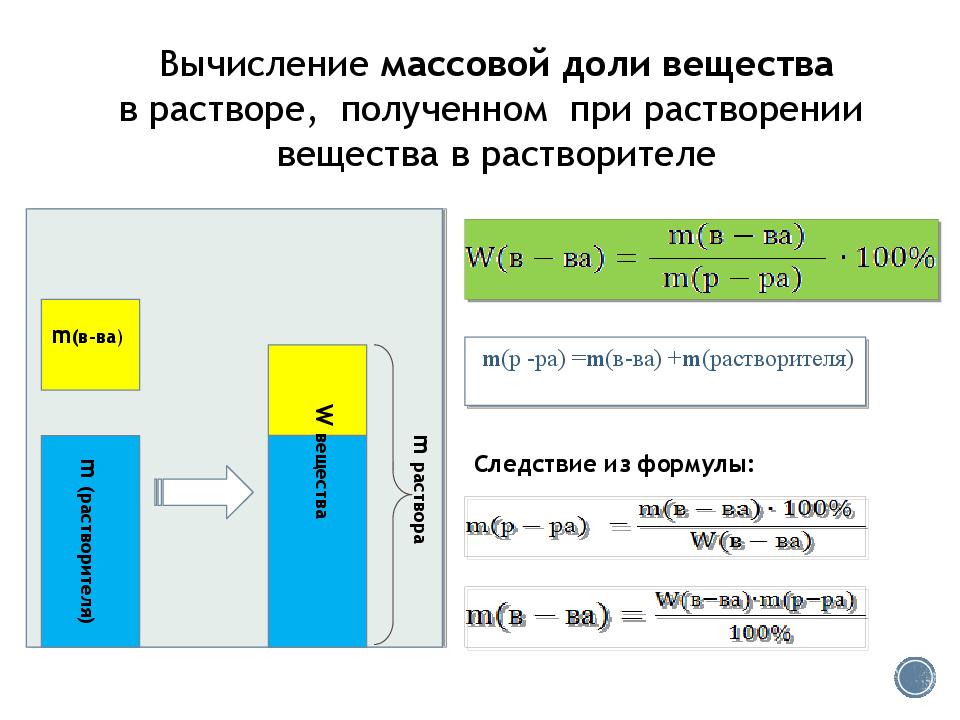
m ( растворителя) m ( в-ва ) m раствора W вещества m ( р - ра ) = m ( в-ва ) + m (растворителя) Вычисление массовой доли вещества в растворе, полученном при растворении вещества в растворителе Следствие из формул ы:
Слайд 3
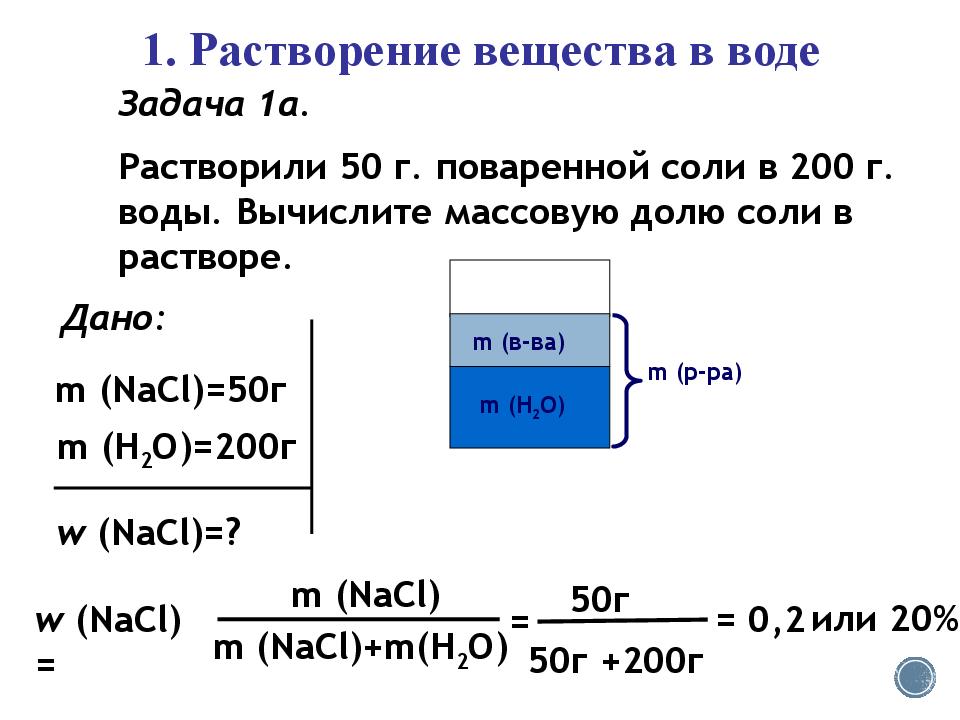
1. Растворение вещества в воде Задача 1а. Растворили 50 г. поваренной соли в 200 г. воды. Вычислите массовую долю соли в растворе. Дано: m (N аCl )=50 г m (H 2 O)=200 г w (N аCl )=? m ( в-ва ) m (р -ра ) m (H 2 O) w (N аCl ) = m (N аCl ) m (N аCl )+m(H 2 O) = 50г 50г +200г = 0,2 или 20%
Слайд 4: Решение задач
Сколько грамм соли и воды нужно взять для приготовления 150 г 15% раств о ра? Дано: m ( раствора )= 1 50 г m (H 2 O ) - ? m ( N аCl ) - ? w (N аCl )= 15 % m ( H 2 O ) = m ( раствора ) - m(N аCl )
Слайд 5: Решите самостоятельно
Сколько грамм воды и сахара нужно взять для приготовления 300 г 15% раств о ра? Дано: m ( раствора )= 300г m (H 2 O ) - ? m ( сахара ) - ? w ( сахара )= 15 % m ( H 2 O ) = m ( раствора ) - m(N аCl )
Слайд 6: Проверяем домашнее задание
Составить и решить на отдельном листике две СВО И задачи Задача 1. В ________ г воды растворили ______ г поваренной соли. Рассчитайте массовую долю соли в полученном растворе. Задача 2. Требуется приготовить __________ г раствора с массовой долей _________ %. Рассчитайте массу требуемых сахара и воды. Проверяем домашнее задание
Слайд 7: Тестовые задания
Отметьте, какие из следующих четырех утверждений относительно массовой доли растворенного вещества правильные, а какие — неправильные. А. Массовая доля — это доля молекул растворенного вещества в растворе. Б. Массовая доля — это отношение массы растворенного вещества к массе раствора, выраженное в процентах. В. Массовая доля — это отношение массы молекулы растворенного вещества к массе молекулы воды. Г. Массовая доля — это отношение количества молекул растворенного вещества к количеству молекул растворителя.
Слайд 8: Тестовые задания
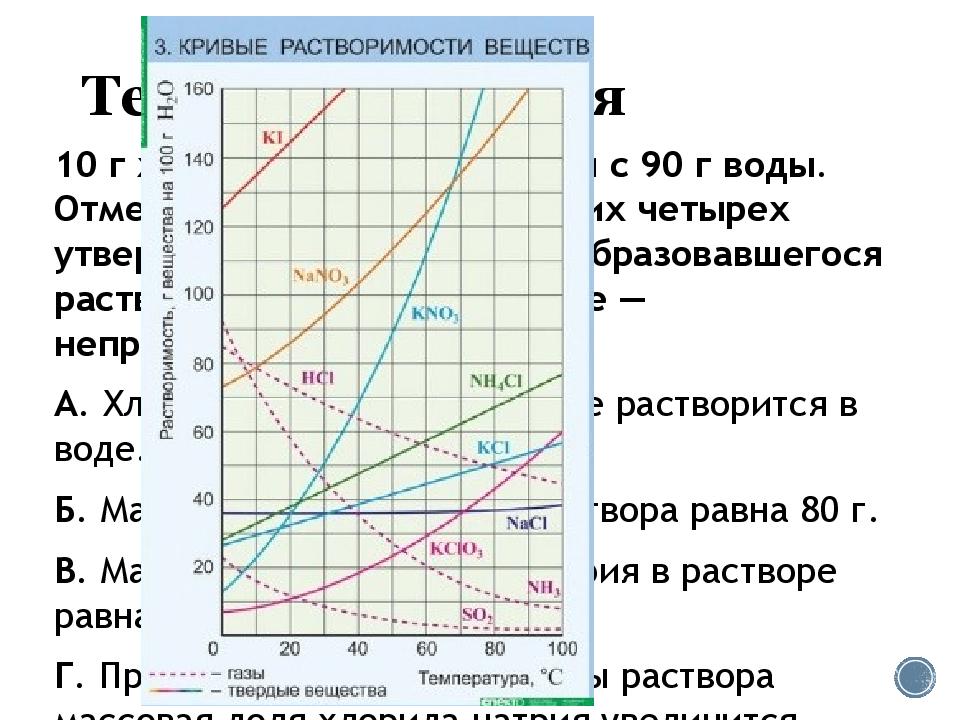
10 г хлорида натрия смешали с 90 г воды. Отметьте, какие из следующих четырех утверждений относительно образовавшегося раствора правильные, а какие — неправильные. А. Хлорид натрия полностью не растворится в воде. Б. Масса образовавшегося раствора равна 80 г. В. Массовая доля хлорида натрия в растворе равна 11,1%. Г. При повышении температуры раствора массовая доля хлорида натрия увеличится.
Слайд 9: Тестовые задания
В 250 г раствора сульфата меди (II) содержится 50 г этой соли. Отметьте, какие из следующих четырех утверждений относительно этого раствора правильные, а какие — неправильные. А. Раствор сульфата меди имеет красную окраску. Б. Масса воды в этом растворе равна 300 г. В. Массовая доля сульфата меди в этом растворе равна 17%. Г. При понижении температуры из этого раствора начнут выделяться пузырьки газа. Тестовые задания
Слайд 10: Домашнее задание
Решить задачу №5 (стр. 59 - учебник) по образцу на следующем слайде Готовиться к СР по задачам (выберу из составленных Вами) Пусть вас не пугают [ МЛ ] в задаче Вспомните (или узнайте в инете) плотность воды и как относятся друг к другу плотность и масса воды
Последний слайд презентации: Решение задач по теме «Растворы»
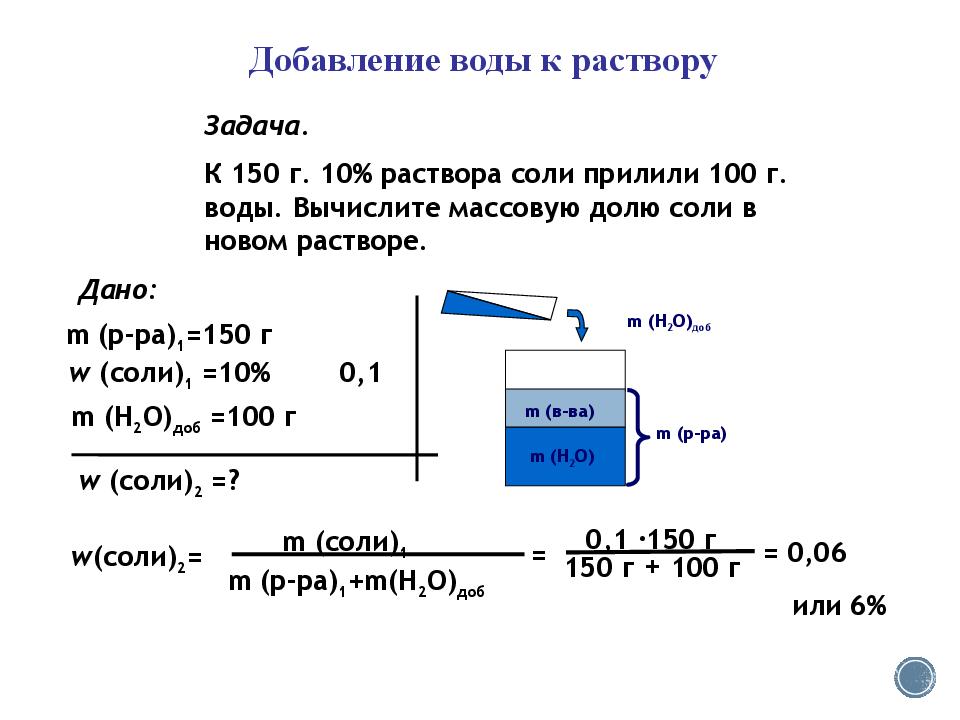
Добавление воды к раствору Задача. К 150 г. 10% раствора соли прилили 100 г. воды. Вычислите массовую долю соли в новом растворе. w (соли) 2 = m (соли) 1 m (р- ра ) 1 +m(H 2 O) доб = 0,1 150 г 150 г + 100 г = 0,06 или 6% . Дано: m (р- ра ) 1 =150 г w (соли) 2 =? w (соли) 1 =10% 0,1 m (H 2 O) доб =100 г m ( в-ва ) m (р -ра ) m (H 2 O) m (H 2 O) доб