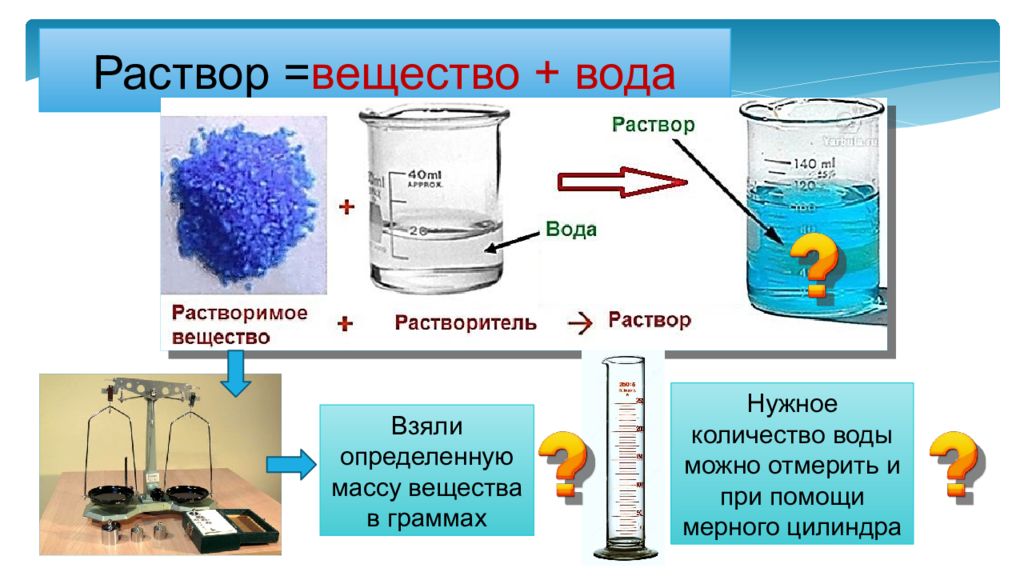
Слайд 2: Раствор = вещество + вода
Взяли определенную массу вещества в граммах Нужное количество воды можно отмерить и при помощи мерного цилиндра
Слайд 3: Массовая доля растворенного вещества
Существуют различные способы выражения концентрации растворённого вещества в растворе. Мы познакомимся с массовой долей растворённого вещества. ω ( р.в.) – это безразмерная величина, равная отношению массы растворённого вещества m ( р.в.) к общей массе раствора m (р- ра ) : m( р- ра ) = m( р.в.) + m( Н 2 О)
Слайд 4
Массовую долю растворённого вещества можно выражать в процентах. Тогда м ассовую долю растворенного вещества называют ПРОЦЕНТНОЙ КОНЦЕНТРАЦИЕЙ раствора: Физический смысл «массовой доли растворенного вещества». Пример : массовая доля растворённого вещества CaCl 2 в воде равна 0,06 или 6%. Это означает, что в растворе хлорида кальция массой 100г содержится хлорид кальция массой 6г и вода массой 94г. 100г раствора CaCl 2 = 6г CaCl 2 + 94г Н 2 О Массовая доля растворенного вещества
Слайд 5
Решение задачи Сколько грамм поваренной соли и воды нужно взять для приготовления 200 г 15% раствора? Дано: m (р- ра ) = 200 г ω (в- ва ) = 15% Найти: m ( H 2 O ); m (в- ва ). Решение: Запишем формулу для расчёта массовой доли: 2. Преобразуем формулу и вычислим массу растворённого вещества в растворе: m ( в - ва ) = ( ω ( в - ва ) · m ( р - ра ) ) / 100% m (в- ва ) = (15 % · 200 г) / 100% = 30 г 3. Вычислим массу растворителя – воды: m( р - ра ) = m( в - ва ) + m ( H 2 O ) m ( H 2 O ) = m( р - ра ) - m( в - ва ) = 200 г - 30 г = 170 Ответ: для приготовления 200 г 15% раствора надо взять 30г соли и 170 г воды.
Слайд 6: Объемная доля газов в смеси
Для того чтобы выразить состав смеси газов количественно, используют величину «объемная доля газов в смеси». Объемную долю газа в смеси обозначают греческой буквой – «фи». Объемная доля газов в смеси - это отношение объема данного газа к общему объему смеси : • 100%
Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ. Физический смысл величины « Объемная доля газов» => в 100 л воздуха содержатся следующие компоненты: 78 л азота, 21 л кислорода, 30 мл углекислого газа, 97 мл благородных газов (главным образом аргон). Пример: Сумма объемных долей всех газов в воздухе : ( N 2 ) + ( O 2 ) + ( CO 2 ) + ( др.газы ) = 78% + 21% + 0,03% + 0,97% = 100%.
Слайд 8: Решение задач
Пример 1. Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты. Дано: V(смеси) = 50 мл, V(СО 2 ) = 48,5 мл, V( N 2 ) = 1,5 мл. Найти: ( СО 2 ), ( N 2 ) Решение: 1) рассчитаем объемную долю углекислого газа в смеси ( СО 2 ) = 48,5 мл : 50 мл = 0,97 или 97% 2) рассчитаем объемную долю азота в смеси ( СО 2 ) + ( N 2 ) = 100%, ( N 2 ) = 100% – ( СО 2 ) = 100% – 97% = 3%. Ответ: ( СО 2 ) = 97%, ( N 2 ) = 3%.
Слайд 9
Пример 2. Вычислите объем кислорода, содержащегося в 500 л воздуха, если доля кислорода 0,21? Решение: 1) Запишем исходную формулу: 2) Преобразуем формулу: V (в- ва ) = V (смеси) • ( в- ва ) V(О 2 ) = V( возд.) • ( О 2 ) 3) Подставим в полученную формулу числа и рассчитаем объем кислорода: V(О 2 ) = 500(л) • 0,21 = 105 л Дано: V (воздуха) = 500 л ( О 2 ) = 0,21 Найти: V (О 2 ) Ответ: в 500л воздуха содержится 105 л кислорода.