Первый слайд презентации: СОЕДИНЕНИЯ ХРОМА
Составитель: И.Н. Пиялкина, учитель химии МБОУ СОШ №37 города Белово
Слайд 2
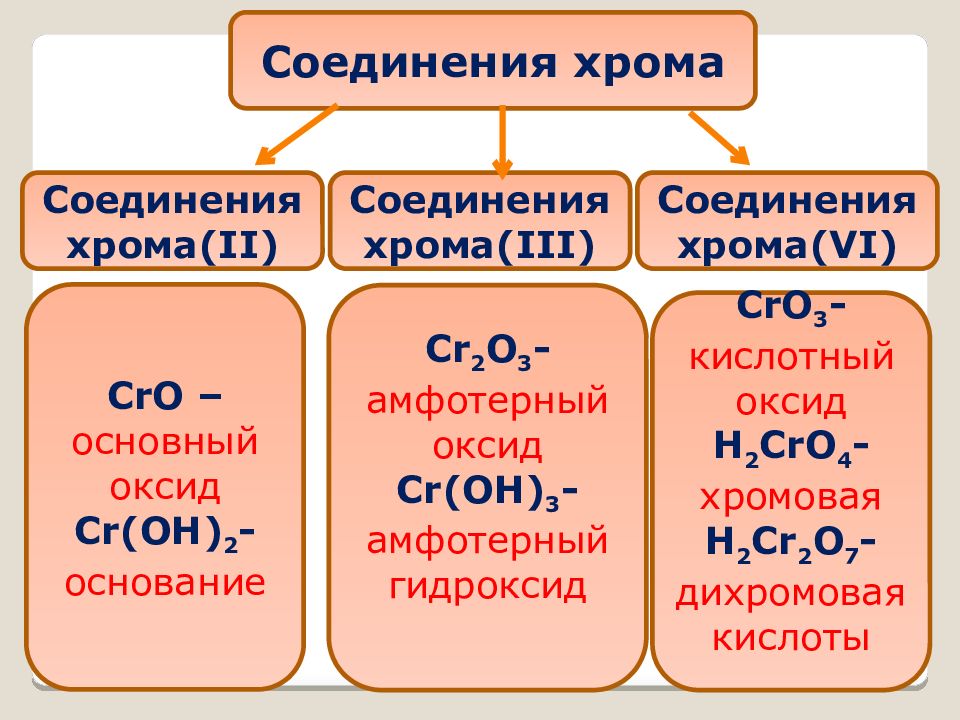
Соединения хрома Соединения хрома (II) Соединения хрома (III) Соединения хрома (VI) CrO – основный оксид Cr(OH) 2 - основание CrO 3 - кислотный оксид H 2 CrO 4 - хромовая H 2 Cr 2 O 7 - дихромовая кислоты Cr 2 O 3 - амфотерный оксид Cr(OH) 3 - амфотерный гидроксид
Слайд 3
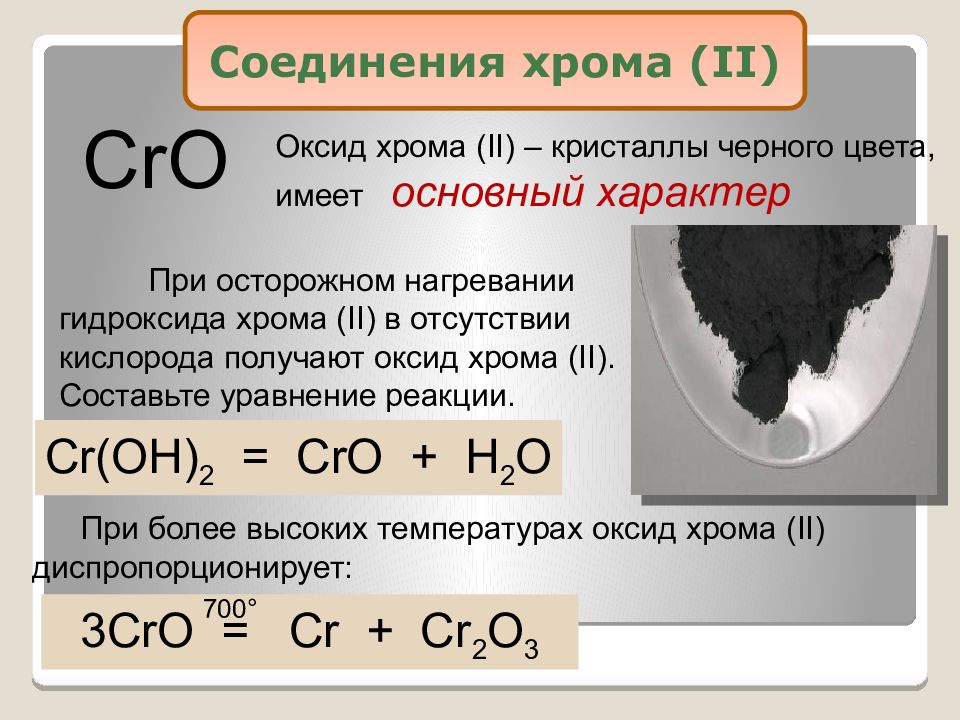
CrO Оксид хрома ( II) – кристаллы черного цвета, имеет основный характер При осторожном нагревании гидроксида хрома ( II) в отсутствии кислорода получают оксид хрома ( II). Составьте уравнение реакции. Cr(OH) 2 = CrO + H 2 O 3CrO = Cr + Cr 2 O 3 При более высоких температурах оксид хрома ( II) диспропорционирует: 700° Соединения хрома ( II)
Слайд 4
Оксида хрома ( II ) реагирует с соляной и серной кислотами. Рассмотрите реакции с точки зрения ТЭД. CrO + H 2 SO 4 = CrSO 4 + H 2 O CrO + 2H + + Cl – = Cr 2+ + 2Cl – + H 2 O CrO + 2H + = Cr 2+ + H 2 O CrO + 2HCl = CrCl 2 + H 2 O CrO + 2H + + SO 4 2– = Cr 2+ + SO 4 2– + H 2 O CrO + 2H + = Cr 2+ + H 2 O
Слайд 5
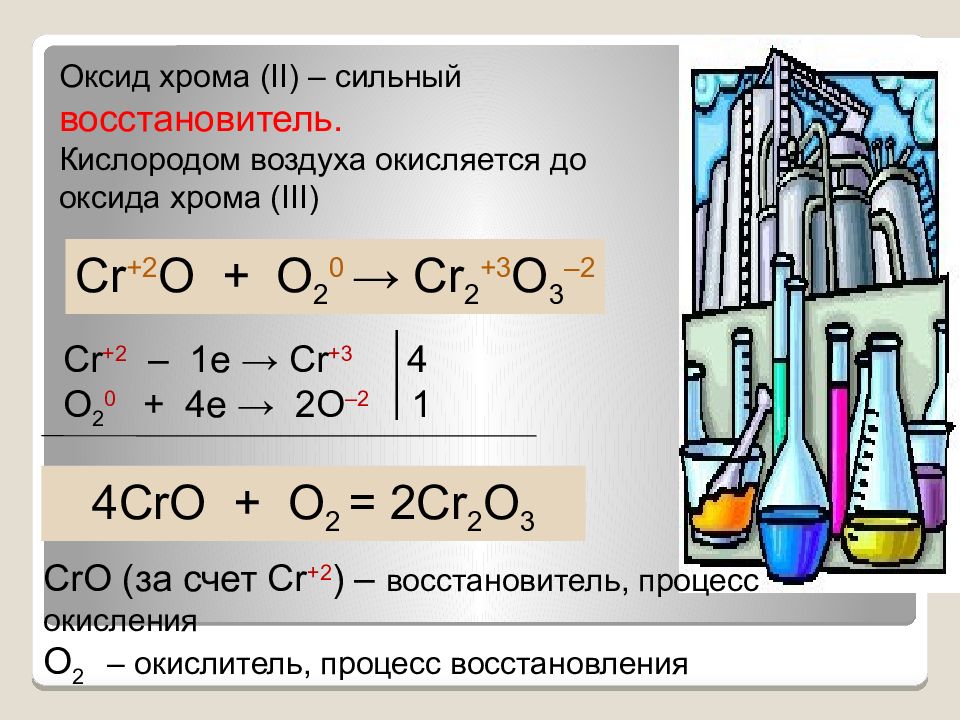
Оксид хрома ( II ) – сильный восстановитель. Кислородом воздуха окисляется до оксида хрома ( III ) Cr +2 O + O 2 0 → Cr 2 +3 O 3 –2 Cr +2 – 1e → Cr +3 4 O 2 0 + 4e → 2O –2 1 4CrO + O 2 = 2Cr 2 O 3 CrO ( за счет Cr +2 ) – восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
Слайд 6
Cr(OH) 2 Гидроксид хрома ( II) Гидроксид хрома ( II ) получают в виде желтого осадка действием растворов щелочей на соли хрома ( II ) без доступа воздуха. CrCl 2 + 2NaOH = Cr(OH) 2 ↓ + 2NaCl Cr 2+ + 2Cl – +2Na + +2OH – = Cr(OH) 2 ↓+ 2Na + + 2 Cl – Cr 2+ + 2OH – = Cr(OH) 2 ↓
Слайд 7
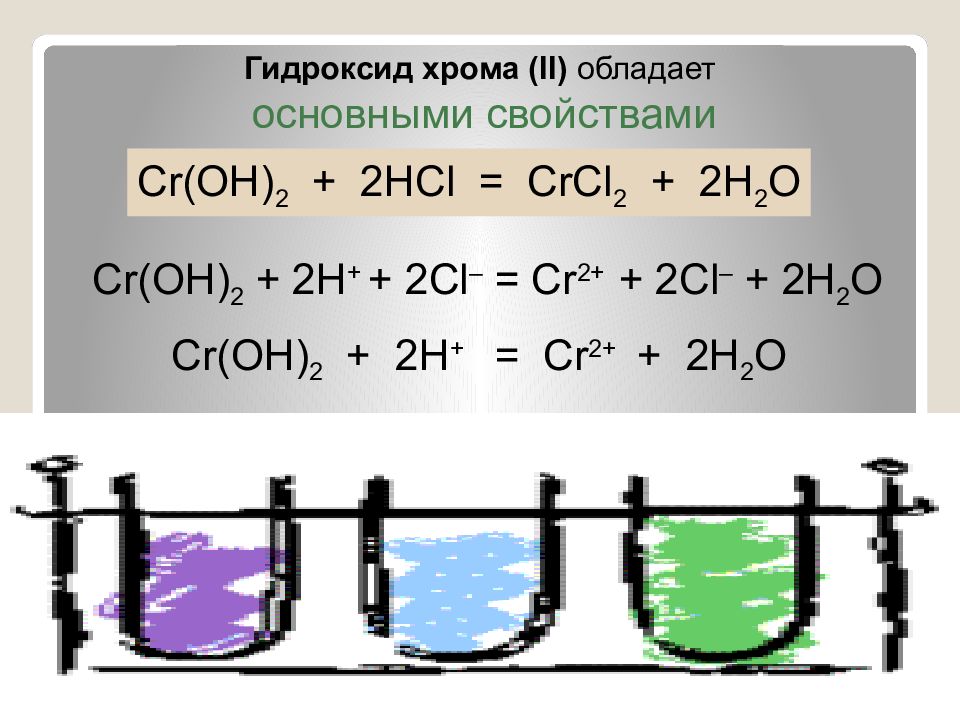
Гидроксид хрома ( II ) обладает основными свойствами Cr ( O Н) 2 + 2HCl = CrCl 2 + 2 H 2 O Cr ( O Н) 2 + 2H + + 2 Cl – = Cr 2+ + 2Cl – + 2 H 2 O Cr ( O Н) 2 + 2H + = Cr 2+ + 2 H 2 O
Слайд 8
Гидроксид хрома ( II ) – сильный восстановитель Кислородом воздуха окисляется до гидроксида хрома ( III ) Cr +2 (ОН) 2 + O 2 0 + Н 2 О → Cr +3 ( O –2 Н) 3 Cr +2 – 1e → Cr +3 4 O 2 0 + 4e → 2O –2 1 4Cr ( O Н) 2 + O 2 + 2Н 2 О = 4 Cr ( O Н) 3 Cr ( O Н) 2 ( за счет Cr +2 ) – восстановитель, процесс окисления O 2 – окислитель, процесс восстановления
Слайд 9
Соли хрома ( II) Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинком в кислой среде солей трехвалентного хрома. Безводные соли хрома (II) белого цвета, а водные растворы и кристаллогидраты — синего цвета. Соединения хрома (II) – сильные восстановители. Легко окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома. Реагируют с концентрированными серной и азотной кислотами: 4 CrCl 2 + O 2 + 4 HCl → 4 CrCl 3 + 2 H 2 O 2 CrCl 2 + 4 H 2 SO 4 → Cr 2 (SO 4 ) +SO 2 ↑ + 4 HCl ↑ + 2 H 2 O CrCl 2 + 4 HNO 3 → Cr(NO 3 ) 3 + NO 2 ↑ + 2 HCl ↑ + H 2 O
Слайд 10
Cr 2 O 3 Оксид хрома ( III ) – тугоплавкий порошок темно-зеленого цвета. Получение ^ В лабораторных условиях термическим разложением дихромата аммония: (NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 2H 2 O В промышленности восстановлением дихромата калия коксом или серой: K 2 Cr 2 O 7 + 3C = 2Cr 2 O 3 + 2K 2 CO 3 + CO 2 K 2 Cr 2 O 7 + S = 2Cr 2 O 3 + K 2 SO 4 t° t° t° Соединения хрома ( III)
Слайд 11
Оксид хрома (III) обладает амфотерными свойствами При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции оксида хрома ( III ) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Cr 2 O 3 + 6HCl = 2CrCl 3 + 3H 2 O Cr 2 O 3 + 6 H + + 6 Cl – = 2 Cr 3 + + 6 Cl – + 3 H 2 O Cr 2 O 3 + 6 H + = 2 Cr 3 + + 3 H 2 O
Слайд 12
При сплавлении оксида хрома ( III ) с оксидами, гидроксидами и карбонатами щелочных и щелочноземельных металлов образуются хромиты : С r 2 O 3 + Ba (OH) 2 = Ba (CrO 2 ) 2 + H 2 O С r 2 O 3 + Na 2 CO 3 = 2NaCrO 2 + CO 2 t° t° Оксид хрома (III) нерастворим в воде.
Слайд 13
В окислительно-восстановительных реакциях оксид хрома (III) ведет себя как восстановитель и переходит в хромат: Cr 2 O 3 + KOH + KMnO 4 → K 2 CrO 4 + MnO 2 + H 2 O Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Cr 2 O 3 + KOH + С a( ClO ) 2 → K 2 CrO 4 + CaCl 2 + H 2 O Cr 2 O 3 + O 2 + Na 2 CO 3 → Na 2 CrO 4 + CO 2 Cr 2 O 3 + KClO 3 + Na 2 CO 3 → Na 2 CrO 4 + KCl + CO 2 Cr 2 O 3 +NaNO 3 + Na 2 CO 3 →Na 2 CrO 4 +NaNO 2 + CO 2
Слайд 14
Оксид хрома ( III) – катализатор В присутствии оксида хрома ( III) аммиак окисляется кислородом воздуха до монооксида азота, который в избытке кислорода окисляется до бурого диоксида азота.
Слайд 15
Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха происходит очень легко в присутствии оксида хрома ( III ) Реакция окисления спирта протекает с выделением энергии. Продукт реакции окисления спирта - уксусный альдегид. Cr 2 O 3, t° 2СН 3 –СН 2 –ОН + О 2 2СН 3 – С ═ О + 2 H 2 O H
Слайд 16
Гидроксид хрома ( III) Cr(OH) 3 Получают гидроксид хрома ( III) действием растворов щелочей или аммиака на растворы солей хрома ( III). Составьте уравнение реакции получения Cr(OH) 3 действием раствора аммиака на хлорид хрома ( III ): CrCl 3 + 3(NH 3 ·H 2 O) = Cr(OH) 3 + 3NH 4 Cl Лабораторный опыт № 1 К раствору хлорида хрома ( III ) прилейте раствор аммиака. Что наблюдаете?
Слайд 17
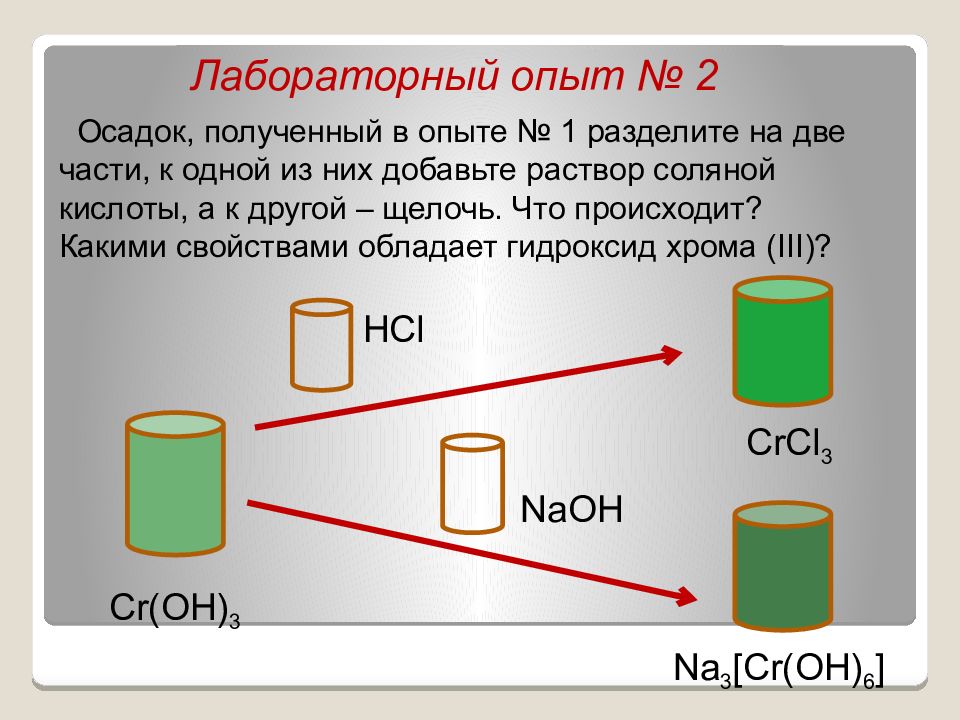
Лабораторный опыт № 2 Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте раствор соляной кислоты, а к другой – щелочь. Что происходит? Какими свойствами обладает гидроксид хрома ( III) ? Cr(OH) 3 CrCl 3 Na 3 [Cr(OH) 6 ] NaOH HCl
Слайд 18
+ H 2 SO 4 + NaOH Осадок, полученный в опыте № 1 разделите на две части, к одной из них добавьте серной кислоты, а к другой – щелочь. Что происходит?
Слайд 19
Гидроксид хрома (III) обладает амфотерными свойствами. При взаимодействии с кислотами образуются соли хрома (III): Составьте уравнение реакции гидроксида хрома ( III ) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Cr(OH) 3 + 3HCl = CrCl 3 + 3H 2 O Cr(OH) 3 + 3H + + 3Cl – = Cr 3 + + 3Cl – + 3 H 2 O Cr(OH) 3 + 3H + = Cr 3 + + 3 H 2 O
Слайд 20
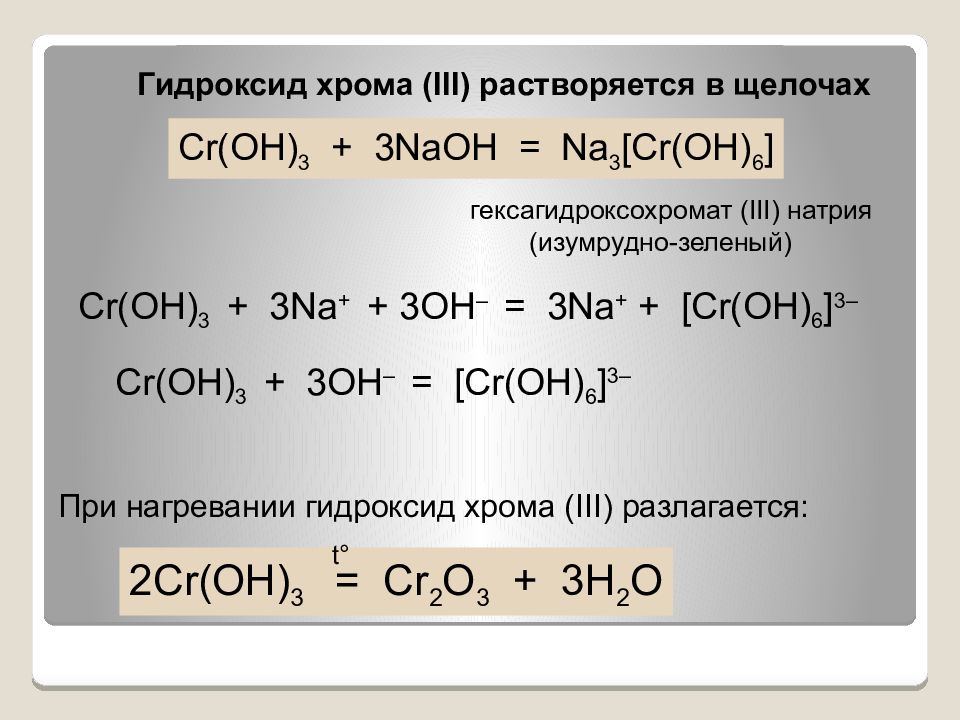
Cr(OH) 3 + 3NaOH = Na 3 [Cr(OH) 6 ] Cr(OH) 3 + 3Na + + 3OH – = 3Na + + [Cr(OH) 6 ] 3– Cr(OH) 3 + 3OH – = [Cr(OH) 6 ] 3– 2Cr(OH) 3 = Cr 2 O 3 + 3H 2 O t° Гидроксид хрома ( III ) растворяется в щелочах При нагревании гидроксид хрома ( III ) разлагается: гексагидроксохромат ( III) натрия (изумрудно-зеленый)
Слайд 21
Соли хрома ( III) Бывают двух видов: CrCl 3 - хроматы ( III ) и хромиты NaCrO 2 или гидроксокомплексы Na 3 [Cr(OH) 6 ] СВОЙСТВА: 1. Хроматы ( III ) в щелочной среде образуют гидроксид хрома( III ), который сразу растворяется, образуя гидроксокомплексы. CrCl 3 + 3 KOH ( нед.) → Cr ( O Н) 3 + 3 KCl CrCl 3 + 6KOH (изб.) → К 3 [Cr(OH) 6 ] + 3 KCl 2. Хромиты устойчивы в щелочной среде, в кислой разрушаются: NaCrO 2 + HCl ( нед.) + H 2 O = Cr(OH) 3 + NaCl NaCrO 2 + 4HCl (изб.) = CrCl 3 + NaCl + 2H 2 O с угольной кислотой Na 3 [Cr(OH) 6 ] + 3CO 2 = Cr(OH) 3 + 3NaHCO 3
Слайд 22
Соли хрома ( III) 3. Взаимный гидролиз: при смешивании солей хрома ( III ) с растворами сульфидов, сульфитов, карбонатов происходит выпадение осадка гидроксида хрома ( III ) и выделение газа Cr 2 S 3 + 6H 2 O = 2Cr(OH) 3 + 3H 2 S В водных растворах катион Cr 3+ встречается только в виде гидратированного иона [Cr(H 2 O) 6 ] 3 +, который придает раствору сине-фиолетовый цвет. 2 CrCl 3 + 3 Na 2 S + 6 H 2 O → 2 Cr ( O Н) 3 + 3Н 2 S + 3 NaCl 4. В растворе подвергаются полному гидролизу:
Слайд 23
Сульфат хрома ( III ) образует двойные соли – хромовые квасцы Из смешанного раствора сульфата хрома ( III ) и сульфата калия кристаллизуется двойная соль – KCr(SO 4 ) 2 ·12H 2 O сине-фиолетового цвета. Применяются в качестве дубящего вещества при изготовлении эмульсий, а также в дубящих растворах и дубящих фиксажах.
Слайд 24
Соединения хрома ( III) могут проявлять как окислительные так и восстановительные свойства. Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. Назовите окислитель и восстановитель. K 3 [Cr(OH) 6 ] +Br 2 +KOH → K 2 CrO 4 + KBr + H 2 O CrCl 3 + H 2 O 2 + KOH → K 2 CrO 4 + KCl + H 2 O KCrO 2 +PbO 2 + KOH → K 2 CrO 4 +K 2 PbO 2 + H 2 O Cr 2 (SO 4 ) 3 +Cl 2 + NaOH → Na 2 CrO 4 + NaCl +H 2 O +Na 2 SO 4 CrCl 3 + Zn → CrCl 2 + ZnCl 2
Слайд 25
Получают CrO 3 действием избытка концентрированной серной кислоты на насыщенный водный раствор дихромата натрия: Na 2 Cr 2 O 7 + 2H 2 SO 4 = 2 CrO 3 + 2NaHSO 4 + H 2 O Оксид хрома ( VI) очень ядовит. 4CrO 3 → 2Cr 2 O 3 + 3O 2 ↑. При нагревании выше 250 °C разлагается: Оксид хрома (VI) CrO 3 — хромовый ангидрид, представляет собой темно-красные игольчатые кристаллы. Соединения хрома ( V I )
Слайд 26
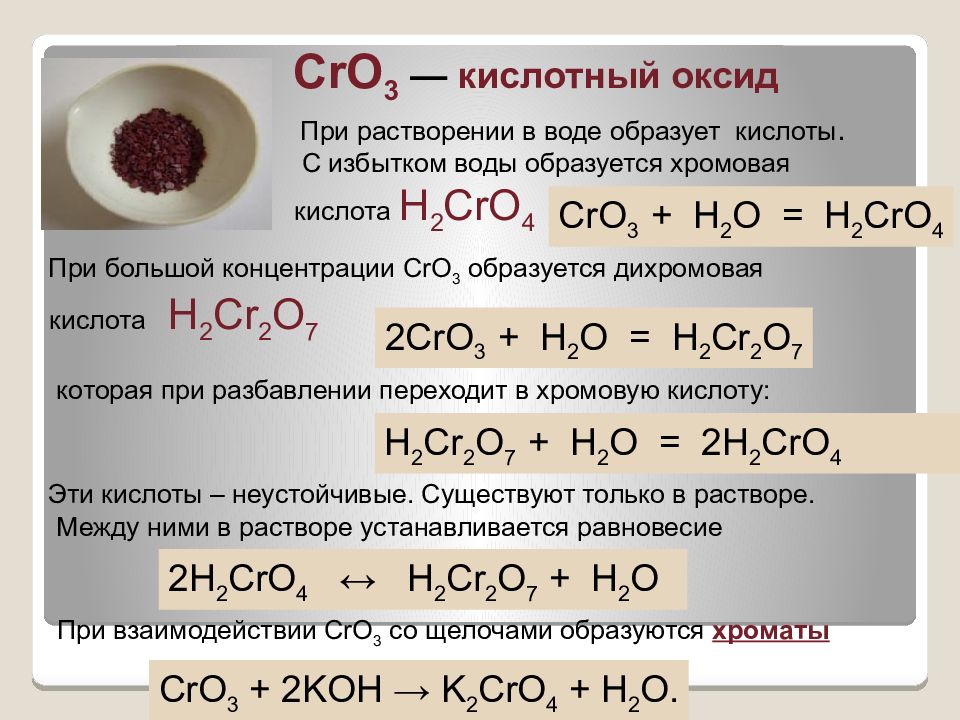
CrO 3 — кислотный оксид С избытком воды образуется хромовая кислота H 2 CrO 4 CrO 3 + Н 2 O = Н 2 CrO 4 При большой концентрации CrO 3 образуется дихромовая кислота Н 2 Cr 2 О 7 2CrO 3 + Н 2 O = Н 2 Cr 2 O 7 которая при разбавлении переходит в хромовую кислоту: Н 2 Cr 2 О 7 + Н 2 О = 2Н 2 CrO 4 При растворении в воде образует кислоты. Эти кислоты – неустойчивые. Существуют только в растворе. Между ними в растворе устанавливается равновесие 2Н 2 CrO 4 ↔ Н 2 Cr 2 O 7 + Н 2 O При взаимодействии CrO 3 со щелочами образуются хроматы CrO 3 + 2KOH → K 2 CrO 4 + H 2 O.
Слайд 27
CrO 3 является сильным окислителем Например этанол, ацетон и многие другие органические вещества самовоспламеняются или даже взрываются при контакте с ним. Окисляет йод, серу, фосфор, уголь. 4CrO 3 + 3S = 2Cr 2 O 3 + 3SO 2 ↑ 4CrO 3 + C 2 H 5 OH → 2 CO 2 + 2 Cr 2 O 3 + 3 H 2 O
Слайд 28
Если поместить оксид хрома на фарфоровую пластинку и капнуть на него несколько капель ацетона,то через несколько секунд ацетон загорается. При этом оксид хрома ( VI ) восстанавливается до оксида хрома ( III ), а ацетон окисляется до углекислого газа и воды. Окисление ацетона хромовым ангидридом (видео) 16 CrO 3 + 3 CH 3 – С – CH 3 → 9 CO 2 + 8 Cr 2 O 3 + 9 H 2 O О
Слайд 29
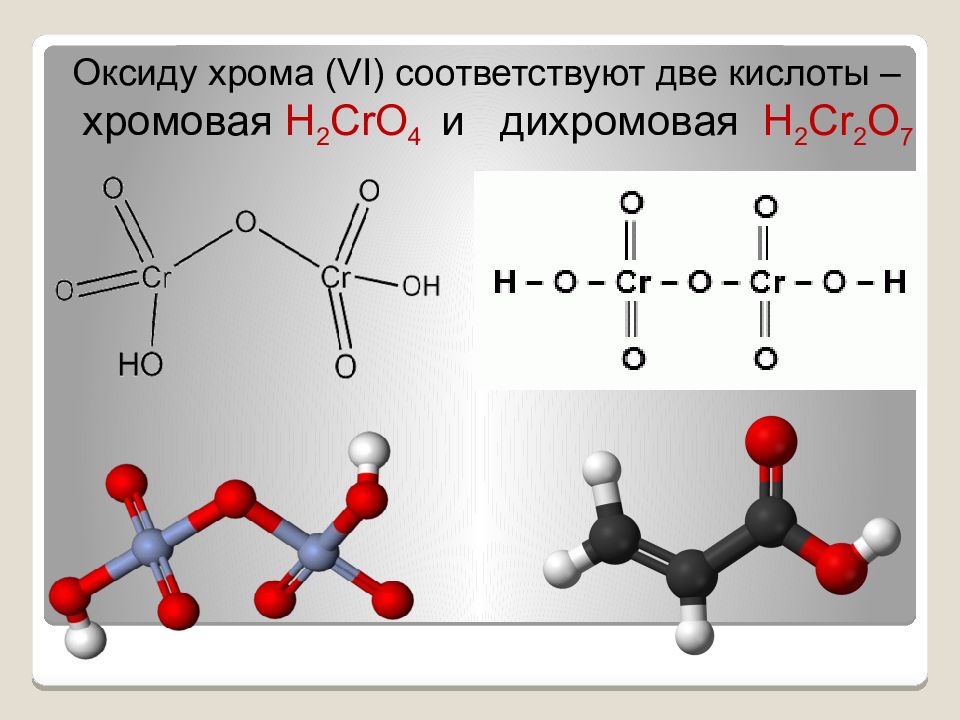
Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н 2 CrO 4 и дихромовая Н 2 Cr 2 O 7
Слайд 30
Хромовая кислота — кристаллическое вещество красного цвета; выделена в свободном состоянии при охлаждении насыщенных водных растворов CrO 3 ; хромовая кислота — электролит средней силы. Изополихромовые кислоты существуют в водных растворах, окрашенных в красный цвет
Слайд 31
хроматы – соли хромовой кислоты устойчивы в щелочной среде, при подкислении переходят в оранжевые дихроматы, соли двухромовой кислоты. Реакция обратима, поэтому при добавлении щелочи желтая окраска хромата восстанавливается. 2CrO 4 2– + 2H+ ↔ Cr 2 O 7 2– + H 2 O хроматы дихроматы соли ОН – Н +
Слайд 32
Лабораторный опыт № 3 К раствору дихромата калия добавьте гидроксид калия. Как изменилась окраска? Чем это вызвано? К полученному раствору добавьте серной кислоты до восстановления желтой окраски. Напишите уравнения реакций.
Слайд 33
2K 2 CrO 4 + H 2 SO 4( разб.) = K 2 Cr 2 O 7 +K 2 SO 4 +H 2 O K 2 Cr 2 O 7 + 2KOH = 2K 2 CrO 4 + H 2 O 2K 2 CrO 4 +2HCl ( разб.) = K 2 Cr 2 O 7 + 2KCl + H 2 O 2K 2 CrO 4 + H 2 O + CO 2 = K 2 Cr 2 O 7 + KHCO 3
Слайд 34
Взаимопревращение хроматов и дихроматов Оксиду хрома ( VI ) соответствуют две кислоты – хромовая Н 2 CrO 4 и дихромовая Н 2 Cr 2 O 7, Хромат калия K 2 CrO 4 и дихромат калия K 2 Cr 2 O 7 – соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым. 2 K 2 CrO 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы. K 2 Cr 2 O 7 + 2 KOH = 2 K 2 CrO 4 + H 2 O
Слайд 35
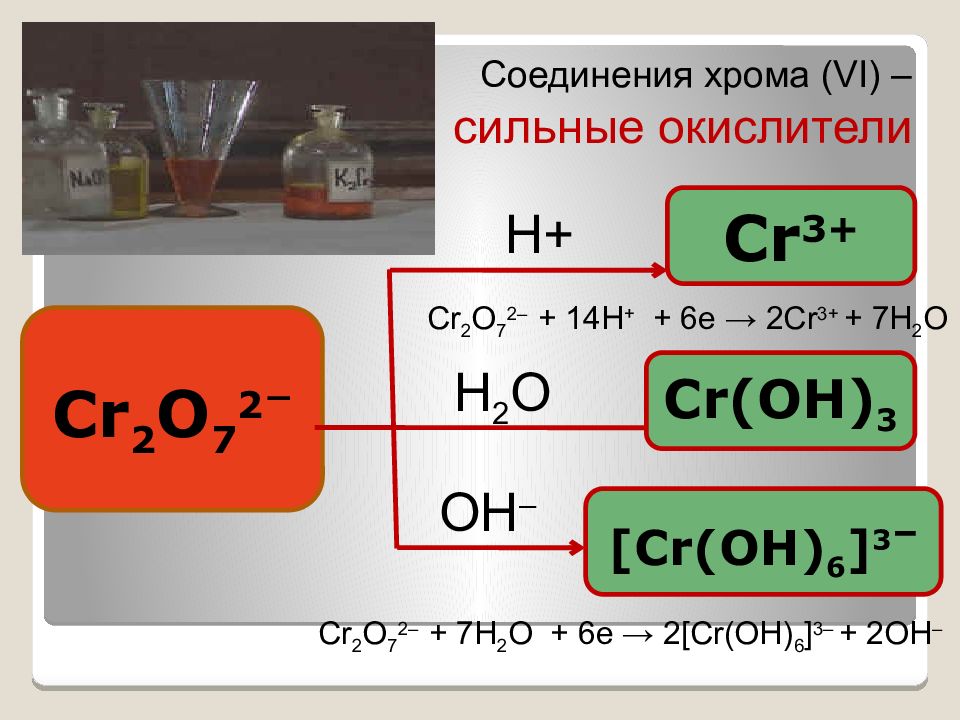
Соединения хрома ( VI) – сильные окислители Cr 2 O 7 2 – Cr 3+ Cr(OH) 3 [Cr(OH) 6 ] 3 – H+ H 2 O OH – Cr 2 O 7 2– + 14H + + 6e → 2Cr 3+ + 7H 2 O Cr 2 O 7 2– + 7Н 2 О + 6 e → 2[Cr(OH) 6 ] 3– + 2ОН –
Слайд 36
Окислительные свойства дихроматов Дихроматы, например дихромат калия K 2 Cr 2 O 7 – сильные окислители. Под действием восстановителей дихроматы в кислой среде переходят в соли хрома ( III ). Примером такой реакции может служить окисление сульфита натрия раствором дихромата калия в кислой среде. К раствору дихромата калия добавляем серную кислоту и раствор сульфита натрия. K 2 Cr 2 O 7 +3Na 2 SO 3 +4H 2 SO 4 =Cr 2 (SO 4 ) 3 +3Na 2 SO 4 +K 2 SO 4 + 4H 2 O Оранжевая окраска, характерная для дихроматов, переходит в зеленую. Образовался раствор сульфата хрома ( III ) зеленого цвета. Соли хрома - ярко окрашены, именно поэтому элемент получил такое название: "хром", что в переводе с греческого означает "цвет, краска". опыт
Слайд 37
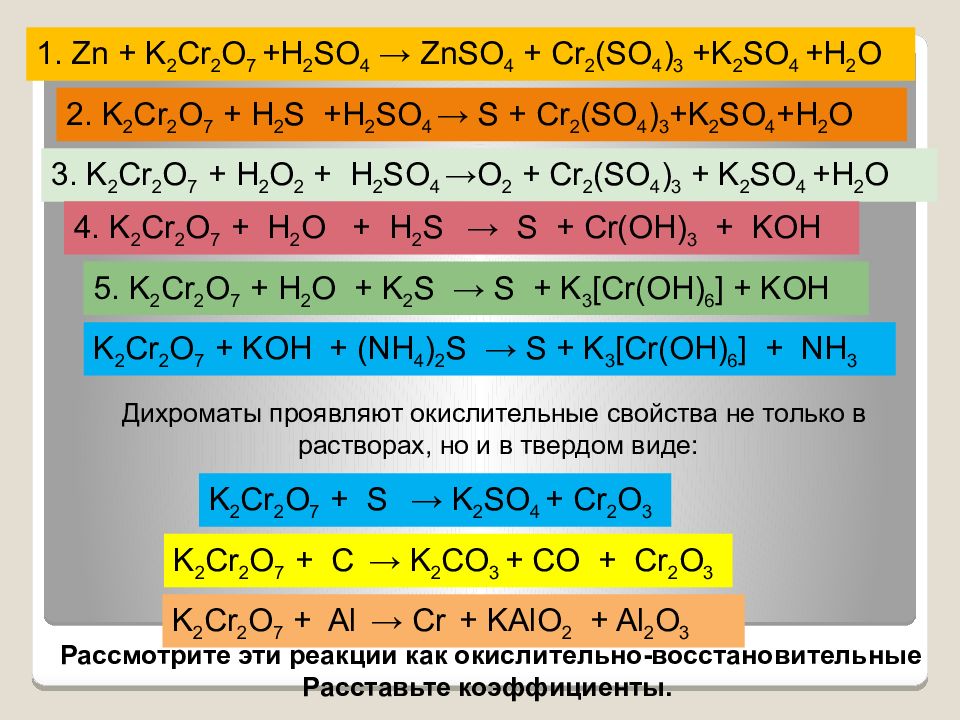
1. Zn + K 2 Cr 2 O 7 +H 2 SO 4 → ZnSO 4 + Cr 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O 2. K 2 Cr 2 O 7 + H 2 S +H 2 SO 4 → S + Cr 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O 3. K 2 Cr 2 O 7 + H 2 O 2 + H 2 SO 4 →O 2 + Cr 2 (SO 4 ) 3 + K 2 SO 4 +H 2 O 4. K 2 Cr 2 O 7 + H 2 O + H 2 S → S + Cr(OH) 3 + KOH 5. K 2 Cr 2 O 7 + H 2 O + K 2 S → S + K 3 [Cr(OH) 6 ] + KOH Дихроматы проявляют окислительные свойства не только в растворах, но и в твердом виде: K 2 Cr 2 O 7 + S → K 2 SO 4 + Cr 2 O 3 K 2 Cr 2 O 7 + С → K 2 С O 3 + СО + Cr 2 O 3 K 2 Cr 2 O 7 + Al → Cr + KAlO 2 + Al 2 O 3 Рассмотрите эти реакции как окислительно-восстановительные Расставьте коэффициенты. K 2 Cr 2 O 7 + KOH + (NH 4 ) 2 S → S + K 3 [Cr(OH) 6 ] + NH 3
Слайд 38
Дихромат калия (хромпик) широко применяется как окислитель органических соединений: 3 С 2 H 5 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 CH 3 – CHO + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O 3 С 3 H 7 OH + K 2 Cr 2 O 7 + 4H 2 SO 4 3CH 3 – C–CH 3 + Cr 2 (SO 4 ) 3 + K 2 SO 4 + 7H 2 O ║ O
Слайд 39
Хроматы щелочных металлов плавятся без разложения, а дихроматы при высокой температуре превращаются в хроматы. Дихромат аммония разлагается при нагревании: (NH 4 ) 2 Cr 2 O 7 Cr 2 O 3 + N 2 + 4H 2 O 180°C
Слайд 40
В ряду гидроксидов хрома различных степеней окисления Cr(ОН) 2 — Cr(ОН) 3 — Н 2 CrО 4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Слайд 41
Степень окисления хром a +2 +3 +6 Оксид CrO Cr 2 O 3 CrO 3 Гидроксид Cr(OH) 2 Cr(OH) 3 H 2 CrO 4 H 2 Cr 2 O 7 Кислотные и окислительные свойства возрастают Основные и восстановительные свойства возрастают Соединения хрома
Слайд 42: Домашнее задание: Выполнить ОВР!
Используем презентацию «ОВР по теме «ХРОМ»
Последний слайд презентации: СОЕДИНЕНИЯ ХРОМА
Начала химии. Современный курс для поступающих в ВУЗы. – М.: 1Федеративная Книготорговая Компания. Химия. Подготовка к ЕГЭ: учебно-методическое пособие / Под ред. В.Н. Доронькина. – Ростов н/Дону: Легион Химия. Пособие для поступающих в вузы /О.О. Максименко. – М. : Филол. о-во СЛОВО: Изд-во Эксмо Интернет-ресурсы (картинки, видеофрагменты: 1) Единая образовательная коллекция цифровых ресурсов. Химия. Неорганическая химия. Металлы побочных подгрупп. Хром. Видеопыты. http://school-collection.edu.ru/ 2) Образовательная коллекция Химия для всех XXI Химические опыты со взрывами и без