Первый слайд презентации
Катионы II (Ag +, Hg 2 2+, Pb 2+ ) и III (Ва 2+, Sr 2+, Са 2+ ) аналитических групп
Слайд 2
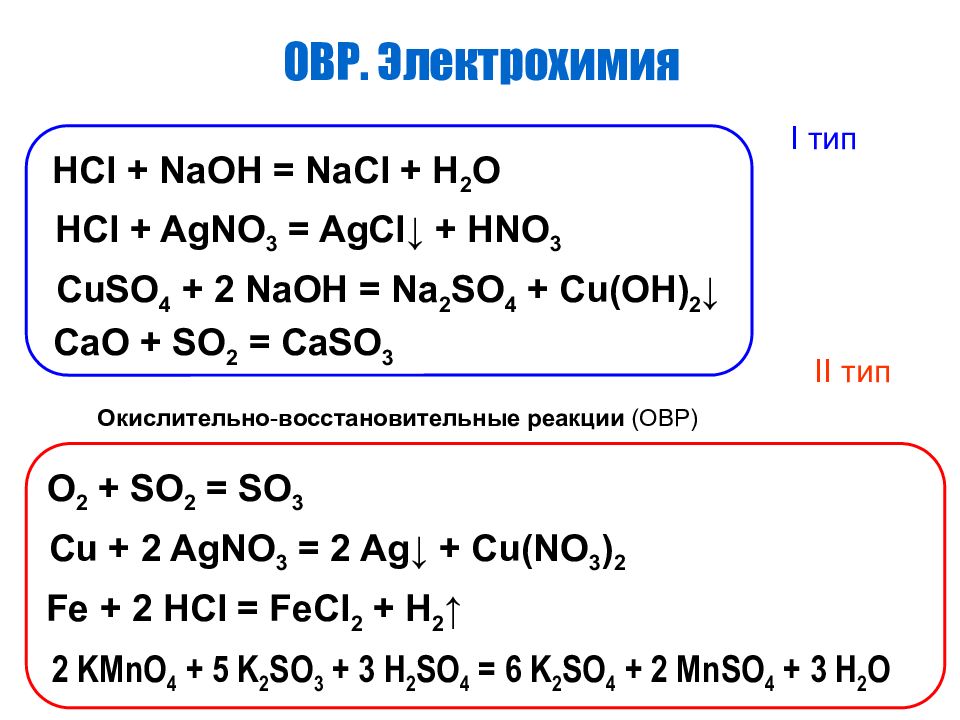
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Действие группового реагента 2 М раствора хлоридной кислоты: Pb(NO 3 ) 2 + 2HCl PbCl 2 + 2HNO 3 ПР = 1,6 10 -5 AgNO 3 + HCl AgCl HNO 3 ПР = 1,78 10 -10 Hg 2 (NO 3 ) 2 + 2HCl Hg 2 Cl 2 + 2HNO 3 ПР = 1,3 10 -18 При увеличении концентрации хлоридной кислоты осадки частично растворяются : AgCl + HCl H[AgCl 2 ] Hg 2 Cl 2 + HCl H[Hg 2 Cl 3 ] PbCl 2 + HCl H[PbCl 3 ]
Слайд 3
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Серебра хлорид, в отличие от ртути (I) хлорида, растворяется в растворе аммиака: AgCl + 2NH 3 H 2 O [Ag(NH 3 ) 2 ]Cl + 2H 2 O Белый осадок ртути (I) хлорида в растворе аммиака чернеет: Hg 2 Cl 2 +2NH 3 H 2 O [NH 2 Hg 2 ]Cl +NH 4 Cl +2H 2 O [NH 2 Hg 2 ]Cl NH 2 HgCl + Hg
Слайд 4
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Действие сульфид-ионов: Pb(NO 3 ) 2 + Na 2 S PbS + 2NaNO 3 2AgNO 3 + Na 2 S Ag 2 S + 2NaNO 3 Hg 2 (NO 3 ) 2 + Na 2 S Hg + HgS + 2NaNO 3
Слайд 5
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ 3PbS + 8HNO 3 3Pb(NO 3 ) 2 + 3S + 2NO + 4H 2 O PbS - 2е ↔ Pb 2+ + S 0 3 NO 3 - + 4H + + 3е ↔ NO + 2H 2 O 2 ____________________________________________________________________________________________________________________________________ 3PbS + 2NO 3 - + 8H + 3Pb 2+ + 3S + 2NO + 4H 2 O 3Ag 2 S + 8HNO 3 6AgNO 3 + 3S + 2NO + 4H 2 O Ag 2 S - 2е ↔ 2 Ag + + S 0 3 NO 3 - + 4H + + 3е ↔ NO + 2H 2 O 2 ____________________________________________________________________________________________________________________________________________________________ 3Ag 2 S + 2NO 3 - + 8H + 6 Ag + + 3S + 2NO + 4H 2 O
Слайд 6
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Действие растворов щелочей: AgNO 3 + NaOH AgOH + NaNO 3 2AgOH Ag 2 O + H 2 O Pb(NO 3 ) 2 + NaОН Pb(ОН) 2 + 2NaNO 3 Pb(OH) 2 + 2NaОН Na 2 [Pb(OH) 4 ] Hg 2 (NO 3 ) 2 + 2NaОН HgO + Hg + 2NaNO 3 + H 2 O
Слайд 7
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Действие раствора калия йодида: AgNO 3 + КI AgI + КNO 3 желтый Pb(NO 3 ) 2 + 2КI PbI 2 + 2КNO 3 золотисто-желтый Hg 2 (NO 3 ) 2 + 2КI Hg 2 I 2 + 2КNO 3 зеленый Hg 2 I 2 + 2КI K 2 [HgI 4 ] + Hg↓
Слайд 8
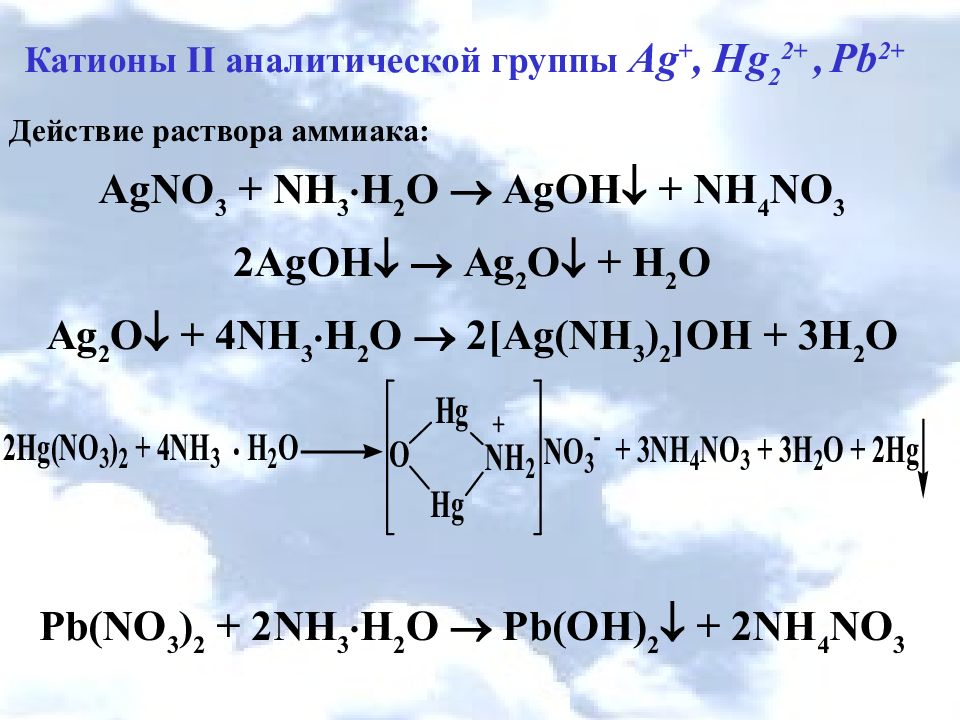
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Действие раствора аммиака: AgNO 3 + NH 3 H 2 O AgOH + NH 4 NO 3 2AgOH Ag 2 O + H 2 O Ag 2 O + 4NH 3 H 2 O 2[Ag(NH 3 ) 2 ]OH + 3H 2 O Pb(NO 3 ) 2 + 2NH 3 H 2 O Pb(OH) 2 + 2NH 4 NO 3
Слайд 9
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ При действии хромат-ионов катионы II аналитической группы образуют окрашенные осадки: 2AgNO 3 + К 2 CrO 4 Ag 2 CrO 4 + 2КNO 3 кирпично-красный Hg 2 (NO 3 ) 2 + К 2 CrO 4 Hg 2 CrO 4 + 2КNO 3 красный Pb(NO 3 ) 2 + К 2 CrO 4 PbCrO 4 + 2КNO 3 желтый
Слайд 10
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Ag 2 CrO 4 +4NH 3 ∙H 2 O [ Ag(NH 3 ) 2 ] 2 CrO 4 +4H 2 O PbCrO 4 + 4КOH K 2 [ Pb(OH) 4 ] + К 2 CrO 4 Ag 2 CrO 4 + 4HNO 3 4 AgNO 3 + H 2 Cr 2 O 7 + H 2 O
Слайд 11
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Катионы II аналитической группы с сульфат-ионами образуют малорастворимые в воде соли белого цвета: 2AgNO 3 + Н 2 SO 4 Ag 2 SO 4 + 2HNO 3 Hg 2 (NO 3 ) 2 + Н 2 SO 4 Hg 2 SO 4 + 2HNO 3 Pb(NO 3 ) 2 + Н 2 SO 4 PbSO 4 + 2HNO 3
Слайд 12
Катионы II аналитической группы Ag +, Hg 2 2+, Pb 2+ Свинца сульфат растворяется в щелочах и 30% растворе аммония ацетата: PbSO 4 + 4NaOH Na 2 [Pb(OH) 4 ] + Na 2 SO 4 2PbSO 4 + 2CH 3 COONH 4 [Pb(CH 3 COO) 2 ·PbSO 4 ] + (NH 4 ) 2 SO 4
Слайд 13
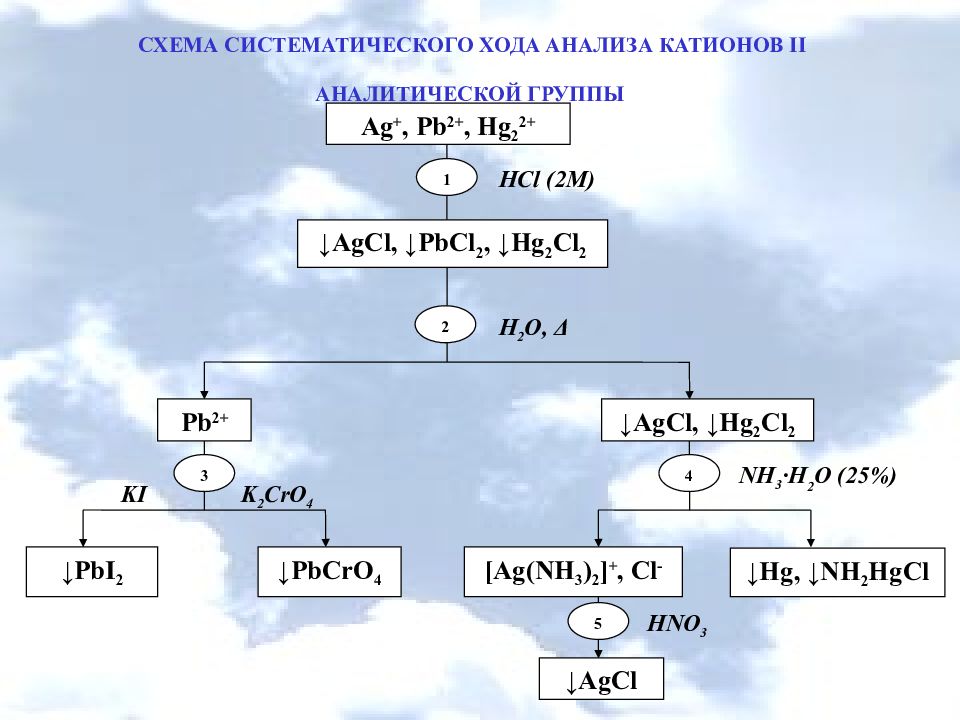
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ ІI АНАЛИТИЧЕСКОЙ ГРУППЫ ↓PbCrO 4 ↓Hg, ↓NH 2 HgCl ↓PbI 2 [Ag(NH 3 ) 2 ] +, Cl - 3 4 Pb 2+ ↓AgCl, ↓Hg 2 Cl 2 ↓AgCl, ↓PbCl 2, ↓Hg 2 Cl 2 Ag +, Pb 2+, Hg 2 2+ 1 2 HCl (2M) H 2 O, Δ NH 3 ·H 2 О (25%) K 2 CrO 4 HNO 3 5 ↓AgCl KI
Слайд 14
Катионы III аналитической группы Ва 2+, Sr 2+, Са 2+ Действие группового реагента 1 М раствора сульфатной кислоты: BaCl 2 + Н 2 SO 4 BaSO 4 + 2 HCl ПР = 1,1 10 -10 SrCl 2 + Н 2 SO 4 SrSO 4 + 2 HCl ПР = 3,2 10 -7 CaCl 2 + Н 2 SO 4 CaSO 4 + 2 HCl ПР = 2,5 10 -5 CaSO 4 + (NH 4 ) 2 SO 4 (NH 4 ) 2 [Ca(SO 4 ) 2 ]
Слайд 15
Катионы III аналитической группы Ва 2+, Sr 2+, Са 2+ Гипсовая вода (насыщенный раствор CaSO 4 ) осаждает ионы Вa 2+ и Sr 2+ в виде соответствующих сульфатов: CaSO 4 Ca 2+ + SO 4 2- BaCl 2 + CaSO 4 BaSO 4 + CaCl 2 SrCl 2 + CaSO 4 SrSO 4 + CaCl 2
Слайд 16
Катионы III аналитической группы Ва 2+, Sr 2+, Са 2+ Действие карбонат-ионов: BaCl 2 + Na 2 CO 3 BaCO 3 + 2 NaCl ПР = 4,0 10 -10 SrCl 2 + Na 2 CO 3 SrCO 3 + 2 NaCl ПР = 1,0 10 -10 CaCl 2 +Na 2 CO 3 CaCO 3 +2 NaCl ПР = 3,68 10 -9 Осадки карбонатов растворяются в минеральных (HCl, HNO 3 ) и уксусной кислотах: BaCO 3 + 2HCl BaCl 2 + H 2 O + CO 2 BaCO 3 + 2CH 3 COOH (CH 3 COO) 2 Ba + H 2 O + CO 2
Слайд 17
Катионы III аналитической группы Ва 2+, Sr 2+, Са 2+ Действие хромат-ионов: BaCl 2 +К 2 CrO 4 BaCrO 4 + 2КCl ПР = 1,2 10 -10 SrCl 2 + К 2 CrO 4 SrCrO 4 + 2КCl ПР = 3,6 10 -5 Осадки BaCrO 4 и SrCrO 4 растворимы в минеральных кислотах: 2BaCrO 4 + 4HCl 2BaCl 2 + Н 2 Cr 2 O 7 + H 2 O Осадок SrCrO 4 в отличие от осадка BaCrO 4 растворяется и в уксусной кислоте: SrCrO 4 + 2CH 3 COOH (CH 3 COO) 2 Sr + Н 2 CrO 4
Слайд 18
Катионы III аналитической группы Ва 2+, Sr 2+, Са 2+ Действие оксалат-ионов: BaCl 2 + Na 2 C 2 O 4 BaC 2 O 4 + 2 NaCl ПР = 1,1 10 -7 SrCl 2 + Na 2 C 2 O 4 SrC 2 O 4 + 2 NaCl ПР = 1,6 10 -7 CaCl 2 +Na 2 C 2 O 4 CaC 2 O 4 + 2 NaCl ПР = 2,3 10 -9 Осадки растворяются в растворах минеральных кислот: BaC 2 O 4 + 2HCl BaCl 2 + H 2 C 2 O 4
Последний слайд презентации: Катионы II (Ag +, Hg 2 2+, Pb 2+ ) и III (Ва 2+, Sr 2+, Са 2+ ) аналитических
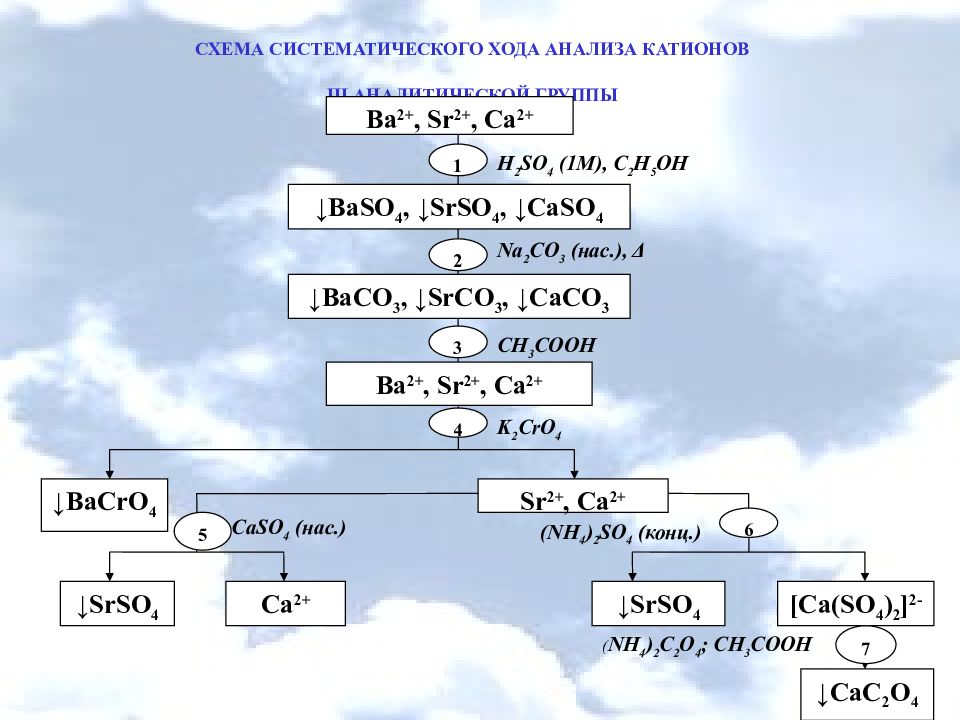
СХЕМА СИСТЕМАТИЧЕСКОГО ХОДА АНАЛИЗА КАТИОНОВ ІIІ АНАЛИТИЧЕСКОЙ ГРУППЫ Ca 2+ [Ca(SO 4 ) 2 ] 2- ↓SrSO 4 ↓SrSO 4 ↓BaCrO 4 Sr 2+, Ca 2+ ↓BaSO 4, ↓SrSO 4, ↓CaSO 4 Ba 2+, Sr 2+, Ca 2+ 1 2 H 2 SO 4 (1M), C 2 H 5 OH Na 2 CO 3 (нас.), Δ (NH 4 ) 2 SO 4 (конц.) ( NH 4 ) 2 C 2 O 4 ; CH 3 COOH 7 ↓CaC 2 O 4 ↓BaCO 3, ↓SrCO 3, ↓CaCO 3 3 CH 3 COOH Ba 2+, Sr 2+, Ca 2+ 4 K 2 CrO 4 5 6 CaSO 4 (нас.)