Первый слайд презентации: СОВРЕМЕННЫЕ ДОСТИЖЕНИЯ МЕДИЦИНСКОЙ ГЕНЕТИКИ
Слайд 2: Медицинская генетика -
раздел генетики, изучающий роль наследственности в патологии человека, закономерности передачи наследственных болезней, разрабатывающий методы диагностики, профилактики и лечения наследственной патологии, включая болезни с наследственной предрасположенностью
Моногенные НБ Хромосомные НБ Полигенные НБ (болезни предрасположенности) Болезни нуклеиновых кислот соматических клеток
Собственно НБ – проявление патологической мутации в фенотипической патологии практически не зависит от факторов окружающей среды – все хромосомные и большая часть моногенных НБ НБ, где для проявления мутации необходимо воздействие специфического (относительно редкого) фактора окружающей среды – ( экогенетические болезни)
Слайд 5: Роль наследственности и среды в развитии патологии человека
Болезни предрасположенности, где наследственные факторы проявляются при взаимодействии со средовыми влияниями: возраст начала, тяжесть течения и исход определяется как наследственными, так и средовыми факторами – большая часть неинфекционных болезней Экстремальные воздействия окружающей среды: травмы, ожоги, обморожения, инфекции – начало болезни чисто средовое, течение и исход зависят от наследственности
Слайд 6
Грегор Мендель в 1865 г. публикует результаты изучения правил наследования различных признаков у гороха: законы доминирования, расщепления и чистоты гамет («Опыты над растительными гибридами»). Сэр Фрэнсис Гальтон (1822 —1911) — географ, антрополог и психолог, двоюродный брат Чарльза Дарвина в 1865 г. выпускает книгу «Наследование таланта и гениальность». В 1900 г. Г. де Фриз (Голландия), К.Корзенс (Германия) и Э.Чермак (Австрия), проведя почти одновременно собственные опыты, не зная друг о друге и работе Менделя, «переоткрыли» основные законы генетики.
Слайд 7: Медико-генетическое консультирование
Профилактика наследственной патологии через медико-генетическое консультирование. В США первые программы обучения медико-генетическому консультированию до степени master появились в 1970-х годах в Университете Сары Лоренс (Бронксвилл, Нью-Йорк). Они возглавлялись Мелиссой Рихтер и Куртом Хиршхорном.
Слайд 10: Ген
Один ген- один фермент - один признак Один ген- одна полипептидная цепь Один ген- одна мРНК Ген-участок ДНК или РНК ( у некоторых вирусов), определяющий линейную последовательность полипептидной цепи или одной молекулы РНК
Слайд 11: Методы медицинской генетики:
Близнецовый Клинико-генеалогический Цитогенетический Биохимический Популяционно-статистический Молекулярно-генетический
Слайд 12: Близнецовый метод
Гемелалогия – наука о близнецах Конкордантность / дискордантность – совпадение / несовпадение по признаку Сравнение МБ и ДБ Коэффициент наследуемости по Хольцингеру: Смб - Сдб / 100 – Сдб (х 100%): СД 2 типа – 57%, IQ – 65-75% Метод контроля по партнеру
Слайд 13: Клинико-генеалогический метод -
прослеживания болезни или признака в семье или роду с указанием родственных связей Установление наследственного характера признака Определение типа наследования Анализ сцепления гена и картирование хромосом Изучение интенсивности мутационного процесса Расшифровка взаимодействия генов Медико-генетическое консультирование
Слайд 14: Типы наследования
Аутосомно-доминантный Аутосомно-рецессивный Х-сцепленный доминантный Х-сцепленный рецессивный У-сцепленный (голандрический) Митохондриальный Каталог Мак-Кьюсика (1990) А-Д - 2 406 А-Р - 1 721 Х-сцепленный - 367 Всего- 4 694
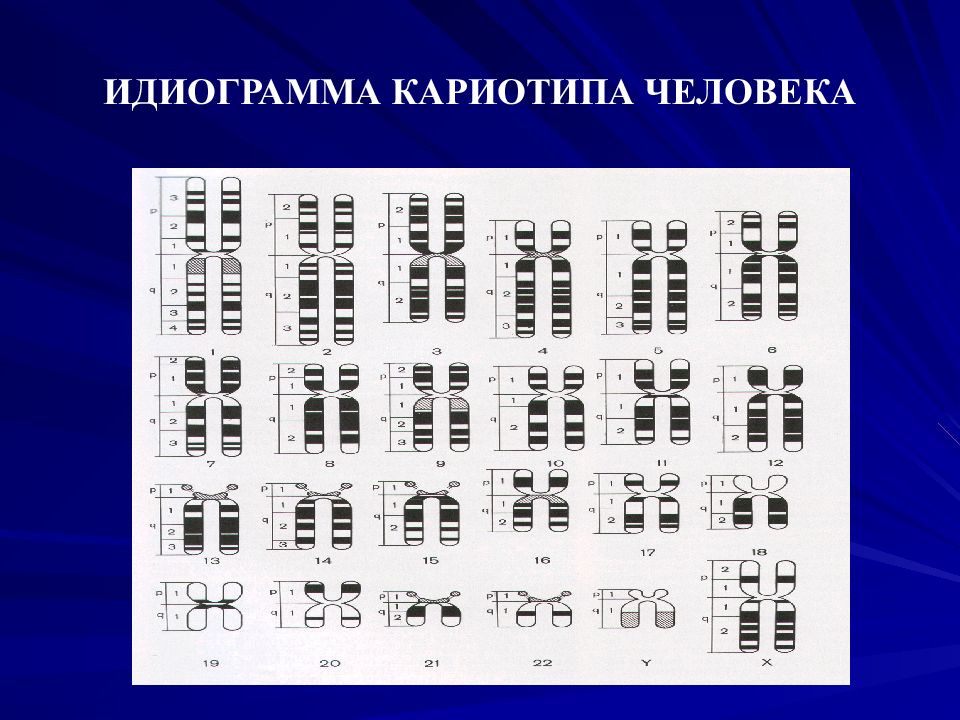
Слайд 15: Цитогенетический метод
Изучение кариотипа человека Кариотип – характеристика вида, в которой учтены число, величина и морфологические особенности хромосом кариотип - это «лицо» вида
Слайд 16: Число хромосом в соматических клетках некоторых биологических видов
Рожь - 14 Табак – 42 Картофель – 48 Капуста – 18 Кошка – 38 Мышь – 40 Собака – 78 Курица – 78 Лягушка – 26 Приматы – 48 _________________________ Человек - 46
Слайд 17: ИЗМЕНЕНИЕ ЧИСЛА И СТРУКТУРЫ ХРОМОСОМ
Часть изменчивости, проявляющаяся, как правило, множественными врожденными пороками развития и умственной отсталостью, обусловлен а изменением числа и структуры хромосом. Известно более 800 хромосомных синдромов, проявляющихся более или менее специфичным фенотипом.
Слайд 20: Биохимические методы
Выявление биохимического фенотипа человека на всех уровнях от первичного продукта гена (полипептидной цепи) до конечных метаболитов в моче и поте На современном этапе в клинической практике применяется в основном в виде скринирующих программ
Слайд 21: Скрининговые программы
Неонатальный скрининг (ФКУ, гипотиреоз, галактоземия, болезнь, при котором моча имеет запах кленового сиропа, адреногенитальный синдром, муковисцидоз и т.д.) Скрининг для выявления гетерозиготных носителей (болезнь Тея-Сакса, бета талассемия) Скрининг беременных: АФП, ХГ
Слайд 22: Постскрининговые исследования
Определение недостающих продуктов реакции (ФКУ-тирозин) Накопление субстрата реакции (ФКУ-фенилаланин) Избыток конечных продуктов (ФКУ-фенилэтиламин, фенилпируват) Поиск атипичных соединений
Слайд 23
Скрининг новорожденных на наследственные болезни ЗАБОЛЕВАНИЯ, ВКЛЮЧЕННЫЕ В ПРОГРАММЫ СКРИНИНГА НОВОРОЖДЕННЫХ В РАЗЛИЧНЫХ ШТАТАХ США В 2000 Г. ( ФКУ 51, Врожденный гипотиреоз 51, Галактоземия 50, Серповидноклеточная анемия 44, АГС 32, Недостаточность биотинидазы 24, Болезнь, при которой моча имеет запах кленового сиропа 24, Гомоцистинурия 17 )
Слайд 24: Популяционная генетика
Годфри Харди, математик из Кэмбриджа и Вильгельм Вайнберг, врач из Штутгарта в 1908 г. объяснили принцип постоянства частоты гена в популяции, на которую не действуют возмущающие факторы. Фишер первым отметил необходимость коррекции смещения в отборе семей для установления типа наследования признаков у человека. Хогбен, Ленц и Мортон. Фишер, Холдейн, Райт и Четвериков – основатели популяционной генетики
Слайд 25: Популяционно-статистический метод
Закон Харди-Вайнберга (Р + Q ) ² = 1 ( P + Q + X)² = 1 P²+2PQ+Q² = 1
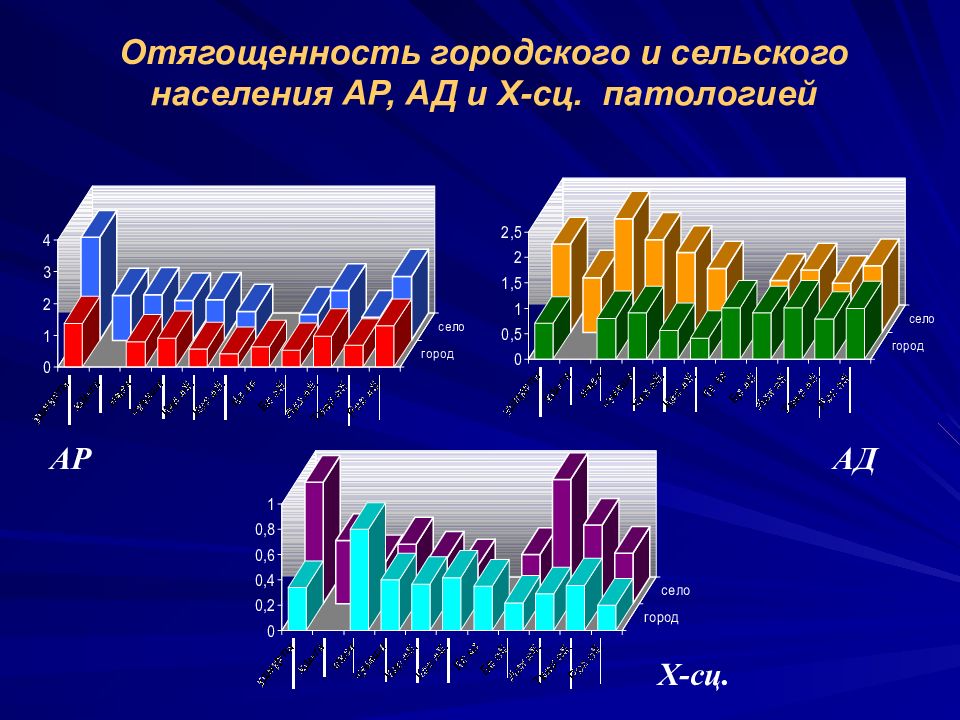
Слайд 27
Отягощенность городского и сельского населения АР, АД и Х-сц. патологией АР АД Х-сц.
Слайд 28: Молекулярная генетика
В 1953 г. Уотсон и Крик описывают структуру ДНК. 1966 г. Ниренберг предлагает расшифровку генетического кода. Открытие рестриктаз (Арбер и Смит), ПЦР, ПДРФ. Картирование генов наследственных болезней. Программа «Геном человека». Клонирование генов миодистрофии Дюшенна, муковисцидоза и многих других.
Слайд 29: Молекулярно-генетические методы диагностики
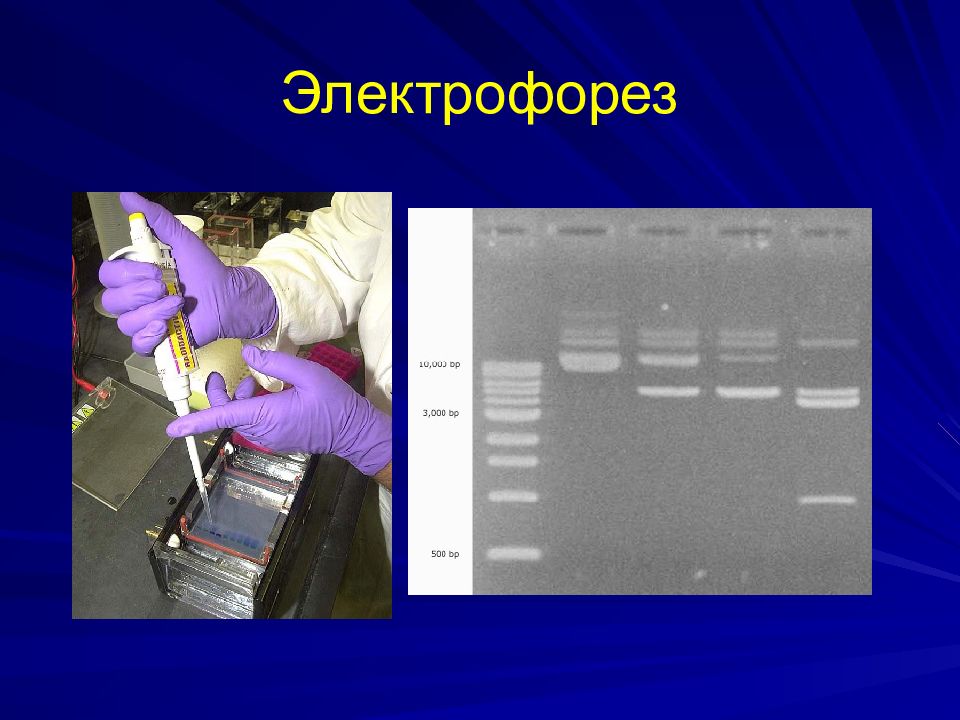
Выделение ДНК Полимеразная цепная реакция Рестрикционный анализ Электрофорез в полиакриламидном и агарозном геле Блотинг по Саузерну
Слайд 30: Источники геномной ДНК
Цельная кровь Культура клеток Букальный эпителий Пятна высушенной крови Другие источники Сыворотка, плазма крови, образцы мочи, образцы тканей При делециях мтДНК предпочтительный материал – образец мышечной ткани
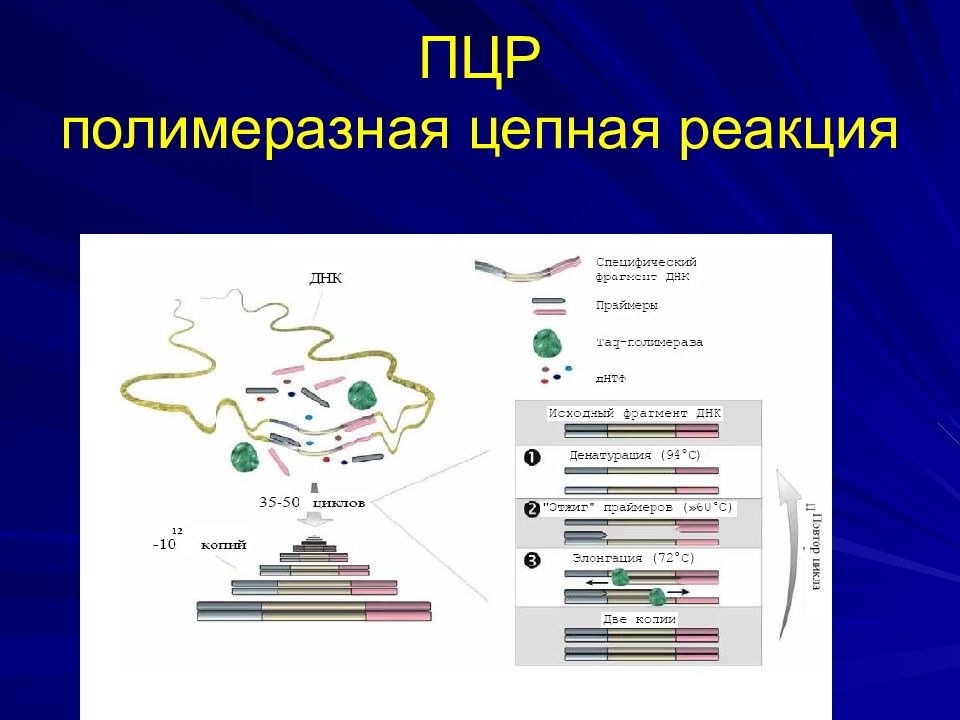
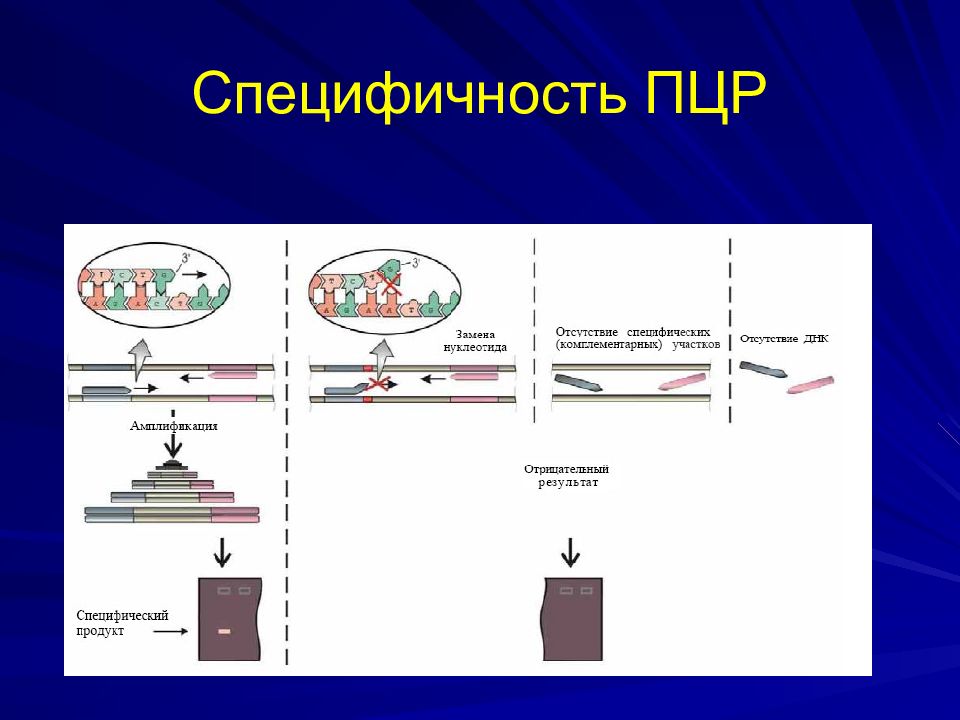
Слайд 31: ПЦР
Состав реакционной смеси: Образец Буфер, содержащий ионы магния Смесь дНТФ Taq -полимераза Специфические олигонуклеотидные праймеры
Слайд 36: Мультиплексная ПЦР
ПЦР с несколькими парами праймеров, соответствующих разным участкам гена Пример –ДНК-диагностика делеций при миодистрофии Дюшена
Слайд 37: Гибридизация
Комплементарное взаимодействие между одноцепочечными полинуклеотидами из разных источников меченная ДНК –проба, зонд связывается с комплементарной ей последовательностью
Слайд 38: Блотинг
Саузерн-блотинг Рестрикция Разделение изучаемого фрагмента в геле Денатурация Перенос на мембрану Гибридизация с меченной пробой
Слайд 39: Биочипы
Матрица на которую нанесены тысячи олигонуклеотидов Олигонуклеотиды специфично гибридизуются с меченными молекулами ДНК
Слайд 41: ВКЛАД ГЕНЕТИКИ В МЕДИЦИНУ
Диагностика, профилактика и лечение наследственных болезней Оценка предрасположенности при мультифакториальных болезнях Изучение генетических болезней соматических клеток Судебно-медицинские исследования Генотерапия Фармакогенетические достижения Клонирование
Слайд 42: НАСЛЕДСТВЕННЫЕ ФАКТОРЫ В ФЕНОТИПИЧЕСКОЙ ИЗМЕНЧИВОСТИ
ОСНОВНОЙ ВКЛАД ГЕНЕТИКИ В МЕДИЦИНУ - УСТАНОВЛЕНИЕ РОЛИ НАСЛЕДСТВЕННЫХ ФАКТОРОВ В ИЗМЕНЧИВОСТИ ФЕНОТИПИЧЕСКИХ ПРИЗНАКОВ, В ТОМ ЧИСЛЕ ПАТОЛОГИЧЕСКИХ, У ЧЕЛОВЕКА НАСЛЕДСТВЕННЫЕ ФАКТОРЫ В ФЕНОТИПИЧЕСКОЙ ИЗМЕНЧИВОСТИ
Слайд 43: Диагностика наследственных болезней
распространенность наследственной патологии (на 1 000 чел.) Генные болезни 10,0 Хромосомные болезни 5,0 ВПР 20,0 Болезни с насл. предрасполож. у детей 10,0 Болезни с насл. предрасполож. у взросл. 150,0
Слайд 44: Доля генетической обусловленности показателей мед. статистики
Младенческая смертность – 20-30% Спонтанные аборты и выкидыши –40-50% Врожденная глухота – 50% Врожденная слепота – 70% Умственная отсталость – 80% Причины болезней госпитализиро- ванных детей – 20-40% Причины болезней госпитализиро- ванных взрослых – 20-50%
Слайд 45: ПРОГРАММА «ГЕНОМ ЧЕЛОВЕКА»
Целями проекта были: Идентифицировать все гены (примерно 20000-25000 генов) генома человека Определить последовательность 3 млрд. пар нуклеотидов, составляющих геном Сохранить всю информацию в базах данных Усовершенствовать методы анализа данных Установить какие этические и социальные проблемы могут возникнуть в связи с Проектом
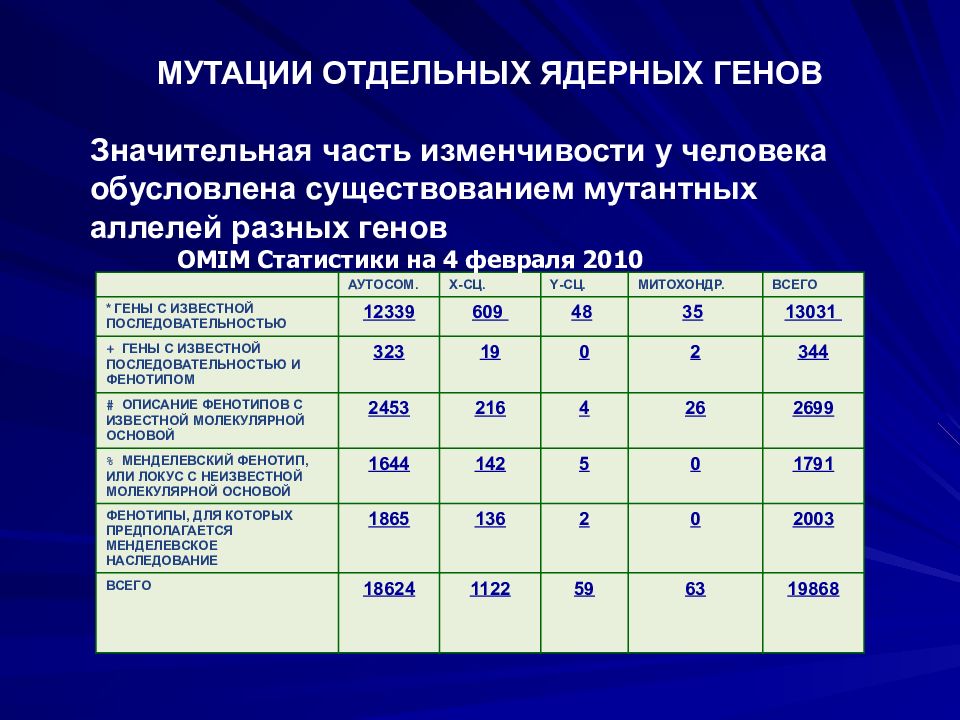
Слайд 46: МУТАЦИИ ОТДЕЛЬНЫХ ЯДЕРНЫХ ГЕНОВ Значительная часть изменчивости у человека обусловлена существованием мутантных аллелей разных генов
АУТОСОМ. Х-СЦ. Y -СЦ. МИТОХОНДР. ВСЕГО * ГЕНЫ С ИЗВЕСТНОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ 12339 609 48 35 13031 + ГЕНЫ С ИЗВЕСТНОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ И ФЕНОТИПОМ 323 19 0 2 344 # ОПИСАНИЕ ФЕНОТИПОВ С ИЗВЕСТНОЙ МОЛЕКУЛЯРНОЙ ОСНОВОЙ 2453 216 4 26 2 699 % МЕНДЕЛЕВСКИЙ ФЕНОТИП, ИЛИ ЛОКУС С НЕИЗВЕСТНОЙ МОЛЕКУЛЯРНОЙ ОСНОВОЙ 1644 142 5 0 1791 ФЕНОТИПЫ, ДЛЯ КОТОРЫХ ПРЕДПОЛАГАЕТСЯ МЕНДЕЛЕВСКОЕ НАСЛЕДОВАНИЕ 1 865 136 2 0 2003 ВСЕГО 18624 1122 59 63 19868 OMIM Статистики на 4 февраля 20 10
Слайд 47
ДНК ДИАГНОСТИКА И ДРУГИЕ ПРИЛОЖЕНИЯ ИЗУЧЕНИЯ ГЕНОМОВ РАЗРАБОТКА МЕТОДОВ ДНК ДИАГНОСТИКИ НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ: ПРЯМЫЕ И НЕПРЯМЫЕ МЕТОДЫ ДНК ДИАГНОСТИКИ РАЗРАБОТКА МЕТОДОВ ДНК ДИАГНОСТИКИ ИНФЕКЦИОННЫХ АГЕНТОВ РАЗРАБОТКА ДНК ВАКЦИН - НОВОЕ НАПРАВЛЕНИЕ ПРОФИЛАКТИЧЕСКОЙ МЕДИЦИНЫ
Слайд 48: ДНК-диагностика
Подтверждение диагноза Диагностика носительства Пресимптоматическая диагностика Пренатальная (дородовая) диагностика Предимплантационная диагностика
Слайд 49: Прямая ДНК-диагностика
Определение мутации, являющейся непосредственной причиной заболевания Косвенная ДНК-диагностика Определение хромосомы, несущей поврежденный ген при семейном анализе
Слайд 50: ДНК-ДИАГНОСТИКА НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙ
ПРЯМОЙ АНАЛИЗ НЕПРЯМОЙ АНАЛИЗ ТРЕБОВАНИЯ: ГЕН ДОЛЖЕН БЫТЬ КЛОНИРОВАН; МУТАЦИИ ОХАРАКТЕРИЗОВАНЫ ТОЧНАЯ КЛИНИЧЕСКАЯ ДИАГНОСТИКА; ГЕН ЛОКАЛИЗОВАН; ЕСТЬ ТЕСНО СЦЕПЛЕННЫЕ МАРКЕРЫ; ДОСТУПНА ДНК ОТ ЧЛЕНОВ СЕМЬИ ПРЕИМУЩЕСТВА: 100% ТОЧНОСТЬ; БЫСТРОТА; НЕ ОБЯЗАТЕЛЬНА ДНК ОТ ВСЕХ ЧЛЕНОВ СЕМЬИ. ДОСТУПЕН ДЛЯ ОЧЕНЬ БОЛЬШОГО ЧИСЛА НАСЛЕДСТВЕННЫХ БОЛЕЗНЕЙs. НЕДОСТАТКИ: ГЕН ДОЛЖЕН БЫТЬ ХОРОШО ОХАРАКТЕРИЗОВАН. ТОЧНОСТЬ <100%. МЕТОДЫ: БЛОТ ПО САУЗЕРНУ (делеции, дупликации, расширение повторов) БЛОТ ПО САУЗЕРНУ (ПДРФ) ПЦР (точковые мутации, делеции, расширение повторов). ПЦР (микросателлиты ПДРФ) Gene Tests – система из 577 лабораторий США, обеспечивающих генетическое тестирование 1148 заболеваний, из них 831 заболевание тестируется в клинических целях.
Слайд 51: ДНК-ДИАГНОСТИКА
ПРЯМАЯ ДНК-ДИАГНОСТИКА Возможна только когда известна структура гена Возможна и без больного члена семьи ( анализ ДНК родителей пробанда) Высокая точность Возможна при полилокусном заболевании КОСВЕННАЯ ДНК-ДИАГНОСТИ КА Возможна когда известно положение гена, а мутация или последовательность неизвестны обязательно проведение семейного анализа и анализ образца больного члена семьи Точность зависит от расположения маркеров Обязательно наличие одного локуса заболевания
Слайд 52: Прямая ДНК-диагностика
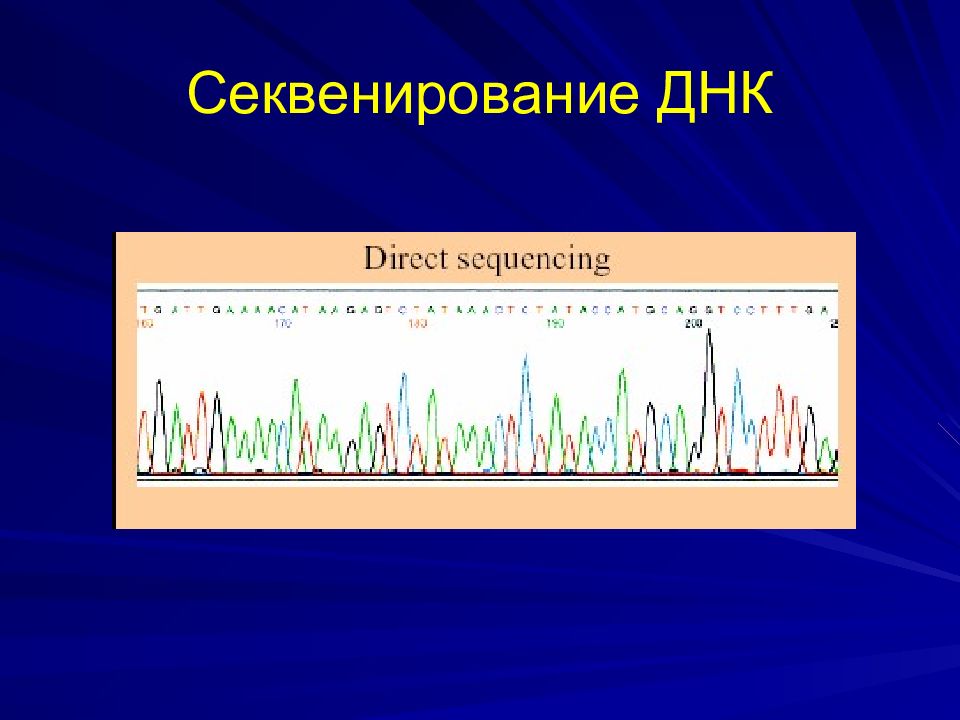
ПЦР ( мультиплексная ПЦР, аллель-специфическая амплификация, ПДАФ) ПЦР-ПДРФ анализ ( анализ полиморфизма длины рестрикционных фрагментов) Секвенирование (определение последовательности) гена Блотинг по Саузерну Биочипы
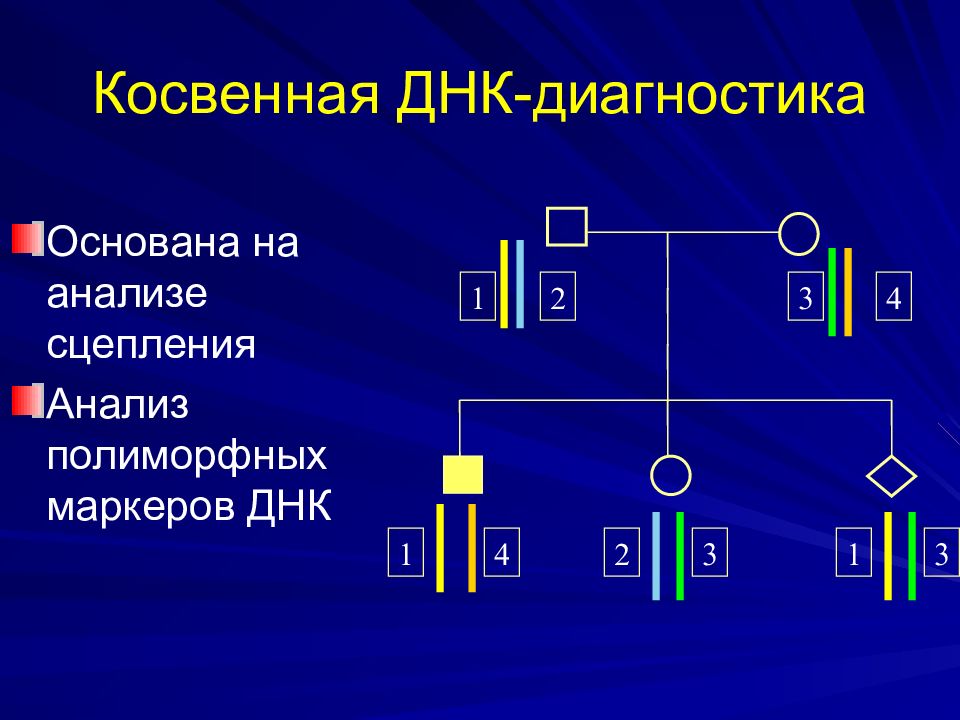
Слайд 53: Косвенная ДНК-диагностика
Основана на анализе сцепления Анализ полиморфных маркеров ДНК 1 2 3 4 1 1 2 3 3 4
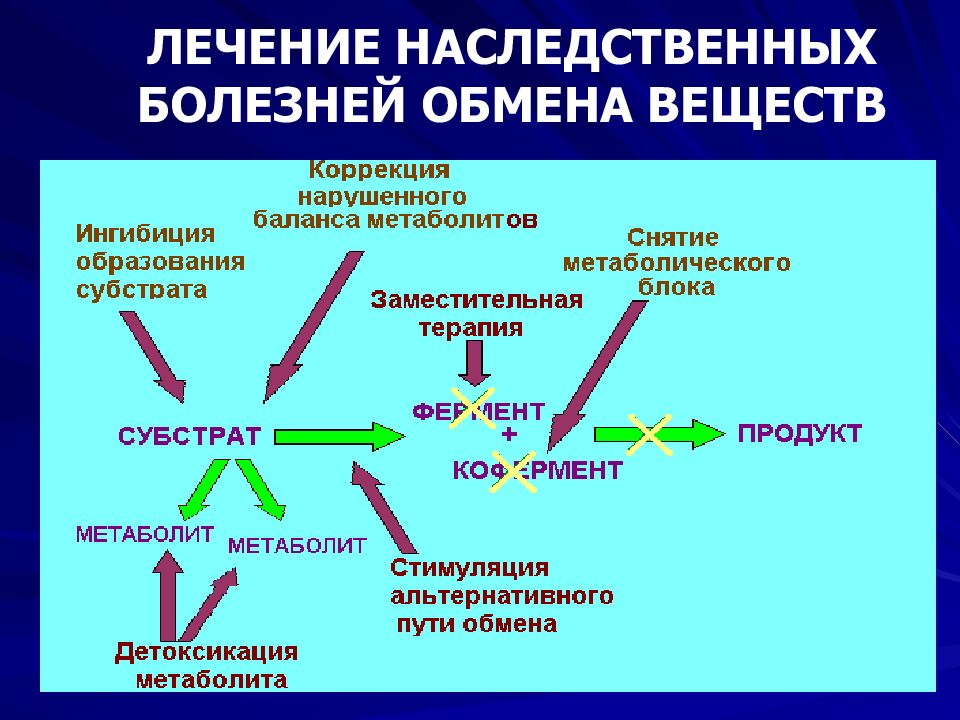
Слайд 54: Лечение наследственных болезней
Симптоматическое – колхицин при подагре, аналгетики, противосудорожные и т.д. Патогенетическое – муковисцидоз, гепато-церебральная дегенерация, болезни обмена Используются все современные виды лечения (лекарства, диета, физиотерапия, хирургические методы) Этиотропное - генотерапия
Слайд 56
МЕДИКО-ГЕНЕТИЧЕСКОЕ КОНСУЛЬТИРОВАНИЕ На первое место из практических приложений генетики в здравоохранение можно поставить создание института медико-генетических консультаций. Одна из первых медико-генетических консультаций в мире была создана выдающимся отечественным невропатологом и генетиком С.Н. Давиденковым в начале 20-х годов сначала в Москве, а затем в Ленинграде.
Слайд 57: Цели и задачи медико-генетических консультаций
Уточнение диагноза наследственного заболевания Определение типа наследования заболевания в семье Прогноз потомства в семье Объяснение в доступной форме смысла медико-генетического заключения и помощь в принятии решения по дальнейшему деторождению Пропаганда медико-генетических знаний среди врачей и населения
Слайд 58: Группы населения, обращающиеся в медико-генетическую консультацию
ГРУППЫ НАСЕЛЕНИЯ ЦЕЛЬ ОБРАЩЕНИЯ ПРОЦЕНТ СЕМЕЙ ЗДОРОВЫЕ СУПРУГИ, ИМЕЮЩИЕ БОЛЬНОГО РЕБЕНКА ПРОГНОЗ ПОТОМСТВА 65 ЛИЦА С НАСЛЕДСТВЕННОЙ ПАТОЛОГИЕЙ УТОЧНЕНИЕ ДИАГНОЗА 30 ЗДОРОВЫЕ ЛИЦА, ИМЕЮЩИЕ БОЛЬНЫХ РОДСТВЕННИКОВ ПРОГНОЗ ЗОРОВЬЯ И ПОТОМСТВА 5
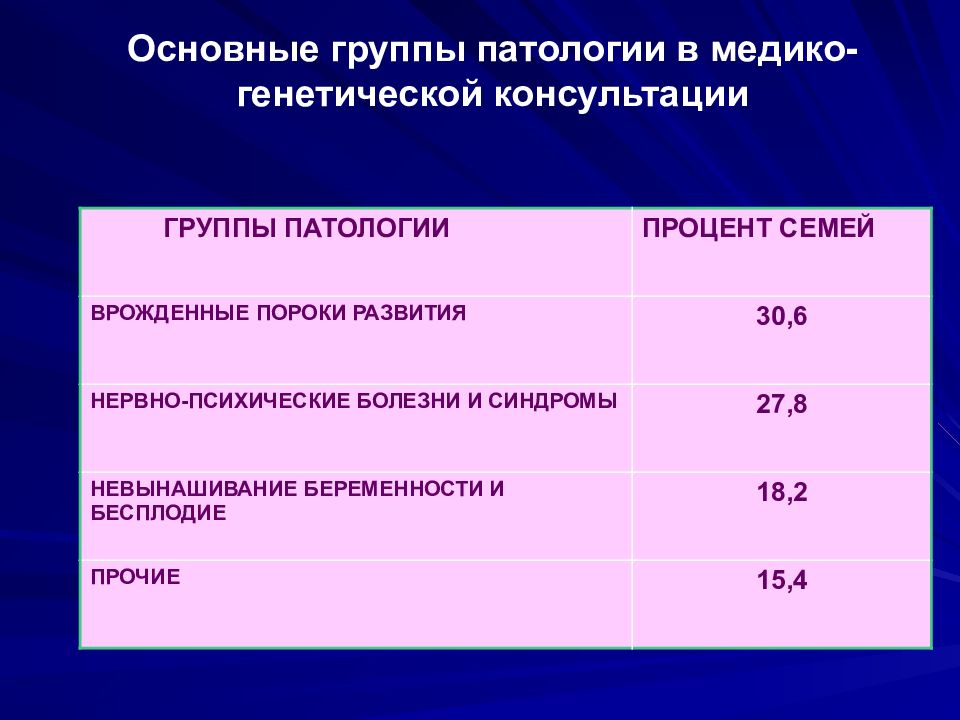
Слайд 59: Основные группы патологии в медико-генетической консультации
ГРУППЫ ПАТОЛОГИИ ПРОЦЕНТ СЕМЕЙ ВРОЖДЕННЫЕ ПОРОКИ РАЗВИТИЯ 30,6 НЕРВНО-ПСИХИЧЕСКИЕ БОЛЕЗНИ И СИНДРОМЫ 27,8 НЕВЫНАШИВАНИЕ БЕРЕМЕННОСТИ И БЕСПЛОДИЕ 18,2 ПРОЧИЕ 15,4
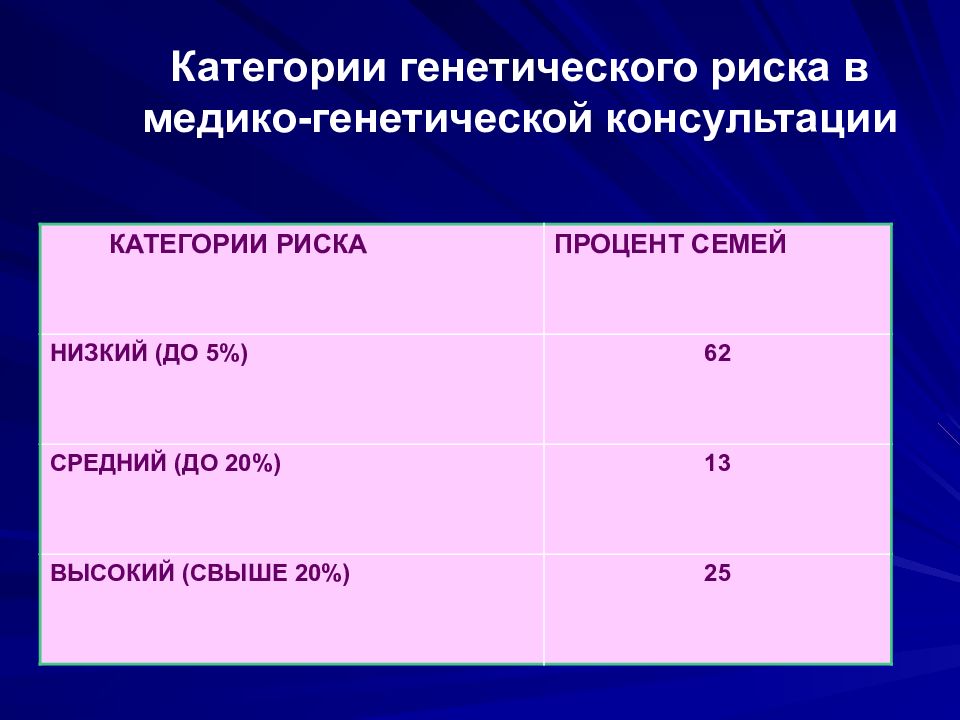
Слайд 60: Категории генетического риска в медико-генетической консультации
КАТЕГОРИИ РИСКА ПРОЦЕНТ СЕМЕЙ НИЗКИЙ (ДО 5%) 62 СРЕДНИЙ (ДО 20%) 13 ВЫСОКИЙ (СВЫШЕ 20%) 25
Слайд 61: Уровни медико-генетической помощи населению
ЧИСЛЕННОСТЬ НАСЕЛЕНИЯ УЧРЕЖДЕНИЯ 150 млн. Федеральные центры : новые методы диагностики (биохимические, цитогенетические, молекулярно-генетические), консультирования, пренатальной диагностики, лечения и реабилитации 6 – 8 млн. Межрегиональные медико-генетические консультации: консультирование, цитогенетическая и биохимическая диагностика, пренатальняЯ диагностика (УЗИ, сывороточные маркеры, инвазивная), скрининг\на ФКУ и гипотиреоз 1,5 – 2 млн. Медико-генетические консультации: консультирование, цитогенетическая и биохимическая диагностика, пренатальная диагнгостика (УЗИ, сывороточные маркеры) 50 – 60 тыс. Врач-генетик ЦРБ: отбор семей с наследственной патологией и направление их в МГК
Слайд 62: Задача МГК с медицинской точки зрения – составление медико-генетического прогноза в семье
Медико-генетический прогноз включает в себя три элемента: определение степени генетического риска оценку тяжести медицинских и социальных последствий заболевания перспективу применения методов пренатальной диагностики
Слайд 63: Задача МГК с социальной точки зрения – помощь семье в принятии правильного решения
Врач-генетик должен помочь консультирующимся понять медицинские факты, тип наследования заболевания, генетический риск его повторения в семье, лучше адаптироваться к несчастью и принять правильное решение относительно дальнейшего деторождения. Эффективность МГК напрямую зависит от грамотного выполнения этой коммуникативной функции врача-консультанта.
Слайд 64: Неонатальный скрининг
включает в себя систему мероприятий: выявление новорожденных с определенными заболеваниями на доклинической стадии; раннее патогенетическое лечение, позволяющее дать обществу полноценных индивидуумов; медико-генетическое консультирование семьи с целью не допустить повторное рождение больного ребенка
Слайд 65
Неонатальный скрининг на наследственные заболевания является принципиально новым подходом к профилактике, предложенный медицинской генетикой практическому здравоохранению в ХХ веке
Слайд 66: Требования к программам неонатального скрининга на наследственные болезни Требования сформулированы ВОЗ в 1968 году, т.н. «золотой стандарт»
Заболевание клинически и лабораторно должно быть хорошо изучено Частота заболевания в популяции должна быть достаточно высокой Заболевание должно быть тяжелым, или даже летальным Лабораторные тесты не должны давать ложноотрицательных результатов Лабораторные тесты должны быть простыми, безопасными и этически приемлемыми Должно быть разработано эффективное лечение скринируемого заболевания Скрининг должен быть экономически эффективным
Слайд 67: Этим требованиям отвечают следующие заболевания:
Фенилкетонурия – в мире скрининг начат с 1964 года, в России – с 1985 года; Врожденный гипотиреоз – в мире скрининг начат с 1973 года, в России – с 1993 года; Адрено-генитальный синдром – проводится во многих странах мира, в России с 2006 года ( в рамках национального проекта по здравоохранению ); Галактоземия - проводится в некоторых странах мира, в России с 2006 года ( в рамках национального проекта по здравоохранению); Муковисцидоз - проводится в некоторых странах мира, в России с 2006 года (в рамках национального проекта по здравоохранению
Слайд 68: Пренатальная диагностика
Впервые была предложена Фухсом в 1956 г. (статья в Nature «Пренатальное определение пола»)
Слайд 69: Пренатальная диагностика
Пренатальная диагностика позволяет перейти от вероятностного к однозначному прогнозированию исхода беременности. Первые попытки инвазивной пренатальной диагностики сделаны в середине 50-х годов прошлого века в связи с эритробластозом у плода, обуслов-ленным Rh- изоиммунизацией.
Слайд 70: Пренатальная диагностика
успешно использует методы, относящиеся к акушерству и гинекологии, лучевой диагностике и медицинской генетике. Разработка методов инвазивных диагностических процедур получения клеток плода в сочетании со все расширяющимися возможностями ДНК-диагностики создала предпосылки для дородовой диагностики широкого круга наследственных болезней. Пренатальная диагностика является особым видом помощи семье, заключающимся в профилактике новых случаев заболевания.
Слайд 71: Общие показания к проведению пренатальной диагностики
Повышенный генетический риск рождения ребенка с наследственным или врожденным заболеванием. Тяжелый характер заболевания, оправдывающий прерывание беременности Отсутствие удовлетворительного способа лечения предполагаемого заболевания Наличие точного диагностического теста Согласие семьи на проведение пренатальной диагностики и прерывание беременности по показаниям
Слайд 72: Неинвазивные (скринирующие) методы
УЗИ плода Сывороточные факторы в крови матери – тройной тест (АФП, ХГЧ, НЭ) Новые сывороточные маркеры: димерный ингибин А, бета-коровый фрагмент ХГЧ (в моче), белок беременных РАРР-А Клетки плода (эритробласты, лимфоциты) в кровяном русле матери
Слайд 73: Инвазивные (диагностические) методы
Амниоцентез Биопсия ворсин хориона Кордоцентез Фетоскопия
Слайд 74: Генетика соматических клеток
Гибридизация соматических клеток: вирус Сендай и пропиленгликоль обеспечивают слияние соматических клеток, селективная среда, обеспечивающая изоляцию гибридных клеток. Картирование генов на индивидуальных хромосомах (первый картированный ген – ген тимидинкиназы). Культура клеток HeLa – из клеток рака матки. Клональное происхождение раковых клеток.
Слайд 75
МУТАЦИИ ГЕНОВ СОМАТИЧЕСКИХ КЛЕТОК Мутации генов соматических клеток, являются одной из основных причин онкологических заболеваний. Наиболее важная роль в малигнизации клеток принадлежит мутациям в генах протоонкогенов и генах супрессорах опухолевого роста. Та и другая система генов в норме имеет непосредственное отношение к клеточному делению. По-видимому, мутации генов соматических клеток имеют отношение не только к возникновению опухолей, но и к старению, а также к патогенезу распространенных неинфекционных заболеваний, таких, например, как атеросклероз и др.
Слайд 76: Генетическая дактилоскопия
В ДНК человека присутствует огромное число вариабельных точек, по которым наблюдается высокая индивидуальная изменчивость Молекулярный анализ этих участков генома позволяет проводить идентификацию человека Для анализа пригоден любой биологический материал
Слайд 77: Вариабельность ДНК
Около 99,7% ДНК-последовательности у всех людей идентичны Около 0,3% (примерно 10 000 000 нуклеотидов) различаются между отдельными индивидами.
Слайд 78: Повторяющиеся последовательности
Сателлитная ДНК – размер повторяющегося элемента от нескольких сотен до нескольких тысяч пн Минисательтная ДНК ( VNTR – variant number tandem repeats ) размер повторяющегося элемента 10-100пн Микросательтная ДНК ( STR – short tandem repeats ) размер повторяющегося элемента 2-6 пн
Слайд 79: Полиморфные варианты ДНК
Различия в последовательности ДНК (Однонуклеотидные полиморфизмы – SNP) -----------A G GCTG------------- -----------A A GCTG------------- Различия в длине последовательностей ----------AATG AATG---------------- ----------AATG AATG AATG-------
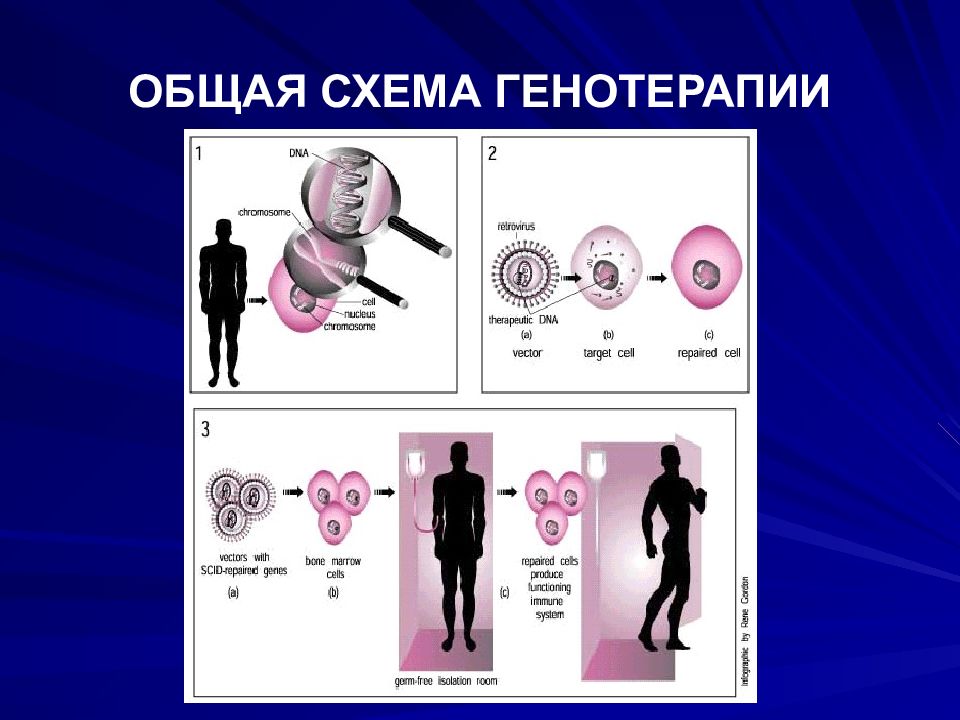
Слайд 80: ГЕНОТЕРАПИЯ
ГЕНОТЕРАПИЯ – НОВОЕ НАПРАВЛЕНИЕ В ЛЕЧЕНИИ БОЛЕЗНЕЙ ЧЕЛОВЕКА, КОТОРОЕ РАССМАТРИВАЕТСЯ КАК ФАРМАКОТЕРАПИЯ XXI ВЕКА
Слайд 81
Генотерапия – это метод для исправления дефектного гена, ответственного за развитие заболевания. Для исправления дефектного гена могут быть использованы разные подходы: Наиболее часто в ядро вводится нормальный ген без специфической локализации для замещения дефектного гена. Дефектный ген может быть замещен нормальным геном с помощью гомологичной рекомбинации. Дефектный ген может быть исправлен с помощью селективной обратной мутации. Может быть изменена регуляция определенного гена (уровень его активности).
Слайд 82: Цели генотерапии
Коррекция наследственной патологии: введение нормально работающего гомолога дефектного гена в клетки-мишени Придание клеткам-мишеням новых функций, способствующих устранению патологических процессов: введение генов, обладающих условным цитотоксическим эффектом или способствующих формированию выраженного иммунного ответа (опухоли, инфекции)
Слайд 84: УСЛОВИЯ ДЛЯ ПРОВЕДЕНИЯ ГЕНОТЕРАПИИ
ИДЕНТИФИКАЦИЯ И КЛОНИРОВАНИЕ ГЕНА, ПРОДКУТЫ КОТОРОГО НЕОБХОДИМЫ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЗНАНИЕ ЗВЕНЬЕВ ПАТОГЕНЕЗА ЗАБОЛЕВАНИЯ, КОТОРОЕ ПРЕДПОЛАГАЕТСЯ ЛЕЧИТЬ ГЕНОТЕРАПИЕЙ РАЗРАБОТКА СПОСОБОВ ДОСТАВКИ ГЕНА В КЛЕТКИ-МИШЕНИ (трансгеноз) СОЗДАНИЕ ГЕНЕТИЧЕСКОЙ КОНСТРУКЦИИ, КОТОРАЯ ОБЕСПЕЧИТ ВЫСОКУЮ И ПРОДОЛЖИТЕЛЬНУЮ АКТИВНОСТЬ ТРАНСГЕНА ДЛЯ СОМАТИЧЕСКОЙ ГЕНОТЕРАПИИ ТРАНСГЕНОЗ МОЖЕТ БЫТЬ ПРОВЕДЕН EX VIVO И IN VIVO
Слайд 85: Способы введения экзогенных ДНК
Генная терапия ex vivo предполагает выделение и культивирование специфических типов клеток пациента или их предшественников (стволовые клетки), введение в них чужеродных генов, отбор трансфецированных клеток и реинфузия их тому же пациенту Генная терапия in vivo основана на прямом введении клонированных и упакованных последовательностей ДНК в специфические ткани больного
Слайд 86: ВИРУСЫ, КОТОРЫЕ ИСПОЛЬЗУЮТСЯ В КАЧЕСТВЕ ВЕКТОРОВ
ДЛЯ ДОСТАВКИ «ТЕРАПЕВТИЧЕСКОГО» ГЕНА В КЛЕТКИ –МИШЕНИ ХОЗЯИНА ИСПОЛЬЗУЮТСЯ СПЕЦИАЛЬНЫЕ МОЛЕКУЛЫ ПЕРЕНОСЧИКИ, КОТОРЫЕ НАЗЫВАЮТСЯ ВЕКТОРАМИ. ЧАЩЕ ВСЕГО В КАЧЕСТВЕ ВЕКТОРОВ ИСПОЛЬЗУЮТ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫЕ ВИРУСЫ: РЕТРОВИРУСЫ- класс вирусов, геном которых представлен молекулой РНК. В клетках хозяина на основе этой РНК образуется двунитевая ДНК, которая может интегрироваться в геном делящихся соматических клеток. АДЕНОВИРУСЫ - класс вирусов, геном которых представлен двунитевой молекулой ДНК. Встраиваются в геном неделящихся клеток в присутствии клеток-помощников. АДЕНОАССОЦИИРОВАННЫЕ ВИРУСЫ – класс вирусов, геном которых представлен однонитевой молекулой ДНК, способной встраиваться в специфический сайт хромосомы 19. ВИРУС ПРОСТОГО ГЕРПЕСА - класс вирусов, геном которых представлен двунитевой молекулой ДНК.
Слайд 87: ГЕНЕТИЧЕСКАЯ МОДИФИКАЦИЯ ВИРУСОВ-ВЕКТОРОВ
ЧТОБЫ ИСПОЛЬЗОВАТЬ ВИРУСЫ В КАЧЕСТВЕ ВЕКТОРОВ ИХ ГЕНЕТИЧЕСКИ МОДИФИЦИРУЮТ – УДАЛЯЮТ ГЕНЫ ВИРУСА, ОТВЕТСТВЕННЫЕ ЗА ПАТОГЕННОСТЬ И ВСТАВЛЯЮТ ГЕНЕТИЧЕСКУЮ КОНСТРУКЦИЮ, СОДЕРЖАЩУЮ «ТЕРАПЕВТИЧЕСКИЙ» ГЕН.
Слайд 88: ГЕНЕТИЧЕСКАЯ МОДИФИКАЦИЯ АДЕНО-АССОЦИИРОВАННОГО ВИРУСА
ИЗ ВИРУСА УДАЛЯЮТ REP И CAP ГЕНЫ, КОТОРЫЕ ОТВЕЧАЮТ ЗА СИНТЕЗ БЕЛКОВ, ОБЕСПЕЧИВАЮЩИХ РЕПЛИКАЦИЮ ВИРУСА, ЕГО ИНТЕГРАЦИЮ В ГЕНОМ ХОЗЯИНА И ОБРАЗОВАНИЕ ОБОЛОЧКИ. ВМЕСТО НИХ ВСТАВЛЯЮТ ГЕН ЧЕЛОВЕКА С РЕГУЛИРУЮЩИМИ ПОСЛЕДОВАТЕЛЬНОСТЯМИ. ТАКОЙ ВИРУС МОЖЕТ РАЗМНОЖАТЬСЯ ТОЛЬКО С ПОМОЩЬЮ «ПОМОШНИКА, НАПР. НОРМАЛЬНОГО АДЕНО-АССОЦИИРОВАННОГО ВИРУСА.
Слайд 89: ДРУГИЕ СПОСОБЫ ДОСТАВКИ ТРАНСГЕНОВ
ФИЗИЧЕСКИЕ: электропорация ДНК, бомбардировка частицами золота с нанесенными на них ДНК, микроинъекции ДНК ХИМИЧЕСКИЕ: кальций-фосфатная преципитация ЭНДОЦИТОЗ С УЧАСТИЕМ РЕЦЕПТОРОВ: комплекс ДНК-белок, комплекс ДНК-оболочка вируса СЛИЯНИЕ: липосомы (липидные пузырьки с заключенными в них молекулами ДНК, которые проникают через клеточную оболочку)
Слайд 90: Подходы к генокоррекции онкологических заболеваний
Принцип: Повышение иммунореактивности опухоли Инсерция генов «самоубийц» Блок экспрессии онкогенов Инсерция генов-супрессоров опухоли Защита нормальных клеток от химиотерапии Вводимые гены: Гены цитокинов, чужеродных антигенов Гены тимидинкиназы, цитозиндезаминазы Антисмысловые мРНК Антионкоген Р53 Гены лекарственной устойчивости тип1
Слайд 91: Подходы к генокоррекции вирусных инфекций
Разрушение регуляторных механизмов вирусов. Впервые апробирована на вирусе иммунодефицита HIV – путем введения в Т-лимфоциты от 20 до 50 копий TAR- гена Введение в пораженные ткани антисмысловых последовательностей, способных гибридизоваться с вирусами и, таким образом, их нейтрализовывать
Слайд 92: ГЕНОТЕРАПИЯ МУКОВИСЦИДОЗА
327 БОЛЬНЫХ МУКОВИСЦИДОЗОМ ДОБРОВОЛЬЦЕВ УЧАСТВОВАЛИ В ГЕНОТЕРАПЕВТИЧЕСКИХ ЭКСПЕРИМЕНТАХ КЛИНИЧЕСКИЕ ИСПЫТАНИЯ ГЕНОТЕРАПЕВТИЧЕСКИХ КОНСТРУКЦИЙ ПОКАЗАЛИ, ЧТО МОЖНО ДОБИТЬСЯ ЭКСПРЕССИИ ФУНКЦИОНАЛЬНОГО БЕЛКА CFTR В ЛЕГОЧНОЙ ТКАНИ БЕЗ ПОБОЧНЫХ ЭФФЕКТОВ. ОДНАКО УРОВЕНЬ ЭКСПРЕССИИ ГЕНА МУКОВИСЦИДОЗА ПОКА ОСТАЕТСЯ ОЧЕНЬ НИЗКИМ ДЛЯ ДОСТИЖЕНИЯ ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА.
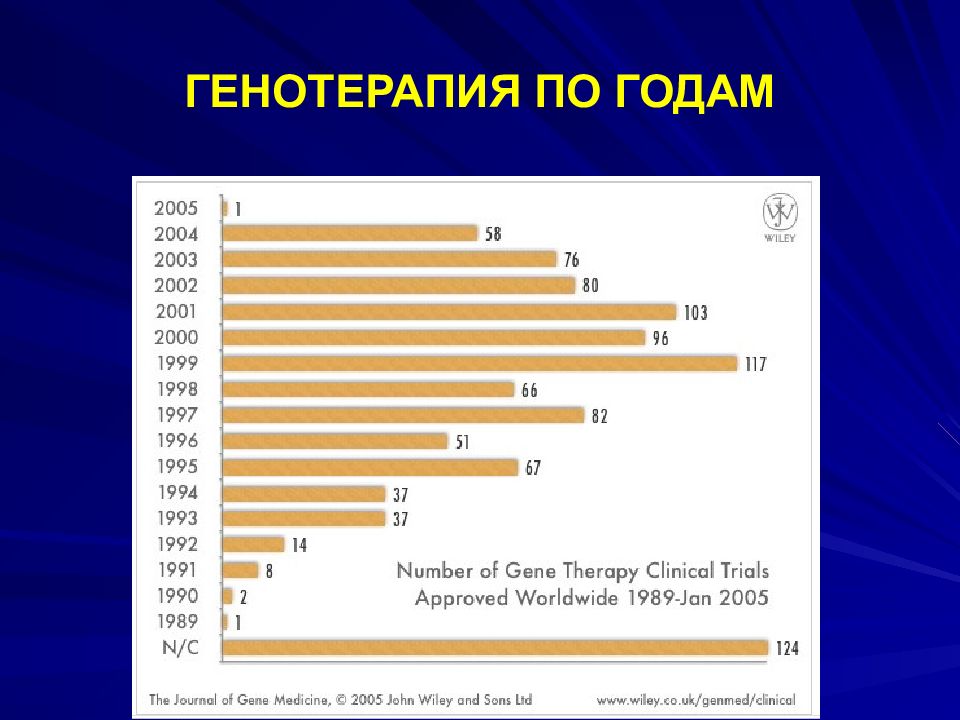
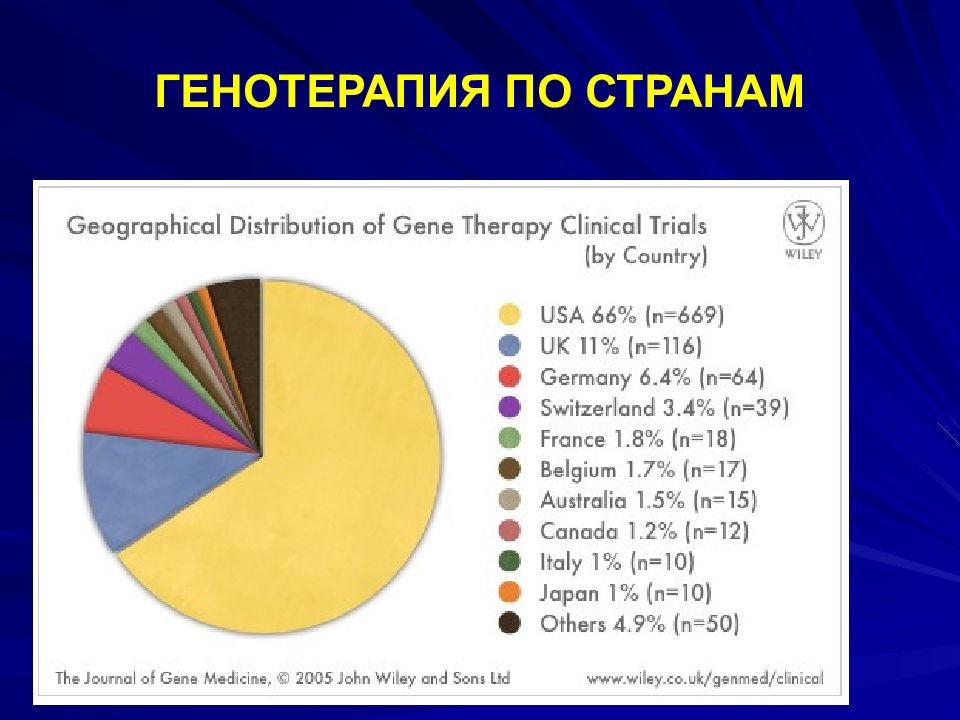
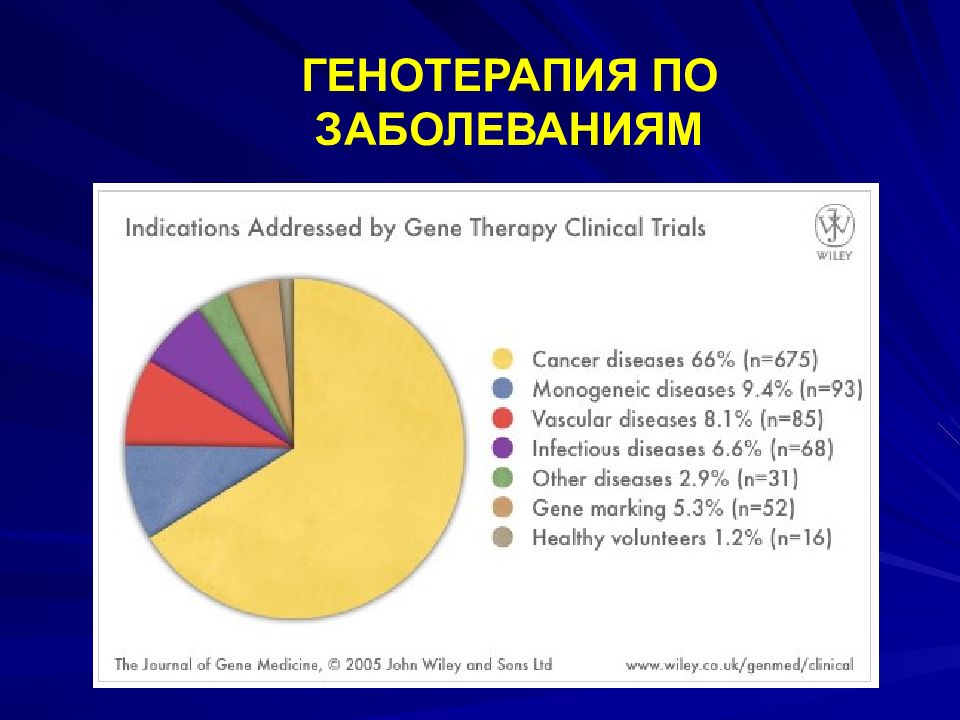
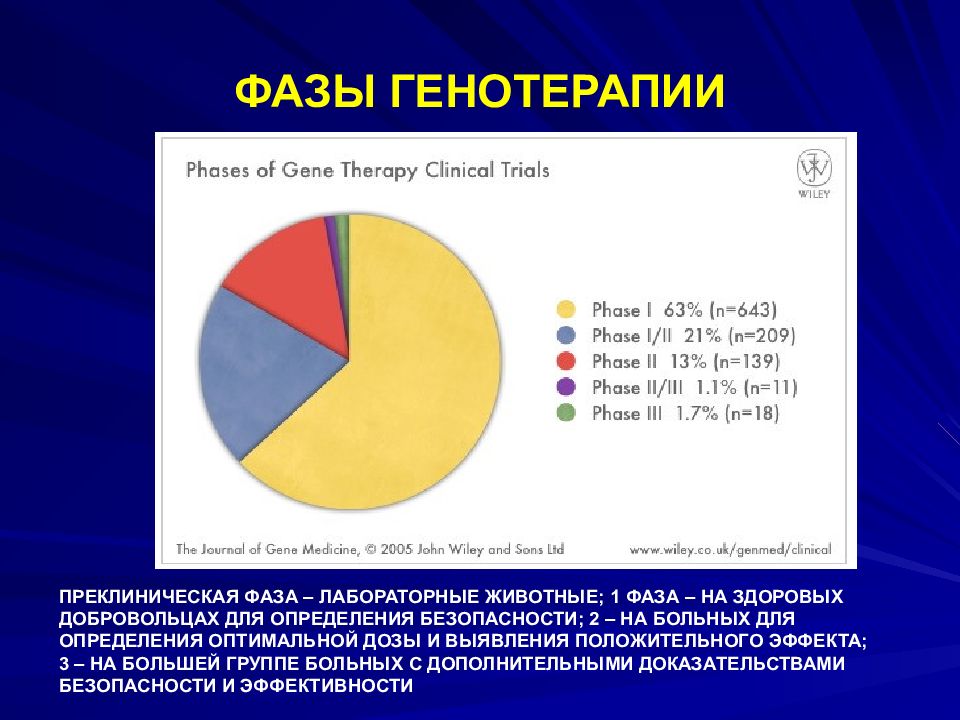
Слайд 97: ФАЗЫ ГЕНОТЕРАПИИ
ПРЕКЛИНИЧЕСКАЯ ФАЗА – ЛАБОРАТОРНЫЕ ЖИВОТНЫЕ; 1 ФАЗА – НА ЗДОРОВЫХ ДОБРОВОЛЬЦАХ ДЛЯ ОПРЕДЕЛЕНИЯ БЕЗОПАСНОСТИ; 2 – НА БОЛЬНЫХ ДЛЯ ОПРЕДЕЛЕНИЯ ОПТИМАЛЬНОЙ ДОЗЫ И ВЫЯВЛЕНИЯ ПОЛОЖИТЕЛЬНОГО ЭФФЕКТА; 3 – НА БОЛЬШЕЙ ГРУППЕ БОЛЬНЫХ С ДОПОЛНИТЕЛЬНЫМИ ДОКАЗАТЕЛЬСТВАМИ БЕЗОПАСНОСТИ И ЭФФЕКТИВНОСТИ
Слайд 98
ФАРМАКОГЕНЕТИКА И ФАРМАКОГЕНОМИКА – НОВЫЕ НАПРАВЛЕНИЯ ФАРМАКОЛОГИИ МЕТАБОЛИЗМ ЛЕКАРСТВ НАХОДИТСЯ ПОД ГЕНЕТИЧЕСКИМ КОНТРОЛЕМ. ГЕНОТИПИРОВАНИЕ ПО ГЕНАМ МЕТАБОЛИЗМА КСЕНОБИОТИКОВ НЕОБХОДИМО ДЛЯ ВЫЯВЛЕНИЯ ИНДИВИДУАЛЬНОЙ ЧУВСТВИТЕЛЬНОСТИ К ЛЕКАРСТВАМ п РОДУКТЫ ГЕНОВ, АССОЦИИРУЮЩИХ С ПРЕДРАСПОЛОЖЕННОСТЬЮ К РАЗЛИЧНЫМ МУЛЬТИФАКТОРИАЛЬНЫМ ЗАБОЛЕВАНИЯМ, ТЕОРЕТИЧЕСКИ ЯВЛЯЮТСЯ МИШЕНЯМИ ДЛЯ ДЕЙСТВИЯ НОВЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Слайд 99
ГЕНЕТИКА ПРОМЫШЛЕННЫХ МИКРОРГАНИЗМОВ И СИНТЕЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Все штаммы промышленных микроорганизмов-продуцентов антибиотик ов, аминокислот, нуклеозид ов, фермент ов получены с помощью генетического конструирования, которое включает получение и выделение необходимых мутантов, как правило, с использованием индуцированного мутагенеза, позволяющие получить штамм-продуцент, отличающийся от исходного по выходу целевого продукта иногда в тысячи раз. И спользовани е технологии генетической инженерии, когда в микробную клетку вводят гены или кДНК человека, привело к микробиологическому синтезу ряда белков человека, в том числе гормонов ( инсулин и гормон роста), факторов свертывания крови (фактор VIII, IX и тканевой активатор плазминогена), бета-интерферона, гамма-нтерферона, альфа-интерферона, интерлейкина 2, эритропоэтина и др.
Слайд 100: Клонирование
Точное воспроизведение живого объекта в каком-то количестве копий. (копии идентичны по набору генов) Растения – черенкование, животные – бесполое размножение Монозиготные близнецы – природные клоны Первые работы по клонированию в СССР 40-е годы XX века акад. В.А. Струнников (тутовый шелкопряд)
Слайд 101: Методика:
Из яйцеклетки извлекают ядро и вводят диплоидное соматическое ядро из тотипотентных клеток Методика пересадки ядер в яйцеклетку разработал Г.В. Лопашов 40-е годы В 50-е годы американцы Бригс и Кинг выполнили сходные опыты Ян Вильмут - Долли
Последний слайд презентации: СОВРЕМЕННЫЕ ДОСТИЖЕНИЯ МЕДИЦИНСКОЙ ГЕНЕТИКИ: Проблемы:
Эффективность: не более 1-2% (Долли – 1 из 236 опытов) Ядра соматической клетки взрослого отличаются от такового у эмбриона (теломераза) Перестройка генома идет в период эмбрионального развития Геном и среда – «норма реакции» Этические проблемы