Первый слайд презентации
Свойства и применение кислорода. Круговорот кислорода в природе
Слайд 2
Цель урока: изучить физические и химические свойства кислорода, дать общее понятие об оксидах, реакциях горения; рассмотреть практическую значимость и применение; доказать, что кислород - один из важнейших элементов на Земле.
Слайд 3
«А ну-ка, химики» 1. Химический знак кислорода? 2. Относительная атомная масса кислорода? 3. Химическая формула кислорода? 4. Относительная молекулярная масса кислорода? 5. В соединениях кислород обычно какой валентности? 6. Расскажите о нахождении кислорода в природе. 7. Перечислите способы получения кислорода в лаборатории. 8. Перечислите способы получения кислорода в промышленности. 9. Установите соответствие между способом получения кислорода и уравнением химической реакцией. 10. Что называют катализаторами? Где эти вещества применяются?
Слайд 4: Кислород
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II Кислород Простое вещество Неметалл Молекула – О 2 Относительная молекулярная масса - 32
Слайд 6: Элемент - вещество
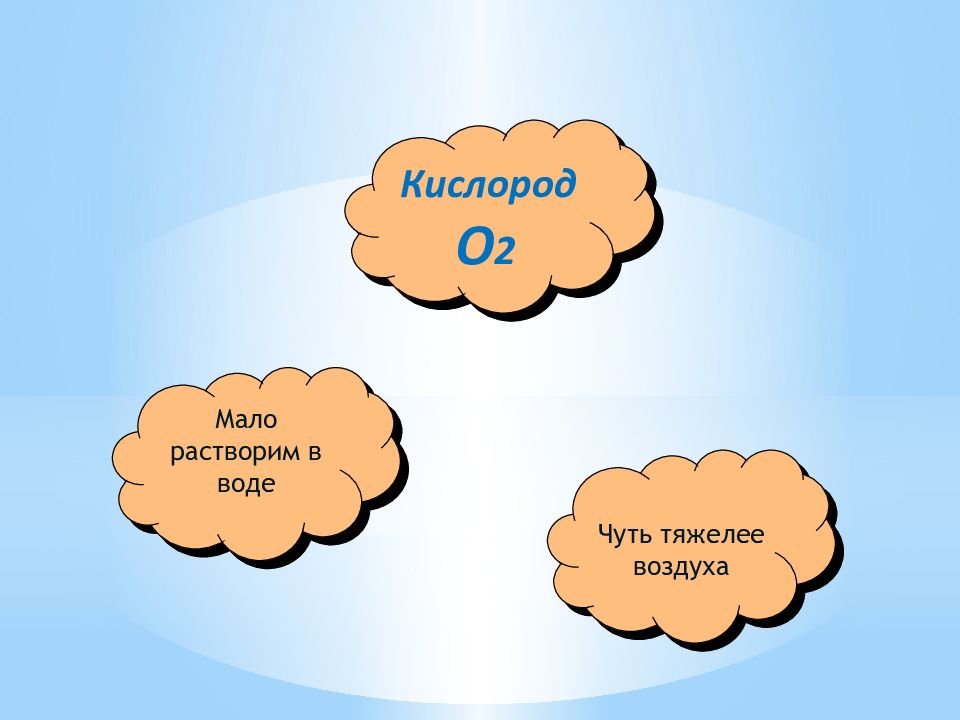
Кислород – газ, плохо растворимый в воде. Химическая формула кислорода – О 2 В воздухе содержится приблизительно 21% кислорода. Молярная масса кислорода - 32 В земной коре содержится приблизительно 47% кислорода. Валентность кислорода равна двум. Рыбы дышат кислородом, растворённым в воде. В промышленности кислород получают из воздуха. Химический знак кислорода – О. На долю кислорода приходится 89% массы Мирового океана Атомная масса кислорода – 16
Слайд 7
Физические свойства кислорода Кислород - бесцветный газ, без вкуса и запаха, относительно малорастворим в воде (в 100 объемах воды при температуре 20ºС растворяется 3,1 объема кислорода). Кислород немного тяжелее воздуха: 1л кислорода при нормальных условиях весит 1,43 г, а 1л воздуха — 1,29г. (Нормальные условия - сокращенно: н.у. - температура 0ºС и давление 760 мм.рт.ст., или 1 атм. ≈ 0,1 МПа). При давлении 760 мм.рт.ст. и температуре -183ºС кислород сжижается, а при снижении температуры до -218,8ºС затвердевает.
Слайд 9
Горение угля в кислороде Если опустить в сосуд с кислородом O 2 тлеющий уголек, то он раскаляется добела и сгорает, образуя оксид углерода(IV) СO 2. C + O 2 = CO 2 Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — раствор гидроксида кальция Са (ОН) 2. Она мутнеет, так как при этом образуется нерастворимый карбонат кальция СаСO 3 : CO 2 + Ca (OH) 2 = CaCO 3 ↓ + H 2 O
Слайд 10
Горение серы в кислороде Сера горит в кислороде ярким синим пламенем с образованием газа с резким запахом — оксида серы(IV): S + O 2 = SO 2
Слайд 11
Горение фосфора в кислороде Фосфор Р сгорает в O2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора(V). 4P + 5O 2 = 2P 2 O 5
Слайд 12
Горение железа в кислороде В кислороде горят и такие вещества, которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe 3 O 4. В этом соединении два атома железа трехвалентны и один двухвалентен. Поэтому реакцию горения железа в кислороде можно выразить следующим уравнением: 3Fe + 2O 2 = FeO * Fe 2 O 3 или Fe 3 O 4
Слайд 14
Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Слайд 15
Оксиды — это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Слайд 16
Известны химические элементы, которые непосредственно с кислородом не соединяются. К ним относятся золото Au и некоторые другие. Оксиды этих элементов получают косвенным путем.
Слайд 24
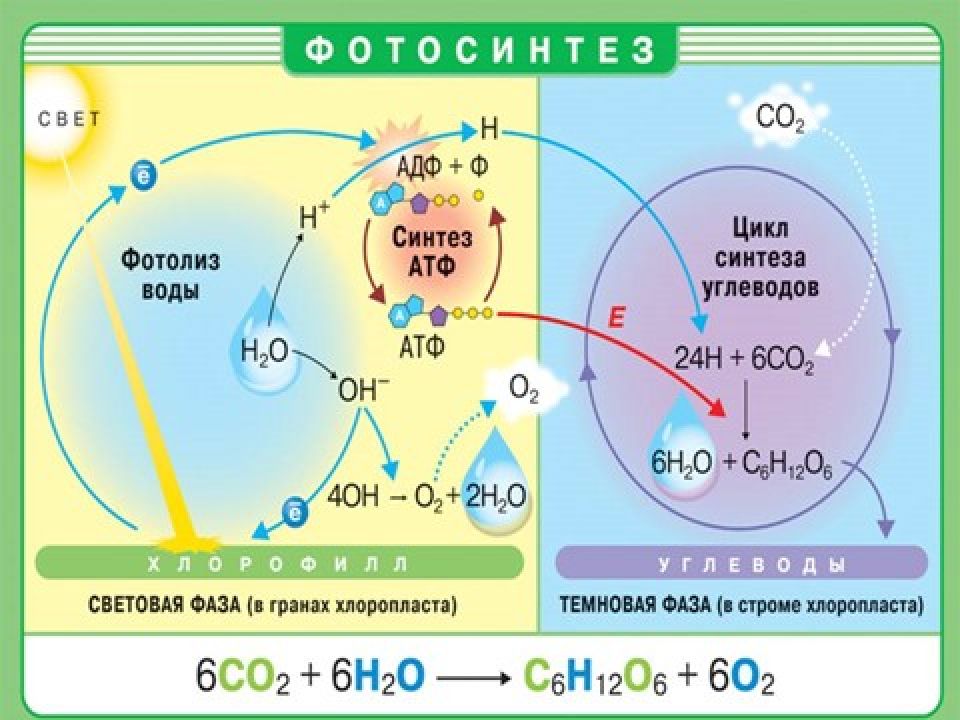
Задание №1. «Правда или ложь? Если знаешь - разберешь» Для кислорода верны следующие утверждения : а) Кислород – бесцветный газ, без вкуса и запаха. б) Кислород немного легче воздуха. в) В кислороде горят и такие вещества, которые обычно считают негорючими, например железо. г) Известны химические элементы, которые непосредственно с кислородом соединяются. К ним относятся золото Au и некоторые другие. д) Применение кислорода основано на его физических свойствах. е) Непрерывный круговорот кислорода непосредственно связан с таким процессом, как фотосинтез.
Слайд 25
Задание №2. «Мозговой штурм» Расставьте коэффициенты в уравнениях реакций. а ) CO 2 + H 2 O = C 6 H 12 O 6 + O 2 б ) P + O 2 = P 2 O 5
Слайд 26
Задание №4. «Ассоциации» С каким применением кислорода ассоциируется данное изображение?
Слайд 28
Рефлексия Сегодня я узнал... было трудно… я понял, что… я научился… я смог… было интересно узнать, что… меня удивило… мне захотелось…
Слайд 29
В чём горят дрова и газ, Фосфор, водород, алмаз? Дышит чем любой из нас Каждый миг и каждый час? Без чего мертва природа? Правильно, без….