Слайд 2: Сущность титриметрического анализа
Основан на измерении объема реагента точно известной концентрации, затраченного на реакцию с определяемым компонентом. Применяются титрованные растворы – растворы концентрация которых точно известна. Основан на законе эквивалентов : C 1 · V 1 = C 2 · V 2. Анализ быстрый; Довольно точный; Анализ эталонный.
Слайд 3: Основные понятия
Титрование – процесс постепенного прибавления по каплям раствора-титранта к анализируемому раствору. Титрант (рабочий раствор) – это раствор которым титруют, его концентрация должна быть точно известна. Титр – это концентрация раствора, указывающая какая масса вещества содержится в одном мл раствора (Т, г/мл). Точка эквивалентности (ТЭ) – это тот момент титрования, когда количество добавленного титранта химически эквивалентно количеству титруемого вещества. Конечная точка титрования (КТТ) - это момент окончания титрования (часто определяется по изменению окраски индикатора).
Реакция должна протекать: по строго определенному стехиометрическому уравнению, побочные реакции должны быть исключены; количественно (практически до конца), К х.р. должна быть достаточно большой; быстро, чтобы в любой момент титрования состояние химического равновесия наступало практически мгновенно. Посторонние вещества не должны мешать титрованию. КТТ должно фиксироваться резко и быстро. Реакции по возможности должны идти при комнатной температуре.
Слайд 7
В основе методов КОТ лежит реакция нейтрализации. Что это за реакция? В основе методов КМТ лежат реакции комплексообразования. Что это за реакции? В основе методов ОТ лежат реакции осаждения. Что это за реакции? В основе методов ОВТ лежат окислительно-восстановительные реакции. Что это за реакции?
Слайд 11: Стандартные и стандартизированные растворы
Стандартные, первичные стандарты (с приготовленным титром). Готовятся по точной навеске. Точную концентрацию определяют расчетно; Стандартизированные, вторичные (с установленным титром). Готовятся по приблизительной навеске. Точную концентрацию определяют стандартизацией; Стандартизация – процесс нахождения концентрации активного реагента в растворе путем титрования его с применением стандартного раствора (первичного стандарта).
Слайд 12: Стандартные растворы
Это титрованные растворы, приготовленные по точной навеске. К ним относятся растворы установочных веществ. Установочные вещества – это химически устойчивые вещества с помощью которых определяют путем стандартизации точную концентрацию рабочих растворов или титрантов. Требования к веществам: Химически чистые; Устойчивые при хранении в сухом виде и в растворах; Состав их должен строго соответствовать формуле.
Слайд 13: Алгоритм приготовления стандартного раствора
Расчет навески: g т = C N • M Э • V л, где C N и V л – заданы. *Взятие навески: на ТВ (0,01 г); на АВ (0,0001 г): g пр. = m капс.+н. – m капс. С ост. * использовать фиксанал. Растворение навески в мерной колбе соответствующего объема. Расчеты:
Слайд 14: Стандартизированные растворы
Это растворы, приготовленные по приблизительной навеске, титр их устанавливают стандартизацией. Свойства этих веществ: Неустойчивые при хранении в сухом виде и в растворах (гигроскопичные, поглощают из воды и воздуха газы, легко вступают в ОВР); Химически нечистые (в составе могут быть примеси); Состав их не соответствует формуле.
Слайд 15: Алгоритм приготовления стандартизированного раствора
Расчет навески: g т = C N • M Э • V л, где C N и V л – заданы. Взятие навески: только на ТВ (0,01 г). Растворение навески в мерной колбе соответствующего объема. Стандартизация по установочному веществу. Расчеты:
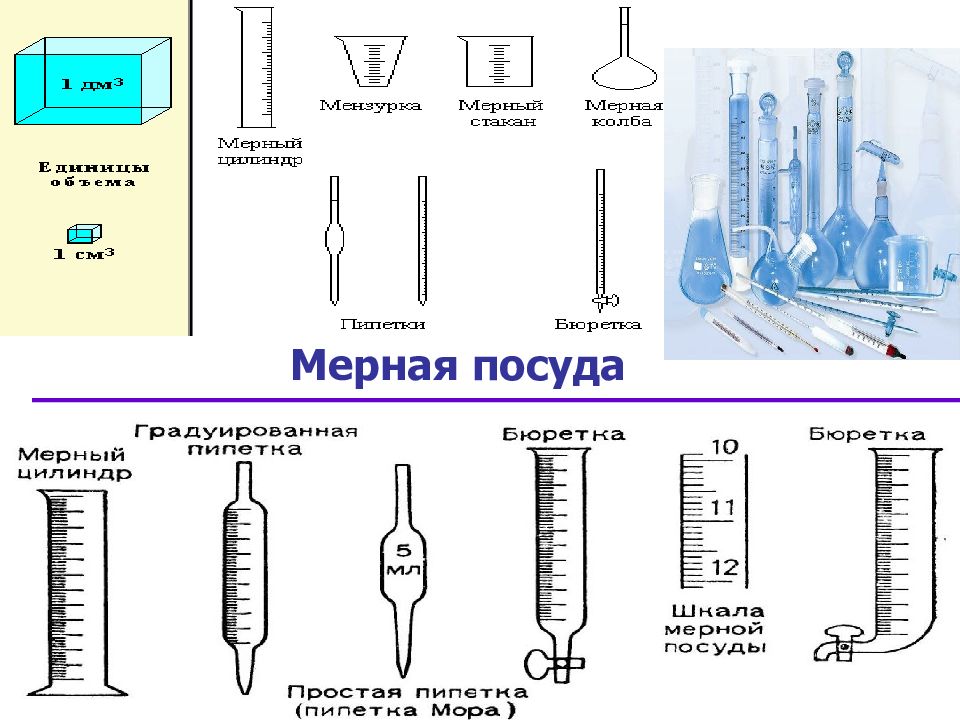
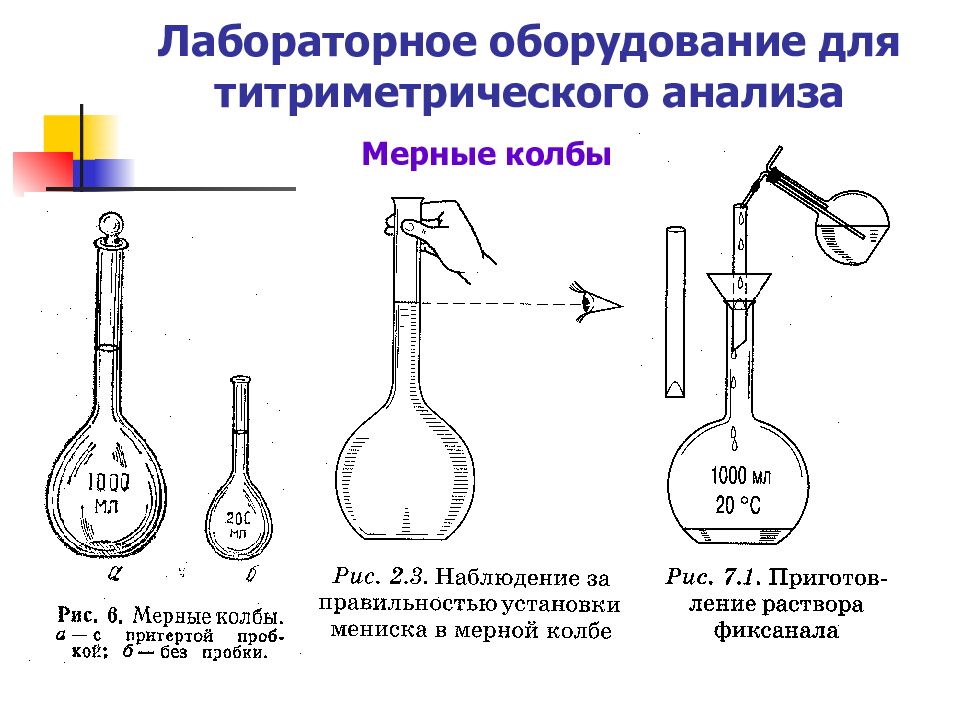
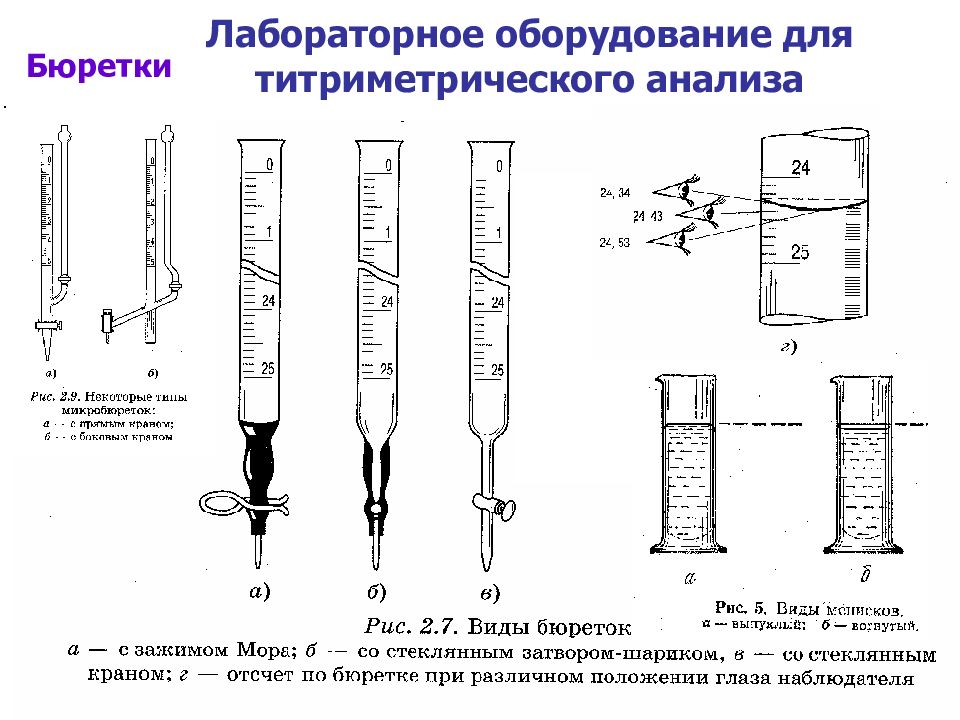
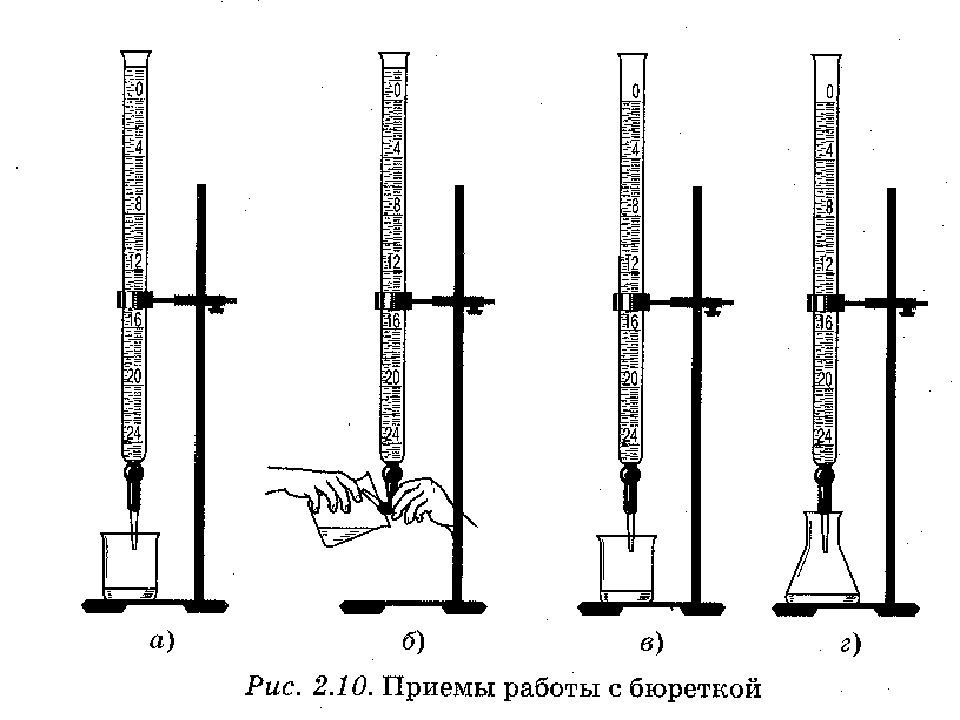
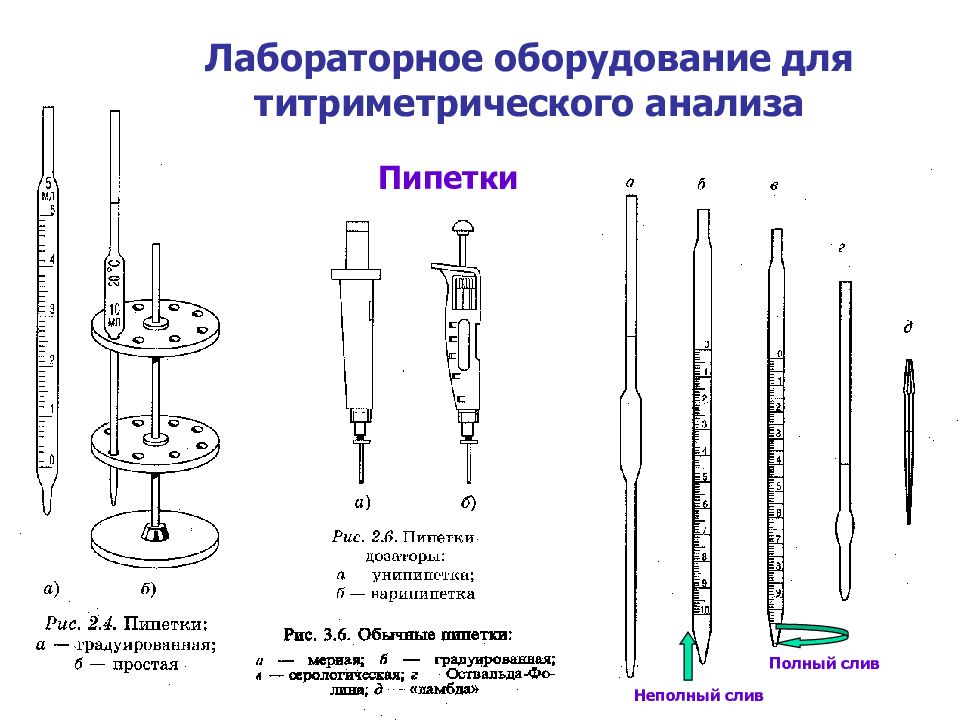
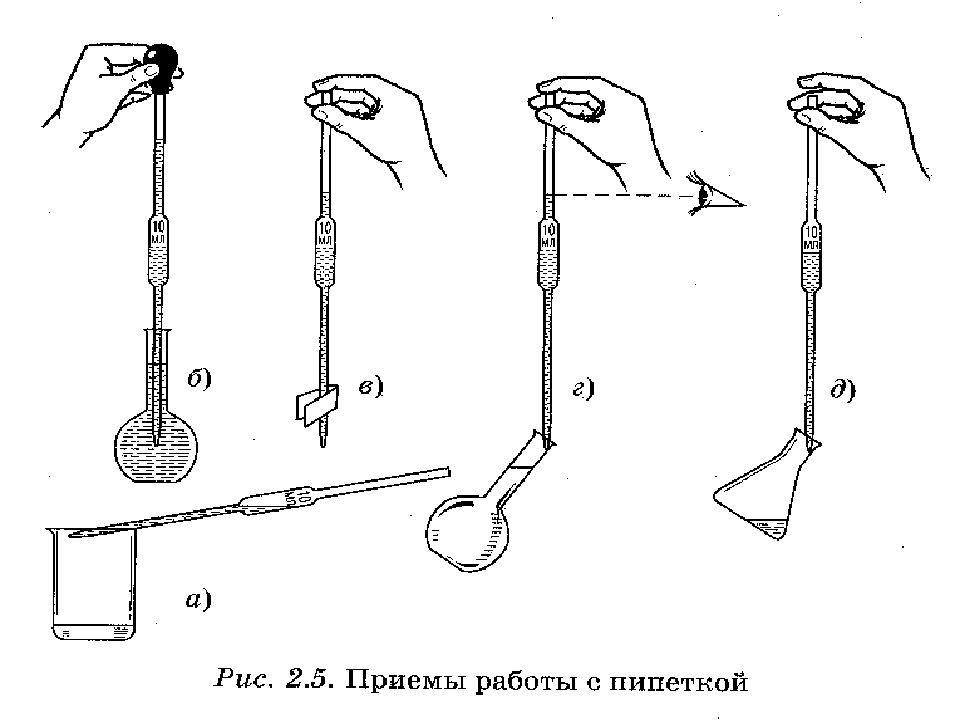
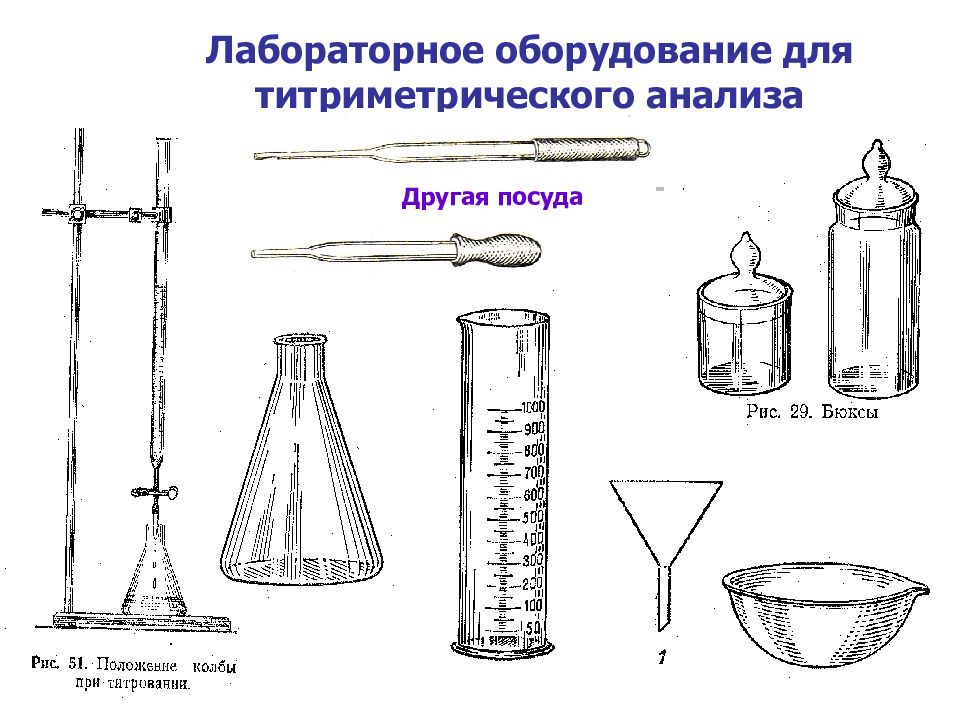
Слайд 20: Лабораторное оборудование для титриметрического анализа
Пипетки Пипетки Неполный слив Полный слив
Слайд 23: Погрешности титриметрического анализа
Погрешности взвешивания; Погрешности измерения объема; Погрешности определения титра раствора; Погрешности титрования анализируемого раствора. Систематические: инструментальные; реактивные; индивидуальные. Перевод некоторых систематических погрешностей в случайные (калибрование посуды; работа на одних весах). Индикаторные погрешности – основной вид систематических погрешностей титриметрического анализа.
Последний слайд презентации: ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗ: Общие указания по выполнению титриметрических определений
Тщательная подготовка рабочего места (ничего лишнего); Посуда должна быть тщательно вымыта (водопроводной и дистиллированной водой) и откалибрована; Измерительные приборы поверены (работать на одних и тех же ТВ и АВ); Используемые реактивы и вода не должны содержать примесей; При титровании должно быть тщательное перемешивание содержимого колбы; Титровать нужно довольно быстро, соблюдая условия и методику; Правильно выбирать индикатор для фиксирования КТТ. Для титрования брать его немного 1-2 капли; Проводить не менее 3-х титрований с разницей результатов в 1-2 капли ( ~ 0,05 мл). Проводить титрования в один день; Скорость сливания титранта должна быть одинаковой, в конце титрования ее необходимо снизить; Все результаты занести в лабораторный журнал.