Первый слайд презентации: Кулонометрический анализ (кулонометрия)
Задание. 1)Запишите тему урока (слайд1). 2)Законспектируйте тему по плану. 3)Пришлите отчет 1 и последней страницы.
Слайд 2: План
1.Сущность метода 2.Прямая кулонометрия 3.Кулонометрическое титрование а)Сущность метода б)Условия проведения кулонометрического титрования в)Кривые титрования г)Применение
Слайд 3: Принципы метода
Кулонометрические методы основаны на измерении количества электричества, затраченного на электропревращение определяемого вещества ( прямая кулонометрия ) или на получение промежуточного реагента, который количественно реагирует с определяемым веществом ( косвенная кулонометрия или кулонометрическое титрование ).
Слайд 4
В основе кулонометрических методов анализа лежат законы электролиза Фарадея : Количество (масса) вещества, выделившегося при электролизе, пропорциональна количеству электричества, прошедшего через раствор. При прохождении через раствор одного и того же количества электричества, на электродах выделяется одно и то же количество эквивалента вещества. Где M - молярная масса вещества, прореагировавшего при электролизе n -число электронов, участвующих в электродной реакции (число Фарадея)
Слайд 5
Главная задача кулонометрических измерений – как можно более точно определить количество электричества. Кулонометрический анализ проводят либо в амперостатическом режиме, либо при контролируемом постоянном потенциале рабочего электрода, когда электрический ток изменяется в процессе электролиза. Различают прямую кулонометрию и косвенную(кулонометрическое титрование).
Слайд 6: Прямая кулонометрия
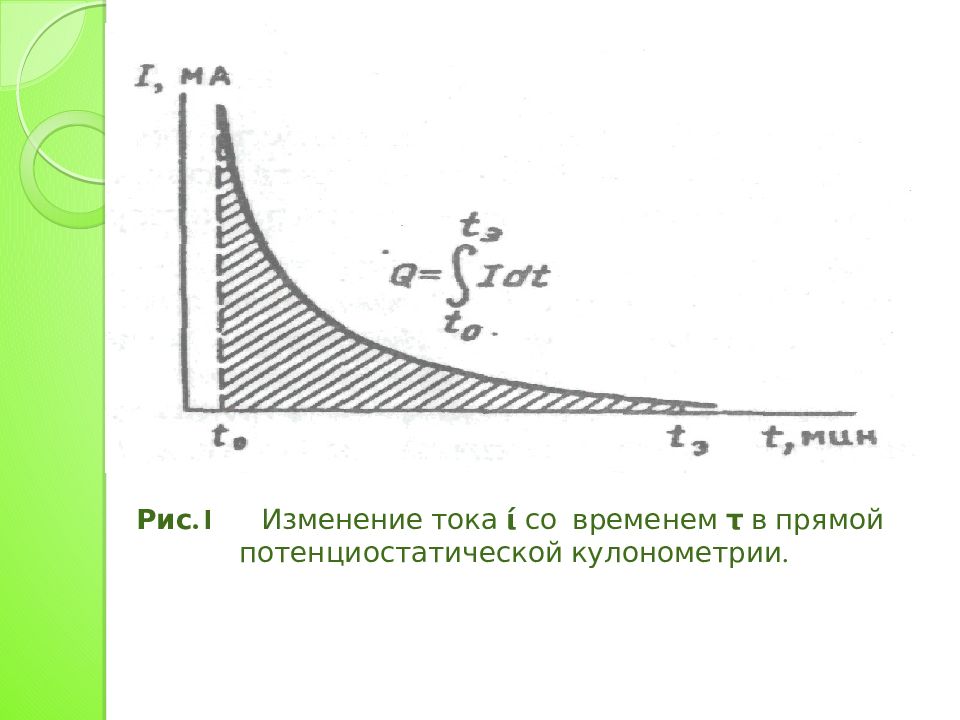
В прямой потенциостатической кулонометрии электролизу подвергают непосредственно определяемое вещество. В процессе электролиза потенциал рабочего электрода поддерживают постоянным, E=const, для чего обычно используют приборы- потенциостаты.
Слайд 7
Если электролиз проводят при постоянной силе тока (гальваностатическая кулонометрия), то количество электричества ( Q ) за время электролиза t Э, при постоянном токе I равно:
Слайд 8
Чаще применяют прямую кулонометрию при постоянном потенциале рабочего электрода. В качестве рабочего электрода чаще всего применяют платиновый электрод, на котором происходит электрохимическое восстановление или окисление определяемого вещества. Кроме рабочего электрода электрохимическая ячейка включает один-другой электрод или чаще два других электрода- электрод сравнения(хлорсеребряный),и вспомогательный(из стали).
Слайд 10
Электролиз ведут до достижения остаточного тока I t, величина которого определяется требуемой точностью. Так, если допустима погрешность порядка 0.1%, то электролиз можно считать завершенным при I t ~ 0.001· I 0. Прямая кулонометрия – высокочувствительный и точный метод анализа, легко поддающийся автоматизации. Общая погрешность метода может составлять 0.5%. При проведении электролиза в течение 10 3 с при силе тока 1 мкА принципиально возможно определить до 10‾ 9 г вещества
Слайд 11: Кулонометрическое титрование
При кулонометрическом титровании титрант не прибавляется из бюретки в титруемый раствор. Роль титранта играет вещество Т, непрерывно генерируемое при электродной реакции на генераторном электроде. Очевидно, имеется аналогия между обычным титрованием, когда титрант вводится извне в титруемый раствор и по мере его прибавления реагирует с определяемым веществом, и генерацией вещества Т, которое по мере своего образования также реагирует с определяемым веществом. Поэтому рассматриваемый метод и получил название «кулонометрическое титрование».
Слайд 12
Кулонометрическое титрование проводят в амперостатическом (гальваностатическом) режиме. Вместо объема прибавленного титранта в кулонометрическом титровании измеряют время τ и ток ί электролиза. Процесс образования вещества Т в кулонометрической ячейке во время электролиза называется генерацей титранта
Слайд 13: Условия проведения кулонометрического титрования
Вспомогательный реагент, из которого на рабочем электроде генерируется титрант, должен присутствовать в растворе в большом избытке по отношению к определяемому веществу. Величина постоянного тока ί = const при проведении электролиза должна быть меньше величины диффузного тока вспомогательного реагента. Необходимо как можно точнее определять количество электричества, израсходованного при проведении электролиза
Слайд 14
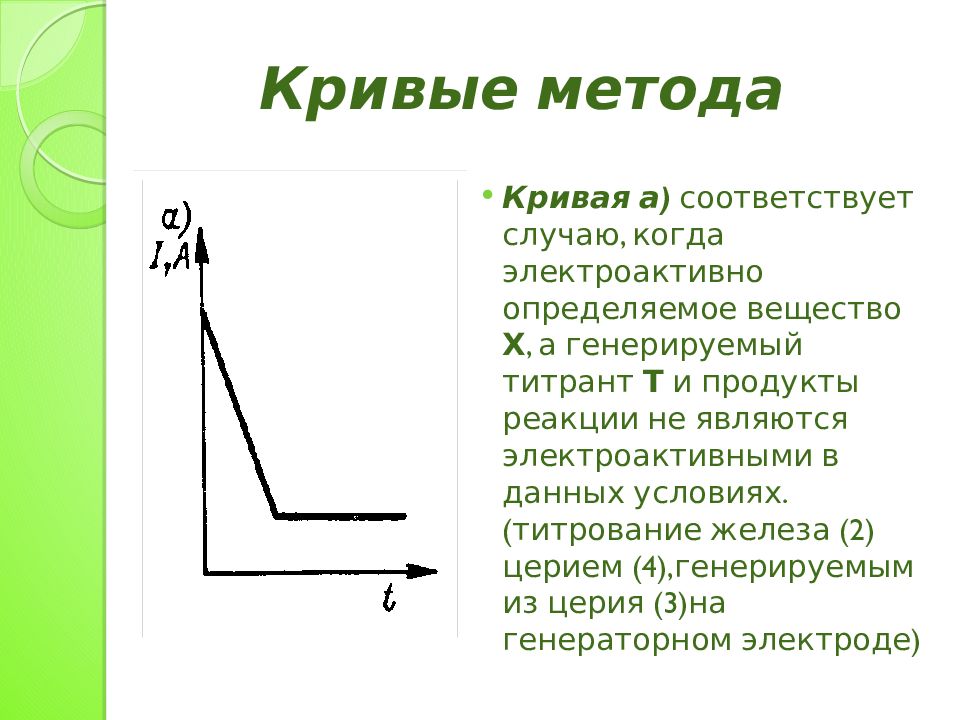
Кривая а) соответствует случаю, когда электроактивно определяемое вещество Х, а генерируемый титрант Т и продукты реакции не являются электроактивными в данных условиях.(титрование железа (2) церием (4),генерируемым из церия (3)на генераторном электроде) Кривые метода
Слайд 15
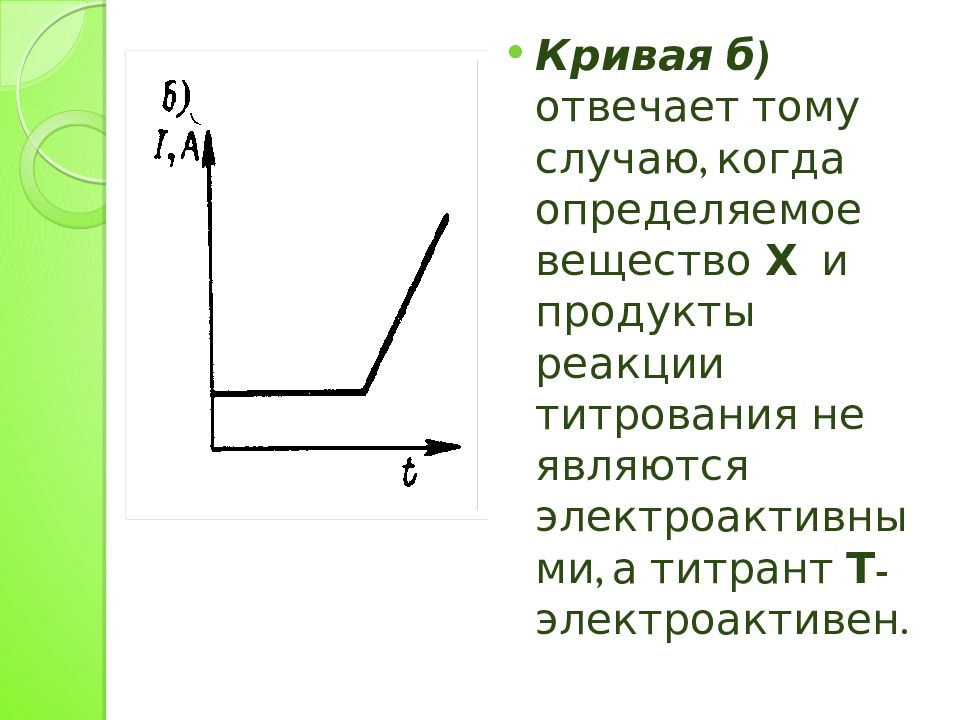
Кривая б) отвечает тому случаю, когда определяемое вещество Х и продукты реакции титрования не являются электроактивными, а титрант Т - электроактивен.
Слайд 16
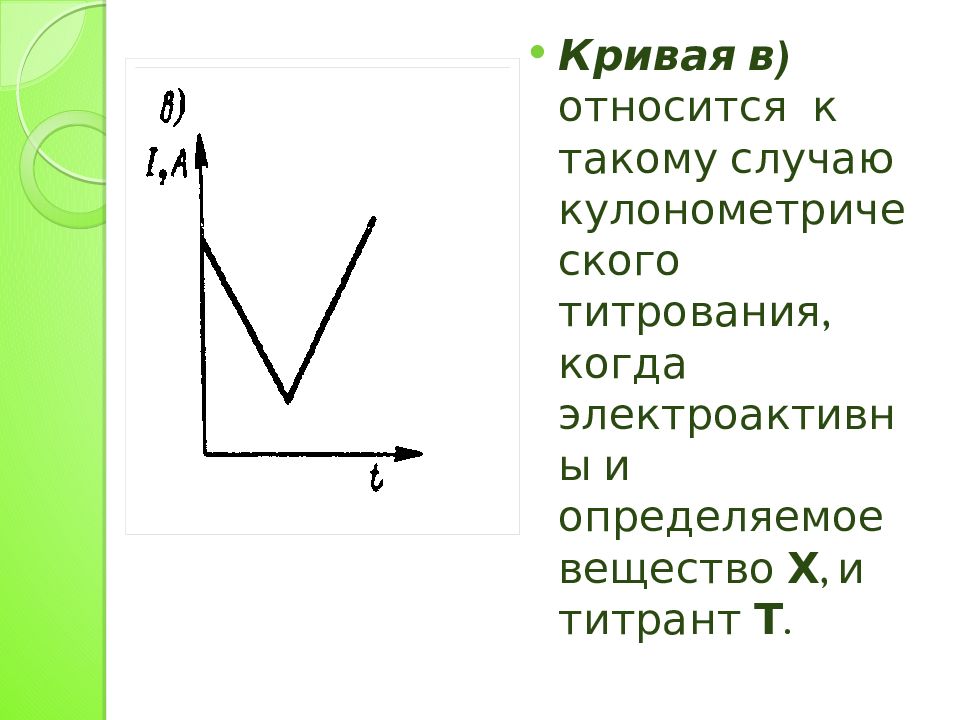
Кривая в) относится к такому случаю кулонометрического титрования, когда электроактивны и определяемое вещество Х, и титрант Т.
Слайд 17: Применение
В кулонометрическом титровании можно использовать все типы реакций титриметрического анализа: кислотно-основные,окислительно-восстоновительные,осадительные,реакции комплексообразования. Можно определять малые количества кислот Определение галогенид-ионов, органических серосодержащих соединений электрогенериронных катионами серебра, цинка Титрование катионов металлов можно проводить анионами ЭДТА,электрогенерированными на катоде из комплексона ртути(2)
Слайд 18
Преимущества: Высокая точность. Обладает широким диапазоном применения в количественном анализе. Позволяет определить малые количества вещества, малостойкие соединения. Не требуется приготовление, стандартизация и хранение титранта Недостатком метода можно считать необходимость использования сравнительно сложной и дорогостоящей аппаратуры.