Первый слайд презентации
УРОК ПО ТЕМЕ «АЗОТ, СТРОЕНИЕ, СВОЙСТВА. ОКСИДЫ АЗОТА» «Жизнь учит только тех, кто ее изучает»
Слайд 3
а з о т - а, альфа, алеф - зет - омега - тов Азот – «начало и конец всех начал» Д. Резерфорд (1749-1819) В 1772 г. в простом опыте показал, что после горения свечи в замкнутом объеме закрытого сосуда и поглощения щелочью углекислого газа остается некий «мефитический воздух» ( mephitic – удушливый), в котором свеча не горит, а мышь гибнет. Одновременно с Резер-фордом «мефитический воздух» получили англича-не Г. Кавендиш и Дж. Пристли, а такаже швед К.В. Шееле. Г.Кавендиш назвал его «испорченный воздух», а К.В. Шееле – «дурной воздух». Но все первооткрыватели «мефи-тического воздуха» объ-яснение природы проис-ходящих химических пре-вращений искали в оши-бочной теории «флогистона». В 1787 г Антуан Лавуазье подробно исследуя «ядо-витый» и «дурной» воздухи, установил, что это одно и тоже вещество, и предложил назвать его азотом, что в переводе с греческого означает безжизненный. Многие современники Лавуазье считали название нового элемента не очень удачным. Так, франц. химик предложил переименовать азот в «нитроген» (обра-зующий селитру). Этому названию мы обязаны и символом азота – N.
Слайд 4
Строение атома ГРУППА ПЕРИОД VA 2 N 7 14.0067 АЗОТ ? ? N 7 14 р + = 7 n 0 = 7 e = 7 ? ? ? 2 5 Степени окисления: -3; -2; -1; 0; +1; +2; +3; +4; +5
Слайд 5
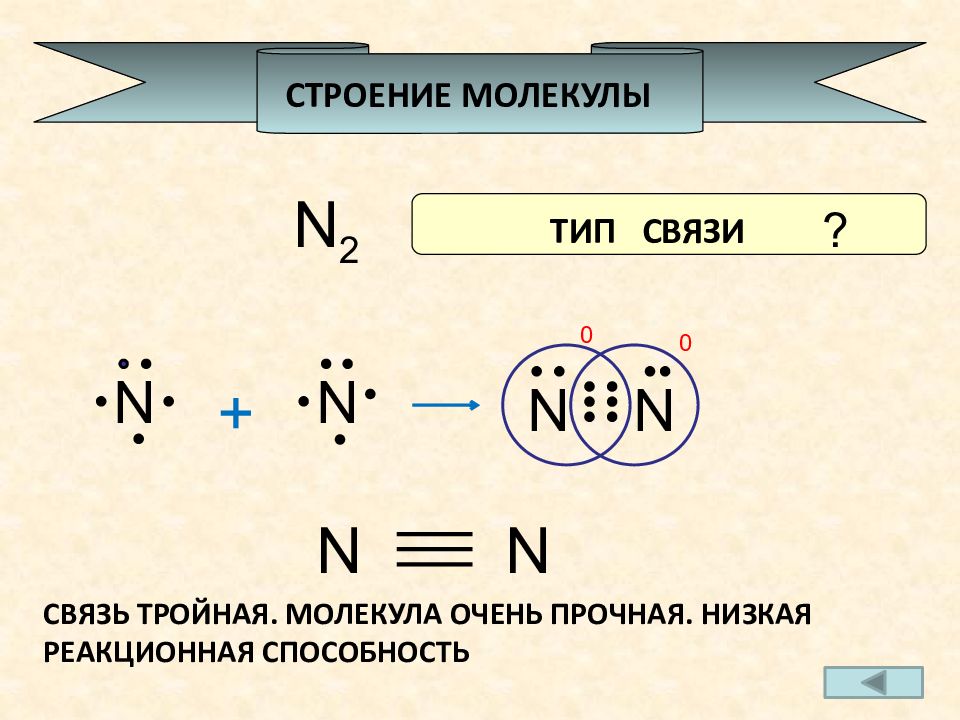
N 2 N + N N N 0 0 СТРОЕНИЕ МОЛЕКУЛЫ N N СВЯЗЬ КВАЛЕНТНАЯ НЕПЛЯРНАЯ ? ТИП СВЯЗИ СВЯЗЬ ТРОЙНАЯ. МОЛЕКУЛА ОЧЕНЬ ПРОЧНАЯ. НИЗКАЯ РЕАКЦИОННАЯ СПОСОБНОСТЬ
Слайд 6
ФИЗИЧЕСКИЕ СВОЙСТВА ПЛОХО РАСТВОРЯЕТСЯ В ВОДЕ (2л N 2 В 100 л ВОДЫ) Т кип = -195,8 0 С Т пл = -210 0 С = 1,25 г/мл ЦВЕТ ЗАПАХ ВКУС ЯДОВИТОСТЬ Mr(N 2 ) < Mr( воздух) ?
Слайд 7: Химические свойства азота
При обычных условиях азот малоактивен. Это объясняется прочностью химических связей в его молекуле. При высоких температурах связи ослабевают и азот становится реакционноспособным. Из металлов азот реагирует в обычных условиях только с литием, образуя нитрид лития: 6 Li + N 2 → 2 Li 3 N + 39кДж
Слайд 8: Химические свойства азота
С другими металлами он реагирует лишь при высоких температурах, образуя нитриды: 3Ca + N 2 → Ca 3 N 2 (нитрид кальция) 2Al + N 2 → 2AlN (нитрид алюминия)
Слайд 9: Химические свойства азота
С кислородом азот взаимодействует только в электрической дуге (3000-4000° С) (например, при грозовом разряде в атмосфере) или при очень сильном нагревании: N 2 + O 2 ↔ 2NO↑ - Q
Слайд 10: Химические свойства азота
При определенных условиях азот реагирует с водородом (температура 300° С, давление 20-30 МПа, катализатор пористое железо): N 2 + Н 2 ↔ 2N Н 3 ↑ + Q (аммиак)
Слайд 11: Получение азота
В лабораториях азот можно получать по реакции разложения нитрита аммония: t NH 4 NO 2 → N 2 ↑ + 2H 2 O В промышленности азот получают выделение из сжиженного воздуха
Слайд 12: НАХОЖДЕНИЕ В ПРИРОДЕ
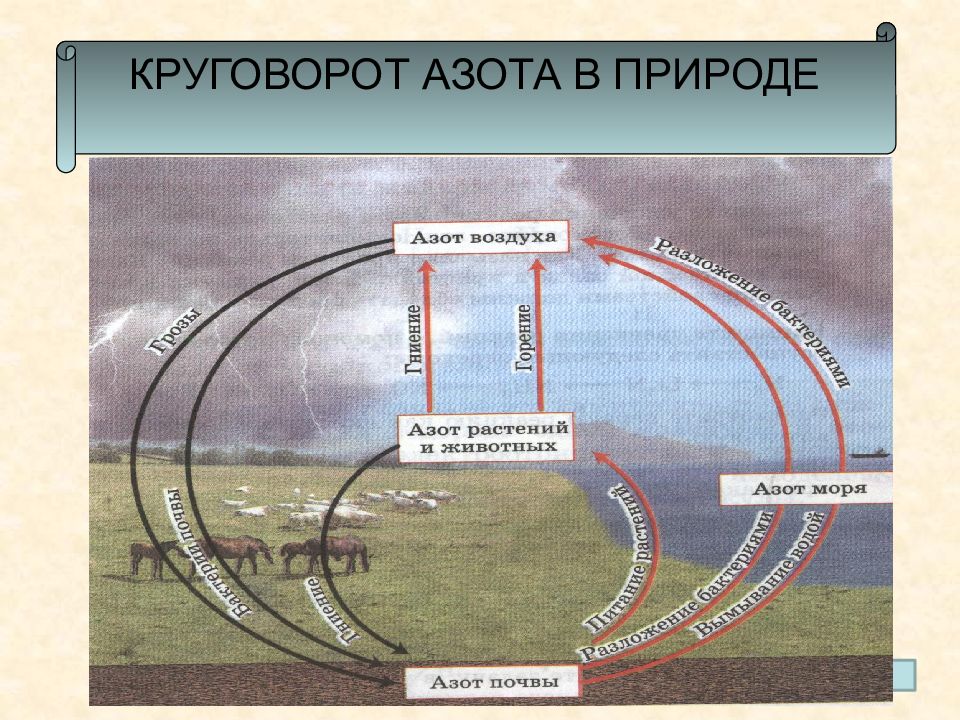
В атмосфере – 78,084% (по объему) и 75,6% (по массе). В литосфере – 0,04% (по массе). В живых организмах - 0,3% (по массе). Занимает V место по распространенности во Вселенной. Среди природных минералов наиболее известны селитры: чилийская NaNO 3 индийская KNO 3 норвежская Са( NO 3 ) 2
Слайд 14
БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЖИЗНЬ с н о N Четыре элемента, Воедино сливаясь, Жизнь дают И строят мир. (Шиллер) В организме взрослого человека содержится до 1,8 кг азота. Он входит в состав белков (16-17%), ДНК, РНК. Наряду с фосфором и калием относится к основным элементам, обеспечивающим рост и развитие растений. « Азот более драгоценен с общебиологической точки зрения, чем самые редкие из благородных металлов» (В.Л. Омелянский)
Слайд 15
БОЛЕЗНЬ ГЛУБИНЫ На глубине несколько десятков метров водолазы начи-нают испытывать нечто похожее на легкое опьянение. Во рту ощущается металлический привкус сжатого азота, обуревает беспричинное веселье. Это азотный наркоз, состояние, часто называемое «болезнью глубины». Нуж-но большое самообладание, чтобы не потерять самокон-троль, не ринуться в глубину без оглядки. Причина здесь такова: давление увеличивает концентрацию азота, растворенного в крови, в жировых и белковых тканях организма. При медленном подъеме избыток растворен-ного азота удаляется. Очень важно, чтобы он ушел из организма через легкие. Но если подъем происходит в кровь в виде пузырьков, не успевая дойти до легких. Эти пузырьки закупоривают капилляры. Тогда организму угрожают сильные боли и даже смерть. Аналогичные процессы происходят и в организме летчиков при быстром подъеме самолета в верхние слои атмосферы. быстро, азот выделяется
Слайд 16: ПРИМЕНЕНИЕ
Производство аммиака, минеральных удобрений В хранилищах музеев В бензохранилищах В медицине, химических лабораториях. В электролампах Соединения азота - в производстве взрывчатых веществ.
Слайд 17
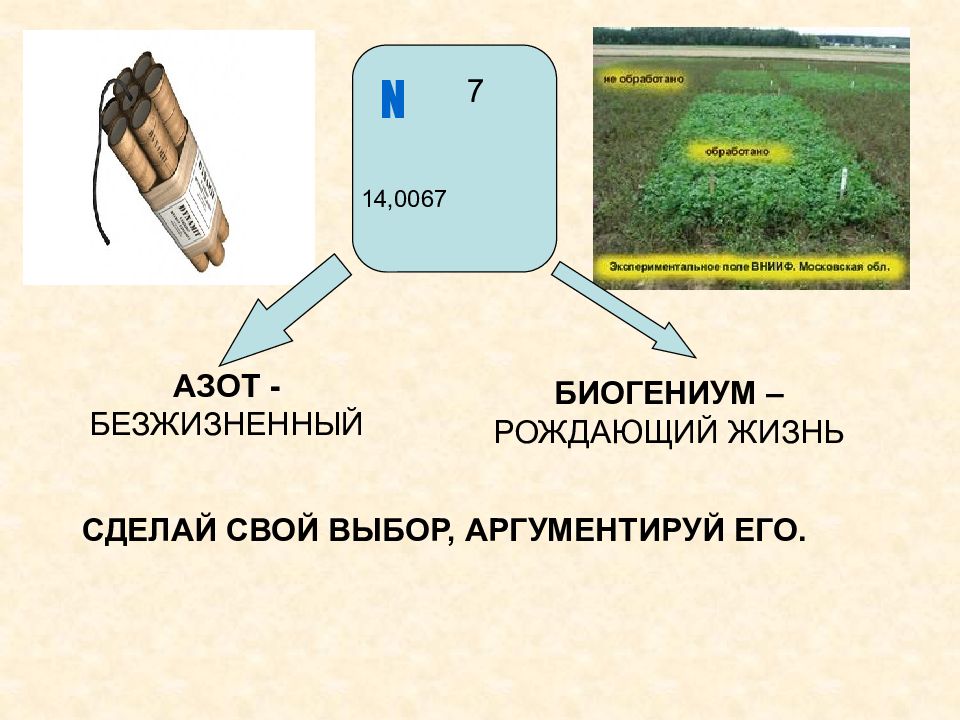
N 7 14,0067 АЗОТ - БЕЗЖИЗНЕННЫЙ БИОГЕНИУМ – РОЖДАЮЩИЙ ЖИЗНЬ СДЕЛАЙ СВОЙ ВЫБОР, АРГУМЕНТИРУЙ ЕГО.
Слайд 18: Оксиды азота
Оксид азота ( I ) Оксид азота ( II ) Оксид азота ( III ) Оксид азота ( IV ) Оксид азота ( V ) Составьте молекулярные формулы данных оксидов
Слайд 19
Виды оксидов азота N 2 O NO N 2 O 3 NO 2 N 2 O 5 +1 +2 +3 +4 +5 N 2 O – оксид азота( I ) NO – оксид азота( II) Несолеобразующие оксиды, т.к. не взаимодействуют при обычных условиях с кислотами и щелочами с образованием солей. N 2 O 3 – оксид азота( III) - азотистый ангидрид NO 2 – ок c ид азота( IV) и его димер N 2 O 4 – ангидриды азотной и азотистой кислот. N 2 O 5 – азотный ангидрид Кислотные оксиды
Слайд 20
Оксид азота( II) - NO Физические свойства. Бесцветный газ, при низких температурах - голубая жидкость. В твердом состоянии -димеризован ( N 2 O 2 ). Не растворим в воде. t 0 ( плав) = -164 0 С, t 0 (кип) = - 151,7 0 С. Получение. 1. При реакции неактивных металлов с разбавленной азотной кислотой: 3Cu + 8HNO 3 = 3Cu(NO 3 ) 2 + 2NO + 4H 2 O 2. При каталитическом окислении аммиака: 4 NH 3 + 5O 2 = 4NO + 6H 2 O 3. При взаимодействии с кислородом воздуха: N 2 + O 2 = 2NO (t 0 ≥ 2000 0 C, кат. Pt/Rh) 4. При взаимодействии нитритов с серной кислотой: 2 NaNO 2 + H 2 SO 4 = Na 2 SO 4 + NO + NO 2 + H 2 O
Слайд 21
Химические свойства. Очень реакционноспособное вещество. Может проявлять и окислительные и восстановительные свойства. 1. При обычной температуре окисляется кислородом воздуха: 2 NO + O 2 = 2NO 2 2. Восстановитель: NO + NO 2 = N 2 O 3 2 NO + Cl 2 = 2 NOCl ( нитрозилхлорид) 3. Окислитель: 2NO + 2SO 2 = 2SO 3 + N 2 2NO + 2 Н 2 = N 2 + 2Н 2 О (200 0 С) 2NO + 2Cu = N 2 + 2 CuO ( 5 00 0 С) 2NO + 2H 2 S = N 2 + 2 S + 2Н 2 О ( 3 00 0 С) 4. Взаимодействует с органическими веществами. Применение. В производстве азотной кислоты.
Слайд 22
Оксид азота( IV) - NO 2 и его димер N 2 O 4 Физические свойства. Это красно-бурый газ с резким запахом. При низких температурах из-за наличия у атомов азота неспаренных электронов димеризуется в N 2 O 4. Димер в жидком состоянии бесцветный, в твердом - белый. t ( пл ) = -11,2 0 С. Хорошо растворяется в холодной воде. Насыщенный раствор имеет ярко-зеленый цвет. Получение. Термическим разложением нитратов металлов, расположенных в ряду активности в интервале Al -С u : 2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2 Взаимодействием меди с концентрированной азотной кислотой : Cu + 4HNO 3 = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O Окислением оксида азота( II): 2NO + O 2 = 2NO 2
Последний слайд презентации: УРОК ПО ТЕМЕ «АЗОТ, СТРОЕНИЕ, СВОЙСТВА. ОКСИДЫ АЗОТА» «Жизнь учит только тех,
Химические свойства. Взаимодействие с водой: 2NO 2 + H 2 O ( хол ) = HNO 3 + HNO 2 3 NO 2 + H 2 O (гор) = 2 HNO 3 + NO Взаимодействие с растворами щелочей: 2NO 2 + 2КОН = К NO 3 + К NO 2 + Н 2 О При растворении в воде в присутствии кислорода: 4 NO 2 + 2 H 2 O + О 2 = 4 HNO 3 Используется в промышленном способе получения азотной кислоты. Хороший окислитель: NO 2 + SO 2 = SO 3 + NO 2NO 2 + 4Cu = 4CuO + N 2 (500-600 0 C)