Слайд 23: Получение азота
Окисление аммиака: 4NH 3 + 3 O 2 → 2 N 2 + 6H 2 O (при нагревании) Реакции внутримолекулярного окисления-восстановления азота: 2N 2 O → 2 N 2 + O 2 (при нагревании) 2NaN 3 → 3 N 2 + 2Na (при нагревании) Восстановление азотной кислоты: 5 Mg + 12HNO 3 ( разб.) → N 2 + 5Mg(NO 3 ) 2 + 6H 2 O
Слайд 35: Получение азида водорода
2NaNH 2 + N 2 O → NaN 3 + NaOH + NH 3 (190 °C ) NaN 3 + H 2 SO 4 → HN 3 + NaHSO 4
Слайд 38: Химические Свойства азида водорода
4 H 2 + HN 3 → 3NH 3 HN 3 + 2HCl → 2Cl + N 2 + NH 3 10HN 3 + 2KMnO 4 + 3H 2 SO 4 → 15N 2 + 2MnSO 4 + K 2 SO 4 + 8H 2 O
Слайд 40: Как работают подушки безопасности?
Азид натрия — неорганическое вещество с формулой NaN 3. Эта бесцветная соль азотистоводородной кислоты является газообразующим компонентом во многих системах подушек безопасности. При аварии с сильным ударом срабатывает датчик ускорения, сигнал этого датчика поджигает газообразующую смесь на основе азида натрия, при этом происходит реакция большим выделением газообразного горячего азота: 2 NaN 3 → 2Na + 3N 2 ↑ Такая же реакция происходит при нагревании соли до 250—300 °C. Образующийся в качестве побочного вещества натрий сам по себе также опасен и потому в автомобильных подушках безопасности нейтрализуется такими веществами, как нитрат калия или соединениями кремния.
Слайд 46: Получение аммиака
Действие воды на нитриды активных металлов: AlN + 3H 2 O → Al(OH) 3 + NH 3
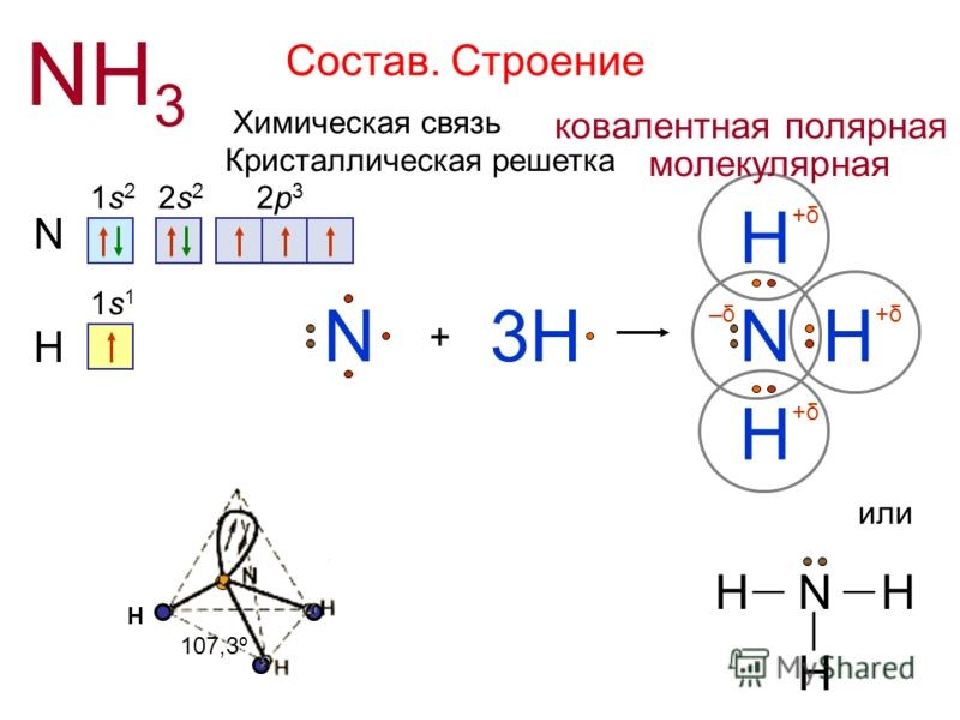
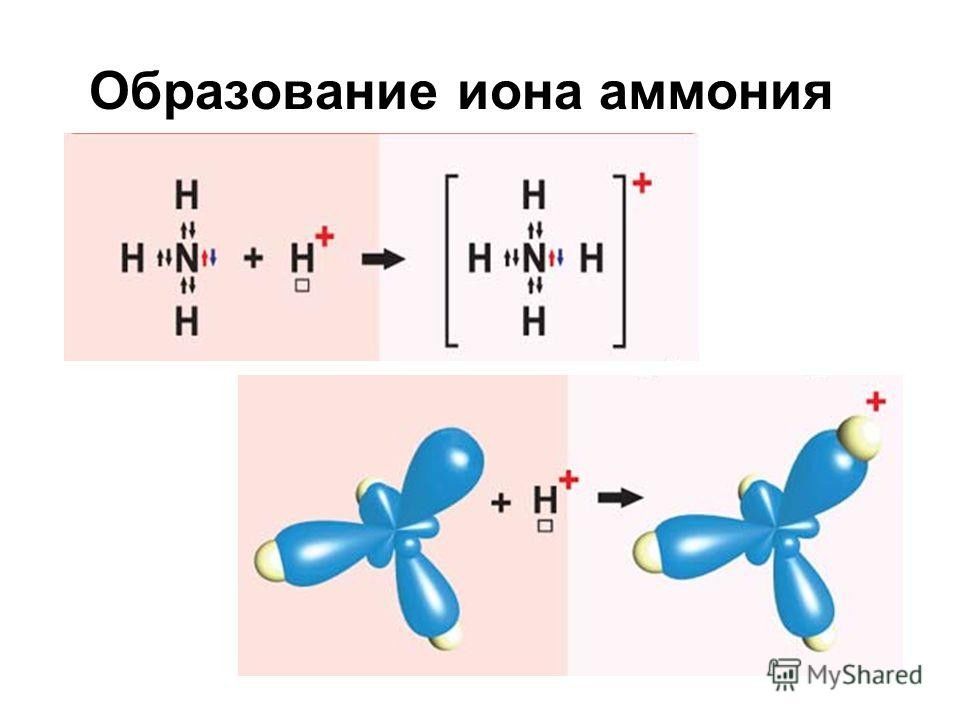
Слайд 57: Химические свойства аммиака
3NH 3 + 4KClO 3 + 3NaOH → 3NaNO 3 + 4KCl + 6H 2 O (300 °С) 4NH 3 + 3F 2 → NF 3 + 3NH 4 F
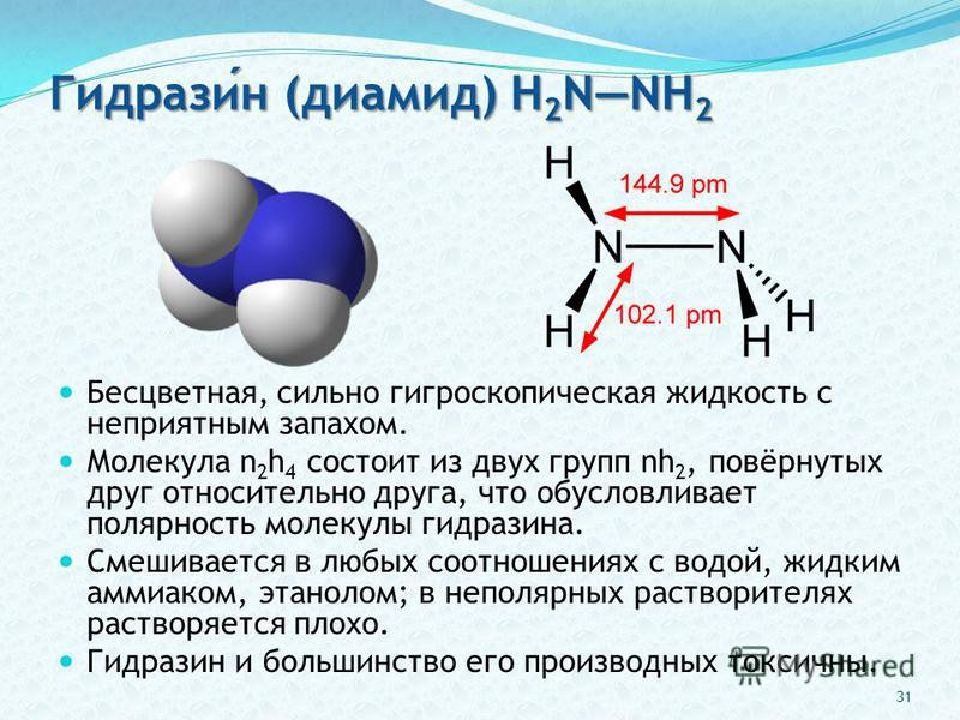
Слайд 82: Химические свойства гидразина
Восстановление: N 2 H 4 + Zn + 4HCl → ZnCl 2 + 2NH 4 Cl Диспропорционирование : 3N 2 H 4 → N 2 + 4NH 3 (при нагревании) Основные: N 2 H 4 + HCl → [N 2 H 5 ] Cl N 2 H 4 + 2HCl → [ N 2 H 6 ]Cl 2
Слайд 89: Тривиальные названия
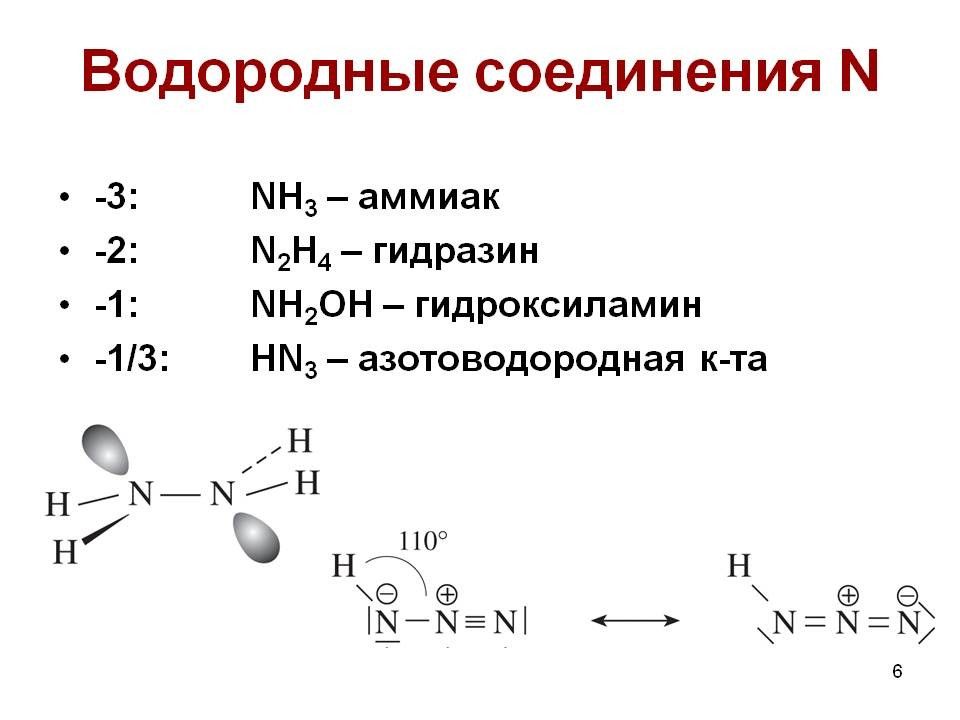
NH 4 Cl – нашатырь Нашатырный спирт, аммиачная вода – раствор NH 3 в воде HN 3 – азидоводород N 2 H 2 – гидразин NH 2 OH - гидроксиламин