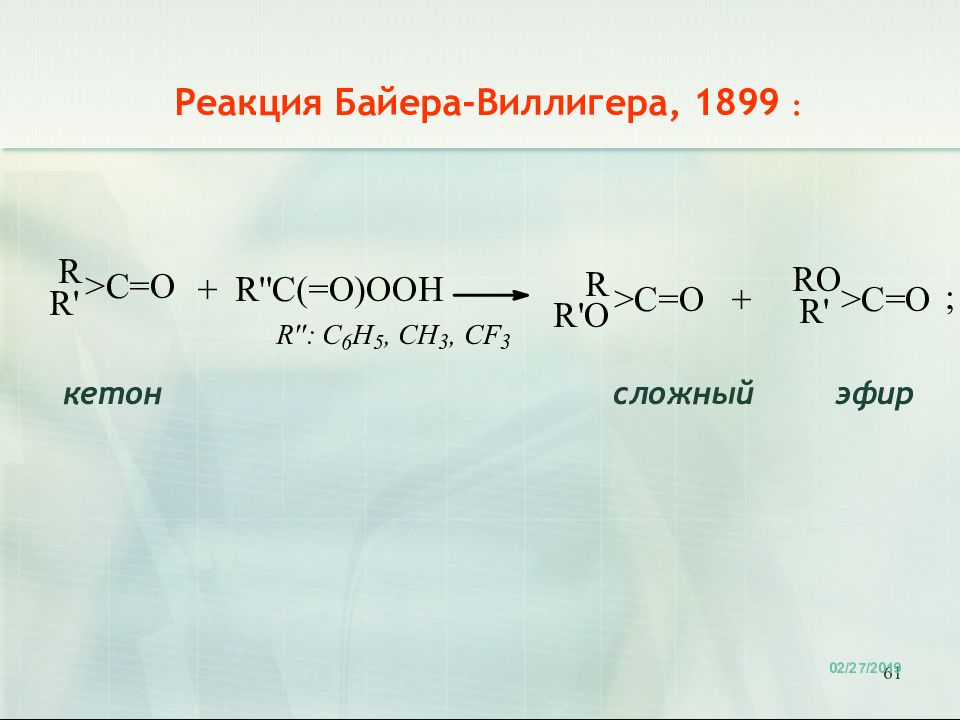
Первый слайд презентации: 10. ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНИЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ
1 № 10. ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНИЛСОДЕРЖАЩИХ СОЕДИНЕНИЙ
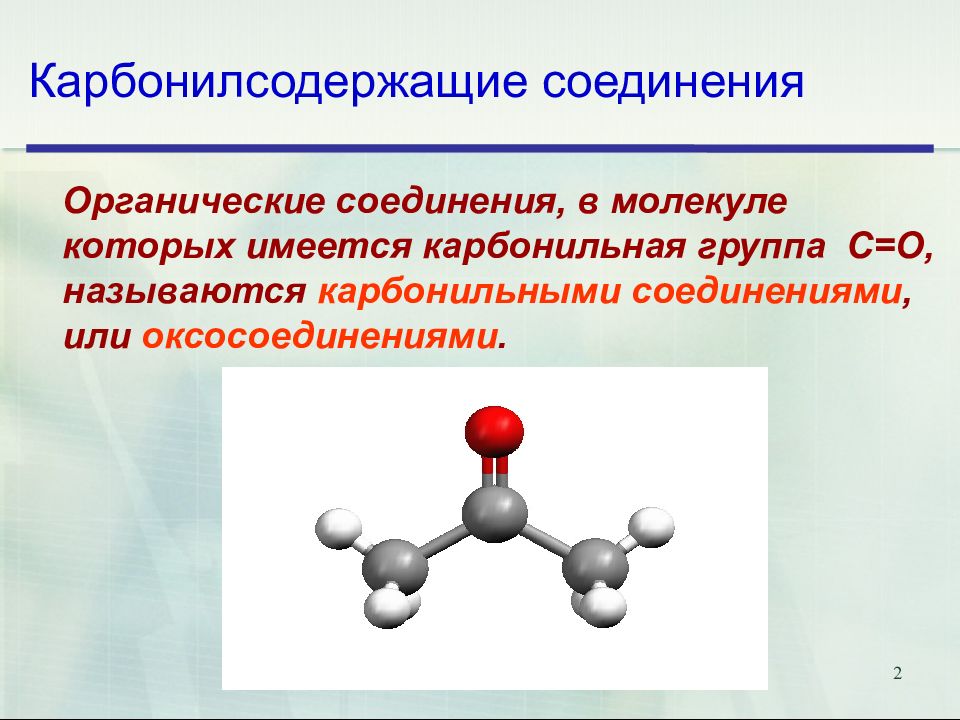
Слайд 2: Карбонилсодержащие соединения
2 Карбонилсодержащие соединения Органические соединения, в молекуле которых имеется карбонильная группа С= O, называются карбонильными соединениями, или оксосоединениями.
Слайд 3: Альдегиды содержат в молекуле карбонильную группу, обязательно связанную с атомом водорода, т. е. альдегидную группу – СН= O
3 Альдегиды содержат в молекуле карбонильную группу, обязательно связанную с атомом водорода, т. е. альдегидную группу – СН= O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу.
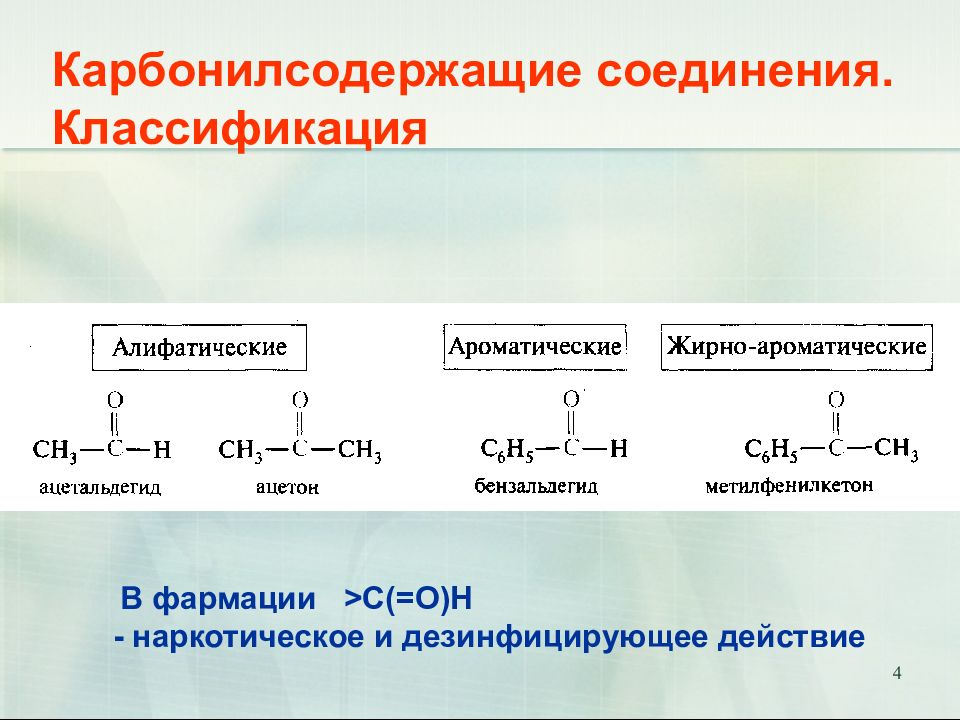
Слайд 4: Карбонилсодержащие соединения. Классификация
4 Карбонилсодержащие соединения. Классификация В фармации >С(=О)Н - наркотическое и дезинфицирующее действие
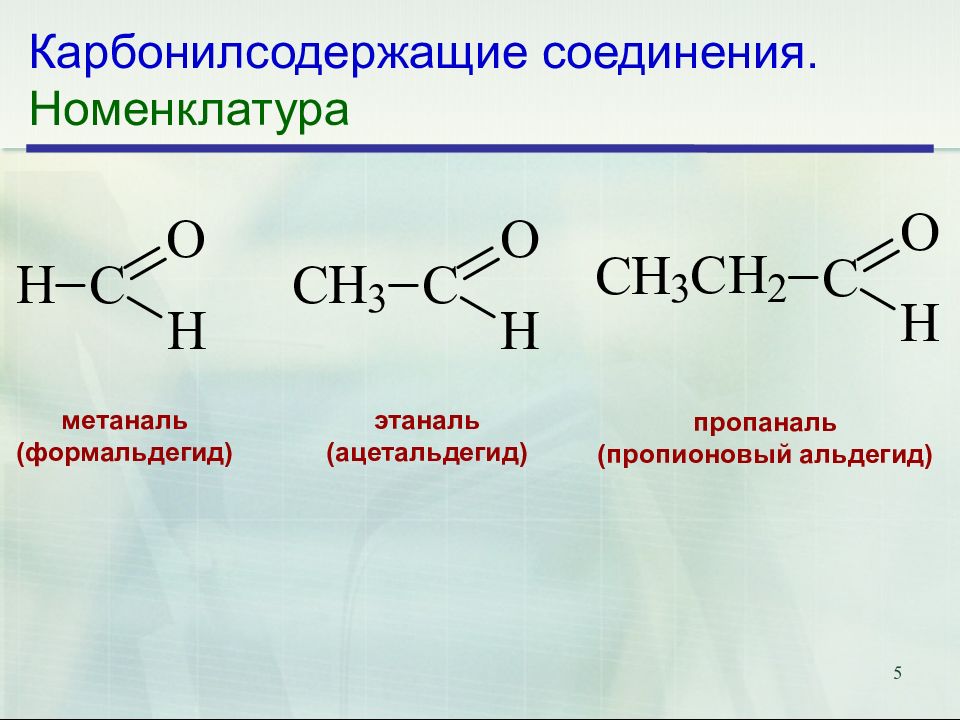
Слайд 5: Карбонилсодержащие соединения. Номенклатура
5 Карбонилсодержащие соединения. Номенклатура метаналь (формальдегид) этаналь (ацетальдегид) пропаналь (пропионовый альдегид)
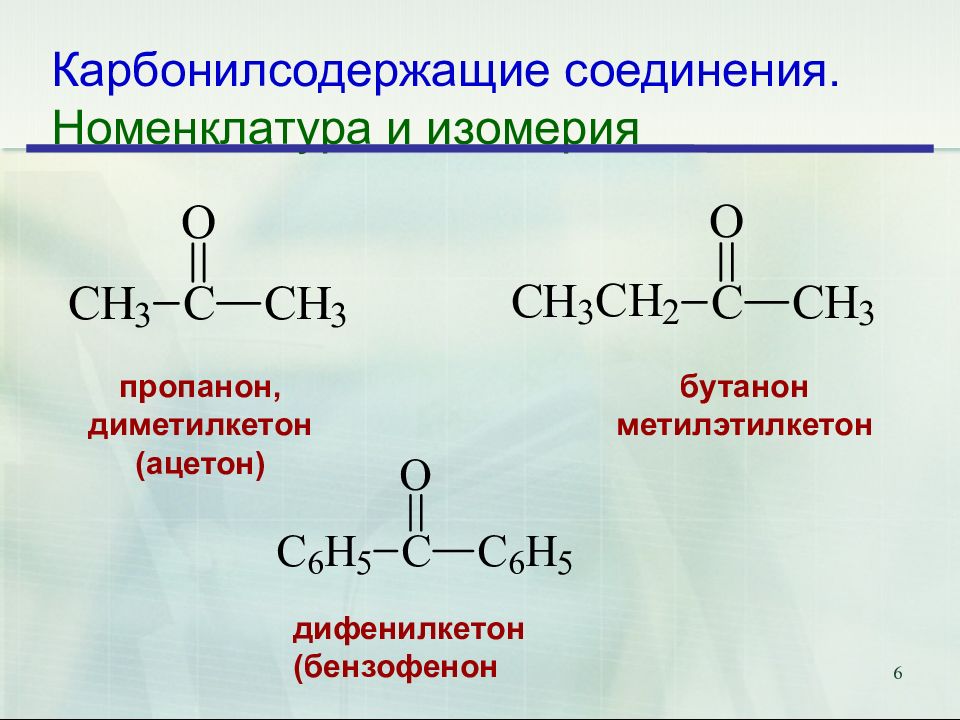
Слайд 6: Карбонилсодержащие соединения. Номенклатура и изомерия
6 Карбонилсодержащие соединения. Номенклатура и изомерия бутанон метилэтилкетон пропанон, диметилкетон (ацетон) дифенилкетон (бензофенон
Слайд 7
7 Формальдегид (метаналь) является газом с резким неприятным запахом. Резкий запах ацетальдегида (этаналя) напоминает запах яблок. По мере удлинения цепи запах альдегидов всё более напоминает запах цветов и фруктов, октаналь, нонаналь и деканаль используются в парфюмерии, и их запах напоминает запах цветов и фруктов. Низшие кетоны являются подвижными жидкостями с освежающим запахом. Некоторые кетоны обладают крайне неприятным запахом 4-гептанон пахнет ананасом и земляникой. ВАНИЛИН
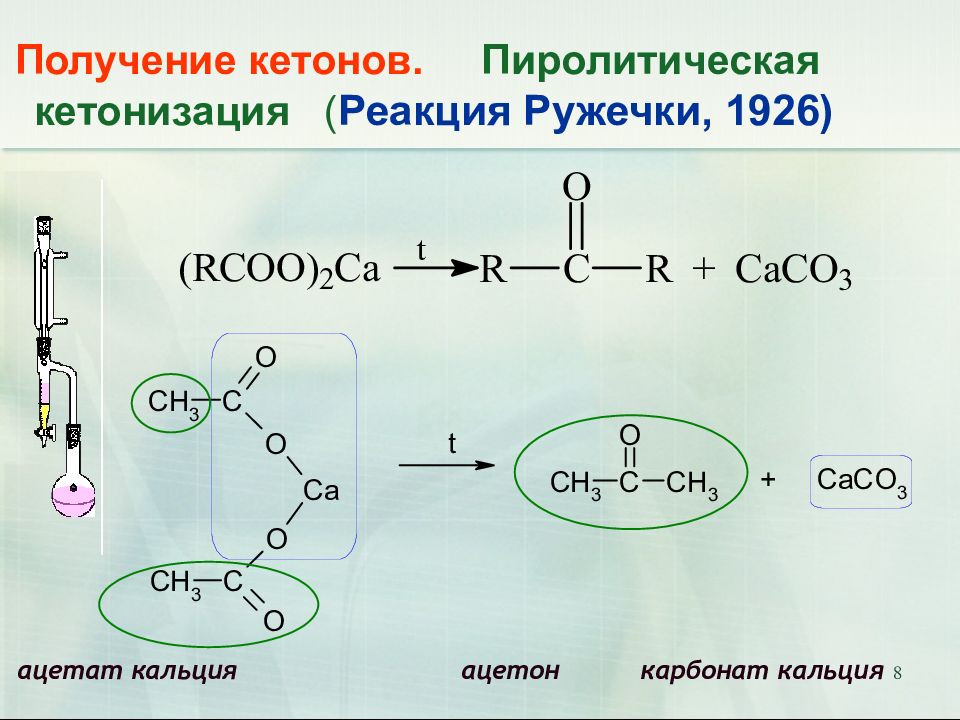
Слайд 8
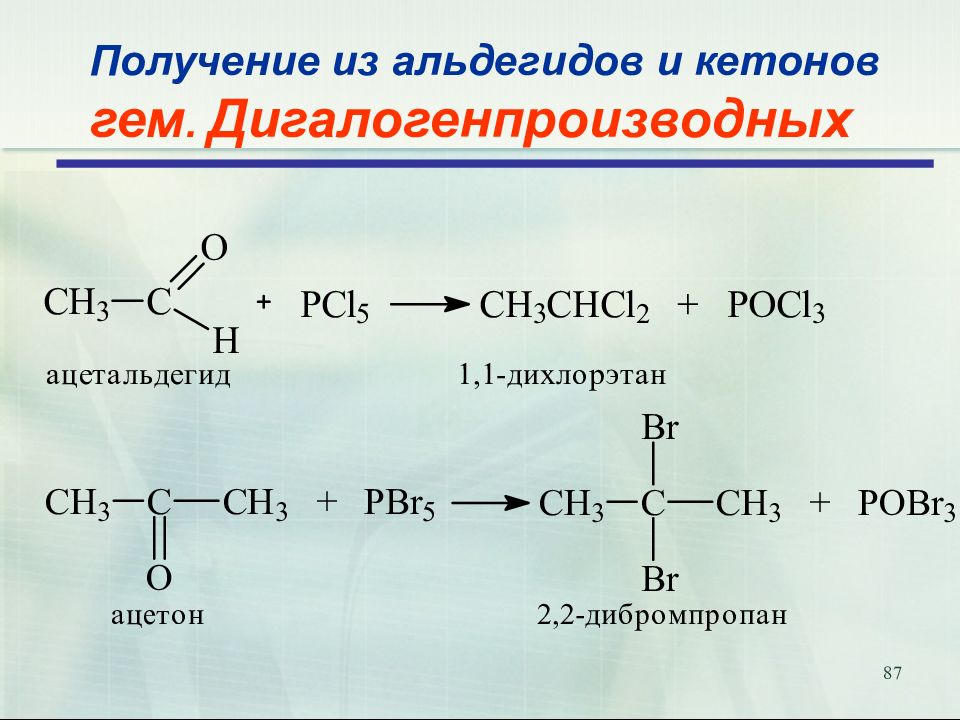
8 Получение кетонов. Пиролитическая кетонизация ( Реакция Ружечки, 1926) ацетат кальция ацетон карбонат кальция
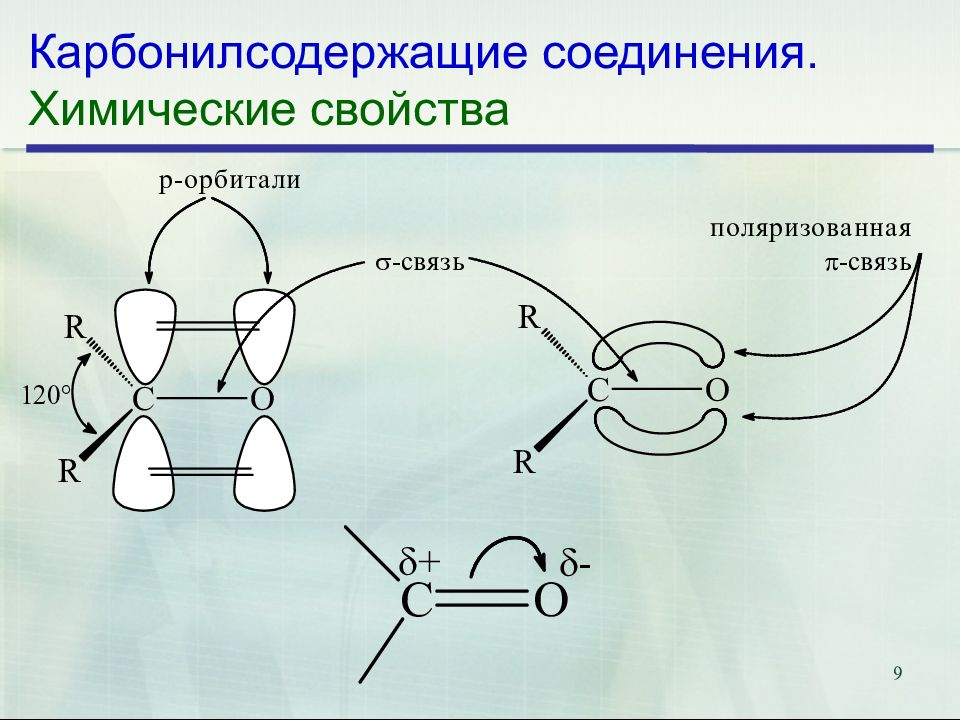
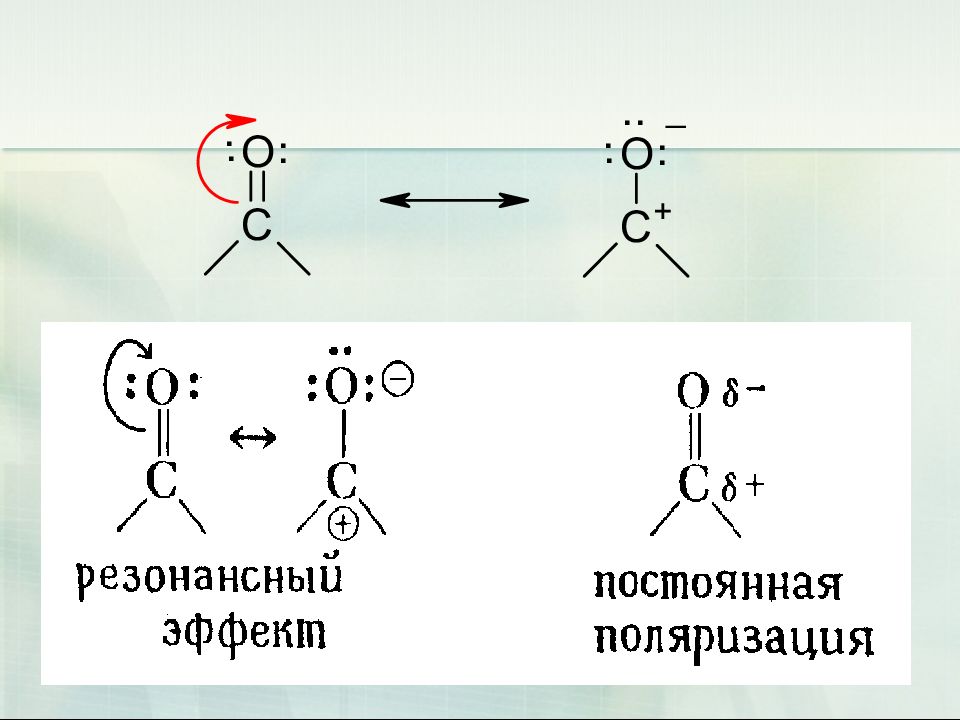
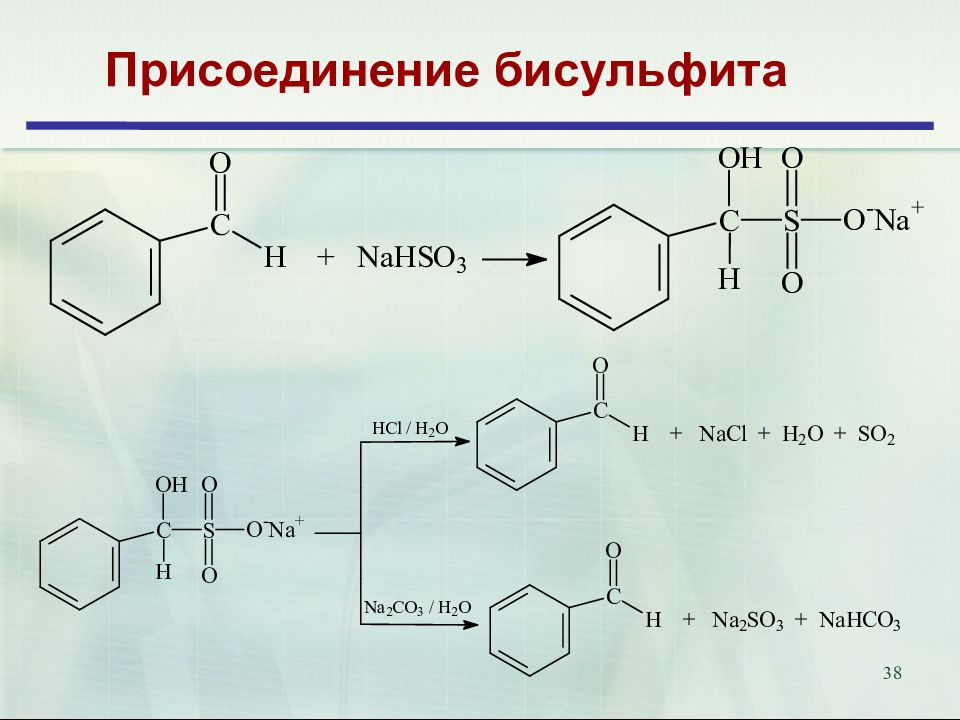
Слайд 9: Карбонилсодержащие соединения. Химические свойства
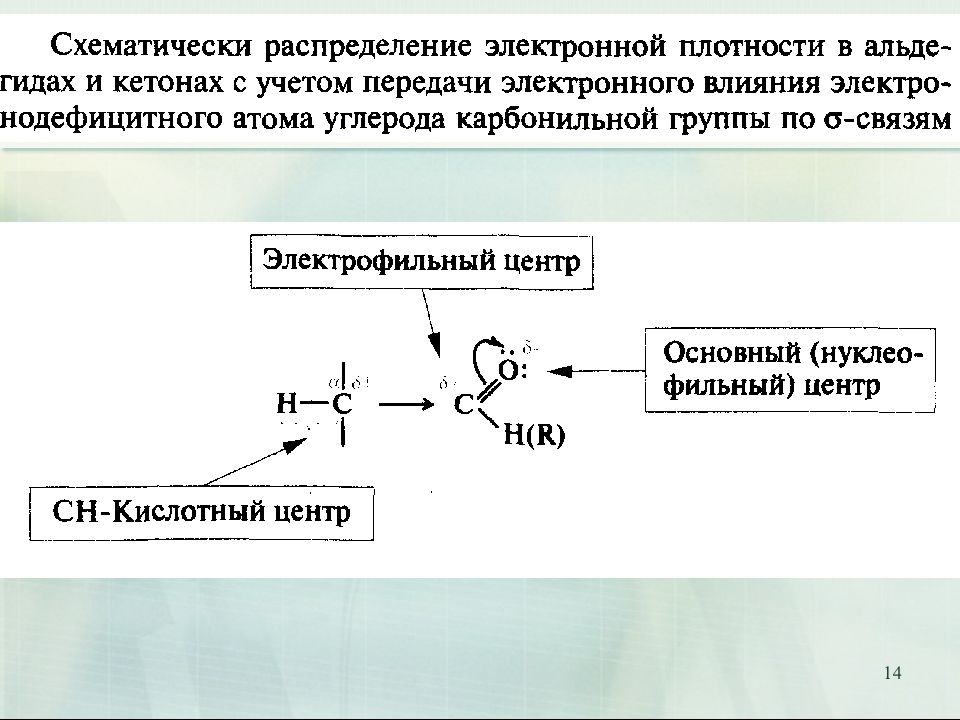
9 Карбонилсодержащие соединения. Химические свойства
Слайд 11: Карбонилсодержащие соединения. Химические свойства
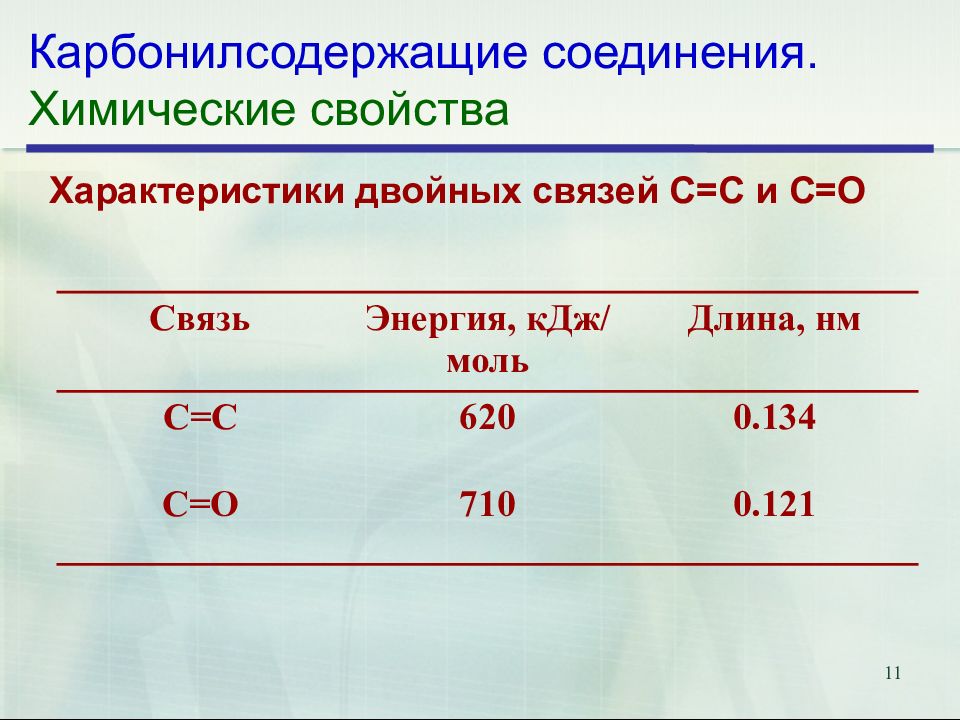
11 Карбонилсодержащие соединения. Химические свойства Характеристики двойных связей С=С и С=О Связь Энергия, кДж / моль Длина, нм С=С 620 0.134 С=О 710 0.121
Слайд 15
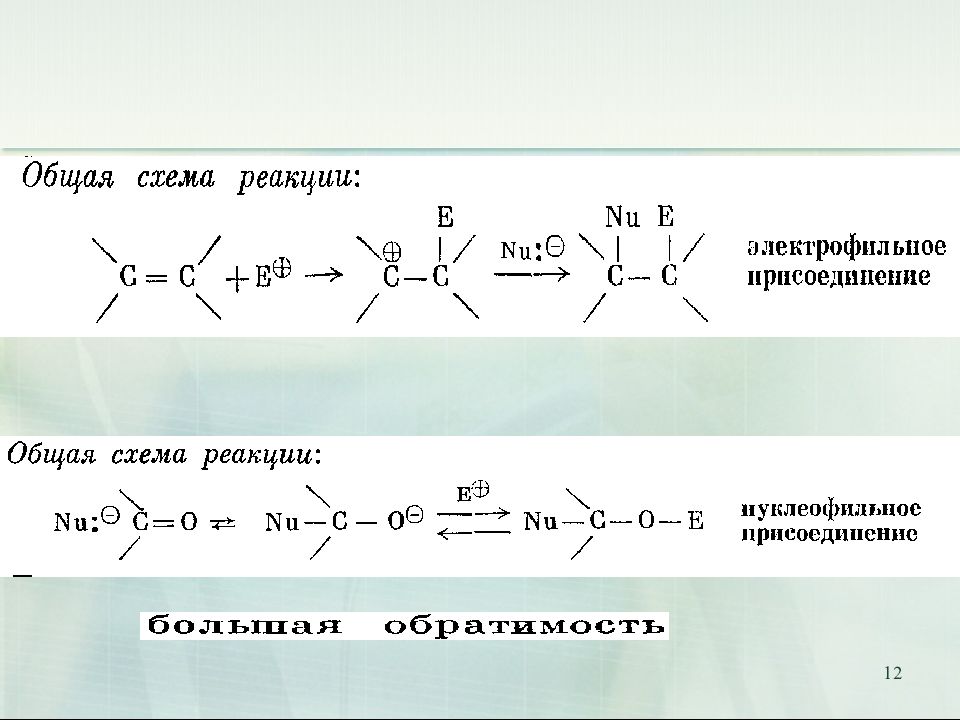
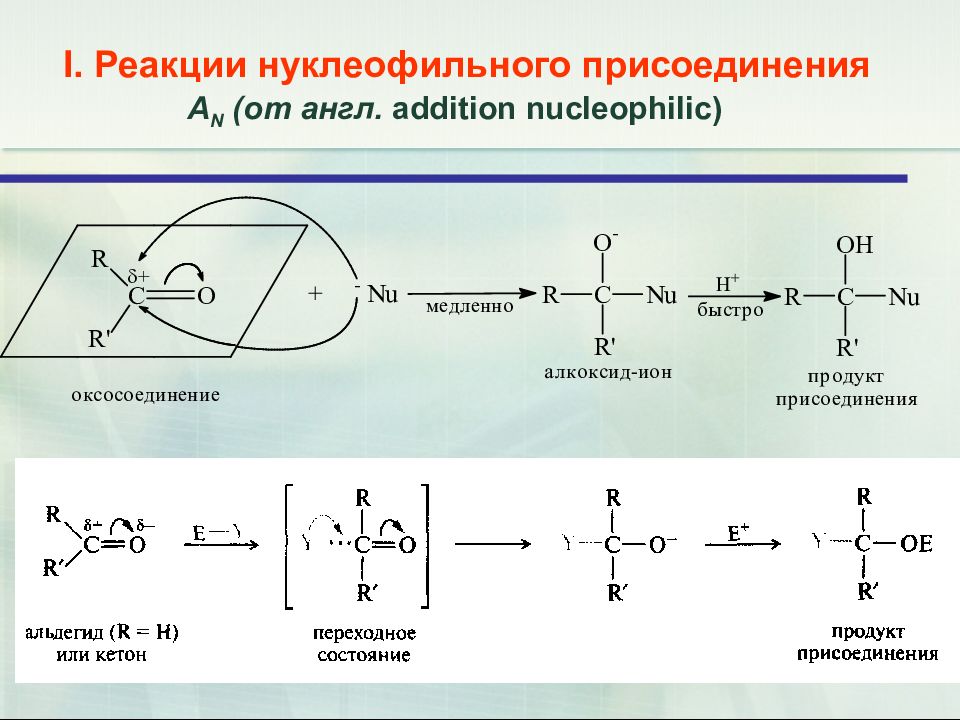
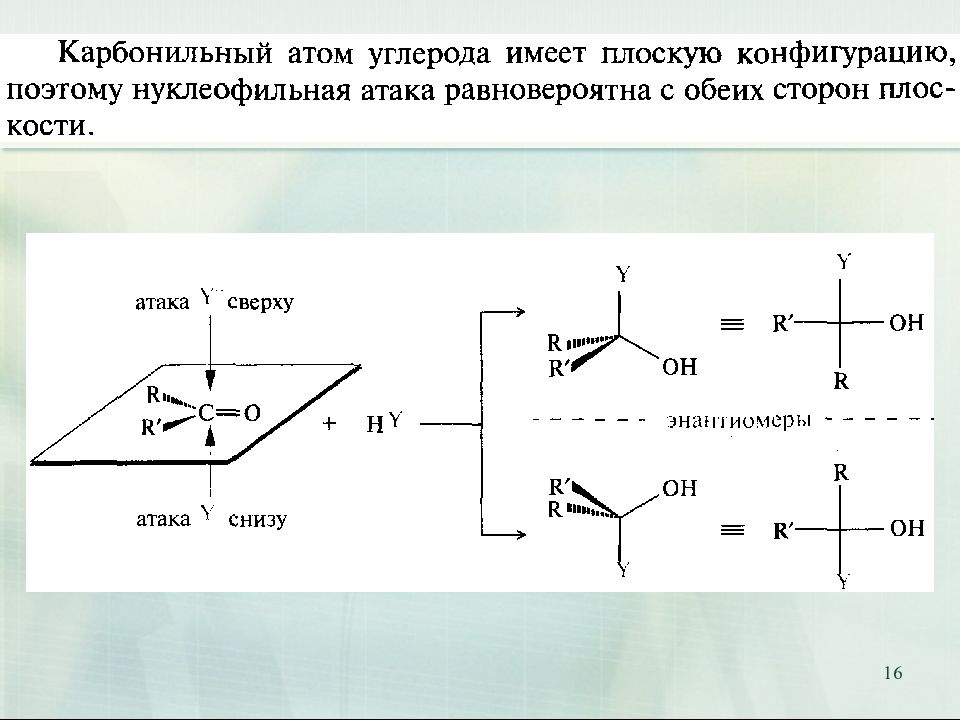
15 I. Реакции нуклеофильного присоединения А N (от англ. addition nucleophilic )
Слайд 17
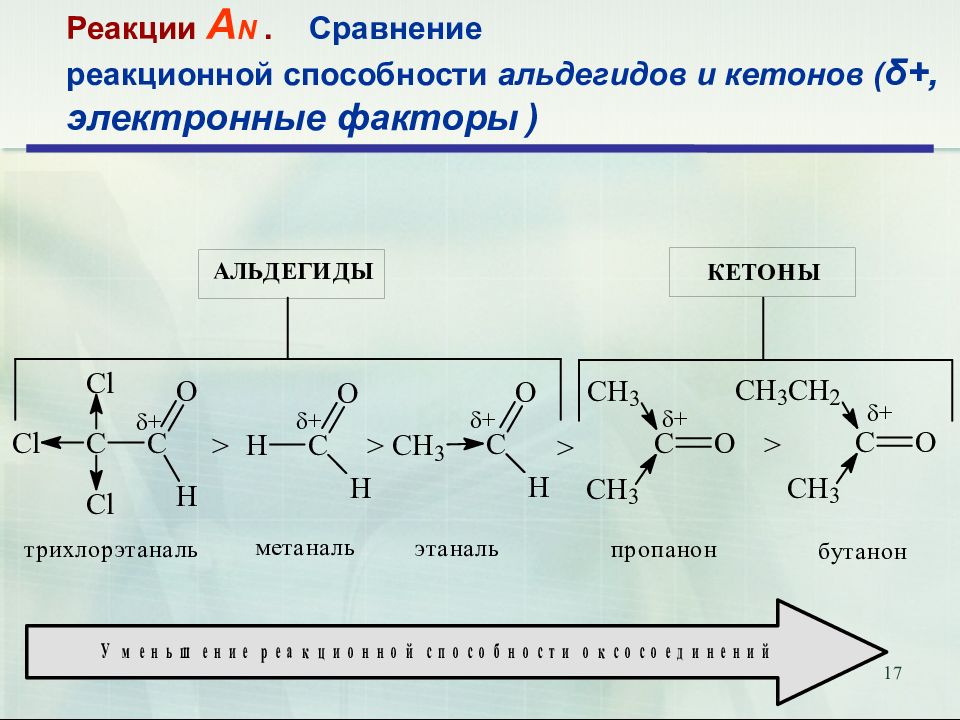
17 Реакции А N. Сравнение реакционной способности альдегидов и кетонов ( δ+, электронные факторы )
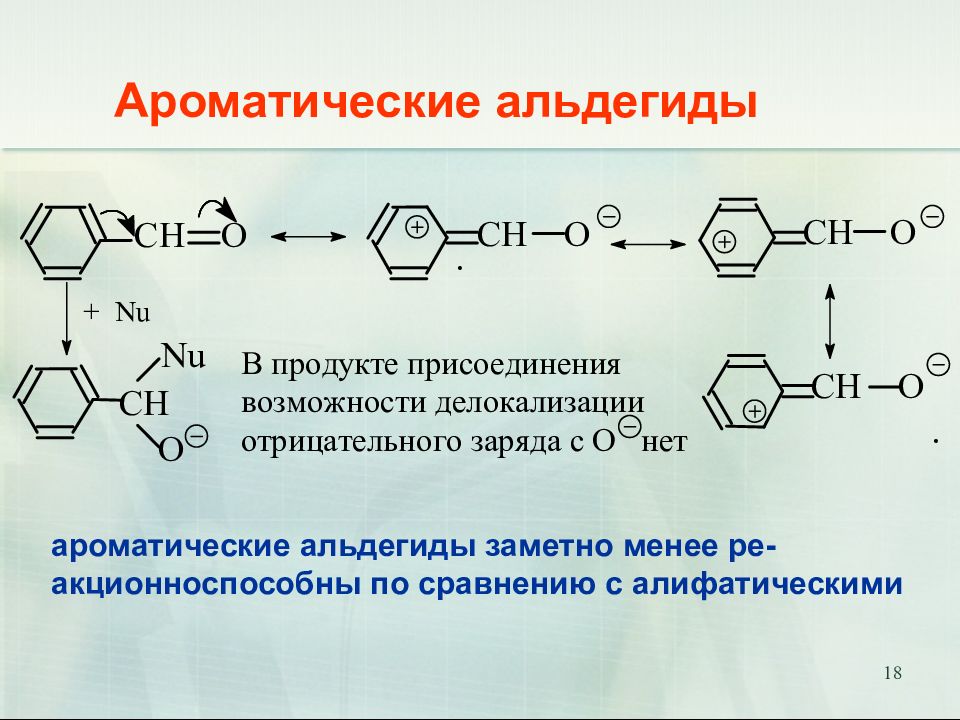
Слайд 18: Ароматические альдегиды
18 Ароматические альдегиды ароматические альдегиды заметно менее ре- акционноспособны по сравнению с алифатическими
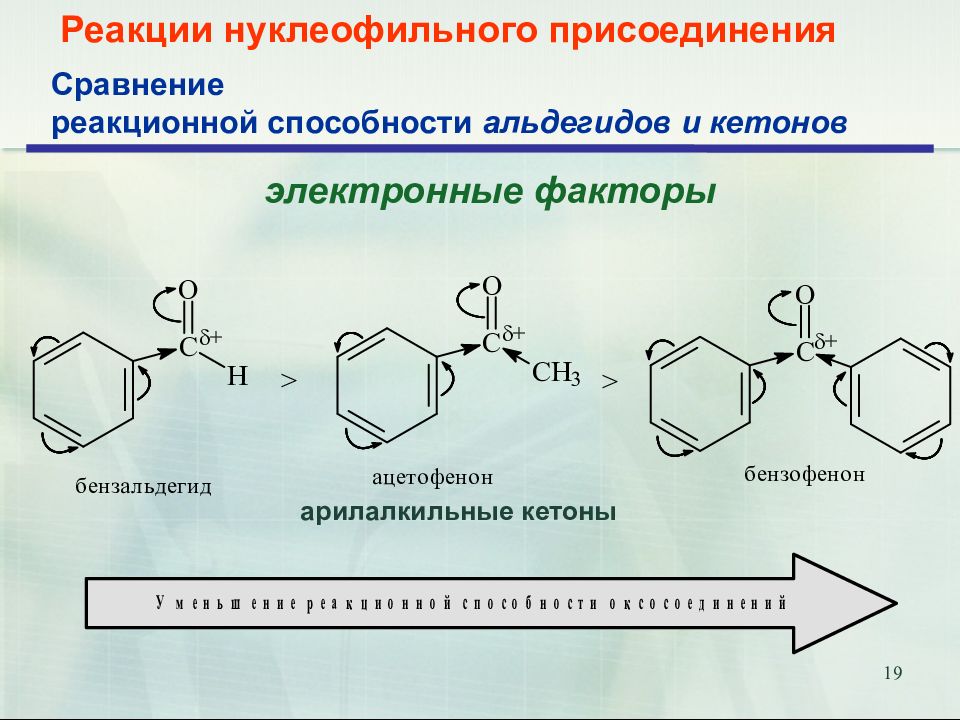
Слайд 19
19 Реакции нуклеофильного присоединения электронные факторы Сравнение реакционной способности альдегидов и кетонов арилалкильные кетоны
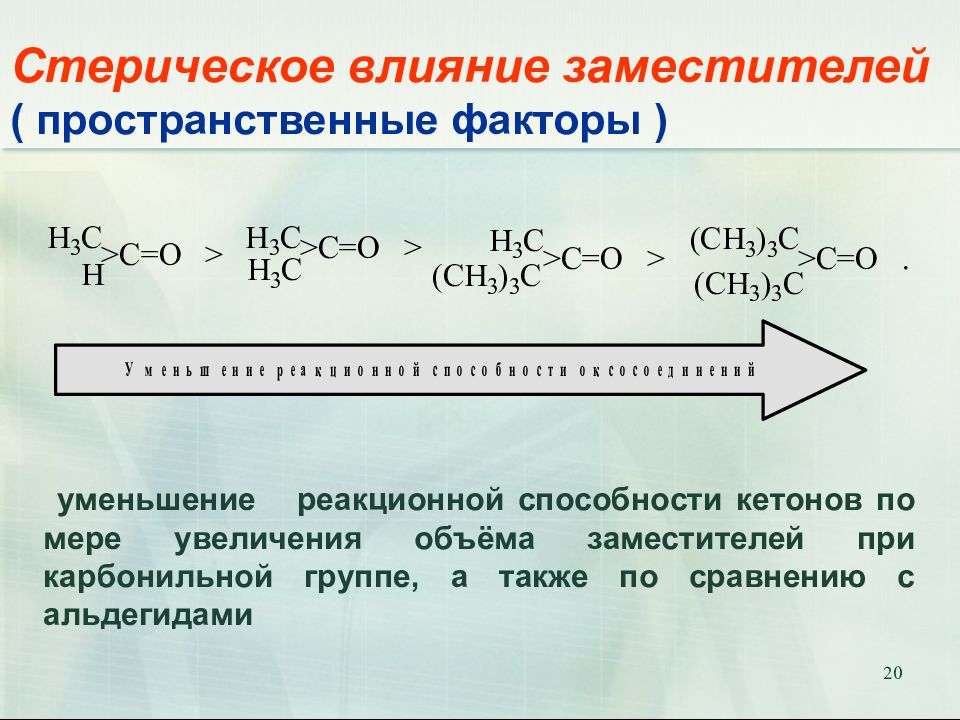
Слайд 20: Стерическое влияние заместителей ( пространственные факторы )
20 Стерическое влияние заместителей ( пространственные факторы ) уменьшение реакционной способности кетонов по мере увеличения объёма заместителей при карбонильной группе, а также по сравнению с альдегидами
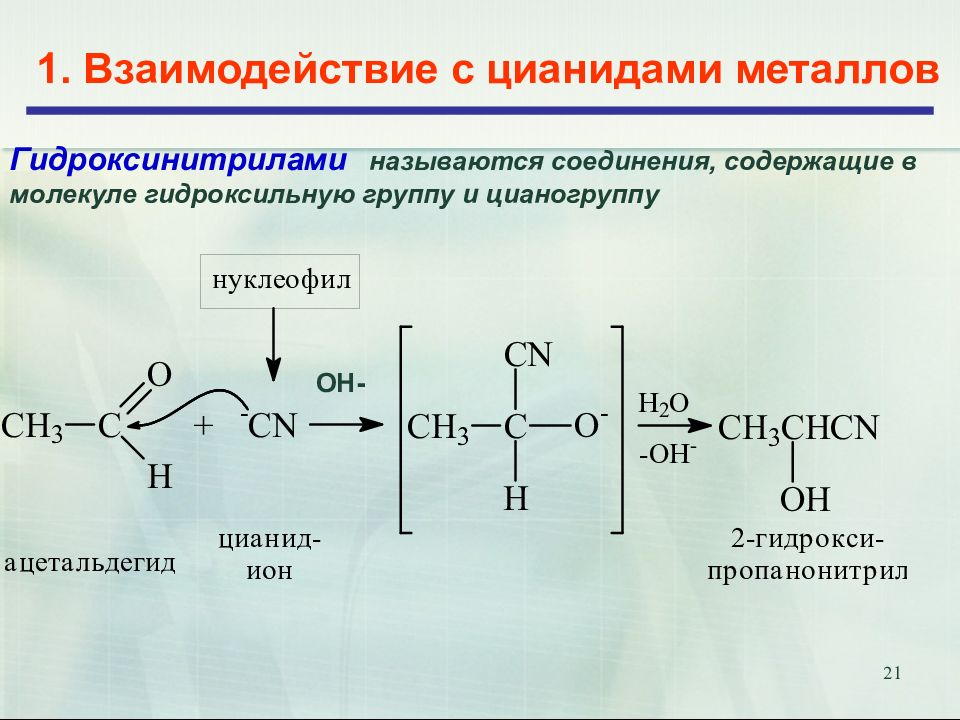
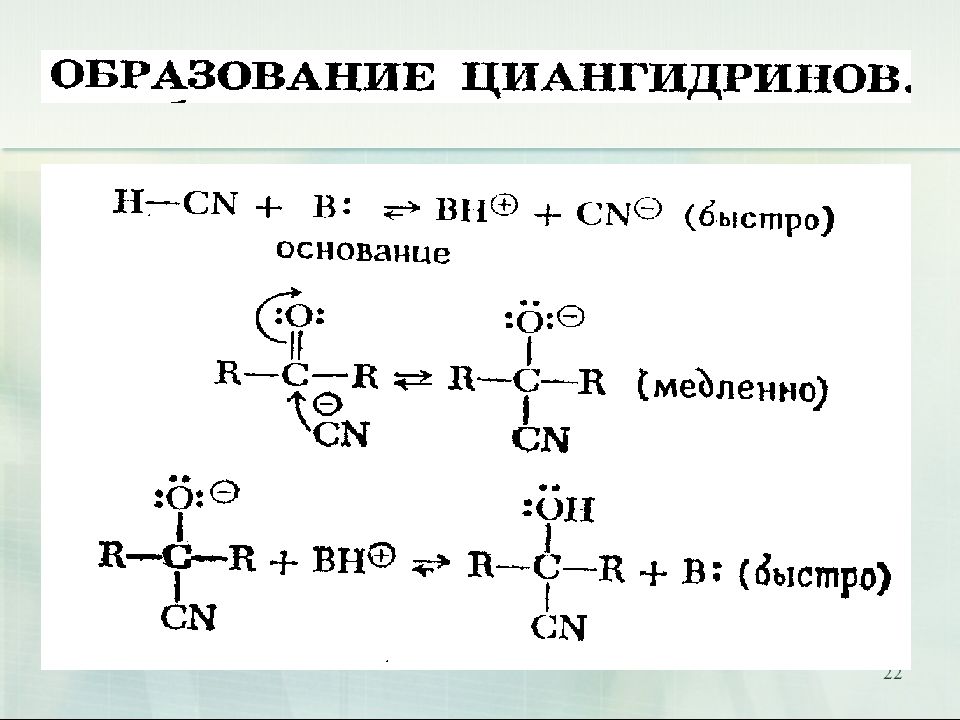
Слайд 21
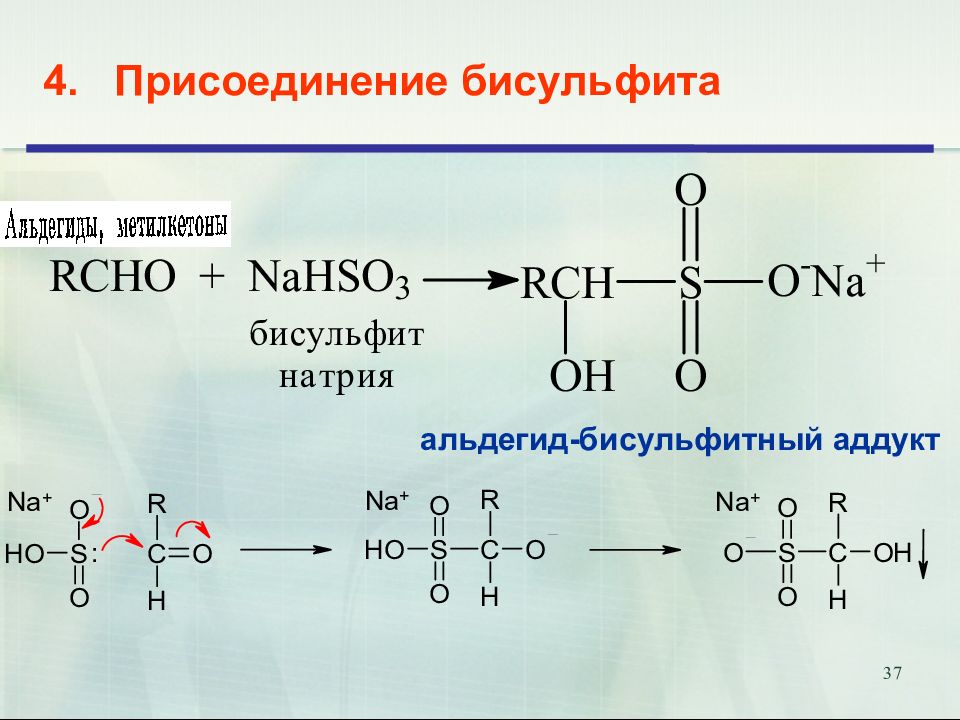
21 1. Взаимодействие с цианидами металлов Гидроксинитрилами называются соединения, содержащие в молекуле гидроксильную группу и цианогруппу ОН-
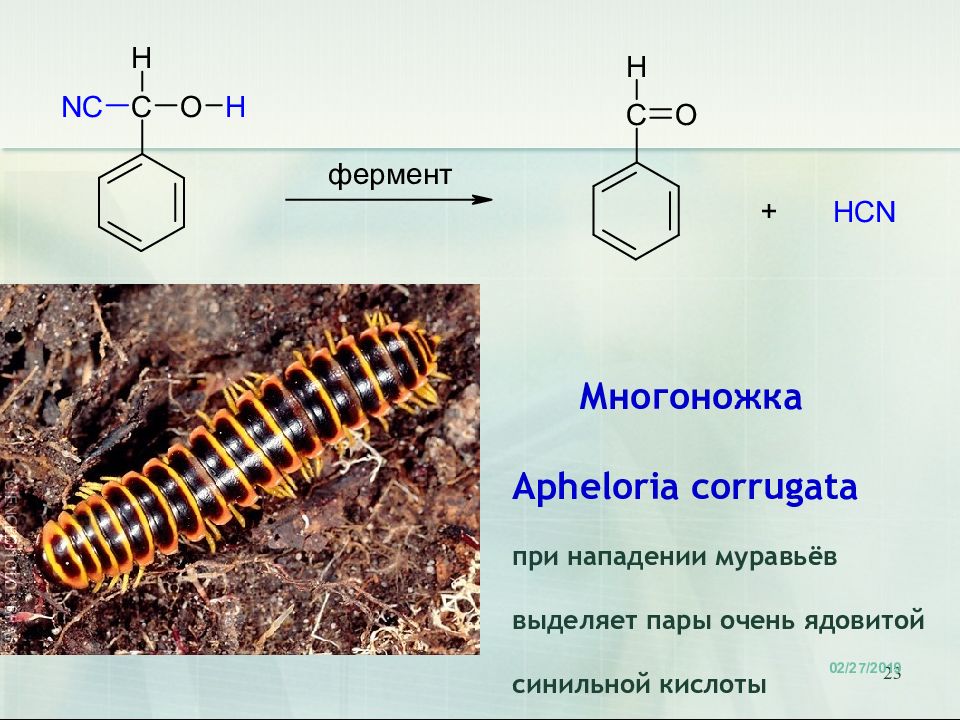
Слайд 23
23 Многоножка Apheloria corrugata при нападении муравьёв выделяет пары очень ядовитой синильной кислоты 18.02.2019
Слайд 25
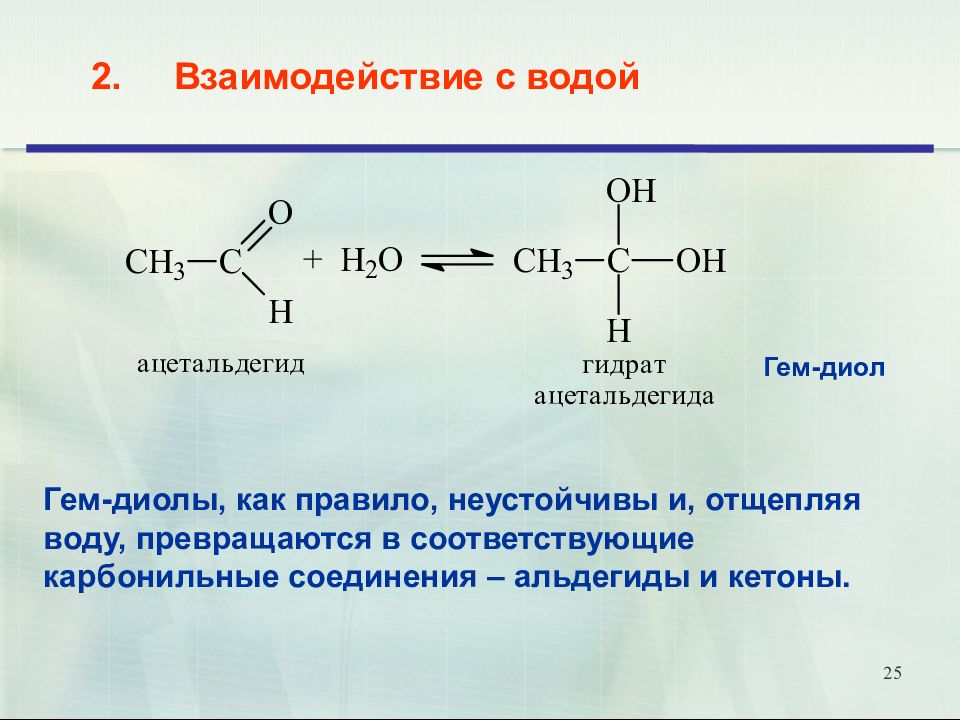
25 2. Взаимодействие с водой Гем-диолы, как правило, неустойчивы и, отщепляя воду, превращаются в соответствующие карбонильные соединения – альдегиды и кетоны. Гем-диол
Слайд 27: Формалин
27 Формалин Применяется в качестве стерилизующего вещества, а также (в патологии) как фиксирующее вещество для хранения биологических препаратов.
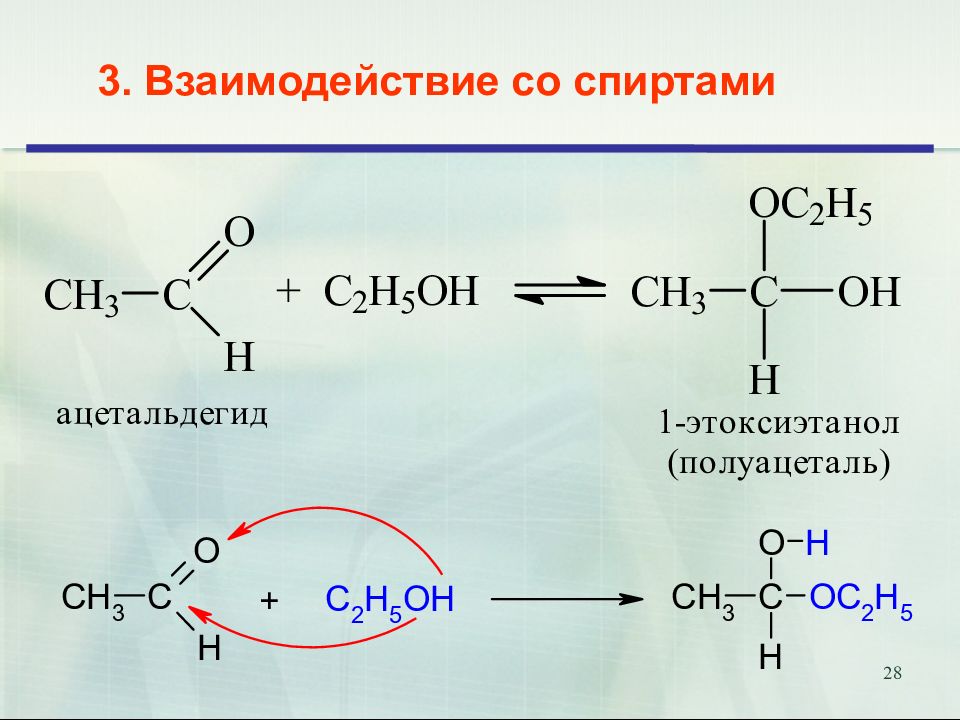
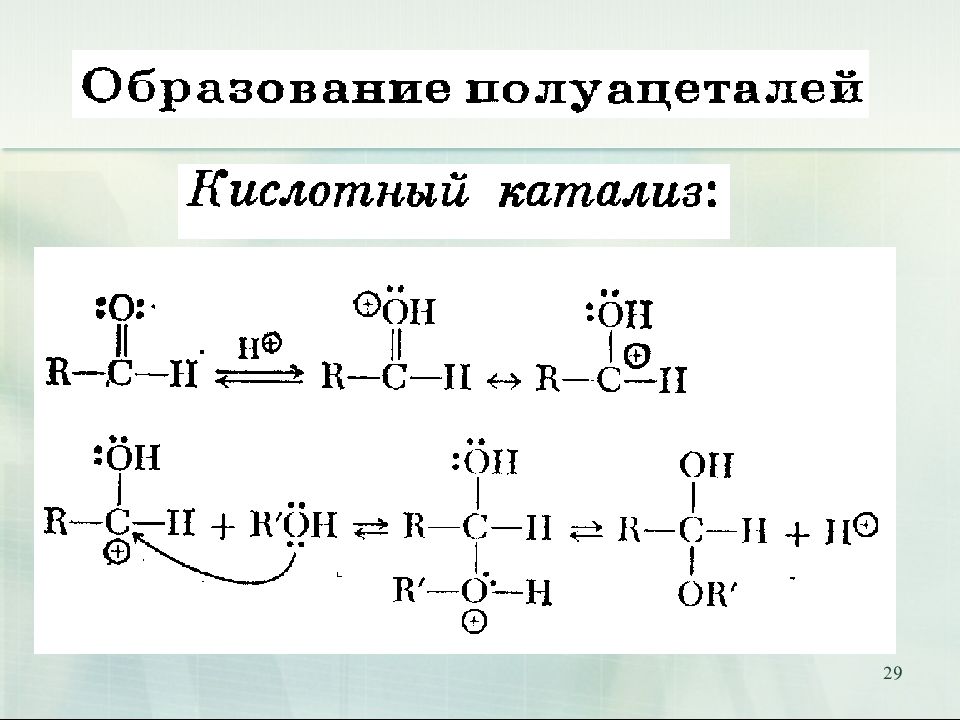
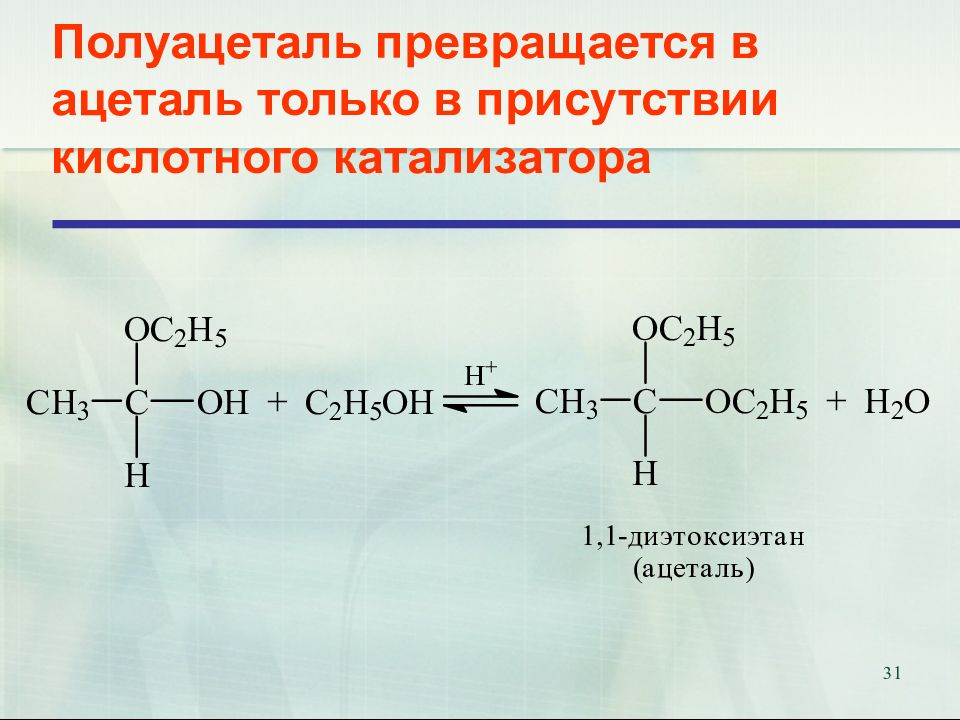
Слайд 31: Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора
31 Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора
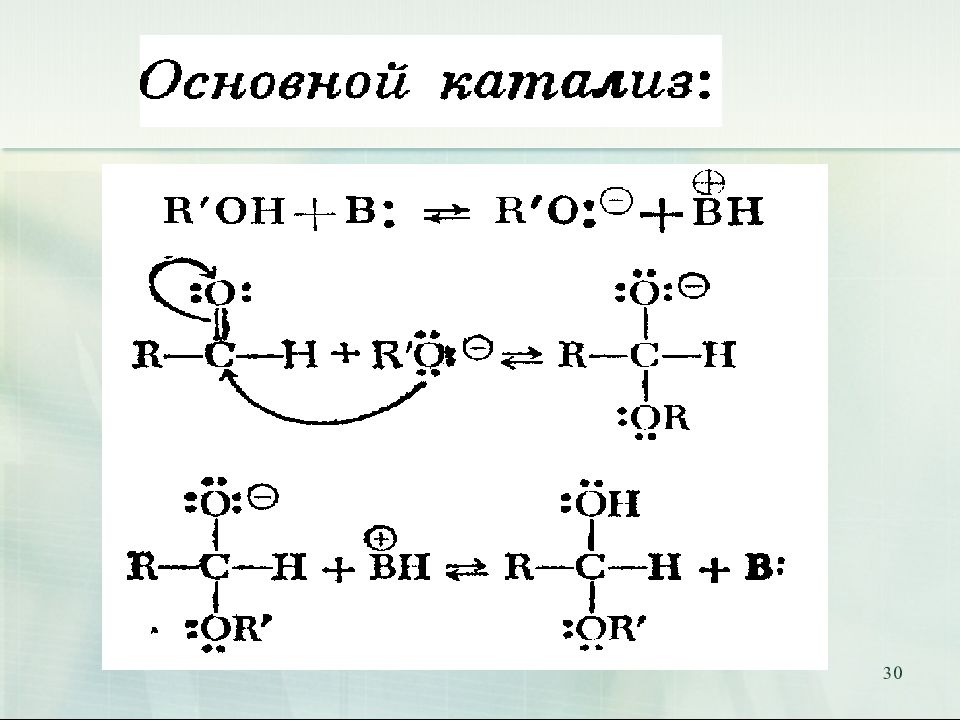
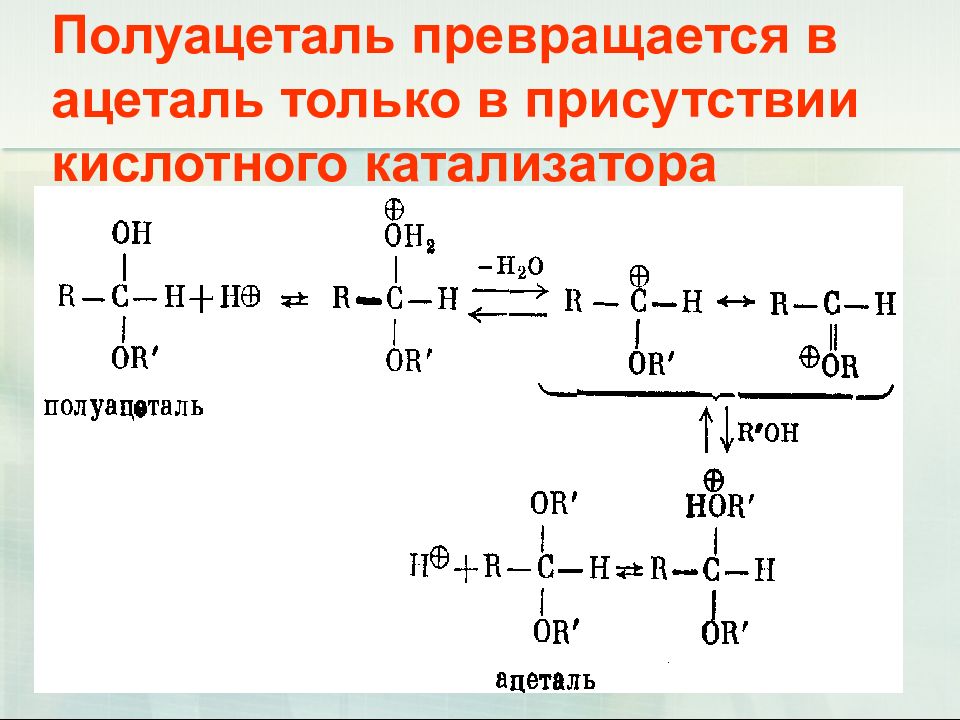
Слайд 32: Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора
32 Полуацеталь превращается в ацеталь только в присутствии кислотного катализатора
Слайд 34
34 В присутствии воды в кислой среде и полуацетали, и ацетали претерпевают обратное расщепление; в оснόвной среде они устойчивы
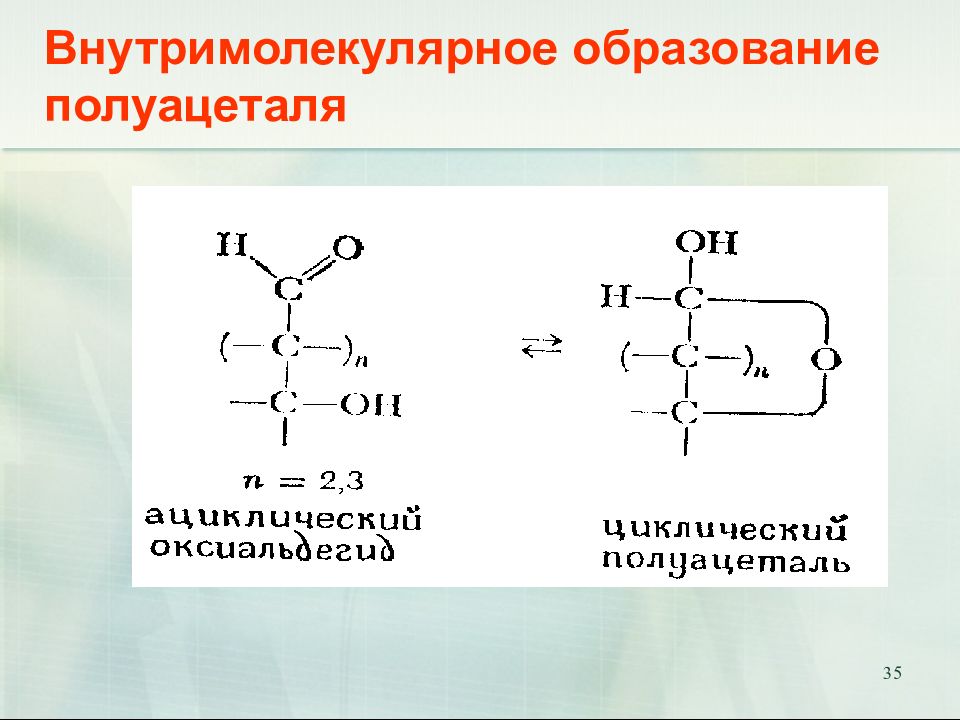
Слайд 35: Внутримолекулярное образование полуацеталя
35 Внутримолекулярное образование полуацеталя
Слайд 39
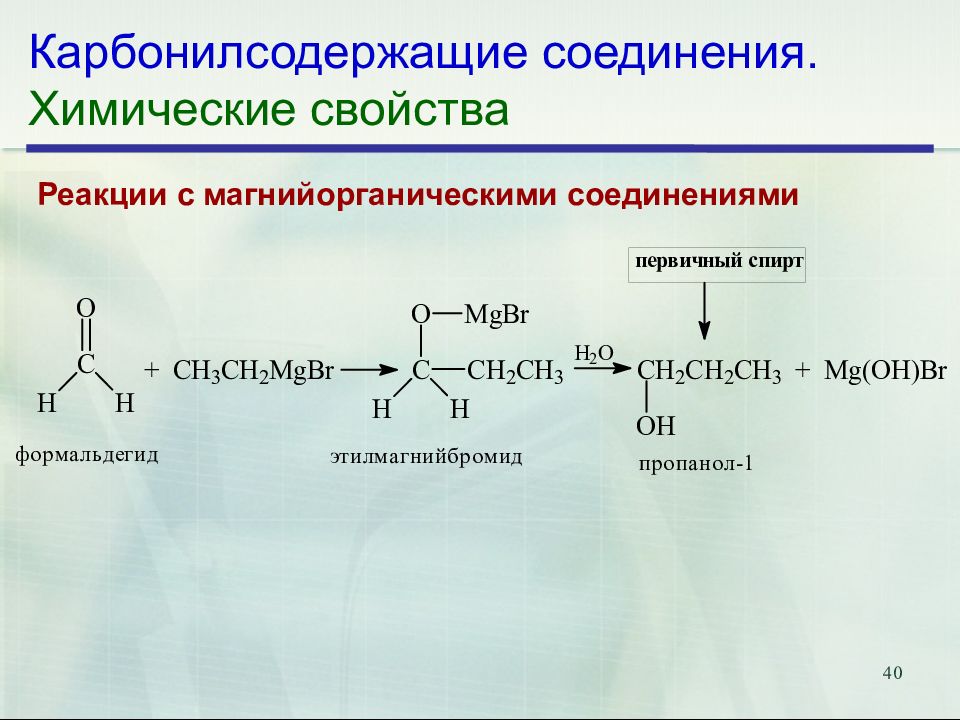
39 5.Реакции с магнийорганическими соединениями Реакция Гриньяра Гриньяр Франсуа Огюст Виктор (6.V.1871–13.XII.1935) (Франция) Нобелевская премия по химии, 1912 г. δ+
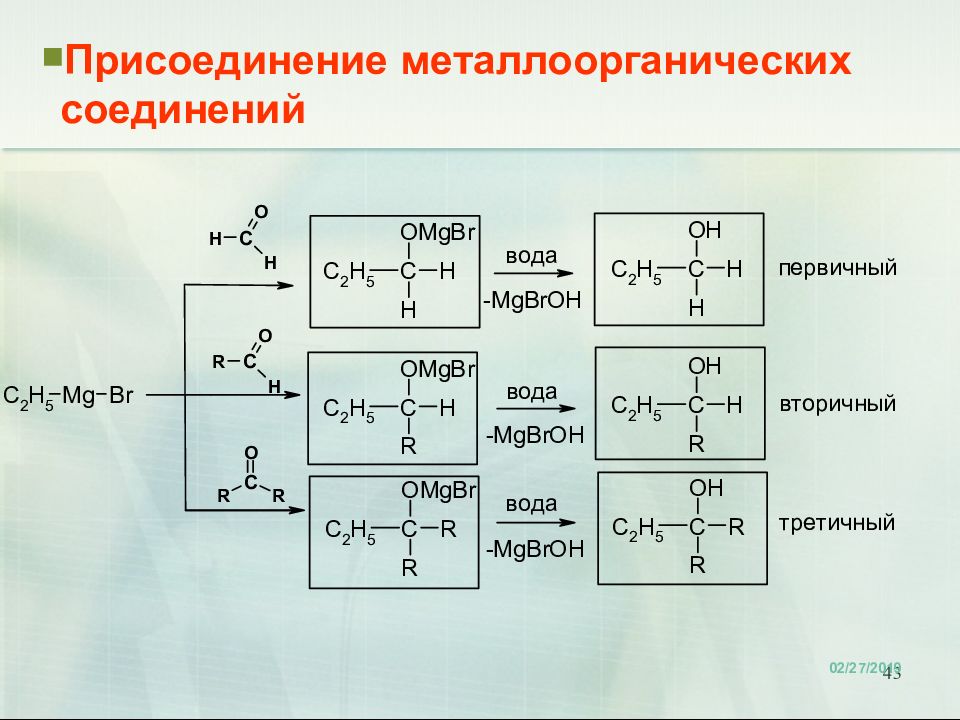
Слайд 40: Карбонилсодержащие соединения. Химические свойства
40 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями
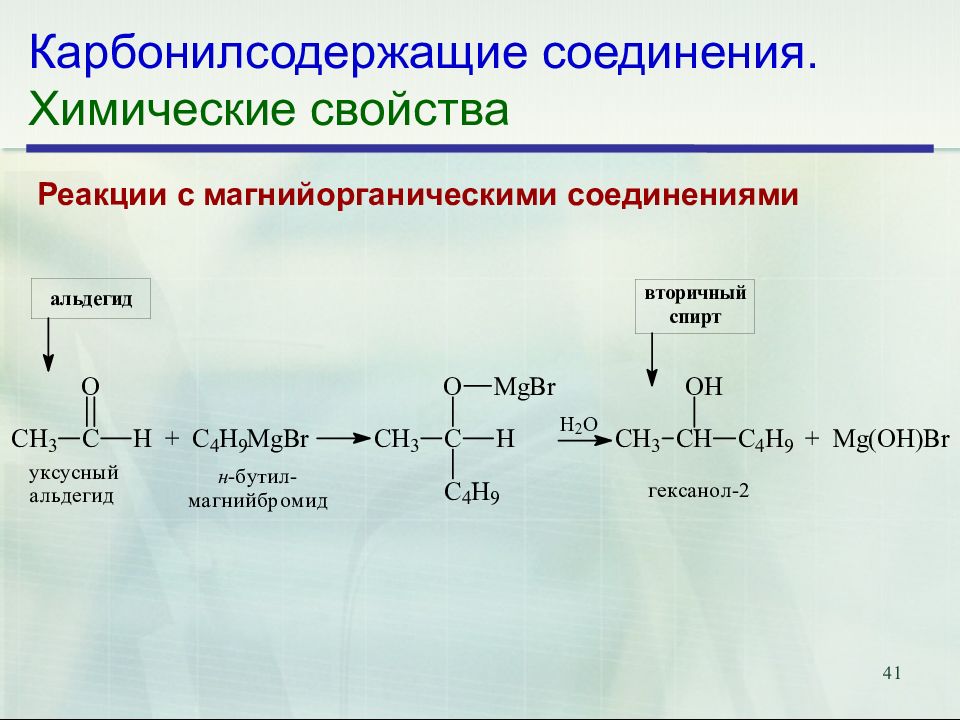
Слайд 41: Карбонилсодержащие соединения. Химические свойства
41 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями
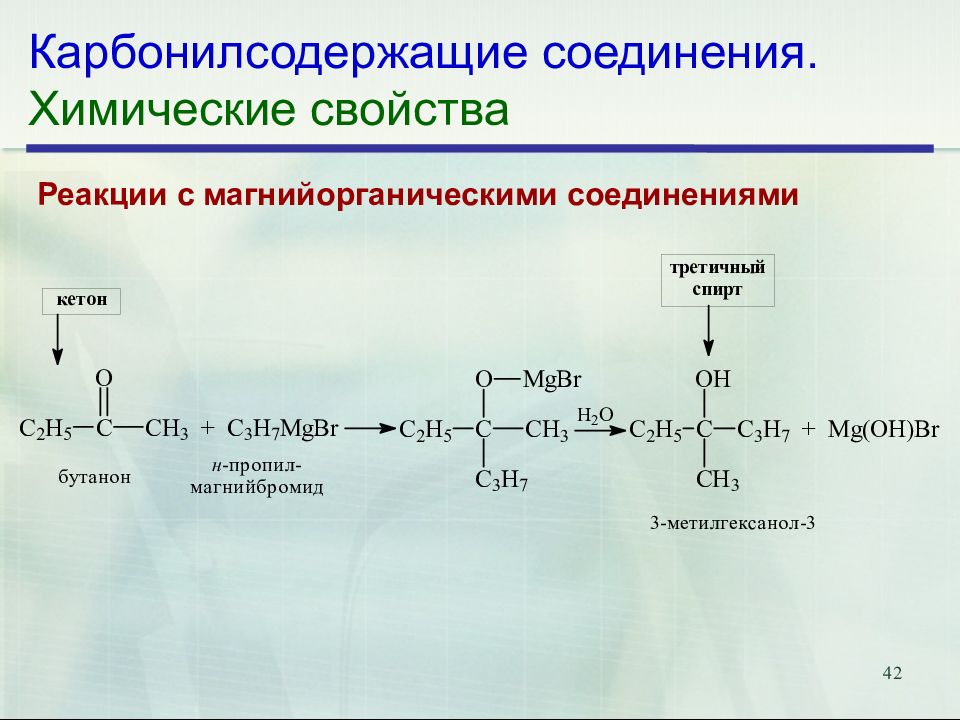
Слайд 42: Карбонилсодержащие соединения. Химические свойства
42 Карбонилсодержащие соединения. Химические свойства Реакции с магнийорганическими соединениями
Слайд 47
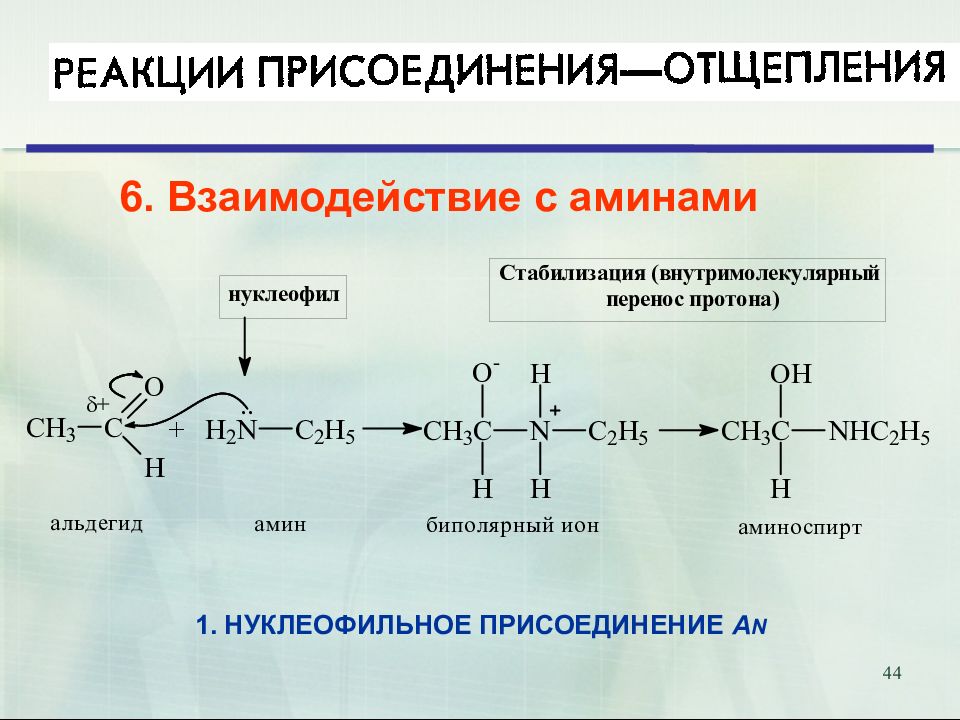
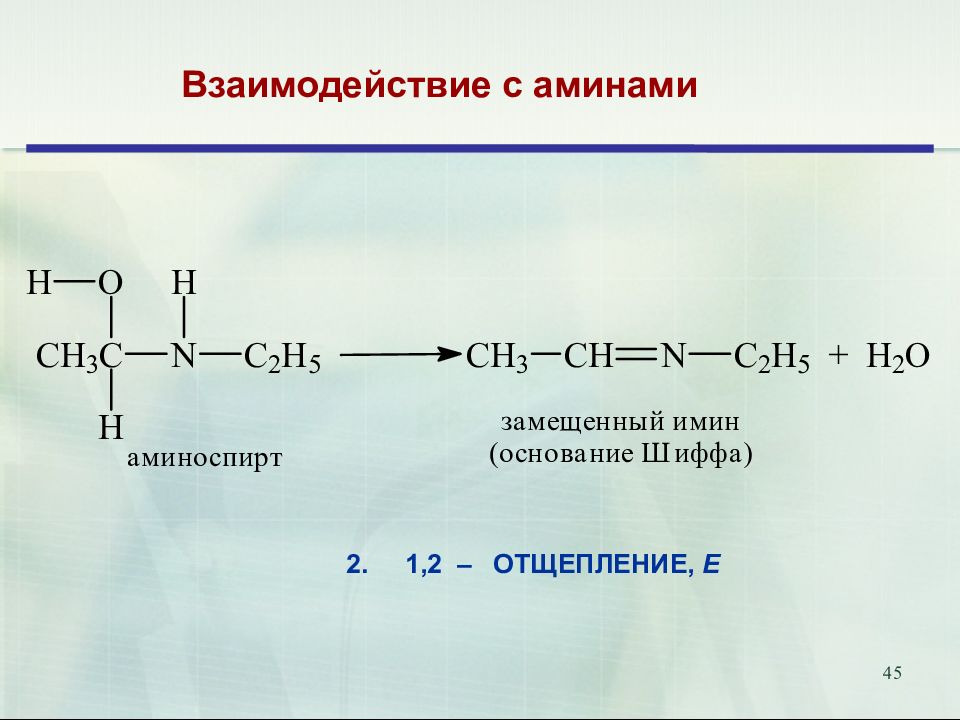
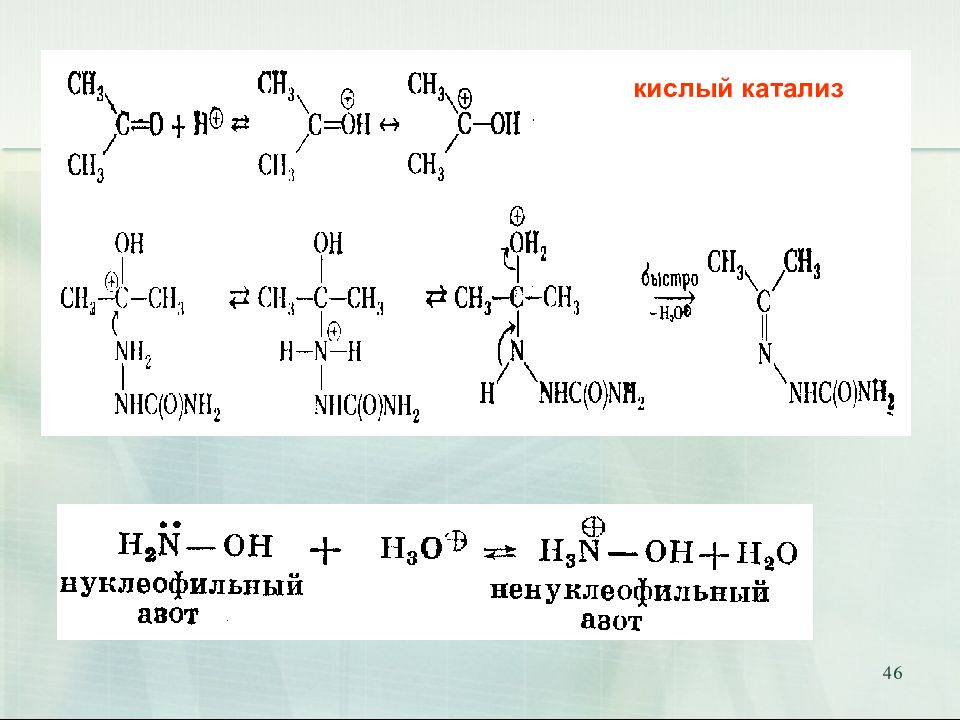
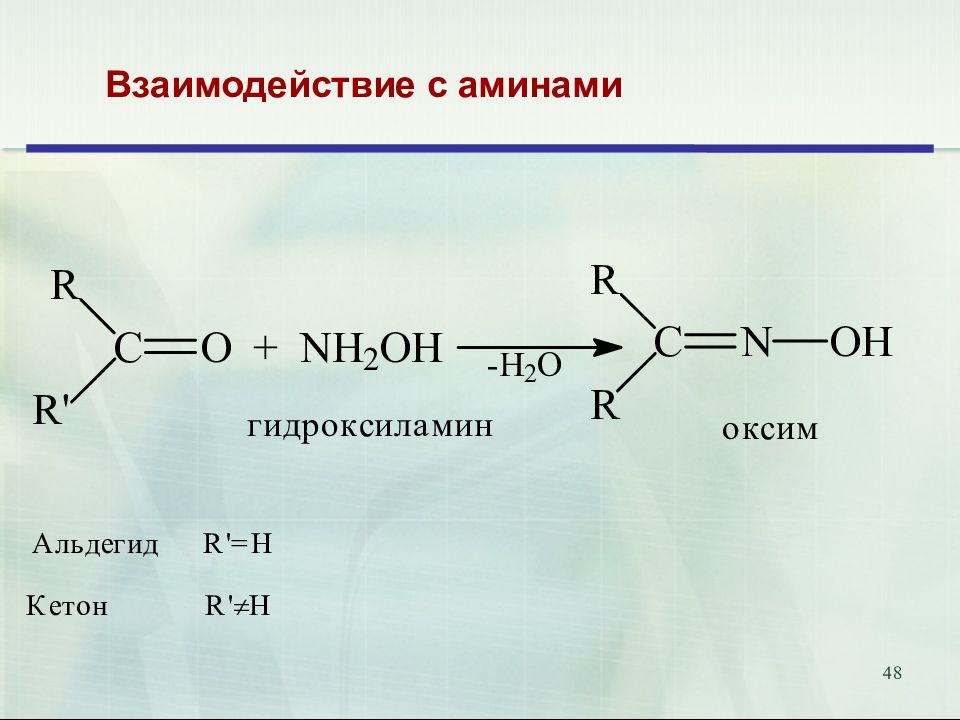
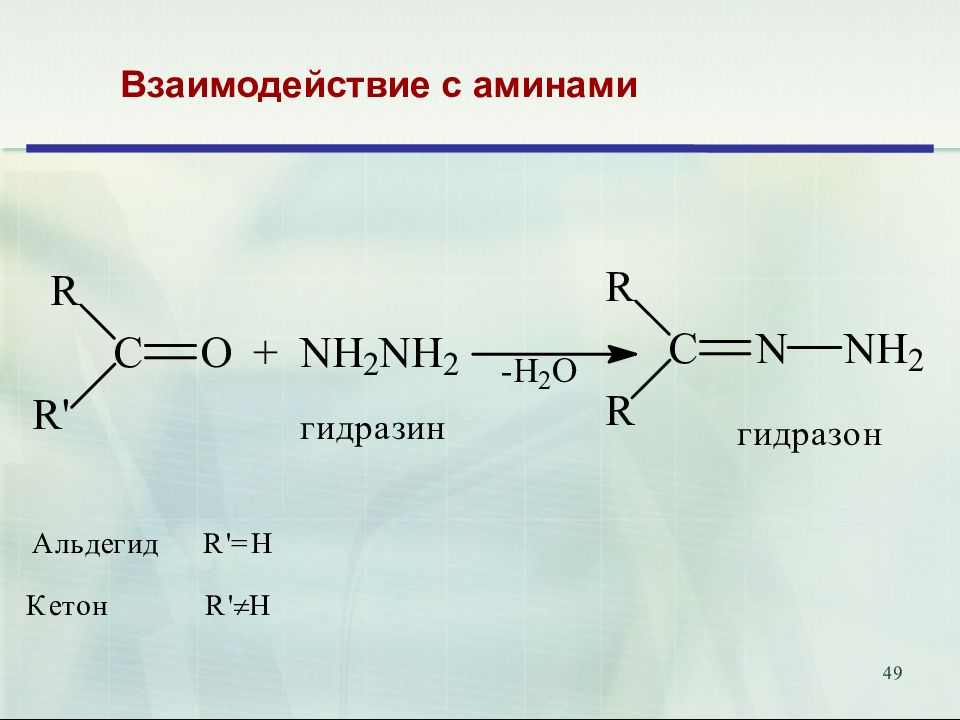
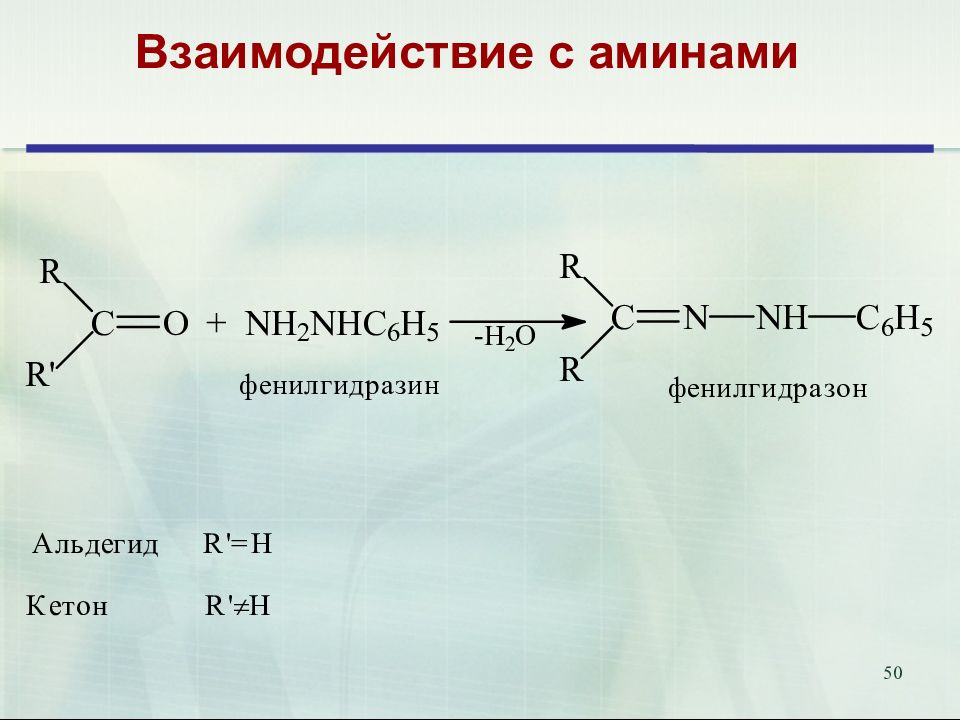
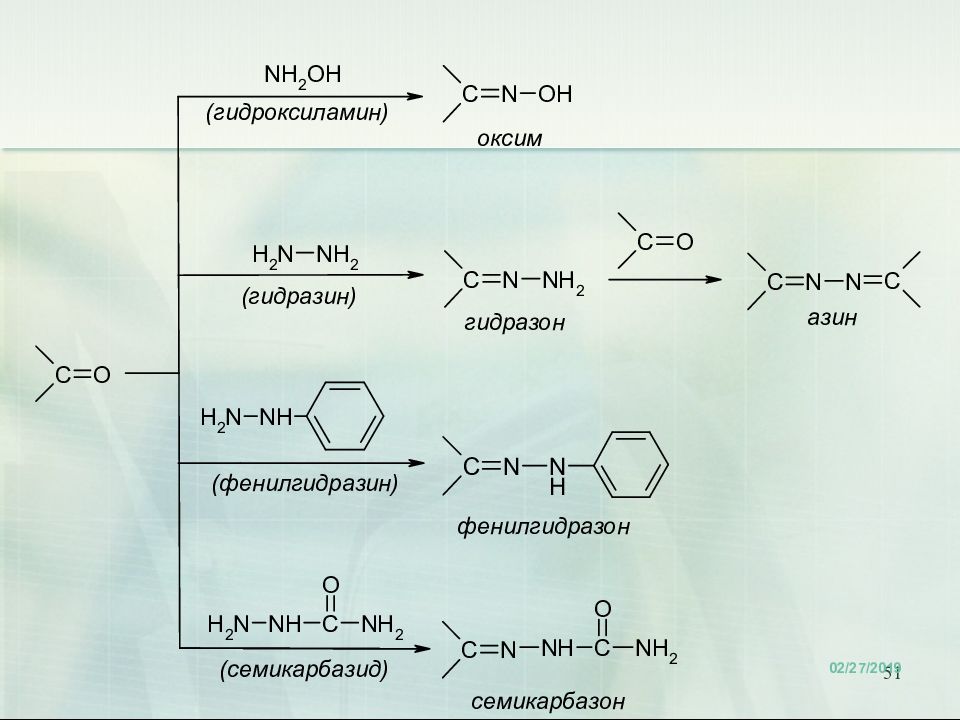
47 Присоединение аммиака и аминов. Биологическое значение. Переаминирование аминокислот in vivo катализируется трансаминазами и идёт через образование оснований Шиффа 18.02.2019 47 Е
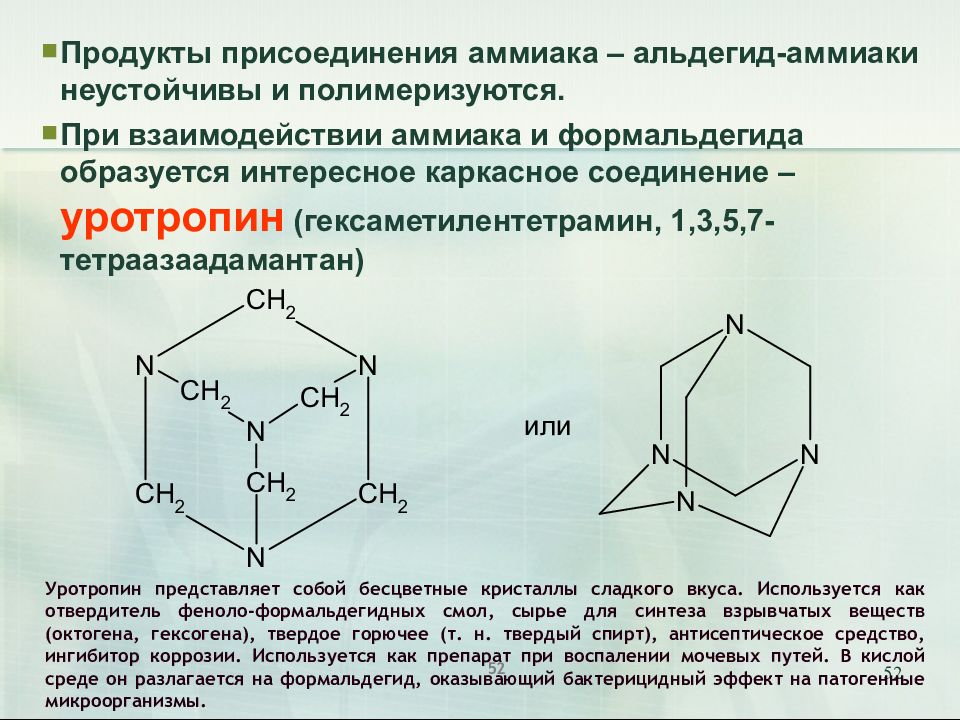
Слайд 52
52 Продукты присоединения аммиака – альдегид-аммиаки неустойчивы и полимеризуются. При взаимодействии аммиака и формальдегида образуется интересное каркасное соединение – уротропин (гексаметилентетрамин, 1,3,5,7-тетраазаадамантан) Уротропин представляет собой бесцветные кристаллы сладкого вкуса. Используется как отвердитель феноло-формальдегидных смол, сырье для синтеза взрывчатых веществ (октогена, гексогена), твердое горючее (т. н. твердый спирт), антисептическое средство, ингибитор коррозии. Используется как препарат при воспалении мочевых путей. В кислой среде он разлагается на формальдегид, оказывающий бактерицидный эффект на патогенные микроорганизмы. 52
Слайд 53: 7. Присоединение водорода (гидрирование, восстановление; получение спиртов ):
53 7. Присоединение водорода (гидрирование, восстановление; получение спиртов ): а) каталитическое гидрирование (даёт первичные и вторичные спирты) >C=O + H 2 (Pt, Pd, Ni-Raney, Rh) >CH OH; б) восстановление натрием в спирте > C = O + Na + C 2 H 5 OH > CH OH
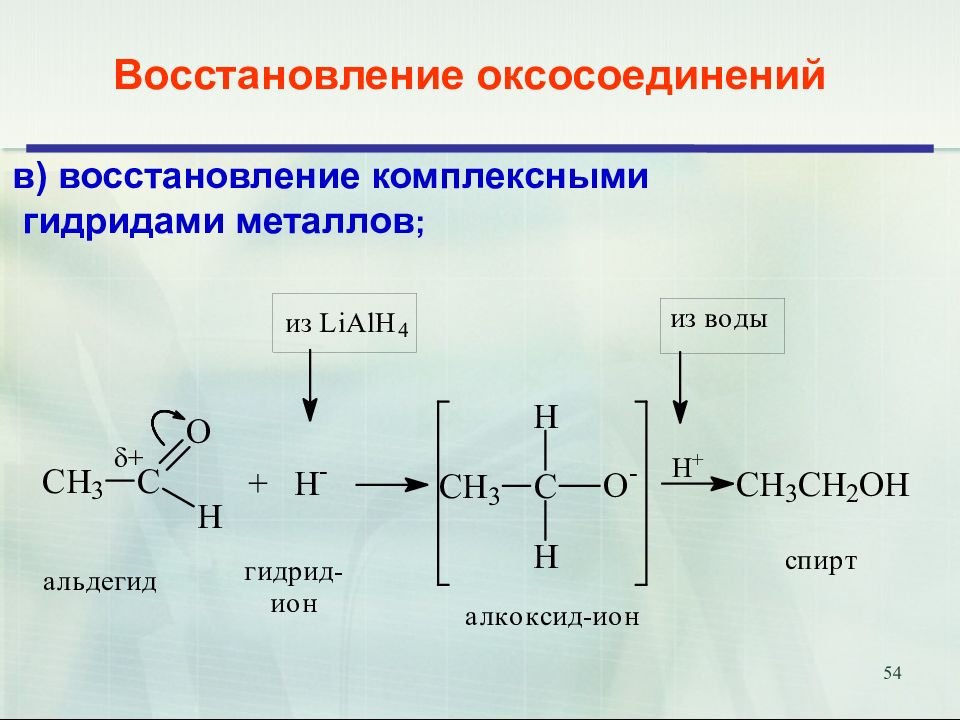
Слайд 54
54 Восстановление оксосоединений в) восстановление комплексными гидридами металлов ;
Слайд 55: д) восстановление по Кижнеру Вольфу :
55 д) восстановление по Кижнеру Вольфу : г) восстановление по Клемменсену > C = O + HCl ( конц. ) + Zn ( мелкие стружки или пыль ) / Hg > CH 2 ;
Слайд 56
56 Реакция "серебряного зеркала" - это реакция восстановления серебра в аммиачном растворе оксида серебра (реактив Толленса). 8. Реакции окисления Другие окислители также могут окислять альдегиды до кислот, например, KMnO 4, CrO 3 / H 2 SO 4 и др. R-CH=O + 2 [Ag(NH 3 ) 2 ]OH => RCOONH 4 + 2 Ag +3 NH 3 + H 2 O
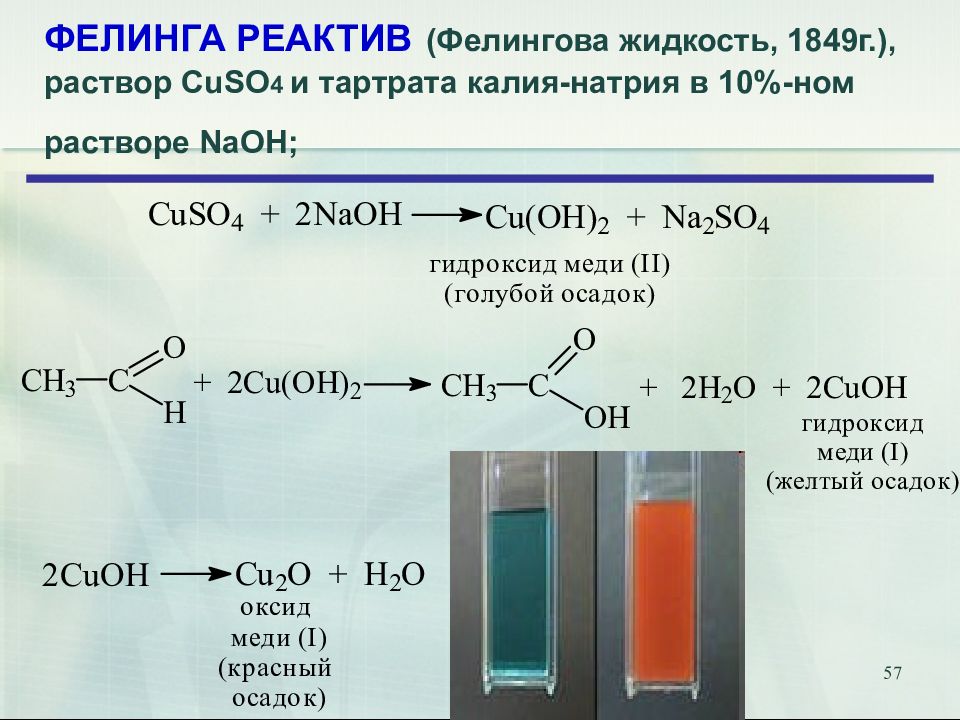
Слайд 57: ФЕЛИНГА РЕАКТИВ (Фелингова жидкость, 1849г.), раствор CuSO 4 и тартрата калия-натрия в 10%-ном растворе NaOH;
57 ФЕЛИНГА РЕАКТИВ (Фелингова жидкость, 1849г.), раствор CuSO 4 и тартрата калия-натрия в 10%-ном растворе NaOH;
Слайд 58: РЕАКТИВ ФЕЛИНГА
58 РЕАКТИВ ФЕЛИНГА R CH=O + Cu(OH) 2 + KOOC (CHOH) 2 COONa + KOH Реактив Фелинга (голубого цвета) R COOK + Cu 2 O ↓. Красный осадок
Слайд 59: Реактив Бенедикта (щелочной раствор цитрата двухвалентной меди)
59 Реактив Бенедикта (щелочной раствор цитрата двухвалентной меди)
Слайд 60: Концентрированная HNO 3, хромовая смесь ( K 2 Cr 2 O 7 + H 2 SO 4 ) или KMnO 4 в сильно кислой среде и при нагревании, окисляют кетоны до смеси 4-х карбоновых кислот
60 Концентрированная HNO 3, хромовая смесь ( K 2 Cr 2 O 7 + H 2 SO 4 ) или KMnO 4 в сильно кислой среде и при нагревании, окисляют кетоны до смеси 4-х карбоновых кислот. Окисление кетонов
Слайд 62
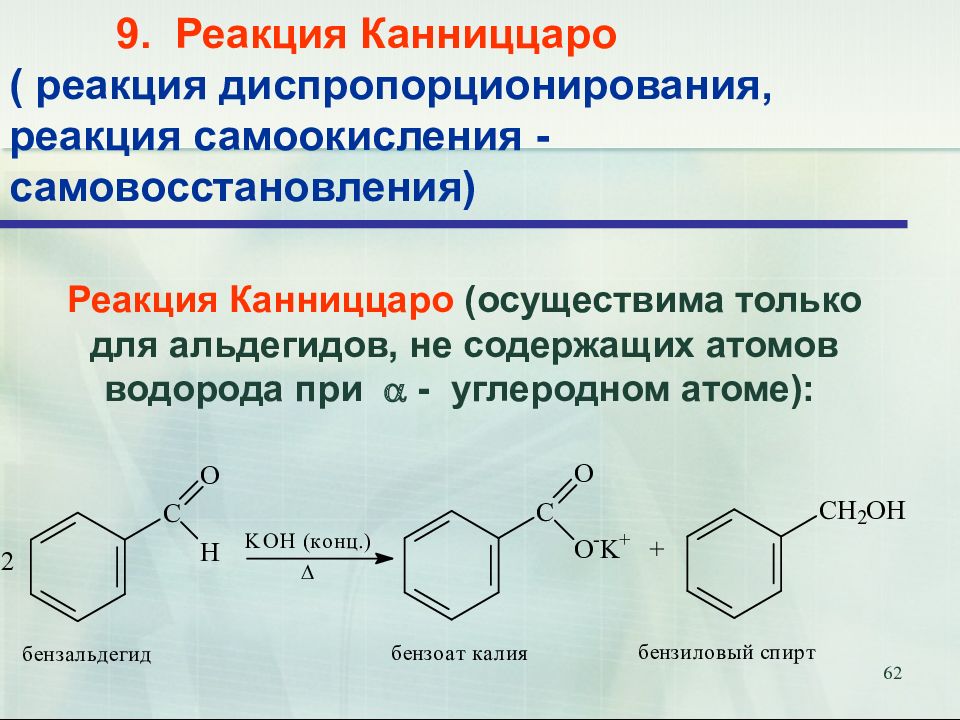
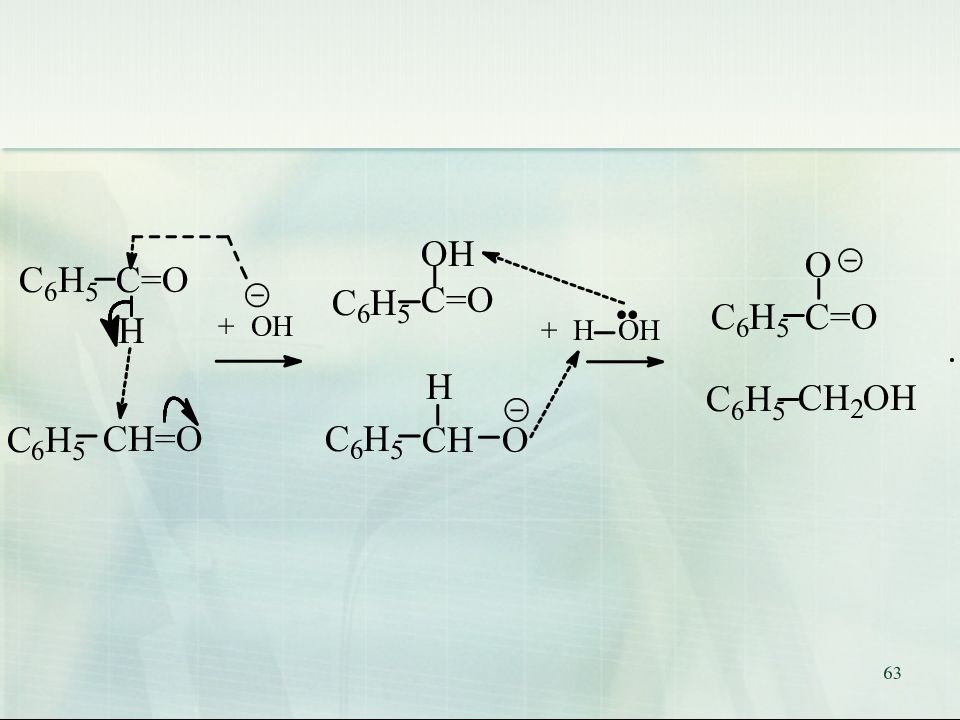
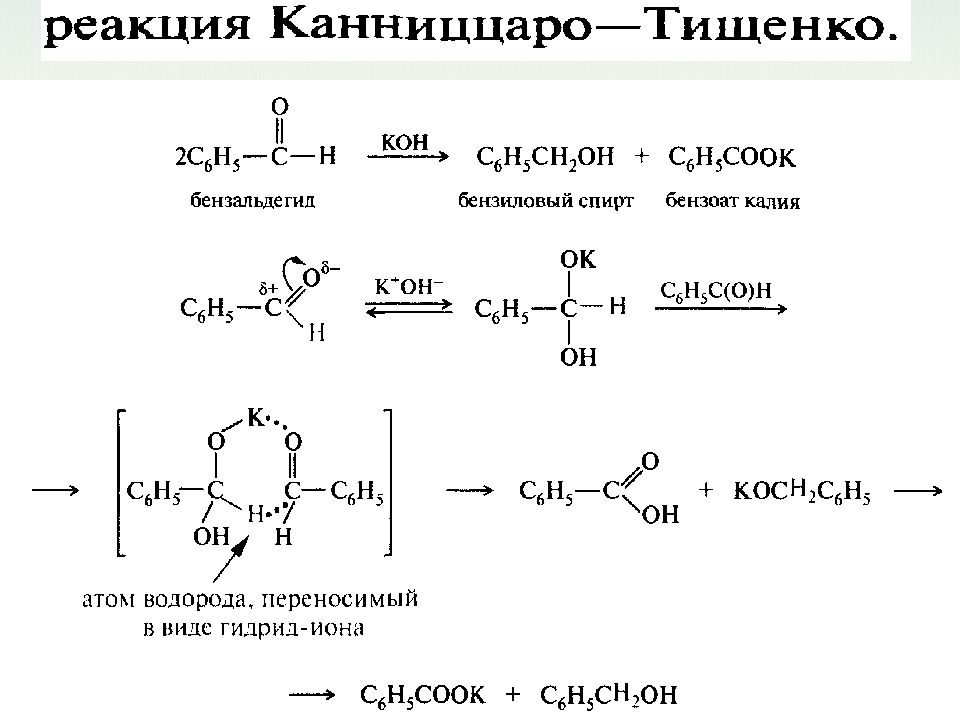
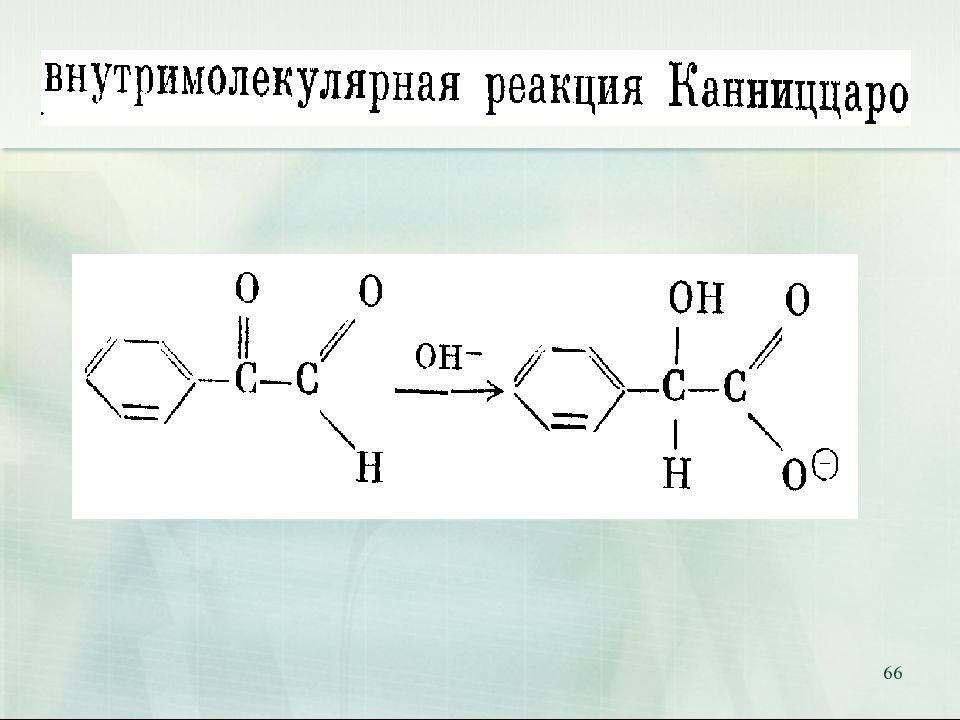
62 9. Реакция Канниццаро ( реакция диспропорционирования, реакция самоокисления - самовосстановления) Реакция Канниццаро (осуществима только для альдегидов, не содержащих атомов водорода при - углеродном атоме):
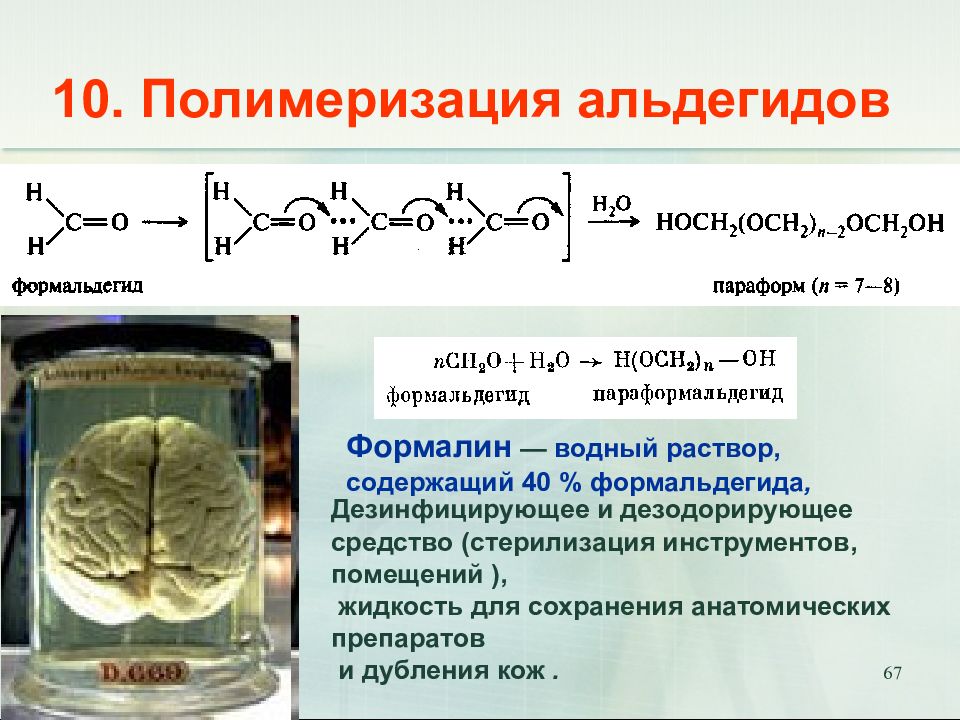
Слайд 67: 10. Полимеризация альдегидов
67 10. Полимеризация альдегидов Дезинфицирующее и дезодорирующее средство (стерилизация инструментов, помещений ), жидкость для сохранения анатомических препаратов и дубления кож. Формалин — водный раствор, содержащий 40 % формальдегида,
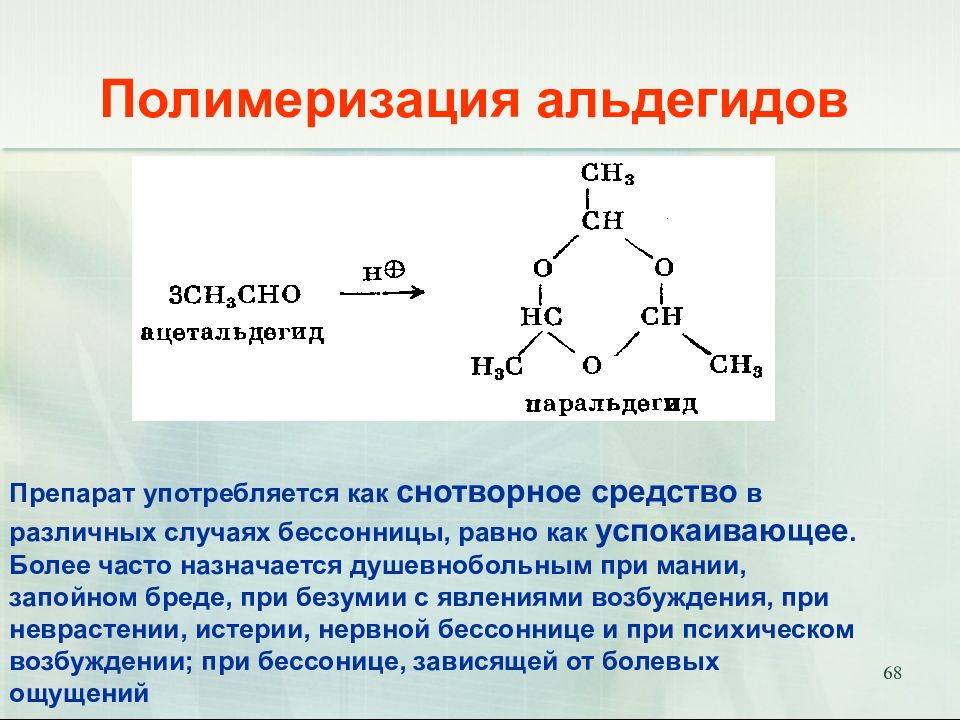
Слайд 68: Полимеризация альдегидов
68 Полимеризация альдегидов Препарат употребляется как снотворное средство в различных случаях бессонницы, равно как успокаивающее. Более часто назначается душевнобольным при мании, запойном бреде, при безумии с явлениями возбуждения, при неврастении, истерии, нервной бессоннице и при психическом возбуждении; при бессонице, зависящей от болевых ощущений
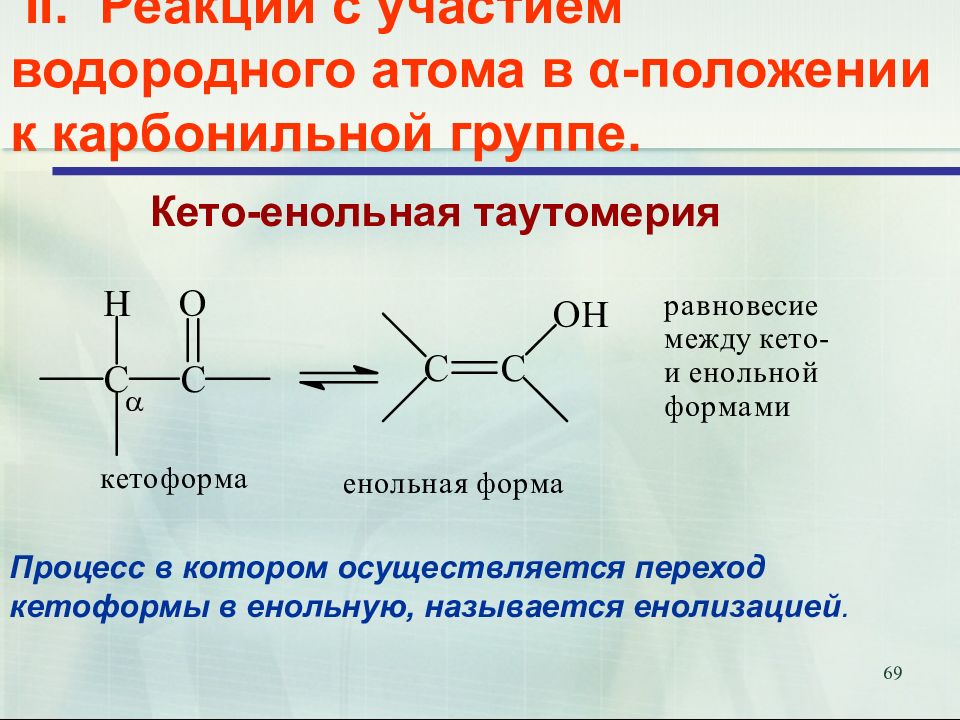
Слайд 69: II. Реакции с участием водородного атома в α-положении к карбонильной группе
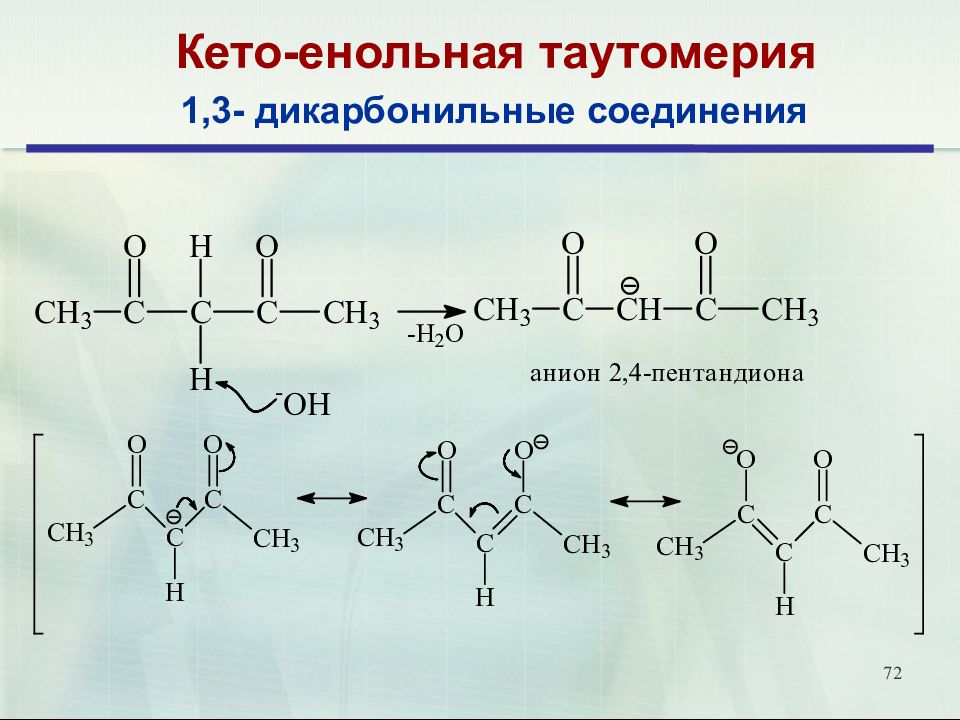
69 II. Реакции с участием водородного атома в α-положении к карбонильной группе. Кето-енольная таутомерия Процесс в котором осуществляется переход кетоформы в енольную, называется енолизацией.
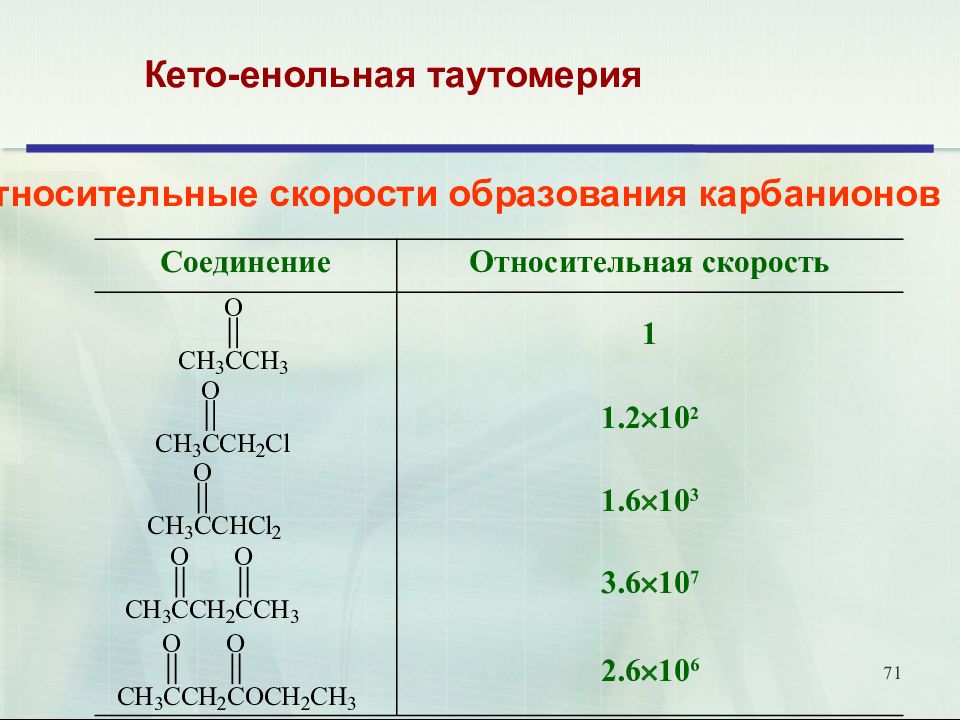
Слайд 71
71 Кето-енольная таутомерия Относительные скорости образования карбанионов Соединение Относительная скорость 1 1.2 10 2 1.6 10 3 3.6 10 7 2.6 10 6
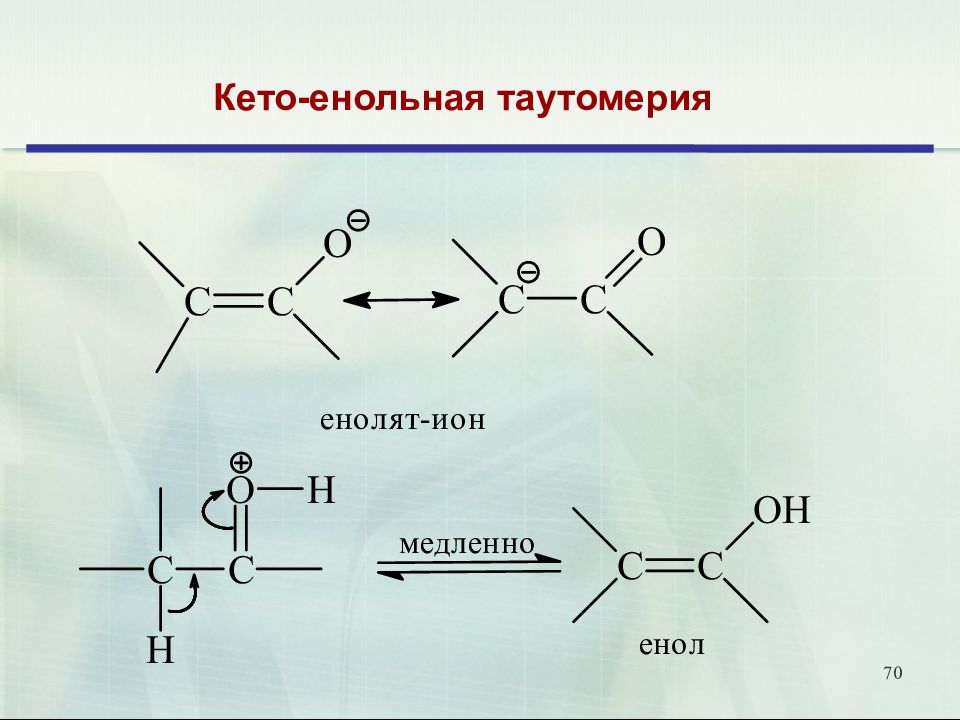
Слайд 72: Кето-енольная таутомерия
72 Кето-енольная таутомерия 1,3- дикарбонильные соединения
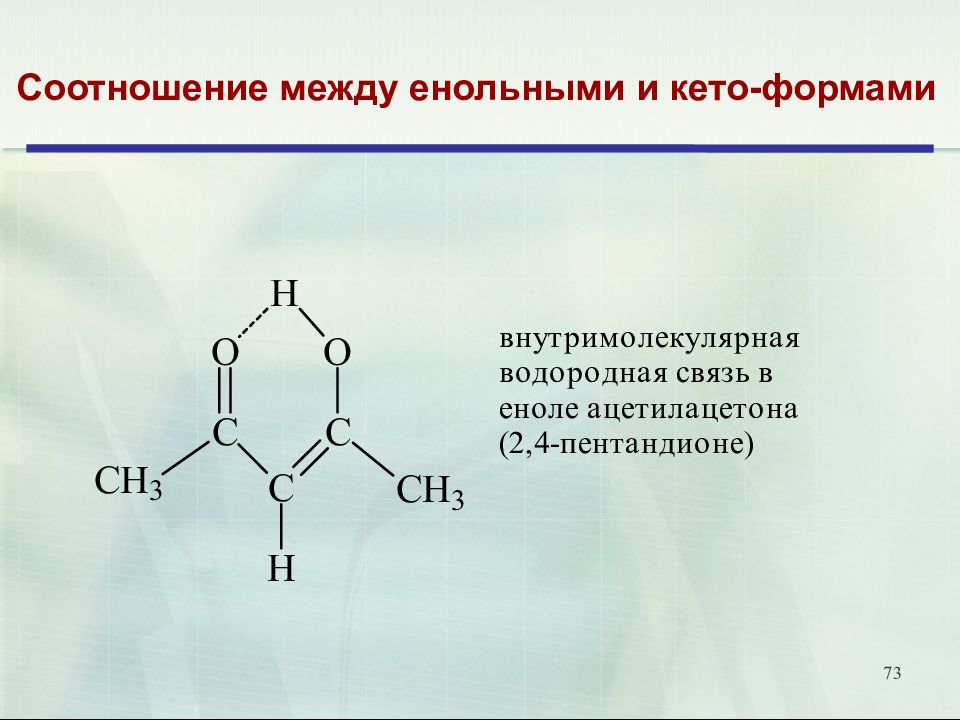
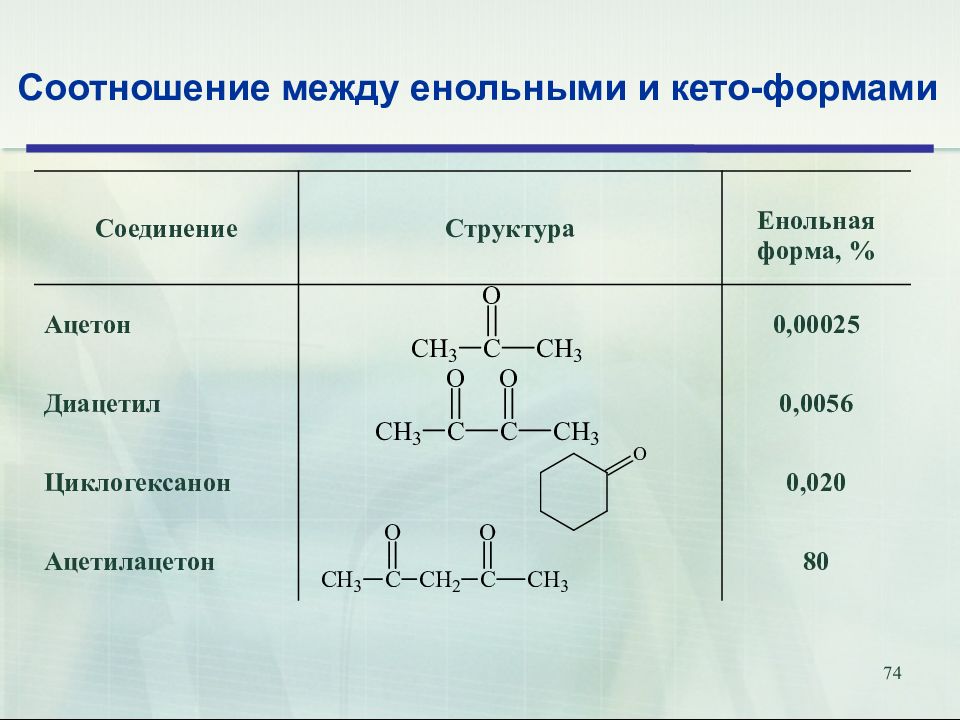
Слайд 74
74 Соотношение между енольными и кето-формами Соединение Структура Енольная форма, % Ацетон 0, 00025 Диацетил 0,0056 Циклогексанон 0,020 Ацетилацетон 80
Слайд 75
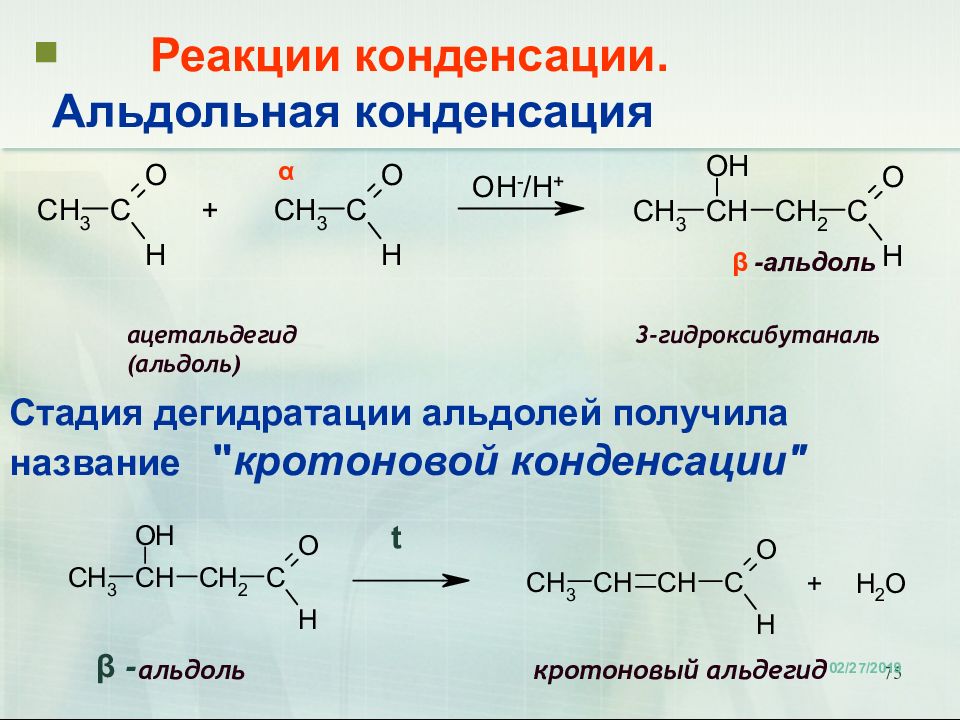
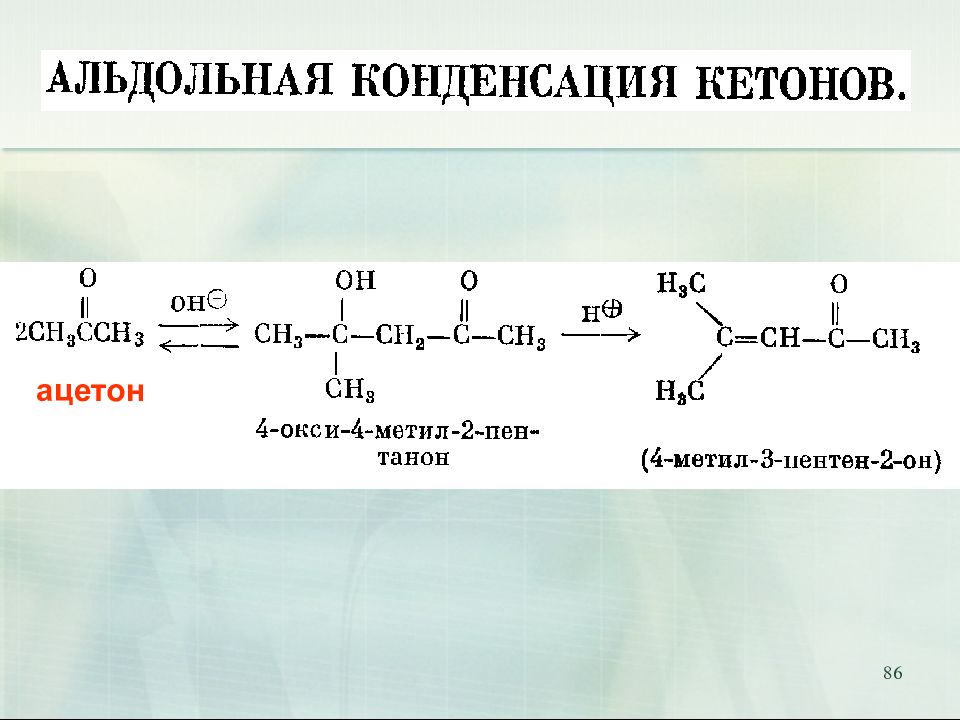
75 Реакции конденсации. Альдольная конденсация ацетальдегид 3-гидроксибутаналь (альдоль) альдоль кротоновый альдегид 18.02.2019 α β - β -альдоль t Стадия дегидратации альдолей получила название " кротоновой конденсации"
Слайд 76
76 Альдольная конденсация была открыта практически одновременно в 1872 году французским химиком Ш.А. Вюрцем и русским химиком и композитором А.П. Бородиным. ttp Шарль-Адольф Вюрц (1817 – 1884) Александр Порфирьевич Бородин (1833 —1887)
Слайд 77
77 А. П. Бородин открыл реакцию Бородина — Хунсдикера Впервые получил в 1862 г. фторорганическое соединение — фтористый бензоил. Открыл альдольную конденсациию. А. П. Бородин считается также одним из основателей классических жанров симфонии и квартета в России. 4 оперы. Самая известная - “ Князь Игорь ” 3 симфонии. Самая известная - Симфония № 2, h-moll « Богатырская» Камерно-инструментальные ансамбли, произведения для фортепиано, романсы и т.д. Самый известный струнный квартет – квартет № 2. А. П. Бородин. Портрет работы Ильи Репина (1888) 18.02.2019 77
Слайд 78
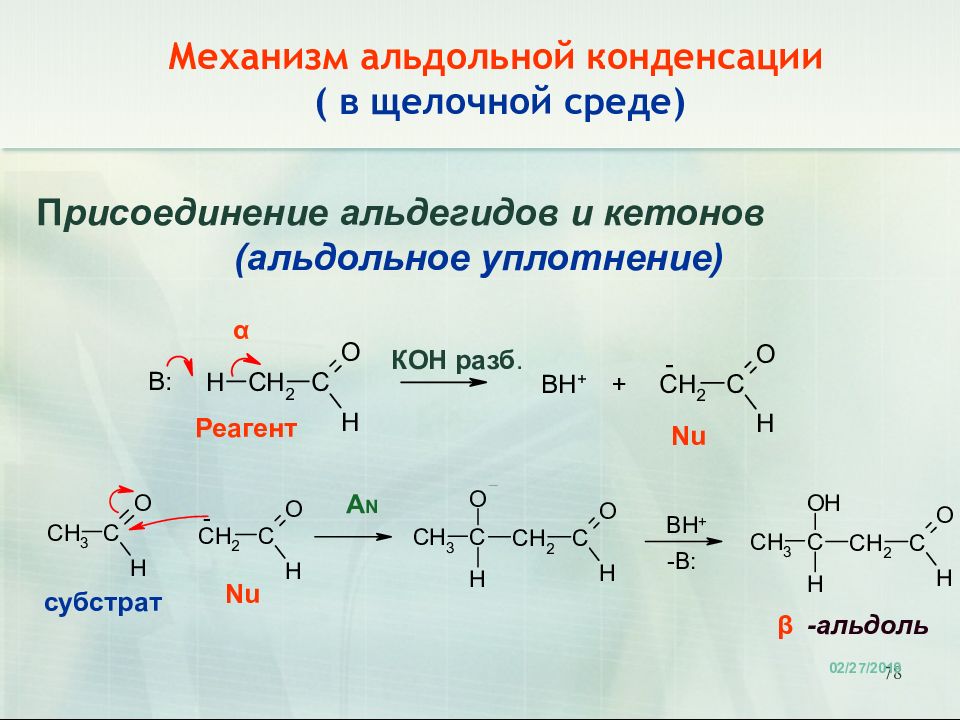
78 Механизм альдольной конденсации ( в щелочной среде) 18.02.2019 П рисоединение альдегидов и кетонов (альдольное уплотнение) -альдоль β α КОН разб. субстрат Реагент Nu Nu A N
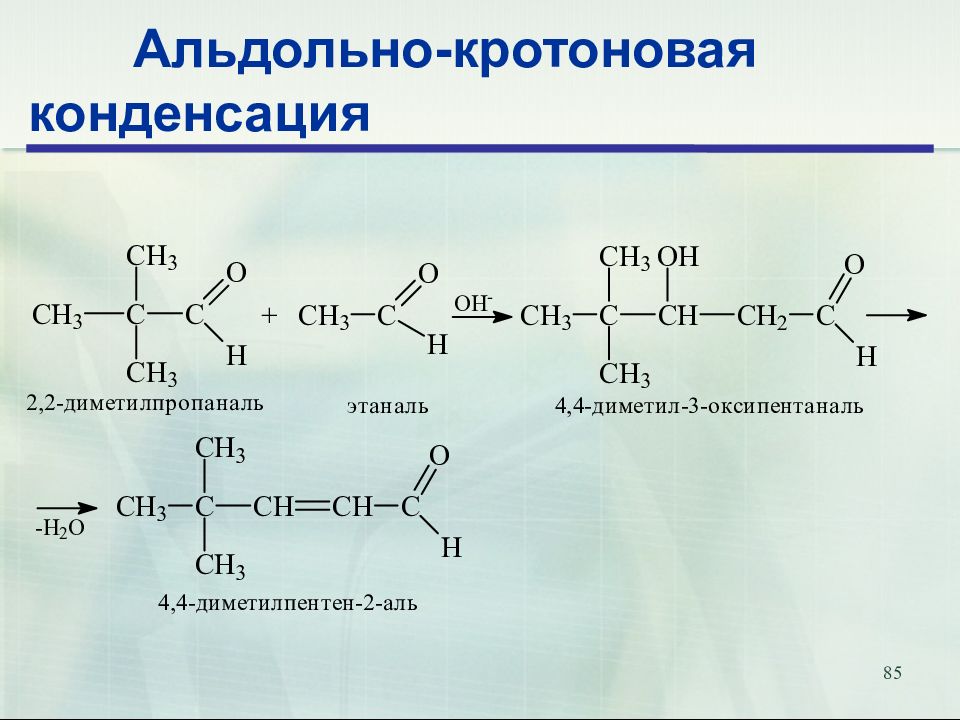
Слайд 80: Альдольно-кротоновая конденсация
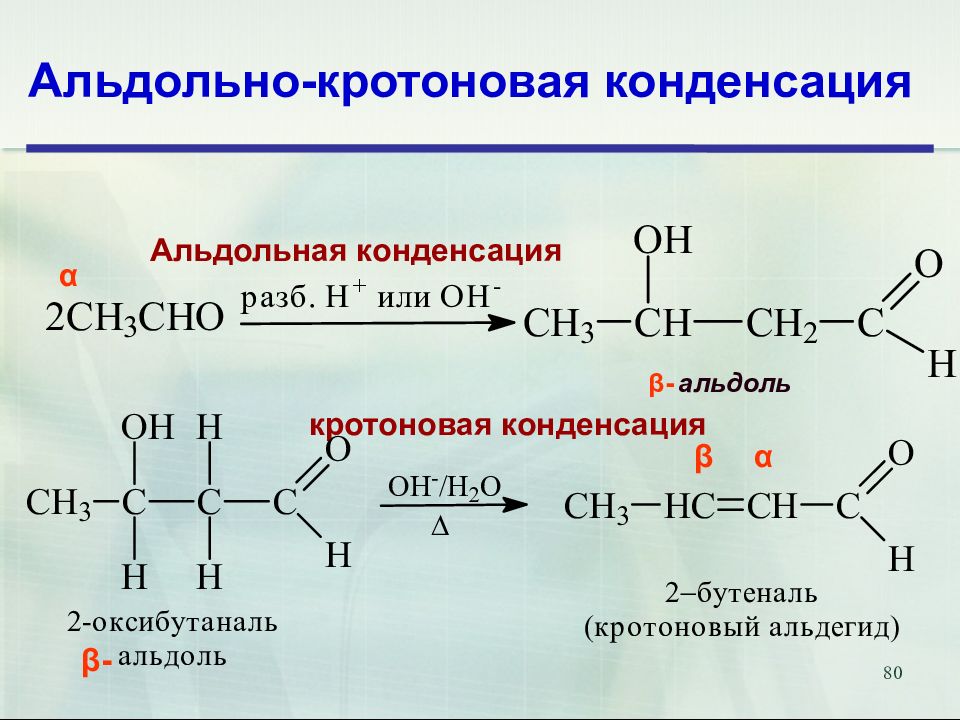
80 Альдольно-кротоновая конденсация Альдольная конденсация альдоль β- α α β кротоновая конденсация β-
Слайд 81: Дегидратация альдоля, катализируемая основанием
81 Дегидратация альдоля, катализируемая основанием
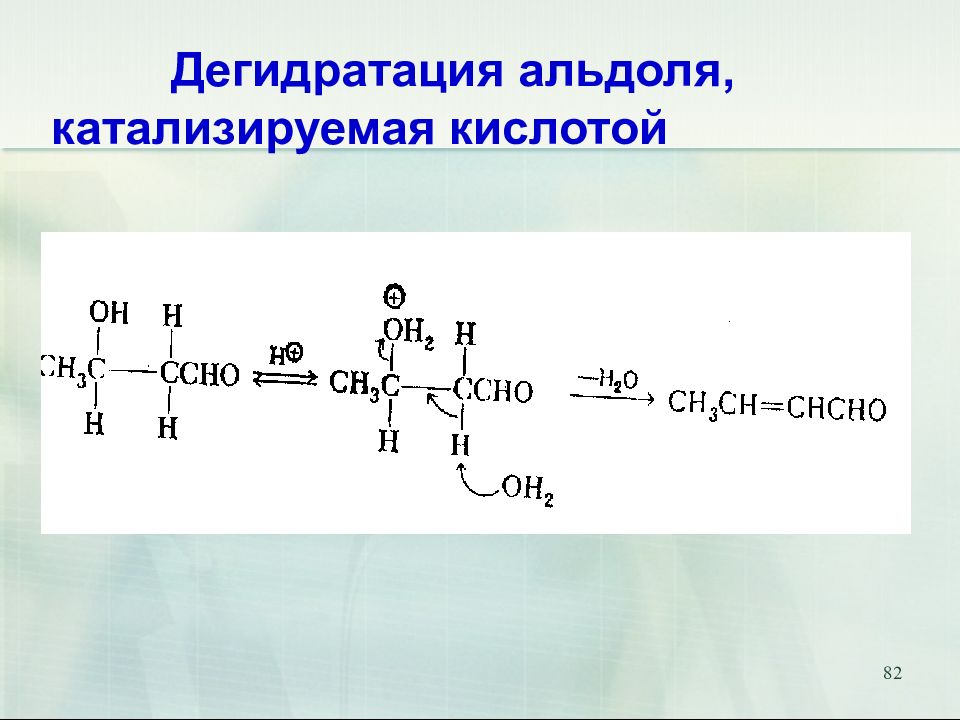
Слайд 82: Дегидратация альдоля, катализируемая кислотой
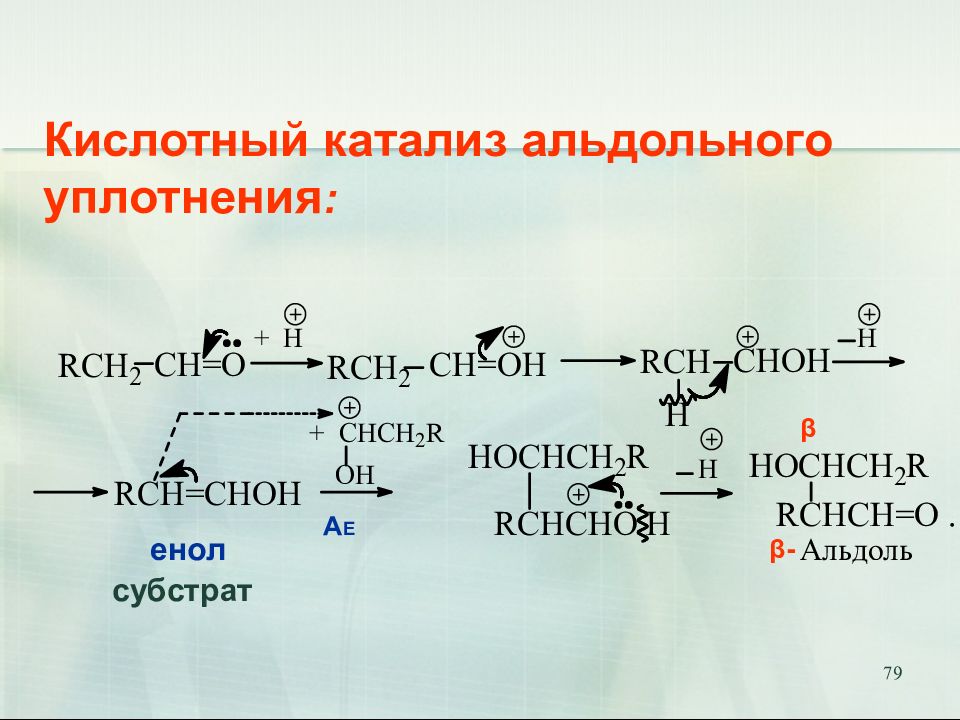
82 Дегидратация альдоля, катализируемая кислотой
Слайд 83
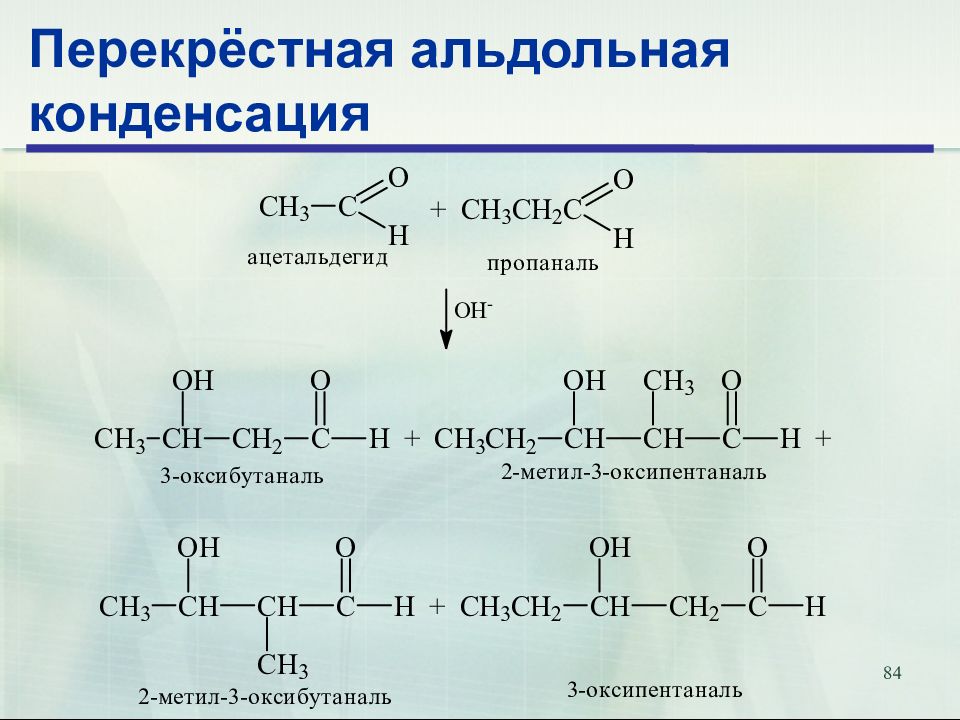
83 Перекрёстная альдольная конденсация Альдольная конденсация двух различных альдегидов называется перекрестной альдольной конденсацией
Слайд 84: Перекрёстная альдольная конденсация
84 Перекрёстная альдольная конденсация
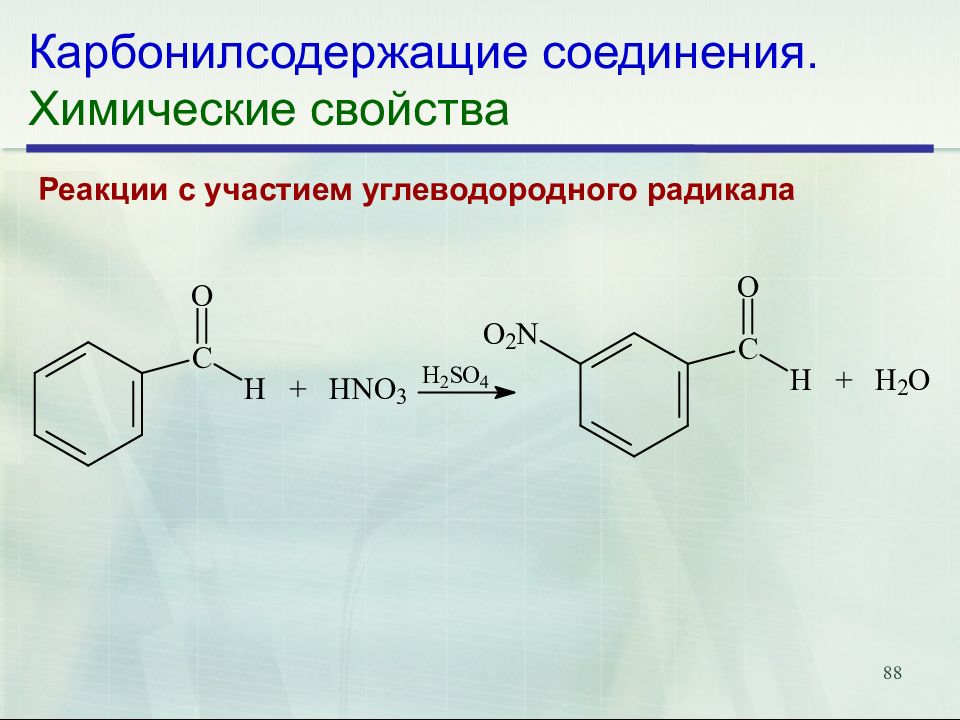
Слайд 88: Карбонилсодержащие соединения. Химические свойства
88 Карбонилсодержащие соединения. Химические свойства Реакции с участием углеводородного радикала
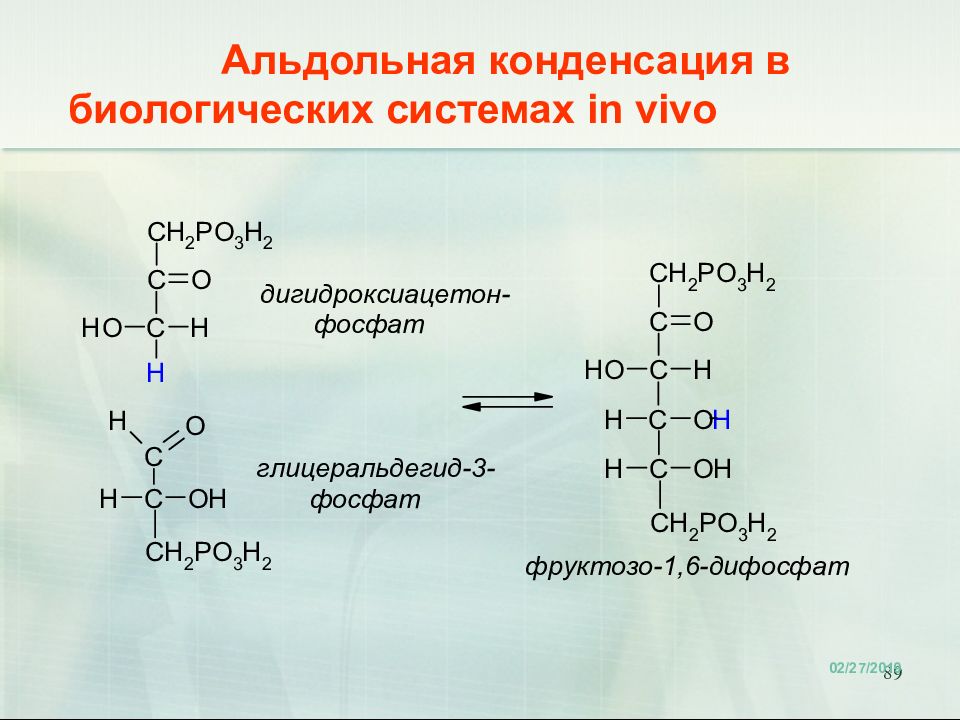
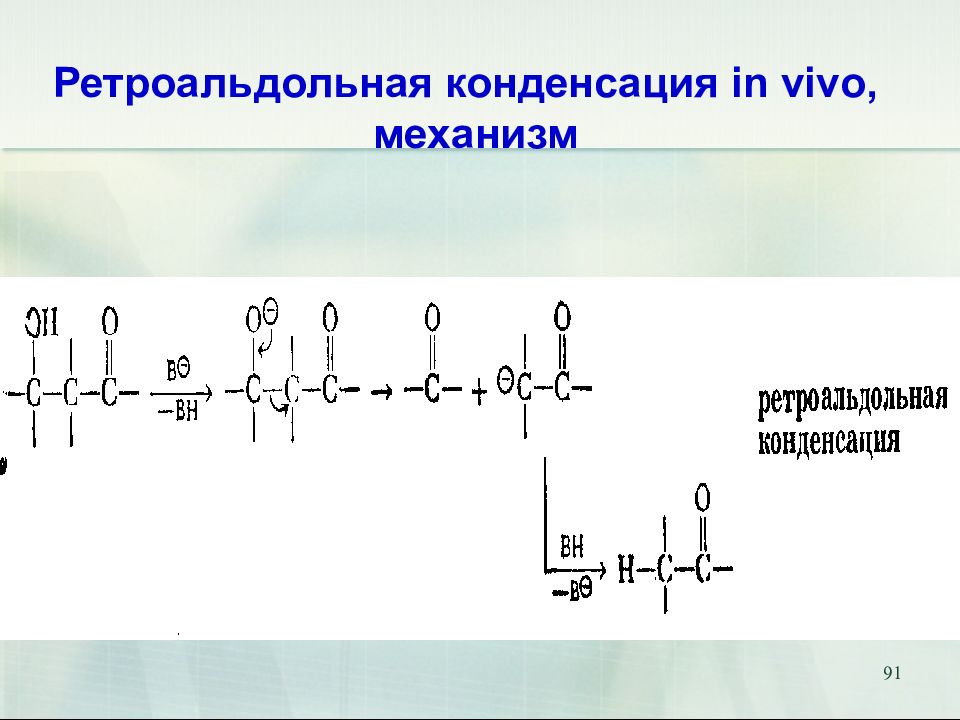
Слайд 90: Ретроальдольная конденсация in vivo
90 Ретроальдольная конденсация in vivo