Первый слайд презентации
№ 8. ОСОБЕННОСТИ СТРОЕНИЯ и РЕАКЦИОННОЙ СПОСОБНОСТИ КАРБОНОВЫХ КИСЛОТ И их ФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ
Слайд 2
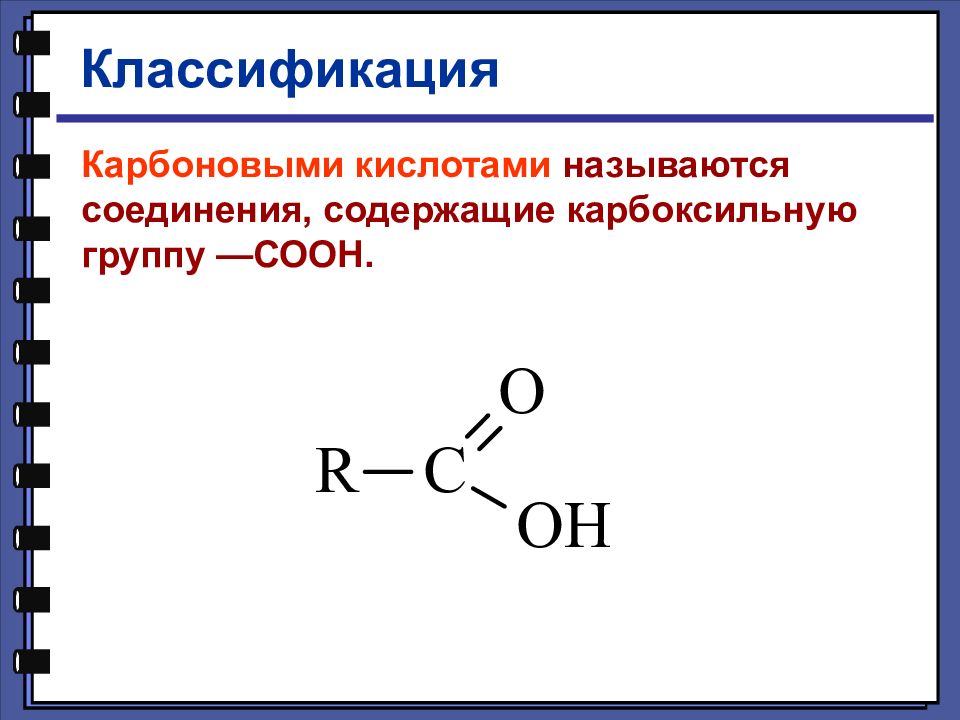
Классификация Карбоновыми кислотами называются соединения, содержащие карбоксильную группу —СООН.
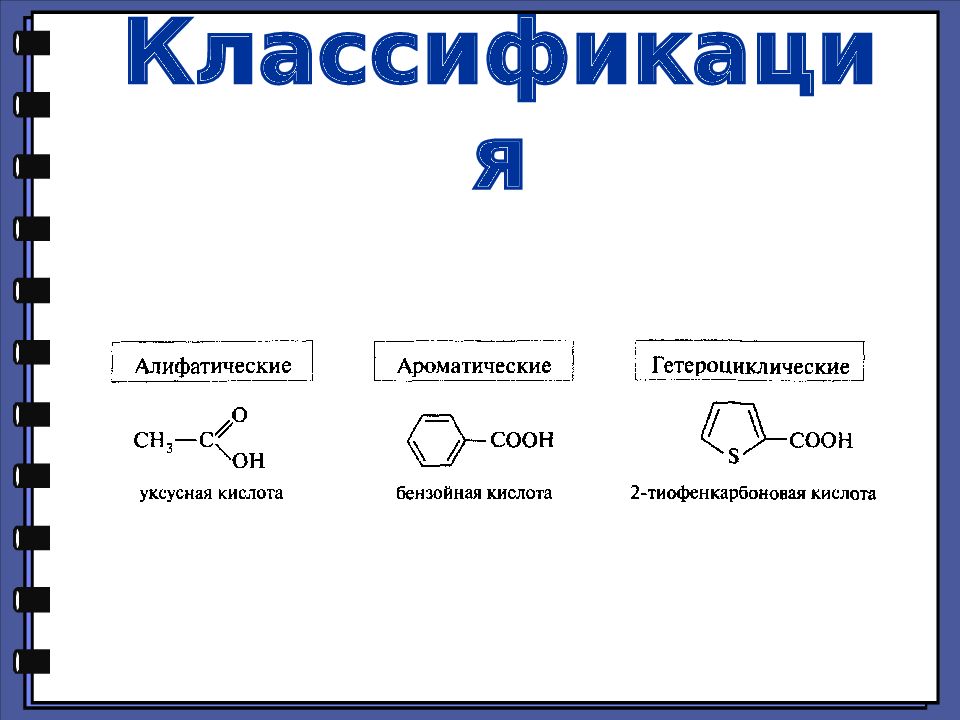
Слайд 3: Классификация
Слайд 4
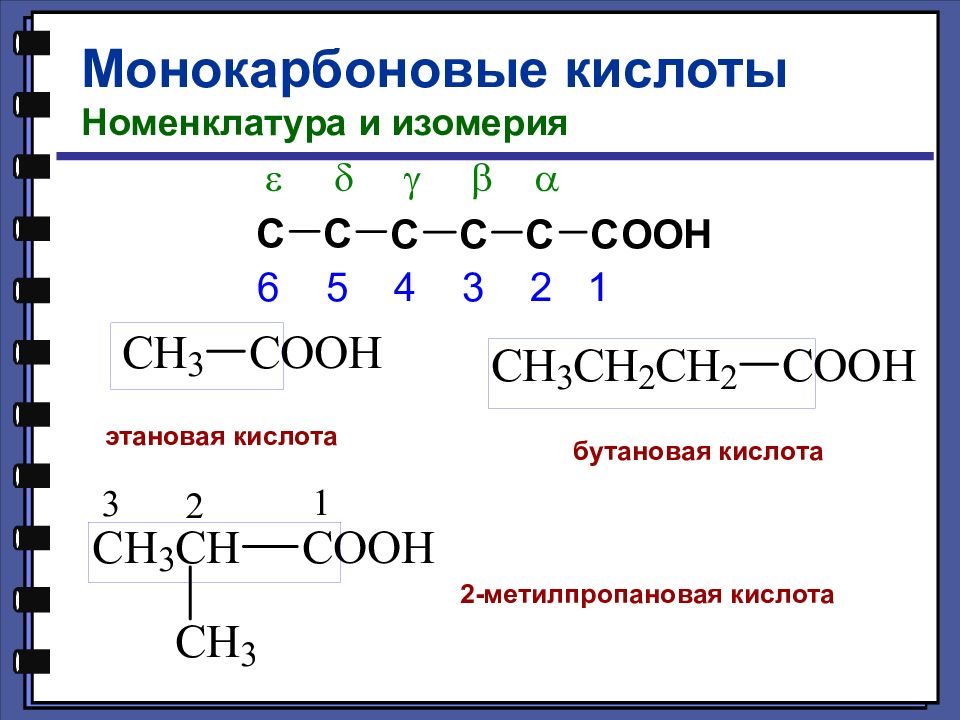
Монокарбоновые кислоты Номенклатура и изомерия этановая кислота бутановая кислота 2-метилпропановая кислота
Слайд 5
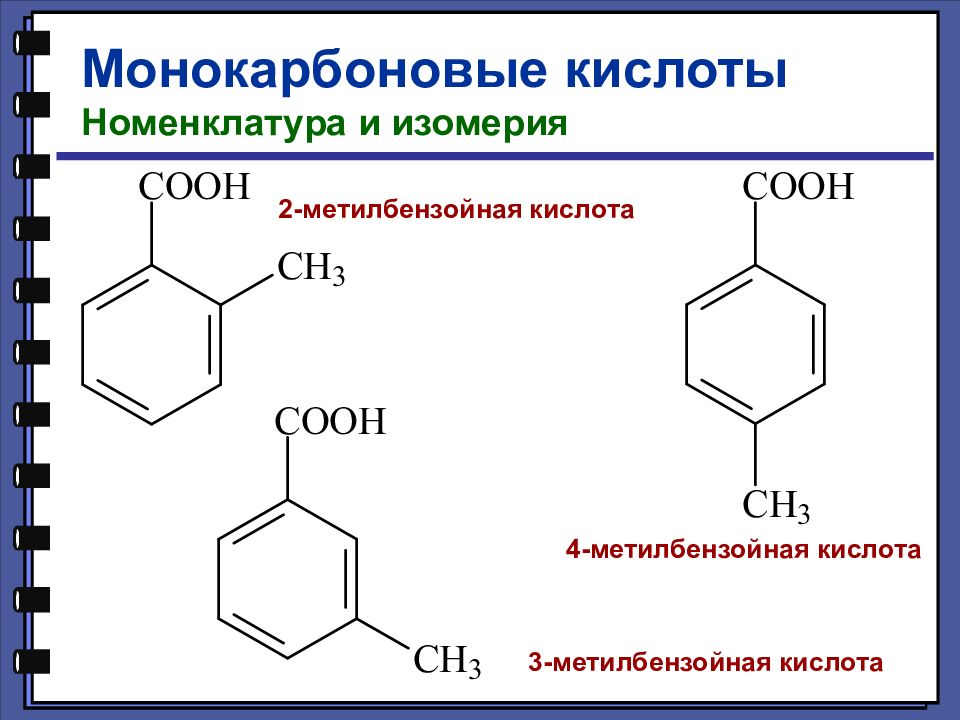
Монокарбоновые кислоты Номенклатура и изомерия 2-метилбензойная кислота 3-метилбензойная кислота 4-метилбензойная кислота
Слайд 6
Монокарбоновые кислоты Номенклатура и изомерия Систематические и тривиальные названия монокарбоновых кислот С 1 -С 10 Формула Систематическое название Тривиальное название HCOOH метановая кислота муравьиная кислота CH 3 COOH этановая кислота уксусная кислота CH 3 CH 2 COOH пропановая кислота пропионовая кислота CH 3 (CH 2 ) 2 COOH бутановая кислота масляная кислота CH 3 (CH 2 ) 3 COOH пентановая кислота валериановая кислота CH 3 (CH 2 ) 4 COOH гексановая кислота капроновая кислота CH 3 (CH 2 ) 5 COOH гептановая кислота энантовая кислота CH 3 (CH 2 ) 6 COOH октановая кислота каприловая кислота CH 3 (CH 2 ) 7 COOH нонановая кислота пеларгоновая кислота CH 3 (CH 2 ) 8 COOH декановая кислота каприновая кислота
Слайд 8
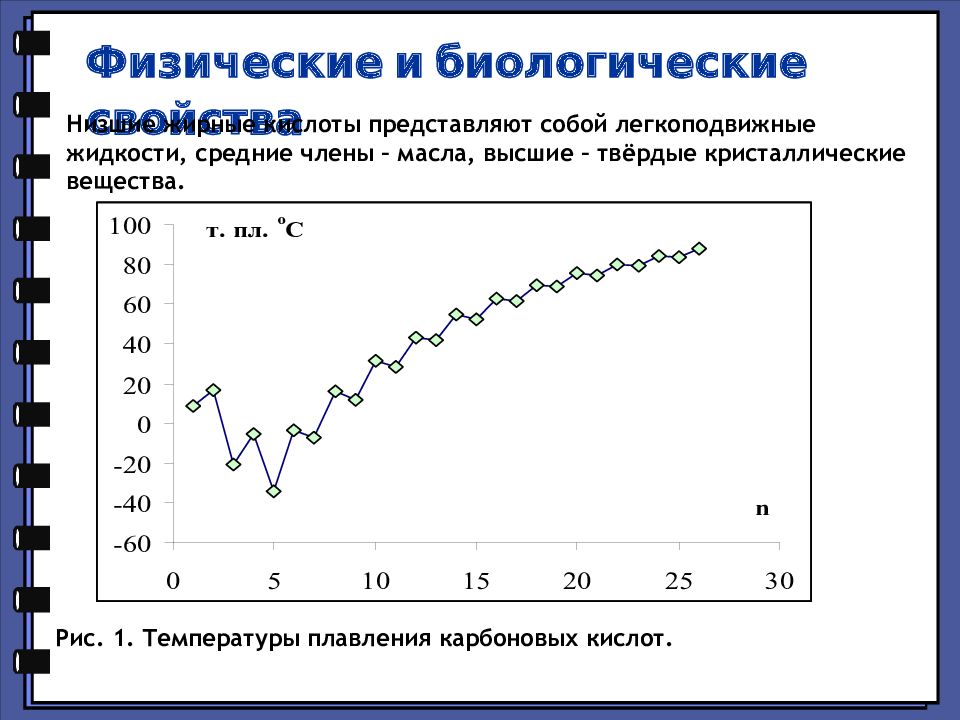
Физические и биологические свойства Низшие жирные кислоты представляют собой легкоподвижные жидкости, средние члены – масла, высшие – твёрдые кристаллические вещества. Рис. 1. Температуры плавления карбоновых кислот.
Слайд 10
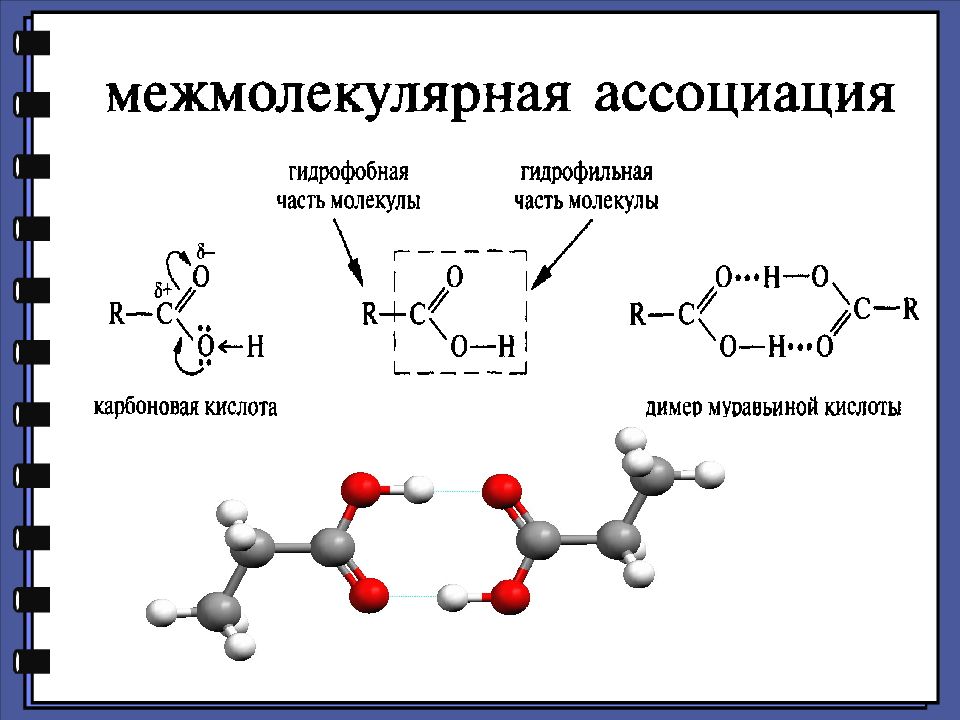
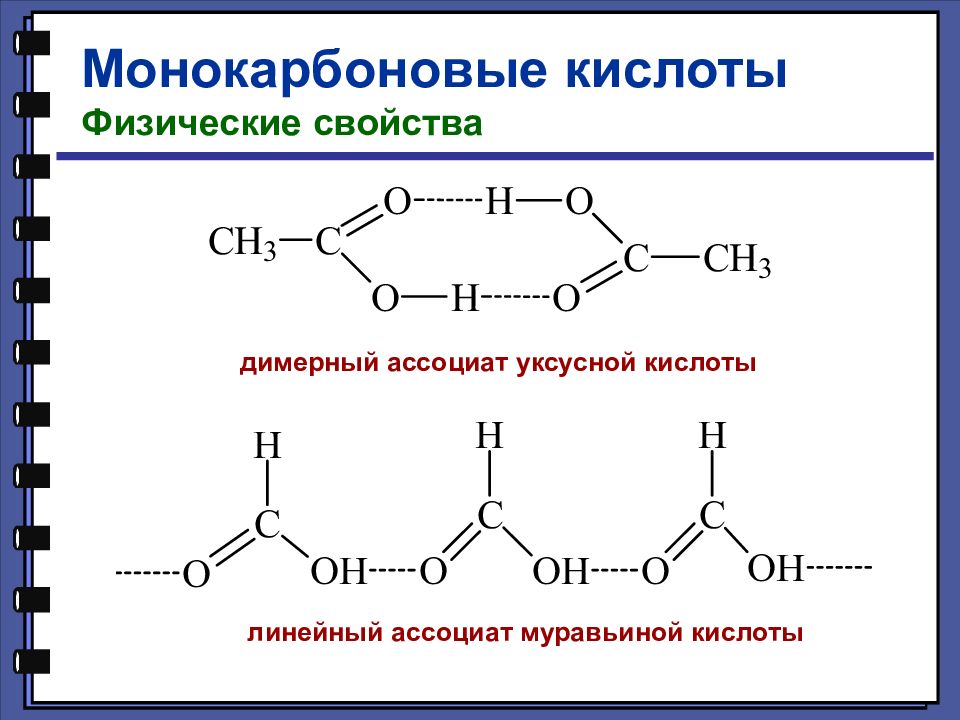
Монокарбоновые кислоты Физические свойства димерный ассоциат уксусной кислоты линейный ассоциат муравьиной кислоты
Слайд 11
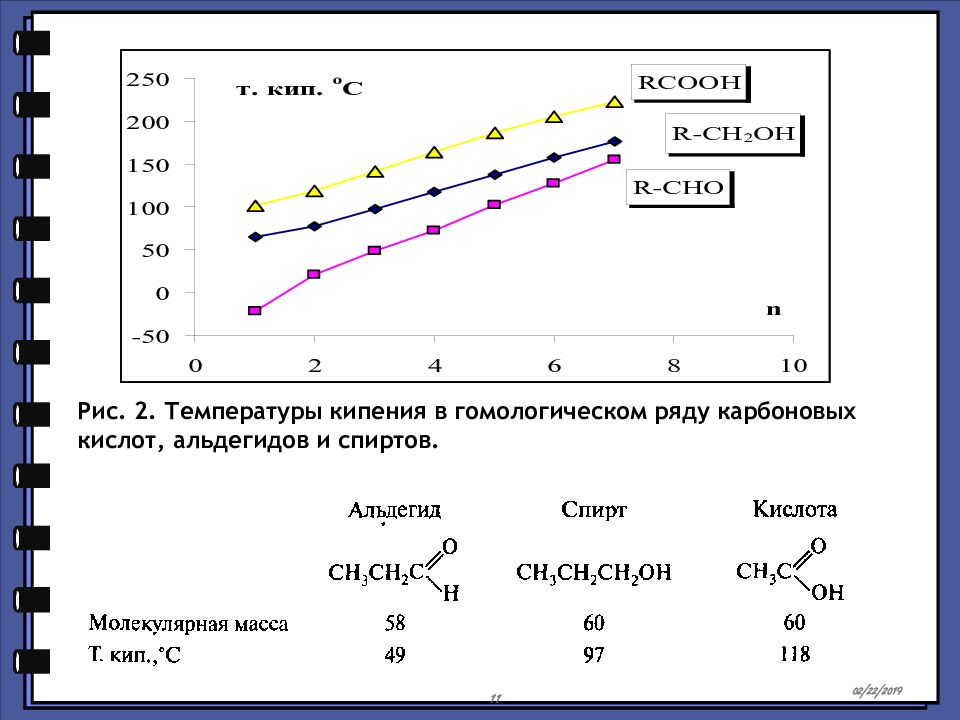
Рис. 2. Температуры кипения в гомологическом ряду карбоновых кислот, альдегидов и спиртов. 15.02.2019 11
Слайд 12
15.02.2019 12 Первые члены гомологического ряда карбоновых кислот обладают резким запахом, средние – прогорклым, неприятным, например, масляная кислота пахнет потом, высшие карбоновые кислоты вследствие нелетучести лишены запаха. Карбоновые кислоты, как правило, не ядовиты, однако приём внутрь концентрированных растворов (например, уксусной эссенции) вызывает тяжёлые ожоги. Нежелательно попадание этих растворов на кожу и тем более внутрь.
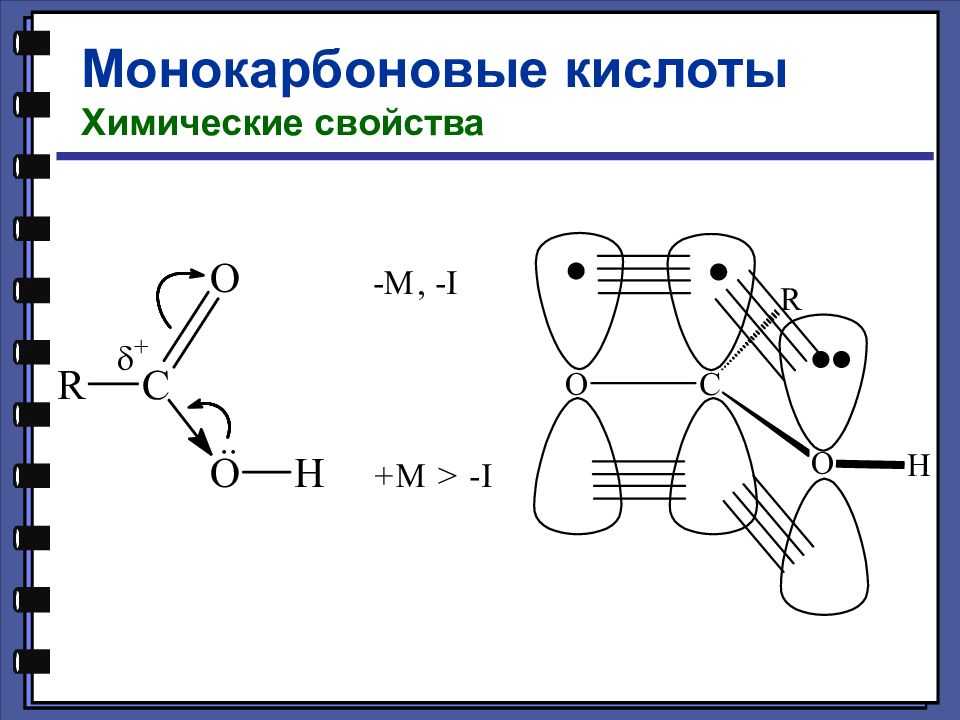
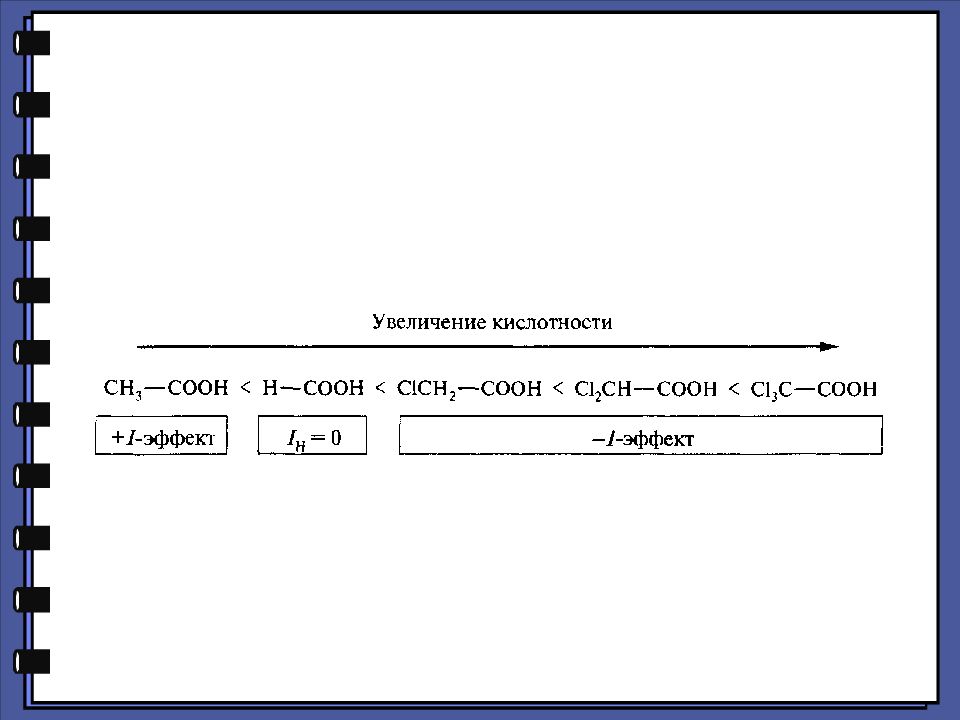
Слайд 17
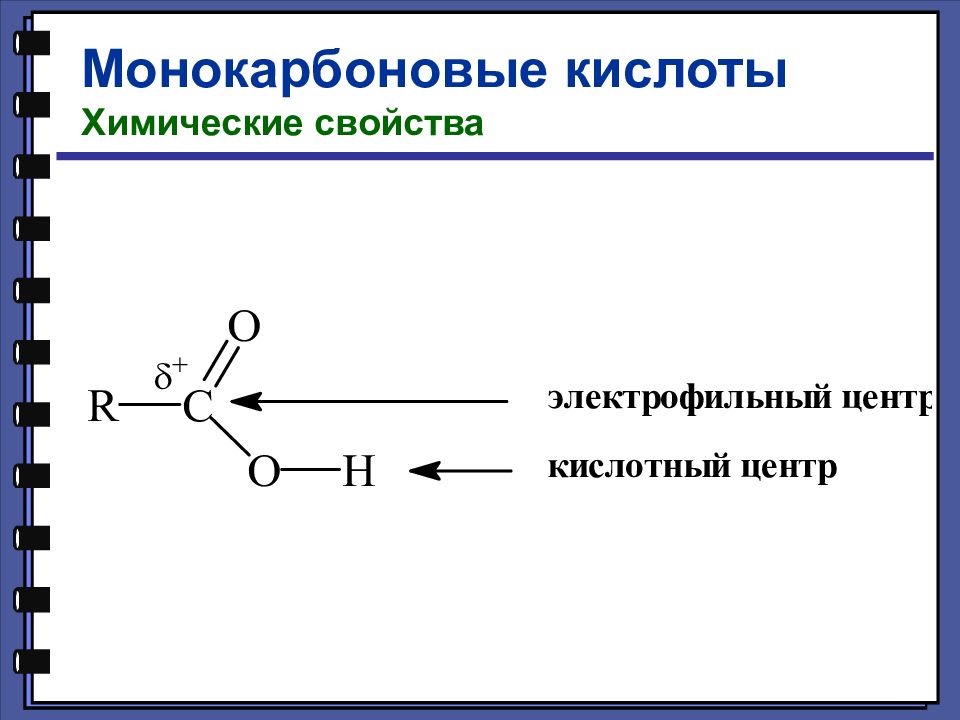
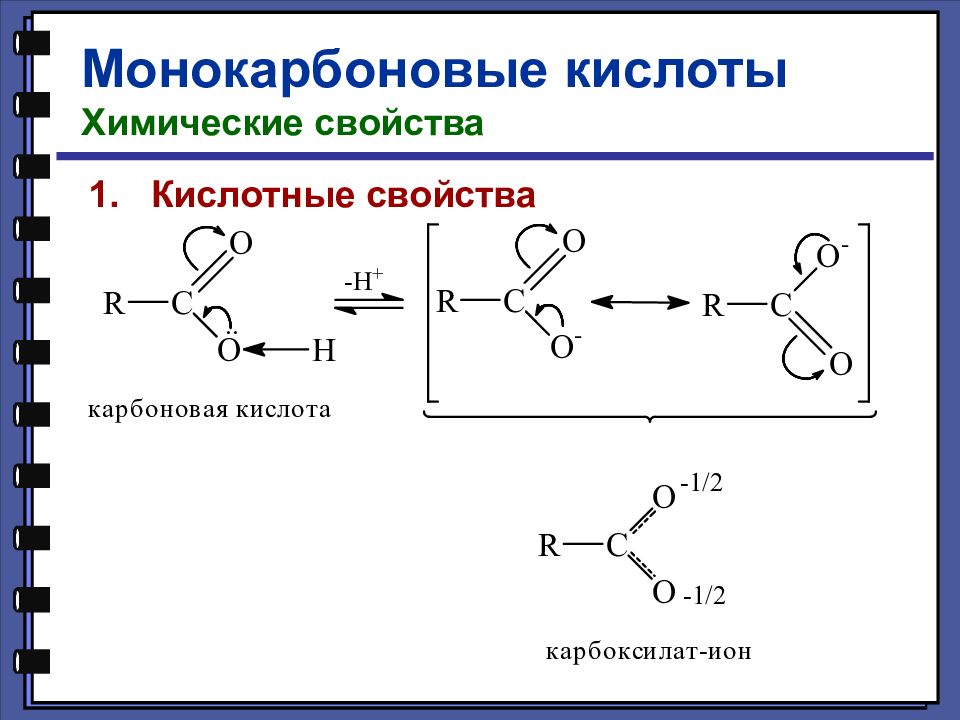
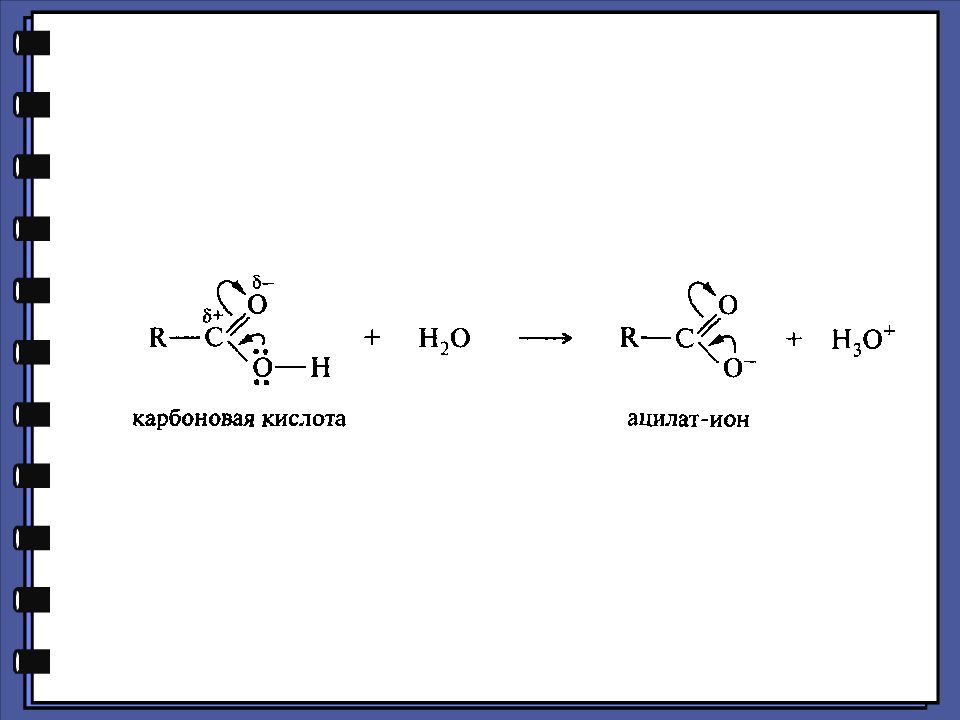
Монокарбоновые кислоты Химические свойства Кислотные свойства уксусная кислота 4,76 монохлоруксусная кислота 2,85 дихлоруксусная кислота 1,25 трихлоруксусная кислота 0,66 pKa
Слайд 18
Монокарбоновые кислоты Химические свойства Кислотные свойства - хлормасляная кислота 2,84 pKa - хлормасляная кислота 4,06 - хлормасляная кислота 4,52 масляная кислота 4,82
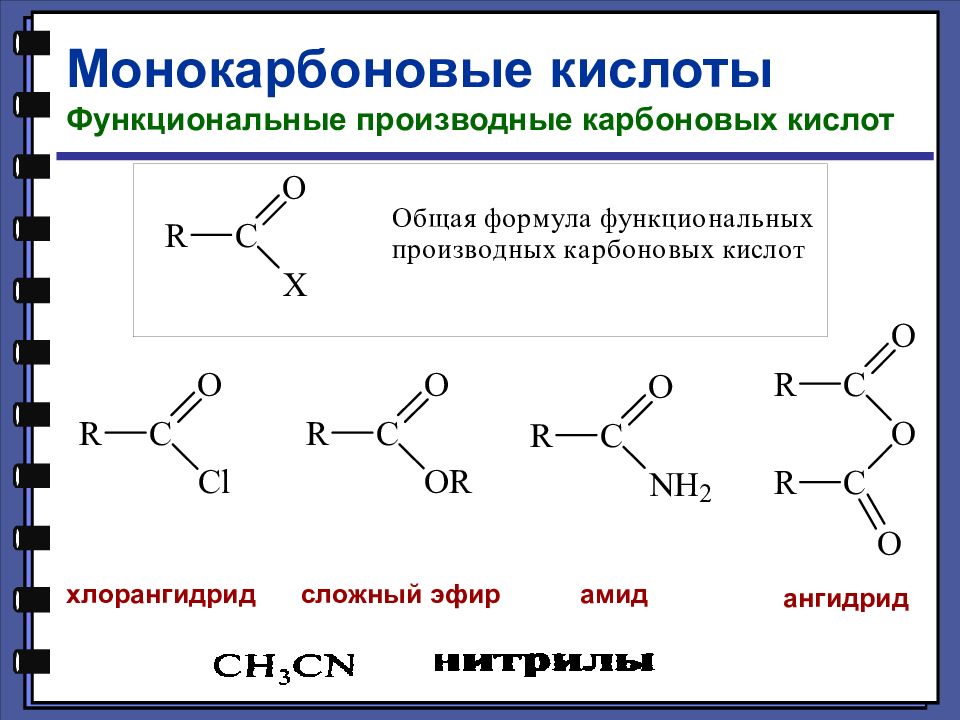
Слайд 20
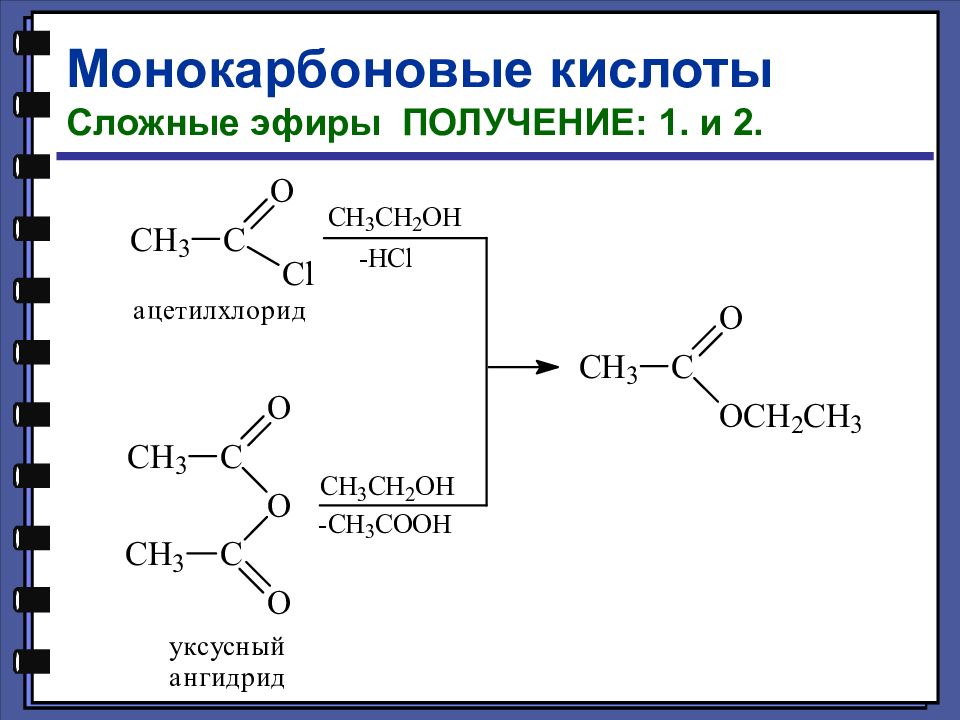
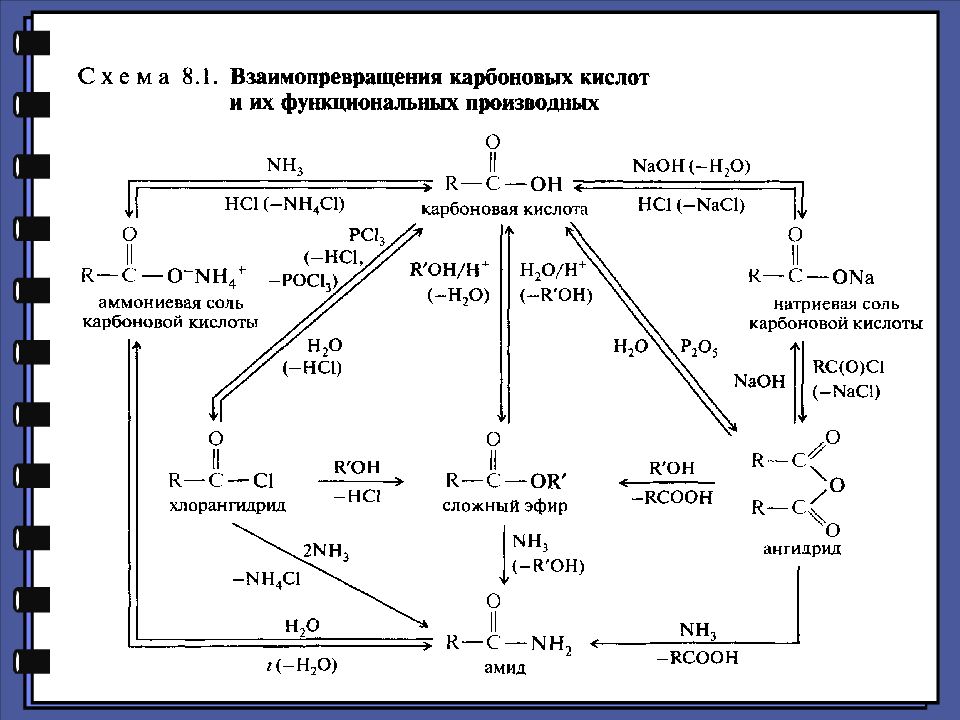
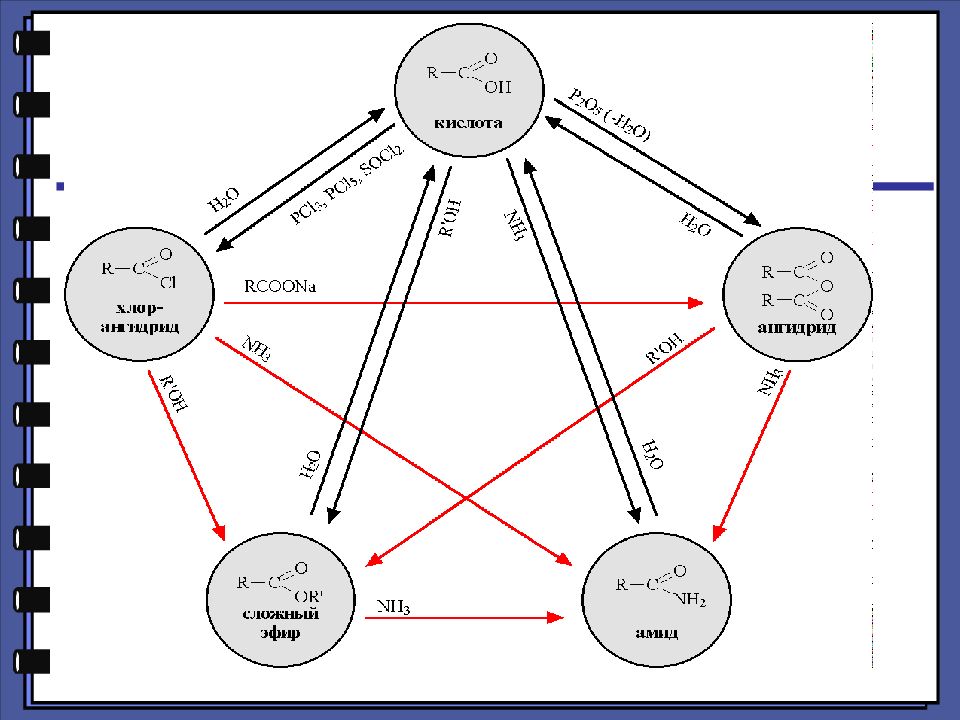
Монокарбоновые кислоты Функциональные производные карбоновых кислот хлорангидрид сложный эфир амид ангидрид
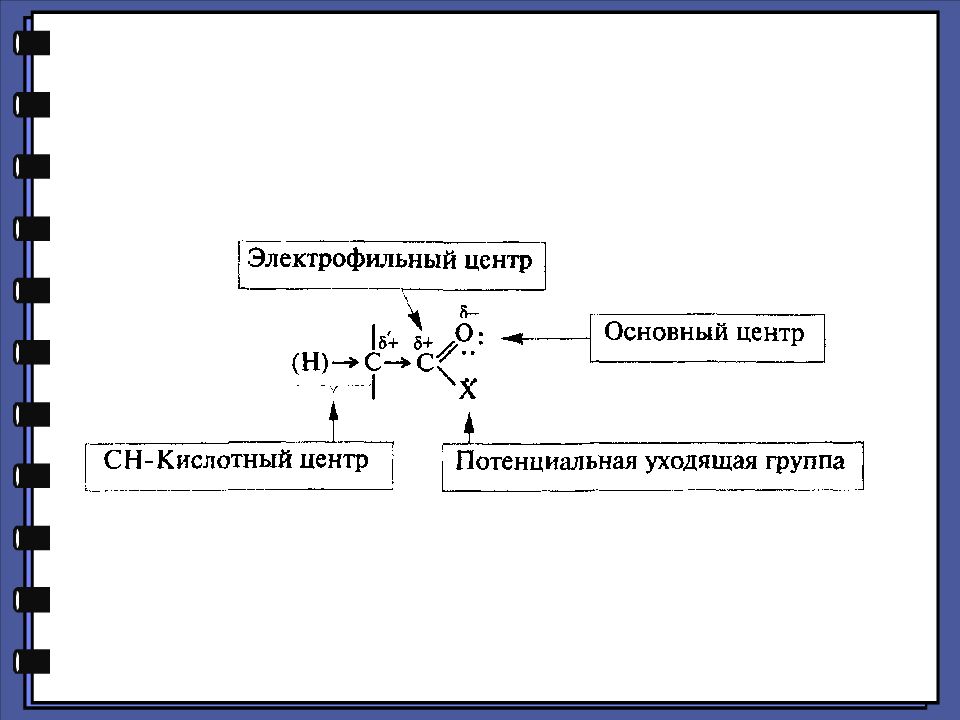
Слайд 22
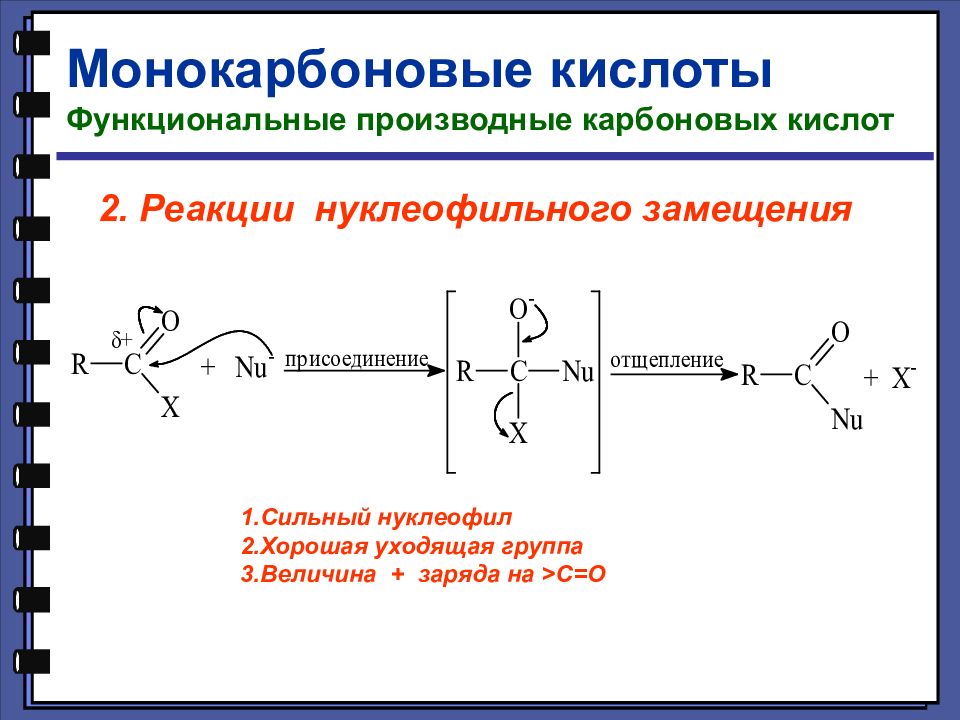
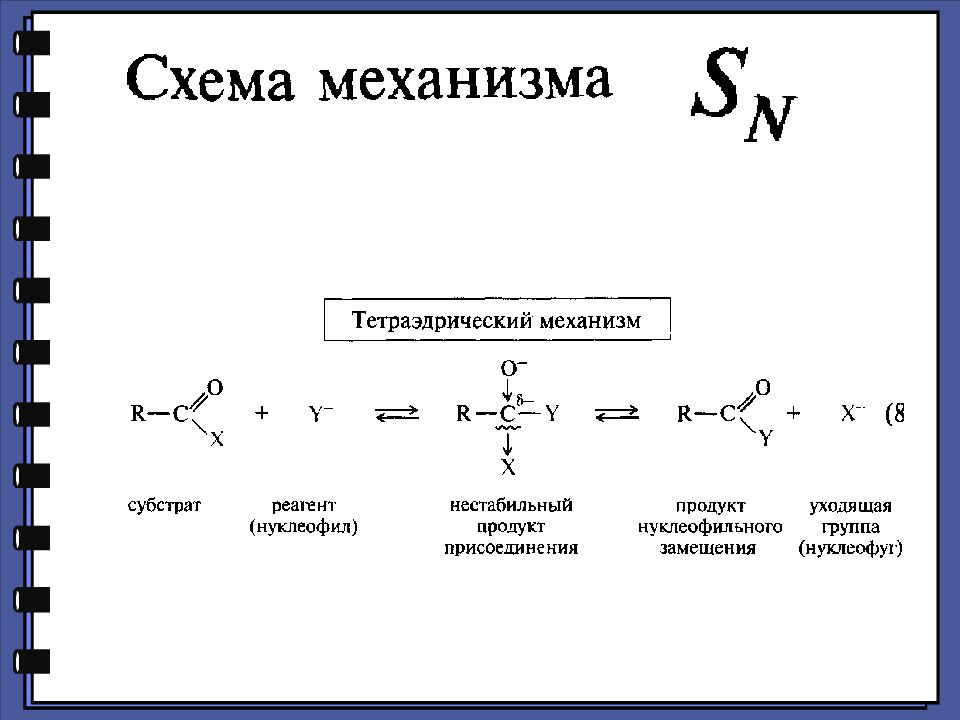
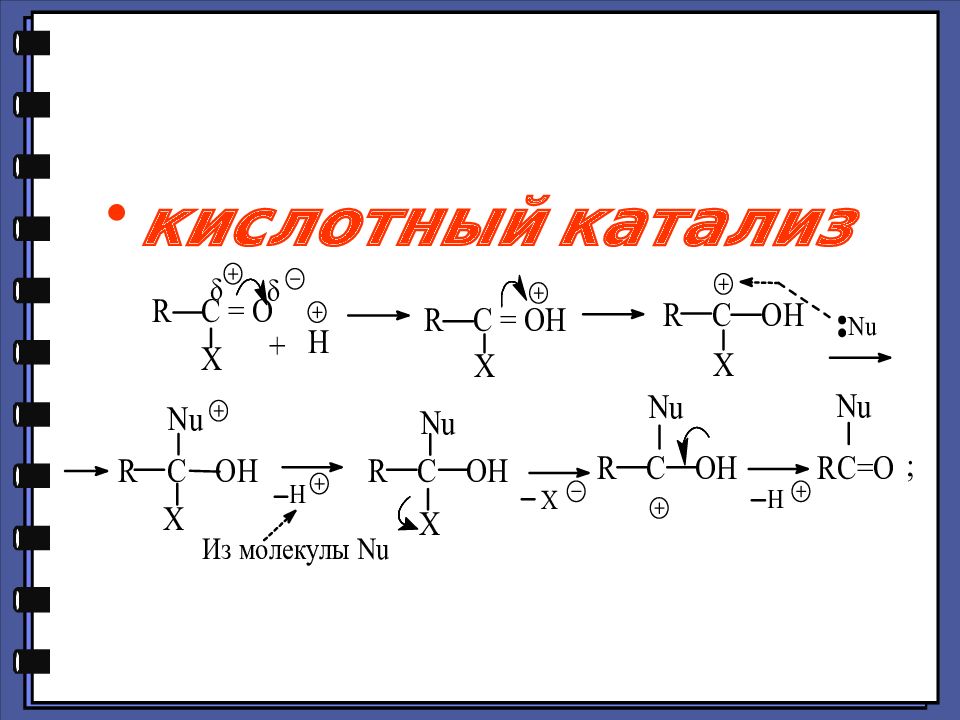
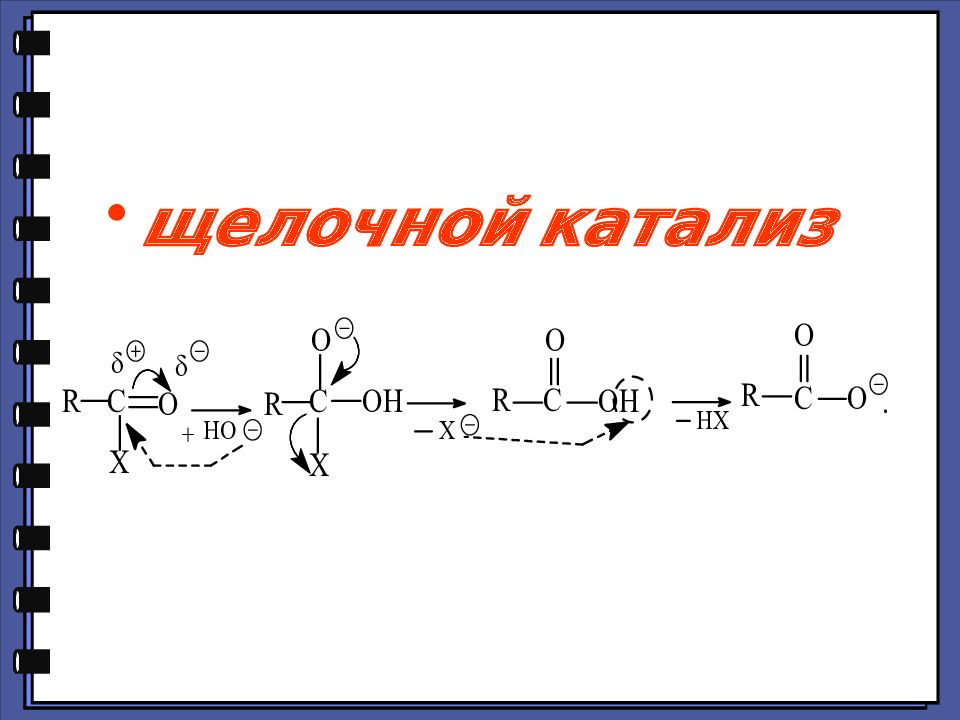
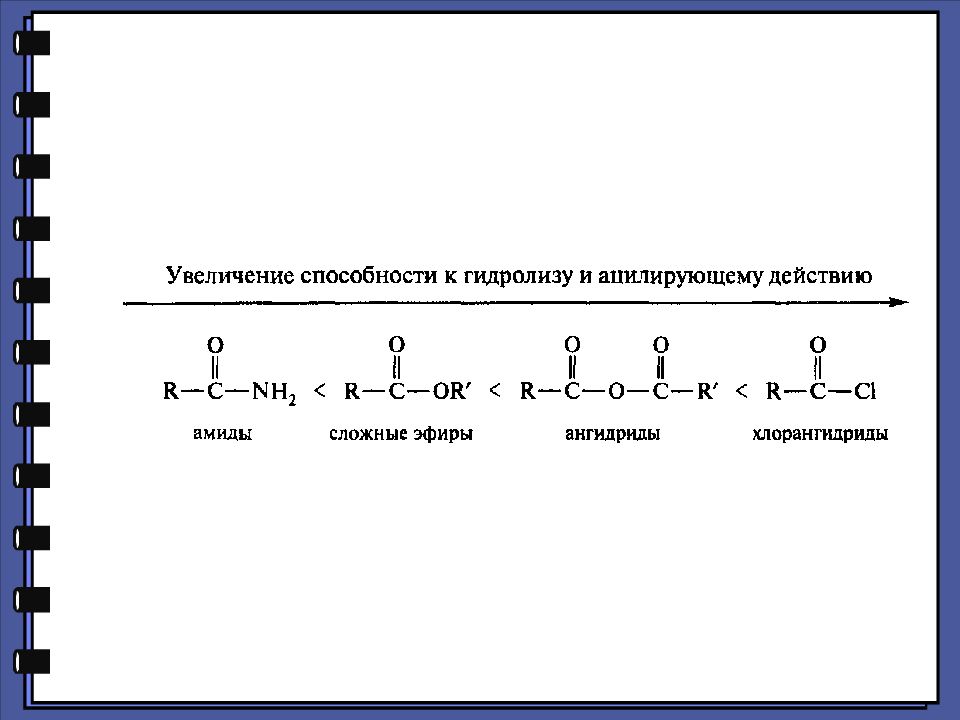
Монокарбоновые кислоты Функциональные производные карбоновых кислот 2. Реакции нуклеофильного замещения 1.Сильный нуклеофил 2.Хорошая уходящая группа 3.Величина + заряда на > С=О
Слайд 27
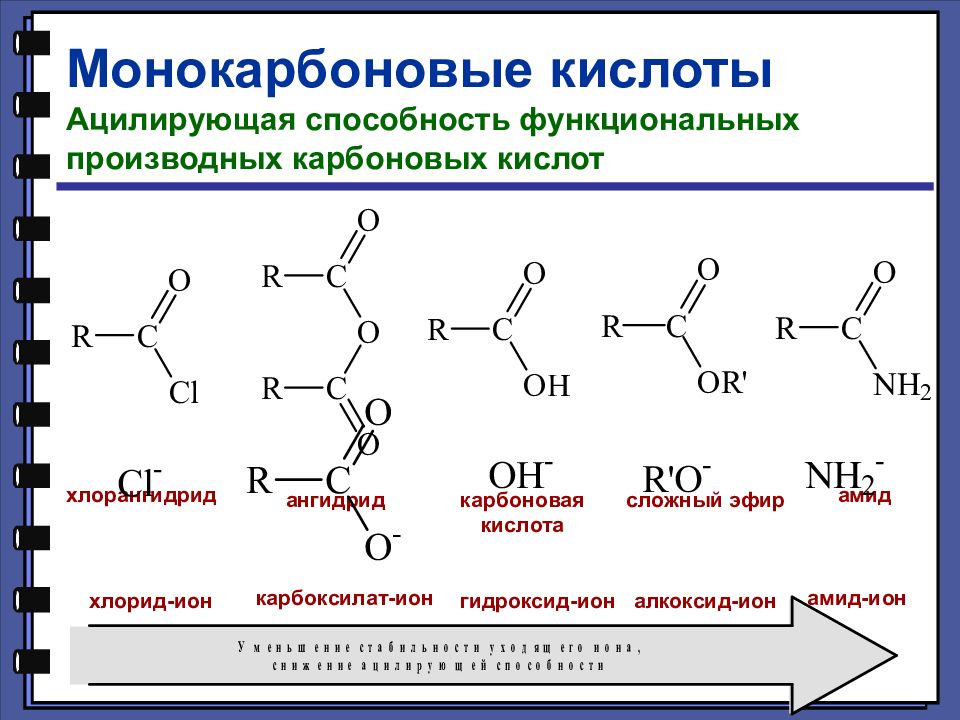
Монокарбоновые кислоты Ацилирующая способность функциональных производных карбоновых кислот хлорангидрид ангидрид карбоновая кислота сложный эфир амид хлорид-ион карбоксилат-ион гидроксид-ион алкоксид-ион амид-ион
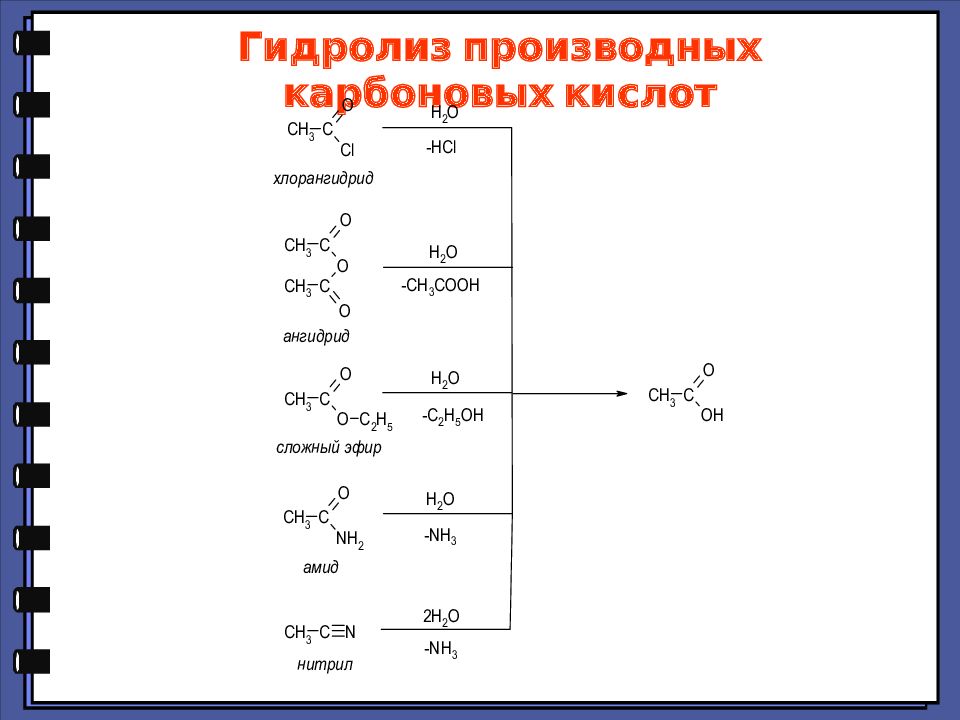
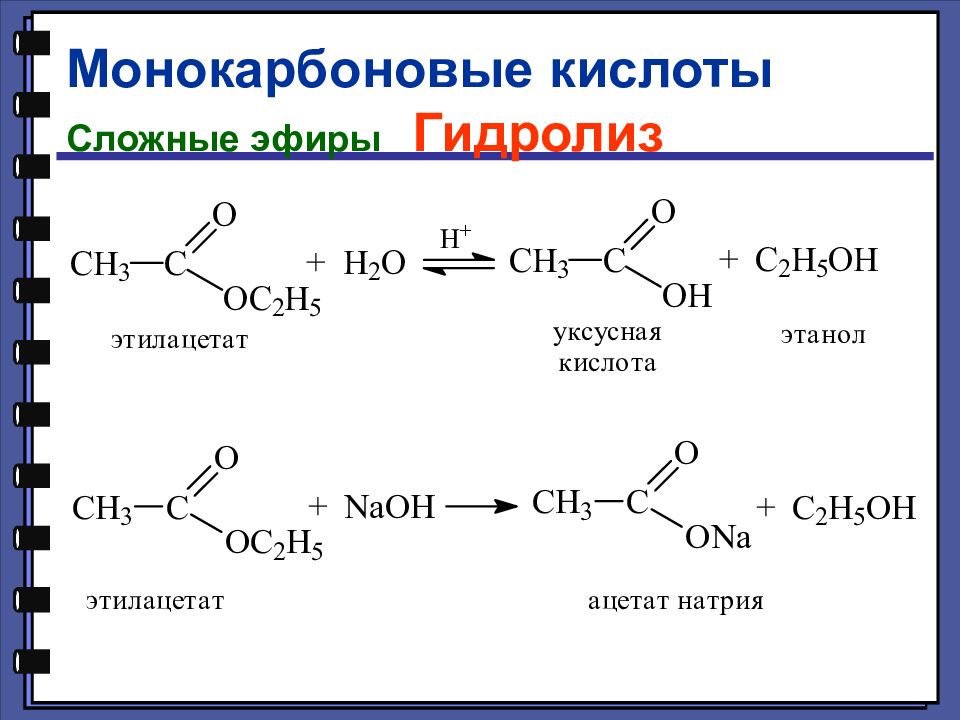
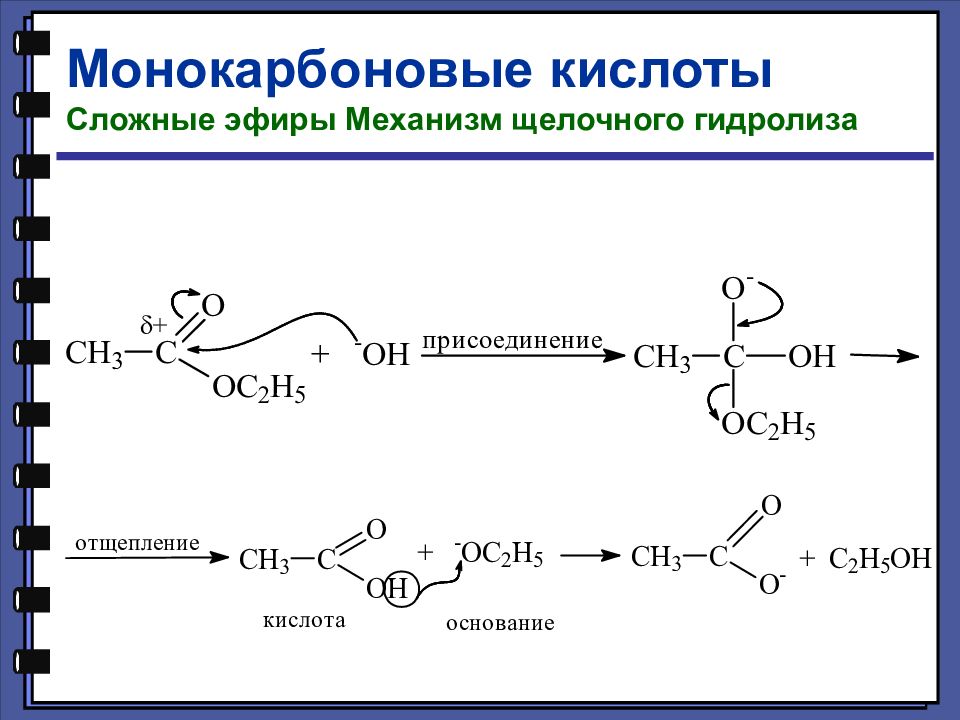
Слайд 28: Гидролиз производных карбоновых кислот
Слайд 29
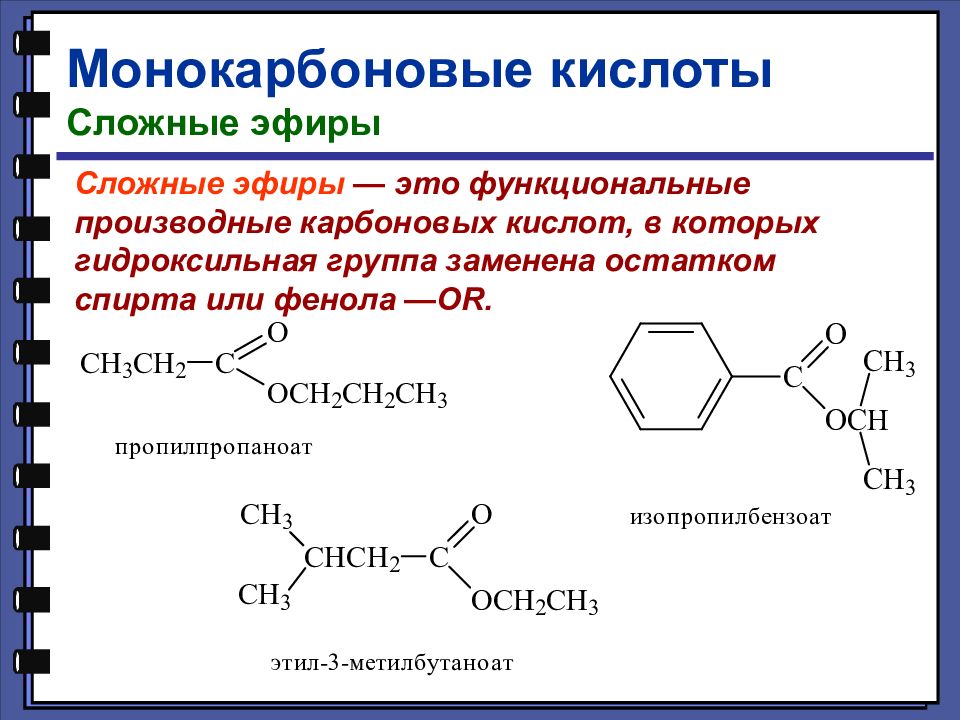
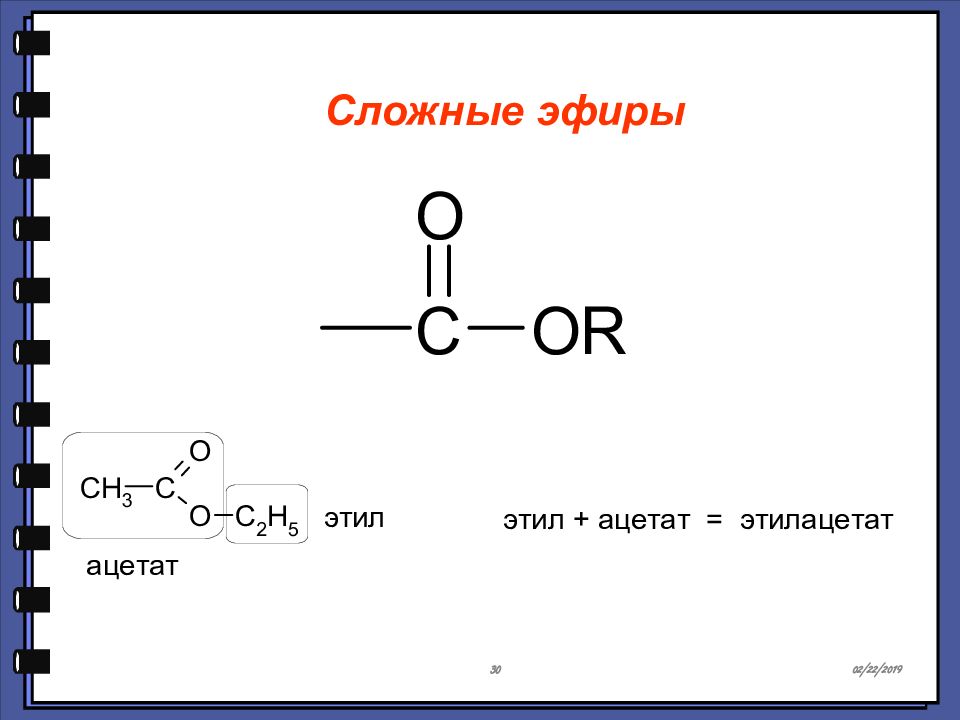
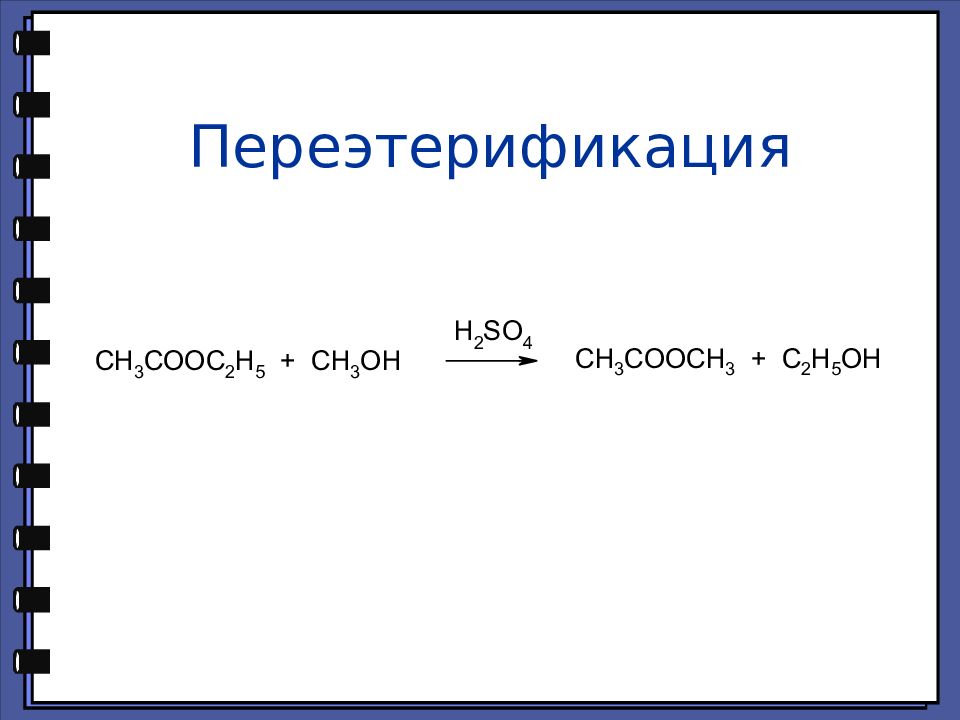
Монокарбоновые кислоты Сложные эфиры Сложные эфиры — это функциональные производные карбоновых кислот, в которых гидроксильная группа заменена остатком спирта или фенола — OR.
Слайд 32
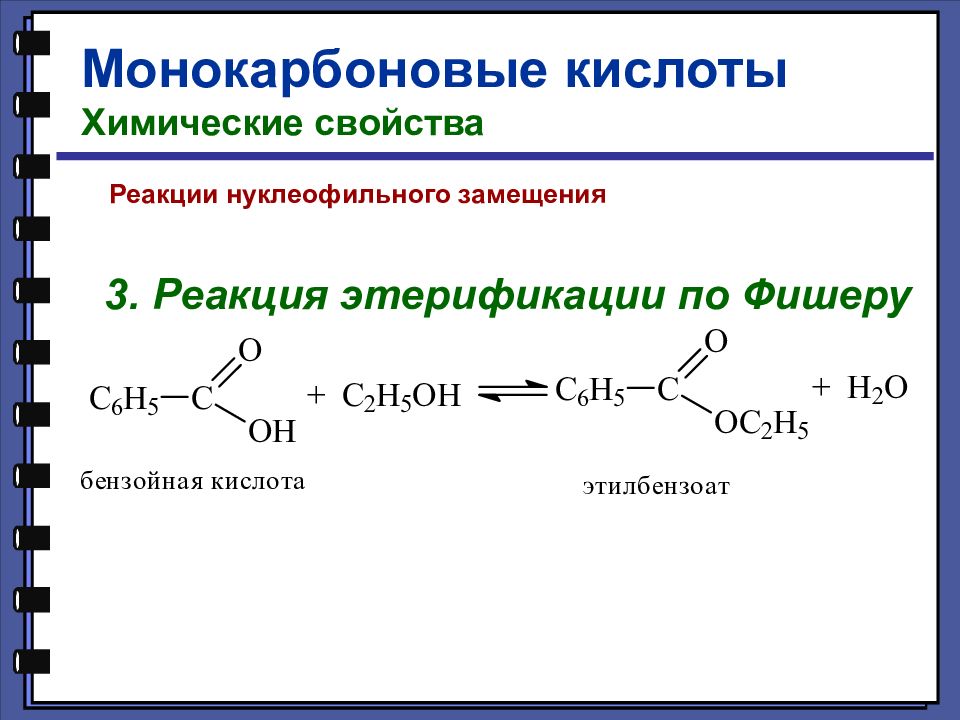
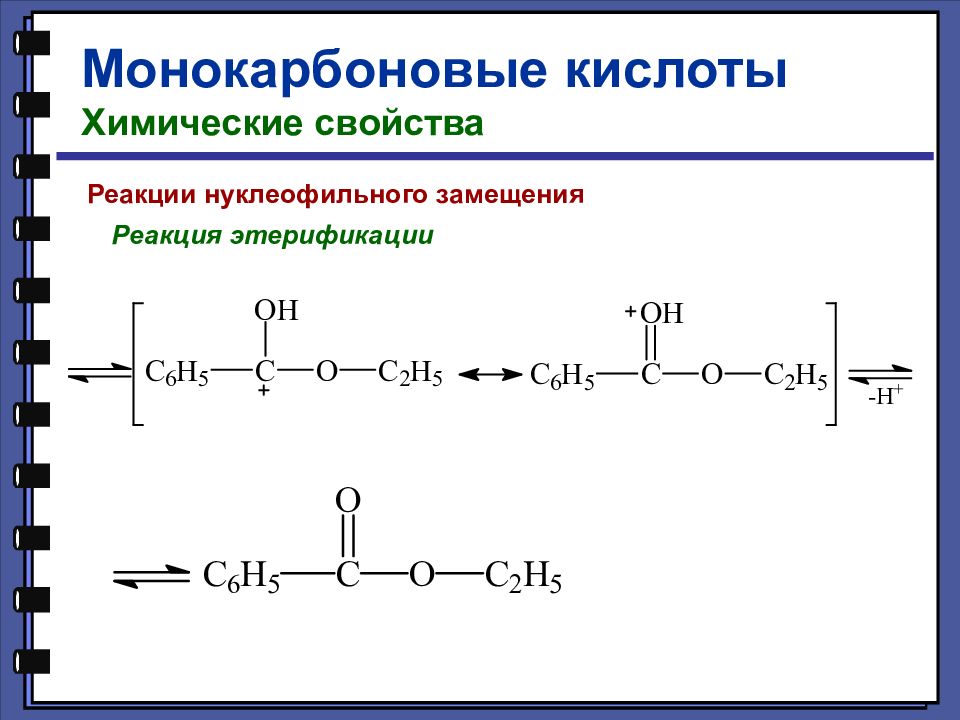
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения 3. Реакция этерификации по Фишеру
Слайд 33
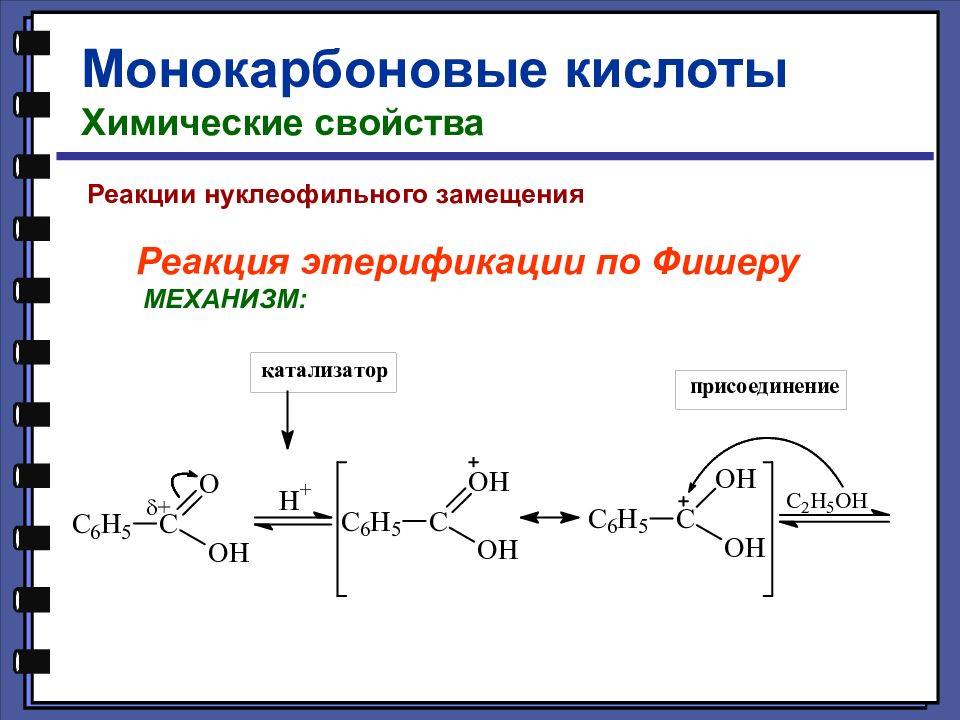
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Реакция этерификации по Фишеру МЕХАНИЗМ:
Слайд 34
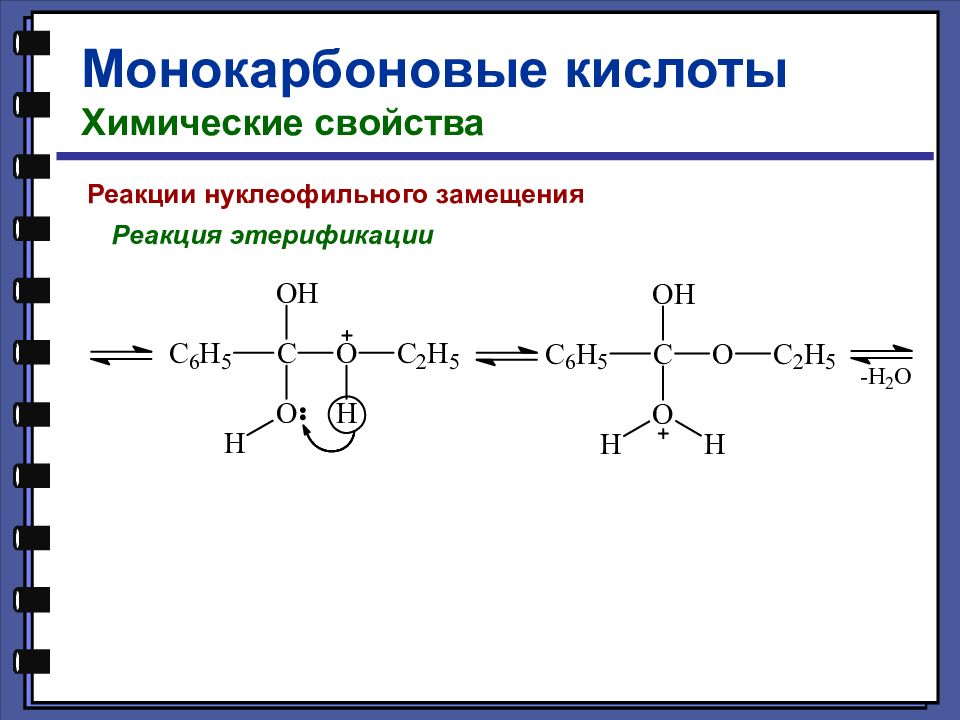
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Реакция этерификации
Слайд 35
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Реакция этерификации
Слайд 40
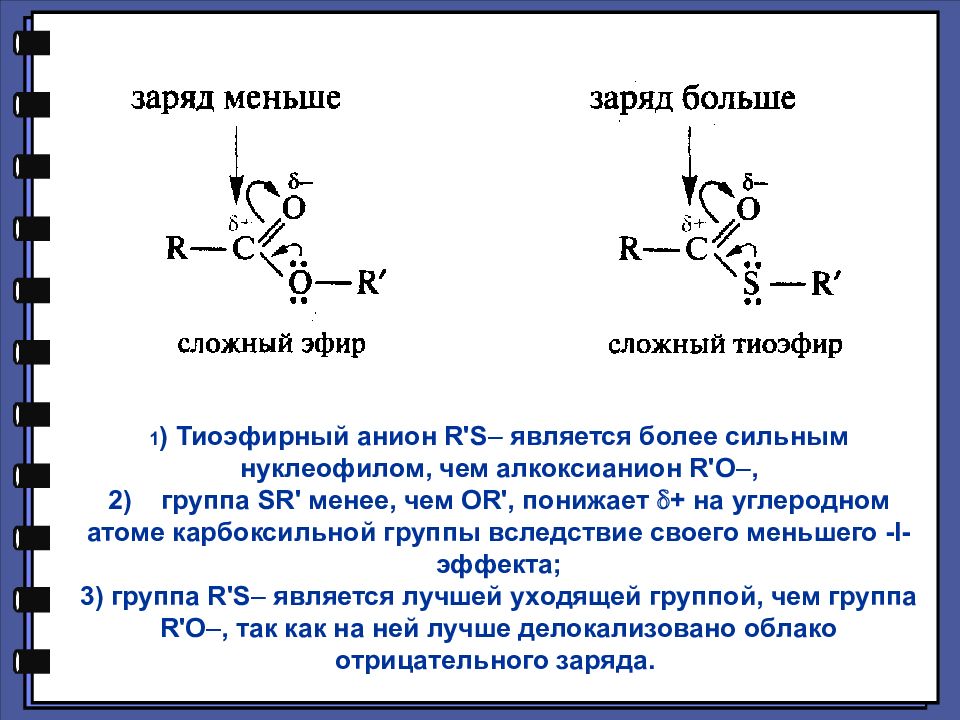
1 ) Тиоэфирный анион R ' S является более сильным нуклеофилом, чем алкоксианион R ' O, 2) группа SR ' менее, чем О R ', понижает + на углеродном атоме карбоксильной группы вследствие своего меньшего - I -эффекта; 3) группа R ' S является лучшей уходящей группой, чем группа R ' O, так как на ней лучше делокализовано облако отрицательного заряда.
Слайд 41
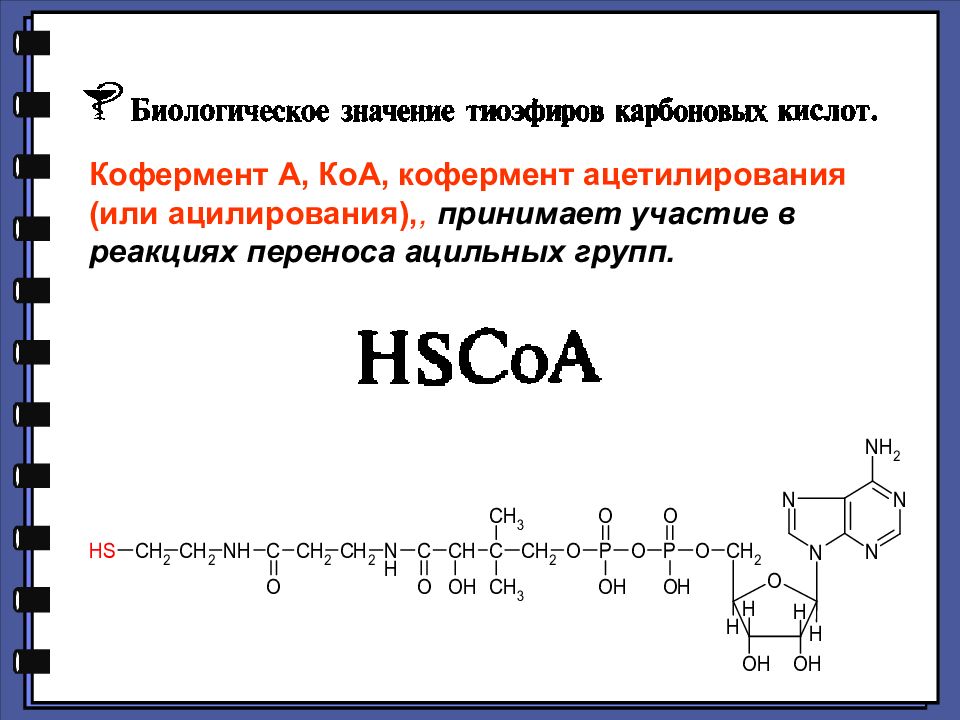
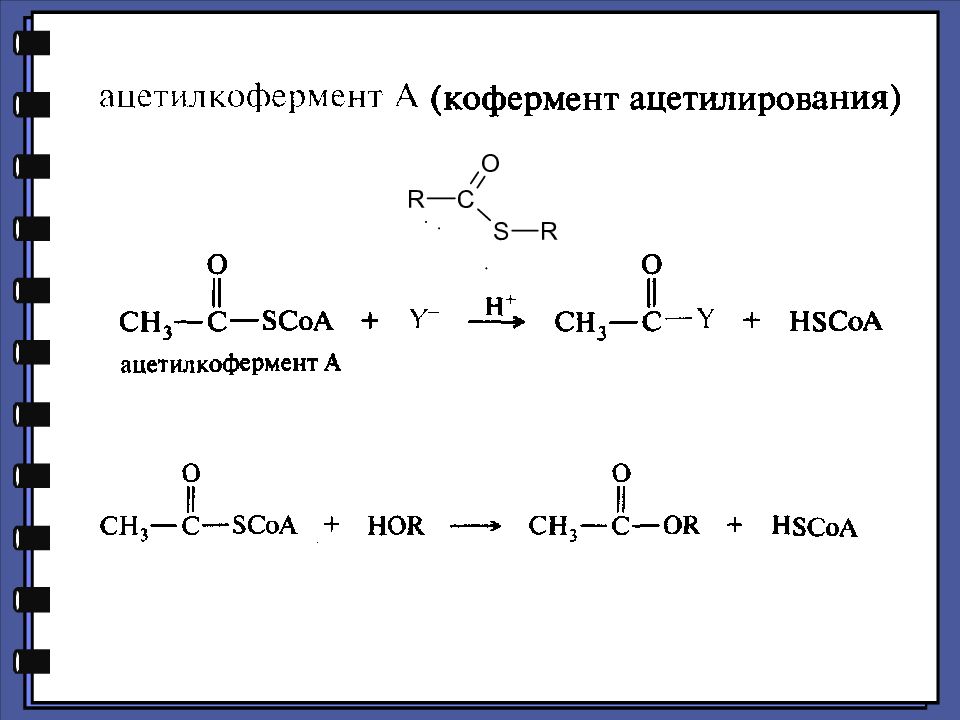
Кофермент А, КоА, кофермент ацетилирования (или ацилирования),, принимает участие в реакциях переноса ацильных групп.
Слайд 42
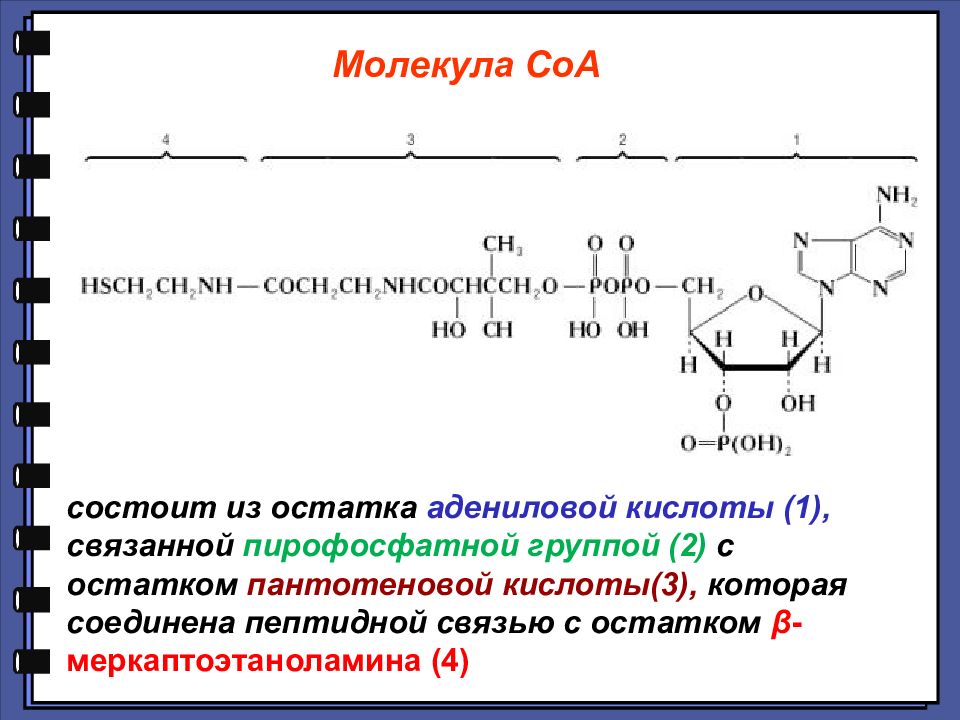
состоит из остатка адениловой кислоты (1), связанной пирофосфатной группой (2) с остатком пантотеновой кислоты(3), которая соединена пептидной связью с остатком β - меркаптоэтаноламина (4) Молекула СоА
Слайд 44
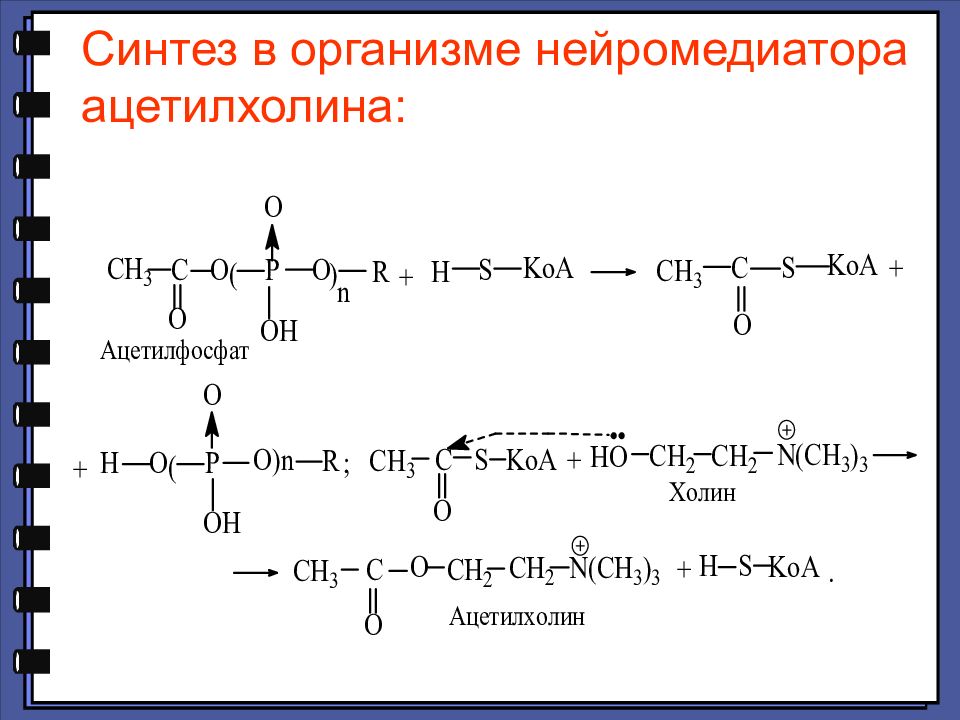
In vivo ацилирование происходит с помощью производного – ацил-КоА, который, в свою очередь может образовываться из свободной карбоновой кислоты и коэнзима А с участием АТФ
Слайд 47
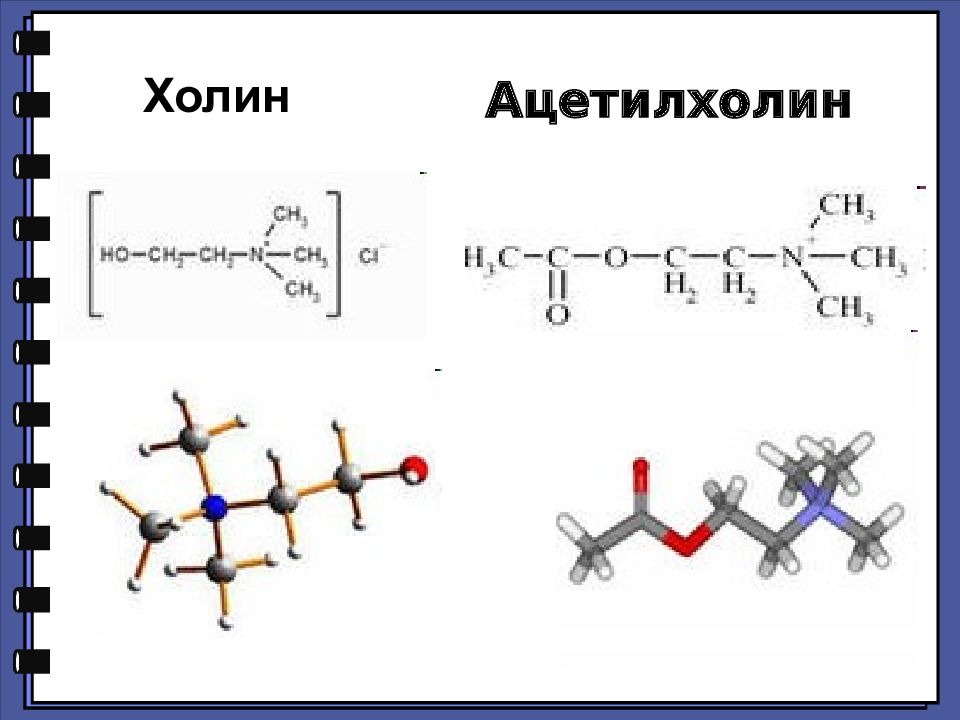
Ацетилхолину принадлежит важная роль как медиатору ЦНС. Он участвует в передаче импульсов в разных отделах мозга, при этом малые концентрации облегчают, а большие — тормозят синаптическую передачу. Изменения в обмене ацетилхолина могут привести к нарушению функций мозга. Недостаток его во многом определяет клиническую картину такого опасного нейродегенеративного заболевания, как болезнь Альцгеймера. Медиатор(-ы) (лат. mediator — посредник; син. нейромедиатор) — биологически активные вещества, выделяемые нервным окончанием и являющиеся посредниками в процессе синаптической передачи.
Слайд 48
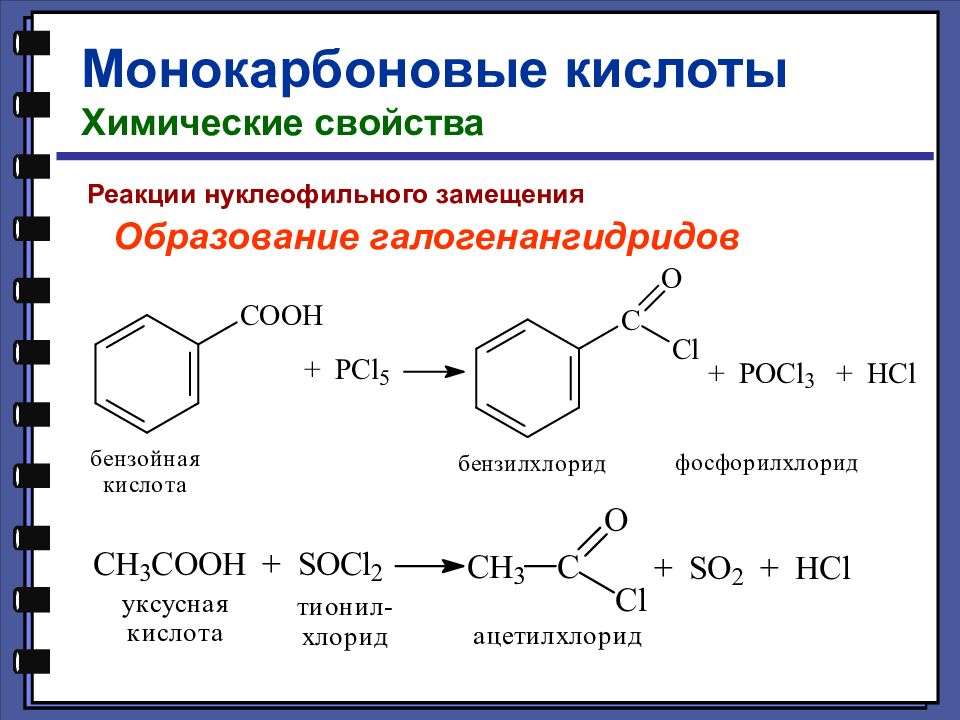
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Образование галогенангидридов
Слайд 49
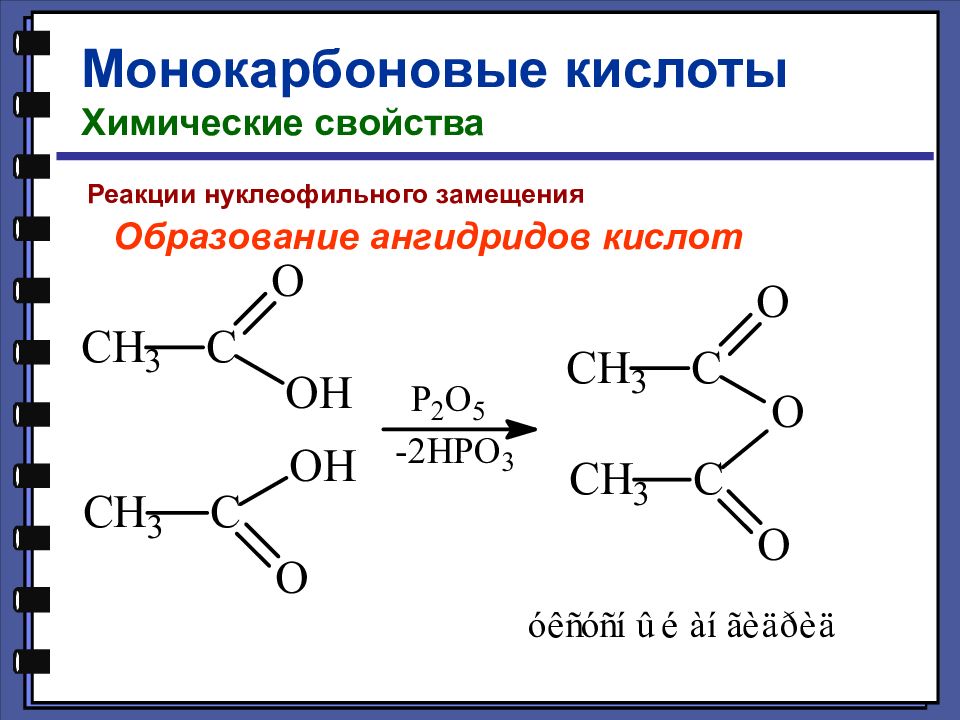
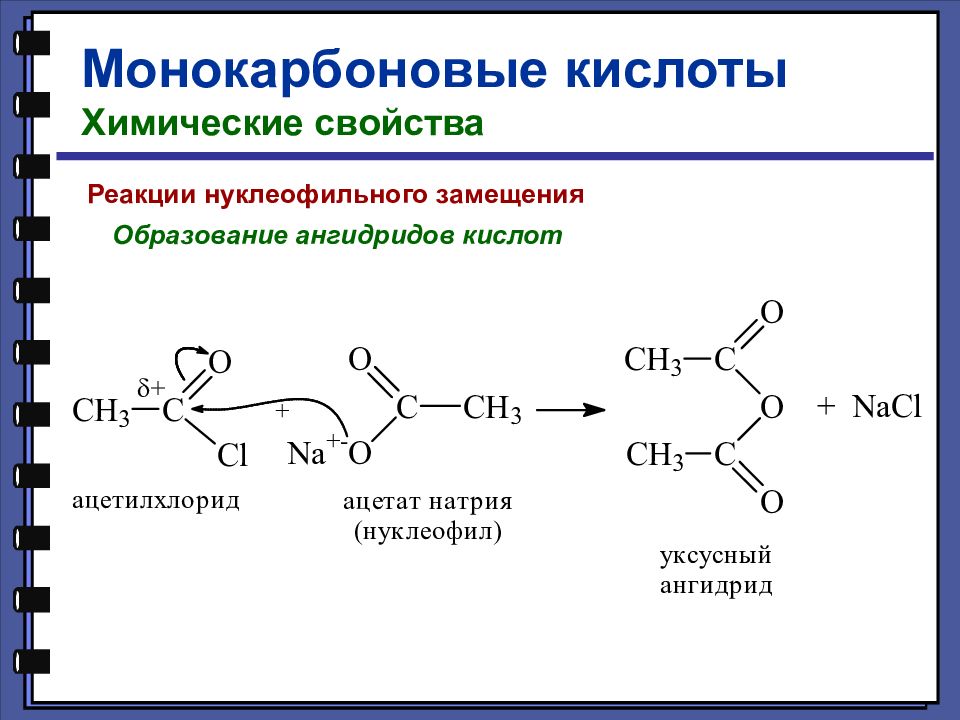
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Образование ангидридов кислот
Слайд 50
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Образование ангидридов кислот
Слайд 51
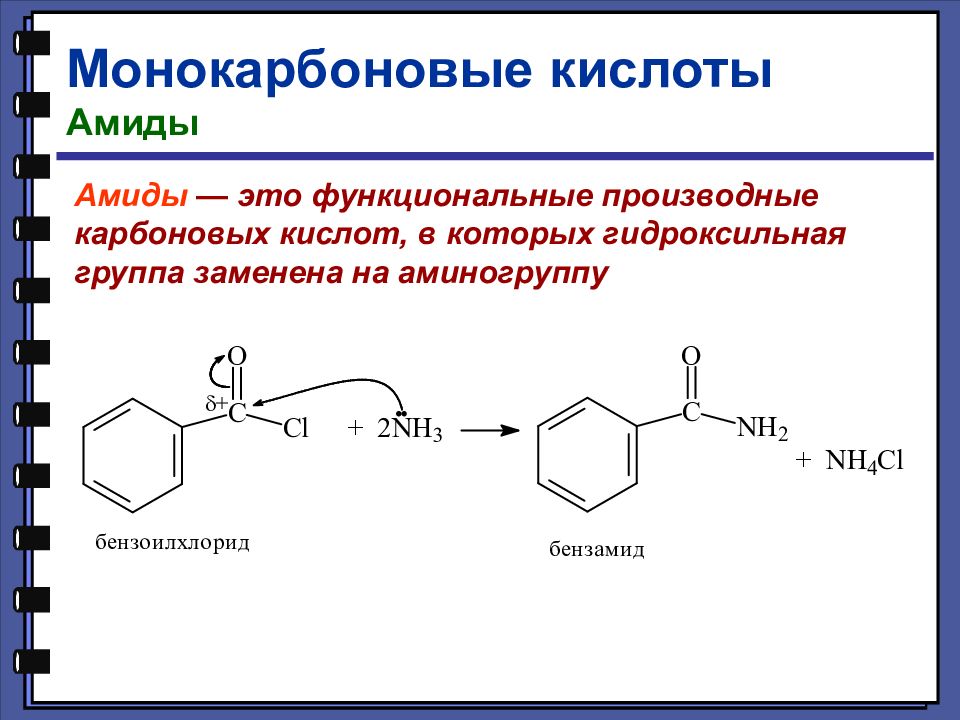
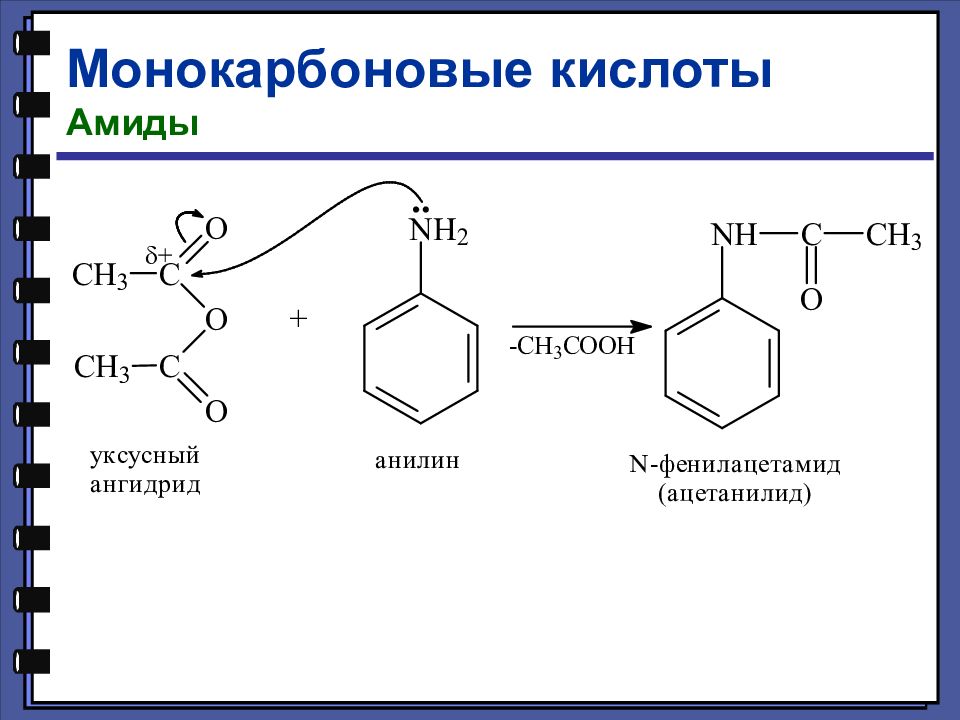
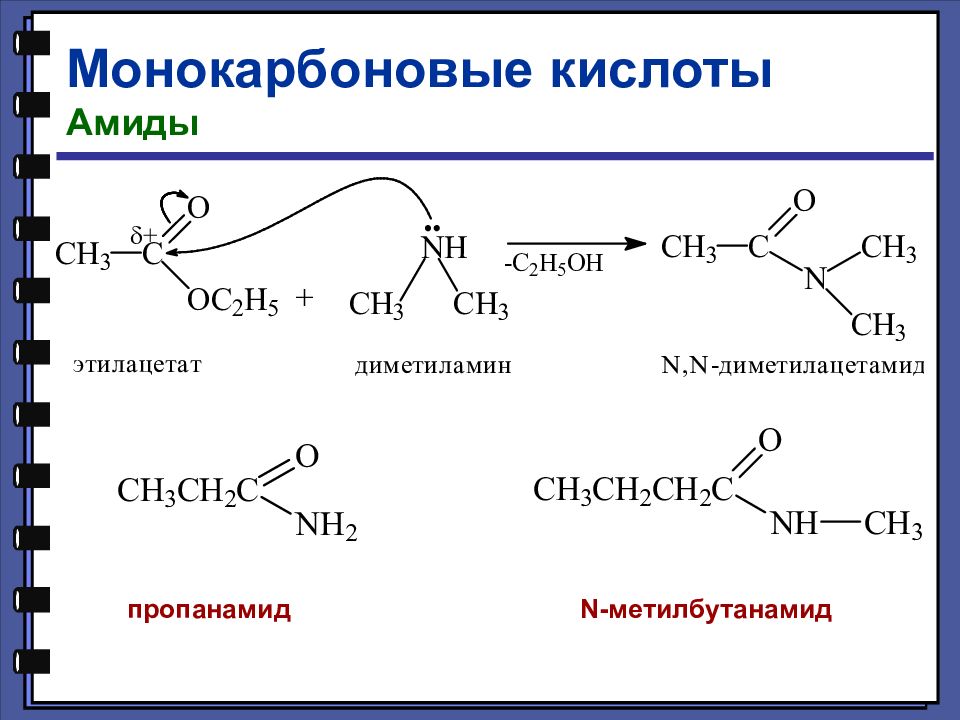
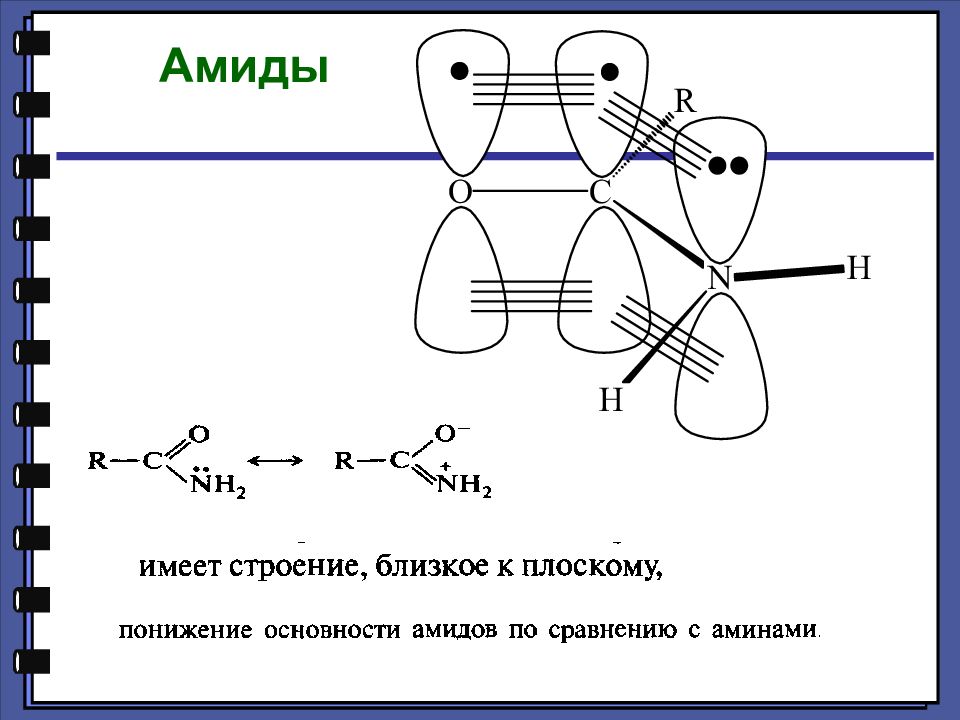
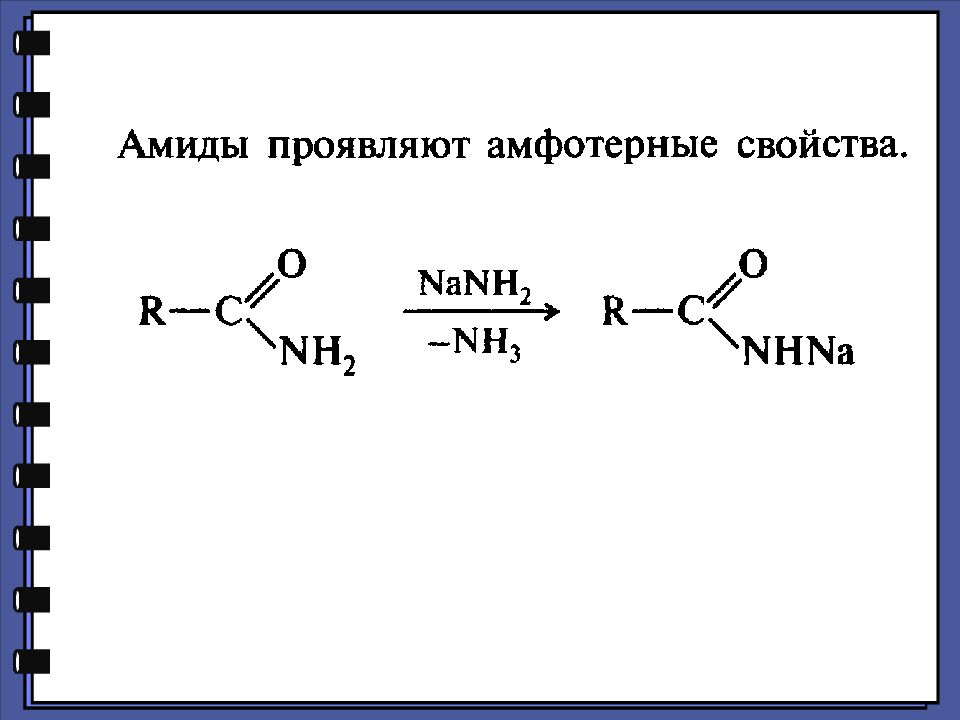
Монокарбоновые кислоты Амиды Амиды — это функциональные производные карбоновых кислот, в которых гидроксильная группа заменена на аминогруппу
Слайд 52
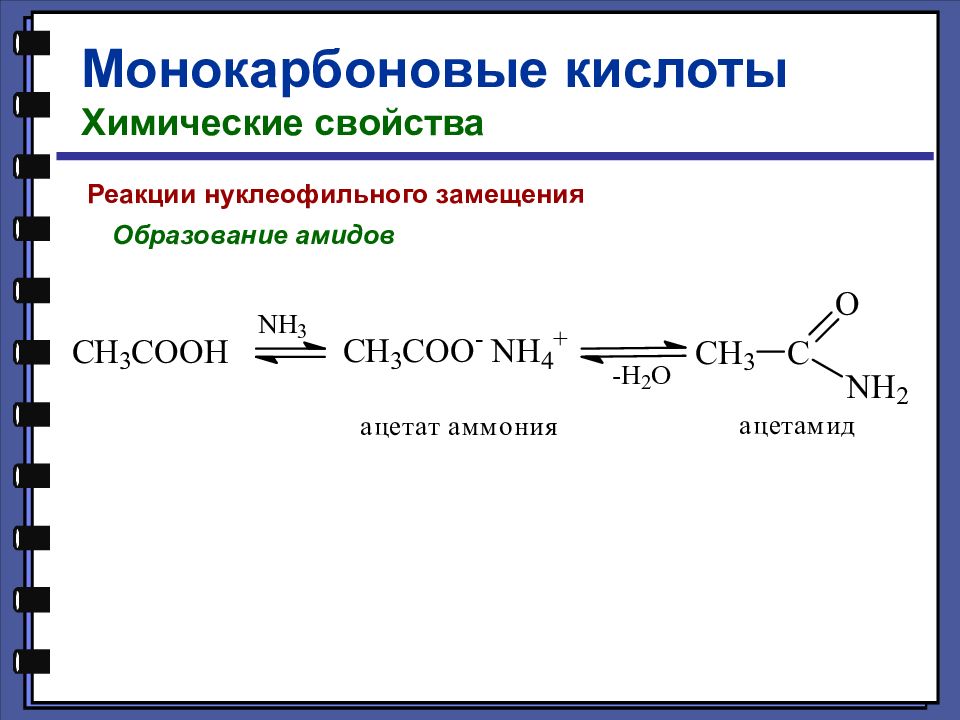
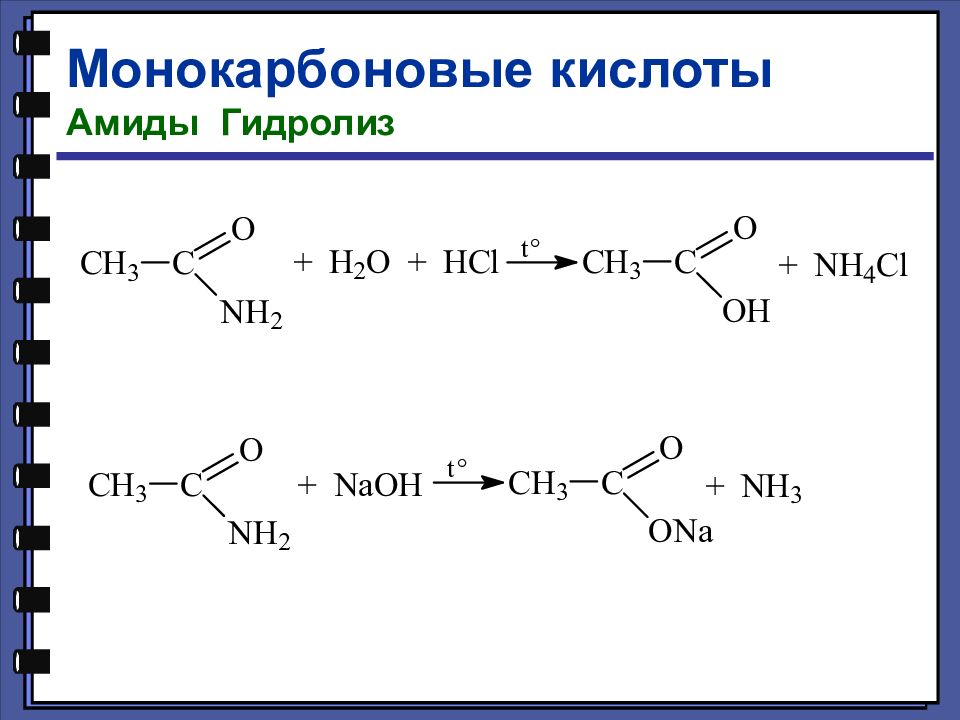
Монокарбоновые кислоты Химические свойства Реакции нуклеофильного замещения Образование амидов
Слайд 58
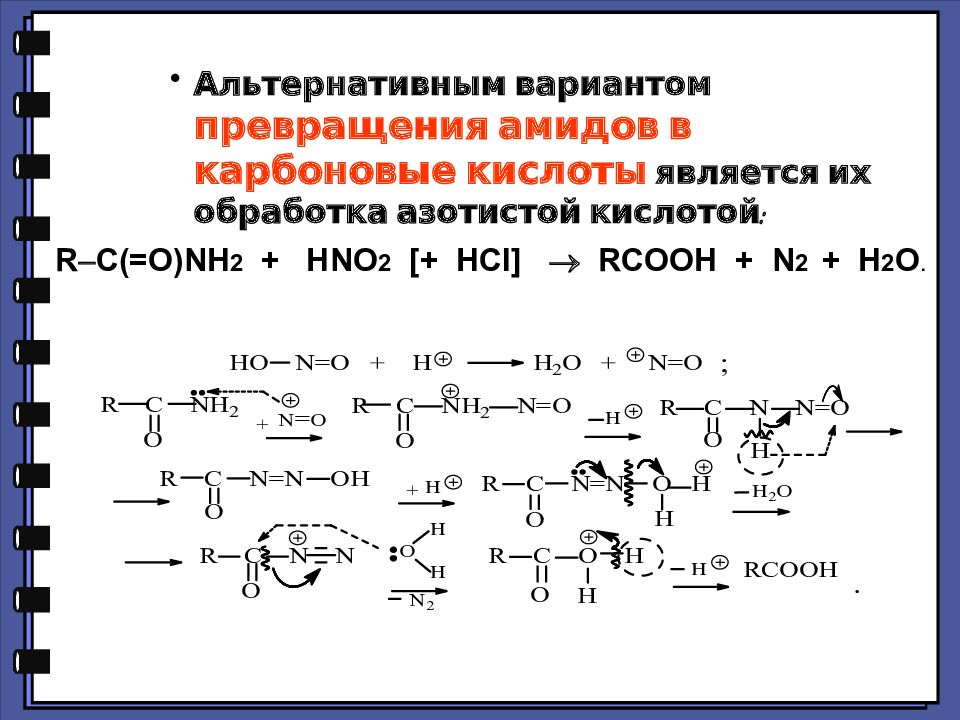
Альтернативным вариантом превращения амидов в карбоновые кислоты является их обработка азотистой кислотой: R C(=O)NH 2 + HNO 2 [+ HCl] RCOOH + N 2 + H 2 O.
Слайд 59
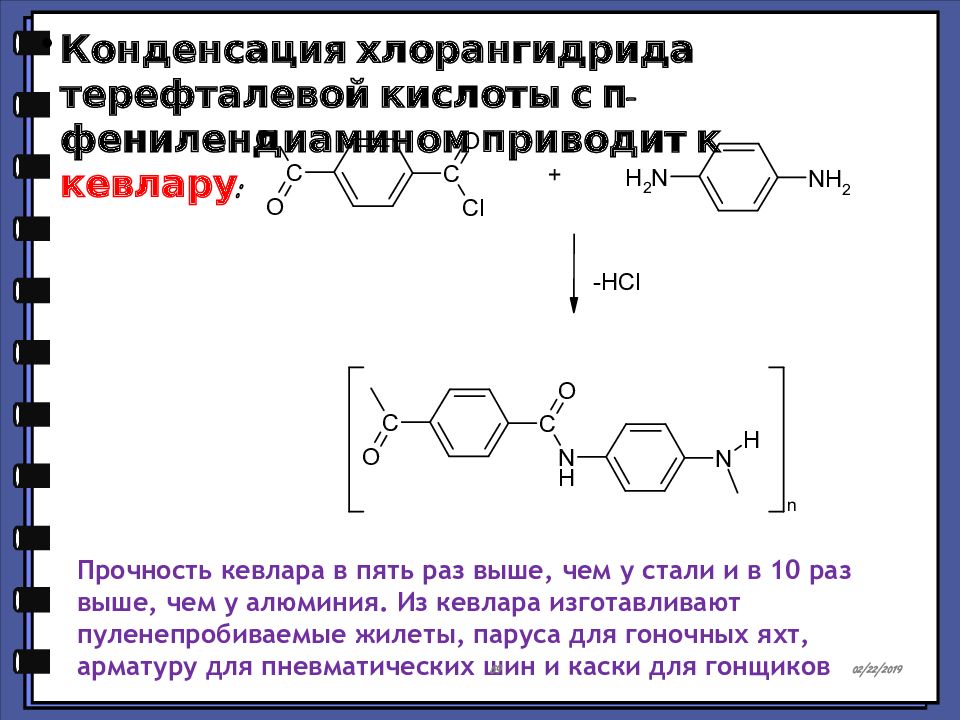
Конденсация хлорангидрида терефталевой кислоты с п-фенилендиамином приводит к кевлару : Прочность кевлара в пять раз выше, чем у стали и в 10 раз выше, чем у алюминия. Из кевлара изготавливают пуленепробиваемые жилеты, паруса для гоночных яхт, арматуру для пневматических шин и каски для гонщиков 15.02.2019 59
Слайд 61
Монокарбоновые кислоты Ацилирующая способность функциональных производных карбоновых кислот
Слайд 62
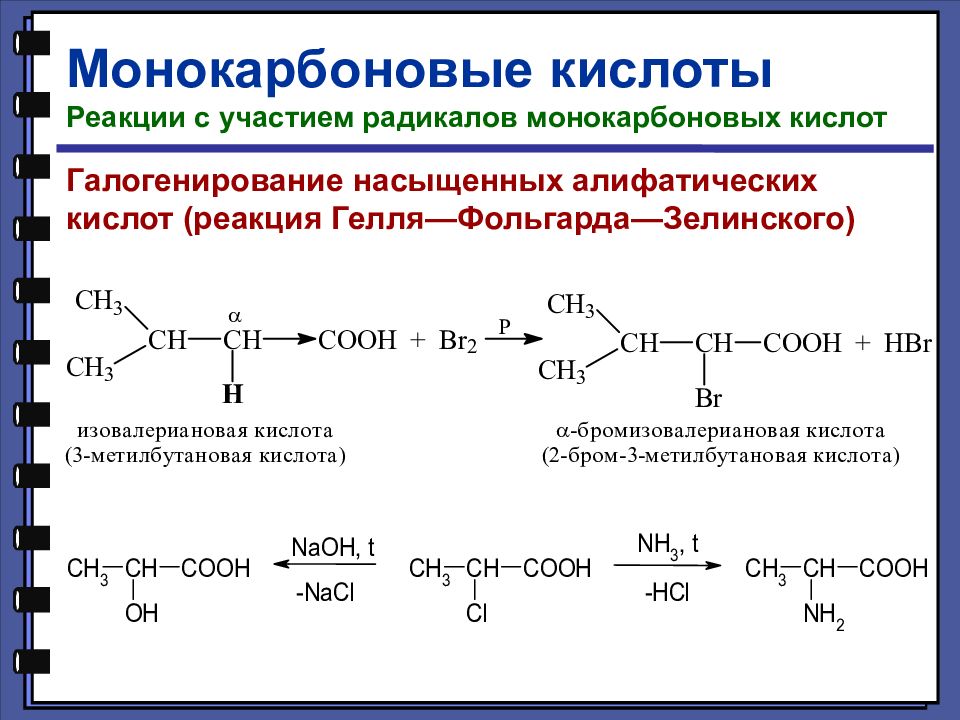
Монокарбоновые кислоты Реакции с участием радикалов монокарбоновых кислот Галогенирование насыщенных алифатических кислот (реакция Гелля—Фольгарда—Зелинского)
Слайд 63
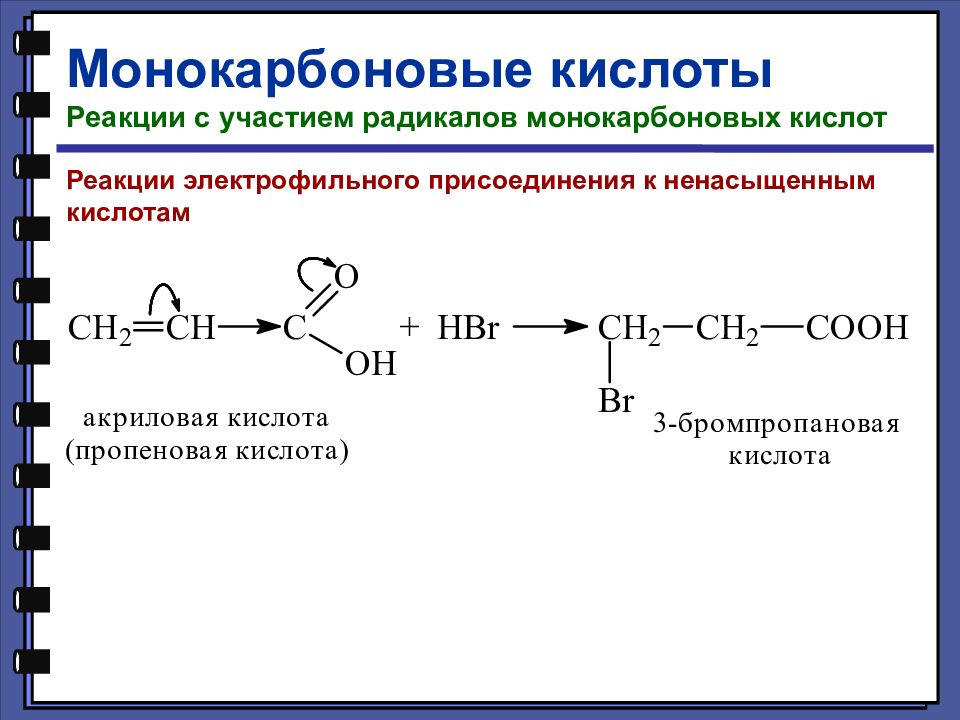
Монокарбоновые кислоты Реакции с участием радикалов монокарбоновых кислот Реакции электрофильного присоединения к ненасыщенным кислотам
Слайд 64
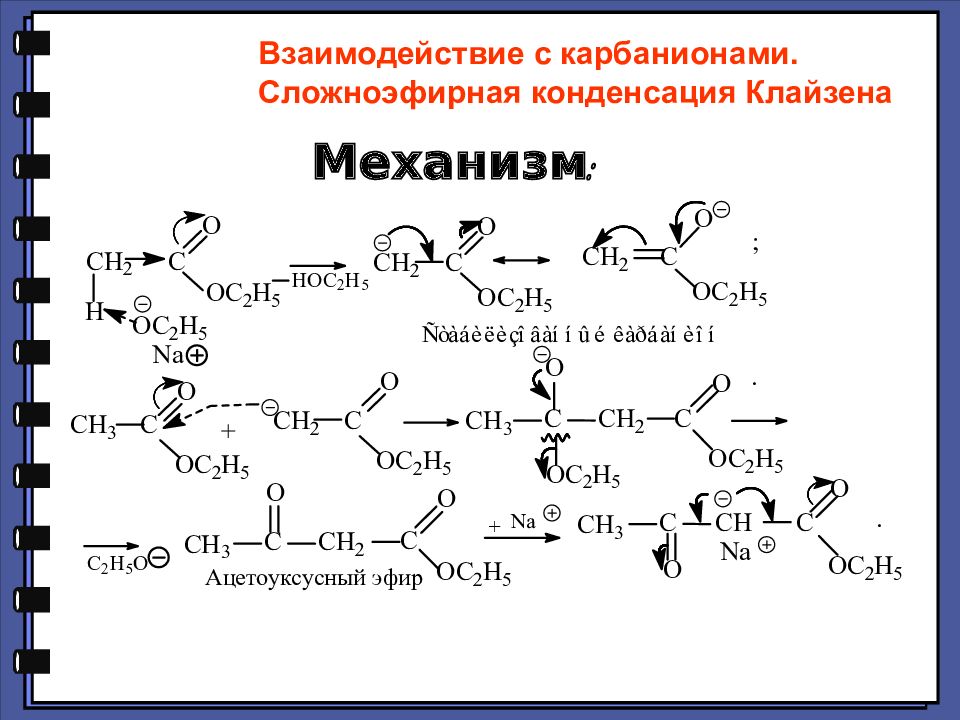
Механизм: Взаимодействие с карбанионами. Сложноэфирная конденсация Клайзена
Слайд 65
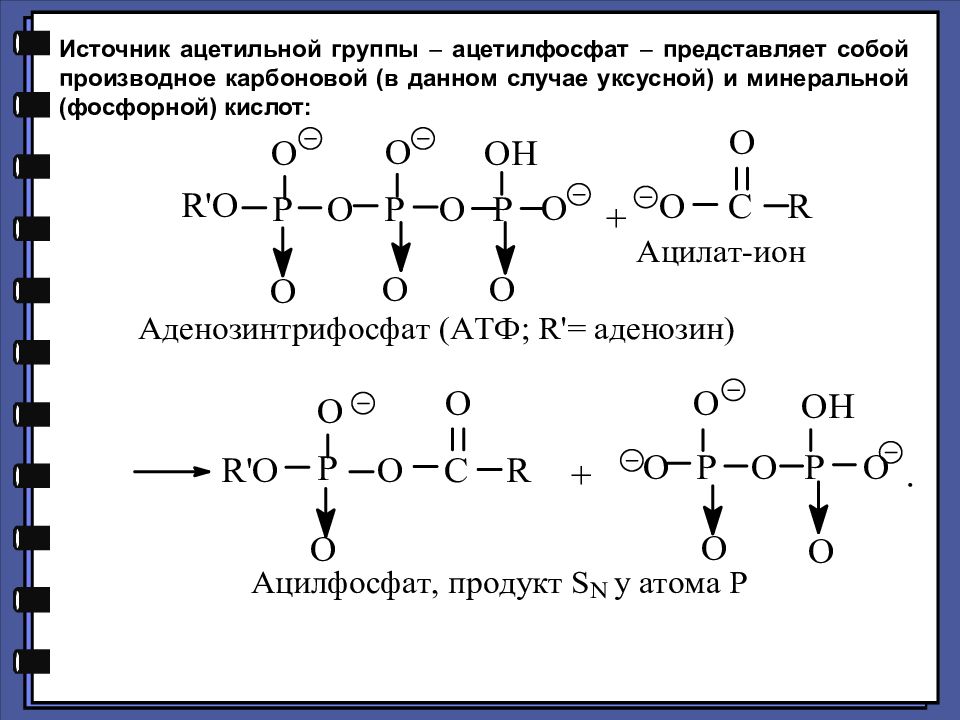
Источник ацетильной группы ацетилфосфат представляет собой производное карбоновой (в данном случае уксусной) и минеральной (фосфорной) кислот:
Слайд 67
Ацилфосфаты с различными ацильными группами наряду с тио- эфирами являются переносчиками этих ацильных групп к различным соединениям, имеющим в своих структурах нуклеофильные группы группы OH, SH, NH 2 –, так как фосфат-анион RO ( HPO 3 ) является очень хорошей уходящей группой.
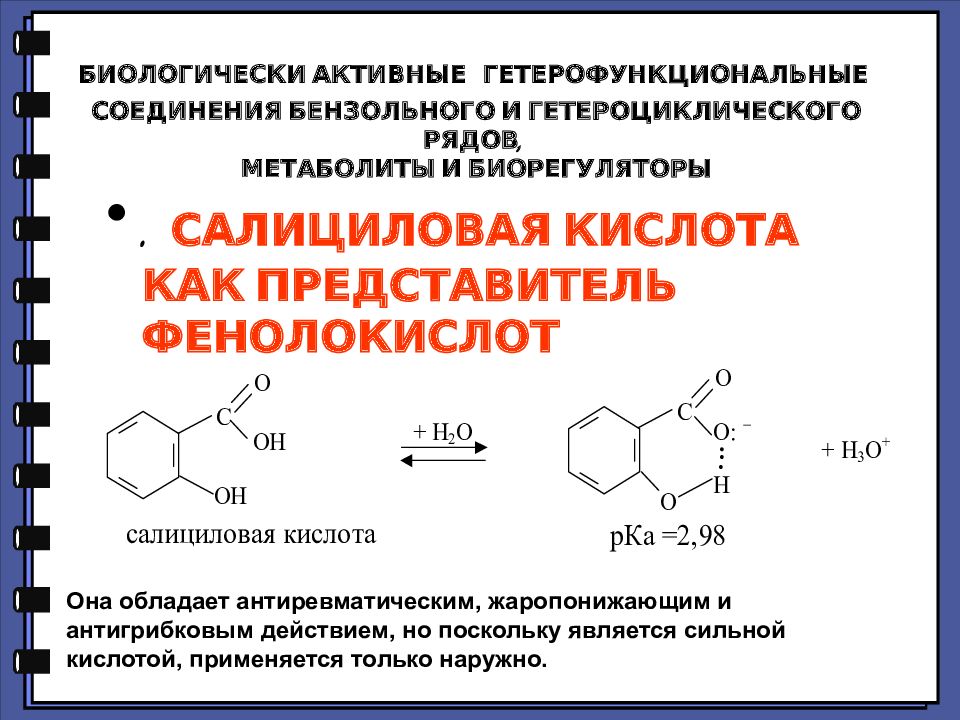
. САЛИЦИЛОВАЯ КИСЛОТА КАК ПРЕДСТАВИТЕЛЬ ФЕНОЛОКИСЛОТ Она обладает антиревматическим, жаропонижающим и антигрибковым действием, но поскольку является сильной кислотой, применяется только наружно.
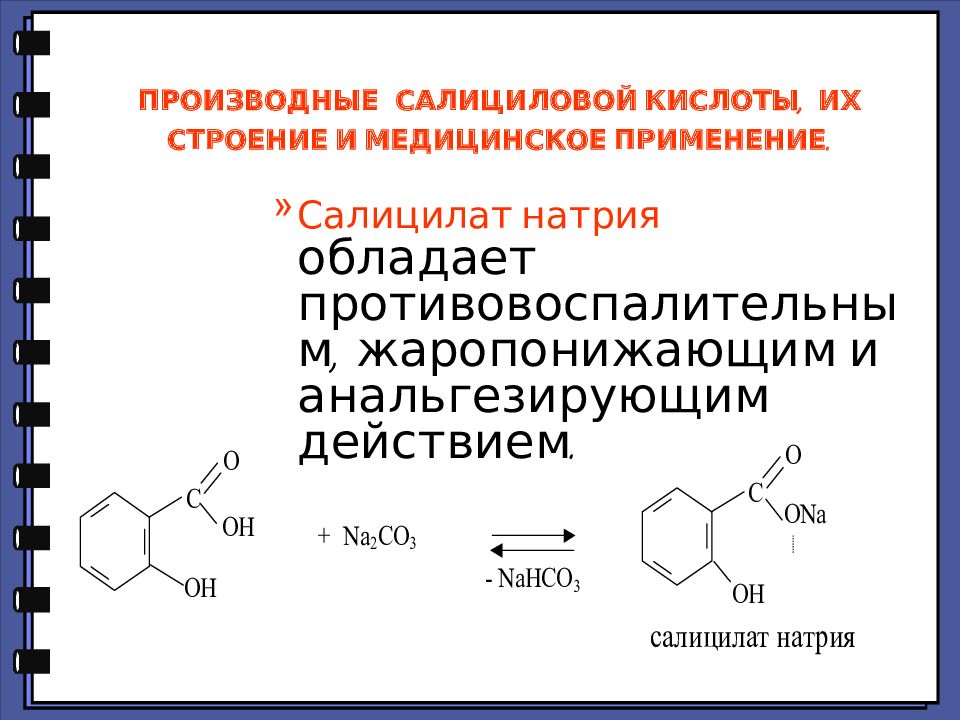
Салицилат натрия обладает противовоспалительным, жаропонижающим и анальгезирующим действием.
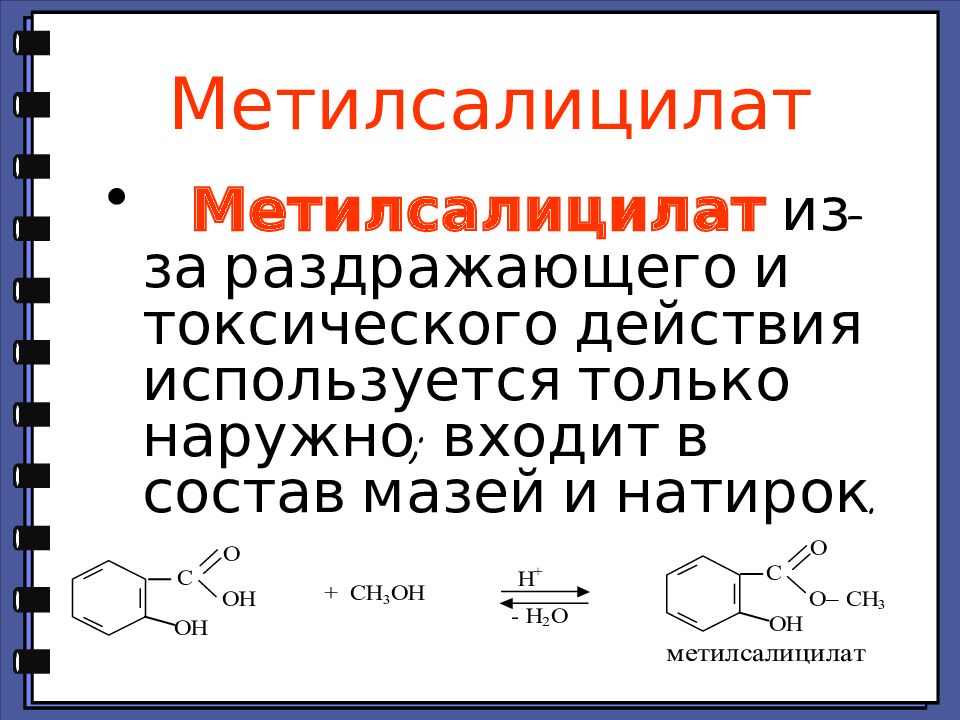
Слайд 70: Метилсалицилат
Метилсалицилат из-за раздражающего и токсического действия используется только наружно; входит в состав мазей и натирок.
Слайд 71: Фенилсалицилат
Фенилсалицилат в кислой среде желудка не гидролизуется, а распадается только в кишечнике. Применяется как дезинфицирующее средство при кишечных заболеваниях, используется также в качестве материала для защитных оболочек некоторых лекарственных средств, которые нестабильны в кислой среде желудка.
Слайд 72: Ацетилсалициловая кислота (аспирин)
Ацетилсалициловая кислота (аспирин) обладает противовоспалительным, жаропонижающим и анальгезирующим действием, а также используется как антиагрегант (препятствует агрегации тромбоцитов и тромбообразованию).
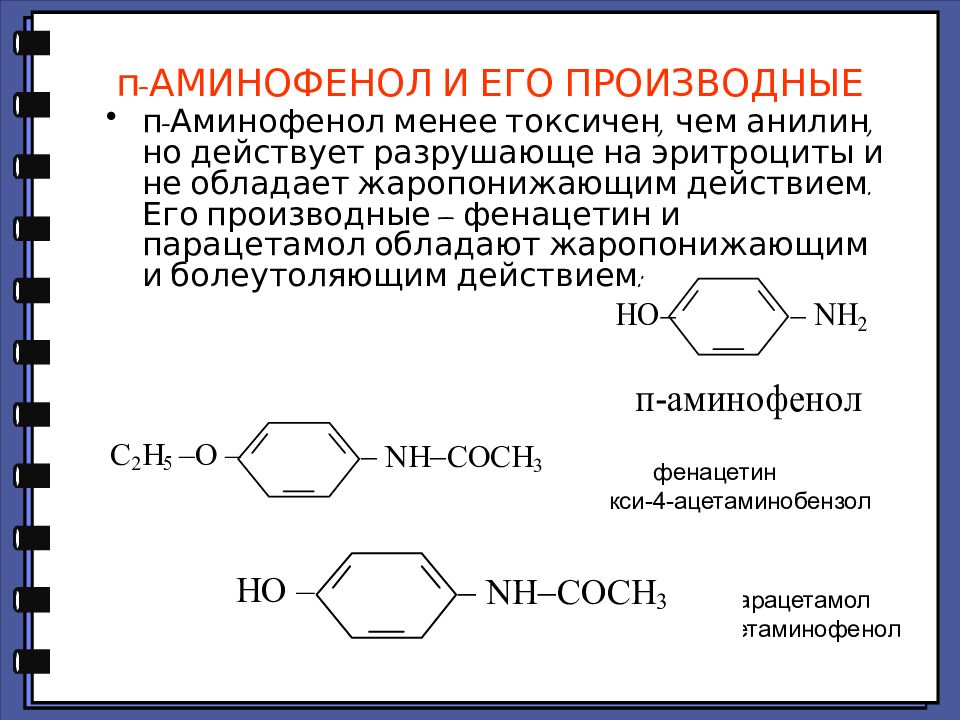
Слайд 73: п-АМИНОФЕНОЛ И ЕГО ПРОИЗВОДНЫЕ
п-Аминофенол менее токсичен, чем анилин, но действует разрушающе на эритроциты и не обладает жаропонижающим действием. Его производные — фенацетин и парацетамол обладают жаропонижающим и болеутоляющим действием: фенацетин 1-этокси-4-ацетаминобензол парацетамол п-ацетаминофенол
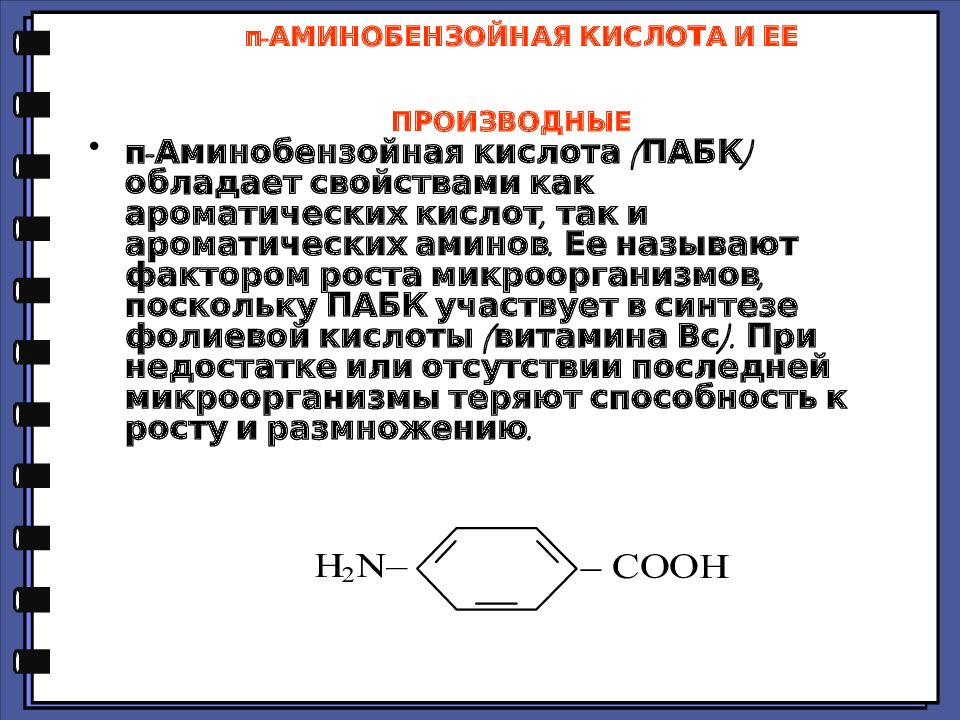
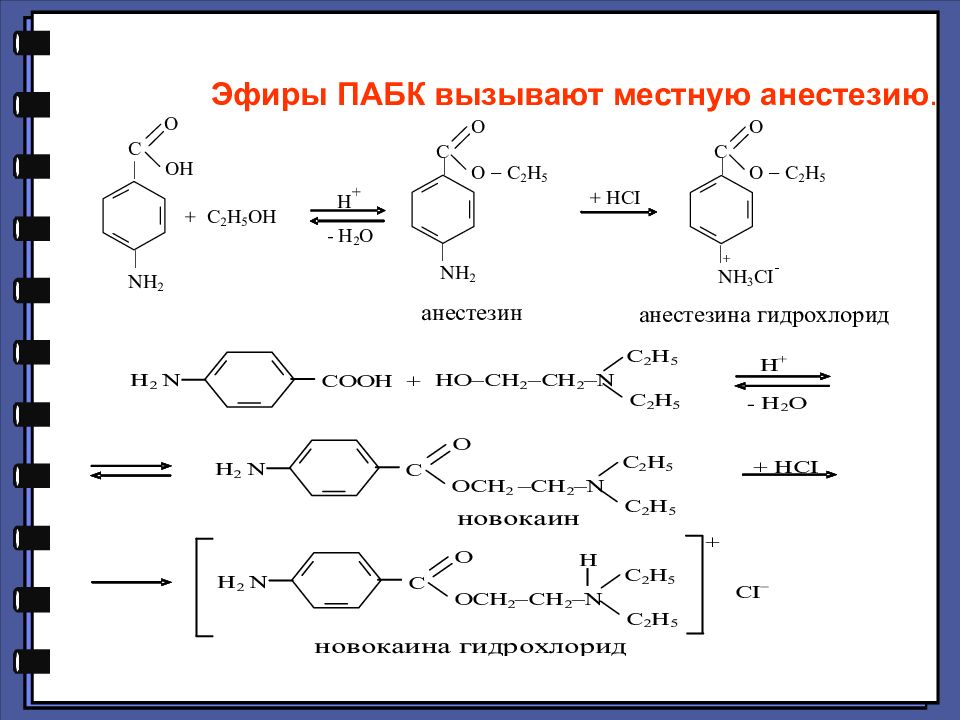
Слайд 74: п-АМИНОБЕНЗОЙНАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ
п-Аминобензойная кислота (ПАБК) обладает свойствами как ароматических кислот, так и ароматических аминов. Ее называют фактором роста микроорганизмов, поскольку ПАБК участвует в синтезе фолиевой кислоты (витамина Вс). При недостатке или отсутствии последней микроорганизмы теряют способность к росту и размножению.
Слайд 77
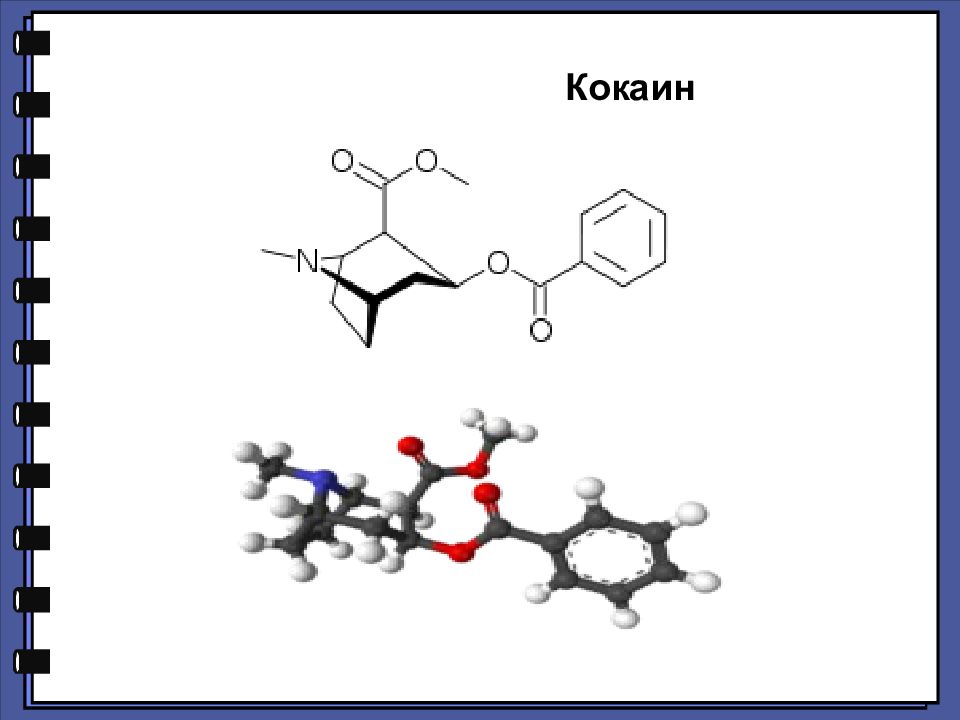
Листья коки Кокаи́н — метиловый сложный эфир бензоилэкгонина, алкалоид тропанового ряда, обладает местноанестезирующим и наркотическим действием. Наряду с другими алкалоидами содержится в растениях рода Эритроксилум ( Erythroxylum), в частности: Кокаиновый куст ( Erythroxylum coca), Erythroxylum laetevirens, Erythroxylum novogranatense, Erythroxylum recurrens, Erythroxylum steyermarkii и др., распространённых в тропической зоне Южной Америки.
Слайд 78
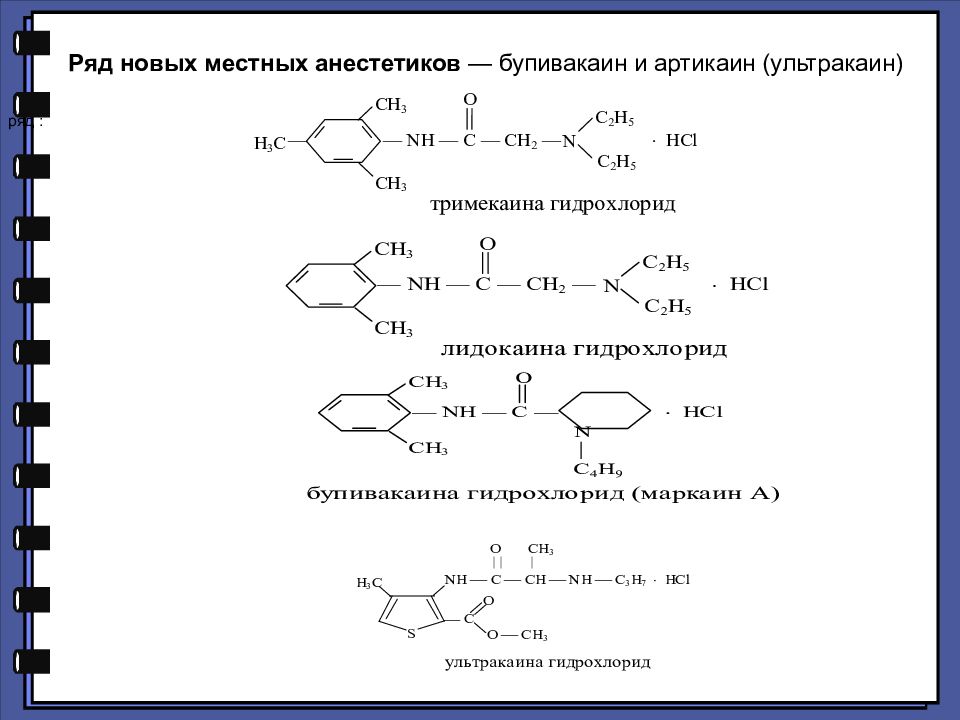
ряд : Ряд новых местных анестетиков — бупивакаин и артикаин (ультракаин)
Слайд 79
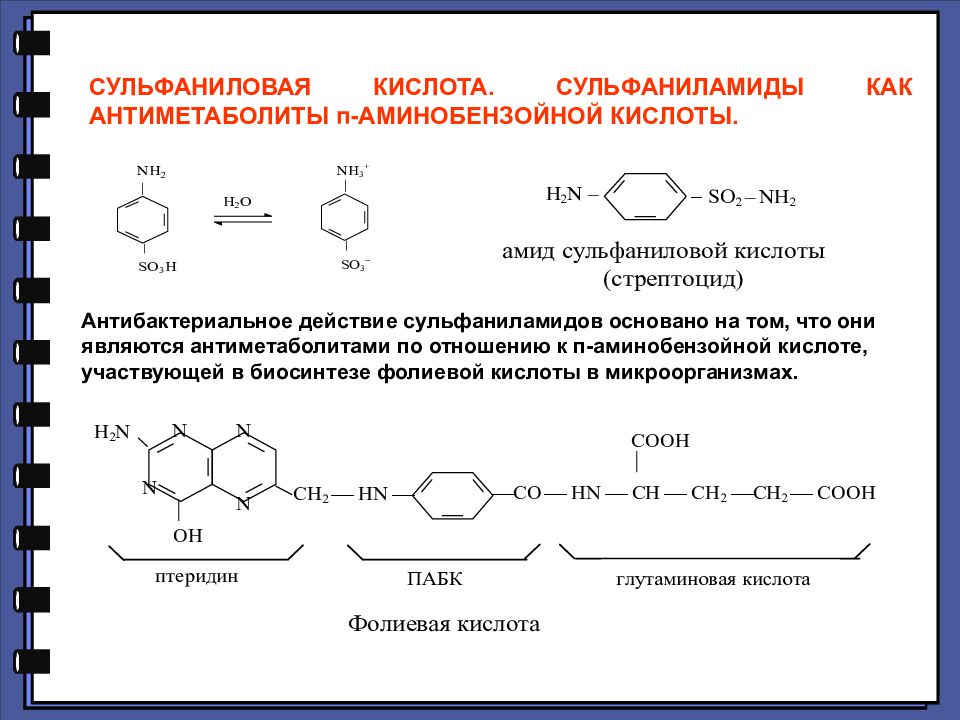
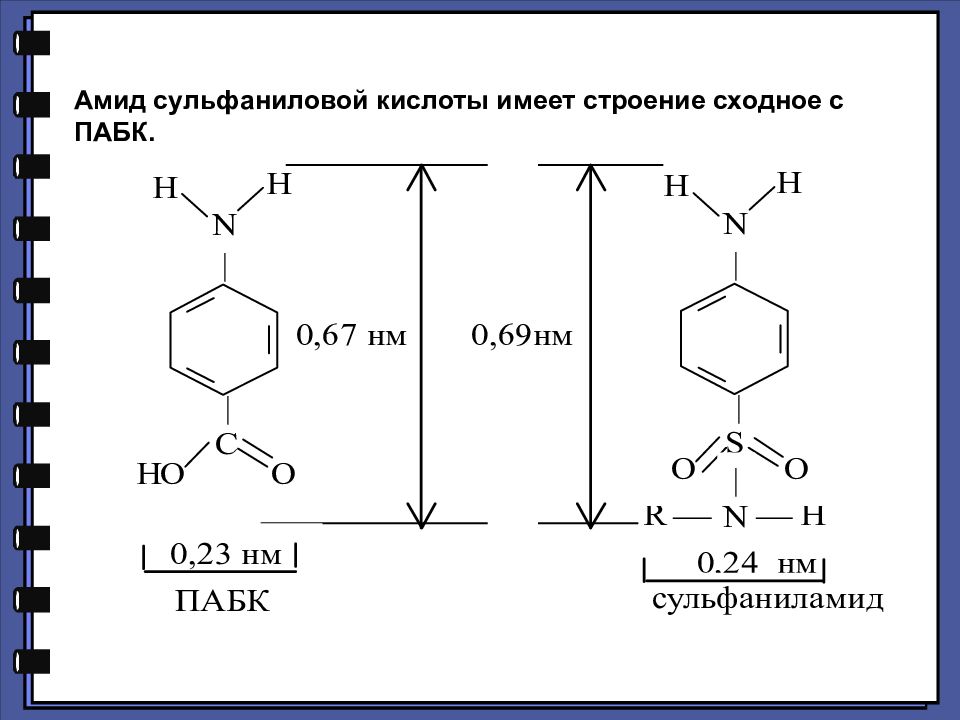
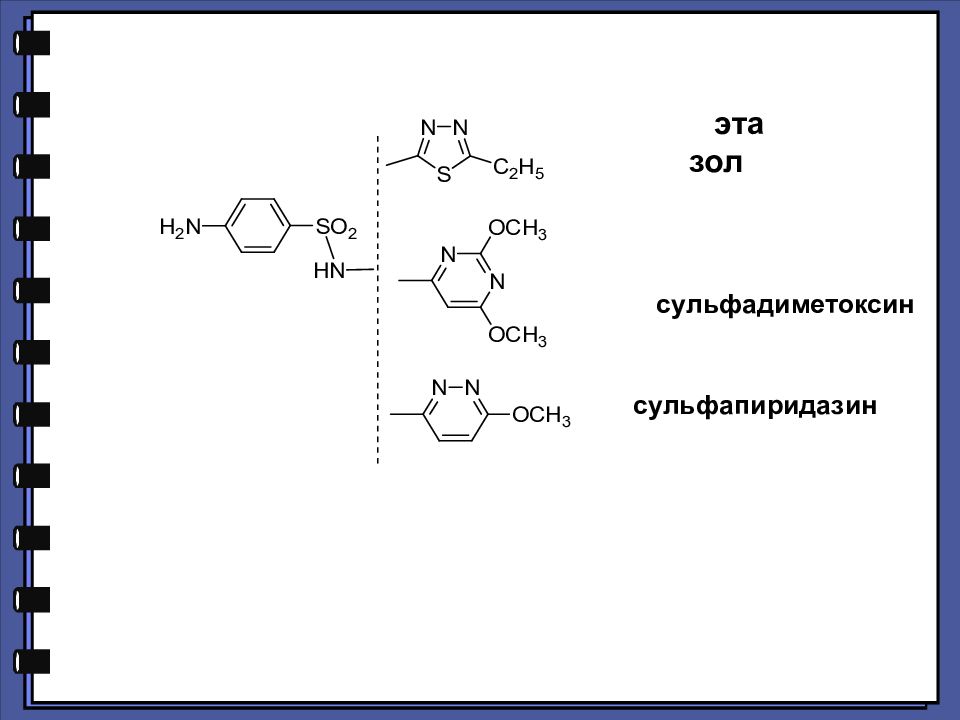
СУЛЬФАНИЛОВАЯ КИСЛОТА. СУЛЬФАНИЛАМИДЫ КАК АНТИМЕТАБОЛИТЫ п-АМИНОБЕНЗОЙНОЙ КИСЛОТЫ. Антибактериальное действие сульфаниламидов основано на том, что они являются антиметаболитами по отношению к п-аминобензойной кислоте, участвующей в биосинтезе фолиевой кислоты в микроорганизмах.
Слайд 81
Избирательность антимикробного действия основана на том, что в организме человека фолиевая кислота не синтезируется. Человек получает готовую фолиевую кислоту из растительных продуктов питания, а ряд микроорганизмов синтезируют ее самостоятельно. Сульфаниламидные препараты, благодаря структурному и химическому сходству с ПАБК могут конкурентно препятствовать синтезу дигидрофолиевой кислоты и ее превращению в тетрагидрофолиевую кислоту, необходимую для синтеза пуриновых и пиримидиновых оснований нуклеиновых кислот, вследствие чего рост и размножение микроорганизмов подавляется.
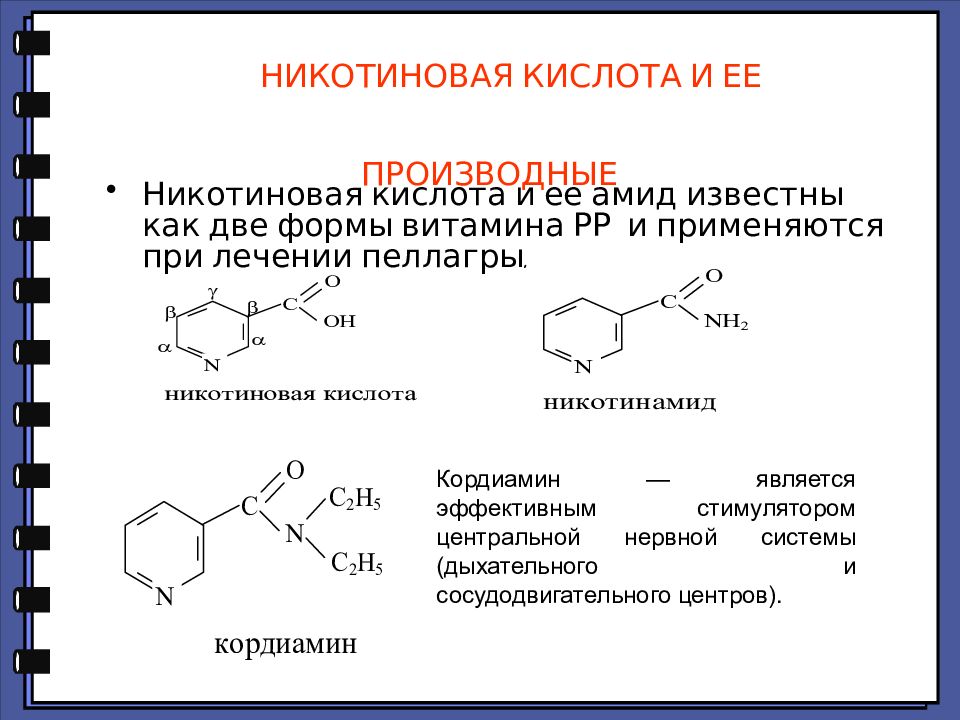
Слайд 83: НИКОТИНОВАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ
Никотиновая кислота и ее амид известны как две формы витамина РР и применяются при лечении пеллагры. Кордиамин — является эффективным стимулятором центральной нервной системы (дыхательного и сосудодвигательного центров).
Слайд 84
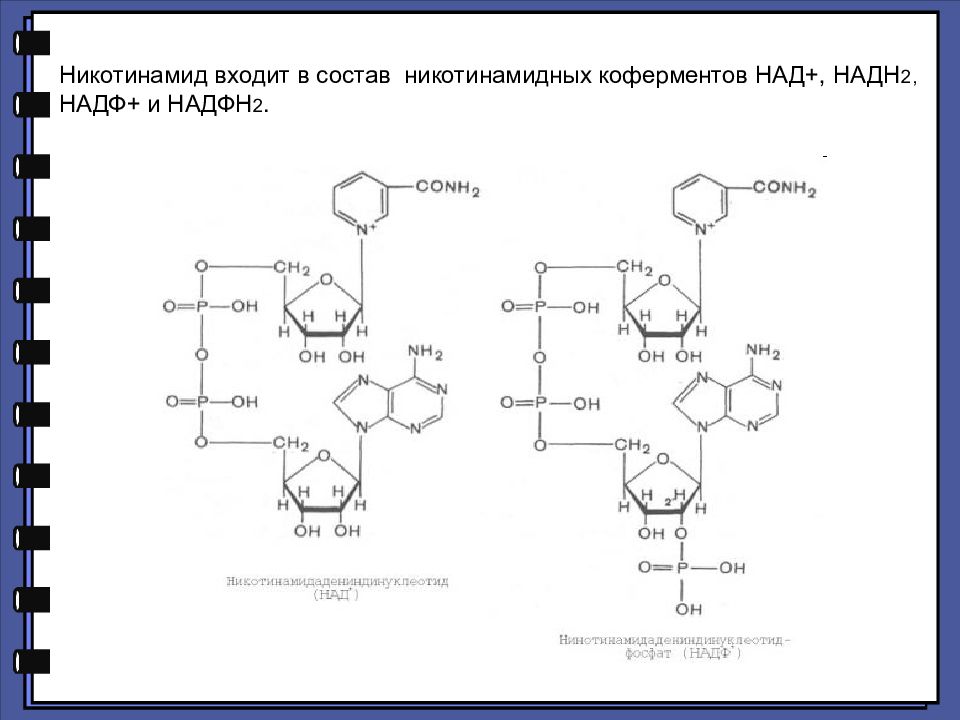
Никотинамид входит в состав никотинамидных коферментов НАД+, НАДН 2, НАДФ+ и НАДФН 2.
Слайд 85
В организме человека с участием НАД + происходит окисление гидроксилсодержащих соединений, например, молочной кислоты в пировиноградную:
Слайд 86
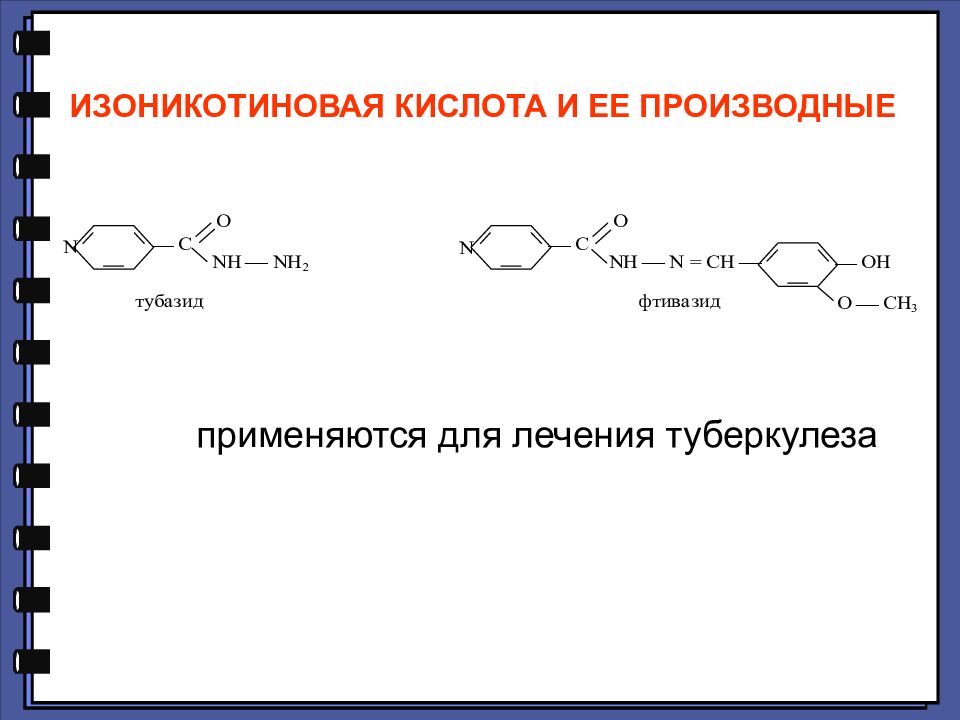
ИЗОНИКОТИНОВАЯ КИСЛОТА И ЕЕ ПРОИЗВОДНЫЕ применяются для лечения туберкулеза
Слайд 88
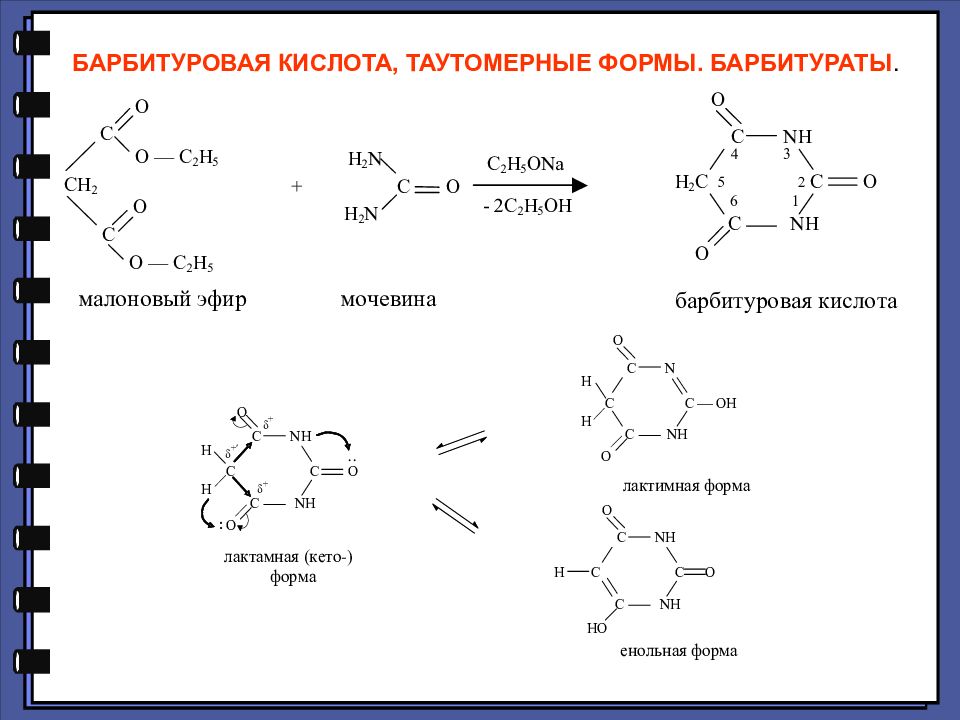
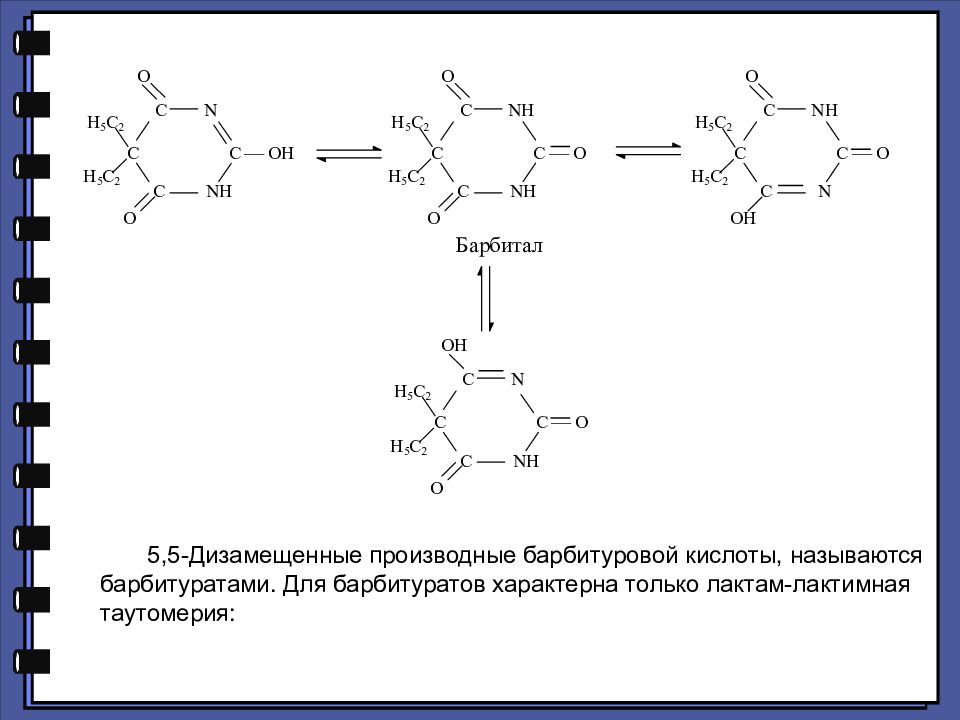
5,5-Дизамещенные производные барбитуровой кислоты, называются барбитуратами. Для барбитуратов характерна только лактам-лактимная таутомерия:
Слайд 89
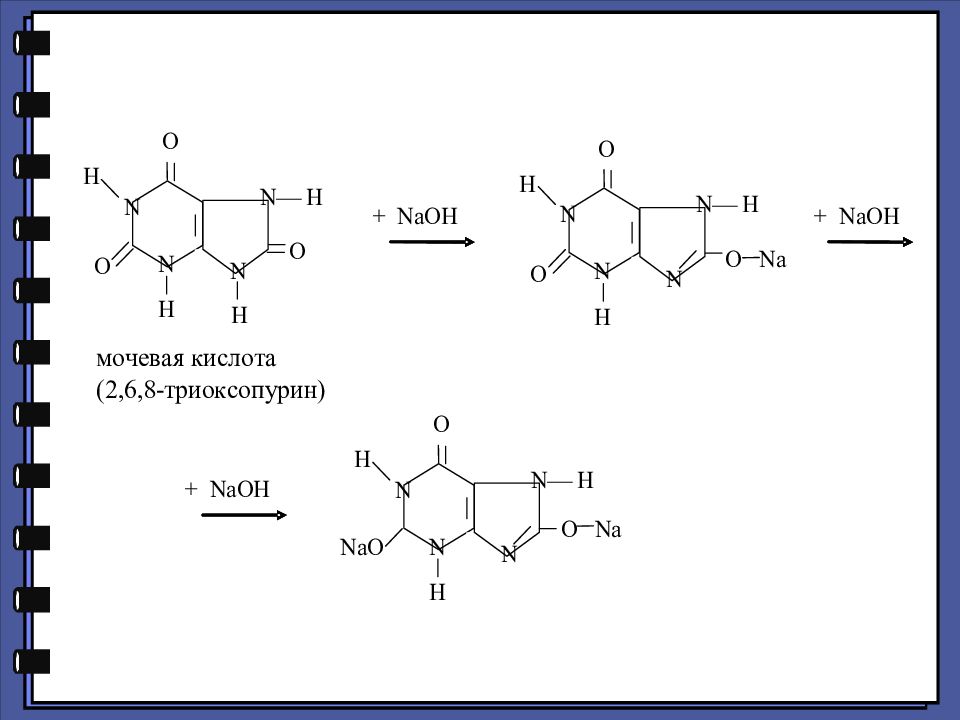
МОЧЕВАЯ КИСЛОТА И ЕЕ СОЛИ. Средние соли щелочных металлов ( Na, K, Li ) хорошо растворимы в воде, кислые соли, за исключением литиевых, плохо растворимы в воде. Очень плохо растворимы в воде ураты аммония; «мочевые камни», «мочевой песок» часто состоят из кислого урата аммония. Мочевая кислота является конечным продуктом обмена пуриновых соединений в организме, выделяется с мочой в количестве 0,5 – 1 г в сутки. Она представляет собой кристаллическое вещество плохо растворимое в воде, со слабо выраженными кислотными свойствами, обусловленными енолизацией (переходом в лактимную форму) и поэтому растворяется в щелочах, образуя средние соли (ураты) с двумя эквивалентами щелочи.
Слайд 91
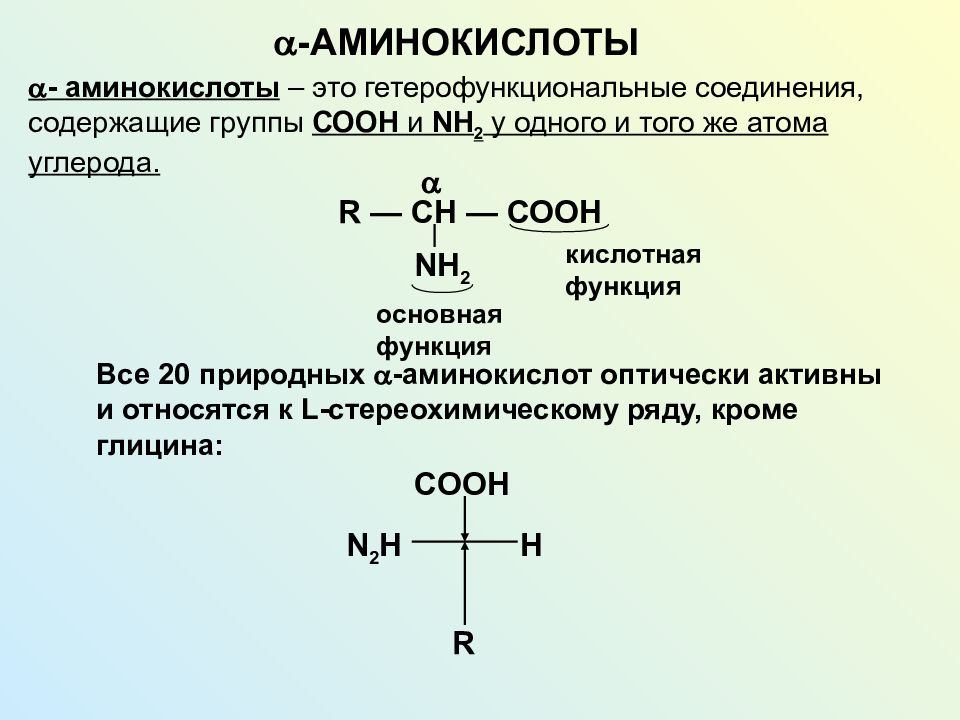
Полифункциональные соединения Гетерофункциональные соединения Полиолы: гликоли, глицерины, тетриты, пентиты, гекситы Полиамины Поликарбоновые кислоты (дикарбоновые кислоты, трикарбоновые кислоты) Аминоспирты Аминокислоты Оксикислоты Альдегидокислоты Кетокислоты Гетероциклические соединения (азотсодержащие гетероциклы, гетероциклы с разными гетероатомами) Особенности химического поведения полифункциональных соединений
Слайд 92
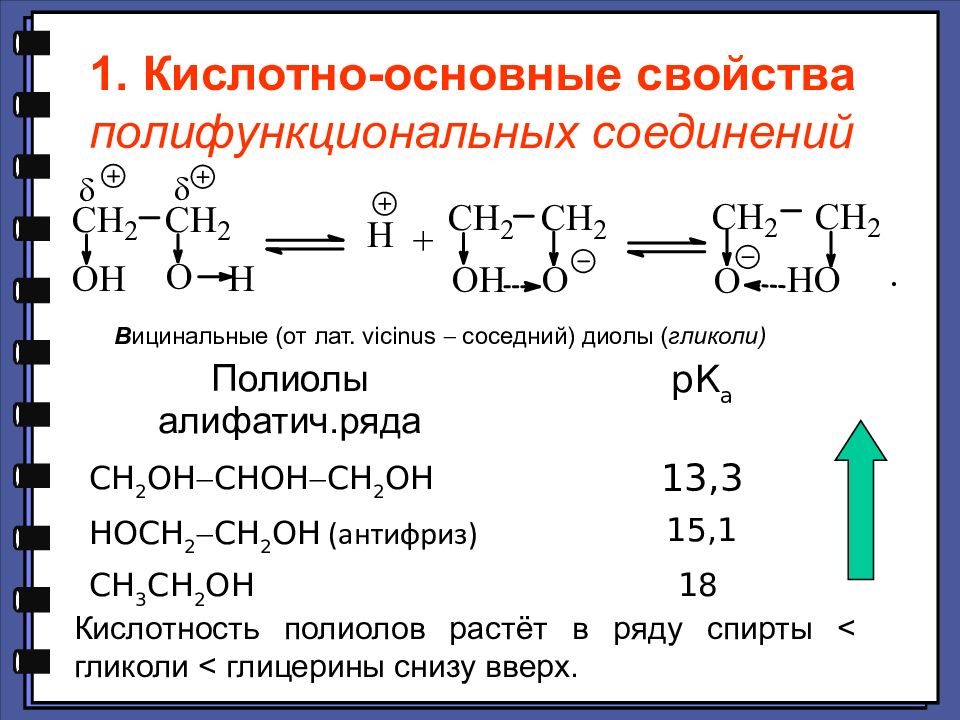
1. Кислотно-основные свойства полифункциональных соединений В ицинальные (от лат. vicinus соседний) диолы ( гликоли) Полиолы алифатич.ряда рК а СН 2 ОН СНОН СН 2 ОН 13,3 НОСН 2 СН 2 ОН (антифриз) 15,1 СН 3 СН 2 ОН 18 Кислотность полиолов растёт в ряду спирты < гликоли < глицерины снизу вверх.
Слайд 93
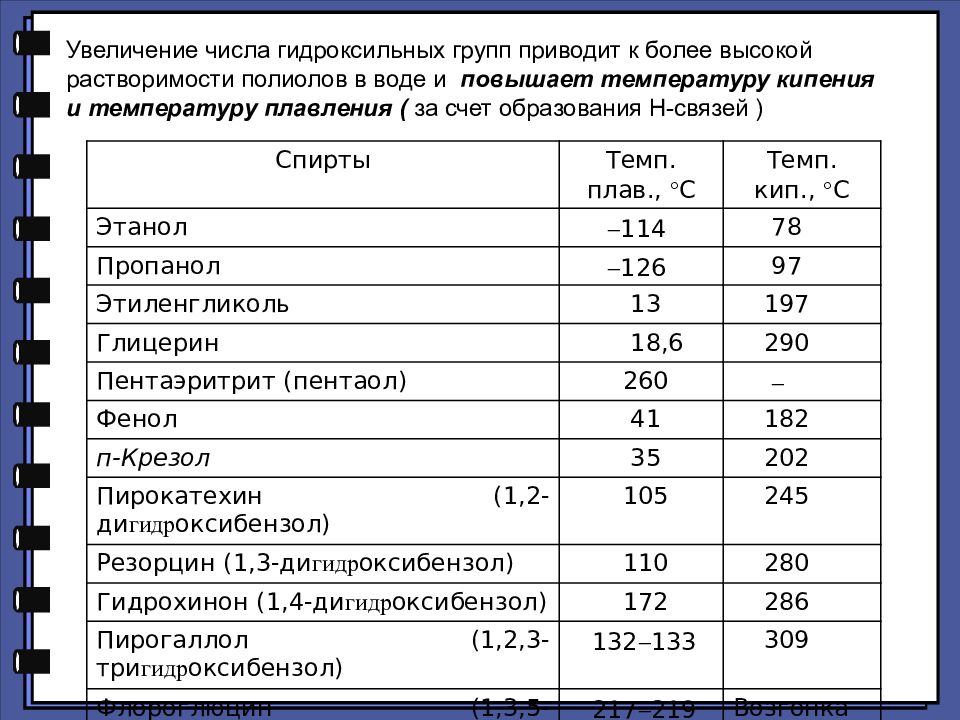
Увеличение числа гидроксильных групп приводит к более высокой растворимости полиолов в воде и повышает температуру кипения и температуру плавления ( за счет образования Н-связей ) Спирты Темп. плав., С Темп. кип., С Этанол 114 78 Пропанол 126 97 Этиленгликоль 13 197 Глицерин 18,6 290 Пентаэритрит (пентаол) 260 Фенол 41 182 п-Крезол 35 202 Пирокатехин (1,2-ди гидр оксибензол) 105 245 Резорцин (1,3-ди гидр оксибензол) 110 280 Гидрохинон (1,4-ди гидр оксибензол) 172 286 Пирогаллол (1,2,3-три гидр оксибензол) 132 133 309 Флороглюцин (1,3,5-три гидр оксибензол) 217 219 Возгонка
Слайд 94
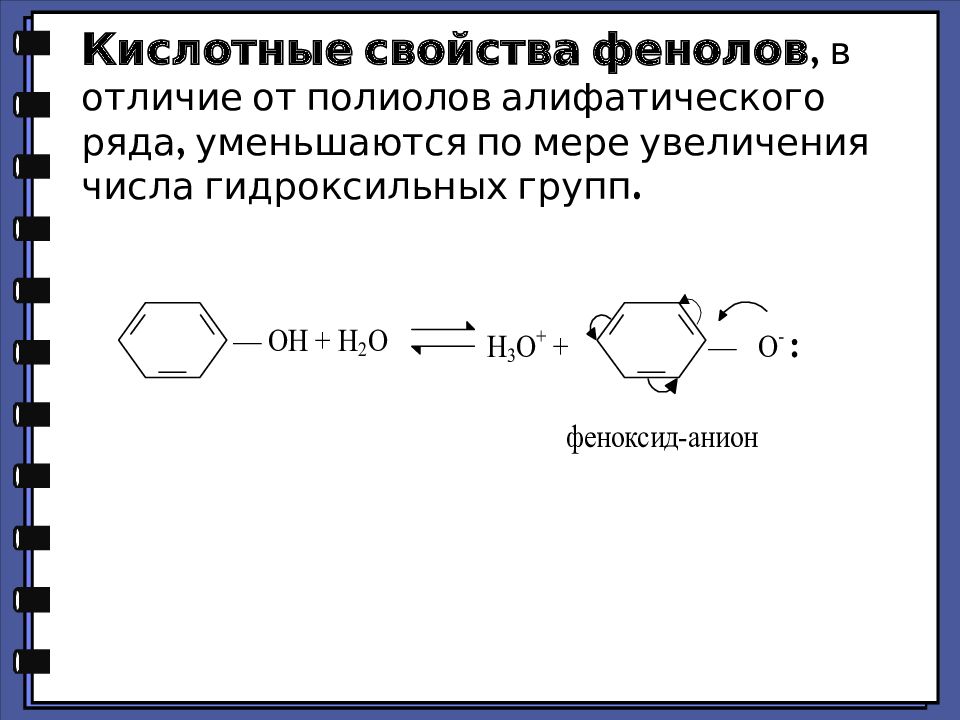
Кислотные свойства фенолов, в отличие от полиолов алифатического ряда, уменьшаются по мере увеличения числа гидроксильных групп.
Слайд 95
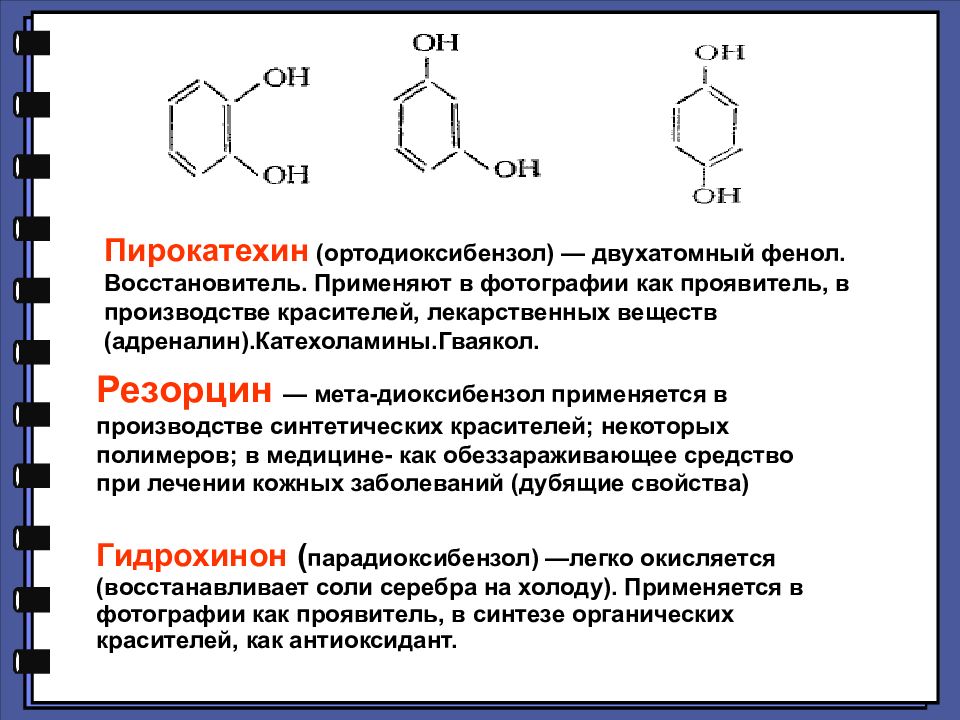
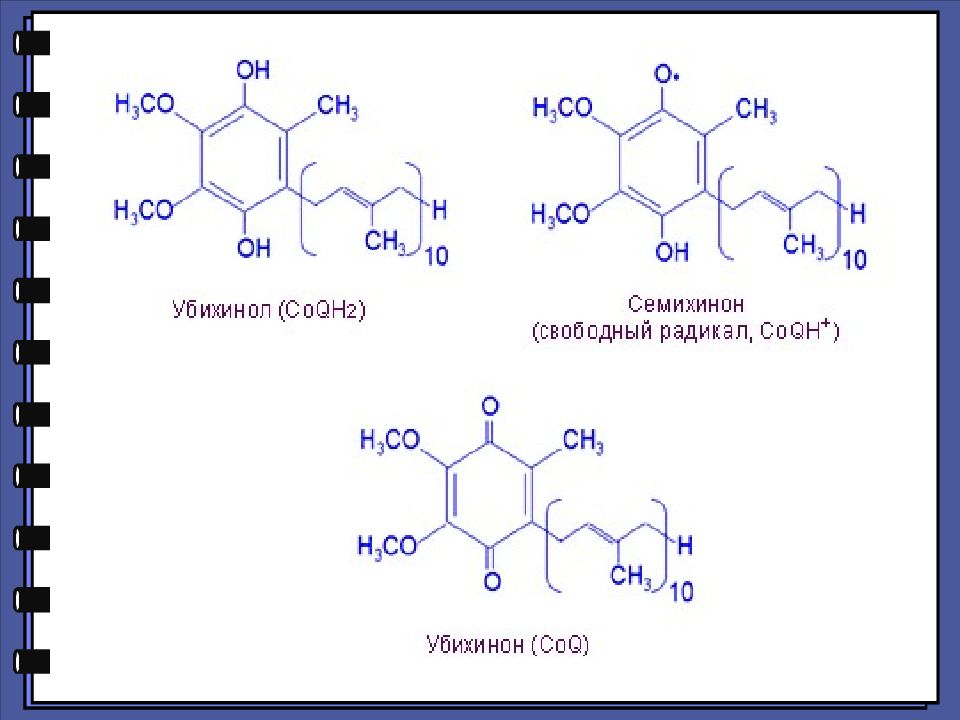
Пирокатехин (ортодиоксибензол) — двухатомный фенол. Восстановитель. Применяют в фотографии как проявитель, в производстве красителей, лекарственных веществ (адреналин).Катехоламины.Гваякол. Резорцин — мета-диоксибензол применяется в производстве синтетических красителей; некоторых полимеров; в медицине- как обеззараживающее средство при лечении кожных заболеваний (дубящие свойства) Гидрохинон ( парадиоксибензол) —легко окисляется (восстанавливает соли серебра на холоду). Применяется в фотографии как проявитель, в синтезе органических красителей, как антиоксидант.
Слайд 96
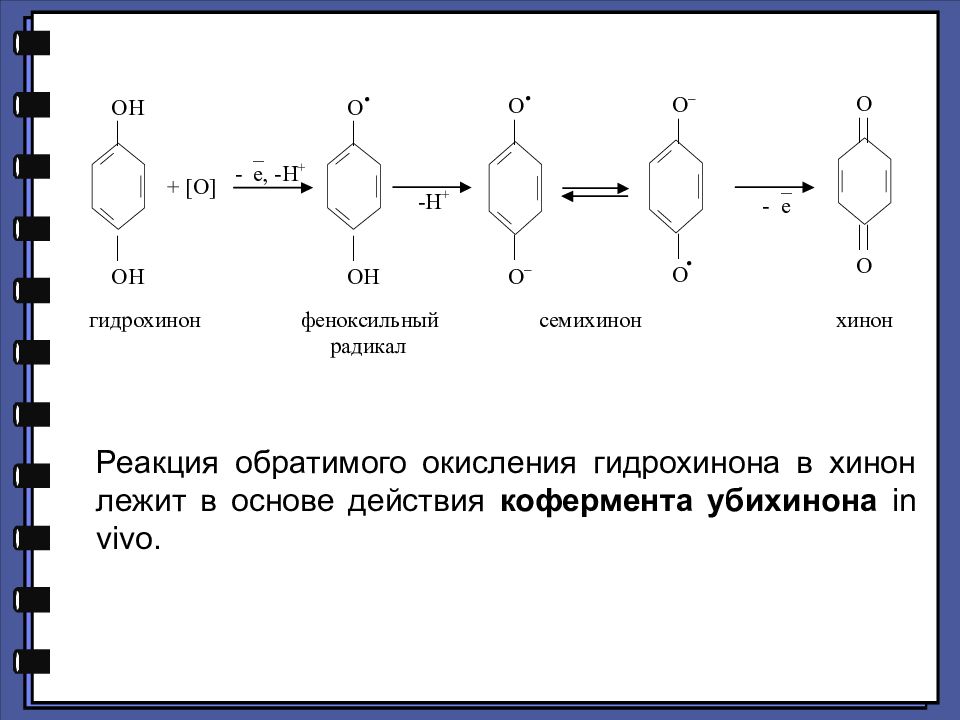
Реакция обратимого окисления гидрохинона в хинон лежит в основе действия кофермента убихинона in vivo.
Слайд 99
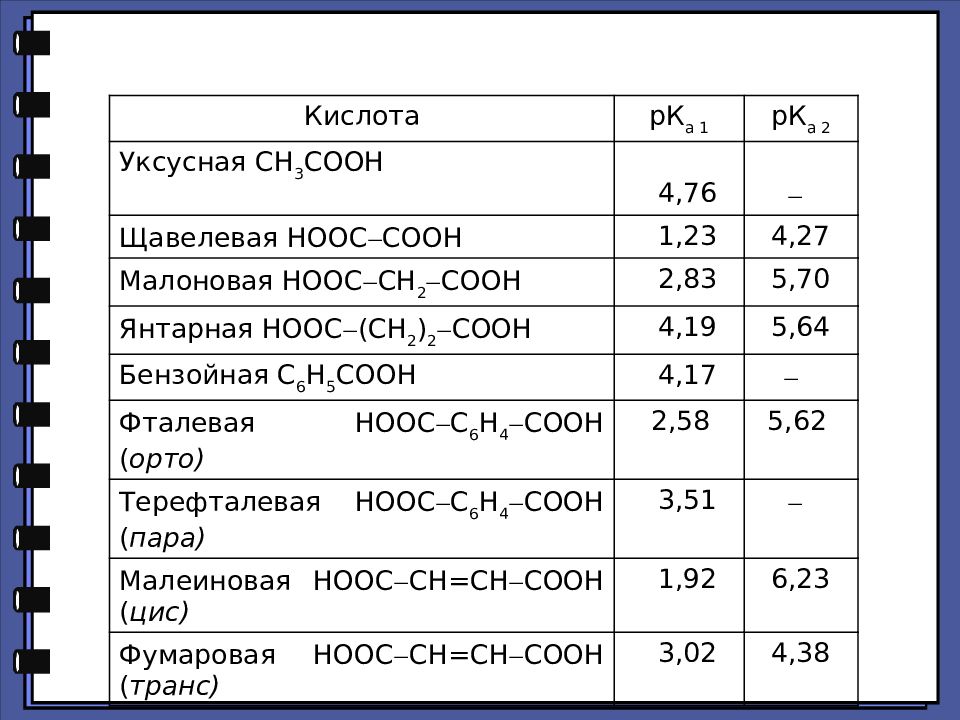
Кислота рК а 1 рК а 2 Уксусная СН 3 СООН 4,76 Щавелевая НООС СООН 1,23 4,27 Малоновая НООС СН 2 СООН 2,83 5,70 Янтарная НООС (СН 2 ) 2 СООН 4,19 5,64 Бензойная С 6 Н 5 СООН 4,17 Фталевая НООС С 6 Н 4 СООН ( орто) 2,58 5,62 Терефталевая НООС С 6 Н 4 СООН ( пара) 3,51 Малеиновая НООС СН=СН СООН ( цис) 1,92 6,23 Фумаровая НООС СН=СН СООН ( транс) 3,02 4,38
Слайд 101
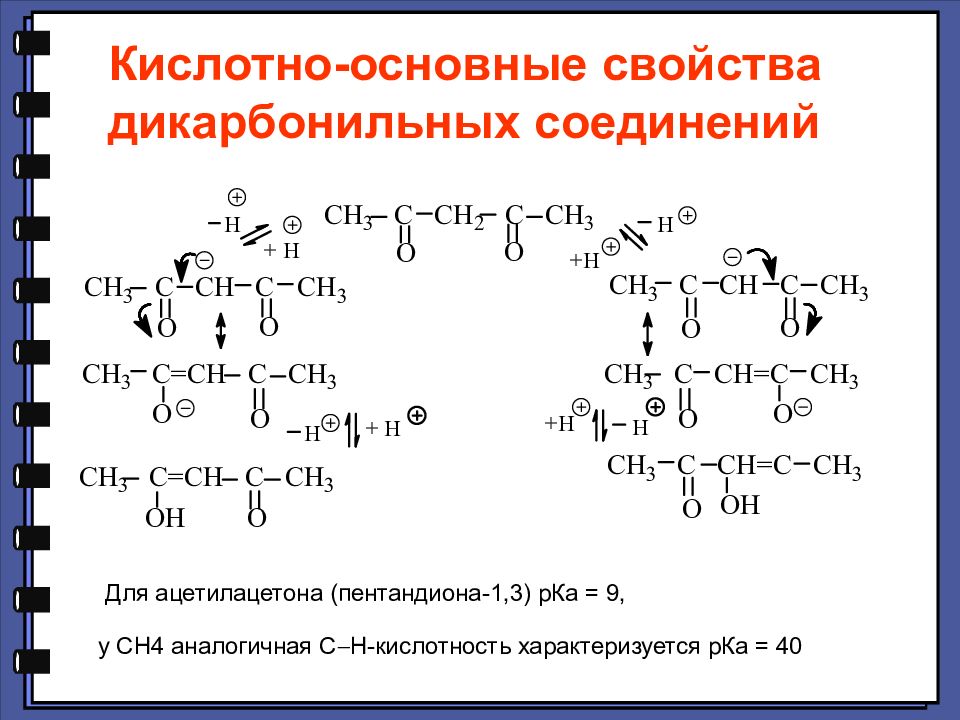
Кислотно-основные свойства дикарбонильных соединений Для ацетилацетона (пентандиона-1,3) рКа = 9, у СН4 аналогичная С Н -кислотность характеризуется рКа = 40
Слайд 102
2. Циклизация полифункциональных соединений Циклизация диолов: а) внутримолекулярная дегидратация (цикл. простой эфир)
Слайд 103
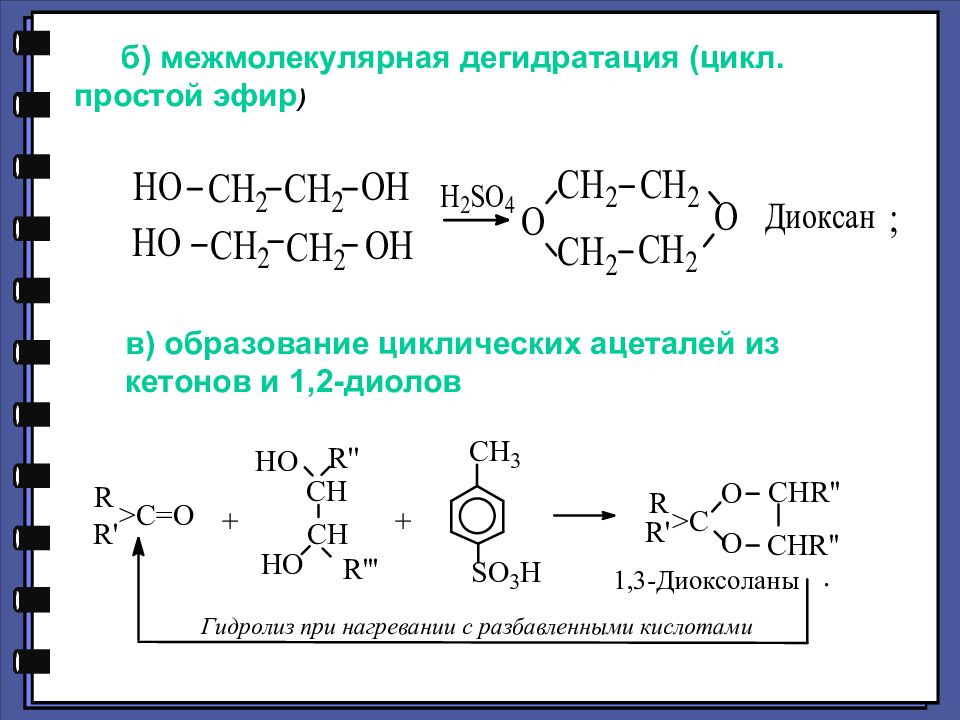
б) межмолекулярная дегидратация (цикл. простой эфир ) в) образование циклических ацеталей из кетонов и 1,2-диолов
Слайд 104
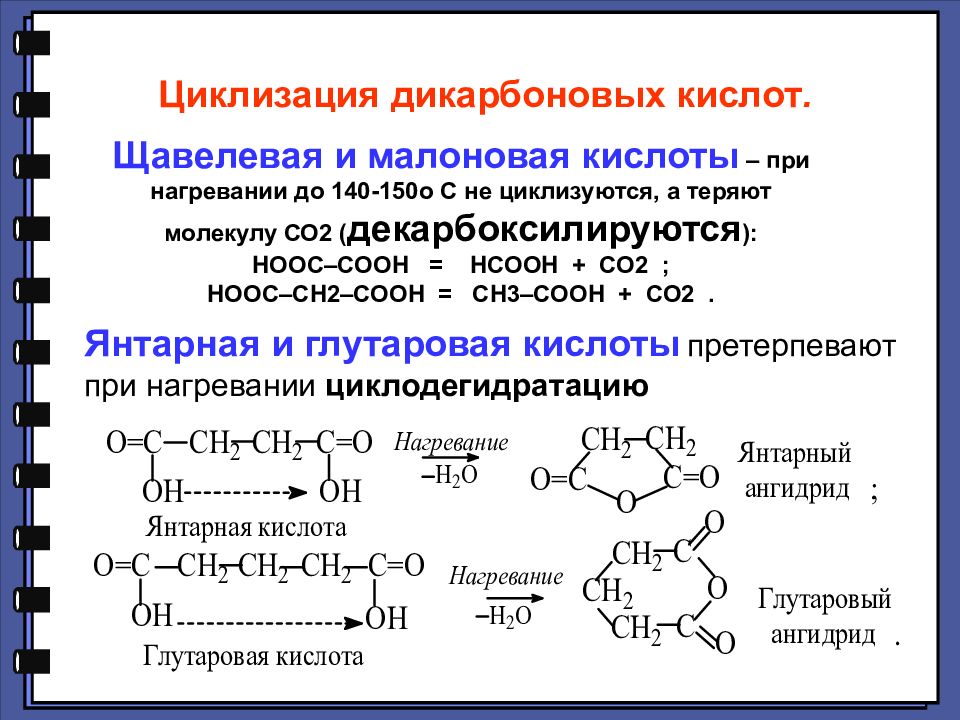
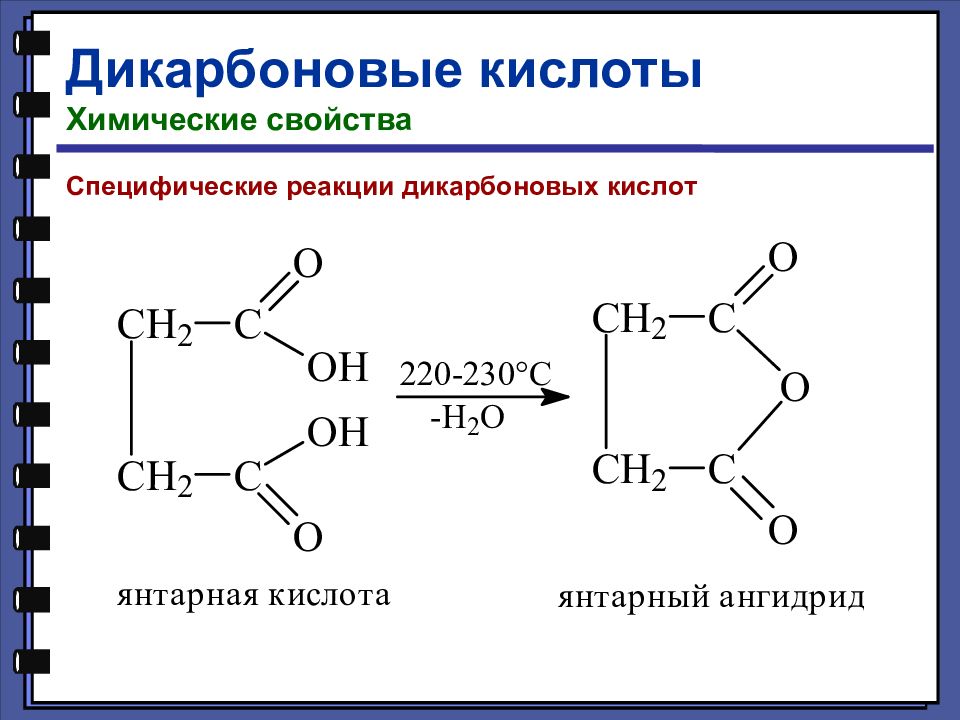
Циклизация дикарбоновых кислот. Щавелевая и малоновая кислоты – при нагревании до 140-150 o С не циклизуются, а теряют молекулу СО2 ( декарбоксилируются ): НООС–СООН = НСООН + СО2 ; НООС–СН2–СООН = СН3–СООН + СО2. Янтарная и глутаровая кислоты претерпевают при нагревании циклодегидратацию
Слайд 105
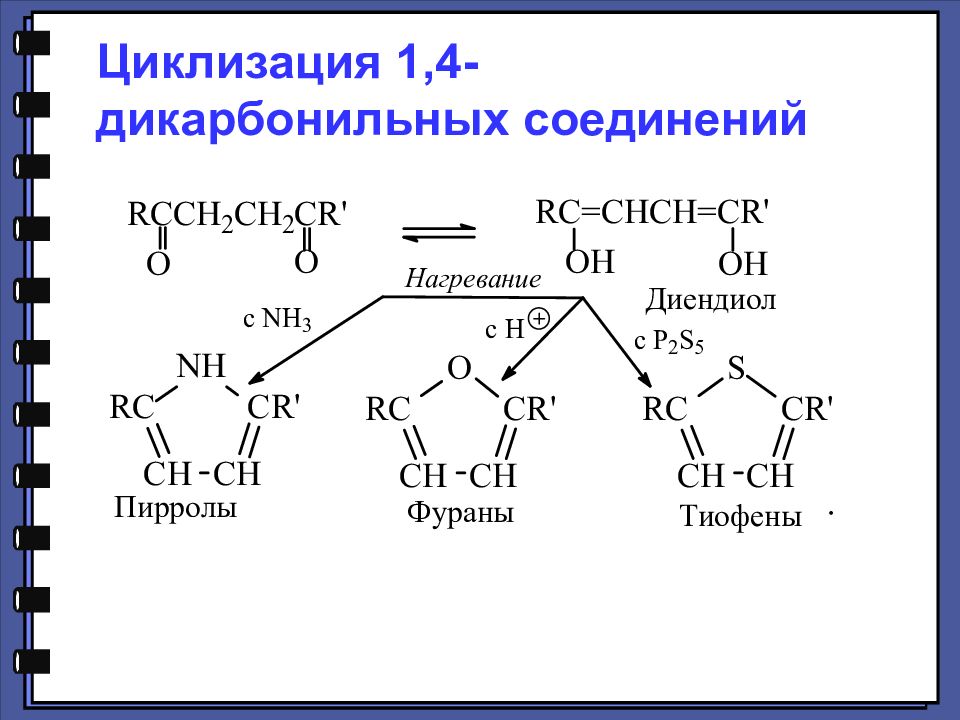
Кислоты с более длинной цепью циклизуются с одновременными дегидратацией и декарбоксилированием
Слайд 107
3. Хелатообразование - процесс возникновения дополнительных нековалентных связей в тех структурах, в которых атом водорода (или металла), связанный ковалентной (или ионной) связью, ориентирован между двумя электронодонорными фрагментами одной и той же молекулы, предоставляющими этому атому водорода (или металла) дополнительное электронное облако.
Слайд 108
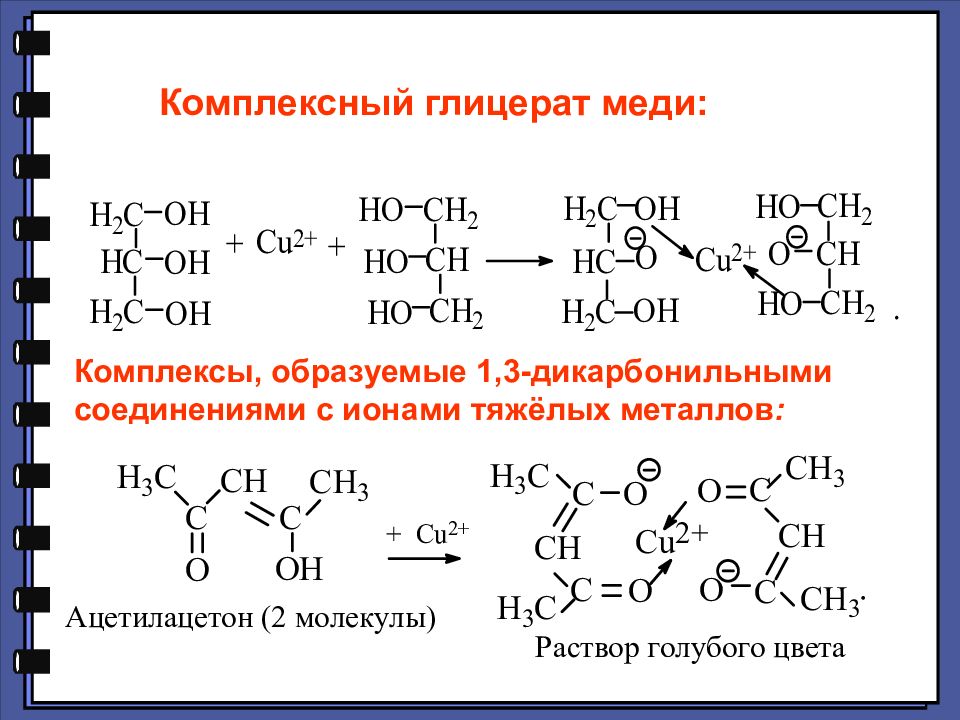
Комплексный глицерат меди: Комплексы, образуемые 1,3-дикарбонильными соединениями с ионами тяжёлых металлов :
Слайд 109
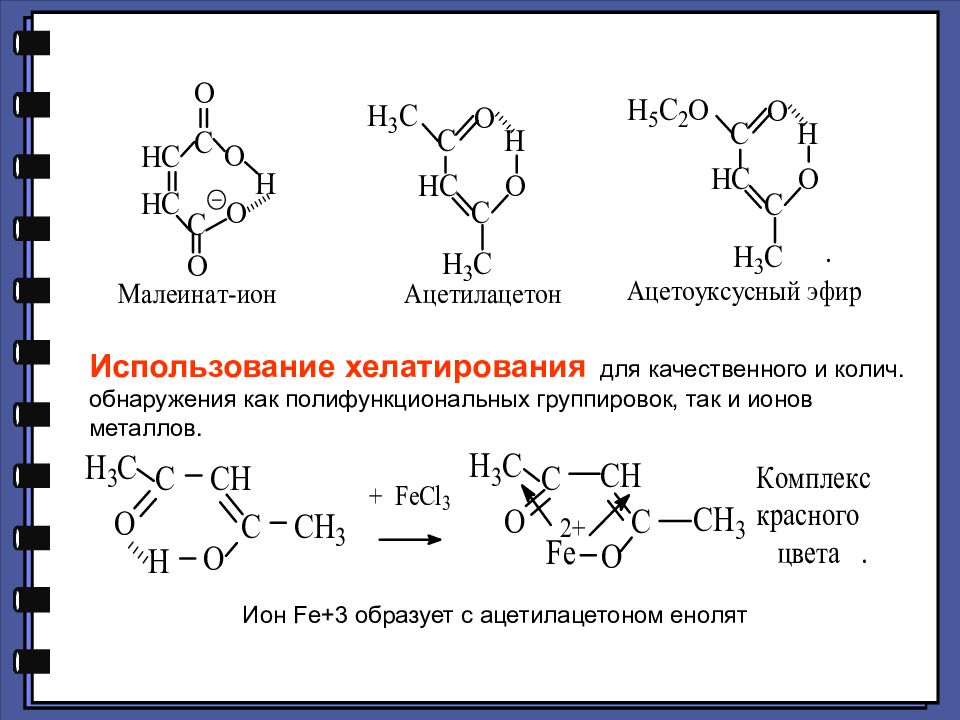
Ион Fe +3 образует с ацетилацетоном енолят Использование хелатирования для качественного и колич. обнаружения как полифункциональных группировок, так и ионов металлов.
Слайд 110
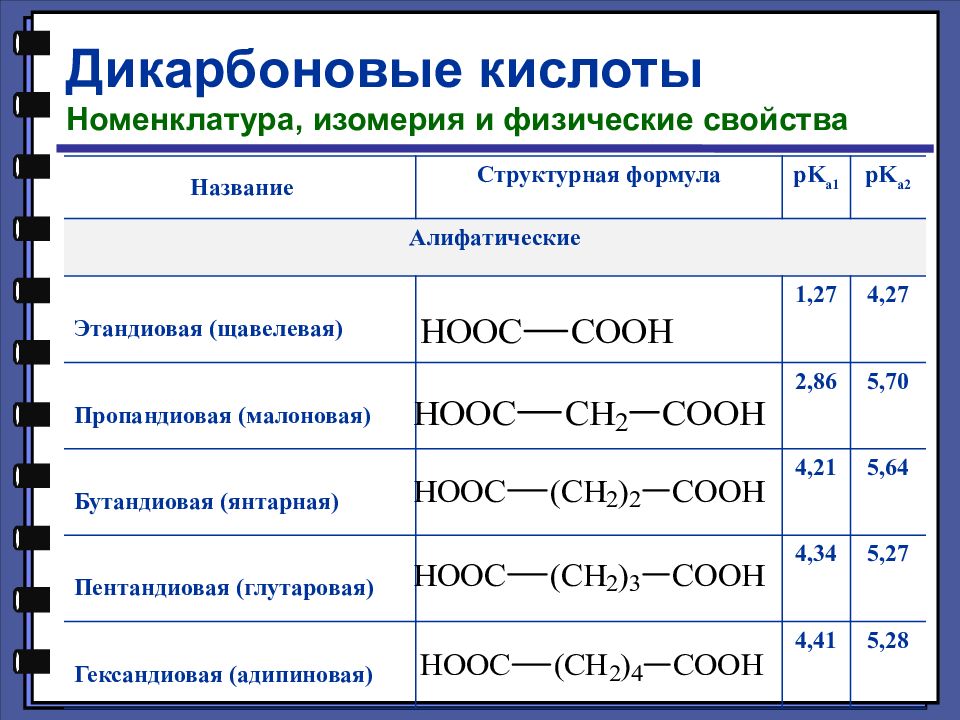
Дикарбоновые кислоты Номенклатура, изомерия и физические свойства Название Структурная формула pK a1 pK a2 Алифатические Этандиовая (щавелевая) 1,27 4,27 Пропандиовая (малоновая) 2,86 5,70 Бутандиовая (янтарная) 4,21 5,64 Пентандиовая (глутаровая) 4,34 5,27 Гександиовая (адипиновая) 4,41 5,28
Слайд 111
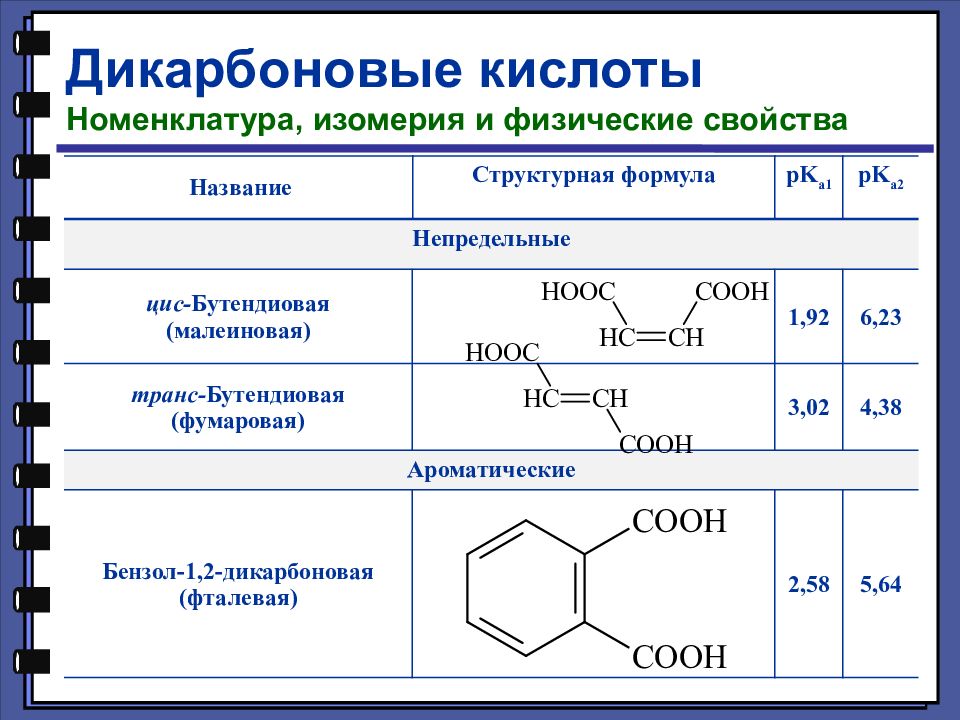
Дикарбоновые кислоты Номенклатура, изомерия и физические свойства Название Структурная формула pK a1 pK a2 Непредельные цис- Бутендиовая (малеиновая) 1,92 6,23 транс- Бутендиовая (фумаровая) 3,02 4,38 Ароматические Бензол-1,2-дикарбоновая (фталевая) 2, 58 5,64
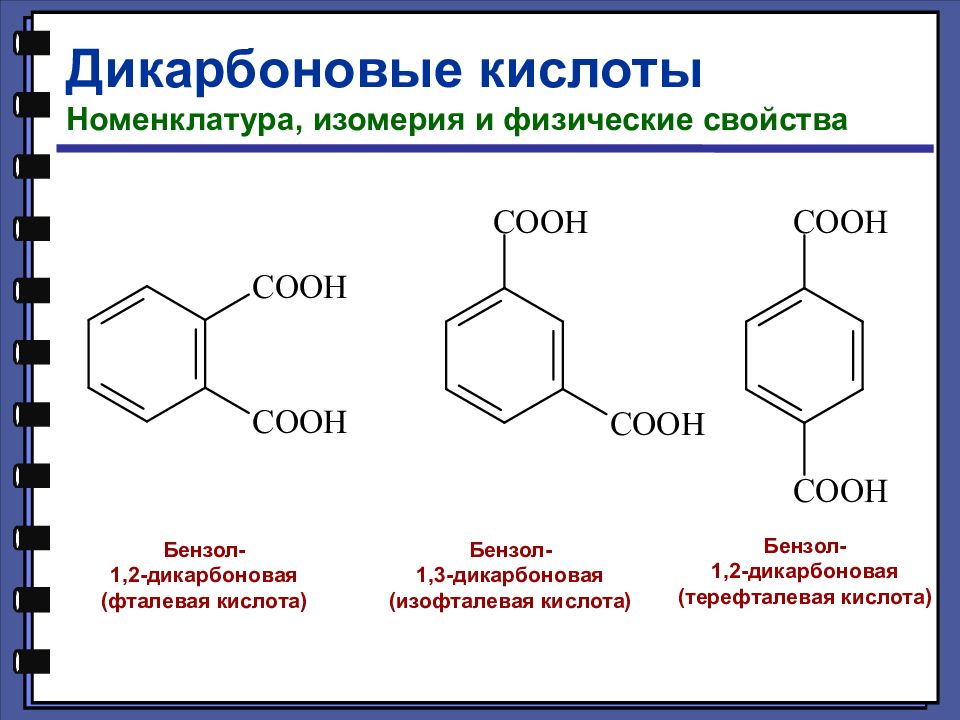
Слайд 112
Дикарбоновые кислоты Номенклатура, изомерия и физические свойства Бензол- 1,2-дикарбоновая (фталевая кислота) Бензол- 1,3-дикарбоновая (изофталевая кислота) Бензол- 1,2-дикарбоновая (терефталевая кислота)
Слайд 115
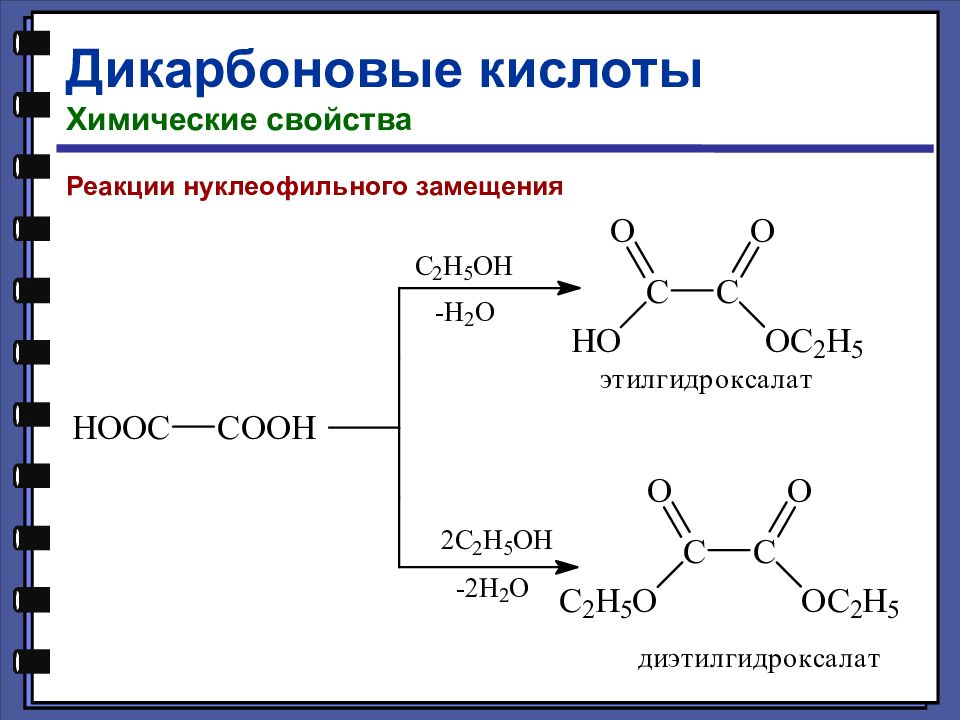
Дикарбоновые кислоты Химические свойства Реакции нуклеофильного замещения
Слайд 116
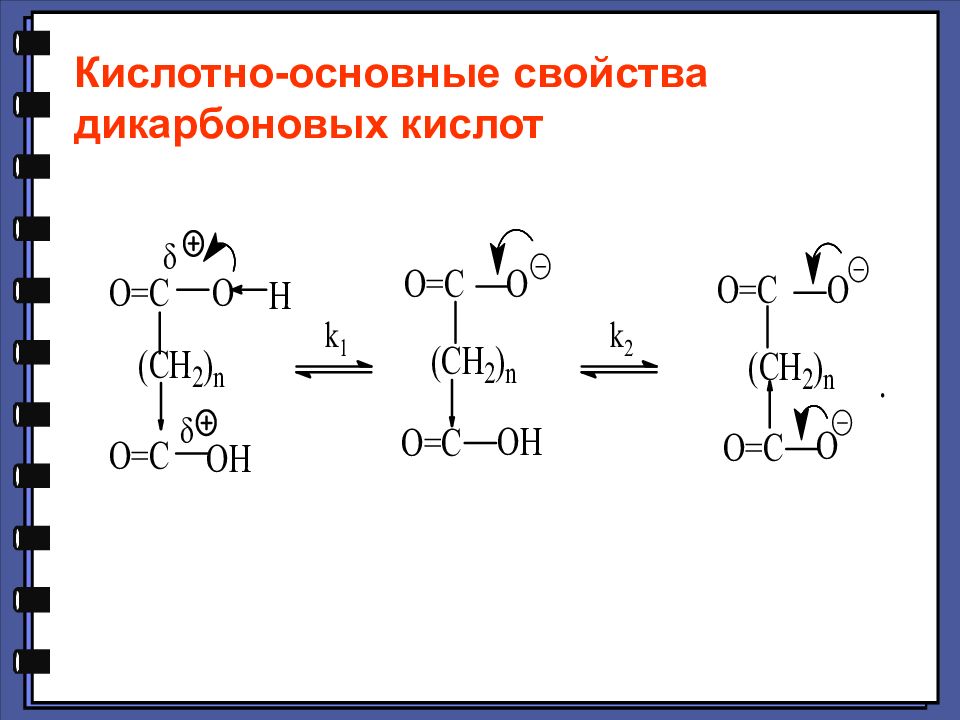
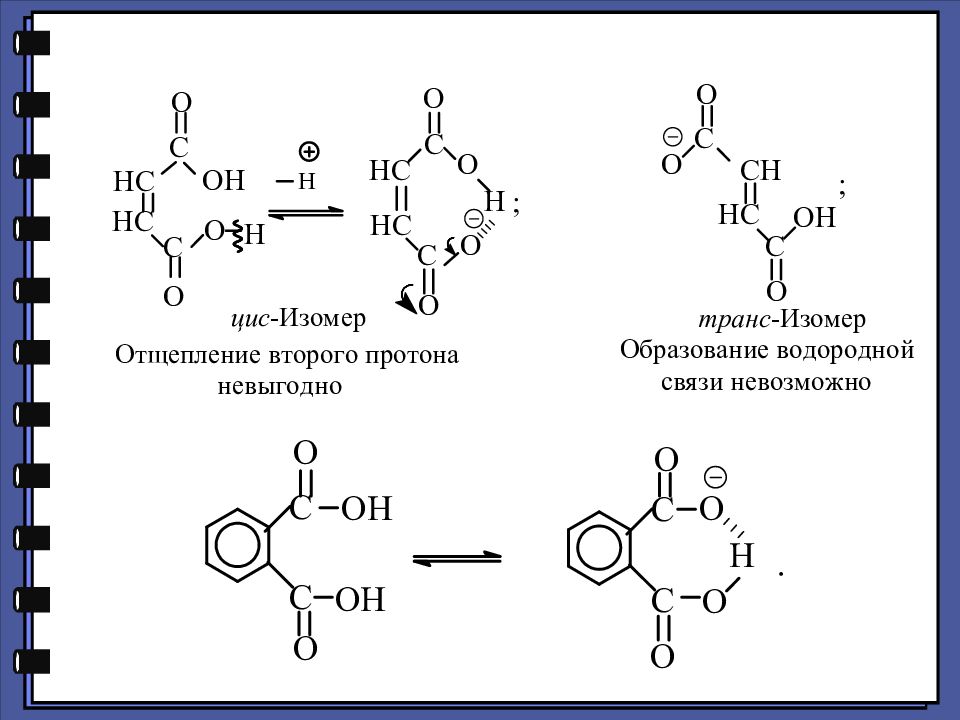
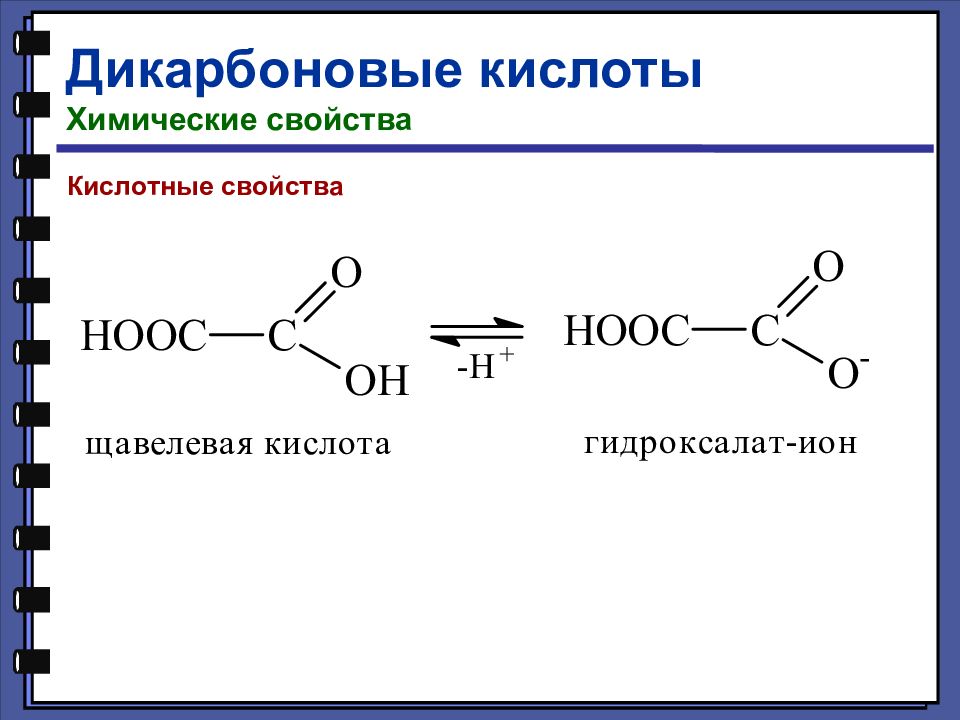
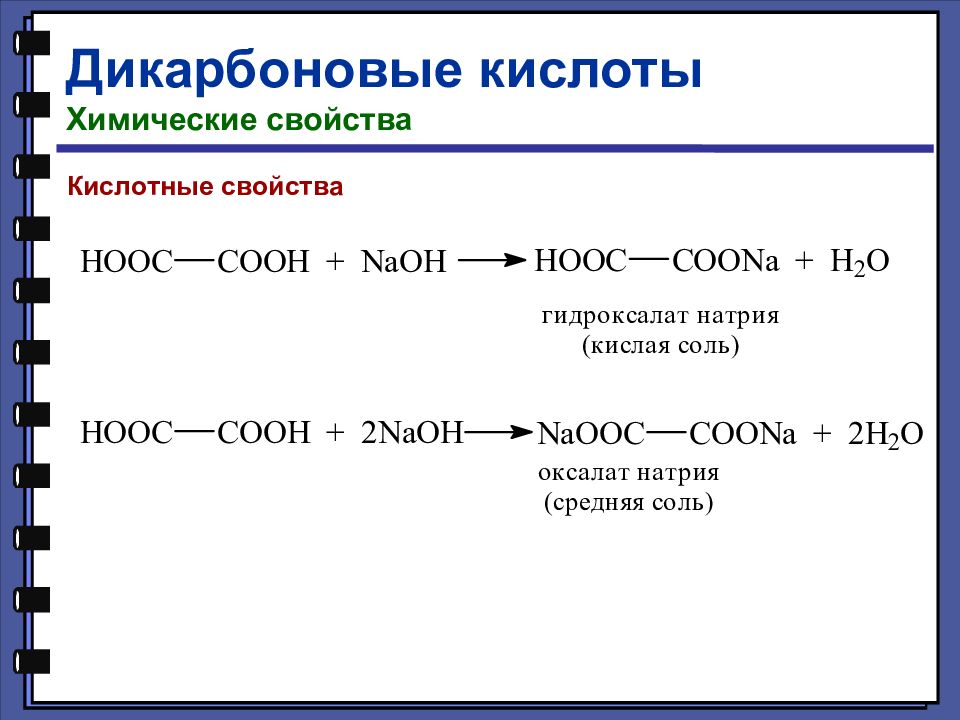
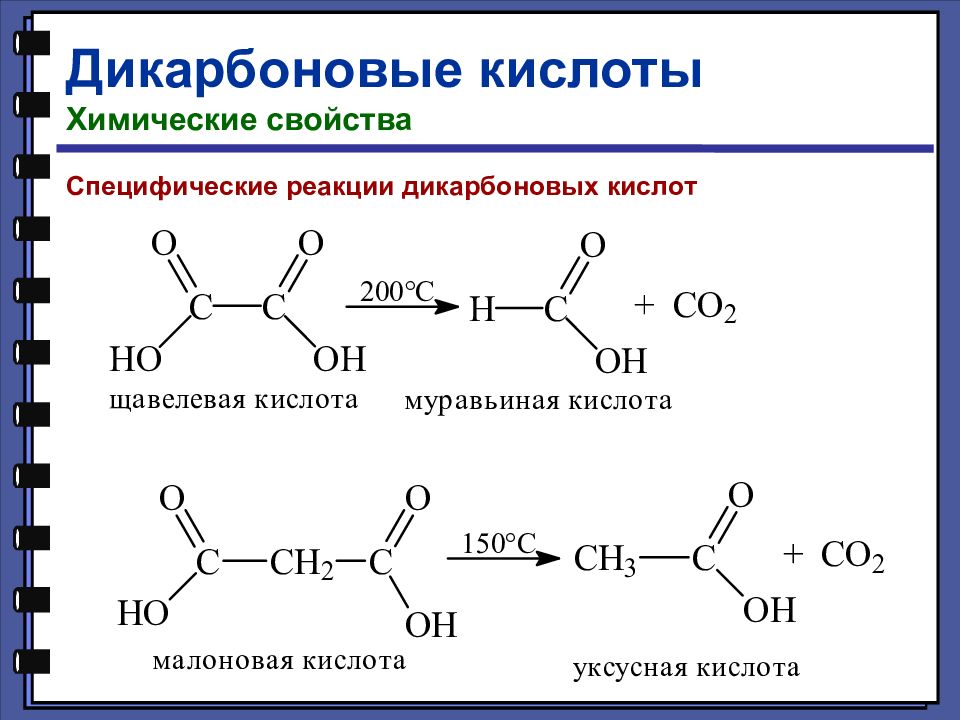
Дикарбоновые кислоты Химические свойства Специфические реакции дикарбоновых кислот
Слайд 117
Дикарбоновые кислоты Химические свойства Специфические реакции дикарбоновых кислот
Слайд 118
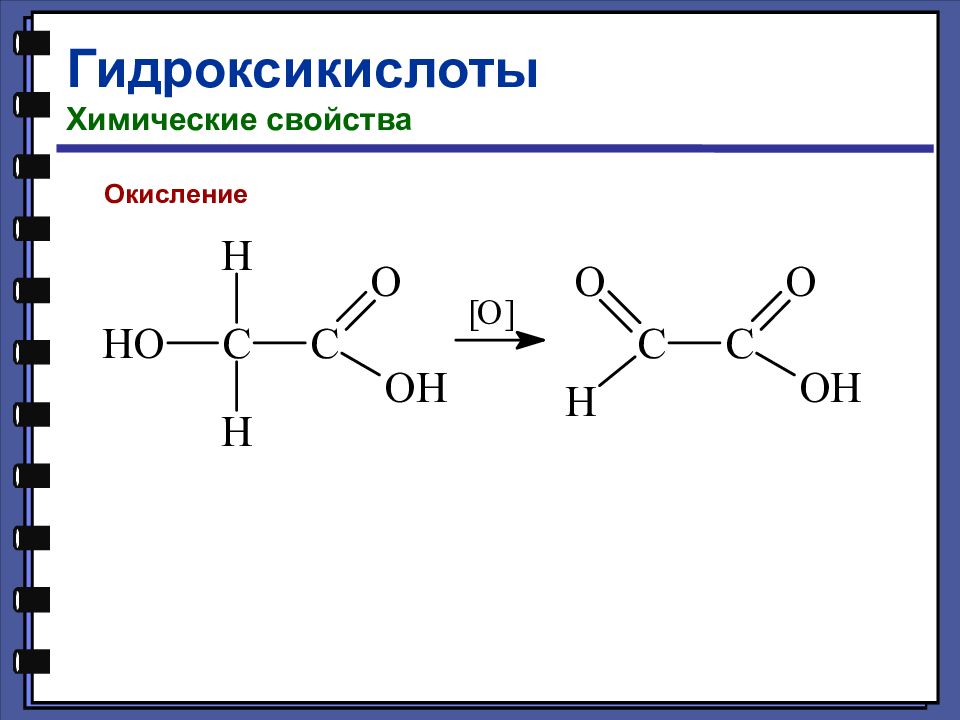
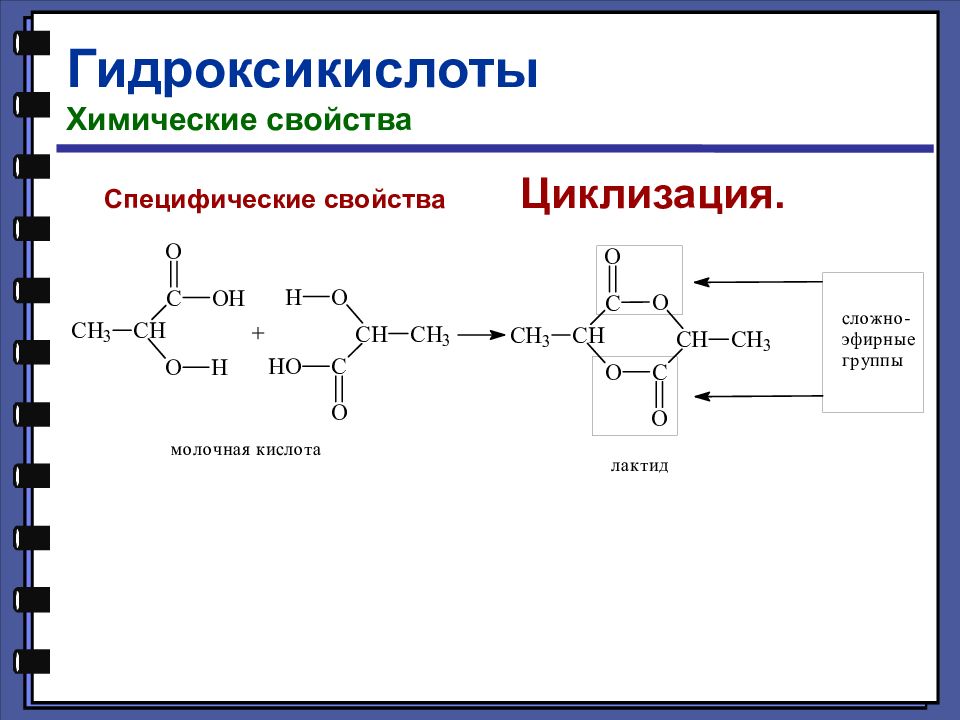
Гидроксикислоты Классификация Гидроксикислоты содержат в молекуле одновременно карбоксильную и гидроксильную группы В зависимости от природы углеводородного радикала гидроксикислоты могут быть алифатическими и ароматическими (фенолокислоты).
Слайд 119
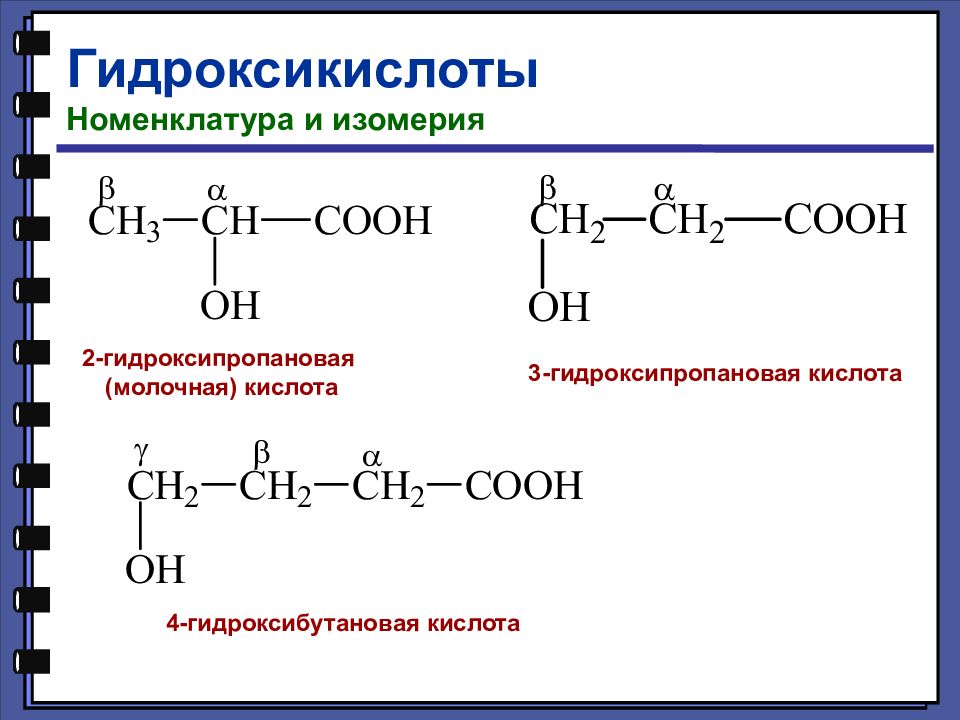
Гидроксикислоты Номенклатура и изомерия 2-гидроксипропановая (молочная) кислота 3-гидроксипропановая кислота 4-гидроксибутановая кислота
Слайд 120
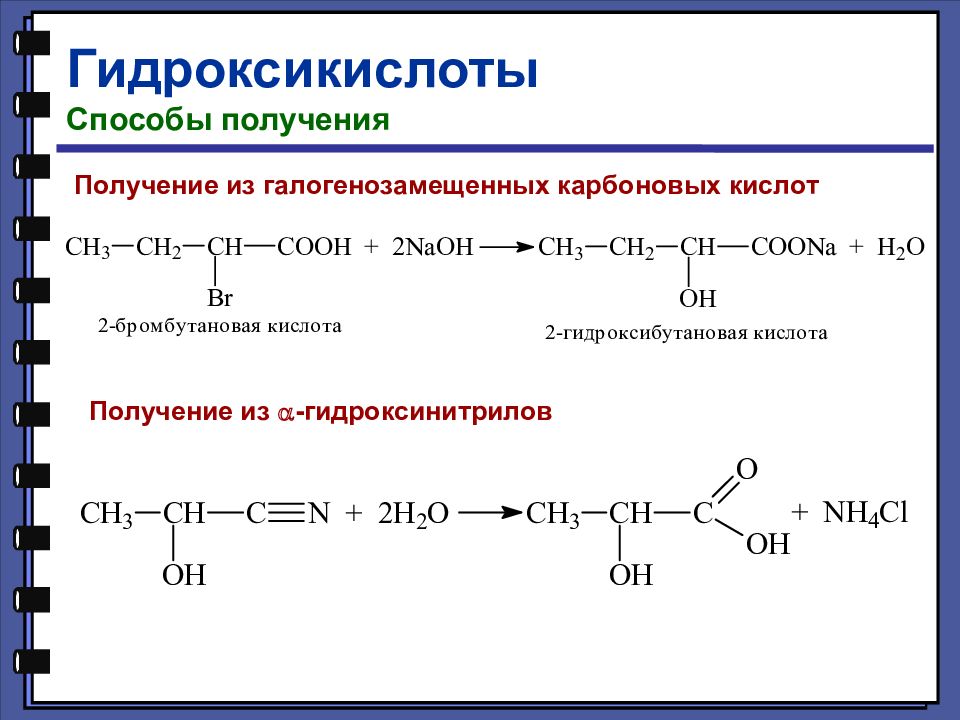
Гидроксикислоты Способы получения Получение из галогенозамещенных карбоновых кислот Получение из a -гидроксинитрилов
Слайд 121
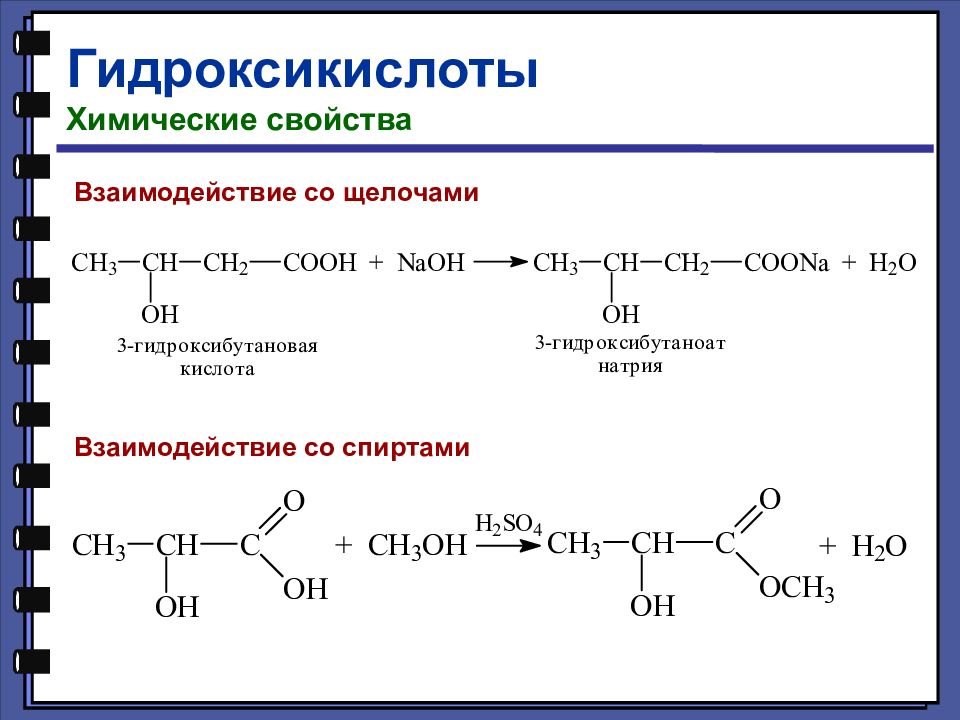
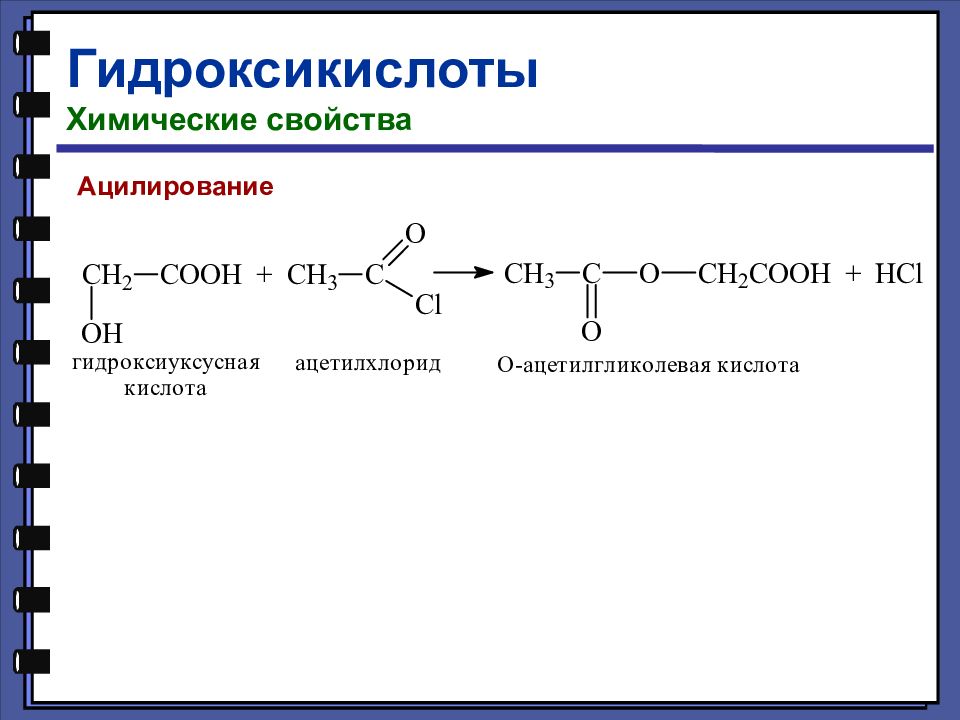
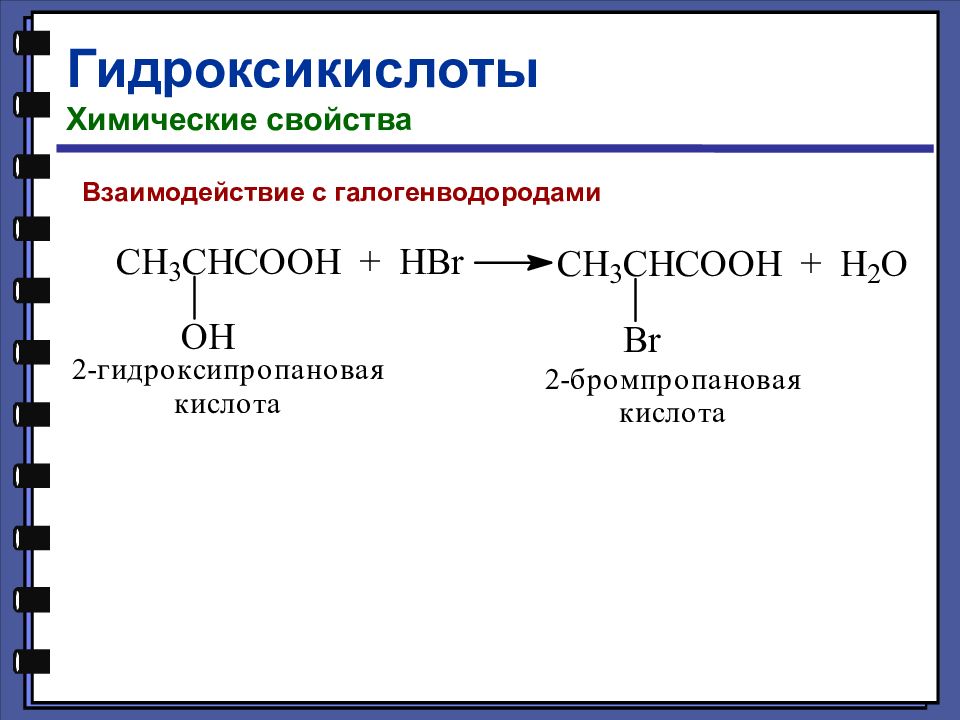
Гидроксикислоты Химические свойства Взаимодействие со щелочами Взаимодействие со спиртами
Слайд 122
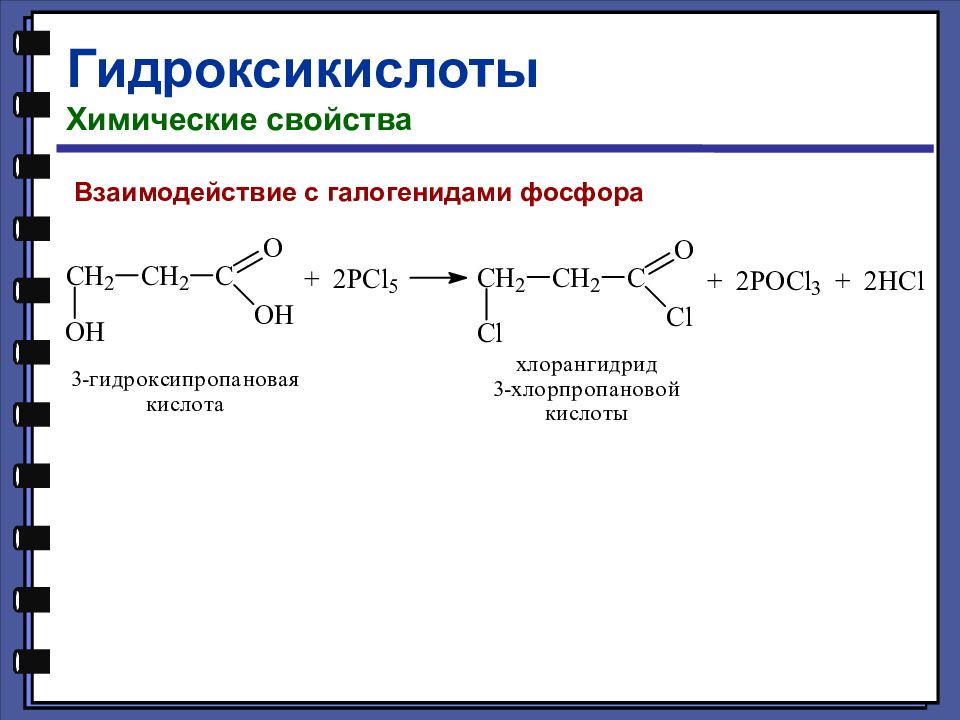
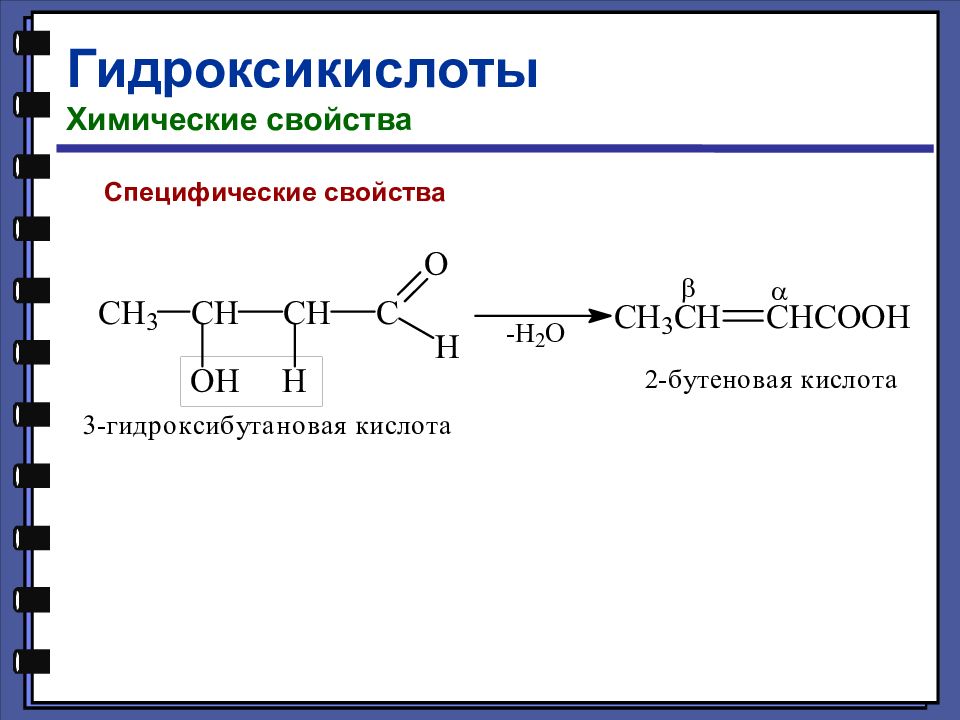
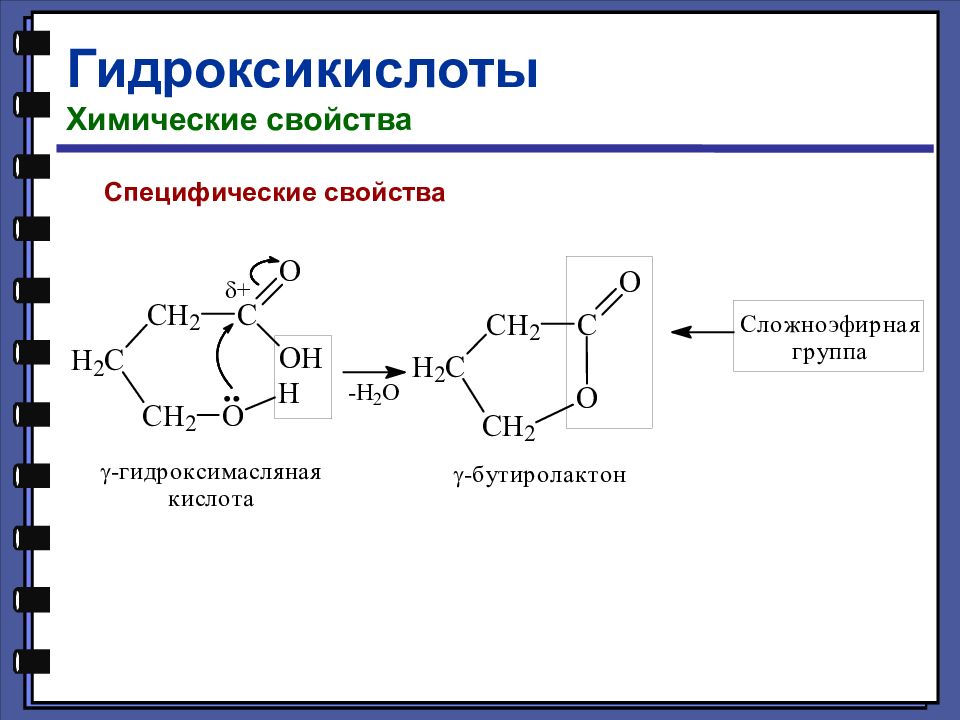
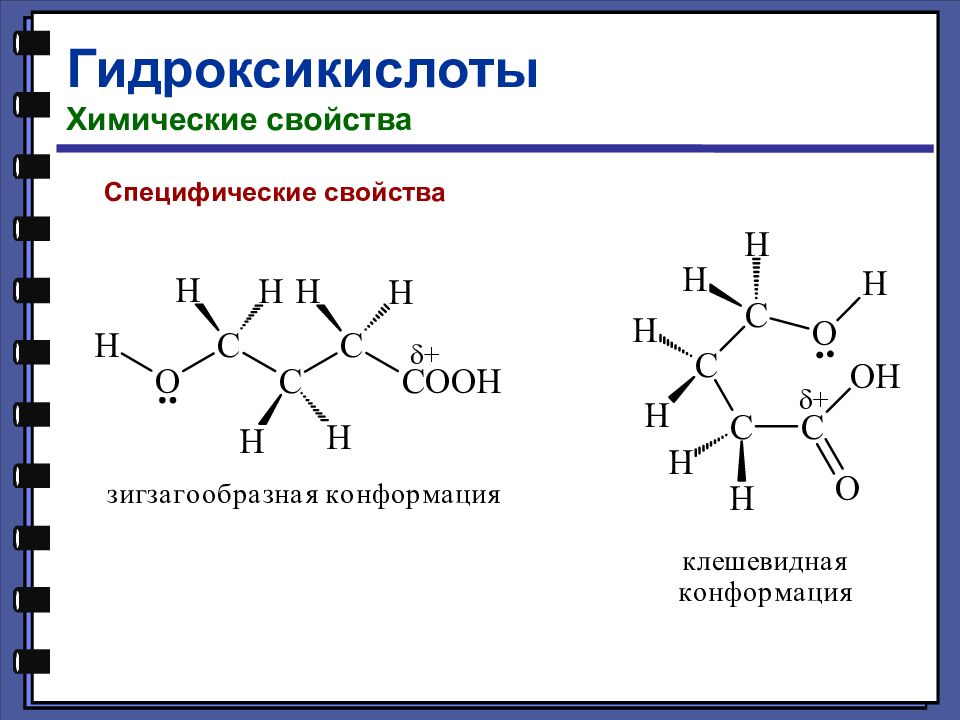
Гидроксикислоты Химические свойства Взаимодействие с галогенидами фосфора
Слайд 126
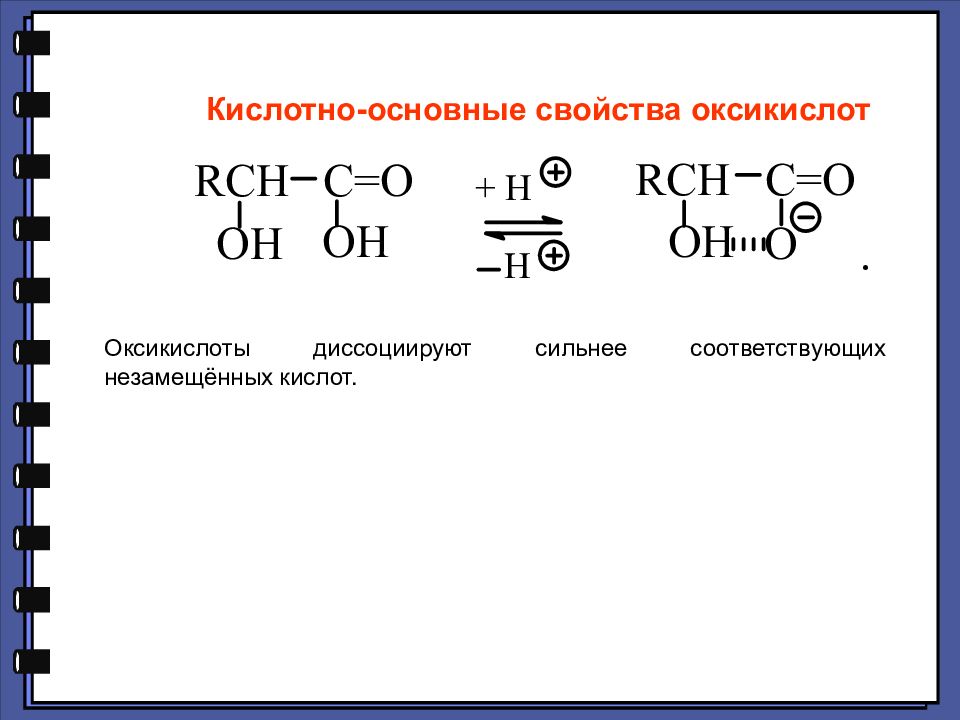
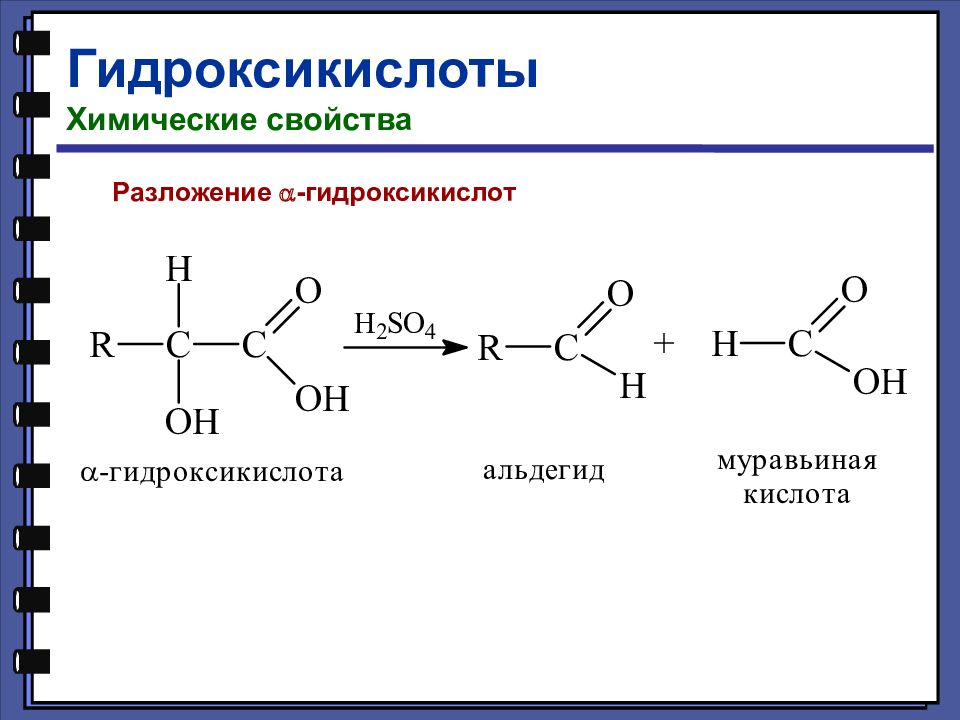
Кислотно-основные свойства оксикислот Оксикислоты диссоциируют сильнее соответствующих незамещённых кислот.
Слайд 127
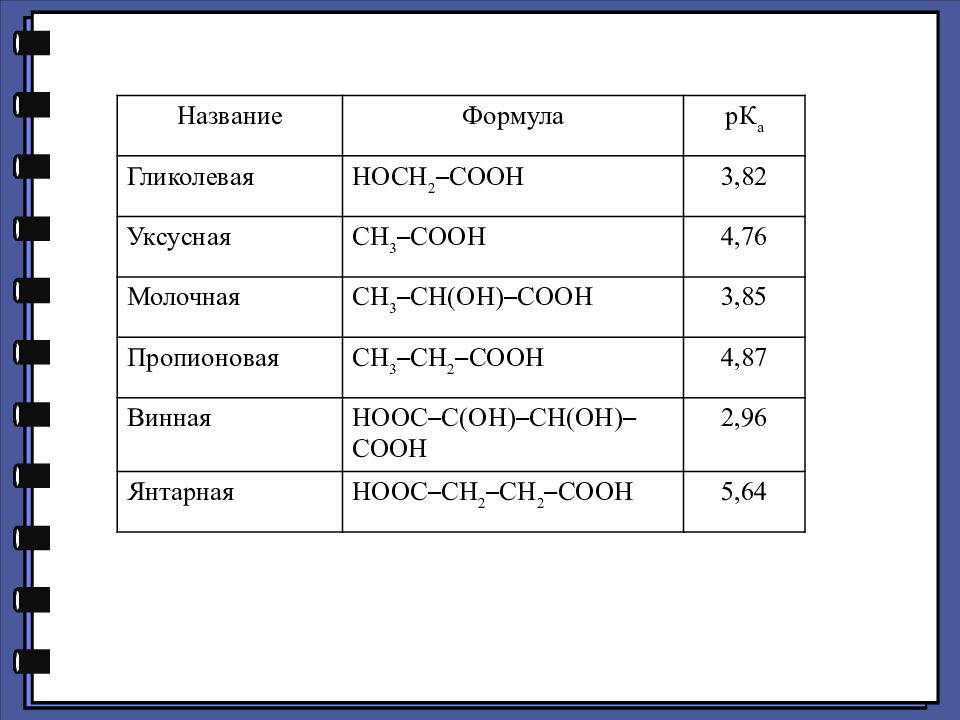
Название Формула рК а Гликолевая HOCH 2 – COOH 3,82 Уксусная СН 3 – СООН 4,76 Молочная СН 3 – CH ( OH ) – COOH 3,85 Пропионовая СН 3 – CH 2 – COOH 4,87 Винная НООС – С(ОН) – СН(ОН) – СООН 2,96 Янтарная HOOC – CH 2 – CH 2 – COOH 5,64
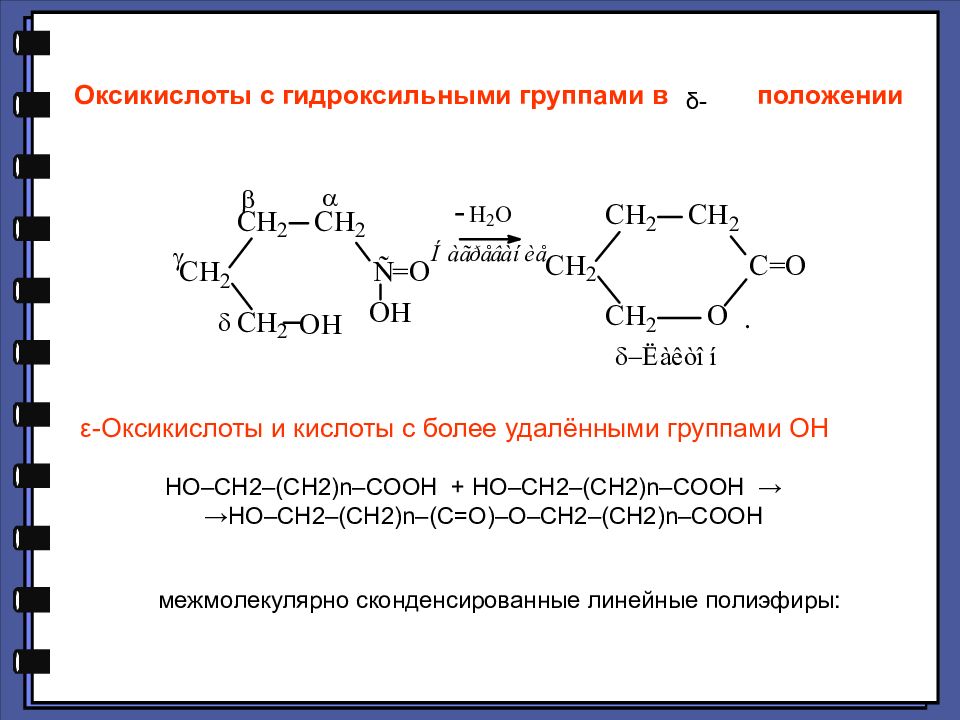
Слайд 131
ε-Оксикислоты и кислоты с более удалёнными группами ОН HO–CH2–(CH2)n–COOH + HO–CH2–(CH2)n–COOH → →HO–CH2–(CH2)n–(C=O)–O–CH2–(CH2)n–COOH межмолекулярно сконденсированные линейные полиэфиры: Оксикислоты с гидроксильными группами в положении δ-
Слайд 133
Хелатообразование Реактив Фелинга, которое образуется при смешивании калий, натриевой соли винной (2,3-дигидроксибутандиовой) кислоты с гидроокисью двухвалентной меди:
Слайд 135
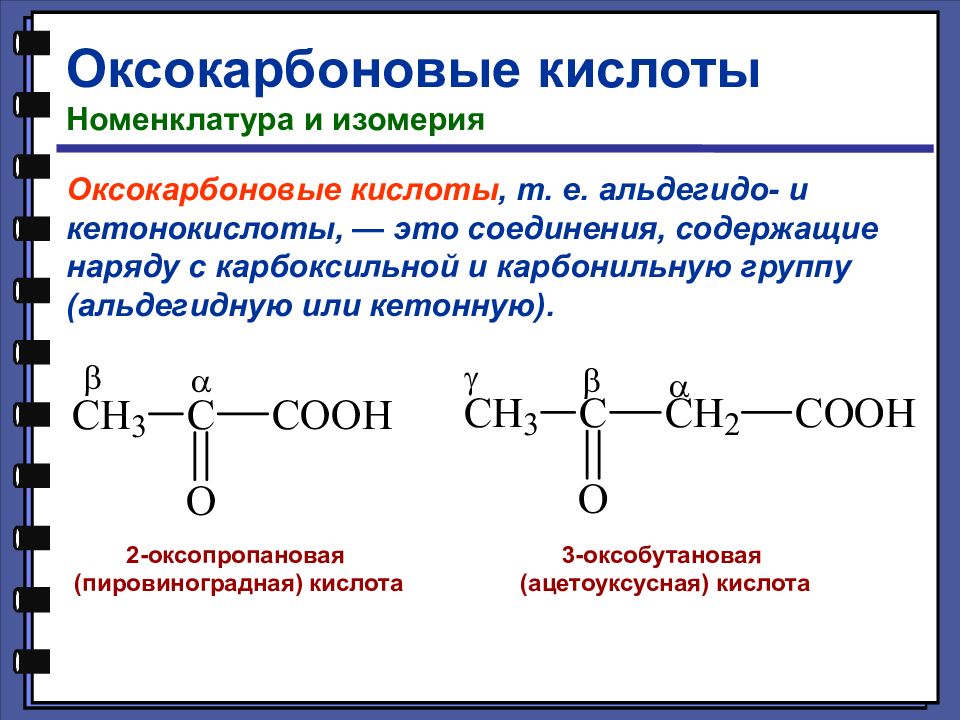
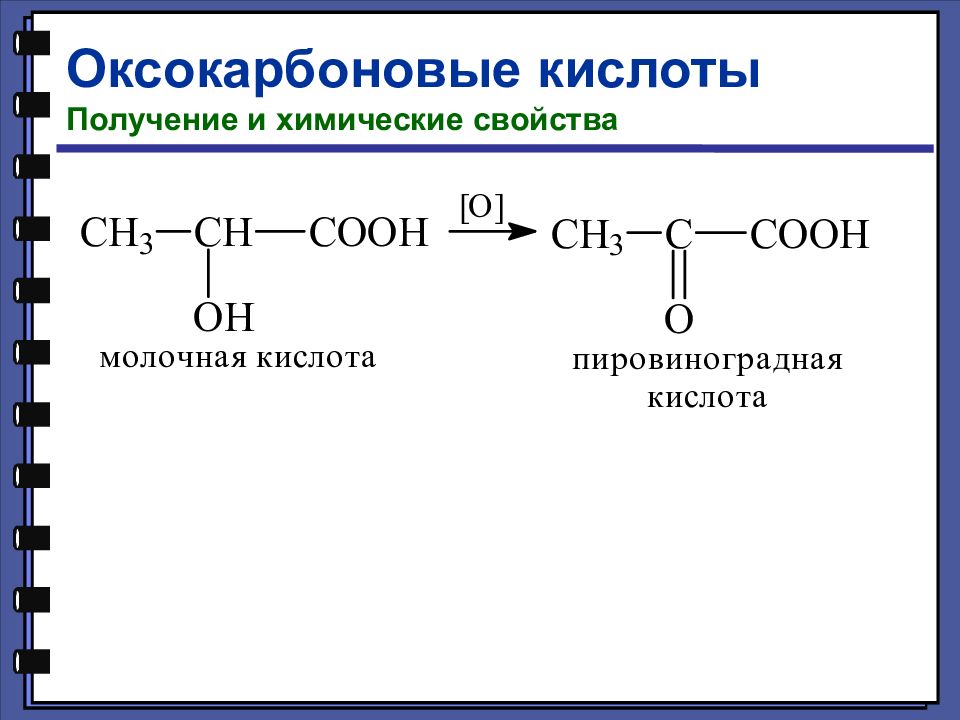
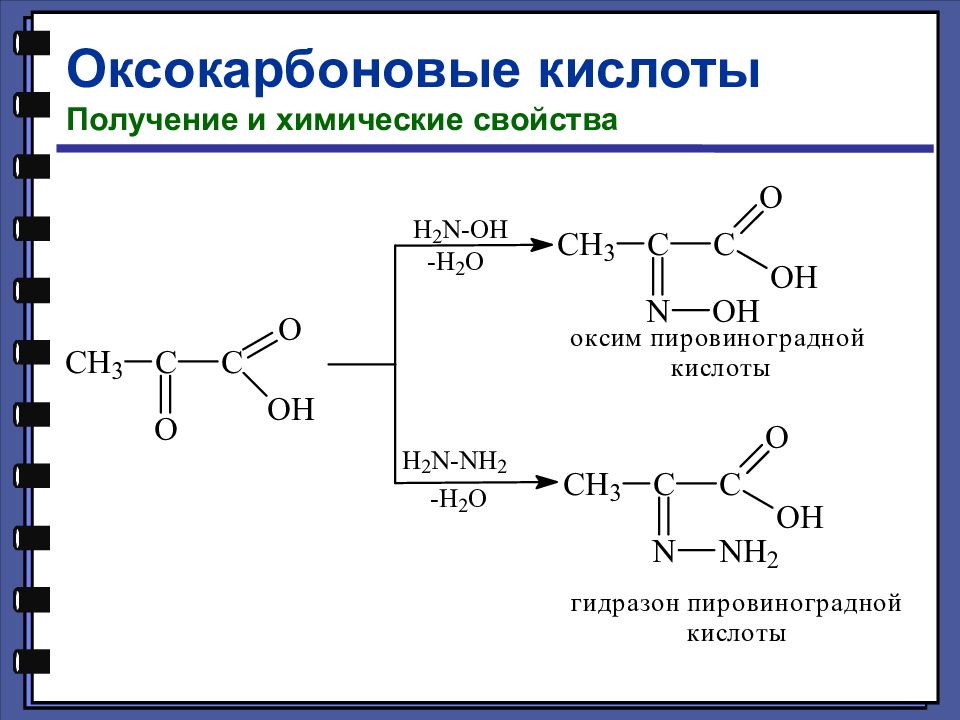
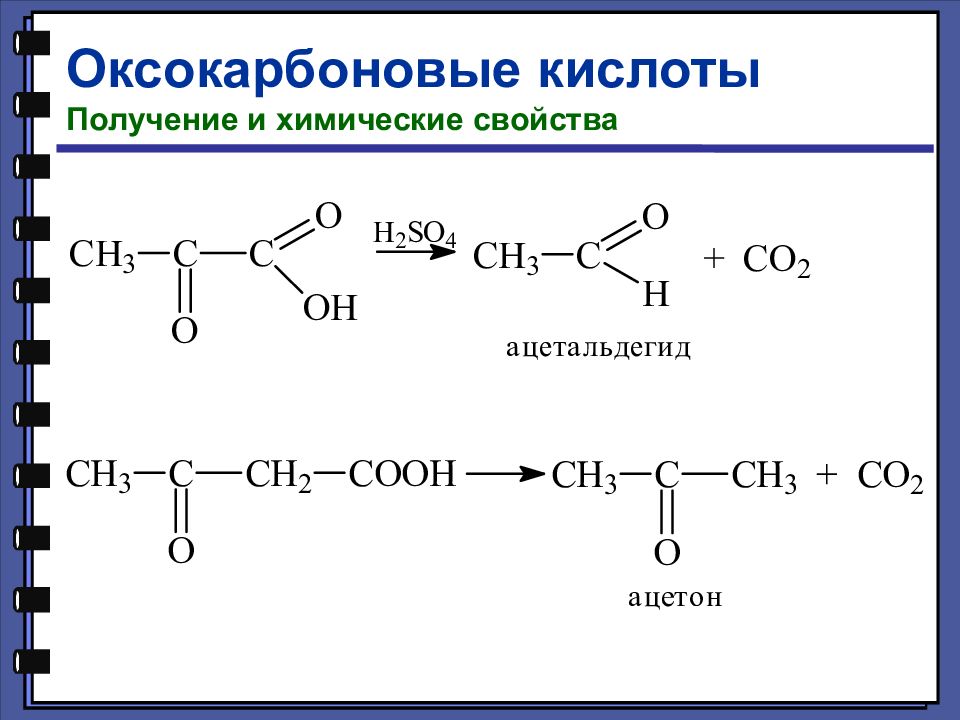
Оксокарбоновые кислоты Номенклатура и изомерия Оксокарбоновые кислоты, т. е. альдегидо- и кетонокислоты, — это соединения, содержащие наряду с карбоксильной и карбонильную группу (альдегидную или кетонную). 2-оксопропановая (пировиноградная) кислота 3-оксобутановая (ацетоуксусная) кислота
Слайд 140
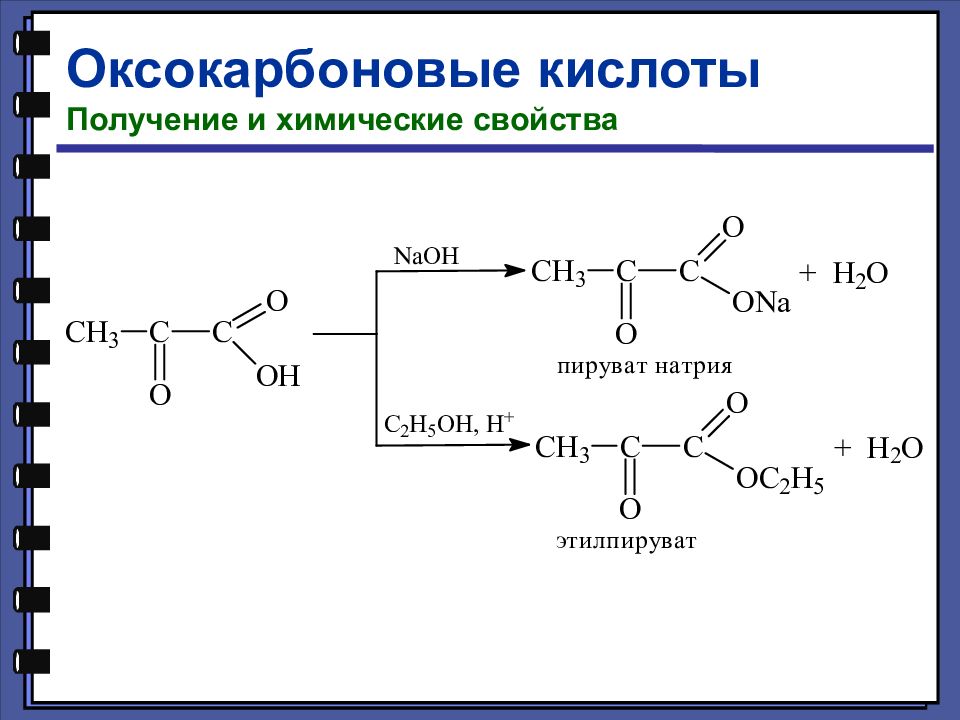
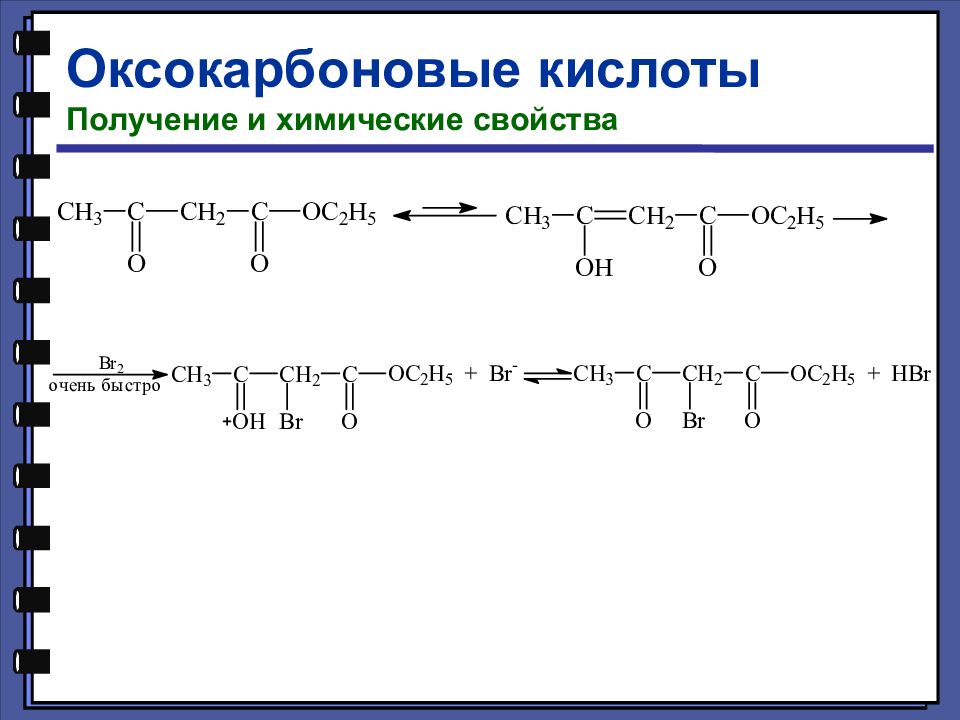
Оксокарбоновые кислоты Получение и химические свойства Таутомерия (динамическая изомерия) — это подвижное равновесие между взаимопревращающимися структурными изомерами. 92,5% 7,5%
Слайд 141
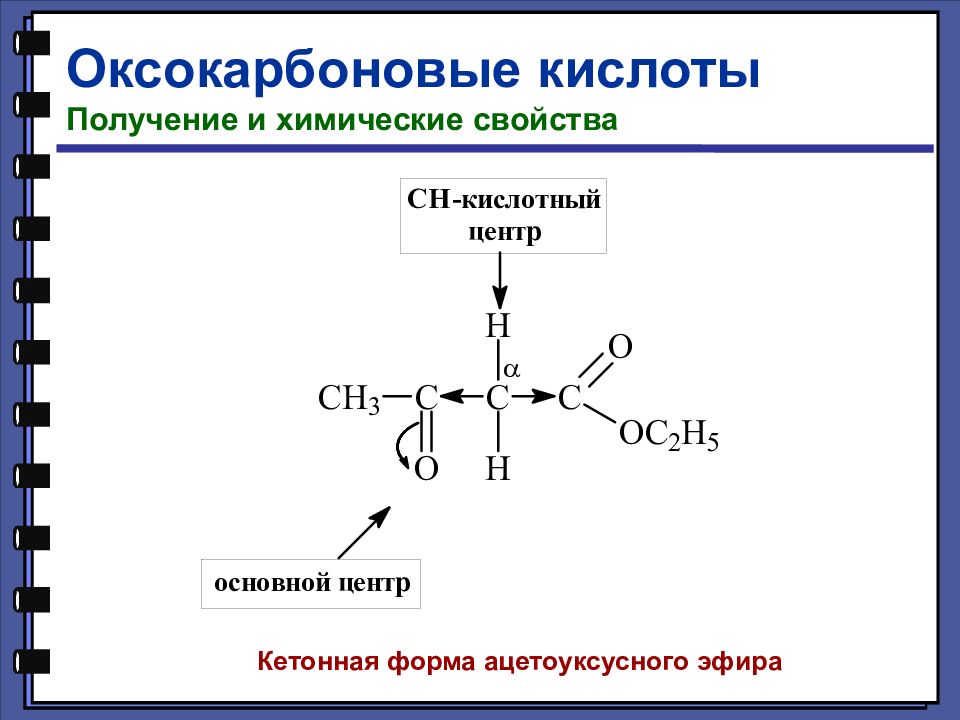
Оксокарбоновые кислоты Получение и химические свойства Кетонная форма ацетоуксусного эфира
Слайд 142
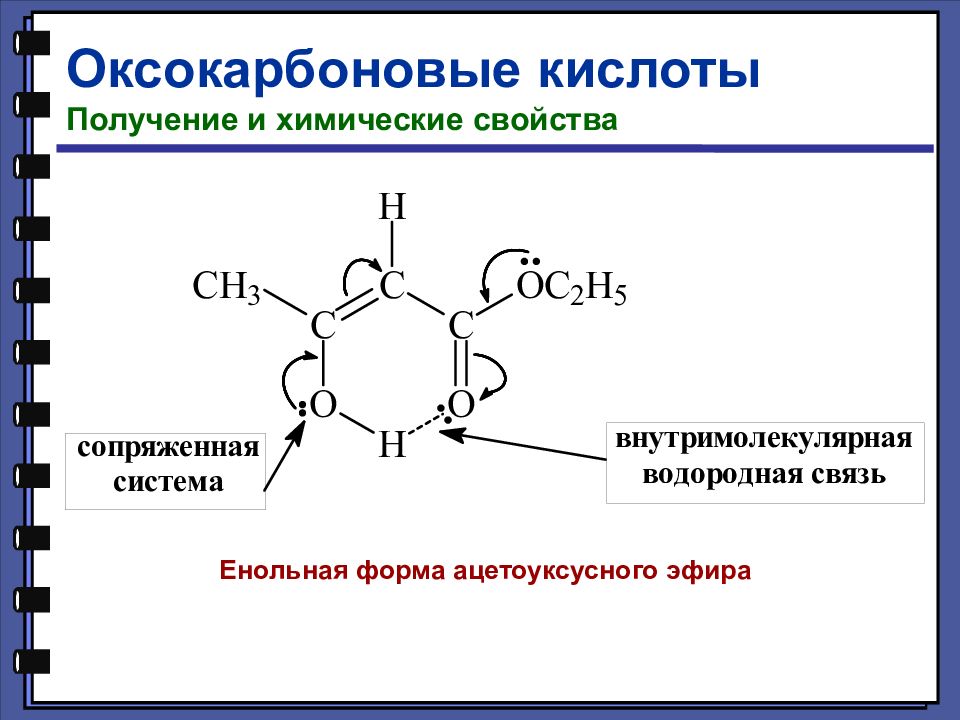
Оксокарбоновые кислоты Получение и химические свойства Енольная форма ацетоуксусного эфира