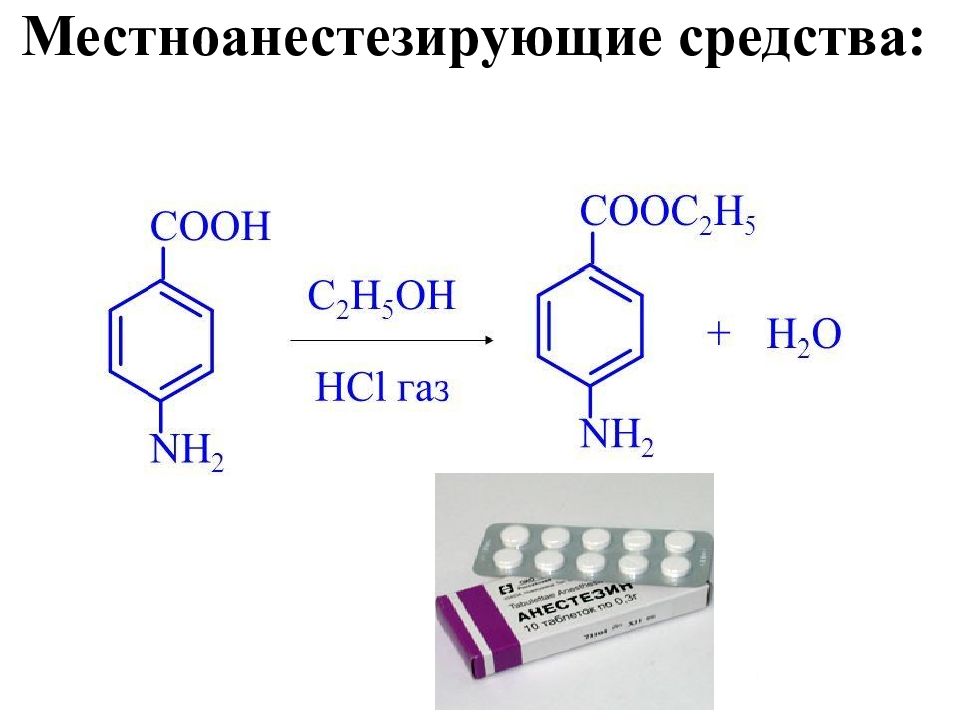
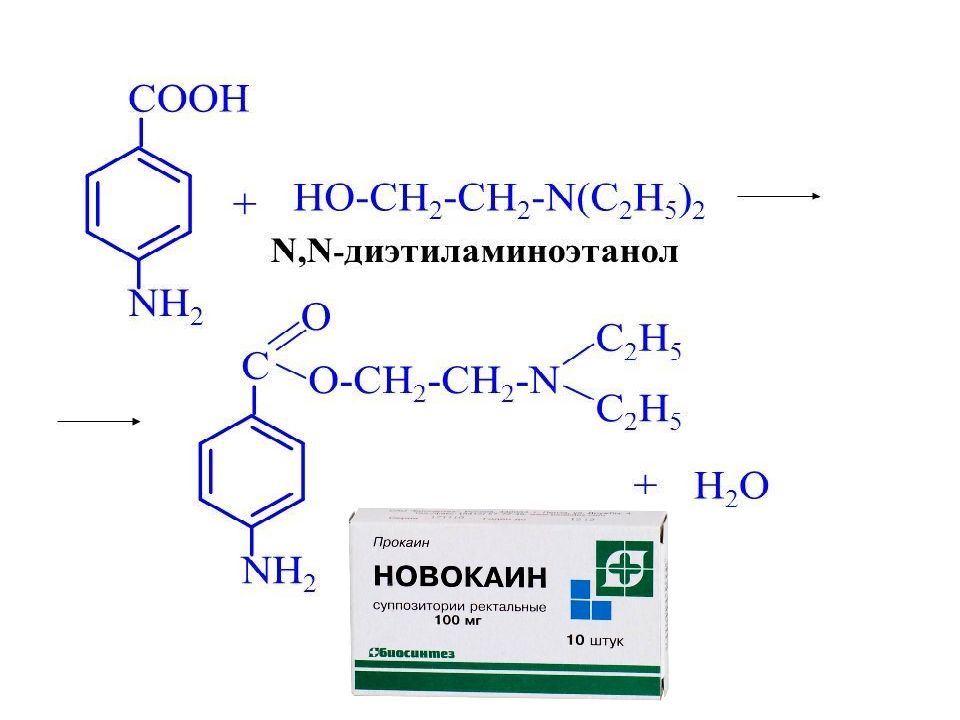
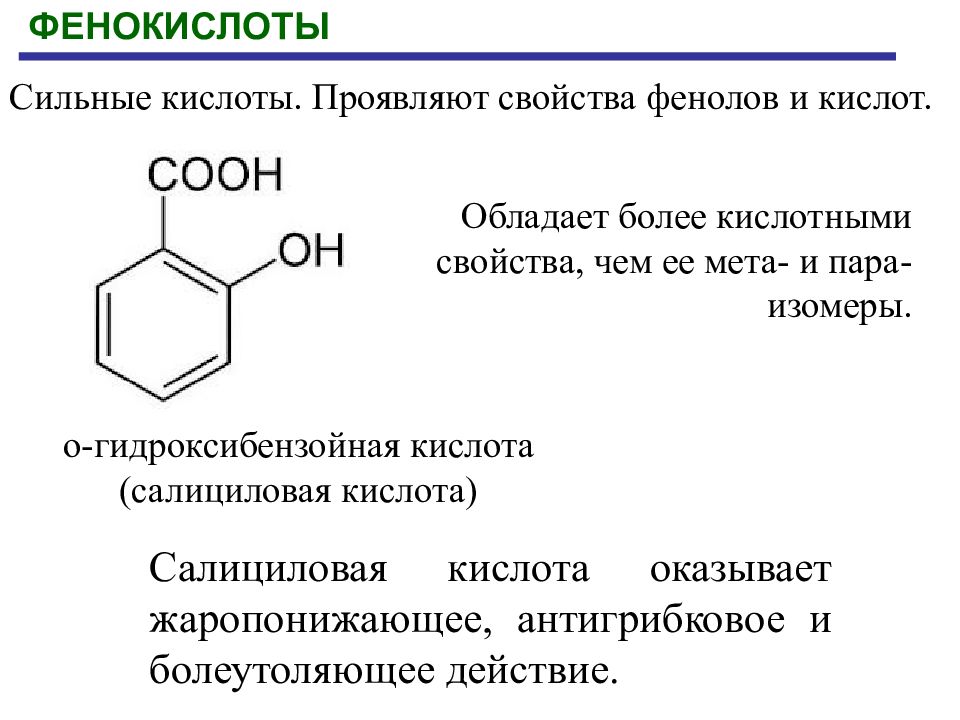
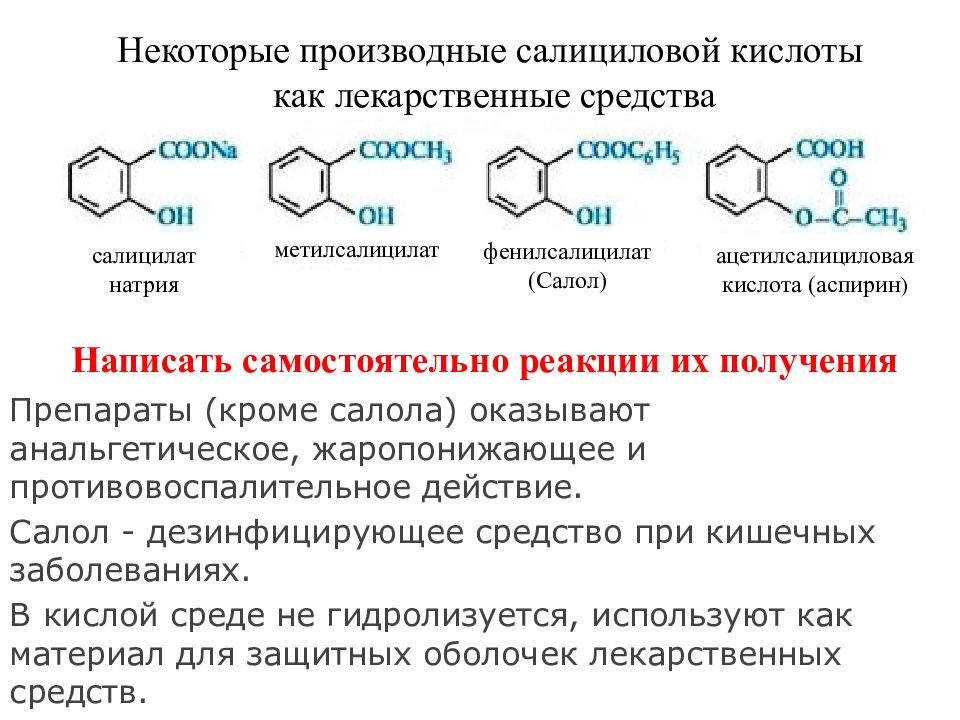
Первый слайд презентации: КАРБОНОВЫЕ КИСЛОТЫ И ИХ ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ : ГИДРОКСИ- И ОКСОКАРБОНОВЫЕ КИСЛОТЫ
Слайд 2
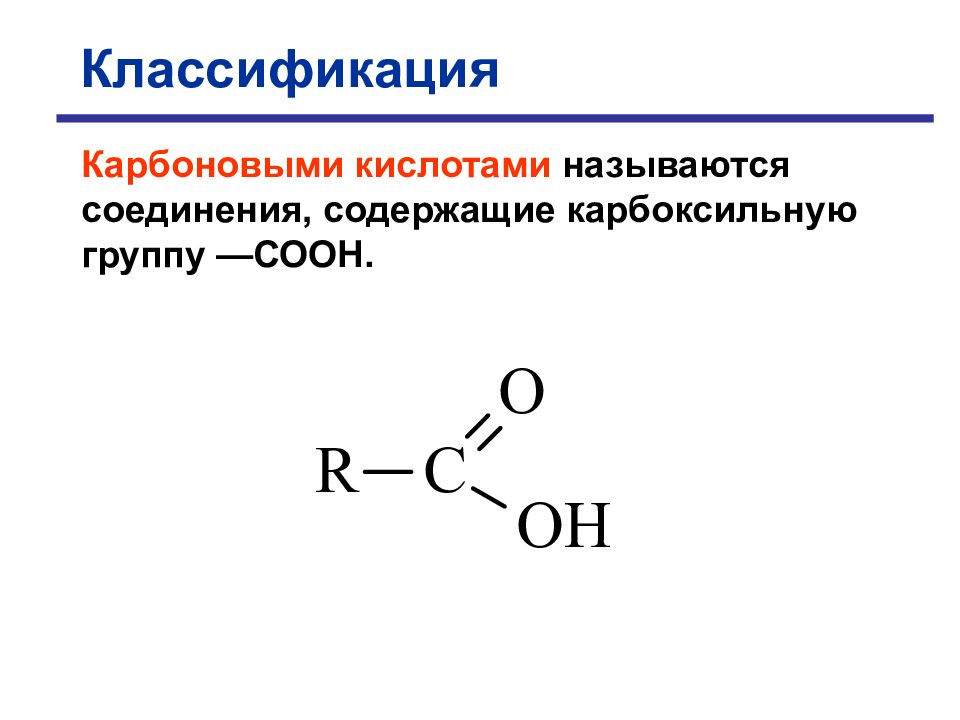
Классификация Карбоновыми кислотами называются соединения, содержащие карбоксильную группу —СООН.
Слайд 3
1. По числу карбоксильных групп : моно-, дикарбоновые кислоты и т.д. 2. В зависимости от строения радикала: - алифатические предельные (ациклические, циклические ) - непредельные (содержат одну или несколько кратных связей) - ароматические (карбо- и гетероароматические) 3. В связи с присутствием в радикале других функциональных групп: - гидроксикарбоновые (содержат одну или несколько гидроксильных групп) - оксокарбоновые (содержат карбонильную группу- альдегидную или кетоновую) - аминокислоты (содержат одну или несколько аминогрупп).
Слайд 4: МОНОКАРБОНОВЫЕ КИСЛОТЫ
Слайд 6: ХИМИЧЕСКИЕ СВОЙСТВА
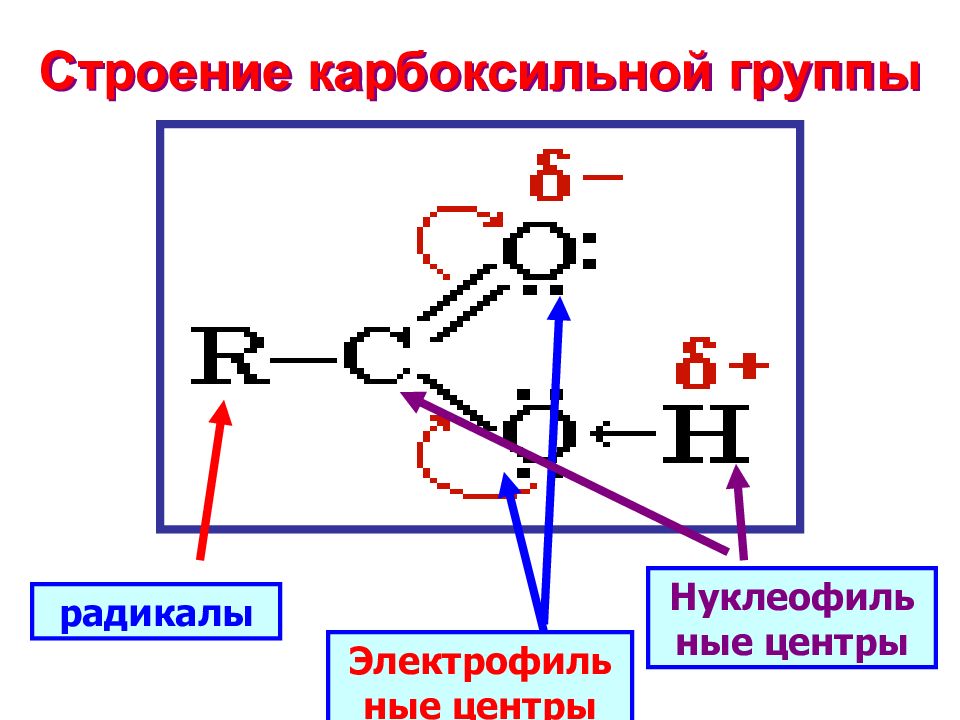
Слайд 7: Строение карбоксильной группы
радикалы Нуклеофильные центры Электрофильные центры
Слайд 9
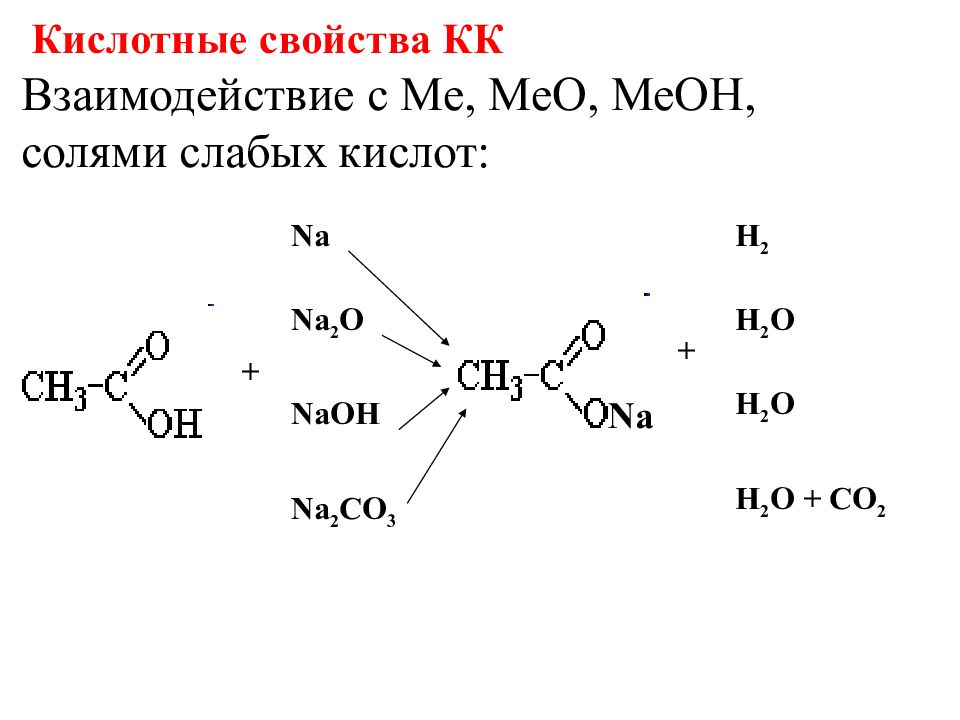
Взаимодействие с Me, MeO, MeOH, солями слабых кислот: Na + Na Na 2 O NaOH Na 2 CO 3 H 2 H 2 O H 2 O H 2 O + CO 2 + Кислотные свойства КК
Слайд 10
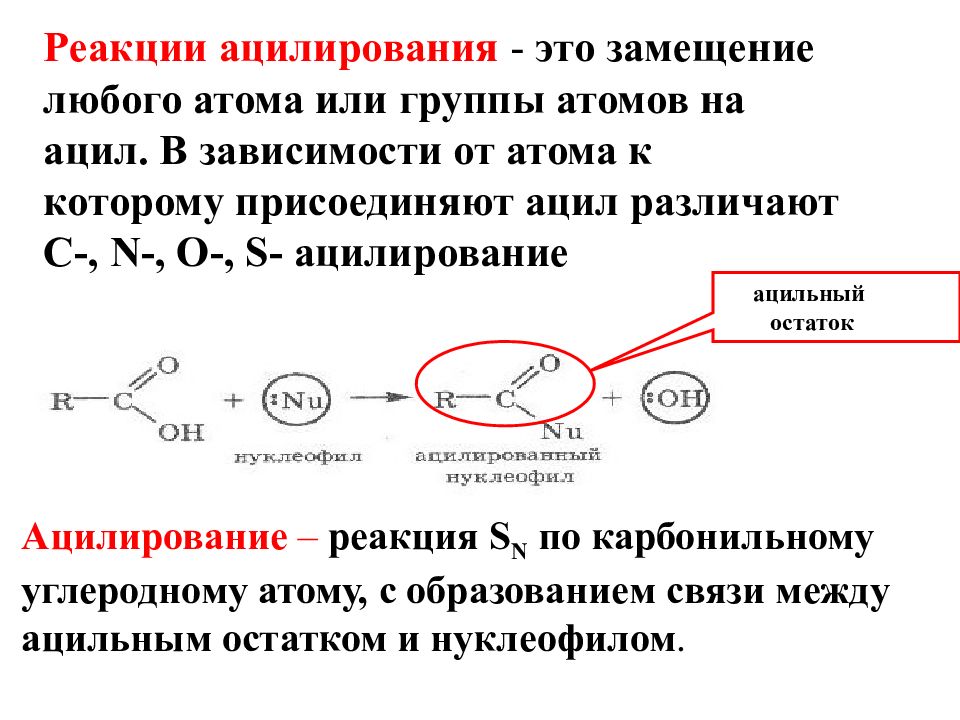
Реакции ацилирования - это замещение любого атома или группы атомов на ацил. В зависимости от атома к которому присоединяют ацил различают C-, N-, O-, S- ацилирование Ацилирование – реакция S N по карбонильному углеродному атому, с образованием связи между ацильным остатком и нуклеофилом. ацильный остаток
Слайд 11
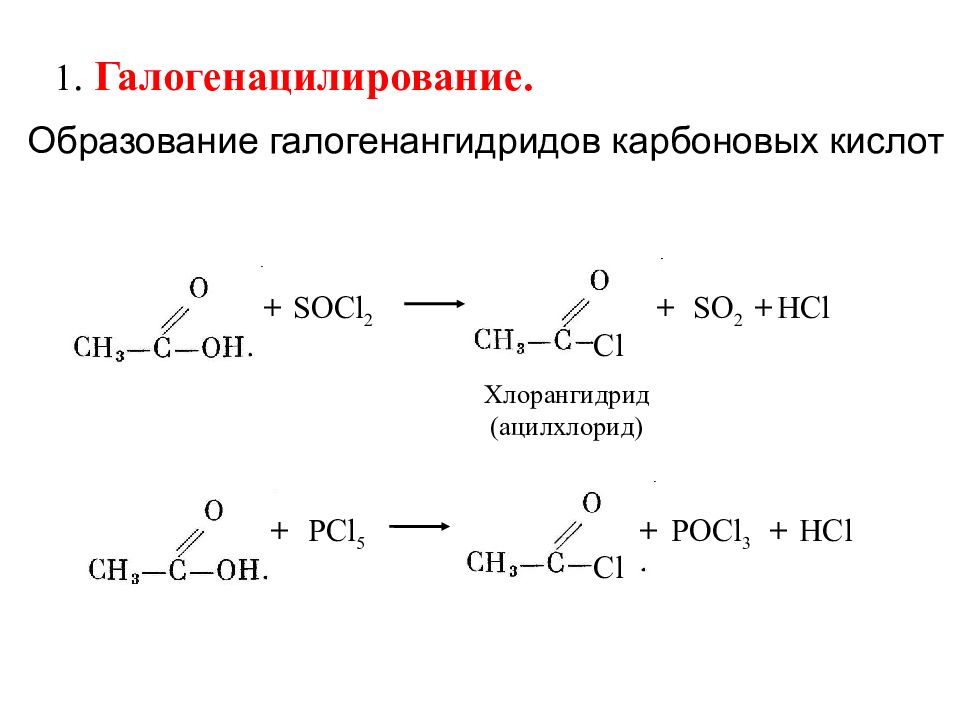
1. Галогенацилирование. + PCl 5 + POCl 3 + HCl Cl + SOCl 2 + SO 2 + HCl Хлорангидрид (ацилхлорид) Cl Образование галогенангидридов карбоновых кислот
Слайд 12
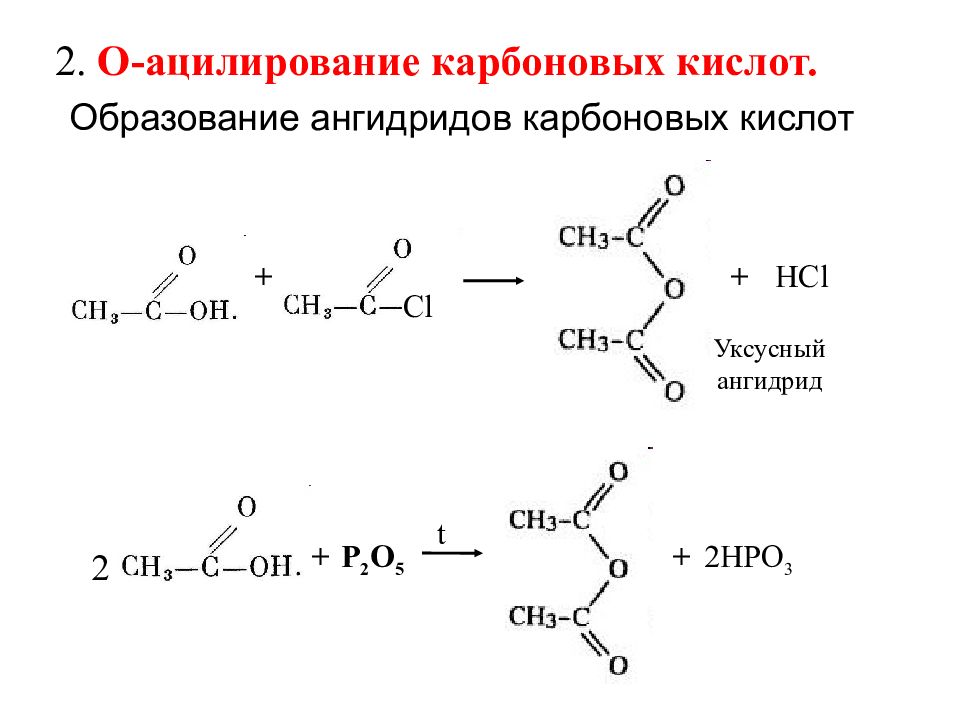
+ + HCl Уксусный ангидрид Cl 2. О-ацилирование карбоновых кислот. t + P 2 О 5 + 2Н PO 3 2 Образование ангидридов карбоновых кислот
Слайд 13
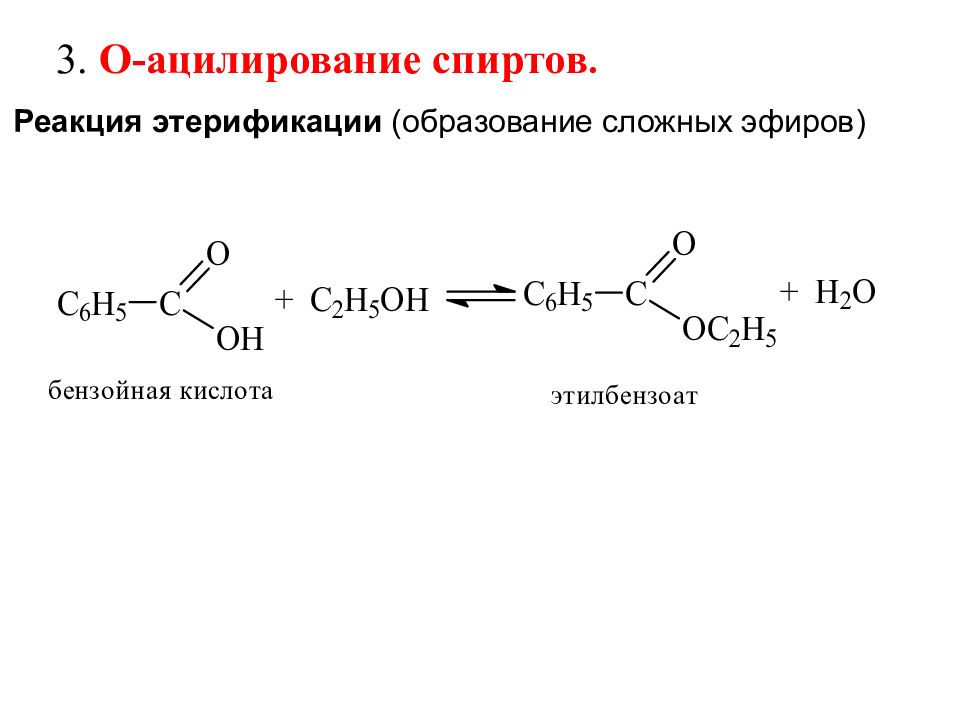
Реакция этерификации (образование сложных эфиров) 3. О-ацилирование спиртов.
Слайд 14
Образование амидов карбоновых кислот 4. N -ацилирование аминов. Реакция образования амидов играет большую роль в организме: за счет этой реакции происходит обезвреживание токсичного аммиака. (этанамид, амид уксусной кислоты)
Слайд 15
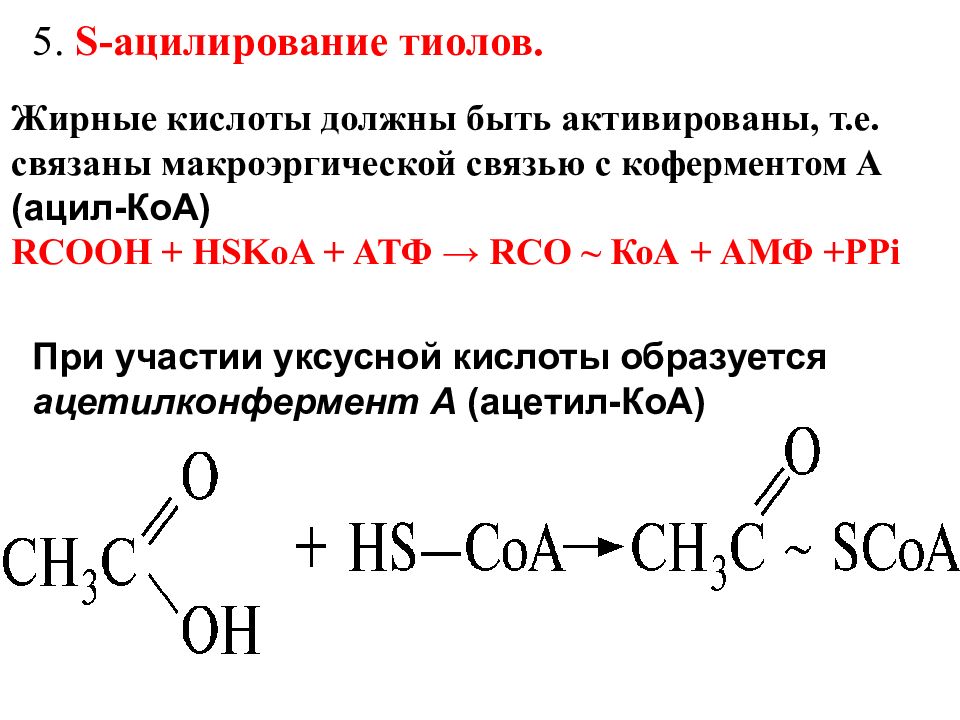
S-Ацилирование тиолов. В метаболизме карбоновых кислот большую роль играет их способность при участии АТФ ацилировать кофермент А*( Кофермент А -сложное соединение, содержащее остаток 2-амино-этантиола HSCH 2 CH 2 NHR, где R включает пантотеновую кислоту и фосфатное производное аденозина. Кофермент А кратко записывается Н S КоА), который содержит тиольную группу (—SH), с образованием сложных тиоэфиров, называемых ацилкоферментами А (ацил-КоА или RCOSKoA):
Слайд 16
5. S -ацилирование тиолов. При участии уксусной кислоты образуется ацетилконфермент А (ацетил-КоА) Жирные кислоты должны быть активированы, т.е. связаны макроэргической связью с коферментом А (ацил-КоА) RCOOH + HSKoA + АТФ → RCO ~ КоА + АМФ +РР i
Слайд 17
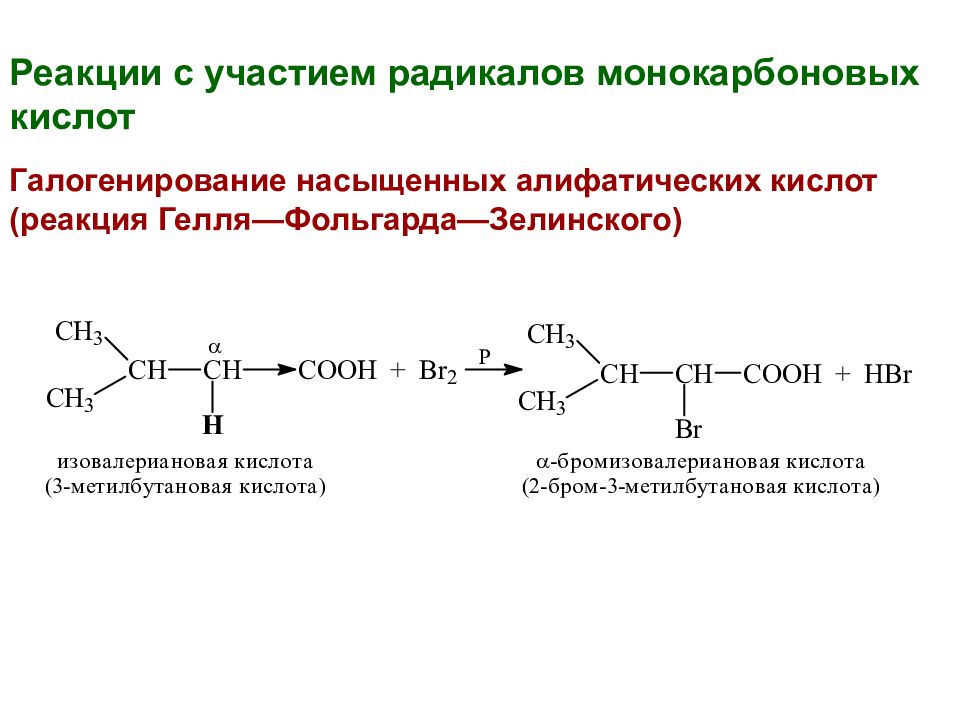
Реакции с участием радикалов монокарбоновых кислот Галогенирование насыщенных алифатических кислот (реакция Гелля—Фольгарда—Зелинского)
Слайд 19
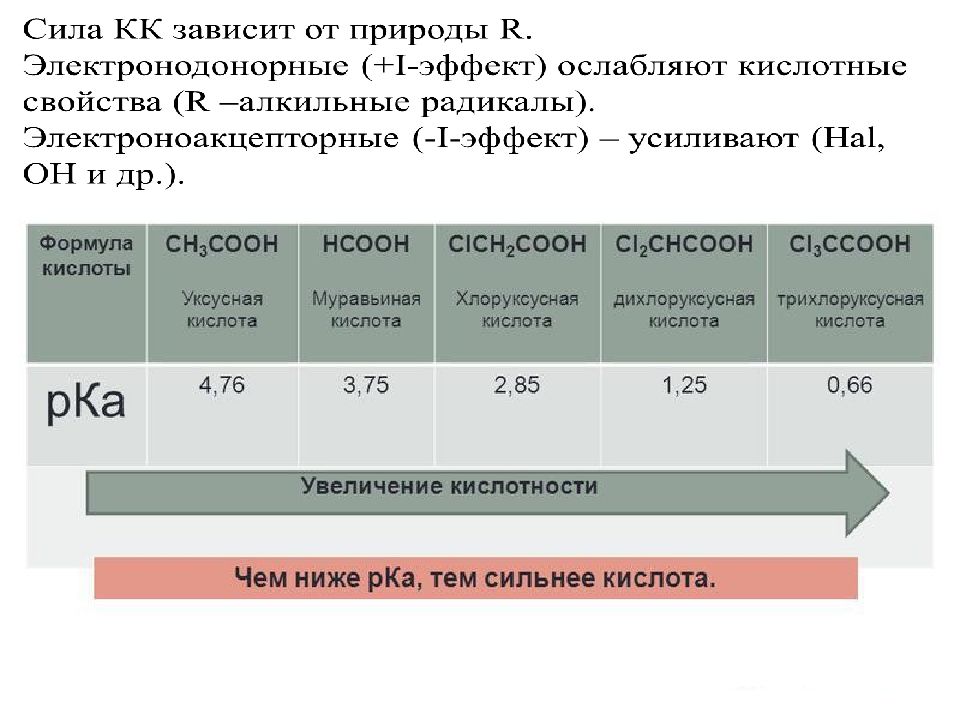
В живом мире наибольшее значение имеют: Диссоциируют ступенчато. Сила уменьшается Кислотные свойства значительно выше, чем монокарбоновых, из-за электроноакцепторного влияния второй –СООН группы.
Слайд 20
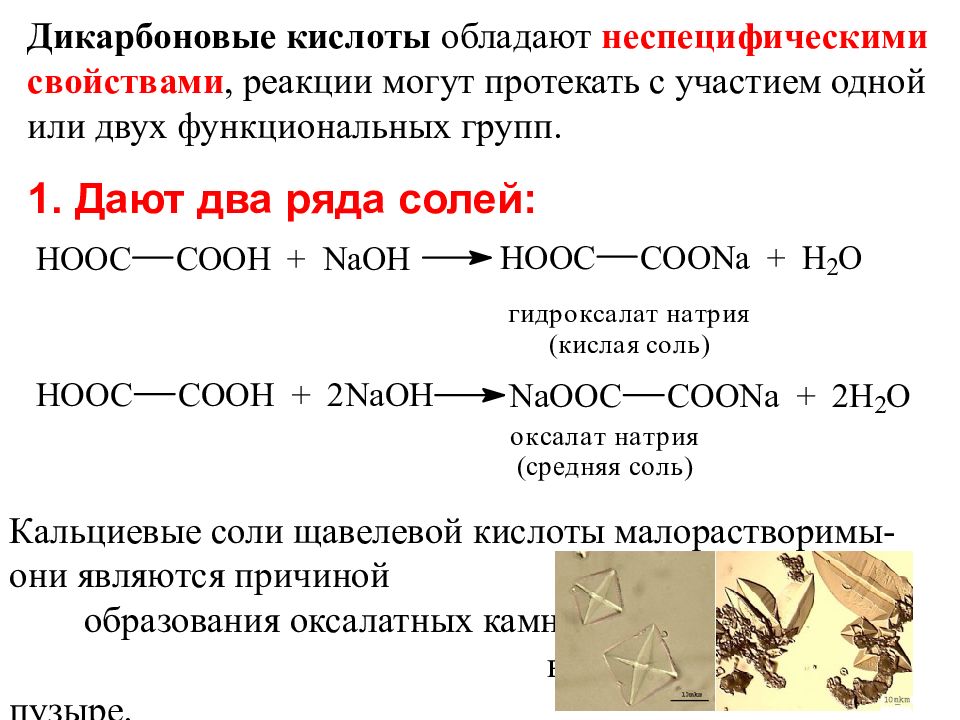
1. Дают два ряда солей: Дикарбоновые кислоты обладают неспецифическими свойствами, реакции могут протекать с участием одной или двух функциональных групп. Кальциевые соли щавелевой кислоты малорастворимы- они являются причиной образования оксалатных камней в почках и мочевом пузыре.
Слайд 21
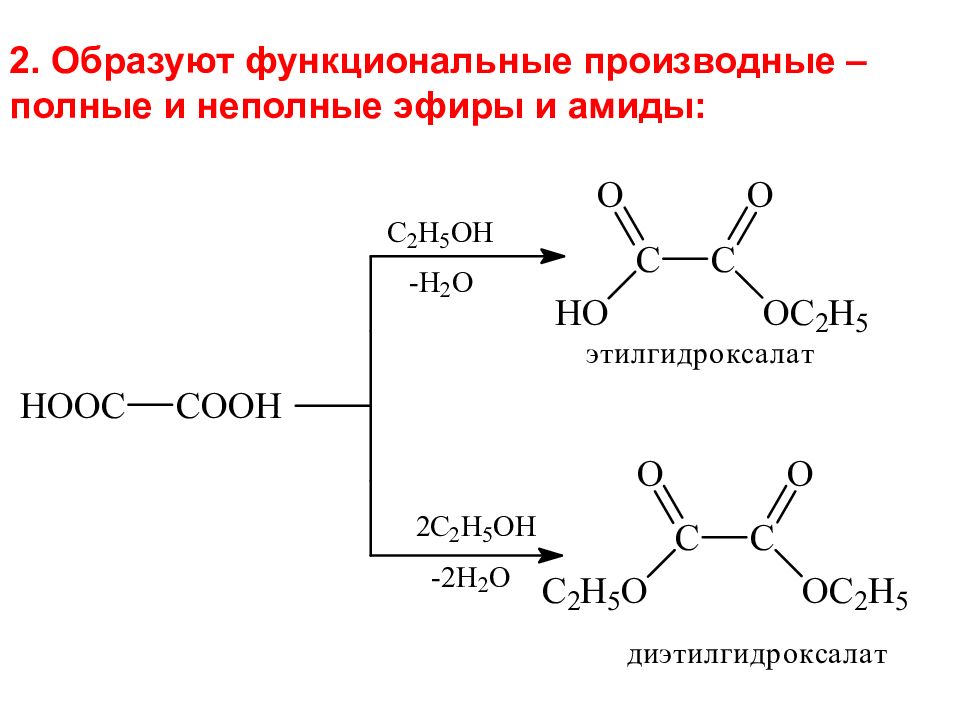
2. Образуют функциональные производные – полные и неполные эфиры и амиды:
Слайд 22
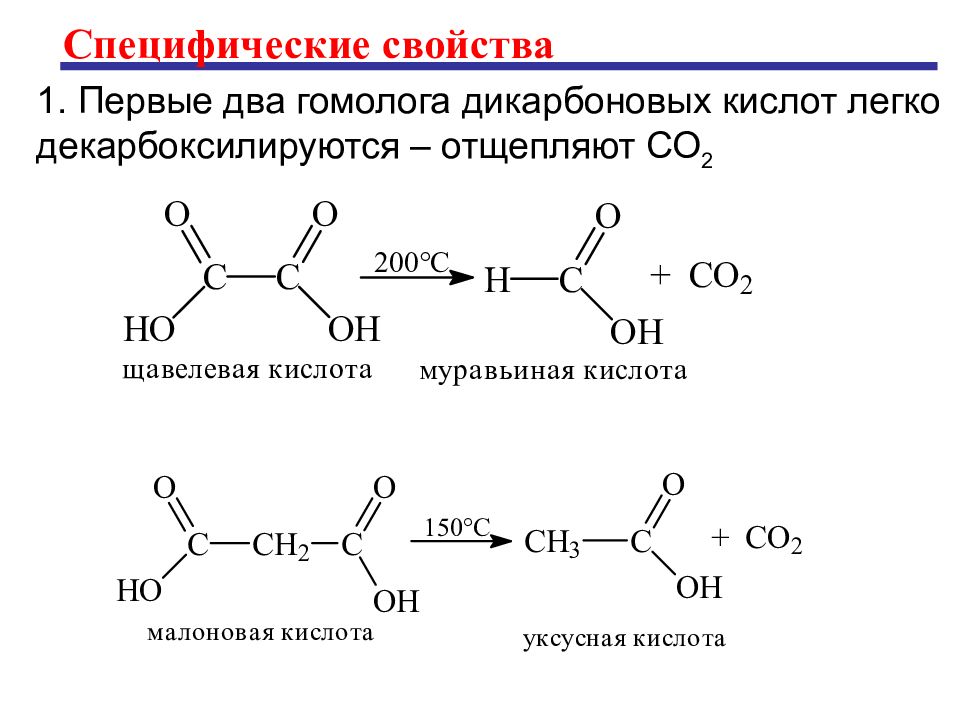
Специфические свойства 1. Первые два гомолога дикарбоновых кислот легко декарбоксилируются – отщепляют СО 2
Слайд 23
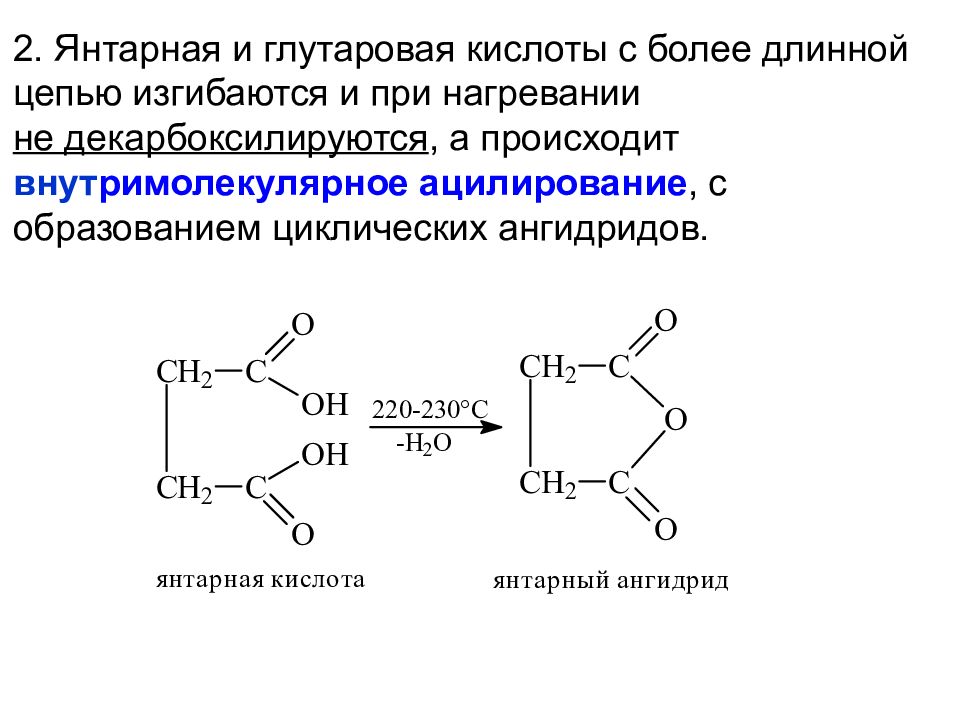
2. Янтарная и глутаровая кислоты с более длинной цепью изгибаются и при нагревании не декарбоксилируются, а происходит внут римолекулярное ацилирование, с образованием циклических ангидридов.
Слайд 24
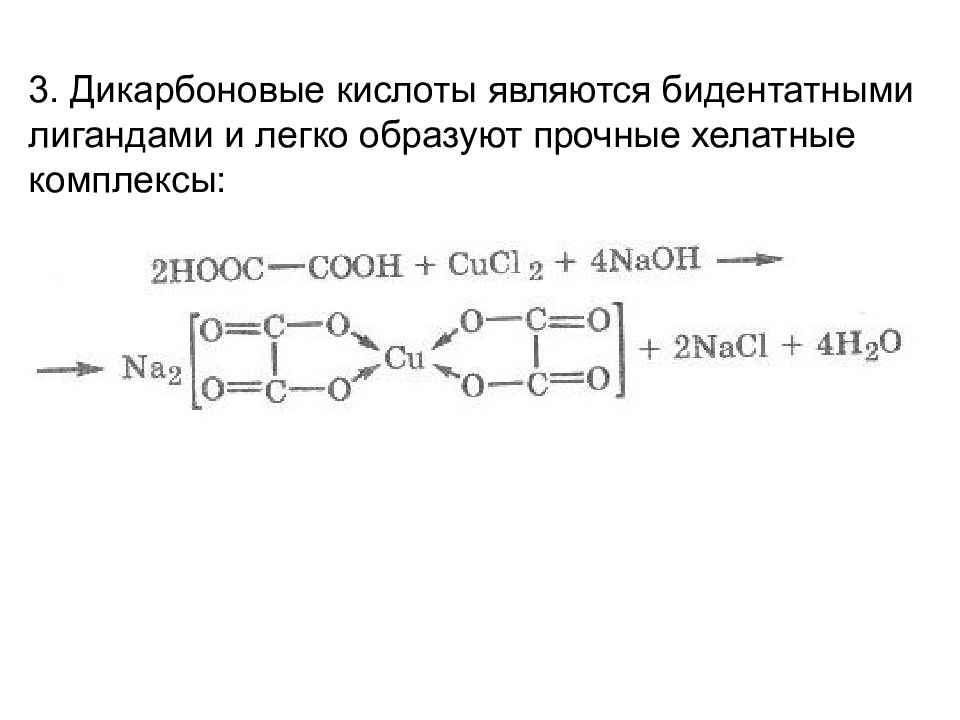
3. Дикарбоновые кислоты являются бидентатными лигандами и легко образуют прочные хелатные комплексы:
Слайд 25
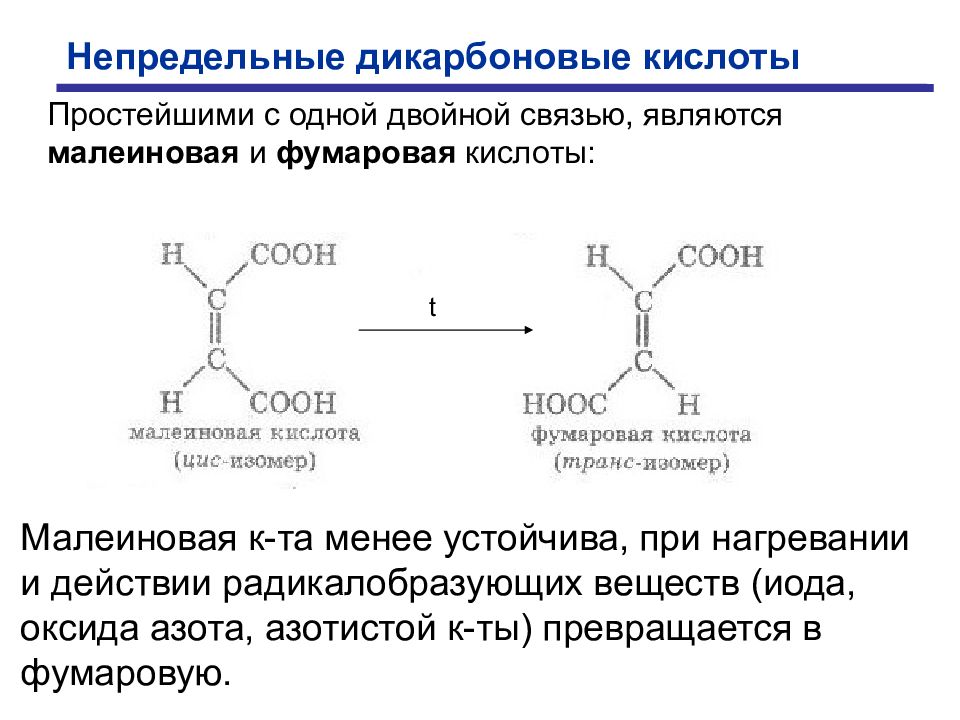
Непредельные дикарбоновые кислоты Простейшими с одной двойной связью, являются малеиновая и фумаровая кислоты: Малеиновая к-та менее устойчива, при нагревании и действии радикалобразующих веществ (иода, оксида азота, азотистой к-ты) превращается в фумаровую. t
Слайд 26
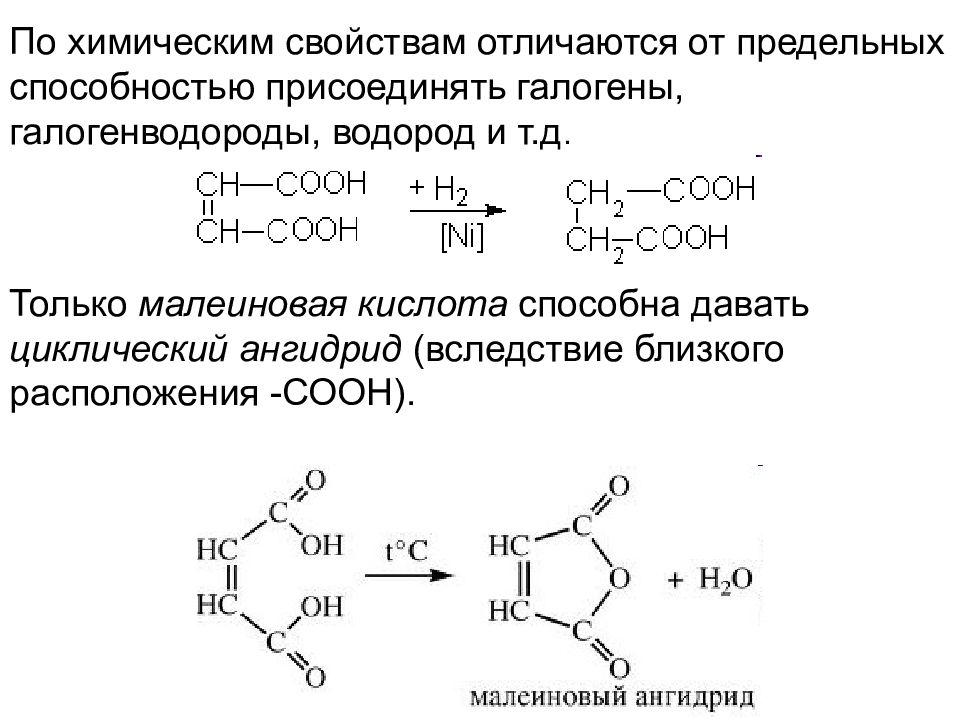
По химическим свойствам отличаются от предельных способностью присоединять галогены, галогенводороды, водород и т.д. Только малеиновая кислота способна давать циклический ангидрид (вследствие близкого расположения -СООН).
Слайд 28
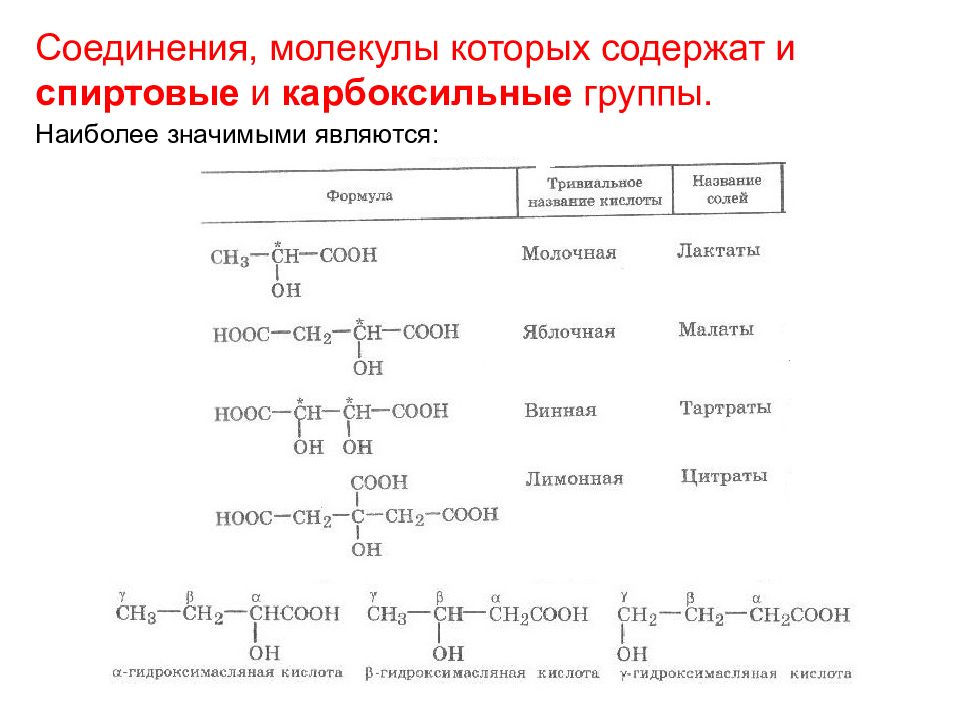
Соединения, молекулы которых содержат и спиртовые и карбоксильные группы. Наиболее значимыми являются:
Слайд 29
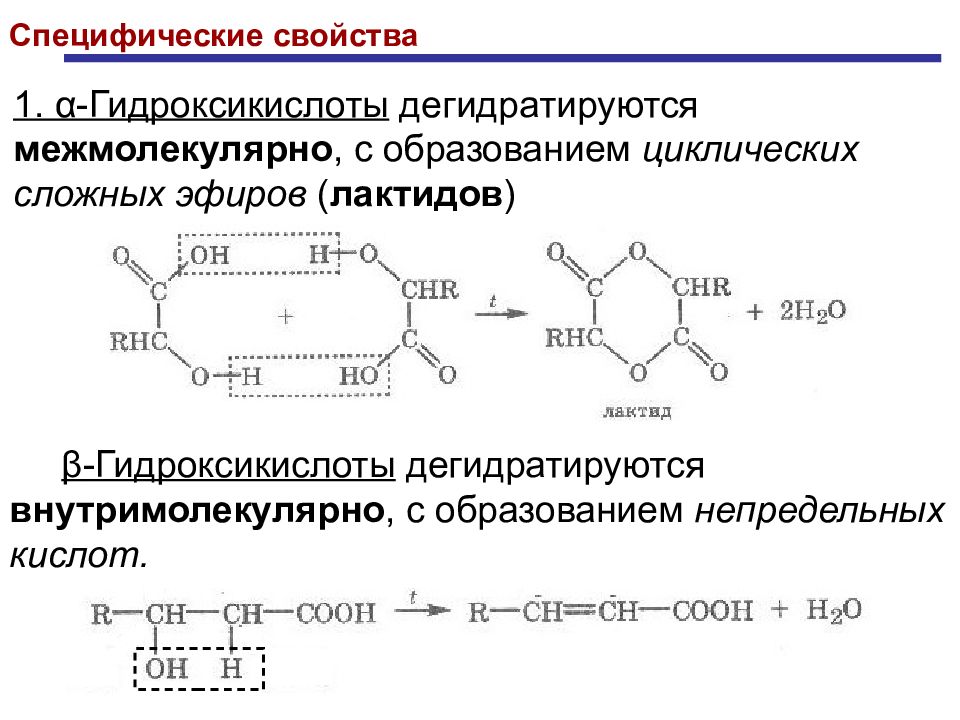
Специфические свойства 1. α -Гидроксикислоты дегидратируются межмолекулярно, с образованием циклических сложных эфиров ( лактидов ) β -Гидроксикислоты дегидратируются внутримолекулярно, с образованием непредельных кислот.
Слайд 30
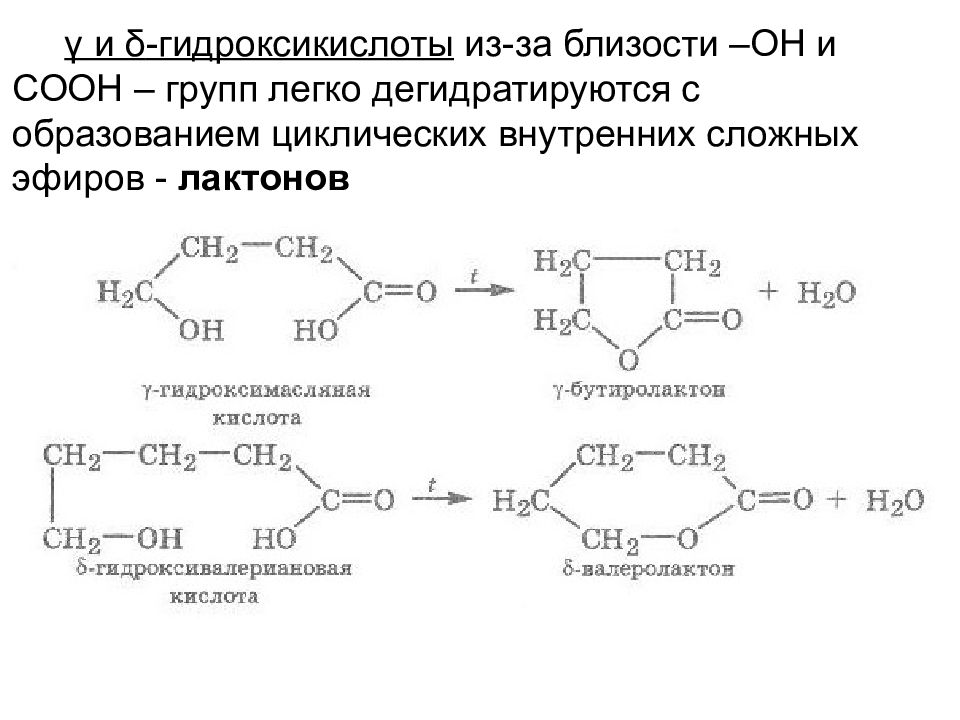
γ и δ -гидроксикислоты из-за близости –ОН и СООН – групп легко дегидратируются с образованием циклических внутренних сложных эфиров - лактонов
Слайд 31
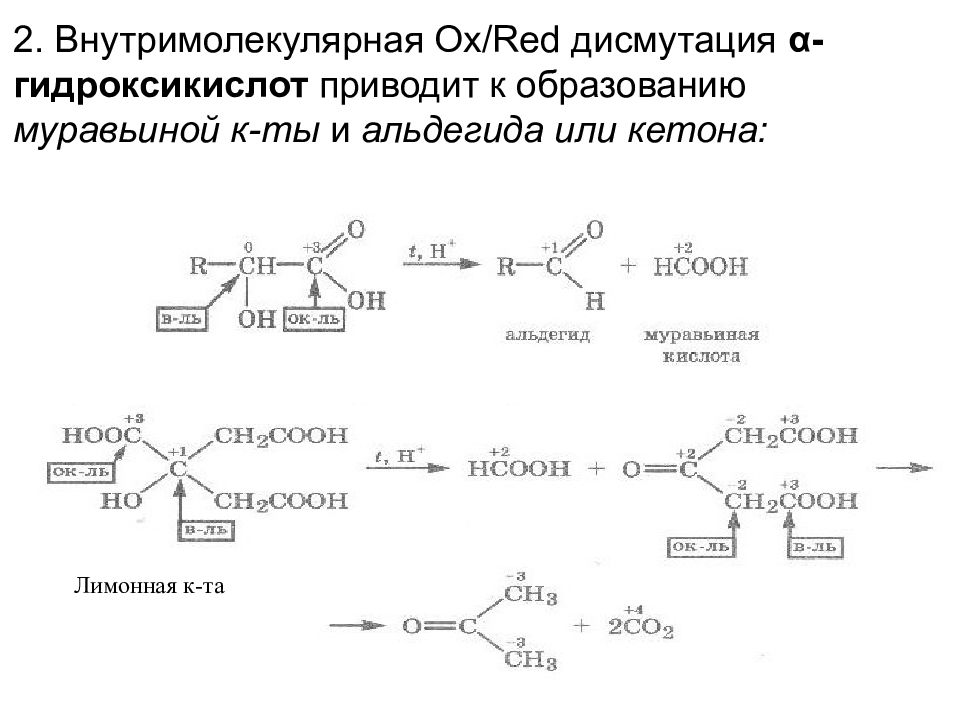
2. Внутримолекулярная Ox/Red дисмутация α -гидроксикислот приводит к образованию муравьиной к-ты и альдегида или кетона: Лимонная к-та
Слайд 33
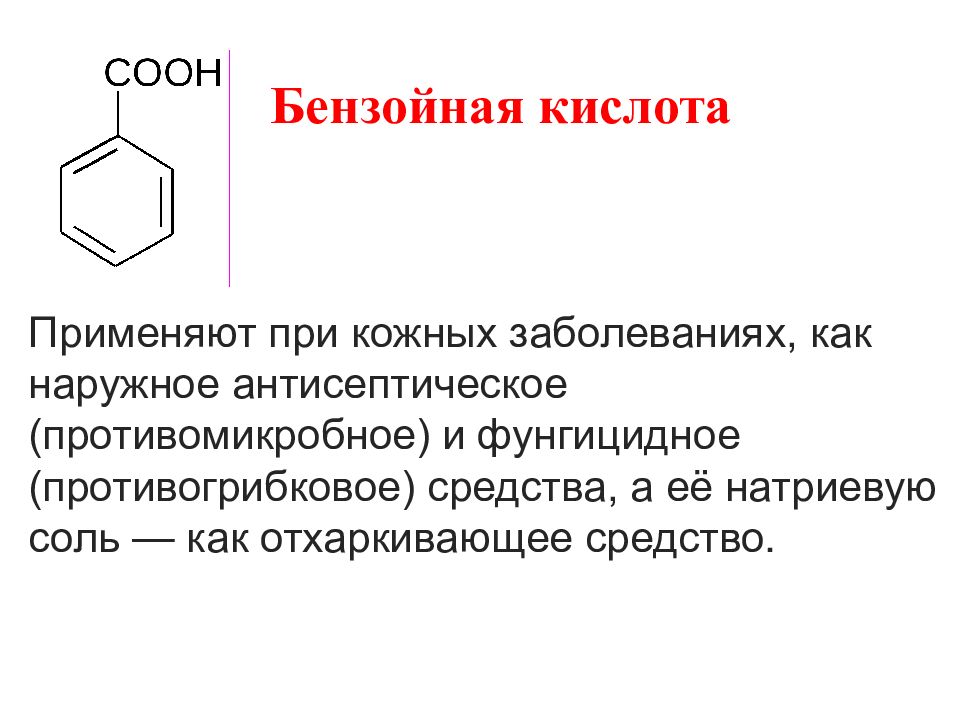
Бензойная кислота Применяют при кожных заболеваниях, как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, а её натриевую соль — как отхаркивающее средство.
Слайд 34
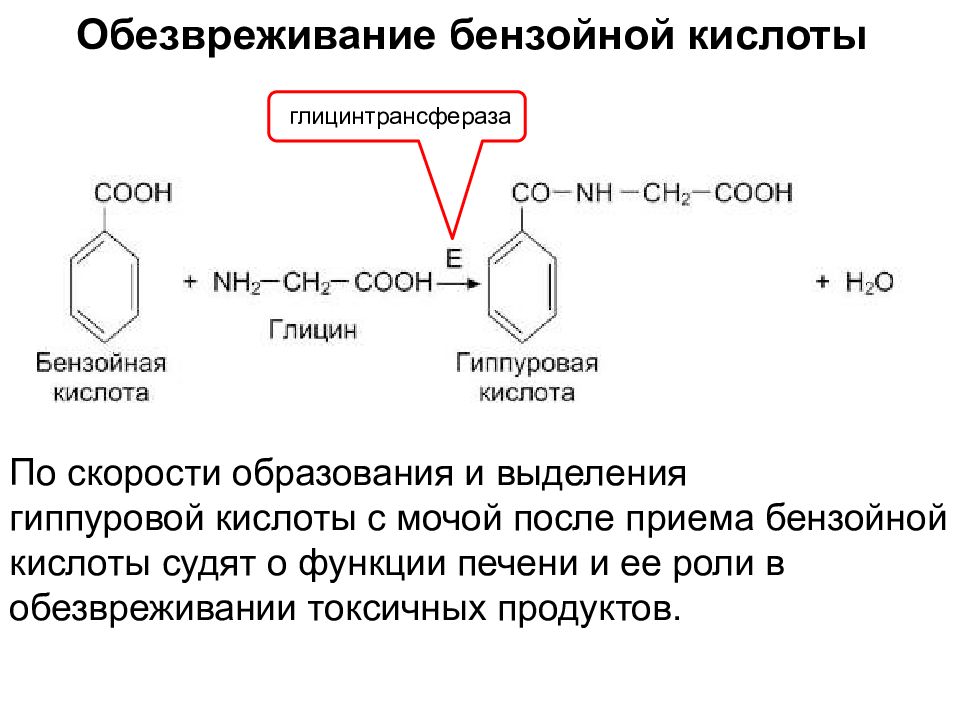
Обезвреживание бензойной кислоты глицинтрансфераза По скорости образования и выделения гиппуровой кислоты с мочой после приема бензойной кислоты судят о функции печени и ее роли в обезвреживании токсичных продуктов.
Слайд 35
n -аминобензойная кислота ( витамин В10 ) - участвует: в усвоении белка, в выработке красных кровяных телец; - активизирует: кишечную микрофлору, синтез интерферона; - повышает эффективность витамина С ; - препятствует образованию тромбов; - антиоксидант и др.
Слайд 38
ФЕНОКИСЛОТЫ Обладает более кислотными свойства, чем ее мета- и пара-изомеры. о-гидроксибензойная кислота (салициловая кислота) Салициловая кислота оказывает жаропонижающее, антигрибковое и болеутоляющее действие. Сильные кислоты. Проявляют свойства фенолов и кислот.
Слайд 39
фенилсалицилат (Салол) метилсалицилат салицилат натрия ацетилсалициловая кислота (аспирин ) Некоторые производные салициловой кислоты как лекарственные средства Написать самостоятельно реакции их получения Препараты (кроме салола) оказывают анальгетическое, жаропонижающее и противовоспалительное действие. Салол - дезинфицирующее средство при кишечных заболеваниях. В кислой среде не гидролизуется, используют как материал для защитных оболочек лекарственных средств.
Слайд 40
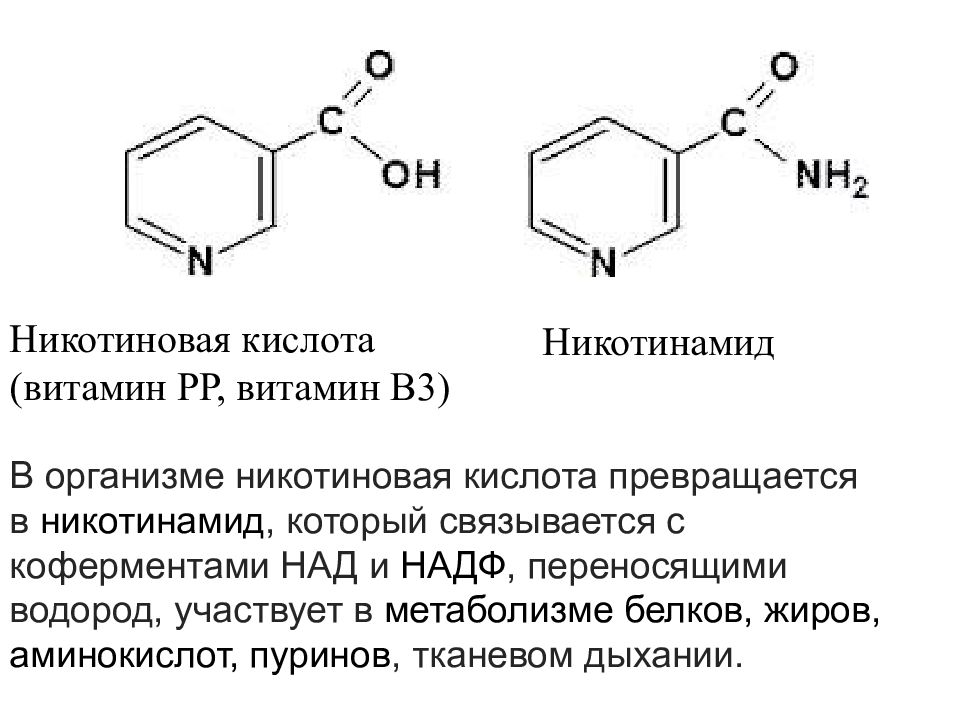
Никотиновая кислота (витамин РР, витамин В3) Никотинамид В организме никотиновая кислота превращается в никотинамид, который связывается с коферментами НАД и НАДФ, переносящими водород, участвует в метаболизме белков, жиров, аминокислот, пуринов, тканевом дыхании.
Слайд 43
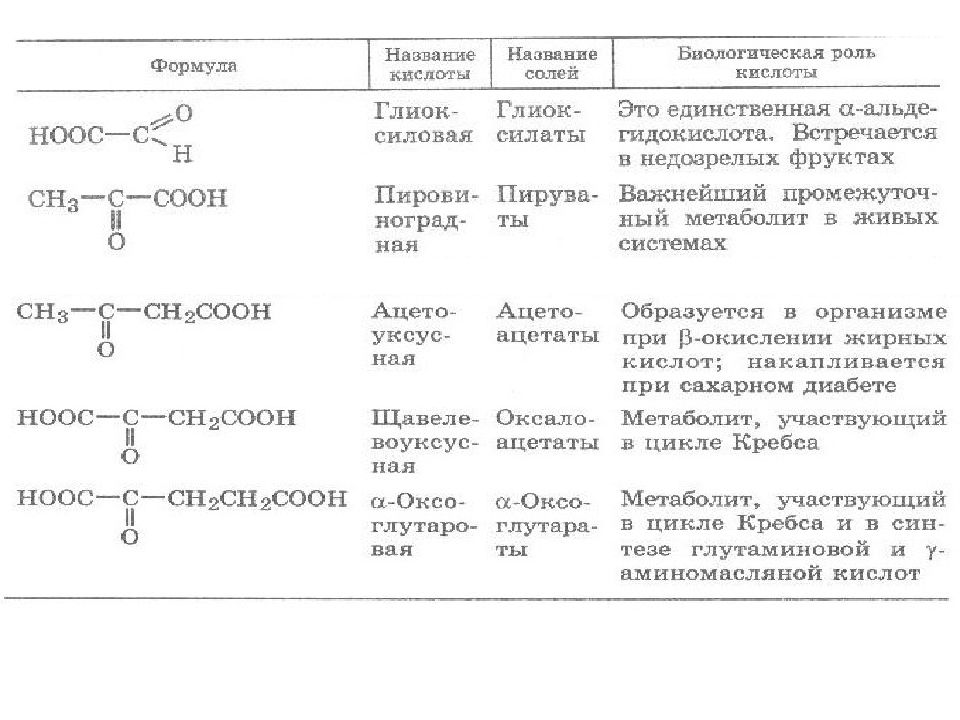
Являются естественными продуктами обмена веществ. Обладают свойствами, характерными для кислот, альдегидов и кетонов. Данные кислоты в организме образуются при окислении соответствующих гидроксикарбоновых кислот с помощью дегидрогеназ с окисленной формой конфермента НАД+:
Слайд 44
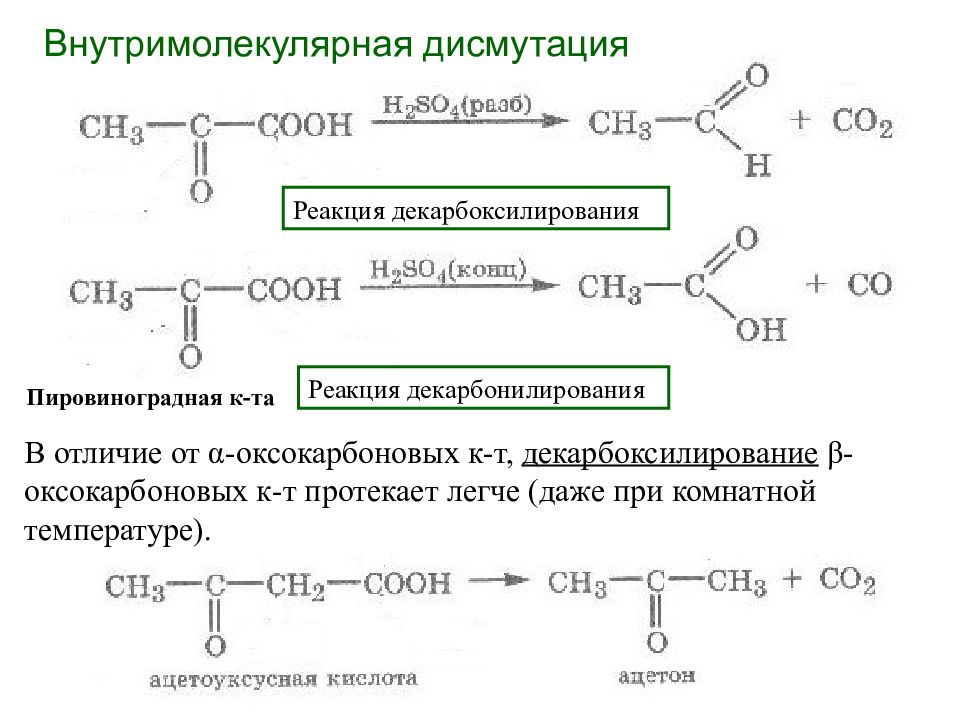
Внутримолекулярная дисмутация Реакция декарбоксилирования Реакция декарбонилирования Пировиноградная к-та В отличие от α -оксокарбоновых к-т, декарбоксилирование β -оксокарбоновых к-т протекает легче (даже при комнатной температуре).
Слайд 45
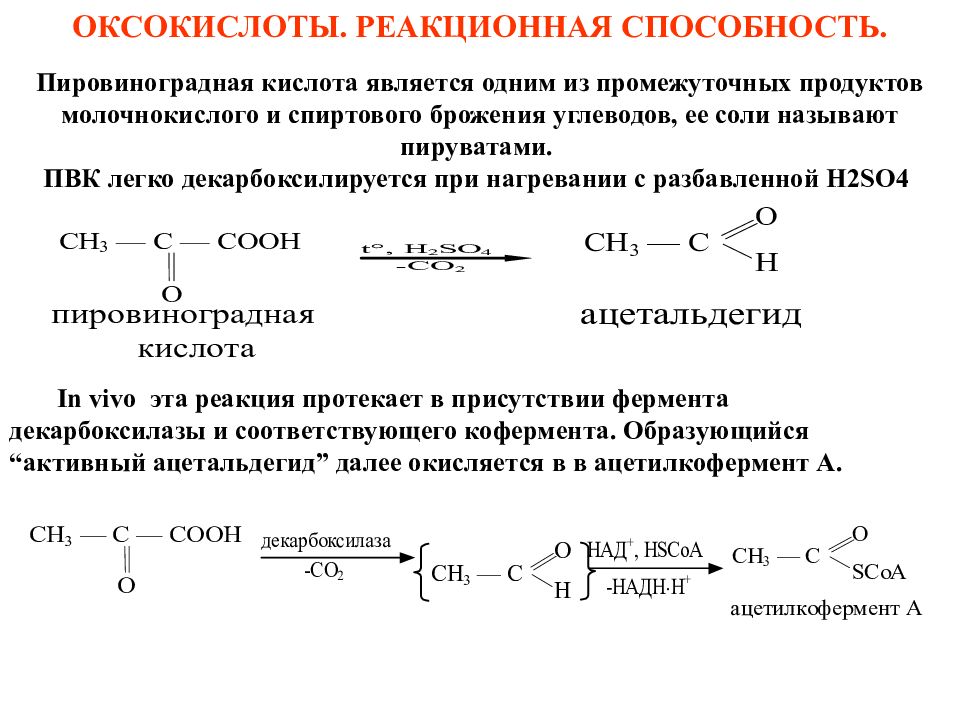
In vivo эта реакция протекает в присутствии фермента декарбоксилазы и соответствующего кофермента. Образующийся “активный ацетальдегид” далее окисляется в в ацетилкофермент А. Пировиноградная кислота является одним из промежуточных продуктов молочнокислого и спиртового брожения углеводов, ее соли называют пируватами. ПВК легко декарбоксилируется при нагревании с разбавленной Н2 SO 4 ОКСОКИСЛОТЫ. РЕАКЦИОННАЯ СПОСОБНОСТЬ.
Слайд 46
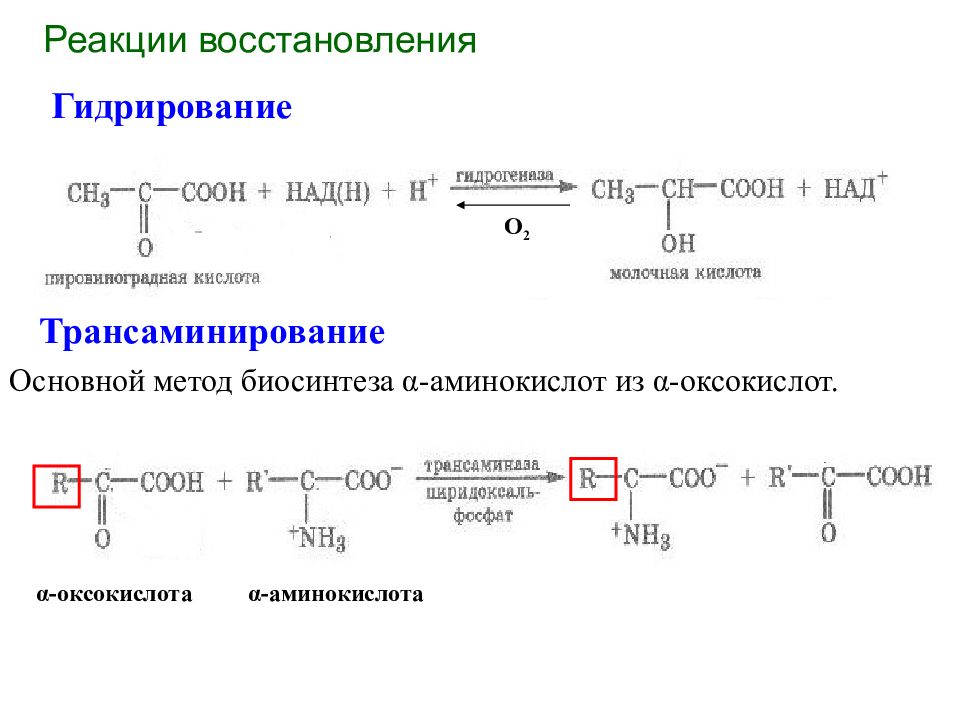
Реакции восстановления Гидрирование Трансаминирование О 2 Основной метод биосинтеза α -аминокислот из α -оксокислот. α -оксокислота α -аминокислота
Слайд 47
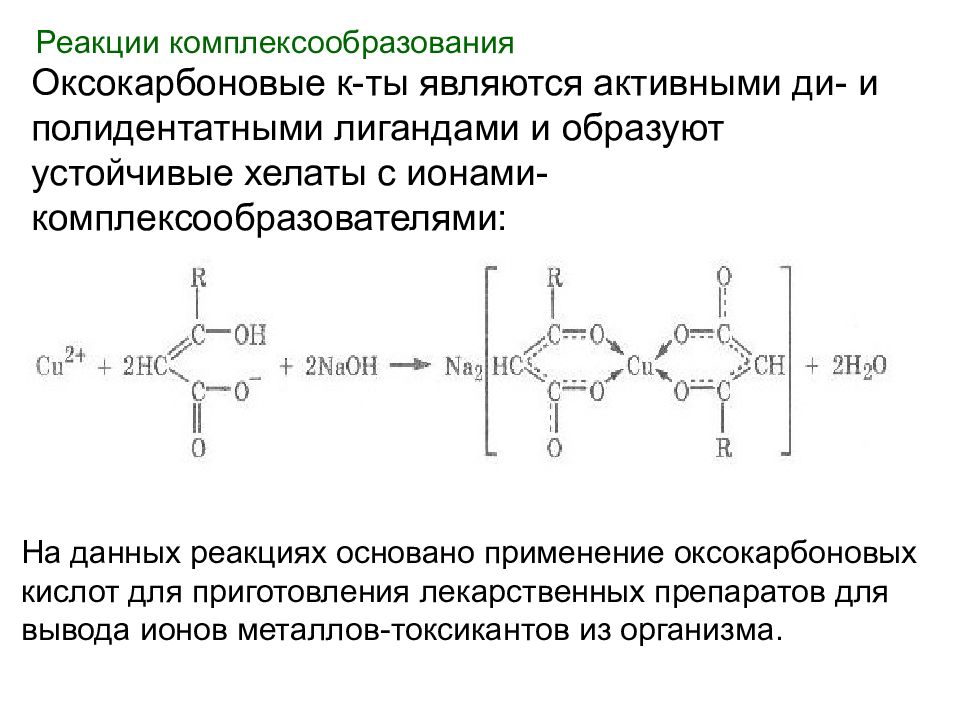
Реакции комплексообразования Оксокарбоновые к-ты являются активными ди- и полидентатными лигандами и образуют устойчивые хелаты с ионами-комплексообразователями: На данных реакциях основано применение оксокарбоновых кислот для приготовления лекарственных препаратов для вывода ионов металлов-токсикантов из организма.
Слайд 48
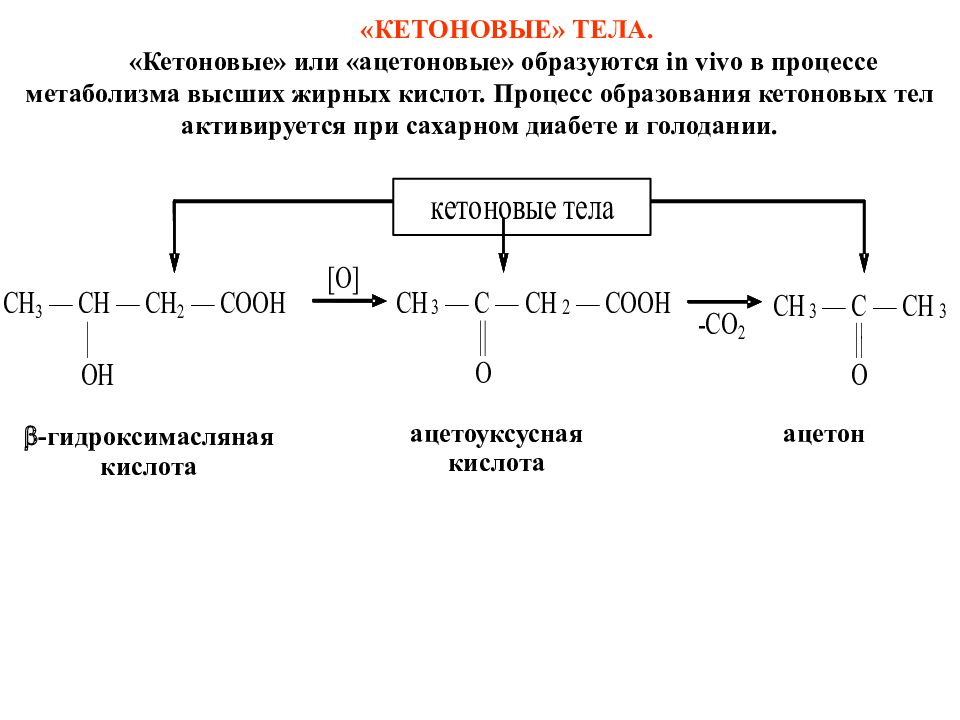
«КЕТОНОВЫЕ» ТЕЛА. «Кетоновые» или «ацетоновые» образуются in vivo в процессе метаболизма высших жирных кислот. Процесс образования кетоновых тел активируется при сахарном диабете и голодании. -гидроксимасляная кислота ацетоуксусная кислота ацетон
Слайд 49
Ацетоуксусный эфир КЕТО форма Кето форма Енольная форма Таутомерия — изомерия, при которой изомеры находятся одновременно в растворе в состоянии подвижного термодинамического равновесия. Такие соединения могут прореагировать полностью как в одной, так и в другой форме. Ацетоуксусный эфир находится в растворе в виде двух форм: “кето” и “енольной.. Атом водорода метиленовой группы, находящейся между двумя карбонильными группами, обладает подвижностью, поэтому протон С –Н кислотного центра может присоединиться к основному центру кислорода карбонильной группы. ТАУТОМЕРИЯ. ТАУТОМЕРНЫЕ ФОРМЫ АЦЕТОУКСУСНОГО ЭФИРА
Слайд 50
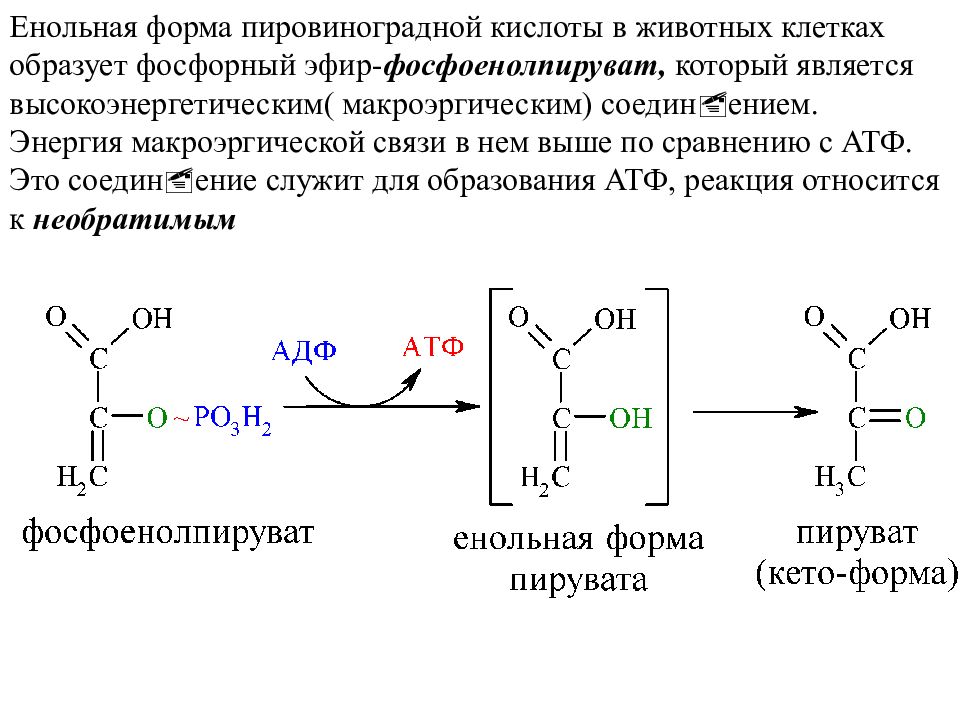
Енольная форма пировиноградной кислоты в животных клетках образует фосфорный эфир- фосфоенолпируват, который является высокоэнергетическим( макроэргическим) соединœением. Энергия макроэргической связи в нем выше по сравнению с АТФ. Это соединœение служит для образования АТФ, реакция относится к необратимым
Слайд 51
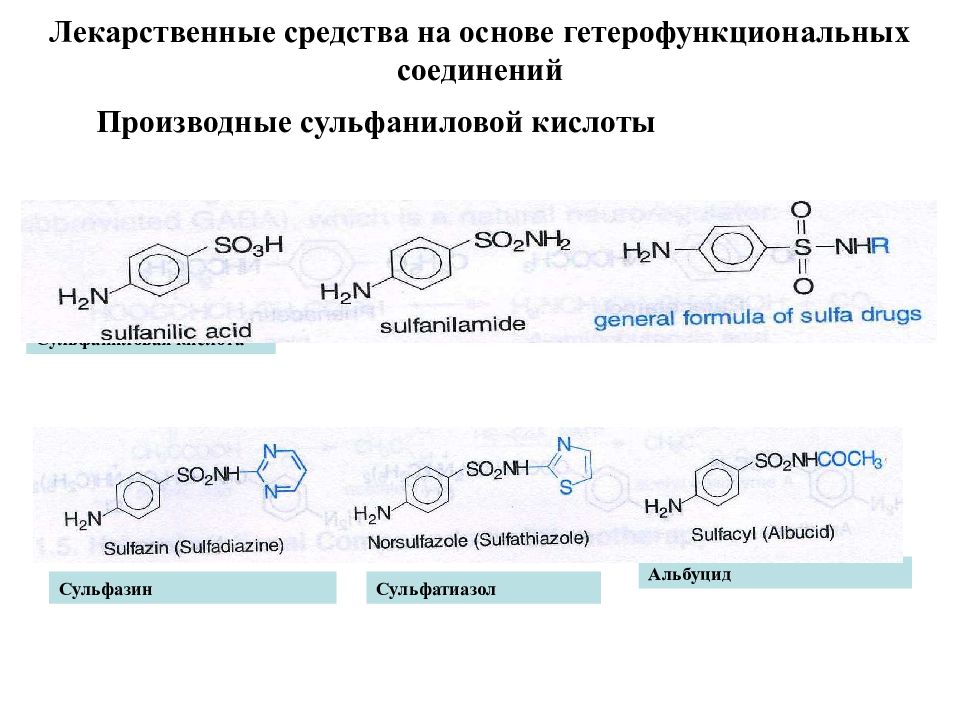
Лекарственные средства на основе гетерофункциональных соединений Производные сульфаниловой кислоты Сульфаниловая кислота Сульфаниламид Замешенный сульфаниламид Сульфазин Альбуцид Сульфатиазол
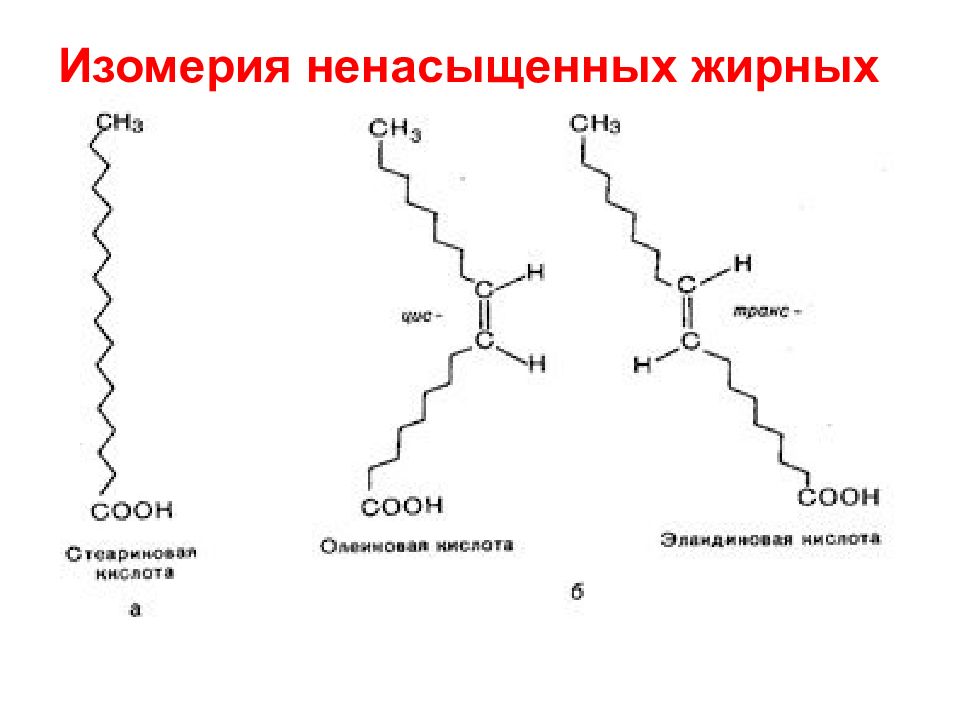
Слайд 53: Природные жирные кислоты
Химическая Название Структура формула Насыщенные СН 3 (СН 2 ) 10 СООН лауриновая 12:0 СН 3 (СН 2 ) 14 СООН пальмитиновая 16:0 СН 3 (СН 2 ) 16 СООН стеариновая 18:0 Ненасыщенные СН 3 (СН 2 ) 5 СН=СН(СН 2 ) 7 СООН пальмитоолеиновая 16:1(9с) СН 3 (СН 2 ) 7 СН=СН(СН 2 ) 7 СООН олеиновая 18:1(9с) СН 3 (СН 2 ) 4 СН=СНСН 2 СН=СН(СН 2 ) 7 СООН линолевая 18:2 (9с,12с) СН 3 СН 2 СН=СНСН 2 СН=СН(СН 2 )СН=СН(СН 2 ) 7 СООН линоленовая 18:3 (9с,12с,15с) СН3(СН 2 ) 4 (СН=СНСН 2 ) 3 СН=СН(СН 2 ) 3 СООН арахидоновая 20:4(5с,8с,11с,14с)
Слайд 55
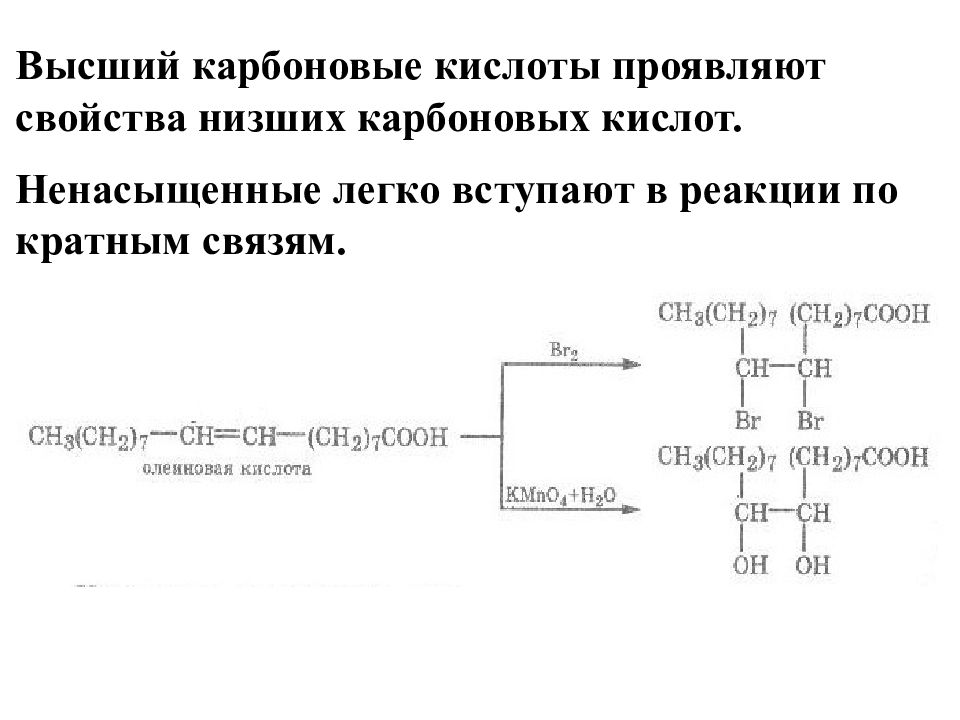
Высший карбоновые кислоты проявляют свойства низших карбоновых кислот. Ненасыщенные легко вступают в реакции по кратным связям.
Слайд 56
Ненасыщенные ВКК значительно легче окисляются в организме и могут ограничивать в нем свободнорадикальное окисление. При полном гидрировании превращаются в предельные:
Последний слайд презентации: КАРБОНОВЫЕ КИСЛОТЫ И ИХ ГЕТЕРОФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ : ГИДРОКСИ- И
Полиненасыщенные жирные кислоты участвуют в переносе и обмене холестерина, в процессах свертывания и агрегации форменных элементов крови, препятствуют развитию атеросклероза, улучшают кровообращение, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и клеток нервной системы, влияют на активность ферментов и иммунную защиту. Некоторые из них - исходный материал для синтеза простагландинов, регулирующих разнообразные процессы в организме Две жирных кислоты – омега-3 (линоленовая кислота) и омега-6 (линолевая кислота) являются незаменимыми