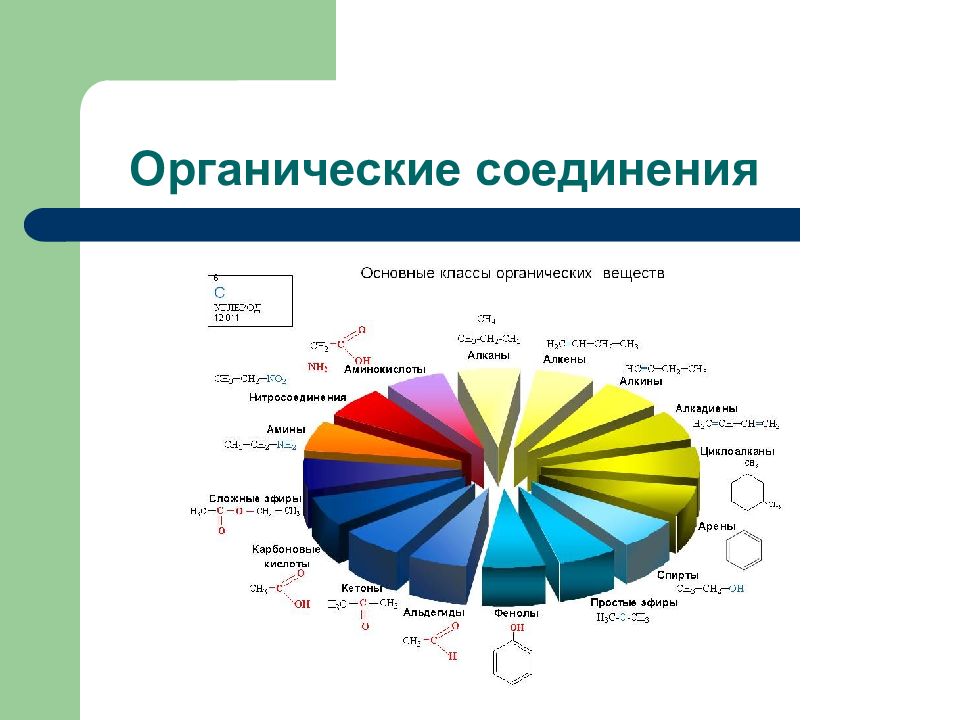
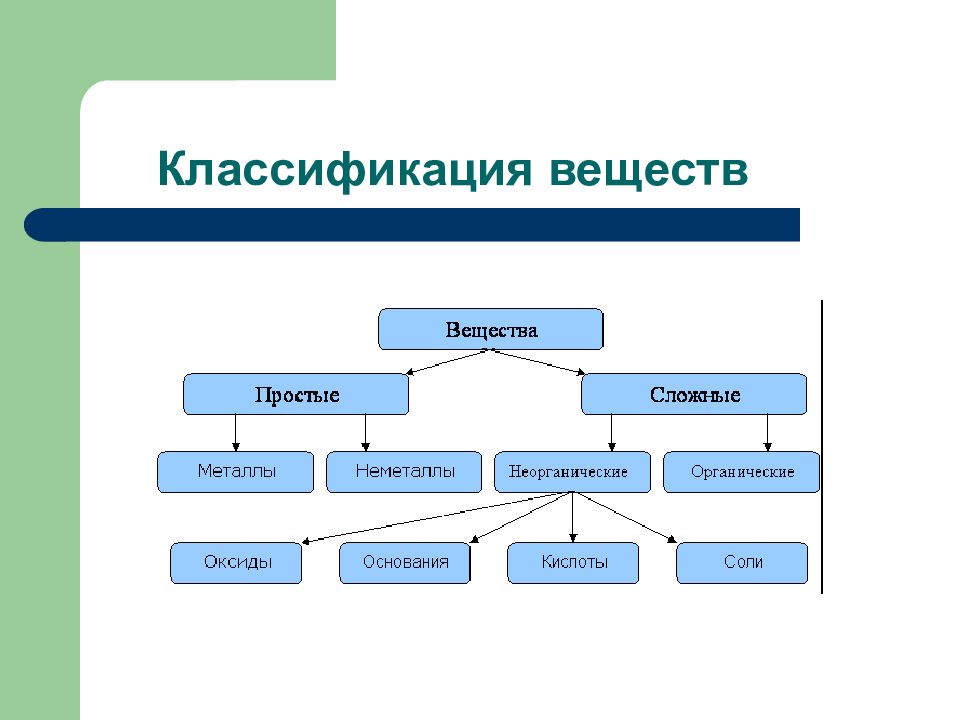
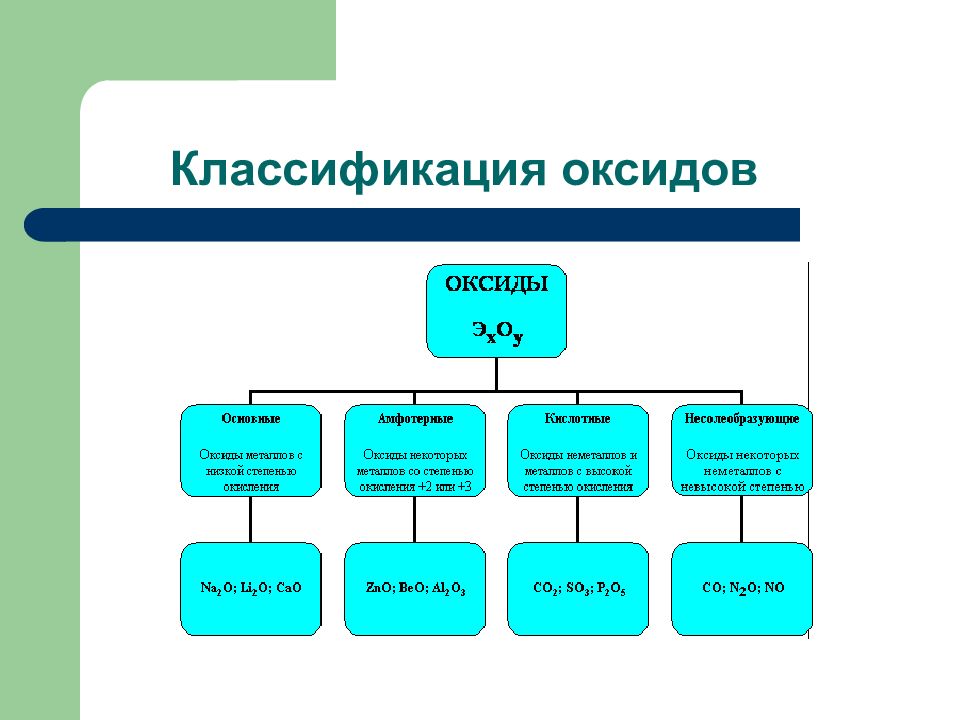
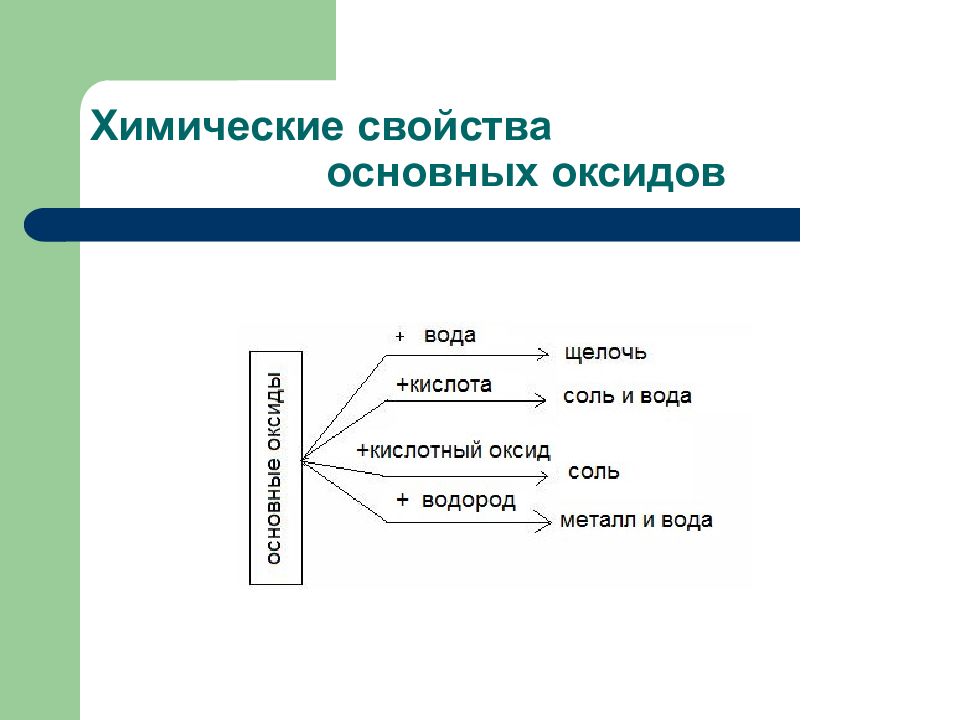
Слайд 2: Дидактические единицы
ДЕ 1. Номенклатура. Сопряжение. Электронные эффекты заместителей. Карбоновые кислоты. Липиды. (6 вопросов). ДЕ 2. Аминокислоты. Белки. Нуклеиновые кислоты. Углеводы. (7 вопросов). ДЕ 3. Школьный курс органической химии (4 вопроса). ДЕ 4. Школьный курс неорганической химии (4 вопроса). ДЕ 5. Химическая термодинамика, кинетика, равновесие. (6 вопросов). ДЕ 6. Растворы. Концентрация. Физико-химические свойства (осмос, закон Ф.Рауля, следствия). Растворы электролитов. (6 вопроса) ДЕ 7. Окислительно-восстановительные реакции. Коррозия. Диаграммы состояния. (5 вопросов).
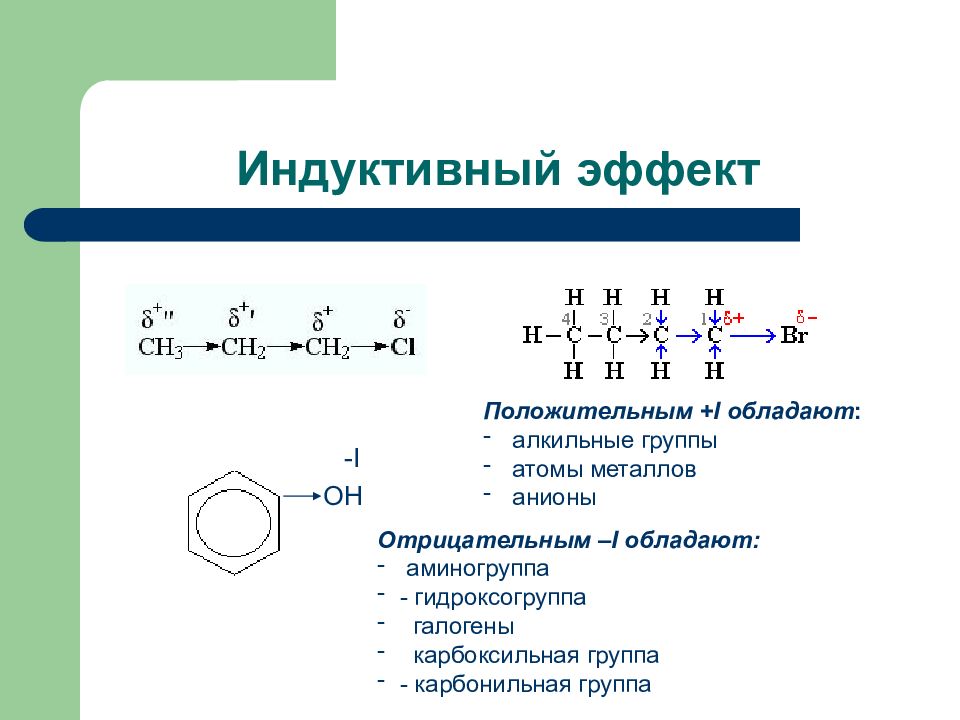
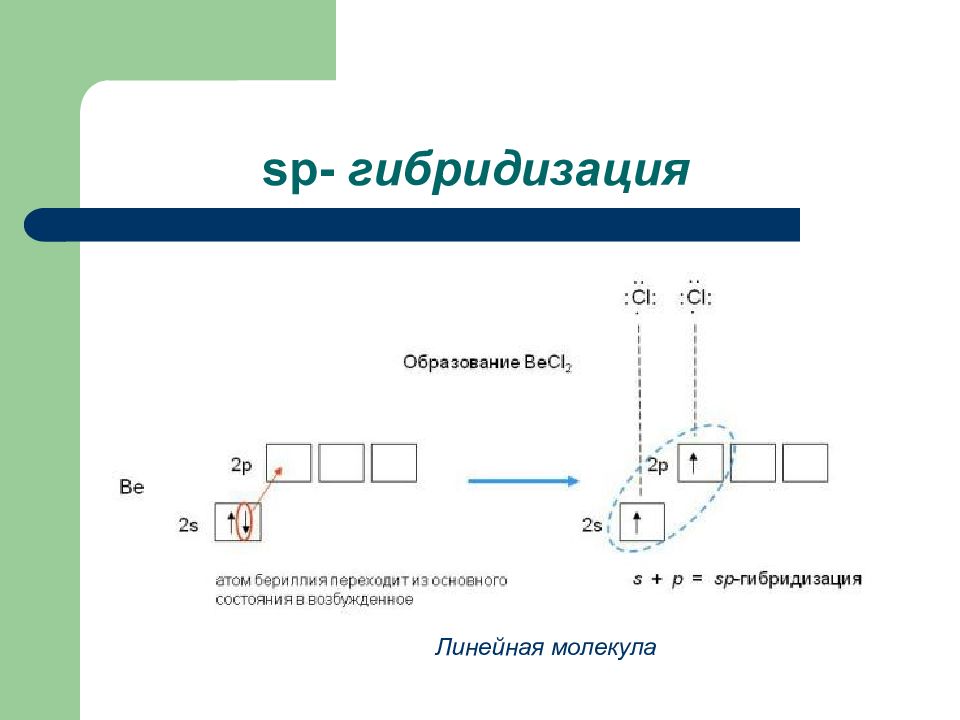
Слайд 3: Индуктивный эффект
ОН - I Положительным + I обладают : алкильные группы атомы металлов анионы Отрицательным – I обладают: аминогруппа - гидроксогруппа галогены карбоксильная группа - карбонильная группа
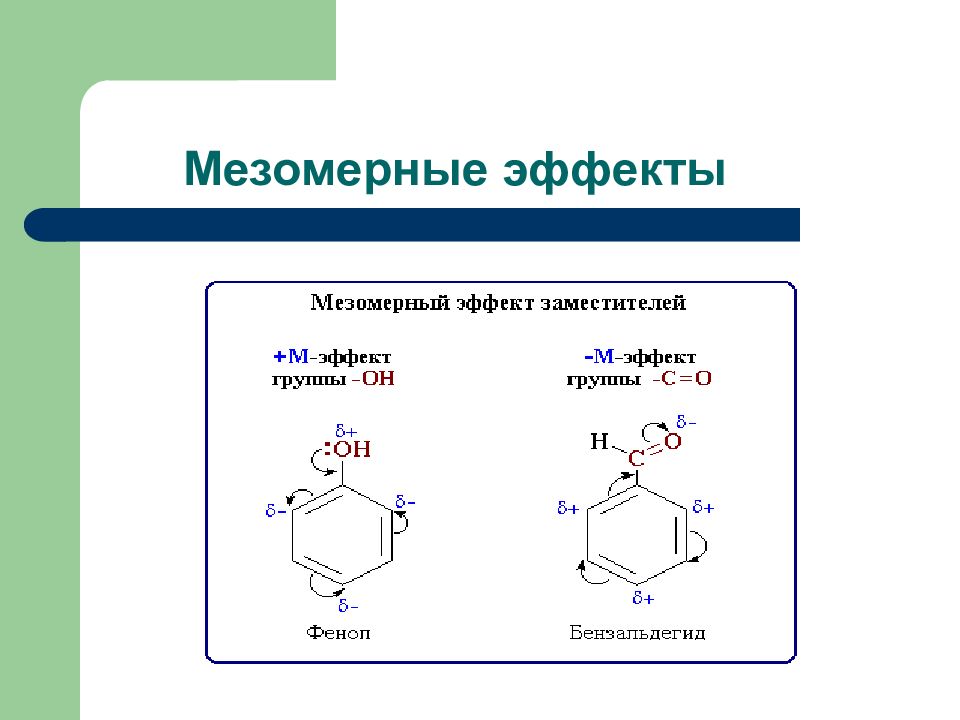
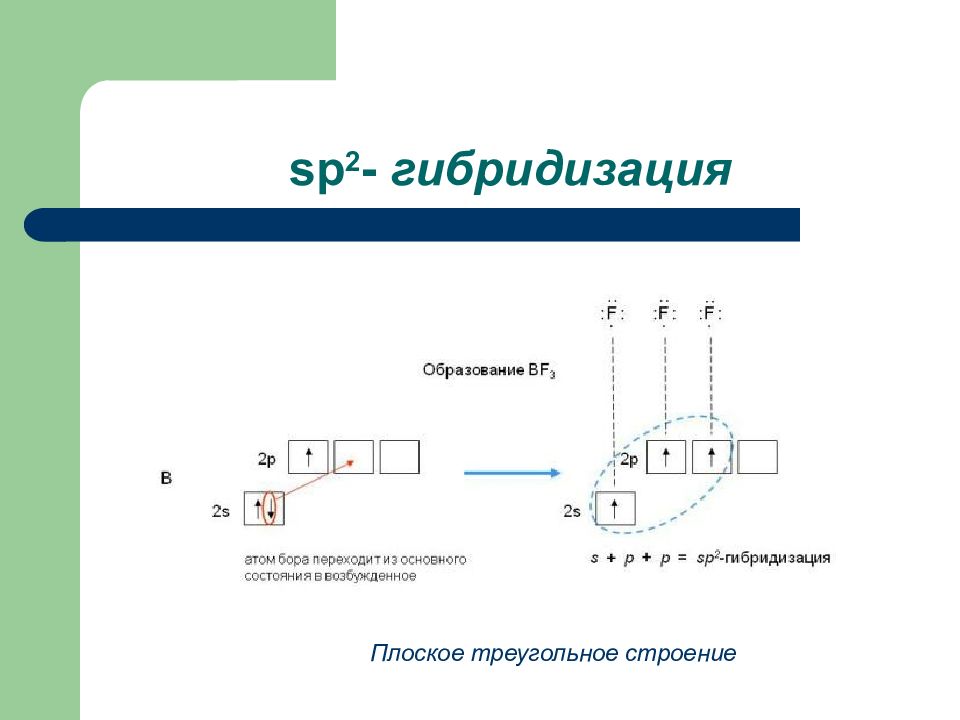
Слайд 4: Мезомерный эффект
Группы атомов, смещающих электронную плотность на себя, обладают - М: - СОН; - СООН - содержат более электроотрица- тельные атомы, находящиеся в sp 2. З аместители, повышающие электронную плотность в сопряженной системе, проявляют + М: -ОН; -О R ; - SH ; - NH 2 – содержат атомы в sp 3 гибридном состоянии Мезомерный эффект – это передача электронного влияния заместителя по системе π - связей
Слайд 6: Признаки ароматичности соединений
Плоский замкнутый цикл. sp 2 гибридизация атомов Сопряженная электронная система (4 n +2) π -электронов, охватывающая все атомы цикла - правило нем.физика Э.Хюккеля, где: n – целое число n =1 число е 6 n =2 число е 10 n = 3 число е 14
Электроотрицательность атома, с которым связан протон Размер атома Возможность делокализации отрицательного заряда по другим атомам Способность растворителя сольватировать образующиеся ионы
Слайд 8: Типы бренстедовских кислот
- О - Н – кислоты : карбоновые кислоты, фенолы, спирты - S - H - кислоты: тиолы - N - Н - кислоты: амиды, амины, имиды - С - Н - кислоты: углеводороды и их производные
Слайд 9: Изменение кислотных свойств органических веществ
СН – кислоты < NH - кислоты < OH - кислоты < SH - кислоты Увеличивается сила кислоты, т.к. повышается стабильность аниона Увеличение длины углеводородного радикала и его разветвление приводит к уменьшению силы кислоты СН 3 ОН рК а = 16; С 2 Н 5 ОН рК а = 18 Введение заместителей в углеводородный радикал способствует изменению кислотности Н 3 СН рК а = 40.0 С l 3 CH рК а =15,7
Слайд 10: Классификация оснований – акцепторов протона
Π - основания: арены алкены алкадиены n- основания (ониевые основания): аммониевые N = N = N (аммиак, его производные, гетероциклы) оксониевые - О - = О (спирты, альдегиды, кетоны, простые эфиры) сульфониевые - S - ( тиоспирты, тиоэфиры, сульфиды) .. .. .. .. .. .. .. .. .. ..
Слайд 11: Сила ониевых оснований зависит
от электроотрицательности гетероатома; от размеров гетероатома; от электронных эффектов заместителей. NH 3 + HOH ↔ NH 4 + + OH - рК b =9.25 pK а = 4.75 (CH 3 ) 2 NH + HOH ↔ (CH 3 ) 2 NH 2 + + OH - pK b = 2.97 pK а = 11.03
Слайд 12: Классификация карбоновых кислот
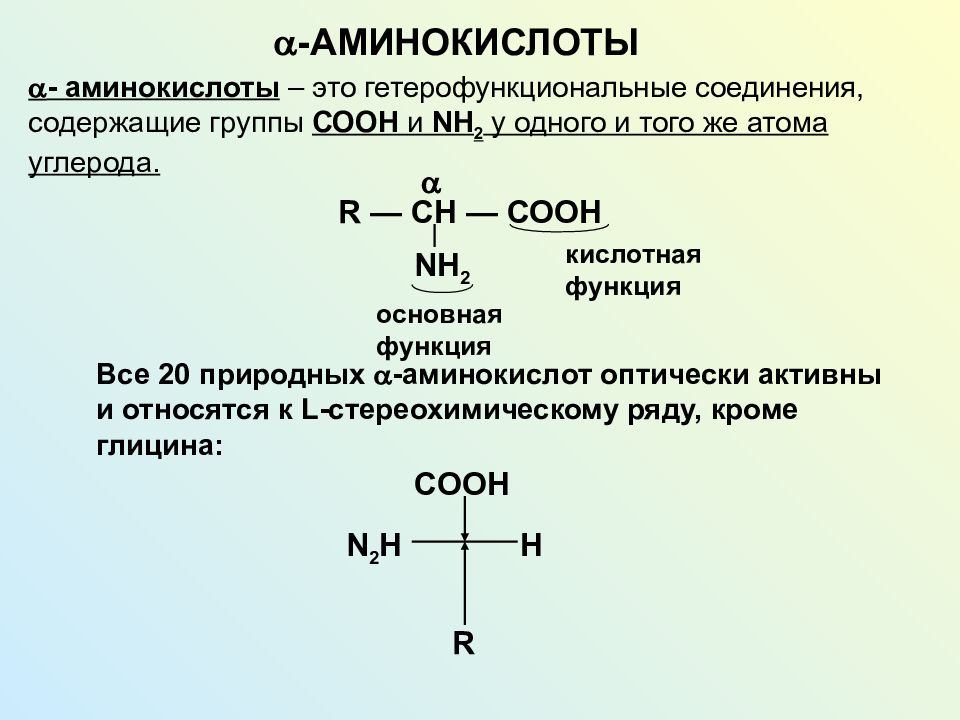
По числу карбоксильных групп: - монокарбоновые - дикарбоновые - трикарбоновые По строению и природе радикала: - предельные (ациклические и циклические) - непредельные - ароматические (карбо- и гетеро-) По наличию других функциональных групп в радикале: - гидроксикислоты ( -ОН ) - оксикислоты ( = О ) - аминокислоты ( - N Н 2 )
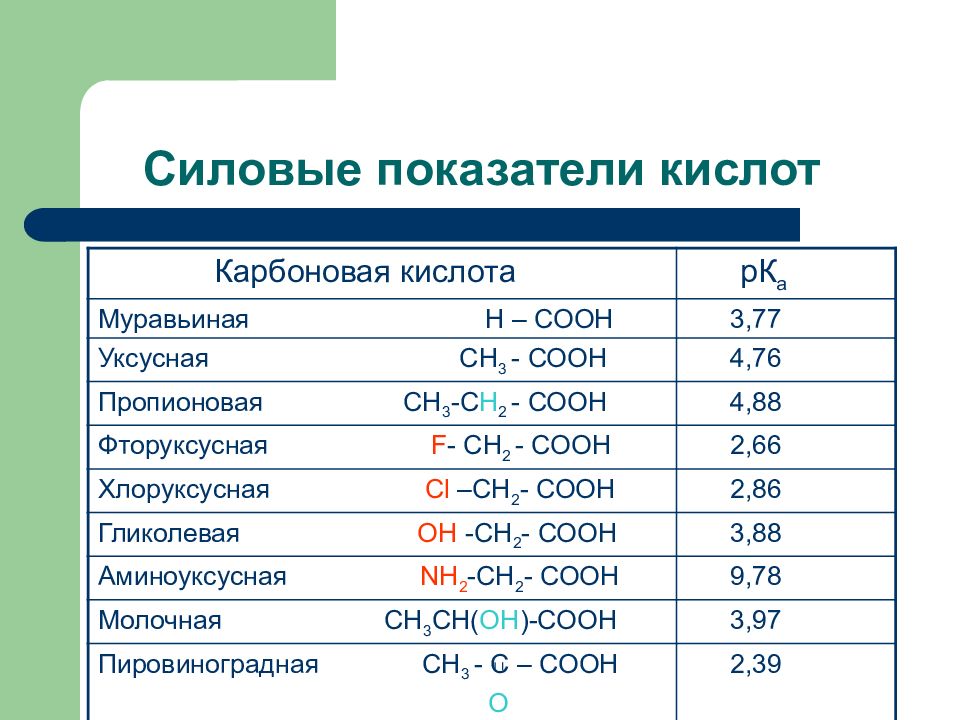
Слайд 13: Силовые показатели кислот
Карбоновая кислота рК а Муравьиная Н – СООН 3,77 Уксусная СН 3 - СООН 4,76 Пропионовая СН 3 -С Н 2 - СООН 4,88 Фторуксусная F - СН 2 - СООН 2,66 Хлоруксусная С l –СН 2 - СООН 2,86 Гликолевая ОН -СН 2 - СООН 3,88 Аминоуксусная N Н 2 -СН 2 - СООН 9,78 Молочная СН 3 СН( ОН )-СООН 3,97 Пировиноградная СН 3 - С – СООН О 2,39
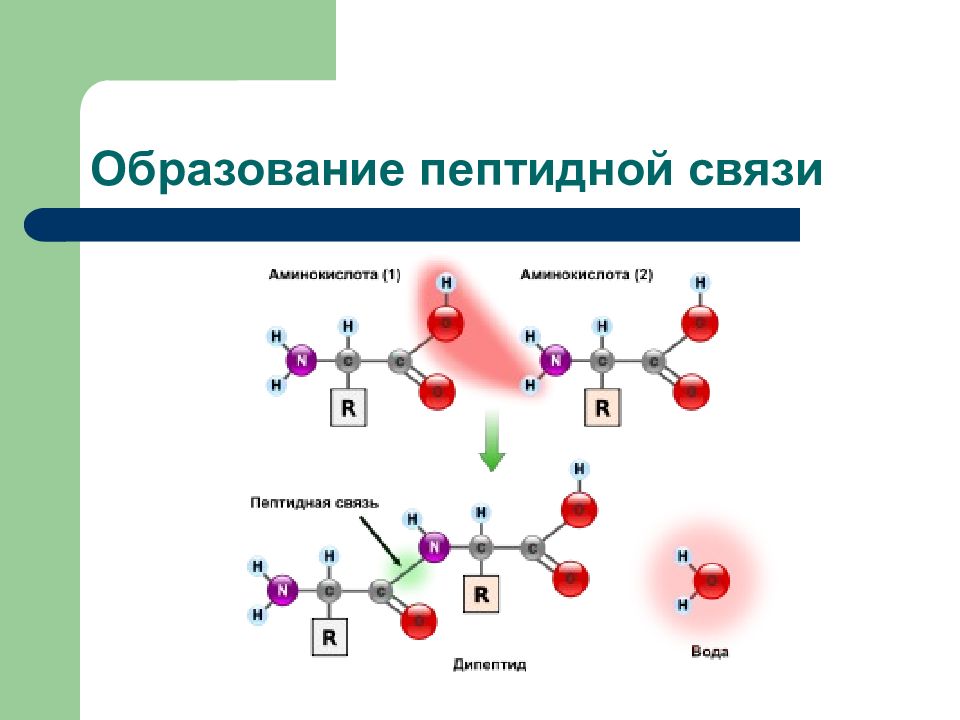
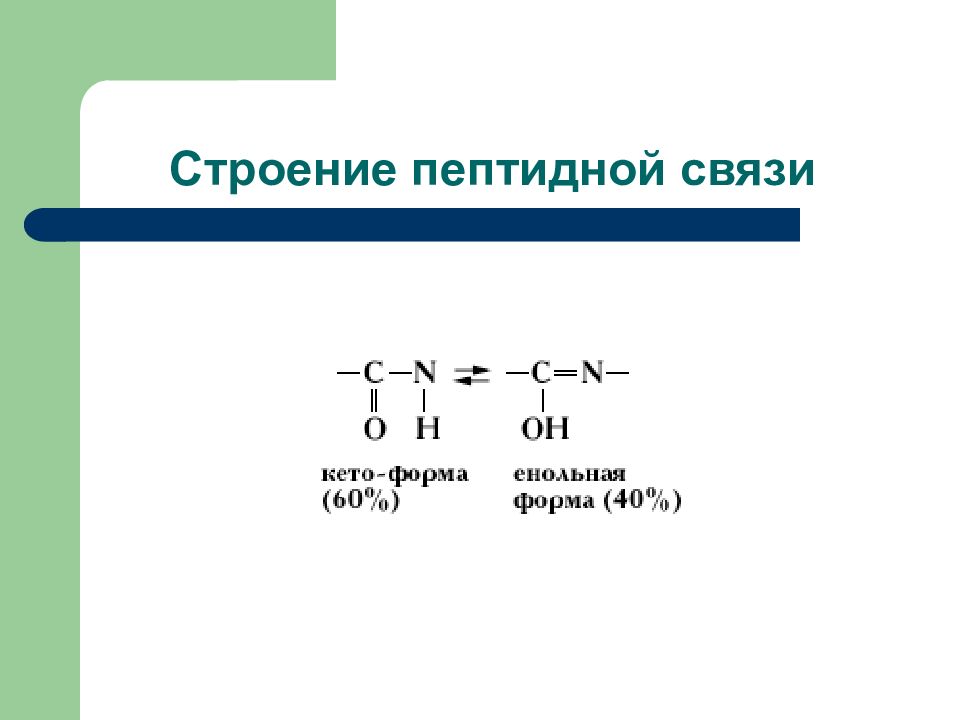
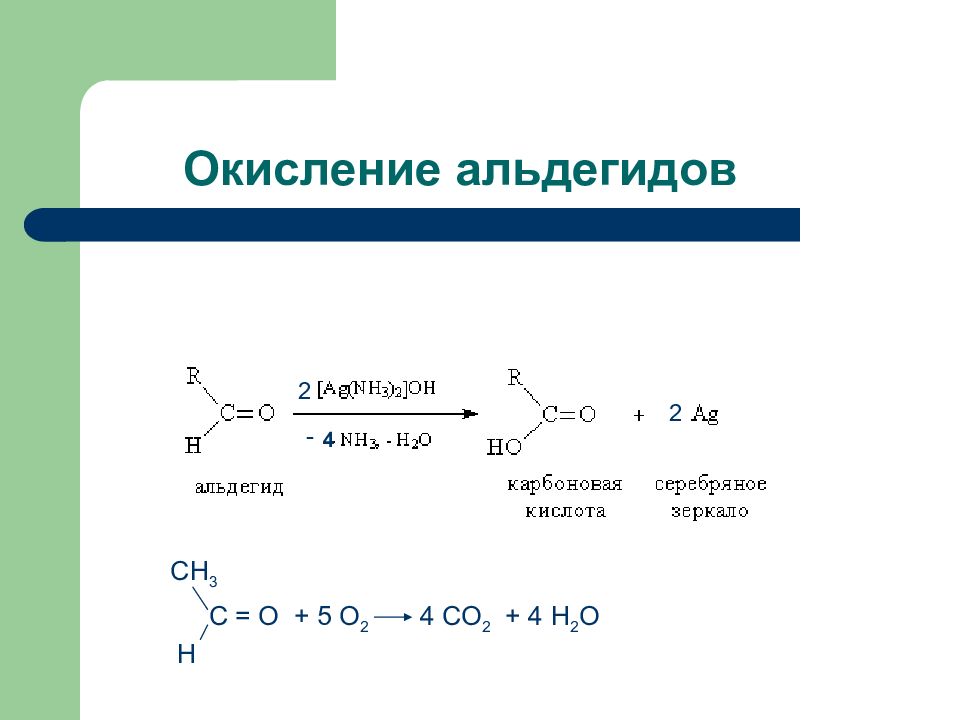
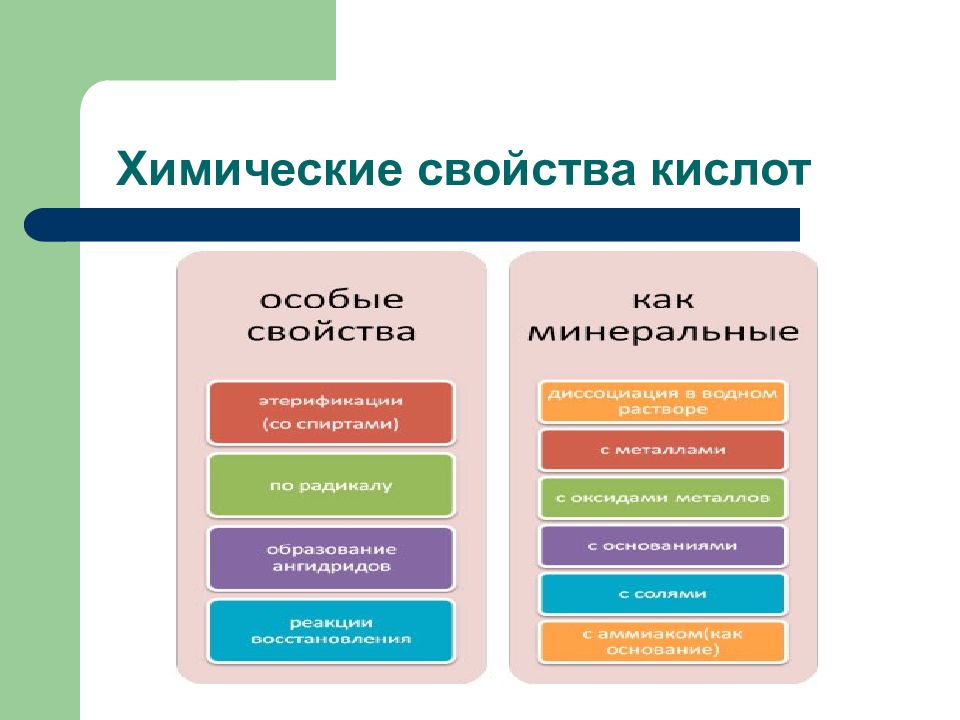
Слайд 14: Химические свойства карбоновых кислот
Реакции с участием карбоксильной группы а) замещение атомов водорода б) замещение гидроксильной группы (нуклеофильное замещение) Это: - образование солей - образование сложных эфиров - образование тиоэфиров - образование амидов Реакции с участием радикала: - дегидрирование - карбоксилирование
Слайд 15: Дикарбоновые кислоты
Общая формула С n H 2n-2 O 4 Щавелевая (этандиовая) НООС-СООН Малоновая (пропандиовая) НООС-СН 2 -СООН Янтарная (бутандиовая) НООС-(СН 2 ) 2 СООН Глутаровая (пентандиовая) НООС-(СН 2 ) 3 -СООН
Слайд 16: Заменимые аминокислоты
Аланин Аргинин Аспарагиновая кислота Глицин Глутаминовая кислота Гистидин Пролин Серин Тирозин Цистеин
Слайд 17: Незаменимые аминокислоты
Валин Лейцин Изолейцин Лизин Треонин Метионин Фенилаланин Триптофан
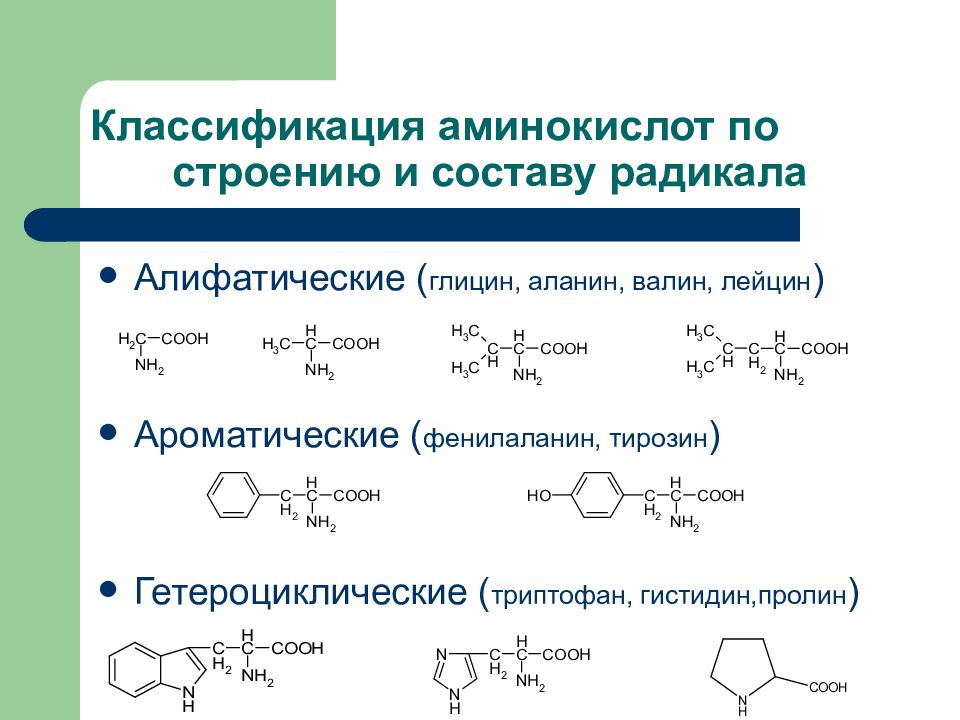
Слайд 18: Классификация аминокислот по строению и составу радикала
Алифатические ( глицин, аланин, валин, лейцин ) Ароматические ( фенилаланин, тирозин ) Гетероциклические ( триптофан, гистидин,пролин )
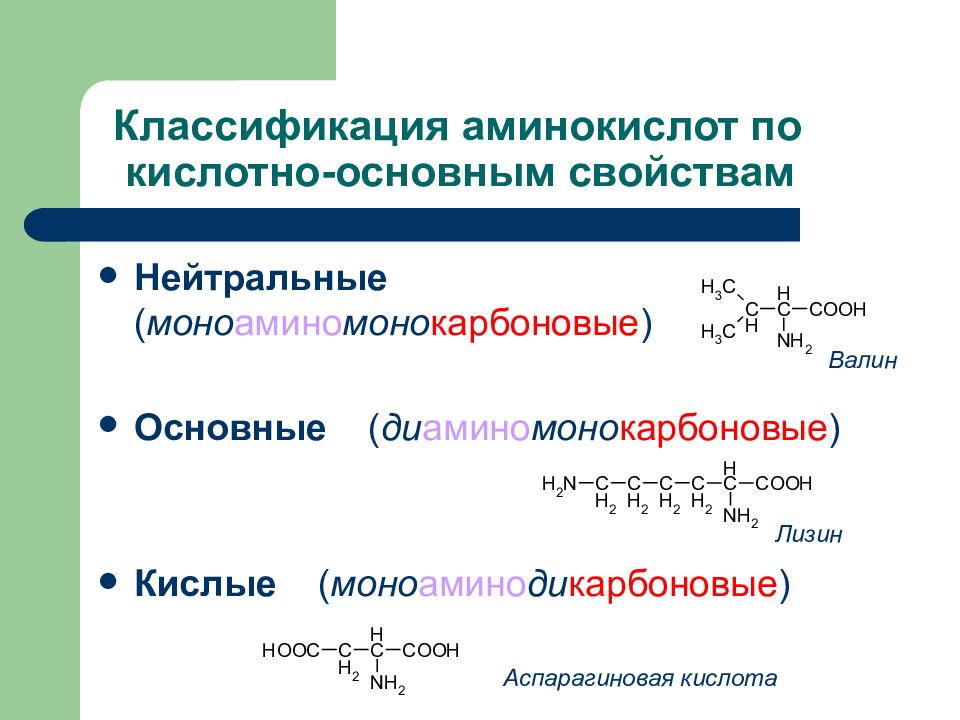
Слайд 19: Классификация аминокислот по кислотно-основным свойствам
Нейтральные ( моно амино моно карбоновые ) Основные ( ди амино моно карбоновые ) Кислые ( моно амино ди карбоновые ) Валин Лизин Аспарагиновая кислота
Слайд 22: Химические свойства
In vitro : по карбоксильной группе: Образование солей при взаимодействии с кислотами и основаниями, в т.ч. внутрикомплексных солей при взаимодействии с ионами тяжелых металлов Образование сложных эфиров Образование амидов Декарбоксилирование в присутствии Ва(ОН) 2 по аминогруппе: Образование солей при взаимодействии с кислотами Ацилирование взаимодействие друг с другом
Слайд 23: Химические свойства
In vivo : Декарбоксилирование Дезаминирование: - неокислительное - окислительное Трансаминирование (переаминирование) Поликонденсация с образованием полипептидов
Слайд 27: Ксантопротеиновая реакция
Для обнаружения а-аминокислот, со- держащих в радикале циклы ароматического характера
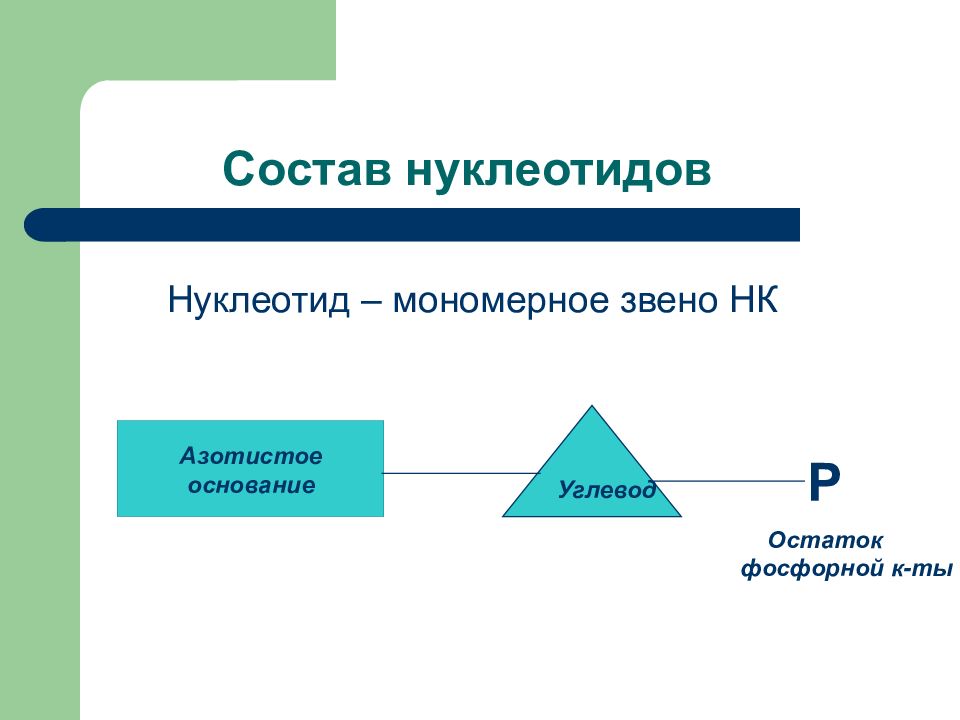
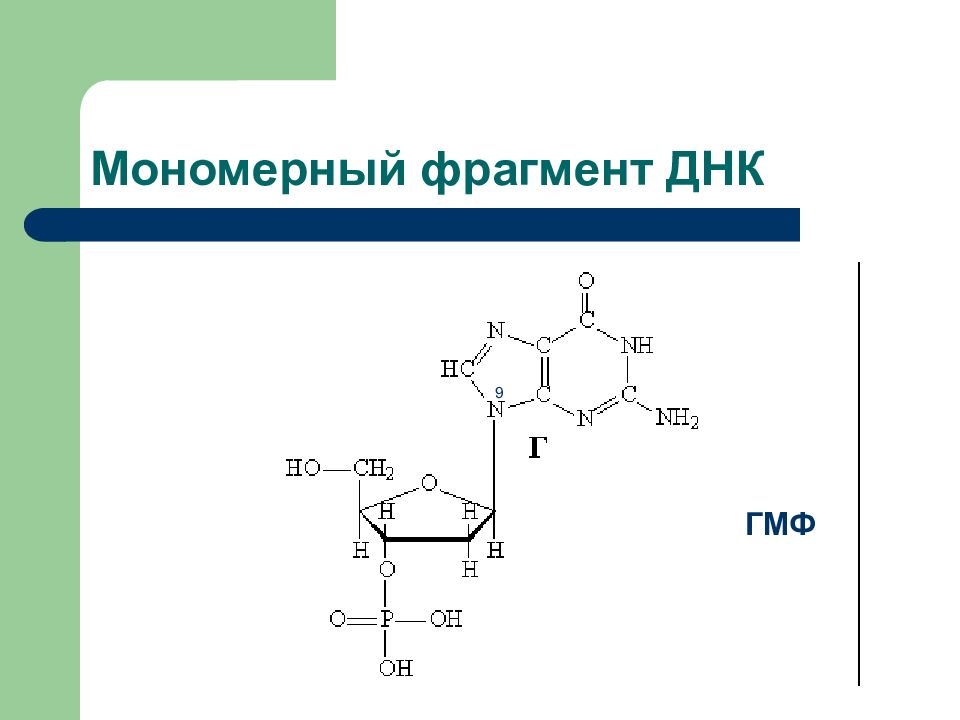
Слайд 28: Состав нуклеотидов
Нуклеотид – мономерное звено НК Азотистое основание Углевод Р Остаток фосфорной к-ты
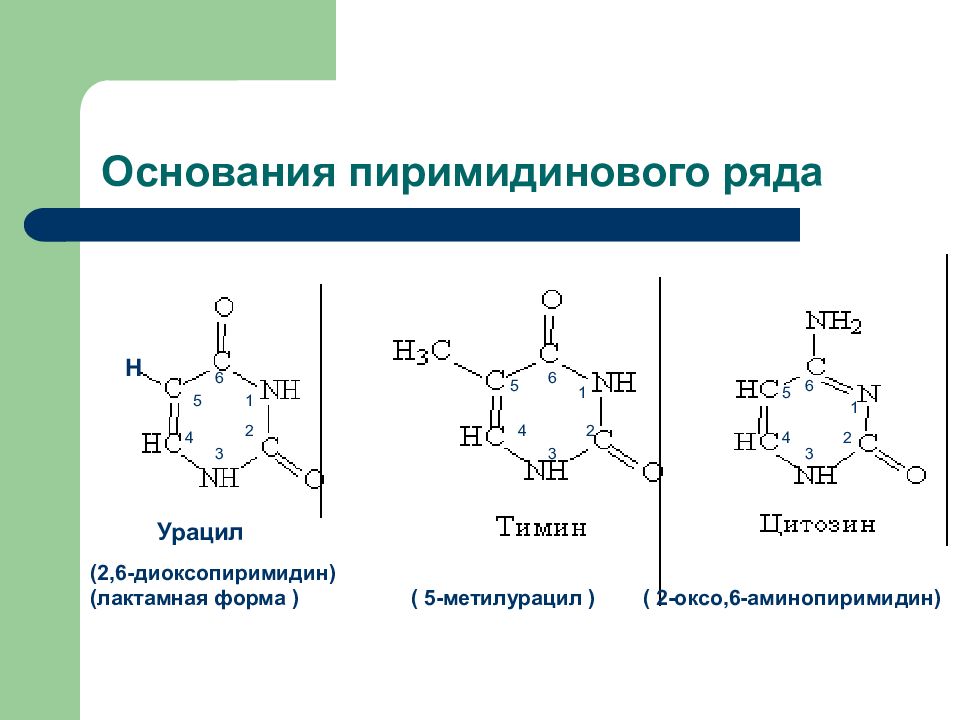
Слайд 29: Основания пиримидинового ряда
Н Урацил 1 2 4 5 5 4 3 2 1 6 6 6 3 5 (2,6-диоксопиримидин) (лактамная форма ) ( 5-метилурацил ) ( 2-оксо,6-аминопиримидин) 1 2 4 3
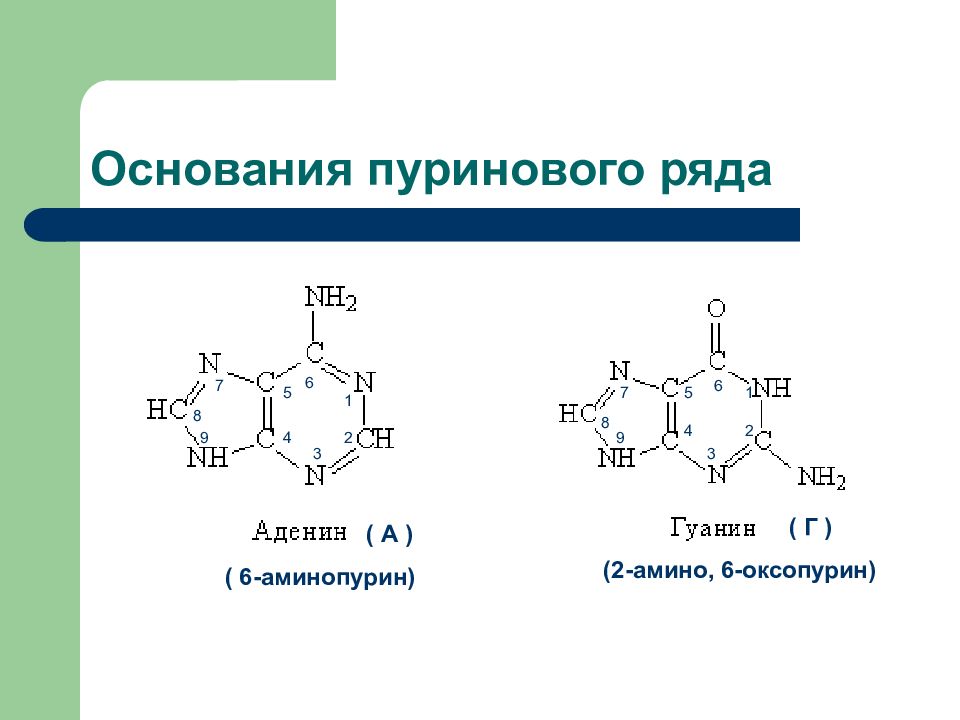
Слайд 30: Основания пуринового ряда
( А ) ( Г ) ( 6-аминопурин) (2-амино, 6-оксопурин) 6 5 4 3 2 1 9 8 7 2 6 5 1 3 4 7 8 9
Слайд 34: Номенклатура нуклеотидов
Основание Нуклеозид Нуклеотид Урацил(У) Уридин Уридинмонофосфорная к-та УМФ Тимин (Т) Тимидин Тимидинмонофосфорная к-та ТМФ Цитозин (Ц) Цитидин Цитидинмонофосфорная к-та ЦМФ Аденин (А) Аденозин Аденозинмонофосфорная к-та АМФ Гуанин (Г) Гуанозин Гуанозинмонофосфорная к-та ГМФ
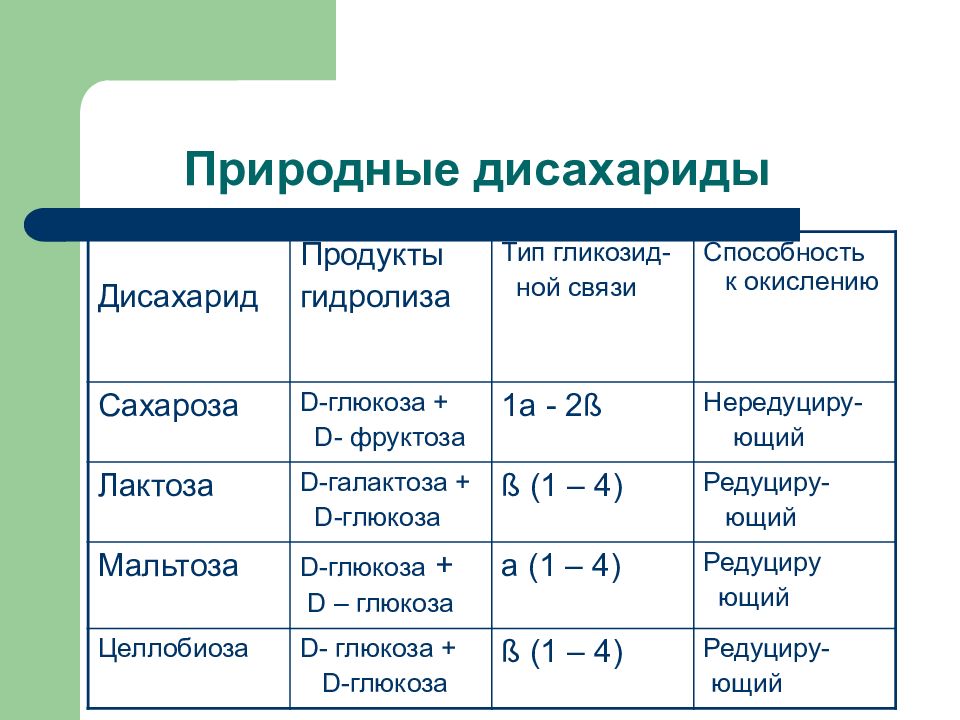
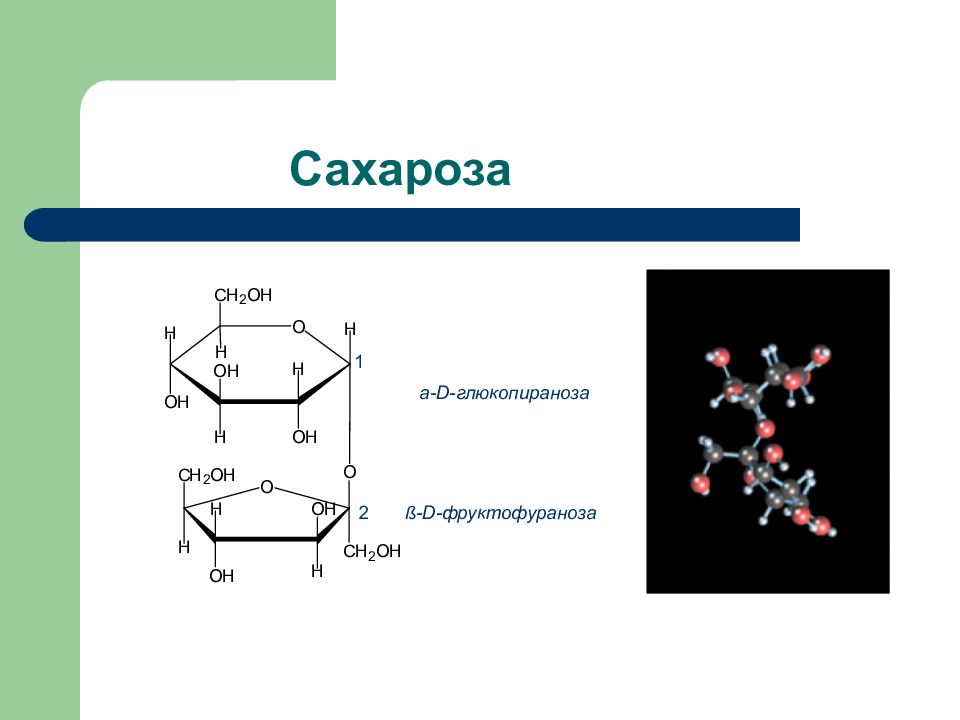
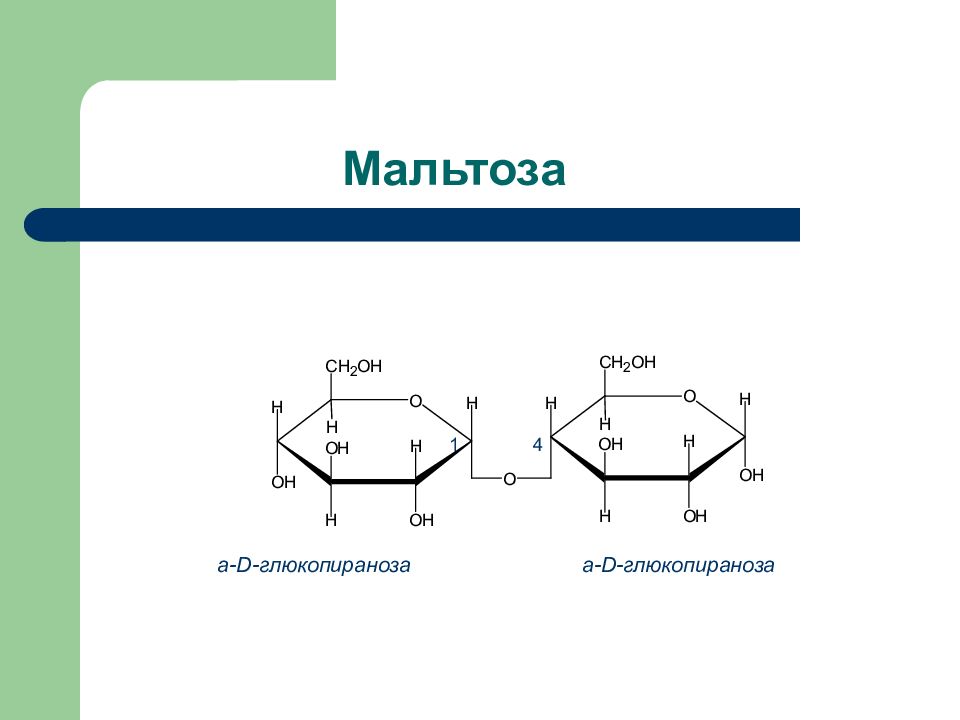
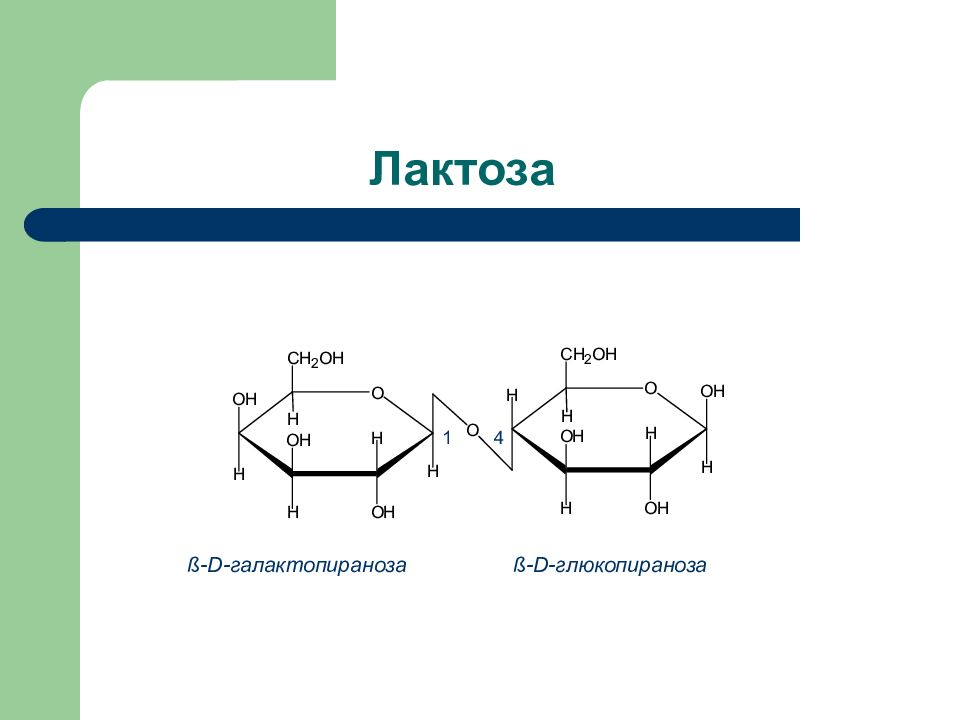
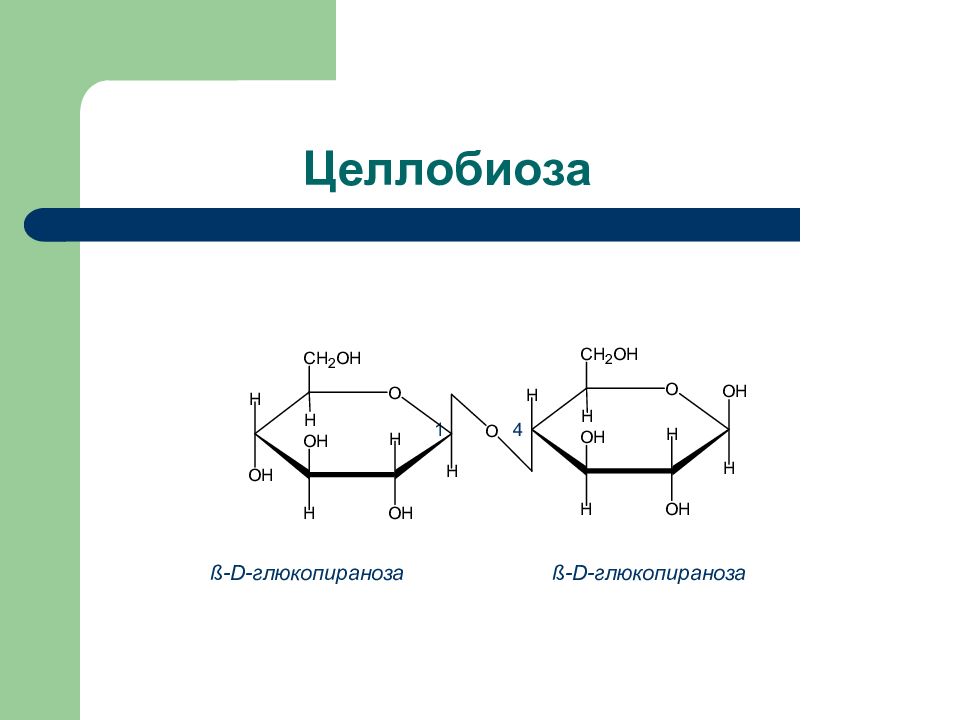
Слайд 35: Природные дисахариды
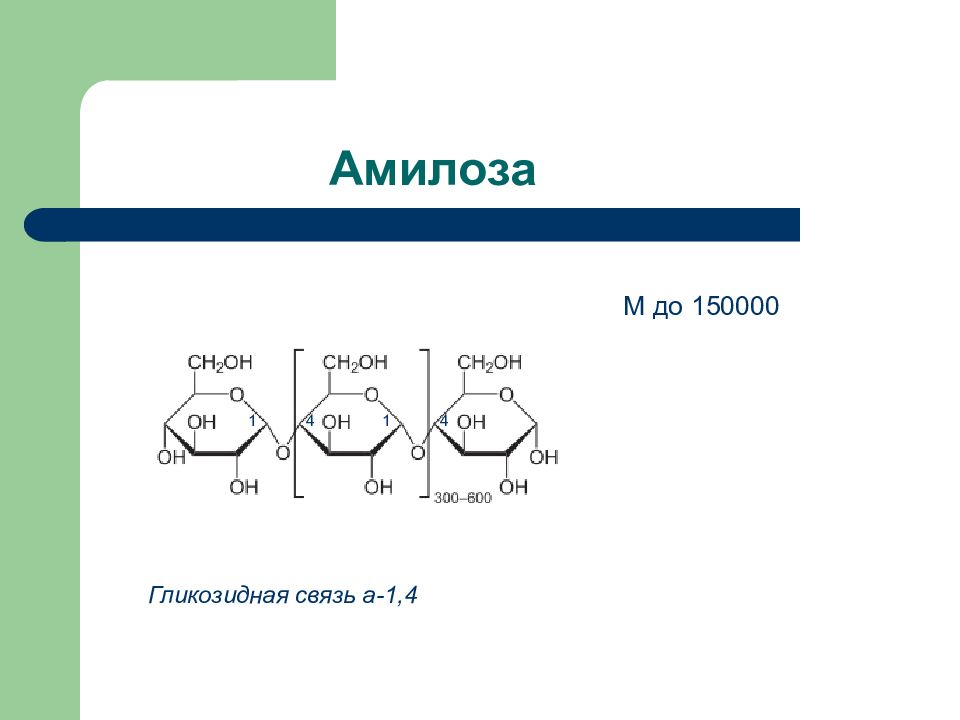
Дисахарид Продукты гидролиза Тип гликозид- ной связи Способность к окислению Сахароза D -глюкоза + D- фруктоза 1 a - 2 ß Нередуциру- ющий Лактоза D- галактоза + D -глюкоза ß (1 – 4) Редуциру- ющий Мальтоза D -глюкоза + D – глюкоза a (1 – 4) Редуциру ющий Целлобиоза D- глюкоза + D -глюкоза ß (1 – 4) Редуциру- ющий
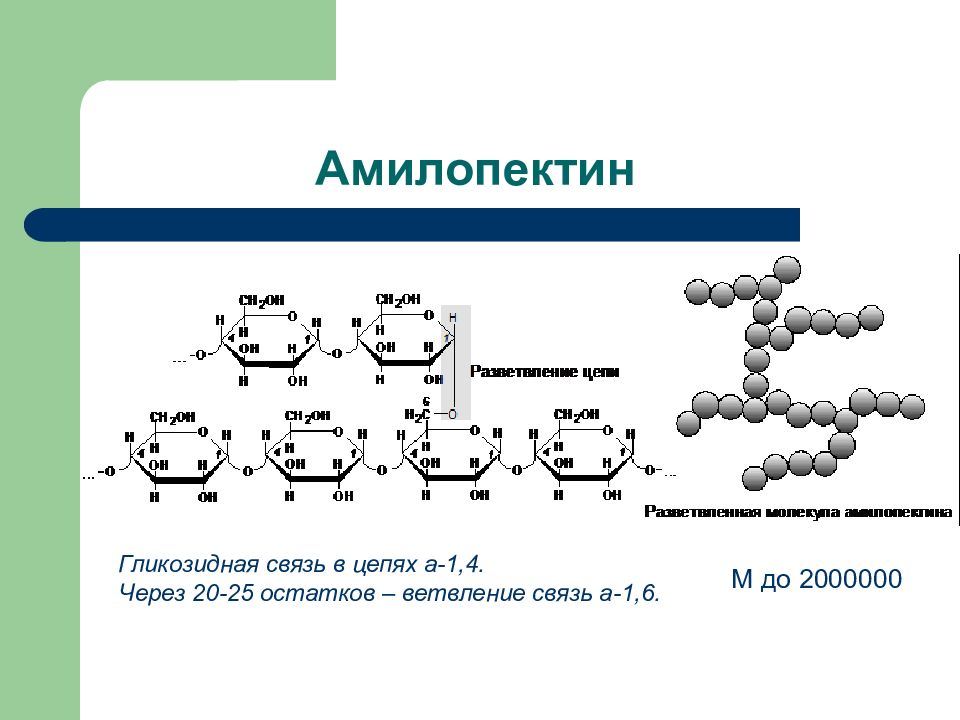
Слайд 41: Амилопектин
Гликозидная связь в цепях а-1,4. Через 20-25 остатков – ветвление связь а-1,6. М до 2000000
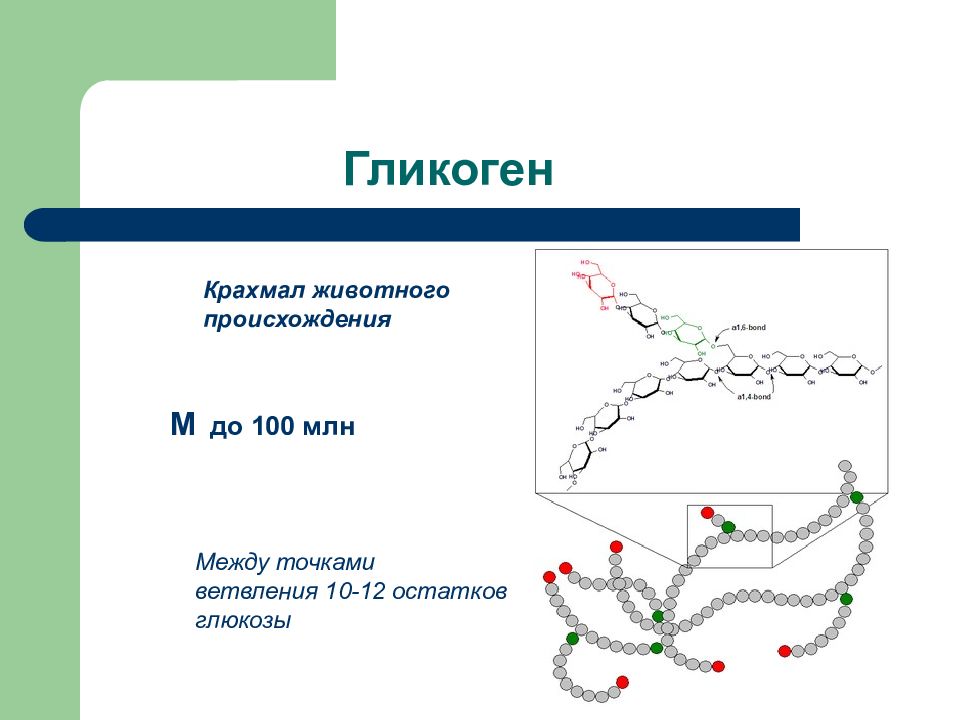
Слайд 42: Гликоген
Крахмал животного происхождения М до 100 млн Между точками ветвления 10-12 остатков глюкозы
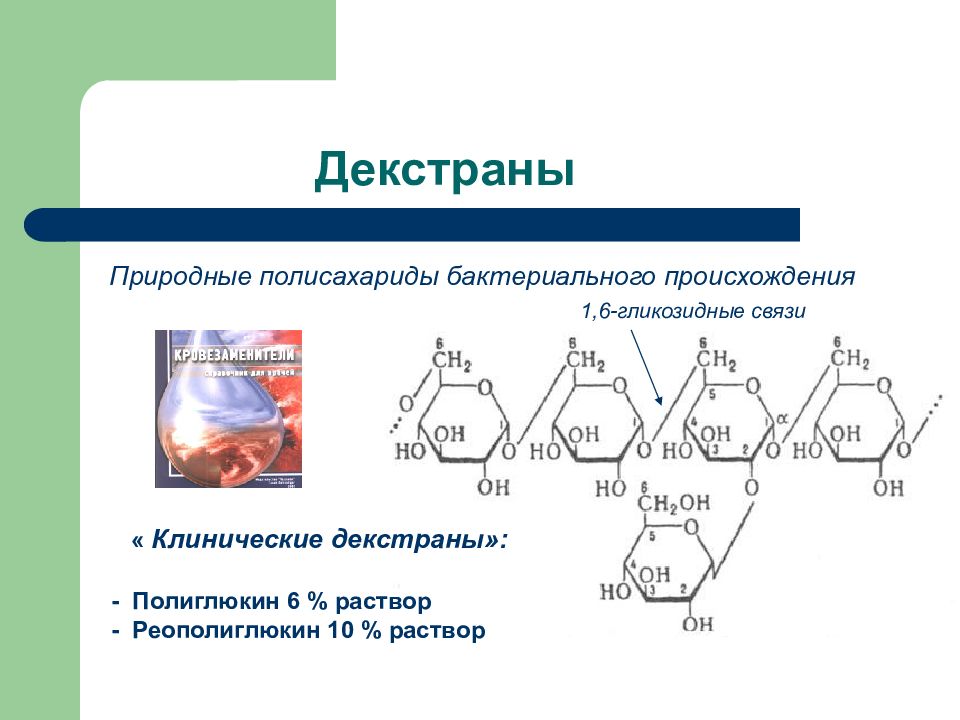
Слайд 43: Декстраны
Природные полисахариды бактериального происхождения « Клинические декстраны»: - Полиглюкин 6 % раствор - Реополиглюкин 10 % раствор 1,6-гликозидные связи
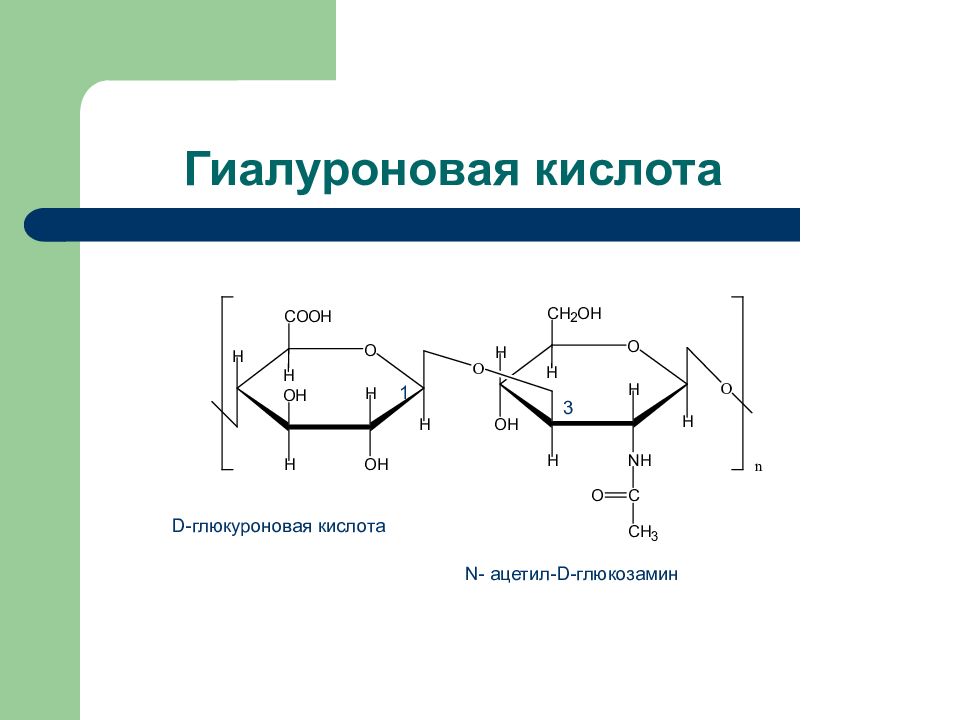
Слайд 44: Гиалуроновая кислота
1 3 D- глюкуроновая кислота N- ацетил- D- глюкозамин
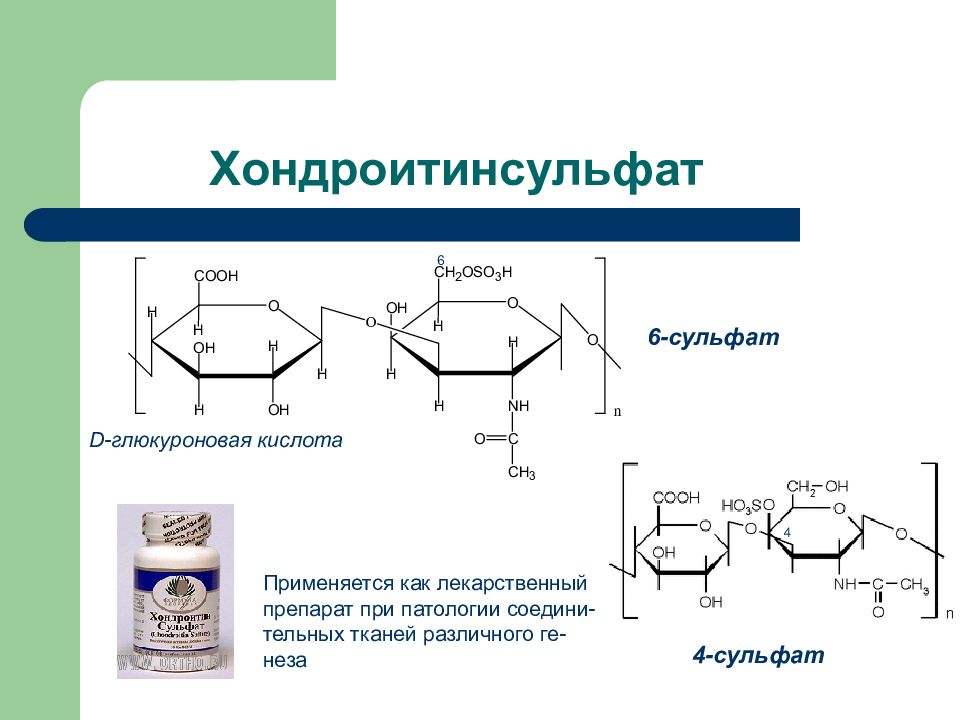
Слайд 45: Хондроитинсульфат
D- глюкуроновая кислота 6 4 6-сульфат 4-сульфат Применяется как лекарственный препарат при патологии соедини- тельных тканей различного ге- неза
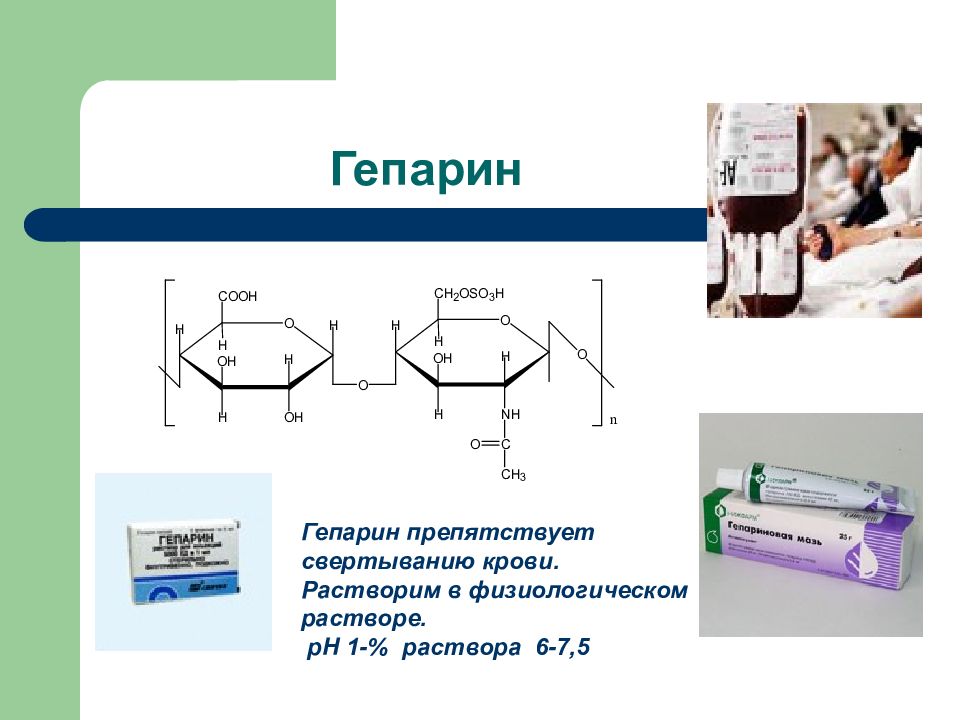
Слайд 46: Гепарин
Гепарин препятствует свертыванию крови. Растворим в физиологическом растворе. рН 1- % раствора 6-7,5
Слайд 47: ДЕ 3. Школьный курс органической химии
Модуль 1. Теория строения органических соединений. Модуль 2. Углеводороды. Модуль 3. Спирты и карбонильные соединения. Модуль 4. Азотсодержащие производные углеводородов (амины, аминокислоты, химические свойства).
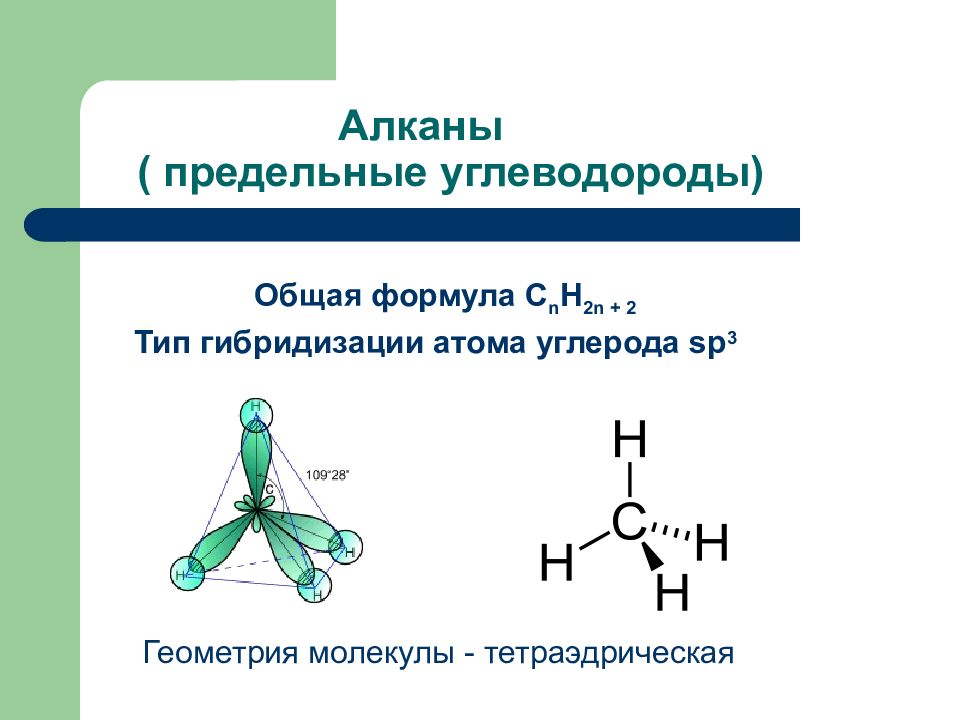
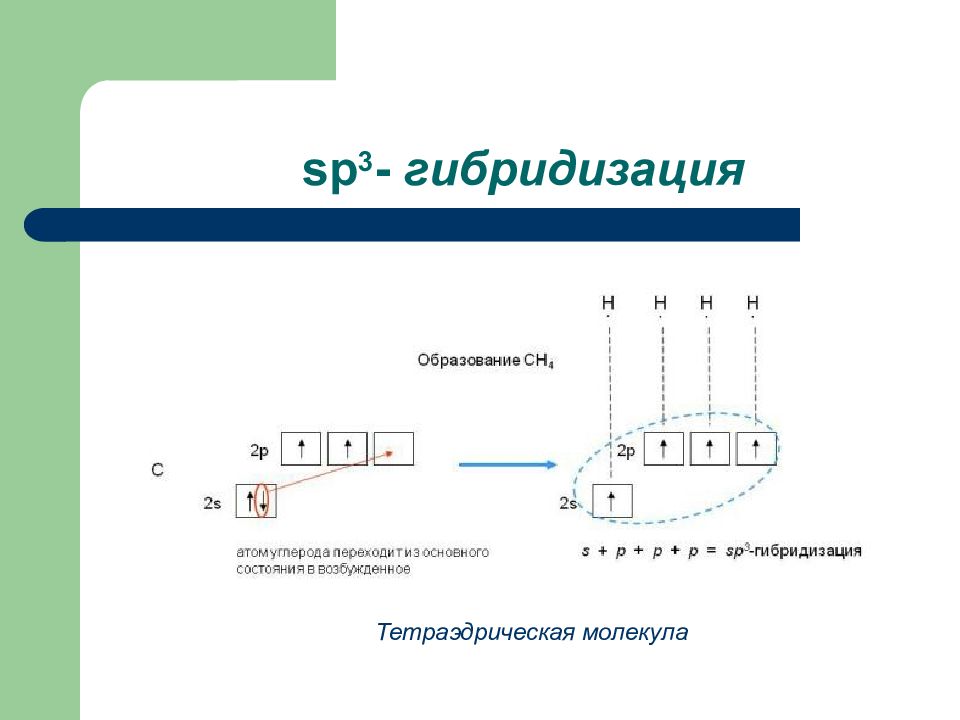
Слайд 49: Алканы ( предельные углеводороды)
Общая формула С n H 2n + 2 Тип гибридизации атома углерода sp 3 Геометрия молекулы - тетраэдрическая
Слайд 50: Химические свойства алканов
Большая химическая инертность. Устойчивость к действию кислот, щелочей и окислителей (бромная вода, перманганат калия) Горение на воздухе и в атмосфере кислорода Крекинг (термическое разложение при высокой температуре) Способность к реакциям замещения (радикальный м-зм) Изомеризация (начиная с бутана) Нитрование (реакция Коновалова) Дегидрирование
Слайд 52: Условия гомолитического разрыва связи (гомолиза)
Облучение Высокая температура Проведение реакции в газовой фазе Далее радикальные реагенты вызывают гомолитический разрыв связи в субстрате:
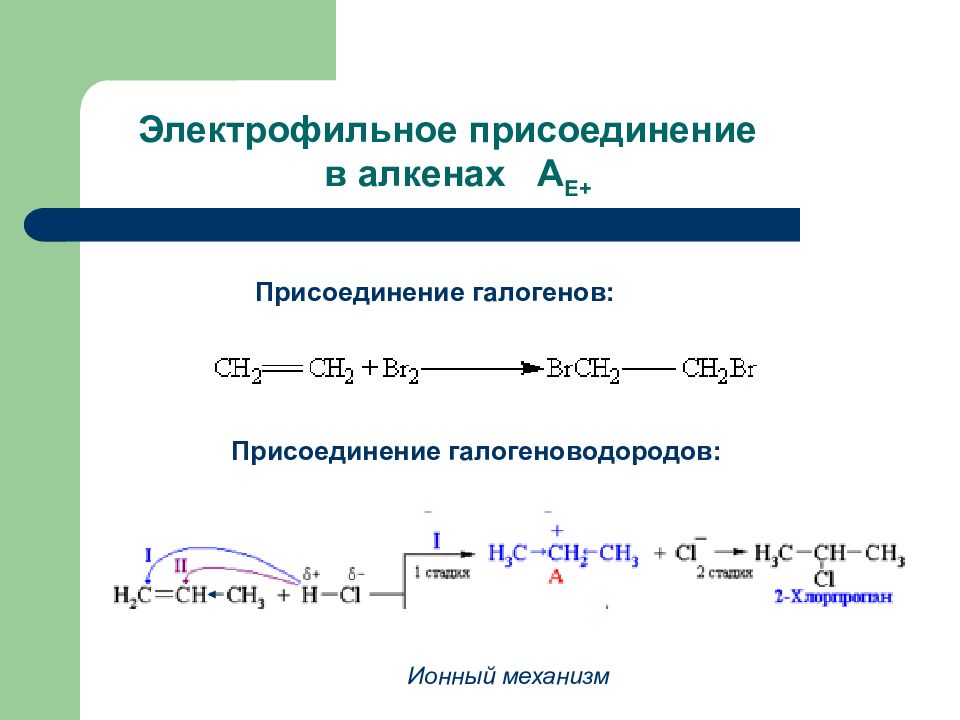
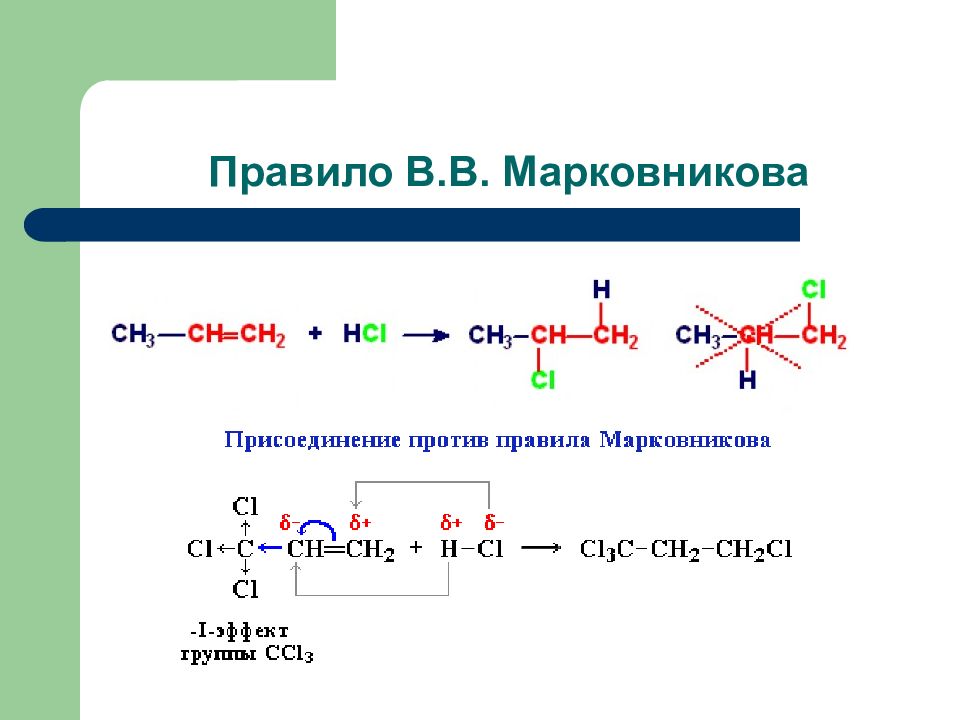
Слайд 54: Электрофильное присоединение в алкенах А Е+
Присоединение галогенов: Присоединение галогеноводородов: Ионный механизм
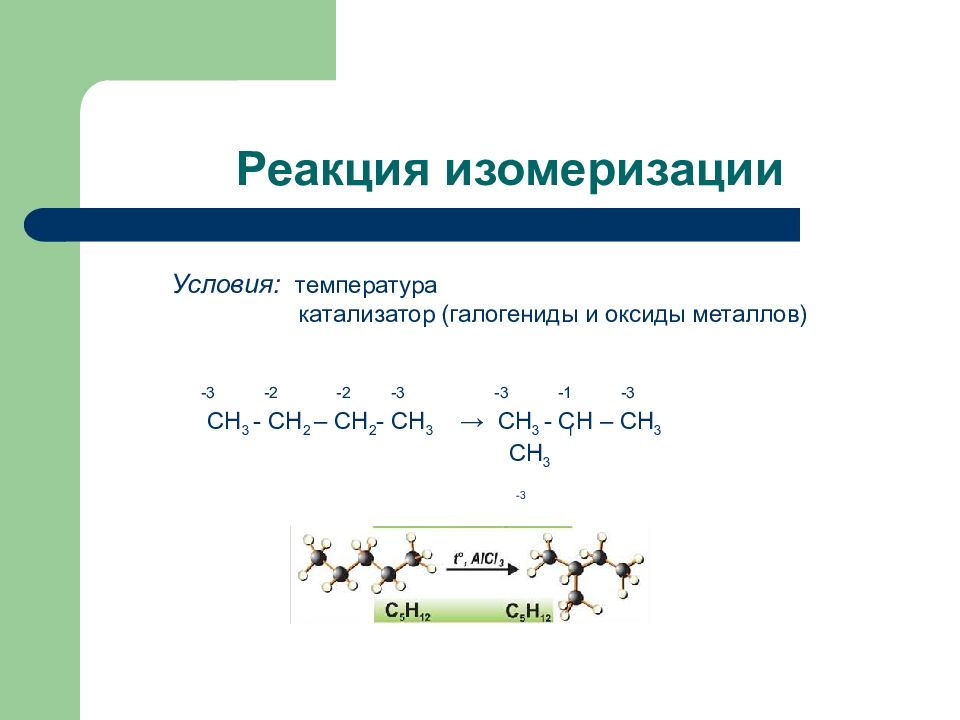
Слайд 55: Реакция изомеризации
Условия: температура катализатор (галогениды и оксиды металлов) СН 3 - СН 2 – СН 2 - СН 3 → СН 3 - СН – СН 3 СН 3 -3 -3 -2 -2 -3 -3 -1 -3
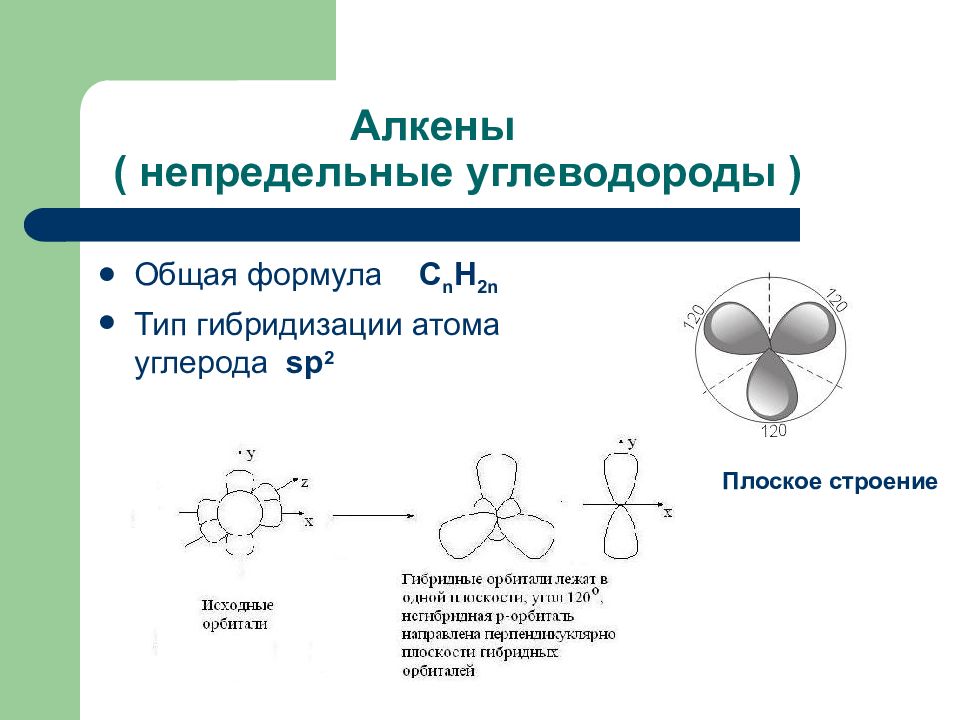
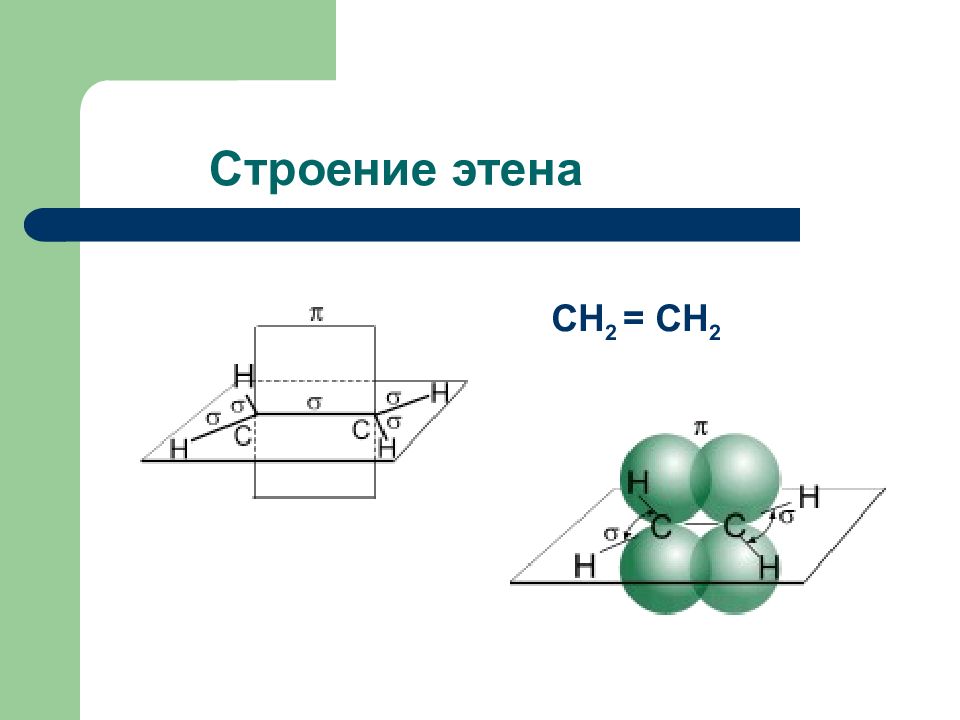
Слайд 56: Алкены ( непредельные углеводороды )
Общая формула С n H 2n Тип гибридизации атома углерода s р 2 Плоское строение
Слайд 58: Химические свойства алкенов
1. Присоединение водорода при повышенной t : 2. Присоединение галогенов: 3. Присоединение галогеноводородов: Ионный механизм А Е
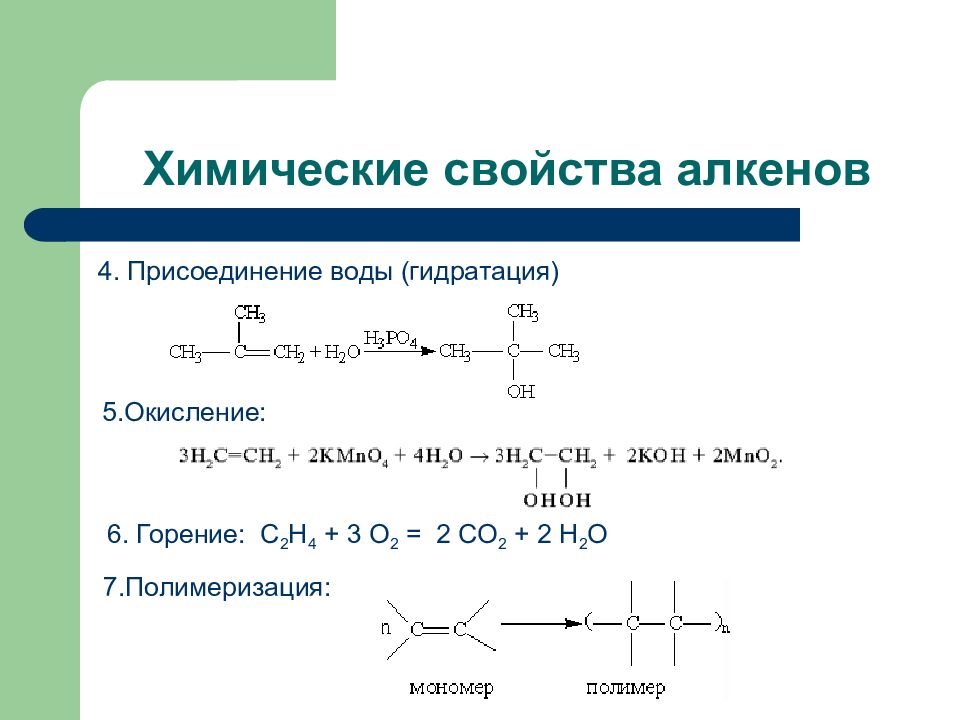
Слайд 60: Химические свойства алкенов
4. Присоединение воды (гидратация) 5.Окисление: 6. Горение: С 2 Н 4 + 3 О 2 = 2 СО 2 + 2 Н 2 О 7.Полимеризация:
Слайд 63: Алкины ( ацетиленовые углеводороды)
Общая формула С n H 2n-2 Тип гибридизации атома углерода sp Линейная молекула
Слайд 64: Химические свойства алкинов
1. Гидрирование: 2. Галогенирование: 3. Гидрогалогенирование: Пропин Пропен Пропан Этин 1,2дибромэтен 1,1,2,2 тетрабромэтан Этин Хлорэтен
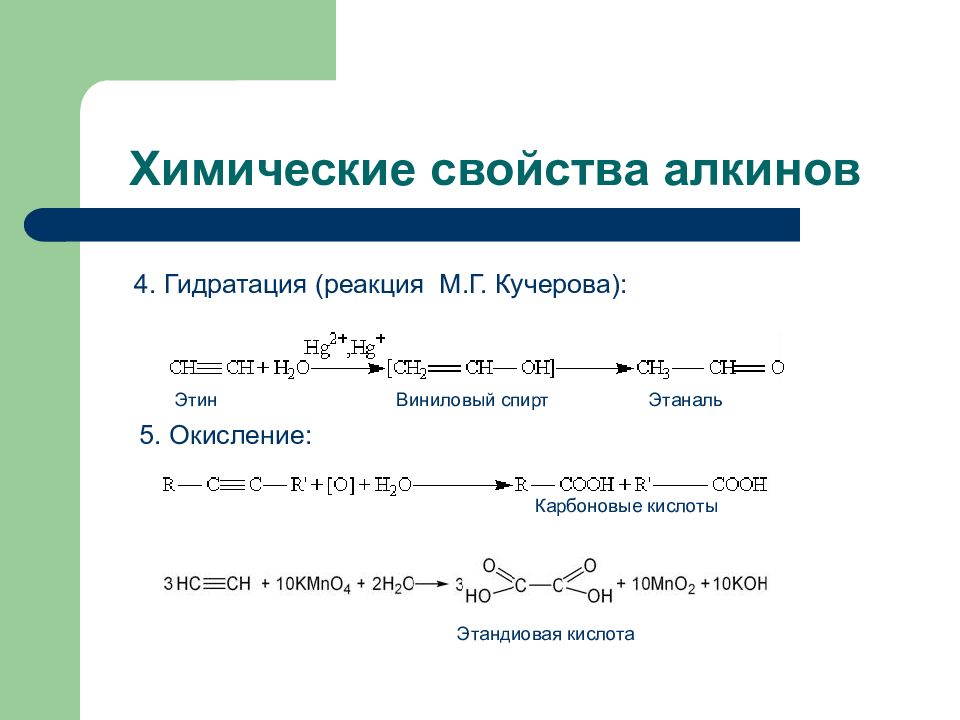
Слайд 65: Химические свойства алкинов
4. Гидратация (реакция М.Г. Кучерова): Этин Виниловый спирт Этаналь 5. Окисление: Карбоновые кислоты Этандиовая кислота
Слайд 66: Химические свойства алкинов
8. Реакции полимеризации: Винилацетилен 9. Реакции замещения с образованием ацетиленидов:
Слайд 67: Реакции замещения в бензольном кольце
Заместители первого рода (ЭД): - NH 2 -OH -CH 3 -Cl -Br - I Заместители второго рода (ЭА): -NO 2 -C=N -SO 3 H - COH - COOH —
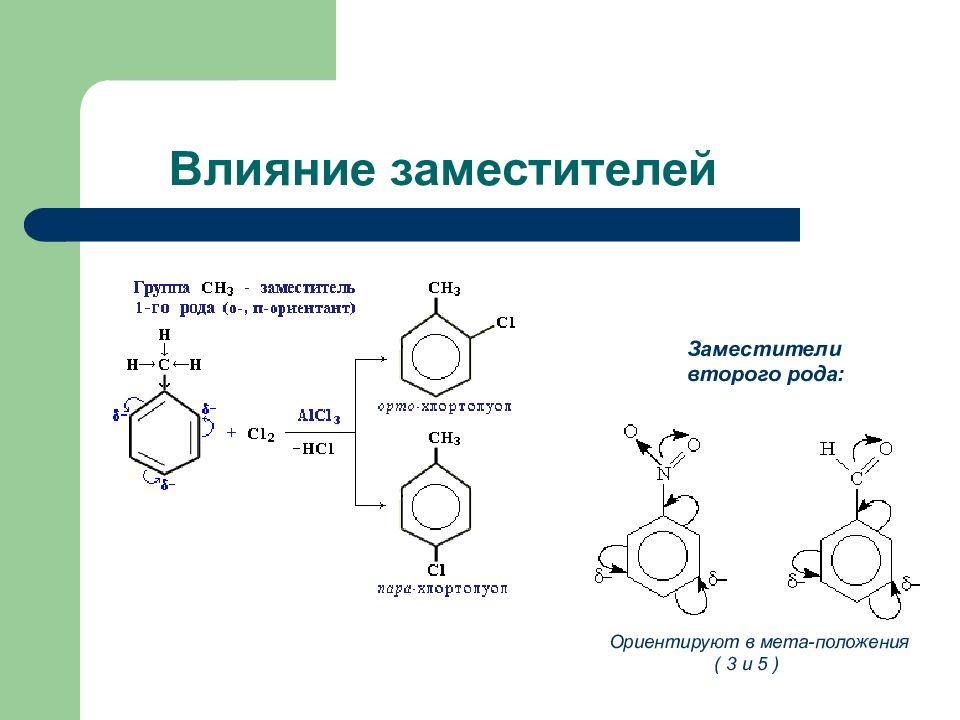
Слайд 68: Влияние заместителей
Заместители второго рода: Ориентируют в мета-положения ( 3 и 5 )
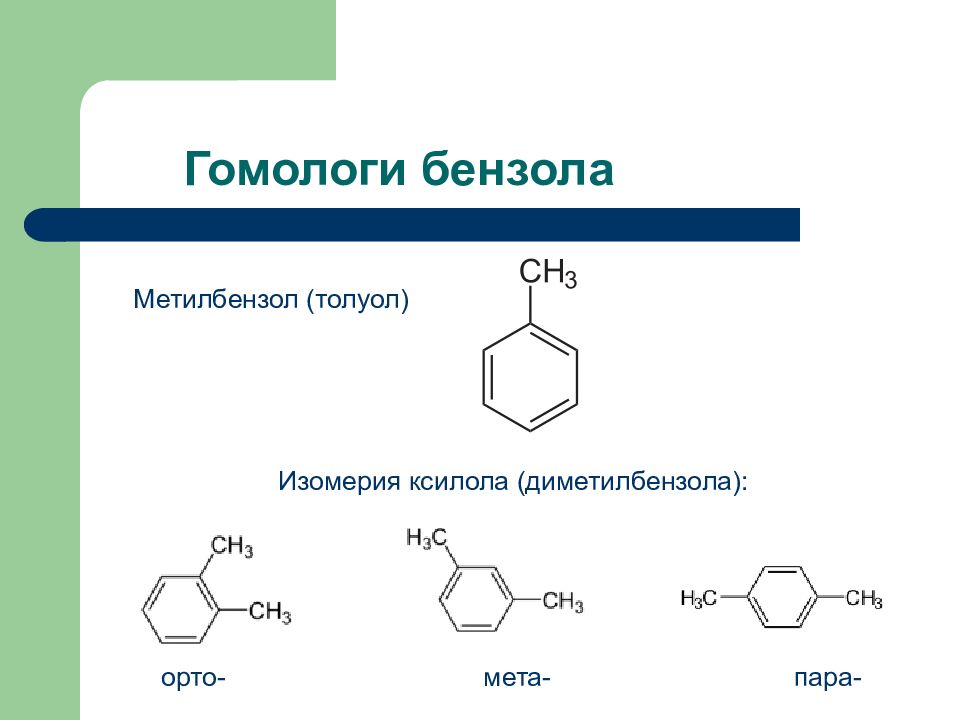
Слайд 69: Гомологи бензола
Метилбензол (толуол) Изомерия ксилола (диметилбензола): орто- мета- пара-
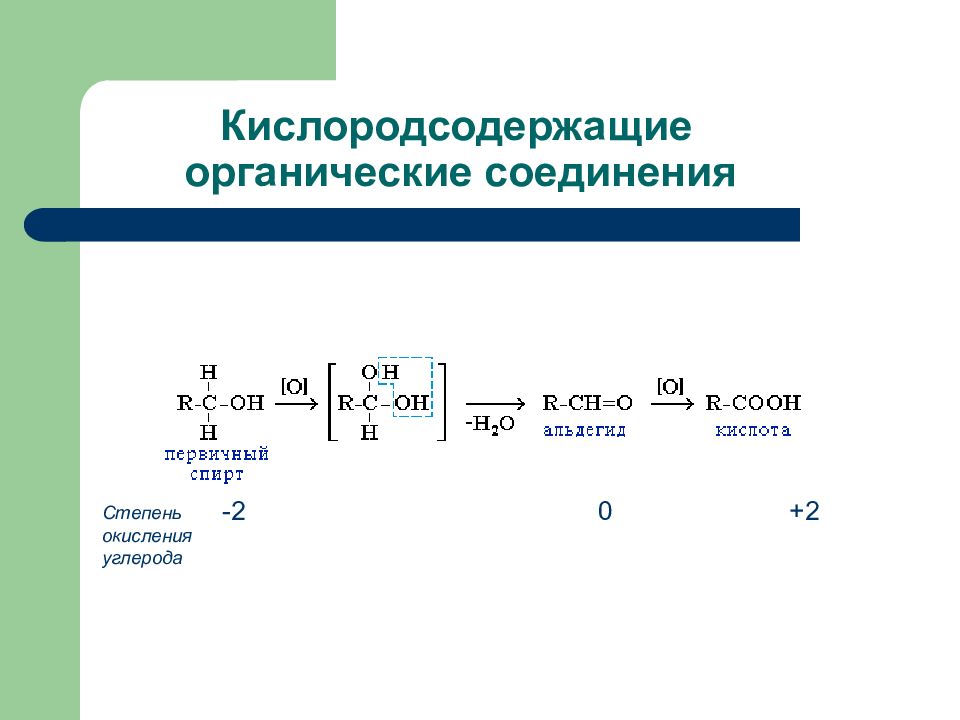
Слайд 70: Кислородсодержащие органические соединения
Степень окисления углерода -2 0 +2
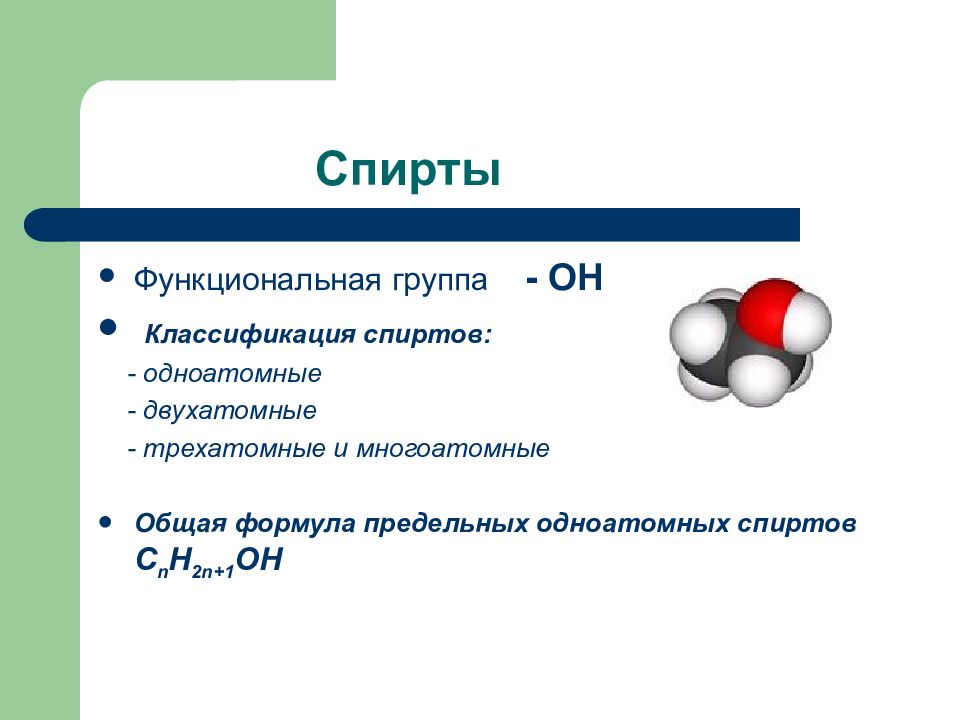
Слайд 71: Спирты
Функциональная группа - ОН Классификация спиртов: - одноатомные - двухатомные - трехатомные и многоатомные Общая формула предельных одноатомных спиртов С n H 2n+1 OH
Слайд 72: Физические свойства спиртов
Низшие спирты (до С 12 ) жидкости с характерным запахом спирта, высшие – твердые вещества без запаха. Плотность жидких спиртов меньше воды, т.е. меньше 1 г/мл Низшие спирты (до С 3 ) хорошо смешиваются с водой, что объясняется возникновением водородных связей, далее – растворимость падает. Молекулы спирта также ассоциированы за счет водородных связей
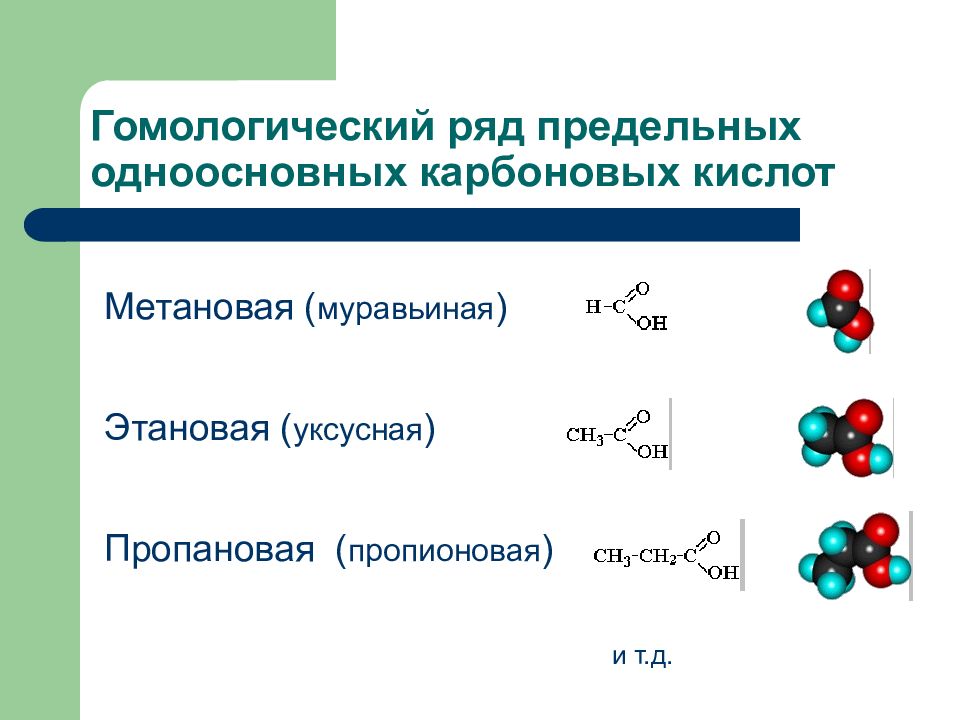
Слайд 75: Гомологический ряд предельных одноосновных карбоновых кислот
Метановая ( муравьиная ) Этановая ( уксусная ) Пропановая ( пропионовая ) и т.д.
Слайд 77: ДЕ 4. Школьный курс неорганической химии
Модуль 1. Строение атома Модуль 2. Химическая связь. Модуль 3. Классы неорганических соединений. Гидролиз солей.
Слайд 83: Виды связей
Ковалентная неполярная Ковалентная полярная Ионная Водородная Металлическая
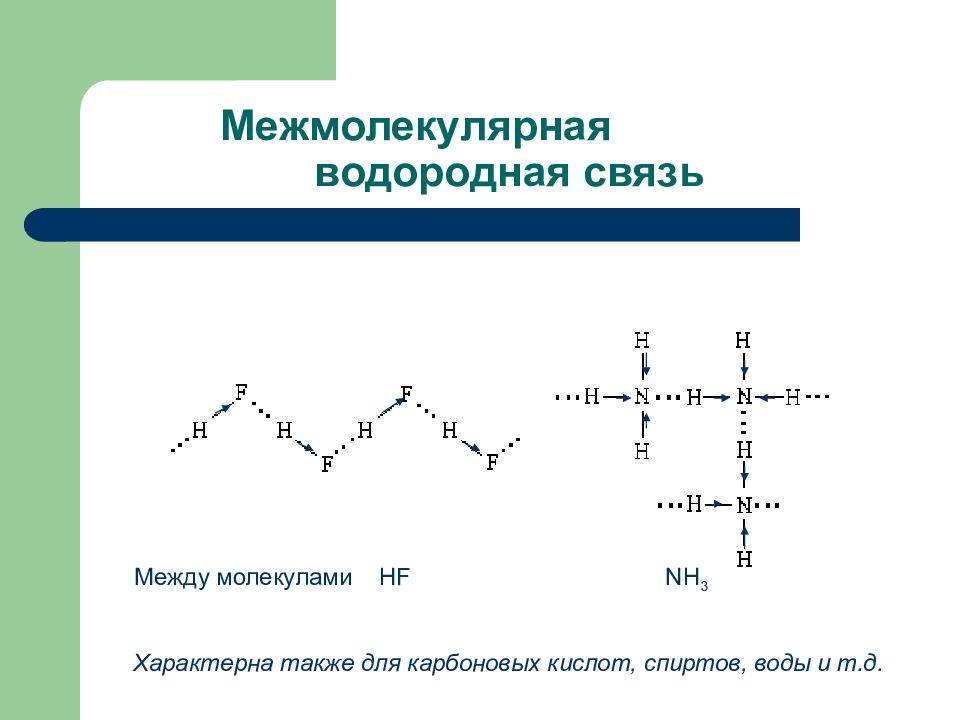
Слайд 84: Межмолекулярная водородная связь
Между молекулами HF NH 3 Характерна также для карбоновых кислот, спиртов, воды и т.д.
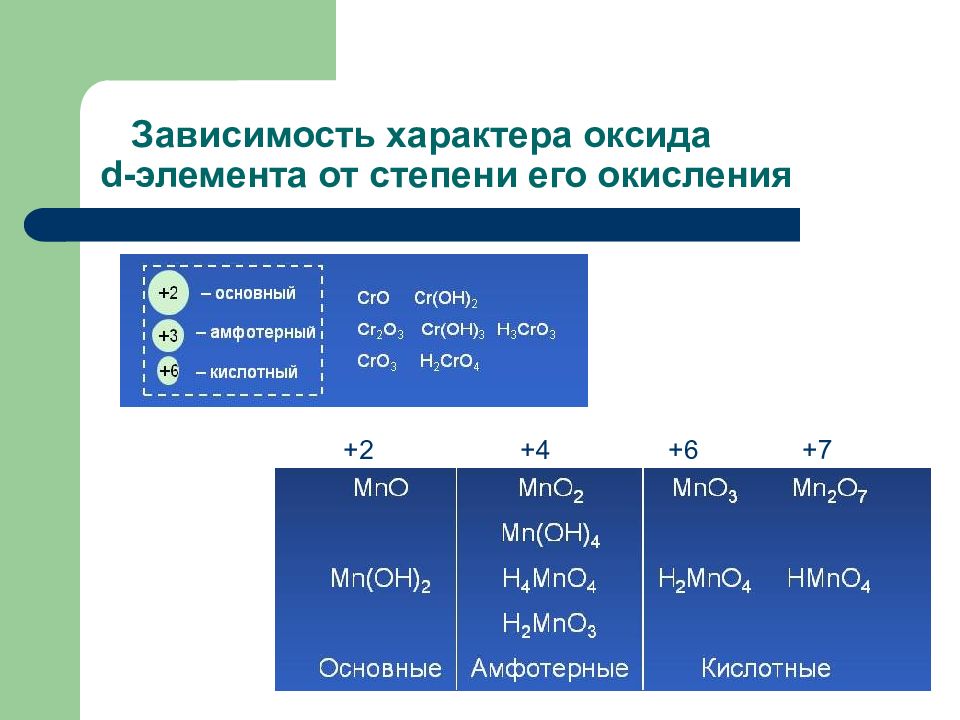
Слайд 87: Зависимость характера оксида d -элемента от степени его окисления
+2 +4 +6 +7
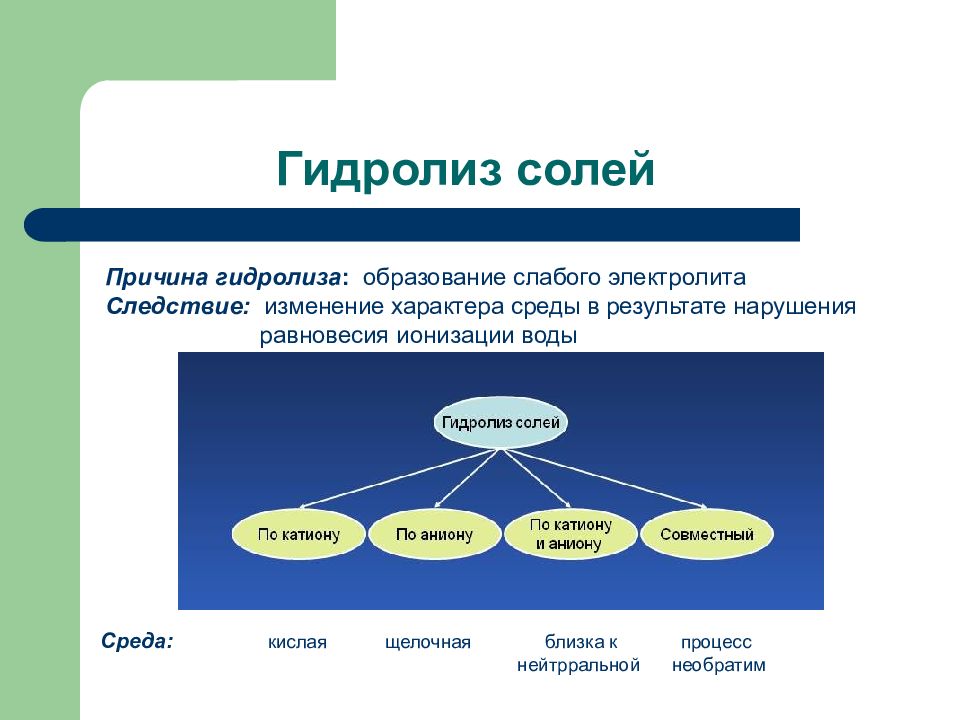
Слайд 91: Гидролиз солей
Причина гидролиза : образование слабого электролита Следствие: изменение характера среды в результате нарушения равновесия ионизации воды Среда: кислая щелочная близка к процесс нейтрральной необратим
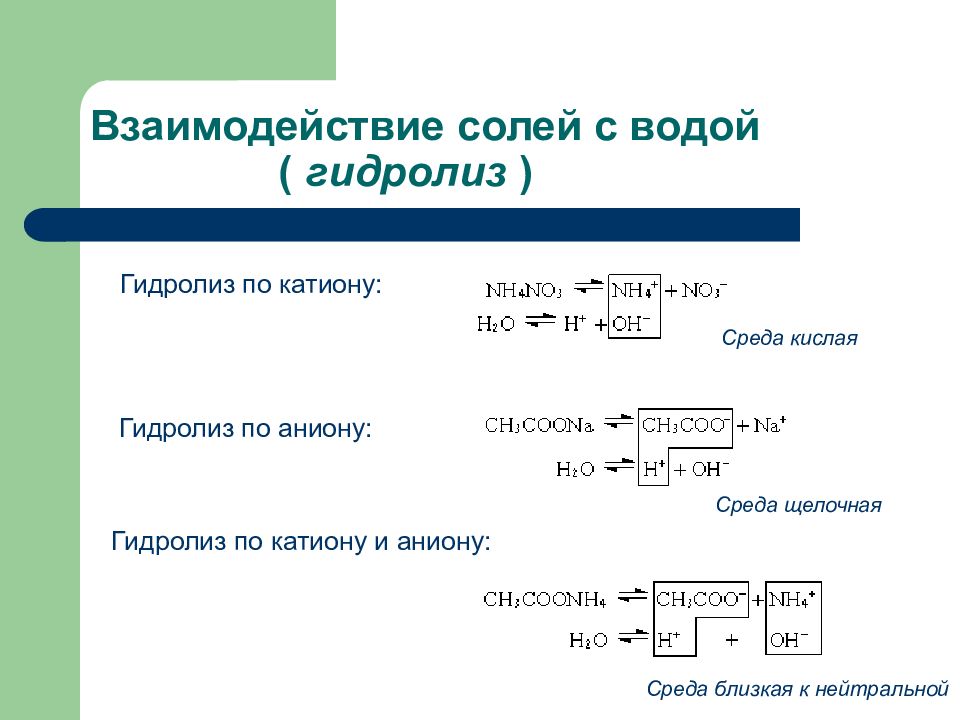
Слайд 92: Взаимодействие солей с водой ( гидролиз )
Гидролиз по катиону: Гидролиз по аниону: Гидролиз по катиону и аниону: Среда кислая Среда щелочная Среда близкая к нейтральной
Слайд 94: Гидролиз соли по аниону
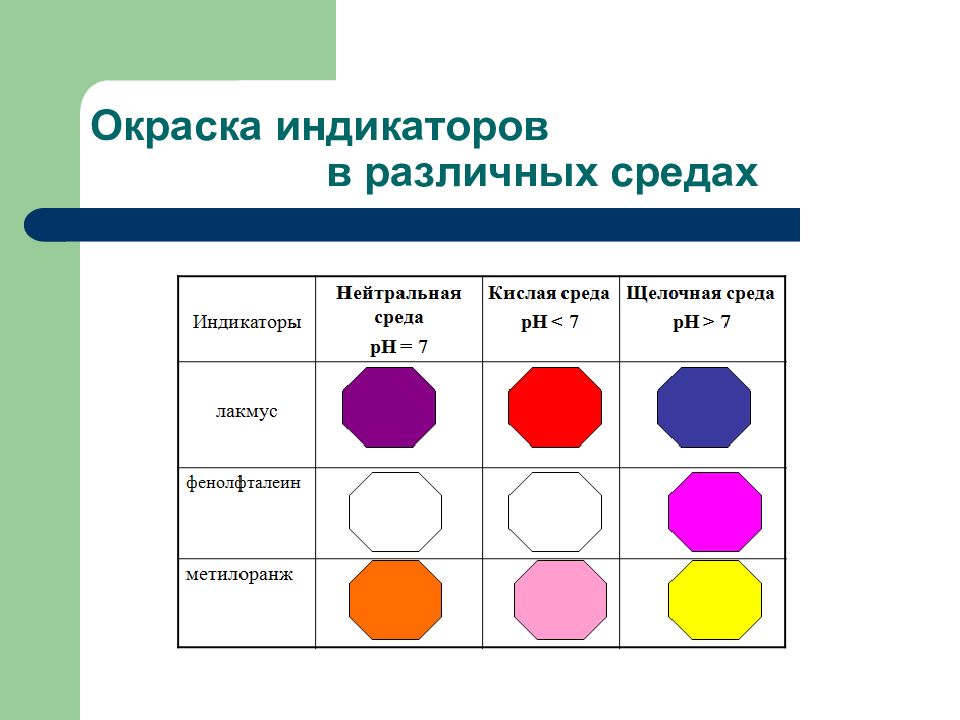
NaNO 2 Na + + NO 2 - 1. Диссоциация соли: 2. Ионное уравнение: 3. Молекулярное уравнение: Среда раствора щелочная, лакмус – синий, фенолфталеин - малиновый
Слайд 95: Гидролиз соли по катиону
FeCl 3 Fe 3+ + 3 Cl - 1 стадия: 2 стадия: З стадия: Среда раствора – кислая, лакмус – красный, метилоранж - красный
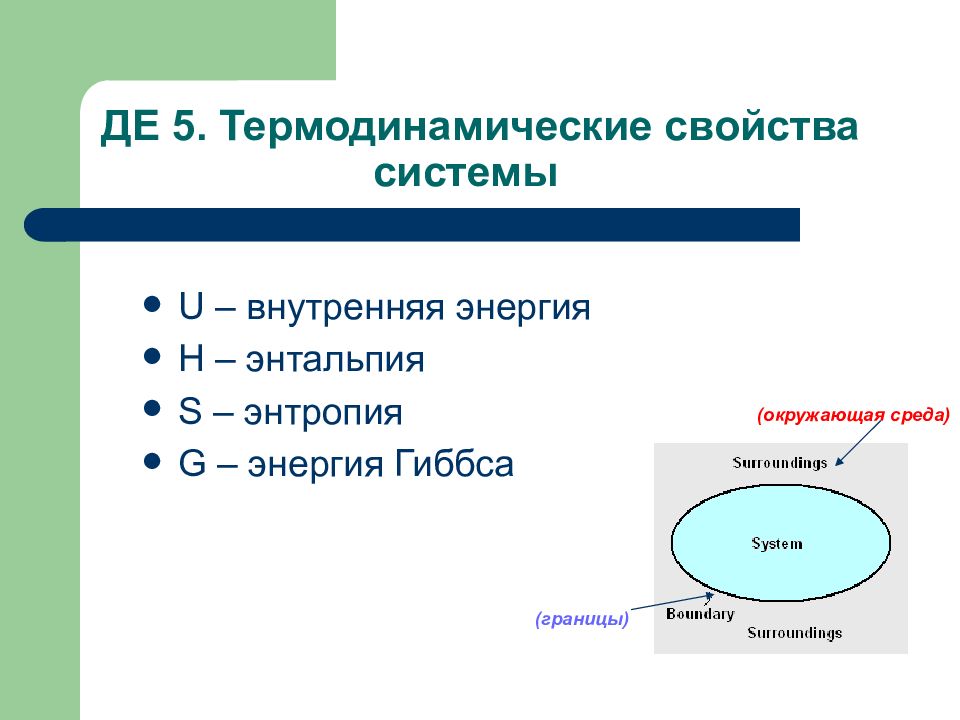
Слайд 96: ДЕ 5. Термодинамические свойства системы
U – внутренняя энергия Н – энтальпия S – энтропия G – энергия Гиббса (окружающая среда) (границы)
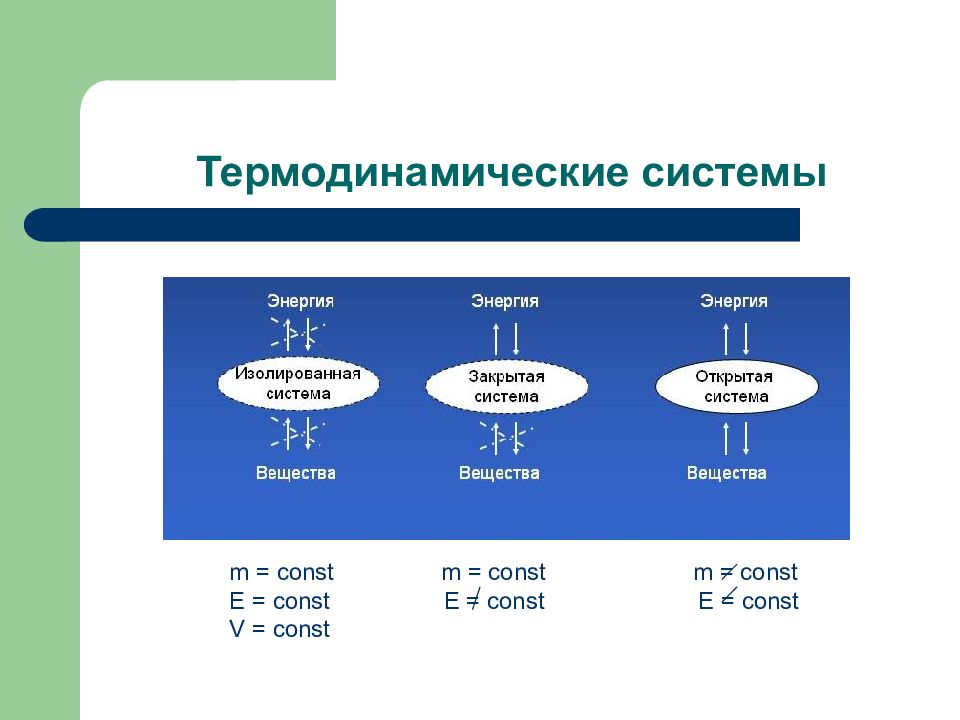
Слайд 97: Термодинамические системы
m = const m = const m = const E = const E = const E = const V = const
Слайд 98: Первый закон термодинамики
Тепло, подводимое к системе, расходуется ею на увеличение внутренней энергии и на совершение работы
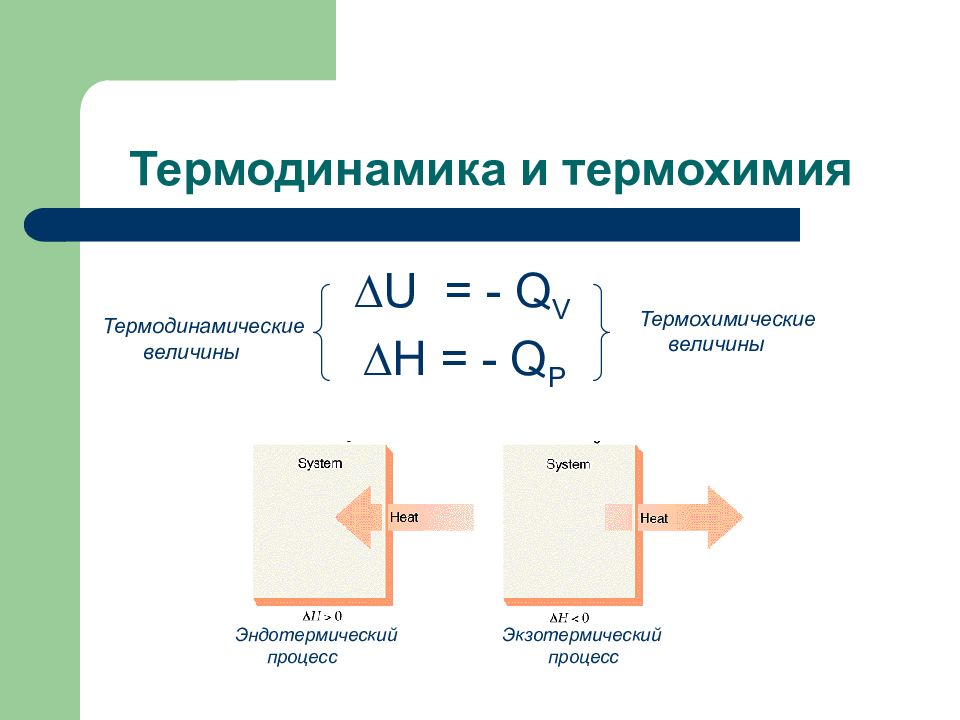
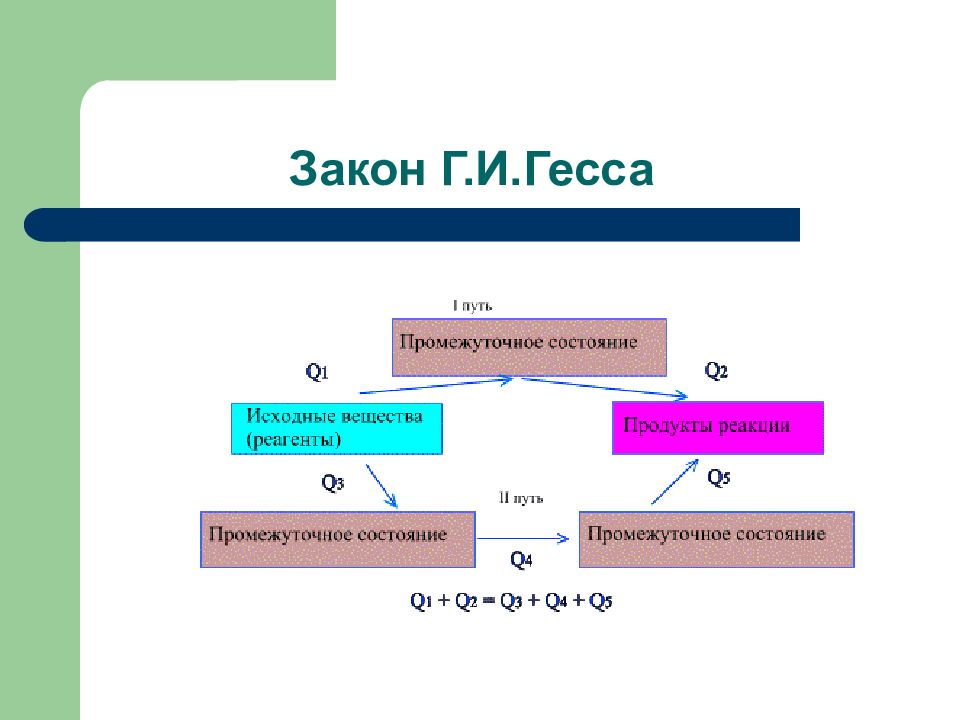
Слайд 99: Термодинамика и термохимия
∆ U = - Q V ∆ H = - Q P 14 Термохимические величины Термодинамические величины Эндотермический Экзотермический процесс процесс
Слайд 101: Первое следствие
Закон Лавуазье- Лапласа: Энтальпия разложения химического соединения равна по величине и противоположна по знаку энтальпии его образования из продуктов разложения ∆Н обр. = - ∆Н разл.
Слайд 102: Второе следствие
Изменение энтальпии химической реакции равно разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов)
Слайд 103: Третье следствие
Изменение энтальпии химической реакции равно разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов реакции ( с учетом стехиометрических коэффициентов) ( combustion – сгорание)
Слайд 104: Второй закон термодинамики
Теплота не может само- произвольно (без ком- пенсации) передаваться от тела менее нагрето- го к телу более нагретому Т 1 > Т 2
Слайд 105: Энергия Гиббса
∆ G < 0 - реакция экз эргоническая ∆ G > 0 - реакция энд эргоническая
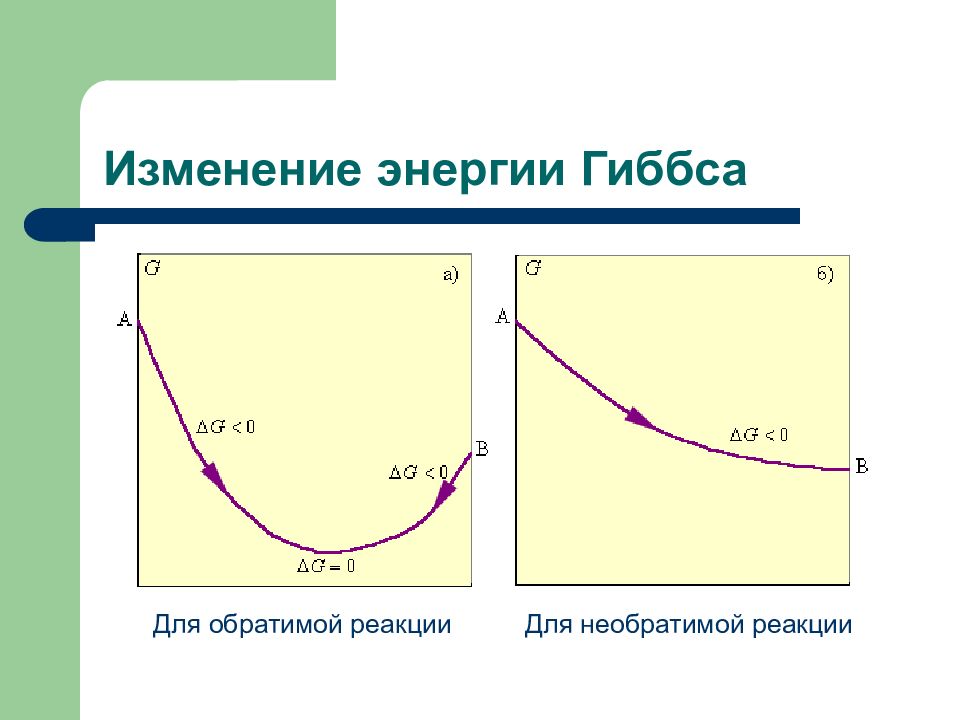
Слайд 106: Изменение энергии Гиббса
Для обратимой реакции Для необратимой реакции
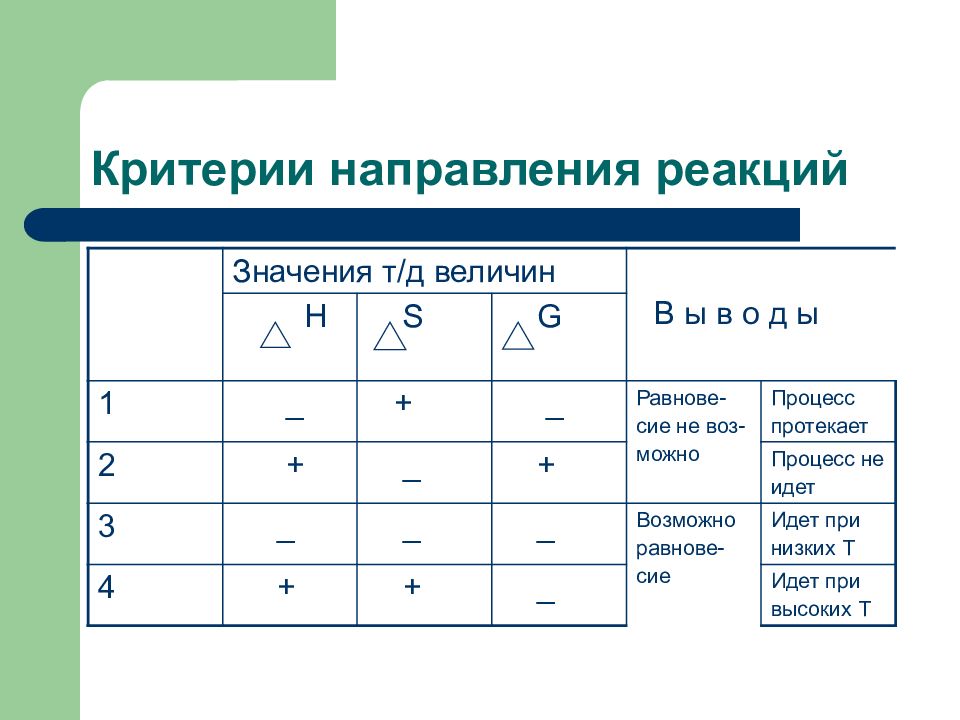
Слайд 107: Критерии направления реакций
Значения т / д величин В ы в о д ы Н S G 1 _ + _ Равнове- сие не воз- можно Процесс протекает 2 + _ + Процесс не идет 3 _ _ _ Возможно равнове- сие Идет при низких Т 4 + + _ Идет при высоких Т
Слайд 108: Химическая кинетика
Скорость химической реакции: Факторы, от которых зависит скорость химической реакции: - Природа реагирующих веществ - Концентрация реагирующих веществ - Температура - Характер среды - Катализатор
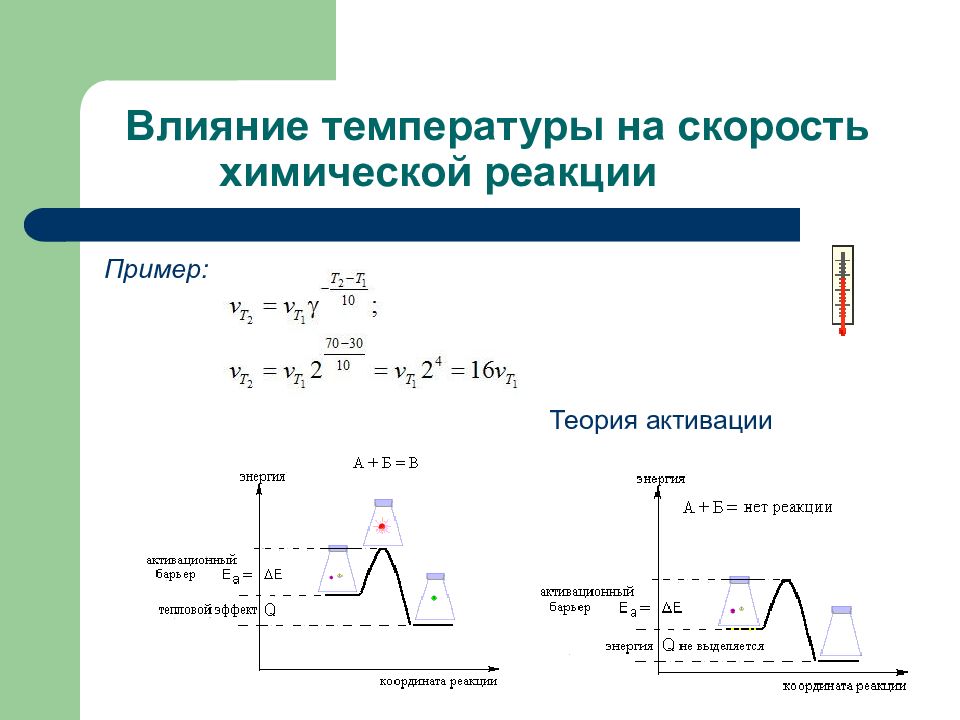
Слайд 110: Влияние температуры на скорость химической реакции
Пример: Теория активации
Слайд 114: Химическое равновесие в системе СО 2(г) + С (тв) 2 СО (г) – Q сместится вправо при
повышении давления понижении температуры повышении концентрации СО повышении температуры
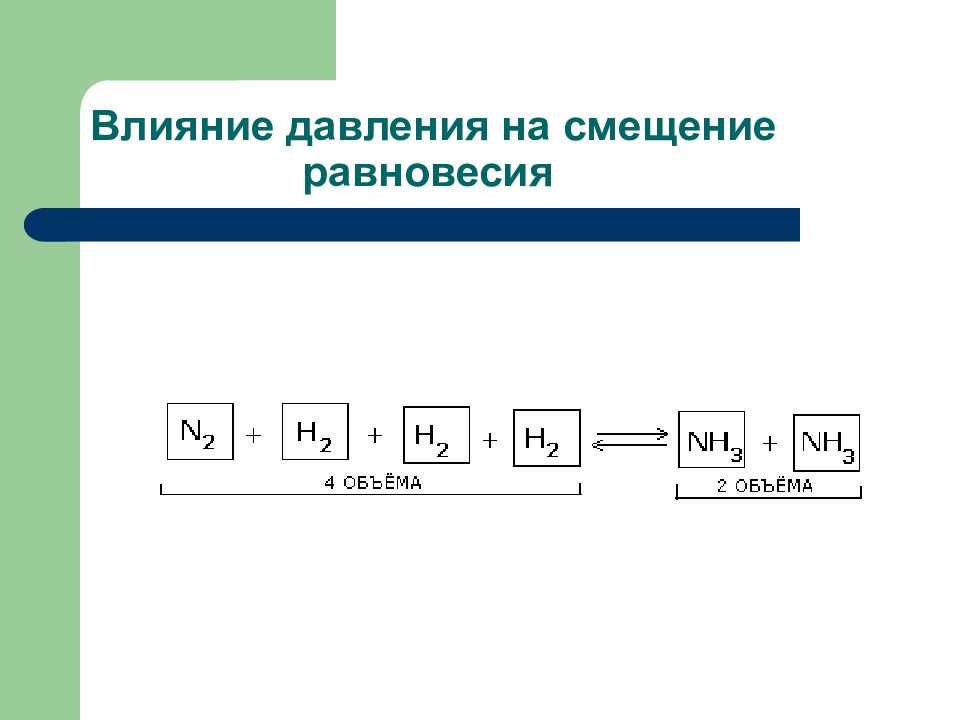
Слайд 115: Равновесие в системе N 2 + O 2 ↔2 NO – Q будет смещаться в сторону продуктов при
1. увеличении концентрации кислорода 2. увеличении давления 3. уменьшении давления 4. понижении температуры
Слайд 116: На смещение равновесия в системе N 2 + 3H 2 ↔ 2NH 3 + Q не влияет
1. понижение температуры 2. повышение давления 3. удаление аммиака из зоны реакции 4. применение катализатора
Слайд 117: ДЕ 6. Концентрация растворов
Массовая доля Молярная концентрация Молярная концентрация эквивалента Титр Моляльная концентрация Мольная доля С = m/M •V, моль / л С э = m/M э • V, моль экв. / л , г / мл , моль / кг
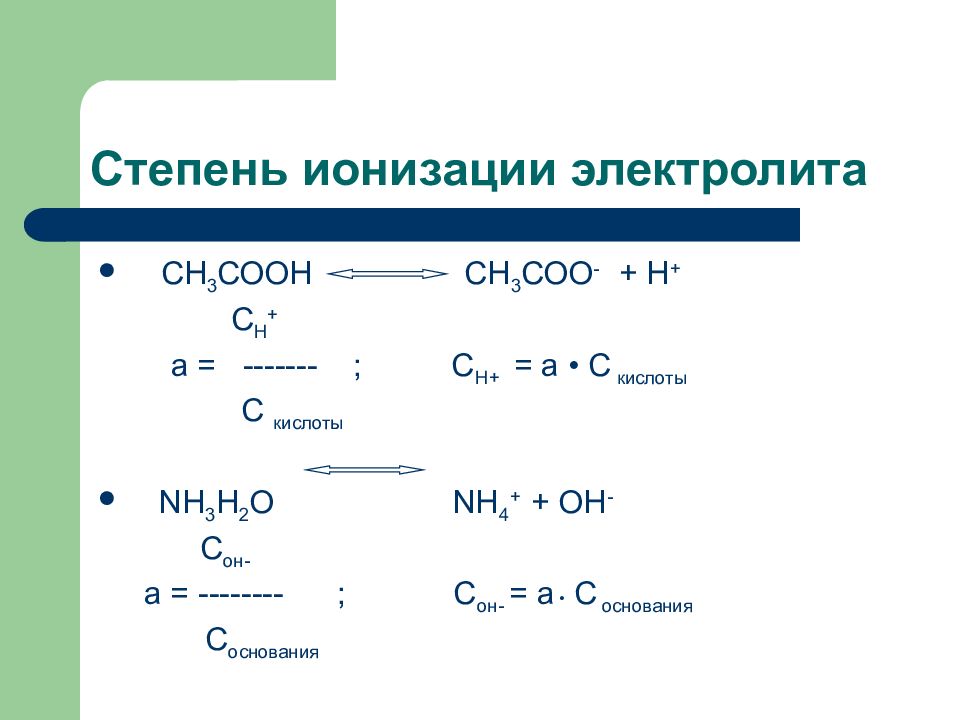
Слайд 118: Степень ионизации электролита
СН 3 СООН СН 3 СОО - + Н + С Н + а = ------- ; С Н+ = а • С кислоты С кислоты NH 3 H 2 O NH 4 + + OH - С он- а = -------- ; С он- = а • С основания С основания
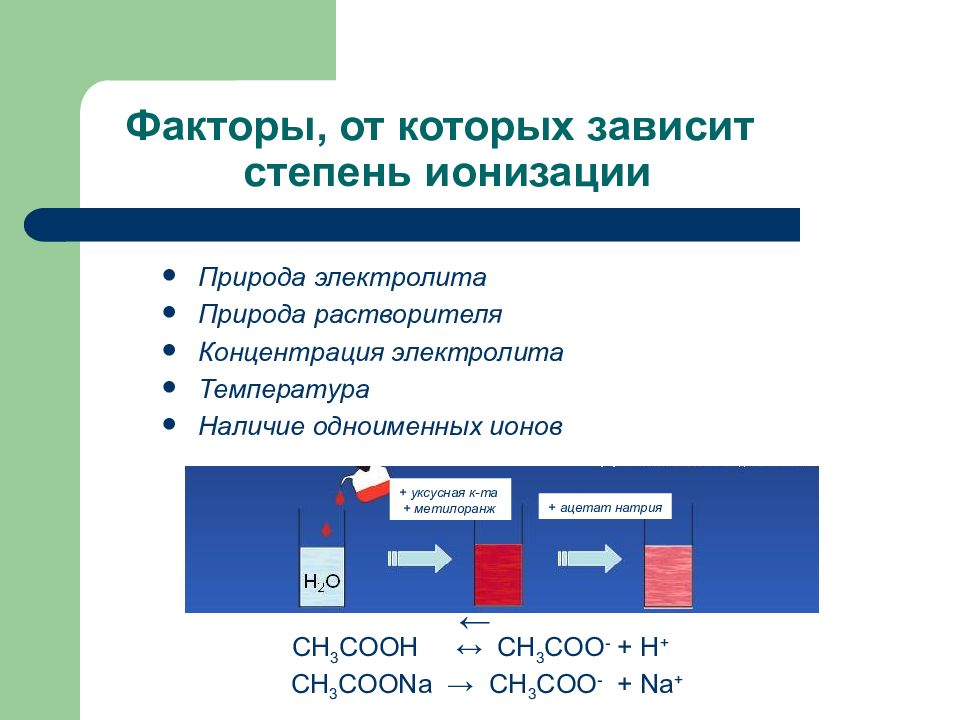
Слайд 119: Факторы, от которых зависит степень ионизации
Природа электролита Природа растворителя Концентрация электролита Температура Наличие одноименных ионов СН 3 СООН ↔ СН 3 СОО - + Н + СН 3 СОО Na → CH 3 COO - + Na + ← + уксусная к-та + метилоранж + ацетат натрия
Слайд 120: Закон разведения Оствальда
Немецкий химик Фридрих Вильгельм Оствальд 1853 -1932 КА ↔ К + + А - Константа ионизации электролита зависит от природы электролита и растворителя, а также от температуры.
Слайд 121: Теория растворов сильных электролитов
Ионная сила раствора – величина, характеризую- щая интенсивность электростатического поля всех ионов: Понятие ионной силы введено американским физико- -химиком Гилбертом Льюисом в 1907 году Ионная сила плазмы крови I = 0,15
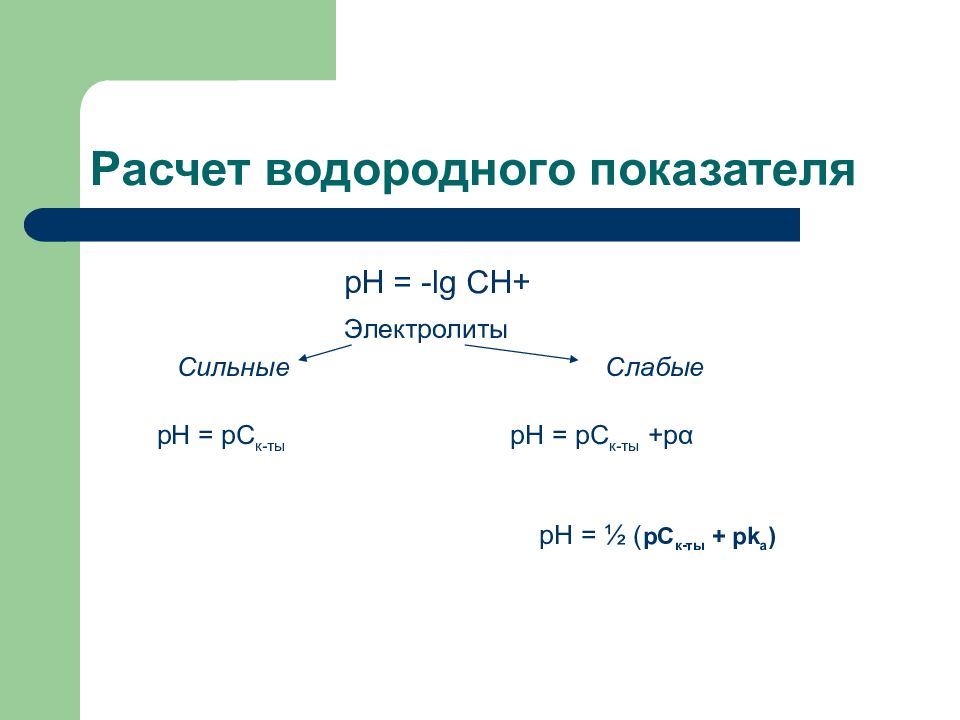
Слайд 122: Расчет водородного показателя
рН = - lg C Н+ Электролиты Сильные Слабые pH = pC к-ты pH = pC к-ты +р α рН = ½ ( pC к-ты + р k a )
Слайд 123: Шкала показателей водных сред
С Н + 10 0 10 -3 10 -7 10 -11 10 -14 С ОН - 10 -14 10 -11 10 -7 10 -4 10 0 рН 0 3 7 11 14 рОН 14 11 7 3 0 Среда Кислая Кислая Нейтраль- ная Щелочная Щелочная 25 0 С
Слайд 124: Расчет осмотического давления
Для растворов электролитов: i = 1 + a(n-1) R= 8.31 Дж / моль •К [ П ] кПа R = 0.082 л•атм / моль•К [ П ] атм
Слайд 125: Осмотическое давление биологических жидкостей
Плазма крови 7,40 атм Цельная кровь 7,63 атм Спинно-мозговая жидкость 6,86 атм Слезная жидкость 10,80 атм
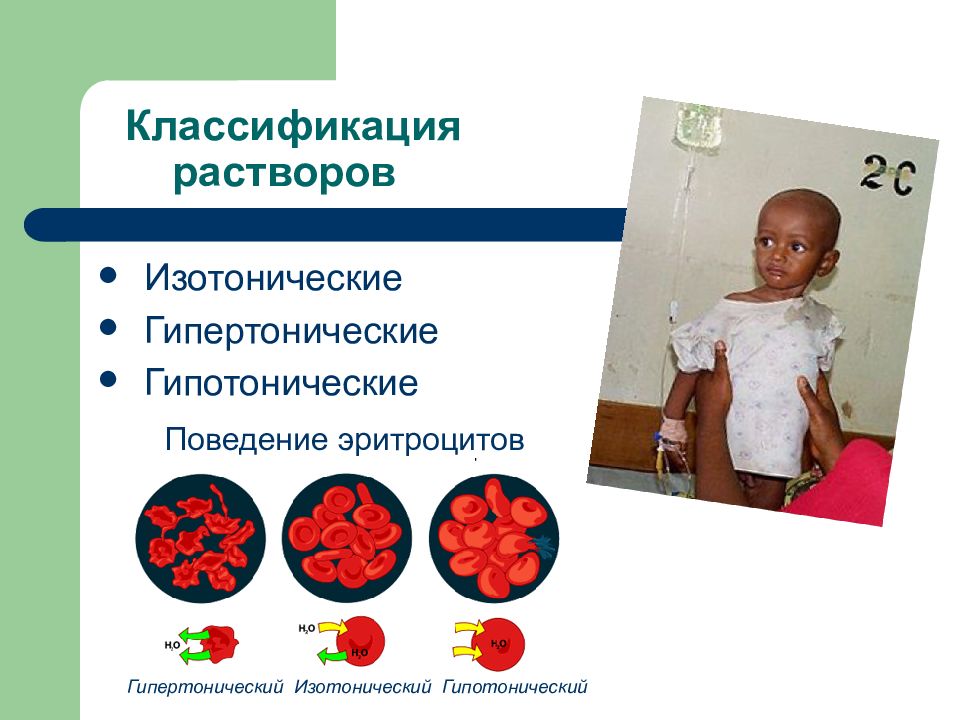
Слайд 126: Классификация растворов
Изотонические Гипертонические Гипотонические Гипертонический Изотонический Гипотонический Поведение эритроцитов
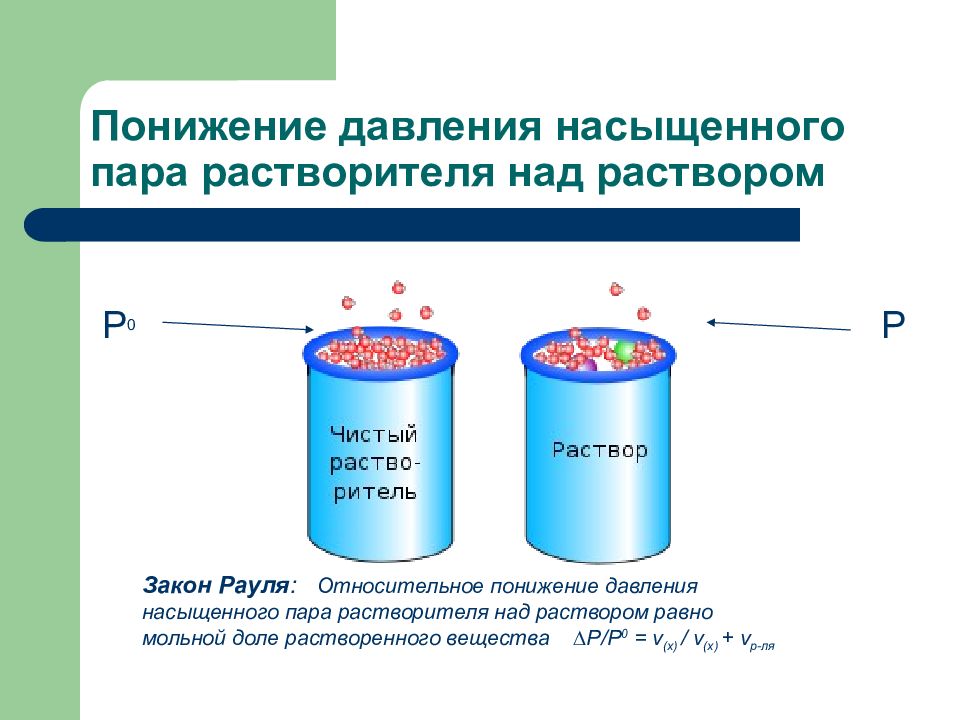
Слайд 127: Понижение давления насыщенного пара растворителя над раствором
Закон Рауля : Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества ∆Р / Р 0 = ν (х) / ν ( х) + ν р-ля Р 0 P
Слайд 128: ДЕ 7. Окислительно-восстановительные реакции
Окислитель + Восстановитель Восстановленная + Окисленная форма ок-ля форма восс-ля
Слайд 130: Примеры окислителей
Атомы или молекулы сильно электроотрицательных элементов : F 2 O 2 Cl 2 N 2 S Сложные анионы, содержащие элемент в высшей положительной степени окисления: MnO 4 - NO 3 - SO 4 2- ClO 4 - CrO 4 2- Cr 2 O 7 2- • Простые катионы с высокими зарядами: Fe 3+ Cu 2+ Sn 4+ Pb 4+ Hg 2+
Слайд 131: Примеры восстановителей
Атомы электроположительных элементов (атомы щелочных и щелочно-земельных металлов) Na Li K Ba Ca Sr Простые отрицательно заряженные ионы: Cl - S 2- Br - J - Простые катионы с низкими зарядами: Fe 2+ Cu + Sn 2+ Pb 2+ Hg + Водород, гидриды ( Н - ),углерод, оксид углерода (+2)
Слайд 132: Примеры веществ с двойственными свойствами
S 2- SO 3 2- SO 4 2- -2 +4 +6 NH 4 NO 2 - NO 3 - -3 +3 +5 +6 е - 2е +6 e - 2 e
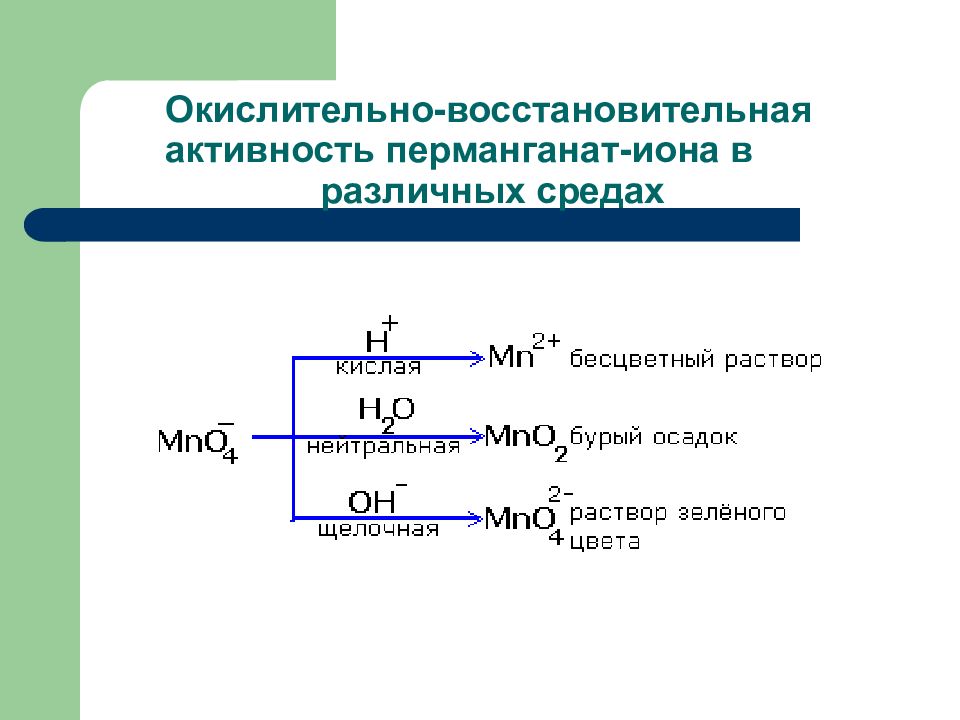
Слайд 133: Окислительно-восстановительная активность перманганат-иона в различных средах
Слайд 134: Виды коррозии по механизму
Химическая коррозия Электрохимическая коррозия Биологическая коррозия
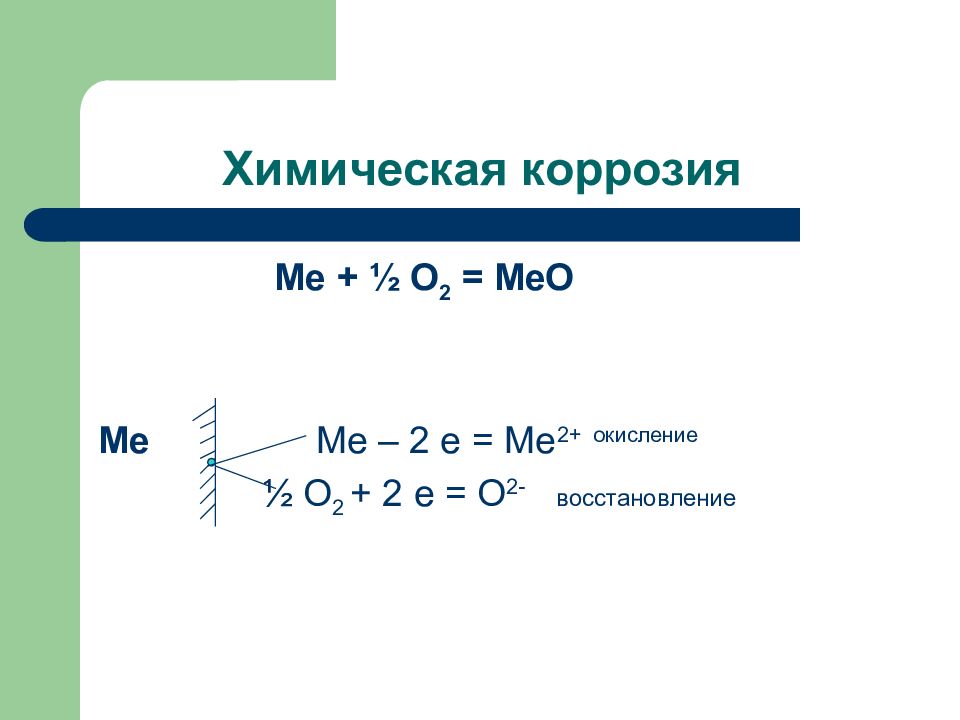
Слайд 135: Химическая коррозия
Ме + ½ О 2 = МеО Ме Ме – 2 е = Ме 2+ окисление ½ О 2 + 2 е = О 2- восстановление
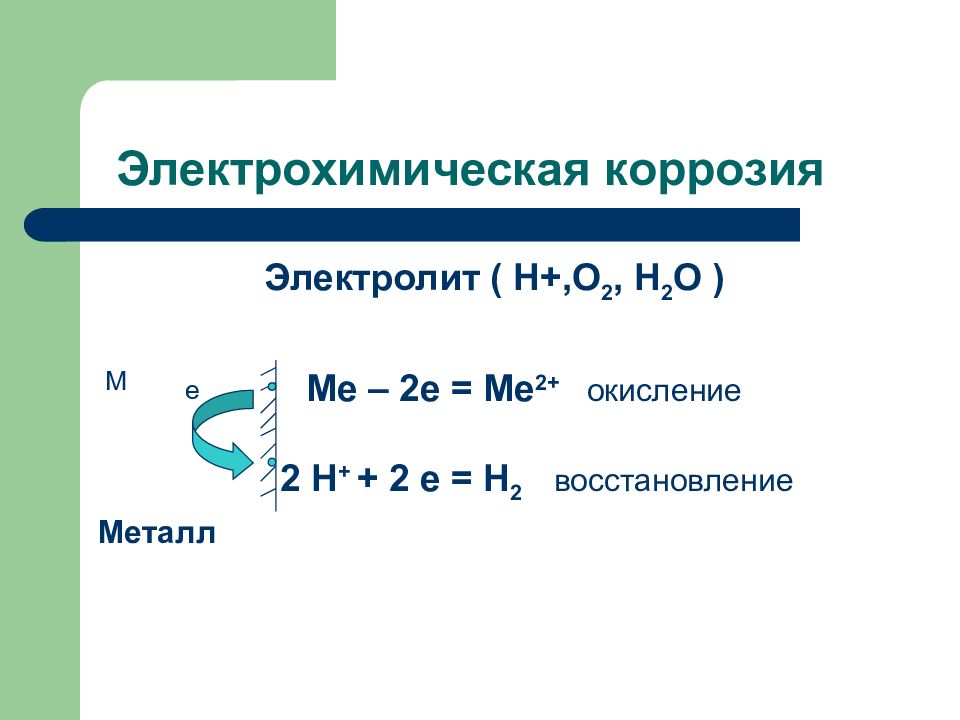
Слайд 136: Электрохимическая коррозия
Электролит ( Н+,О 2, Н 2 О ) Ме – 2е = Ме 2+ окисление 2 Н + + 2 е = Н 2 восстановление Металл М е
Слайд 137: Уравнения возможных катодных процессов в полости рта
2 Н 2 О + 2 е = Н 2 + 2 ОН - (1) водородная 2 Н + + 2 е = Н 2 (2) деполяризация О 2 + 2 Н 2 О + 4 е = 4 ОН - (3) кислородная О 2 + 4 Н + + 4 е = 2 Н 2 О (4) деполяризация
Слайд 138: Схема возникающего гальванического элемента
(-) Fe Fe 2+ H +, O 2, H 2 O Cu (+) Анод Катод Условие работы гальванического элемента: Е + (катода) > Е - (анода)
Слайд 139: Потенциалы процессов ( 298 К )
Потенциал водородной деполяризации: Е 2Н+ / Н 2 = - 0,059 рН – 0,0295 lg P H 2 Потенциал кислородной деполяризации: Е О 2 / 2ОН- = 1,23 - 0,059 рН + 0,0147 lgP O 2
Слайд 140: Стадии процесса коррозии
Анодное окисление металла Катодное восстановление окислителя Движение электронов в металле Движение ионов в среде электролита
Слайд 141: Скорость коррозии
Кислородная деполяризация Растворимость кислорода в воде при 25 0 С и Р О2 = 21 кПа составляет 2,6 •10 -7 моль / мл Водородная деполяризация Катализируют процесс металлы: Pt, Ni, C о Не катализируют процесс: Hg, Pb, Cd, Zn, Sn
Слайд 142: Правило фаз Гиббса
Американский . физик-теоретик Дж.Уиллард Гиббс 1839-1903 C + Ф = К + n или: С = К + n - Ф С – число степеней свободы; К – число компонентов; Ф – число фаз n – число внешних факторов, влияющих на систему
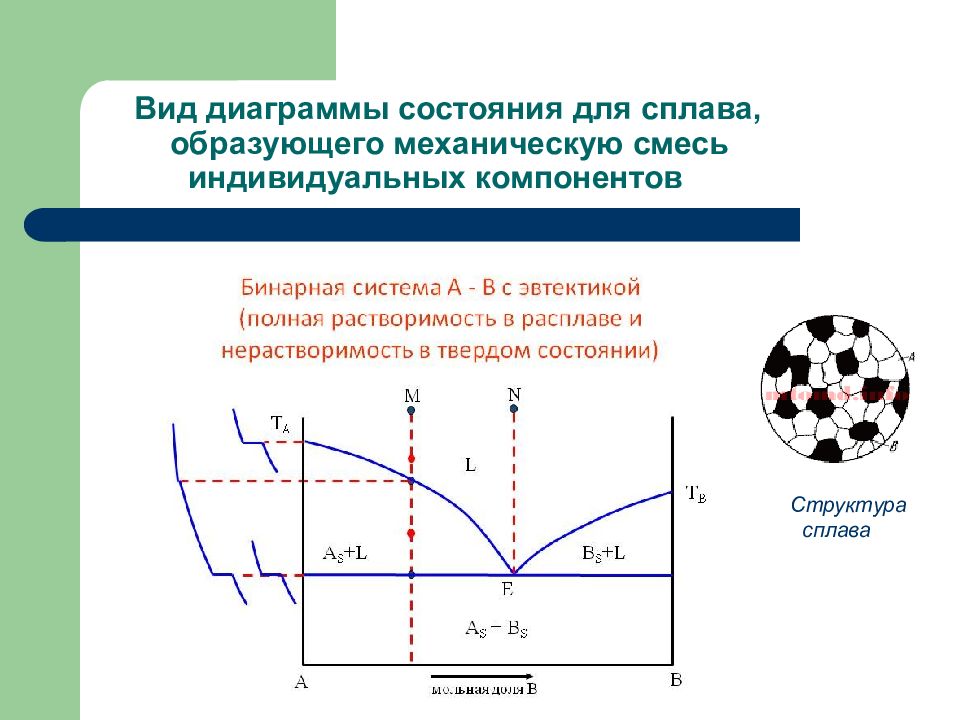
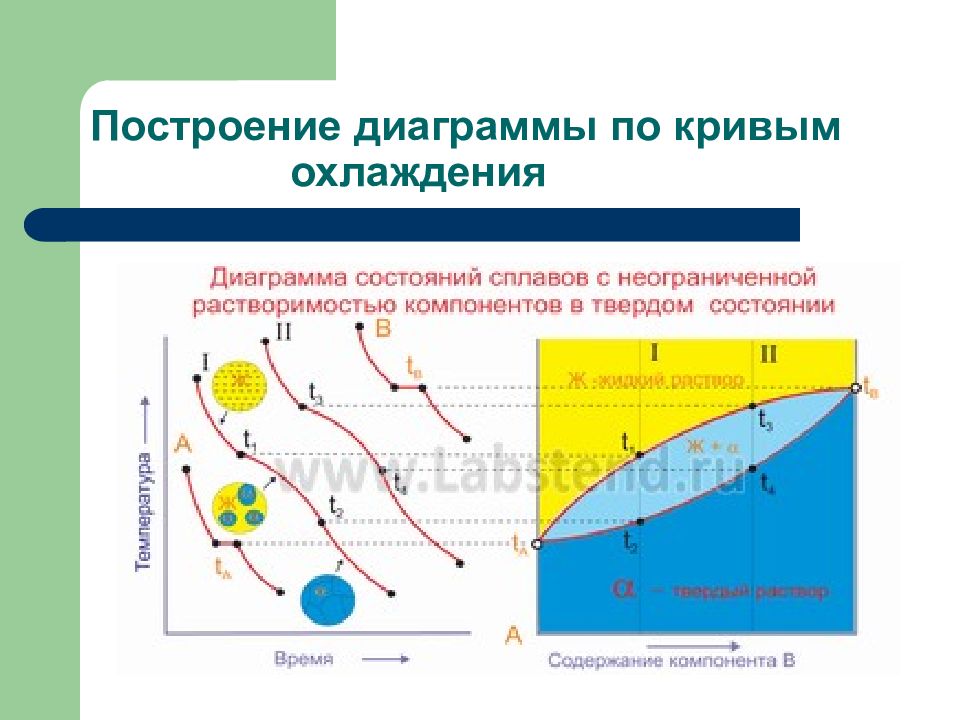
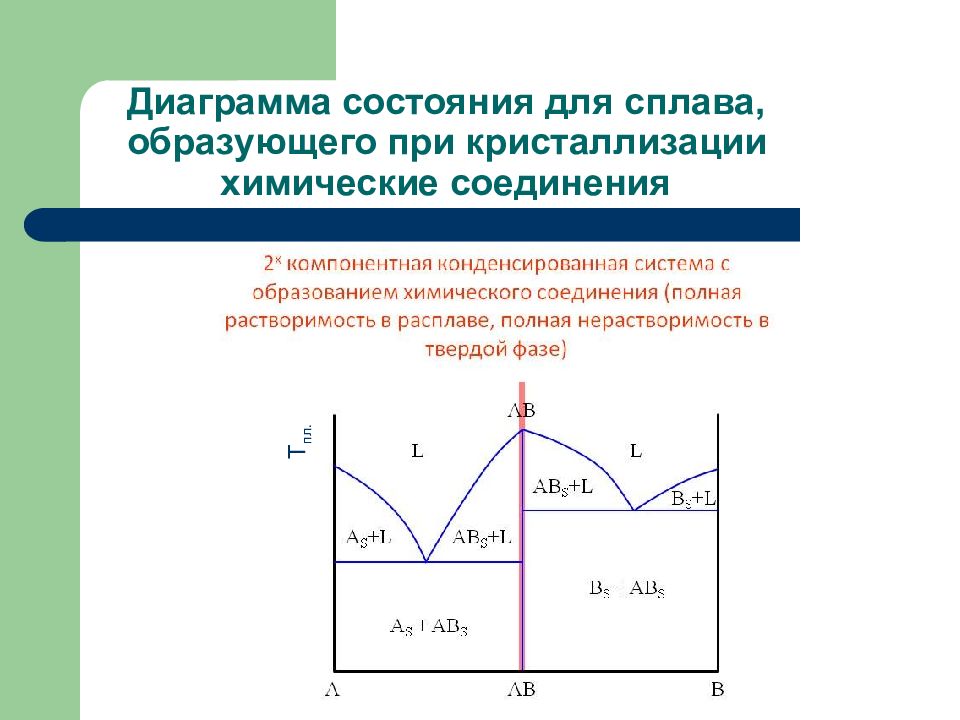
Слайд 143: Виды диаграмм состояния
1. Диаграммы состояния для сплавов, образующих механическую смесь индивидуальных компонентов при кристаллизации. 2. Диаграммы состояния для сплавов с неограниченной растворимостью в твердом состоянии 3. Диаграммы состояния для сплавов, образующих химические соединения при кристаллизации
Слайд 144: Вид диаграммы состояния для сплава, образующего механическую смесь индивидуальных компонентов
Состав сплава, % Е I II IIl lV V Структура сплава