Слайд 2: Аммиакаты
Аммиак благодаря неподеленной паре электронов образует огромное количество комплексных соединений с ионами металлов – так называемых амминокомплексов ( амминов ) или аммиакатов. В отличие от органических аминов, в этих комплексах с атомом азота всегда связаны три атома водорода. NН 3 в роли лиганда называют «амин»; она связана с центральным атомом металла через атом N. Различают аммины анионного типа (напр., K[PtCl 3 (NH 3 )]), катионного (напр., [Pt(NH 3 ) 4 ]Cl 2 ) и комплексы-неэлектролиты (напр., [PtCl 2 (NH 3 ) 2 ]). В зависимости от числа молекул координированного NH 3 аммины часто подразделяют на моно-, ди -, три-, тетр -, пент - и гексаммины. Аммиакаты различаются как по составу, так и по устойчивости в водных растворах, используются в аналитической химии для обнаружения и разделения ионов металлов.
Слайд 3: Аммиакаты
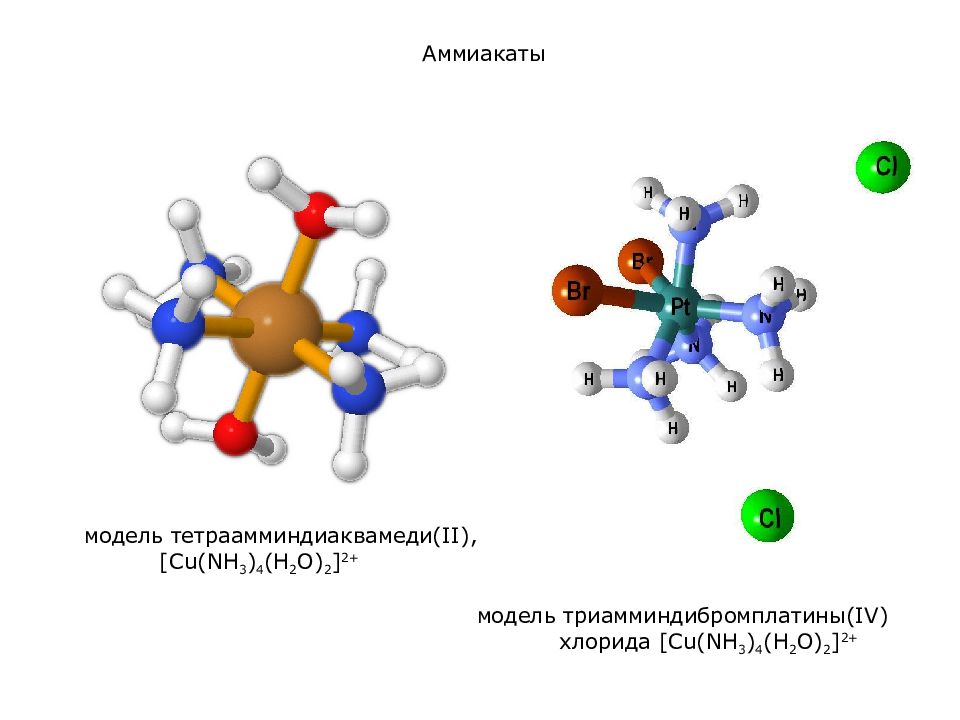
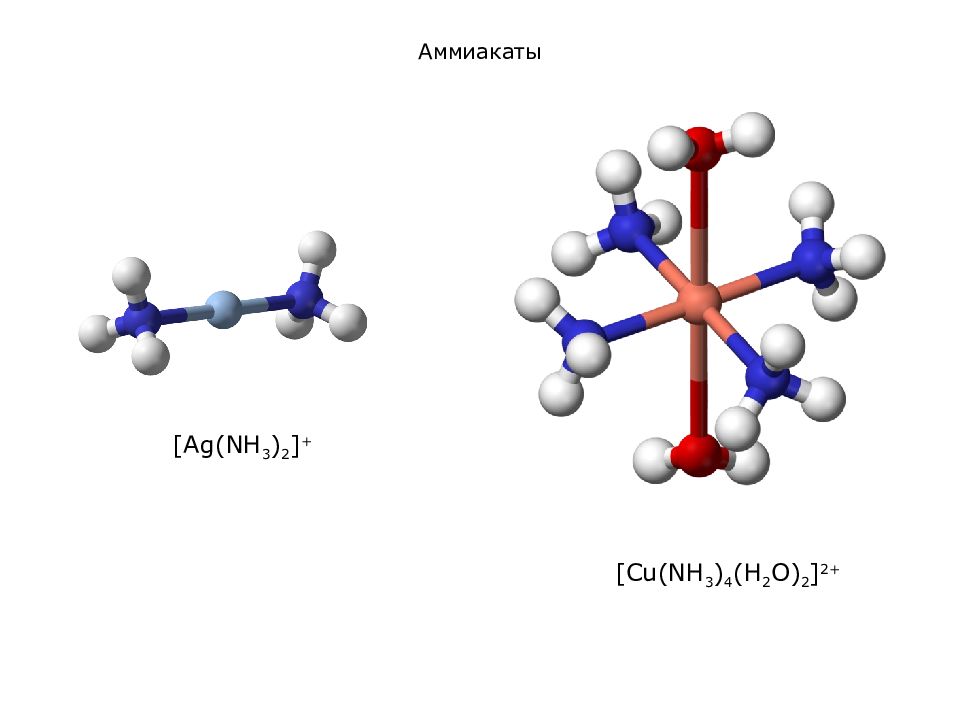
модель тетраамминдиаквамеди (II), [ Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ модель триамминдибромплатины (I V ) хлорида [ Cu (NH 3 ) 4 (H 2 O) 2 ] 2+
Слайд 5: Аммиакаты
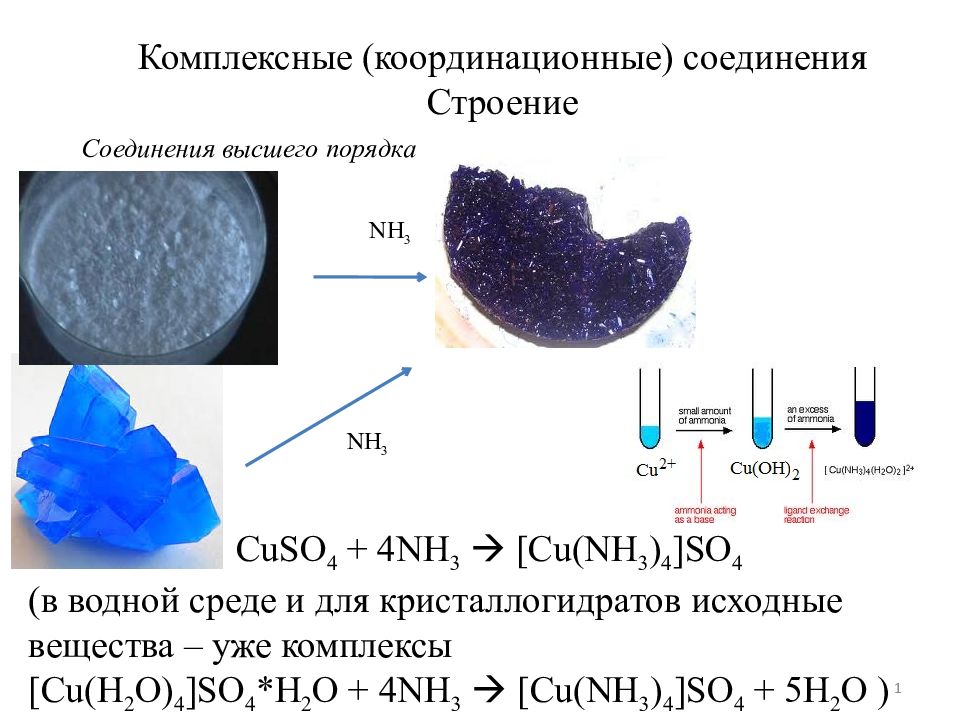
Получение Получают аммиакаты либо взаимодействием солей с NH 3 в водном растворе, либо действием газообразного или жидкого NH 3 на твердые соли. Например, аммиачный комплекс меди образуется в результате реакции: Cu 2+ + 4NН 3 [ Cu (NH 3 ) 4 ] 2+ Как и в случае воды, комплексообразование с аммиаком часто сопровождается изменением окраски вещества. Белый порошок сульфата меди при растворении в воде дает голубой раствор медного купороса в результате образования аквакомплекса [ Cu (H 2 O) 6 ] 2+. При добавлении аммиака сначала осаждаются основные соли переменного состава зеленого цвета, легкорастворимые в избытке реагента, затем этот раствор окрашивается в интенсивный сине-фиолетовый цвет, принадлежащий амминокомплексу [ Cu (NH 3 ) 4 (H 2 O) 2 ] 2+.
Слайд 6: Аммиакаты
Получение При получении аммиаката серебра вначале осаждается буры оксид серебра ( І ), который растворяется в избытке реагента, образуя бесцветный прозрачный раствор: 2AgNO 3 + 2(NH 3 H 2 O) [ разб.] = Ag 2 O + 2NH 4 NO 3 + H 2 O, AgNO 3 + 2(NH 3 H 2 O) [ конц.] = [Ag(NH 3 ) 2 ]NO 3 + 2H 2 O. Аналогично безводный хлорид никеля(II) имеет золотисто-желтый цвет, кристаллогидрат [Ni(H 2 O) 6 ]Cl 2 – зеленый, а аммиакат [Ni(NH 3 ) 6 ]Cl 2 – светло-голубой. NiCl 2 + 6 NH 3 [ Ni ( NH 3 ) 6 ]Cl 2
Слайд 7: Аммиакаты
Химические свойства Растворы аммиакатов довольно устойчивы, за исключением аммиаката кобальта (II) желто-бурого цвета, который постепенно окисляется кислородом воздуха в аммиакат кобальта (III) вишнево-красного цвета. В присутствии окислителей эта реакция протекает мгновенно. Образование и разрушение комплексного иона объясняется смещением равновесия его диссоциации. В соответствии с принципом Ле Шателье равновесие в растворе аммиачного комплекса серебра смещается в сторону образования комплекса (влево) при увеличении концентрации Ag + и/или NH 3. При уменьшении концентрации этих частиц в растворе равновесие смещается вправо, и комплексный ион разрушается. Это может быть обусловлено связыванием центрального иона или лигандов в какие-либо соединения, более прочные, чем комплекс.
Слайд 8: Аммиакаты
Химические свойства Например, при добавлении азотной кислоты к раствору [ Ag (NH 3 ) 2 ] Cl происходит разрушение комплекса вследствие образования ионов NH 4 +, в которых аммиак связан с ионом водорода более прочно: [ Ag (NH 3 ) 2 ] + + 2Н + Ag + + 2NH 4 +, [ Ag ( NH 3 ) 2 ] OH + 3 HNO 3 ( разб.) = AgNO 3 + 2NH 4 NO 3 + H 2 O. [Ag(NH 3 ) 2 ]OH + 3 НС l ( разб.) = AgCl + 2 NH 4 Cl + Н 2 О, [ Ag ( NH 3 ) 2 ] OH + KI ( разб.) + 2H 2 O = AgI + K ОН + 2(NH 3 · H 2 O ). Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулу аммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда ), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка: [Ni(NH 3 ) 6 ]Cl 2 = NiCl 2 + 6NH 3 ( г ) [Cu(NH 3 ) 4 ]SO 4 + 6Br 2 = CuSO 4 + 12HBr + 2N 2 ( г ) [Ni(NH 3 ) 6 ]SO 4 + 3H 2 SO 4 = NiSO 4 + 3(NH 4 ) 2 SO 4 [Cu(NH 3 ) 4 ](OH) 2 + Na 2 S + 4H 2 O = CuS + 2NaOH + 4NH 3 · H 2 O
Слайд 11: Аммиакаты
Если к раствору солей меди добавить аммиак, сначала выпадет голубой гидроксид меди, который растворится в избытке аммиака с образованием интенсивно-синего аммиаката меди
Слайд 12: Аммиакаты
Химические свойства Аммиакат меди можно разрушить как кислотой, так и щелочью: [Cu(NH 3 ) 4 ]SO 4 + 2H 2 SO 4 ( разб ) = CuSO 4 + 2(NH 4 ) 2 SO 4. [Cu(NH 3 ) 4 ]SO 4 + 2NaOH(20%- й, гор.) = Cu ( OH ) 2 + Na 2 SO 4 + 4 NH 3 . Аммиакаты растворимы в воде: [Cu(NH 3 ) 4 ]SO 4 ( разб.) + 2H 2 O = [Cu(H 2 O) 2 (NH 3 ) 4 ] 2+ + SO 4 2− ( в разб. NH 3 · H 2 O ) [ Ag ( NH 3 ) 2 ] OH ( разб.) = [ Ag ( NH 3 ) 2 ] + + ОН При нагревании или со временем аммиакаты также разрушаются: [ Cu ( NH 3 ) 4 ] SO 4 Н 2 О = CuSO 4 + 4 NH 3 + Н 2 О ( 280 – 300°С ). 3[ Ag ( NH 3 ) 2 ] OH ( конц.) + 2 H 2 O –( ) Ag 3 N + 5( NH 3 · H 2 O ). В аммиакатах возможен внутрисферный обмен молекул аммиака на молекулы воды [ Cu ( H 2 O ) 2 ( NH 3 ) 4 ] 2+ + NH 3 H 2 O ⇄ [ Cu ( H 2 O )( NH 3 ) 5 ] 2+ + 2 H 2 O (на холоду) [Cu(H 2 O) 2 (NH 3 ) 4 ] 2+ + 2H 2 O = [Cu(H 2 O) 4 ] 2+ + 4NH 3 ( 80 – 100°C )
Слайд 13: Аммиакаты
Химические свойства РЕАКТИВТОЛЛЕНСА – щелочной раствор [ Ag (NH 3 ) 2 ]ОН. При взаимодействии с восстановителями образует серебро в виде черного осадка или блестящего «зеркала» на стенках реакционного сосуда (иногда при небольшом нагревании) – реакция серебряного зеркала. Применяется для обнаружения альдегидов, восстанавливающих сахаров, полигидроксифенолов, - дикетонов, гидроксикарбоновых кислот, первичных кетоспиртов, аминофенолов, алкил- и арилгидроксиламинов, арил - и алкилгидразинов. Толленса реактив готовят непосредственно перед употреблением из растворов AgNO 3, NaOH и NH 3 · H 2 O. Предложен Бернхардом Толленсом в 1881 г. 2[ Ag ( NH 3 ) 2 ] OH + HC ( H ) O + 2 H 2 O = 2 Ag + NH 4 ( HCOO ) + 3( NH 3 · H 2 O )
Слайд 15: Аммиакаты
Многие аммиакаты были получены в период становления химии и получали тривиальные названия: либо по фамилии открывателя, либо по окраске: Первое основание Рейзе [ Pt ( NH 3 ) 4 ]( OH ) 2 Соль Чугаева [ PtCl ( NH 3 ) 5 ] Cl 3 Виолеосоли цис -[ Co (NH 3 ) 4 Cl 2 ]Х Лутеосоли [ Co (NH 3 ) 6 ]Х 3 Розеосоли [ Co ( NH 3 ) 5 ( H 2 O )]Х 3 Пурпуреосоли [ CoCl ( NH 3 ) 5 ]Х 2 Кроцеосоли транс -[ Co ( NO 2 ) 2 ( NH 3 ) 4 ]Х Празеосоли транс -[ Co (NH 3 ) 4 Cl 2 ]Х Флавосоли цис -[ Co ( NO 2 ) 2 ( NH 3 ) 4 ]Х Соль Рейнеке NH 4 [ Cr ( SCN ) 4 ( NH 3 ) 2 ] Соль Пейроне цис -[ Pt ( NH 3 ) 2 Cl 2 ] Соль Рейзе транс -[ Pt ( NH 3 ) 2 Cl 2 ] Соль Жерара транс -[Pt(NH 3 ) 2 Cl 4 ] Соль Клеве цис -[Pt(NH 3 ) 2 Cl 4 ] Соль Вокелена [Pd(NH 3 ) 4 ][PdCl 4 ] Соль Эрдмана транс - NH 4 [ Co ( NH 3 ) 2 ( NO 2 ) 4 ]
Слайд 16: Аммиакаты
Многие аммиакаты были получены в период становления химии и получали тривиальные названия: либо по фамилии открывателя, либо по окраске: Соль Алена [ Ru ( NH 3 ) 5 N 2 ] Cl 2 Соль Бломстранда [ Pt ( NH 3 ) 2 ( NO 2 ) 2 Cl 2 ] Соль Гиббса [Co(NO 2 ) 3 (NH 3 ) 3 ] Первая соль Косса K [ Pt ( NH 3 ) Cl 3 ] Вторая соль Косса K [ Pt ( NH 3 ) Cl 5 ] Фиолетовая соль Миллона [ PtCl 4 ][ Cu ( NH 3 ) 4 ] Зеленая соль Бектона [ Pt ( NH 3 ) 4 ][ CuCl 4 ] Зеленая соль Магнуса [ Pt ( NH 3 ) 4 ][ PtCl 4 ] Розовая соль Магнуса [ Pt ( NH 3 ) 3 Cl ] 2 [ PtCl 4 ] Соль Морланда C 4 N 3 H 6 [ Cr ( NH 3 ) 2 ( SCN ) 4 ]
Слайд 17: Аммиакаты
Многие амминокомплексы достаточно устойчивы и могут быть получены в твердом состоянии. Твердый комплекс аммиака с хлоридом серебра был использован Майклом Фарадеем для сжижения аммиака. Фарадей нагревал комплексную соль в одном колене запаянной стеклянной трубки, а в другом колене, помещенном в охлаждающую смесь, собирался под давлением жидкий аммиак. Необычными свойствами обладает аммиачный комплекс тиоцианата (роданида) аммония. Если сухую соль NH 4 NCS, охлажденную до 0°C, поместить в атмосферу аммиака, то соль «растает» и превратится в жидкость, содержащую 45% аммиака по массе. Эту жидкость можно хранить в склянке с притертой пробкой и использовать в качестве своеобразного «склада» аммиака.
Слайд 18: Аммиакаты
Опыт. Окисление аммиаката меди (I ) [ Cu (NH 3 ) 2 ]OH воздухом В коническую колбу на 300 мл налейте на 2/3 объема воды. Растворите в ней примерно 0,5 г соли меди (II) – сульфата, ацетата или хлорида. Образуется голубой раствор. Небольшими порциями добавляйте к раствору концентрированный аммиак. Сначала будет образовываться голубой осадок гидроксида меди Cu (OH) 2, который растворится в избытке аммиака с образованием синего аммиачного комплекса меди (II): CuSO 4 + 2NH 3 + 2H 2 O = Cu(OH) 2 + (NH 4 ) 2 SO 4 Cu ( OH ) 2 + 4 NH 3 = [ Cu ( NH 3 ) 4 ]( OH ) 2 После полного растворения осадка прилейте к раствору еще немного аммиака.
Слайд 20: Аммиакаты
Теперь добавьте в колбу кусочки зачищенной медной проволоки или стружки, чтобы она полностью покрыла дно колбы. После этого долейте немного воды так, чтобы свободный объем в колбе был 20 – 30 мл и герметично закройте ее пробкой. Оставим колбу стоять в укромном месте, перемешивая ее содержимое по несколько раз в день (следите, чтобы при этом не открылась пробка). Постепенно синий раствор станет бледнеть и со временем обесцветится. Скорость этого процесса зависит от условий (температуры, количества соли меди, взятой для эксперимента, частоты перемешивания и др.). В нашем случае для полного обесцвечивания раствора понадобилось 2 – 3 недели. Химизм этого процесса довольно прост. При взаимодействии меди с аммиачным комплексом Cu (II) образуется бесцветный аммиачный комплекс одновалентной меди. В результате этого синяя окраска раствора исчезает: [ Cu (NH 3 ) 4 ](OH) 2 + Cu = 2[ Cu (NH 3 ) 2 ](OH)
Слайд 22: Аммиакаты
Теперь сам опыт. Поставьте колбу на белый фон, а рядом с ней – пустой стакан (или банку). Зрители наблюдают закрытую колбу с бесцветным раствором. Предложите всем желающим убедиться, что в стакане ничего нет. Теперь откройте колбу и медленно перелейте раствор в стакан. От контакта с воздухом бесцветная жидкость станет слегка синей. Если содержимое стакана перемешать или продуть через него воздух с помощью пипетки, окраска раствора будет усиливаться, пока раствор не станет интенсивно синим. Впрочем, жидкость станет синей и без посторонней помощи, просто этот процесс будет длиться дольше, поскольку для диффузии кислорода в раствор нужно время. Аммиачный комплекс одновалентной меди легко окисляется кислородом воздуха до синего аммиачного комплекса двухвалентной меди: 4[Cu(NH 3 ) 2 ](OH) + 2H 2 O + O 2 + 8NH 3 = 4[Cu(NH 3 ) 4 ](OH) 2