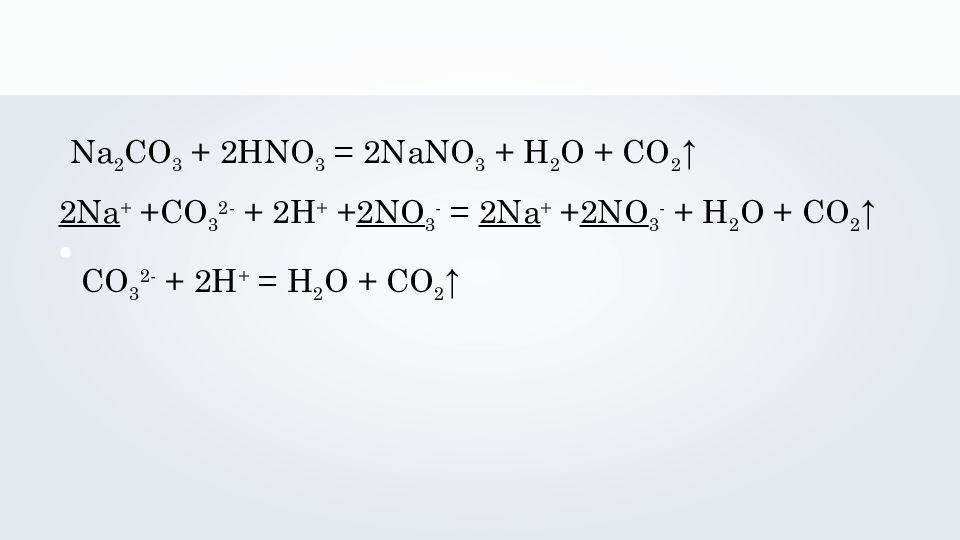Первый слайд презентации: Кислоты, их классификация и свойства
Слайд 2
Кислоты — это сложные вещества, молекулы которых состоят из ионов водорода и кислотного остатка.
Слайд 3: Среди предложенных формул укажите формулу кислоты
К 2 SO 3 KOH H 2 SO 3 NH 4 Cl
Слайд 5
Кислоты – электролиты, которые диссоциируют на ионы водорода и ионы кислотного остатка Сильные кислоты – в растворе находятся только в виде ионов: HNO 3 = H + + NO 3 - H 2 SO 4 = 2H + + SO 4 2- Слабые электролиты находятся в растворе как в виде ионов, так и недиссоциированных частиц H 2 CO 3 ↔ 2H + + CO 3 2-
Слайд 6: Нестабильные кислоты
Существуют только в водных растворах, легко разлагаются: Угольная кислота H 2 CO 3 = CO 2 ↑ + H 2 O Сернистая кислота H 2 SO 3 = SO 2 ↑ + H 2 O
Слайд 7: Укажите сильную, одноосновную, бескислородную кислоту
H 2 SO 4 H 2 S HNO 3 HCl
Слайд 8
Основные типы химических реакций 1. Взаимодействие кислот с основаниями. 2. Взаимодействие кислот с оксидами металлов. 3. Взаимодействие кислот с металлами. 4. Взаимодействие кислот с солями.
Слайд 9
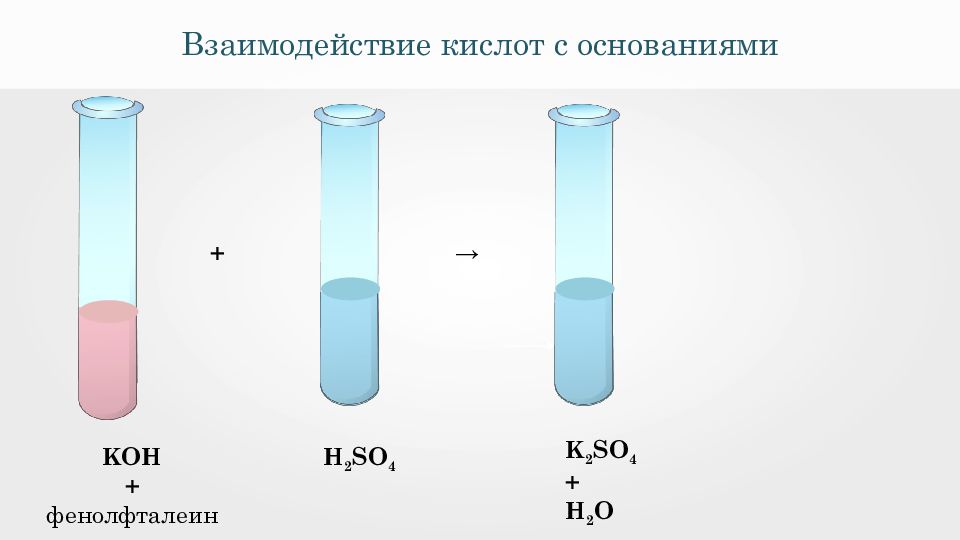
Взаимодействие кислот с основаниями H 2 SO 4 KOH + фенолфталеин → K 2 SO 4 + H 2 O +
Слайд 10
Взаимодействие кислот с основаниями Н 2 SO 4 + 2 KOH = K 2 SO 4 + 2 H 2 O 2H + + SO 4 2- + 2K + + 2OH - = 2K + + SO 4 2- + 2H 2 O 2H + + 2OH - = 2H 2 O H + + OH - = H 2 O
Слайд 11
Взаимодействия серной кислоты с гидроксидом калия Н 2 SO 4 + 2 KOH = K 2 SO 4 + 2 H 2 O Реакции нейтрализации — это реакции взаимодействия сильной кислоты со щелочью, в результате которых образуется малодиссоциирующее вещество вода.
Слайд 12
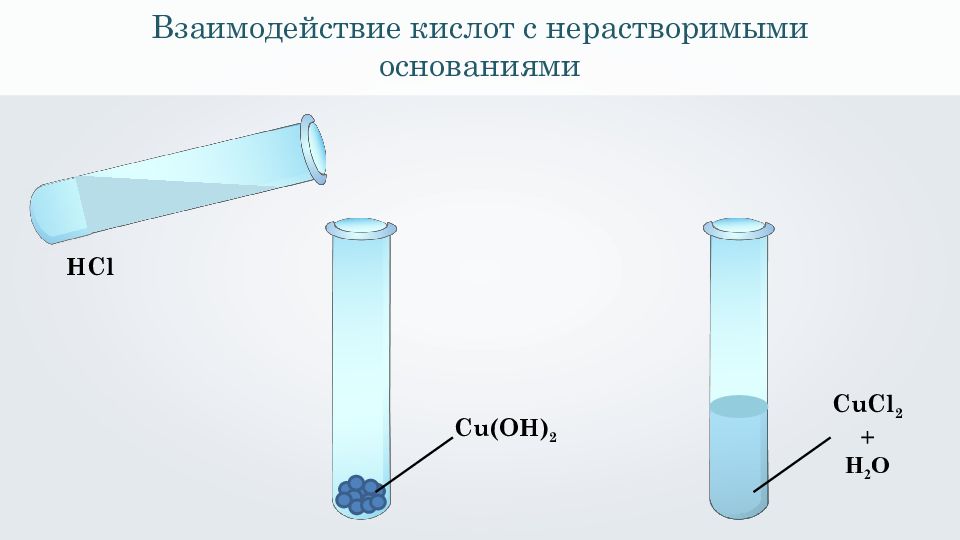
Взаимодействие кислот с нерастворимыми основаниями Cu ( OH ) 2 HCl CuCl 2 + H 2 O
Слайд 13
С u(OH) 2 ↓ + 2HCl = CuCl 2 + 2H 2 O С u(OH) 2 ↓ + 2H + + 2 Cl - = Cu 2+ + 2 Cl - + 2H 2 O С u(OH) 2 ↓ + 2H + = Cu 2+ + 2H 2 O Взаимодействие кислот с нерастворимыми основаниями
Слайд 14
H 2 SO 4 + CuO = CuSO 4 + H 2 O 2 H + CuO = Cu 2+ + H 2 O Взаимодействие кислот с оксидами металлов 2H + + SO 4 2- + CuO = Cu 2+ + SO 4 2- + H 2 O
Слайд 15
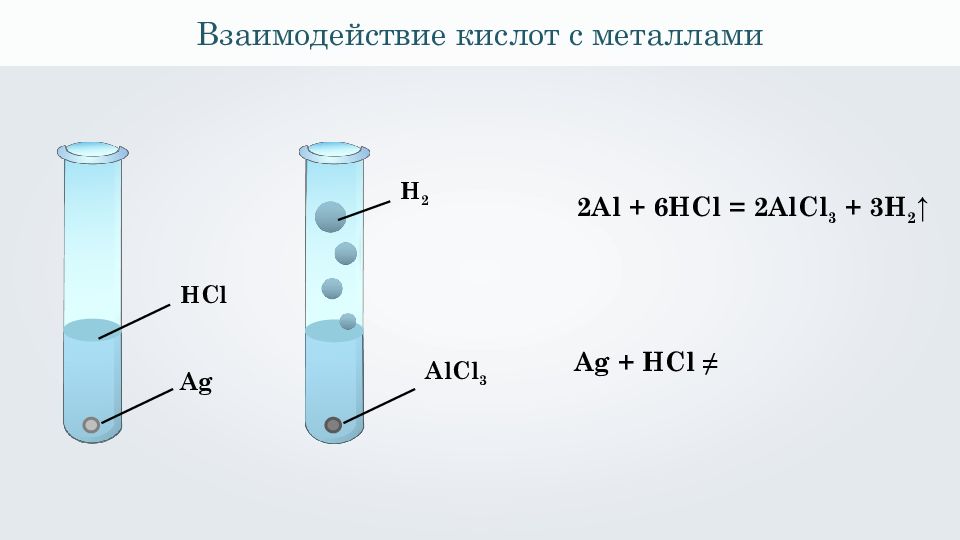
Взаимодействие кислот с металлами Ag AlCl 3 2 Al + 6 HCl = 2 AlCl 3 + 3 H 2 ↑ Ag + HCl ≠ HCl H 2
Слайд 16
Взаимодействие кислот с металлами Ряд напряжений металлов: K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H 2, Cu, Hg, Ag, Au
Слайд 17
Взаимодействие кислот с металлами Условия протекания этого типа реакций. 1. Металл, взаимодействующий с кислотой, должен находиться в ряду напряжений металлов левее водорода. Ряд напряжений металлов: K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H 2, Cu, Hg, Ag, Au
Слайд 18
Взаимодействие кислот с металлами Условия протекания этого типа реакций. 2. В результате реакции должна получиться растворимая соль, т. к. в случае образования нерастворимой соли сразу образуется нерастворимая пленка, и реакция полностью не идёт.
Слайд 19
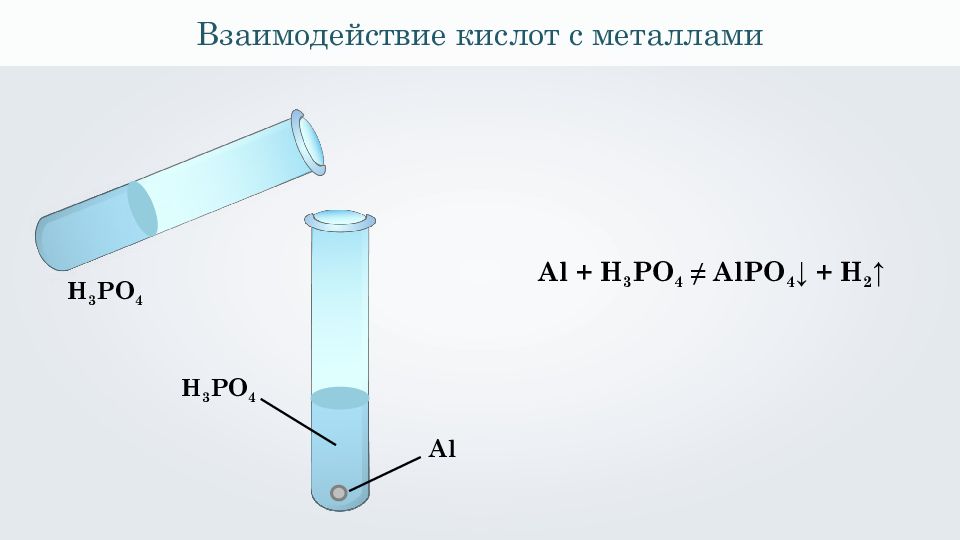
Взаимодействие кислот с металлами Al H 3 PO 4 Al + H 3 PO 4 ≠ AlPO 4 ↓ + H 2 ↑ H 3 PO 4
Слайд 20
Взаимодействие кислот с металлами Условия протекания этого типа реакций.
Слайд 21
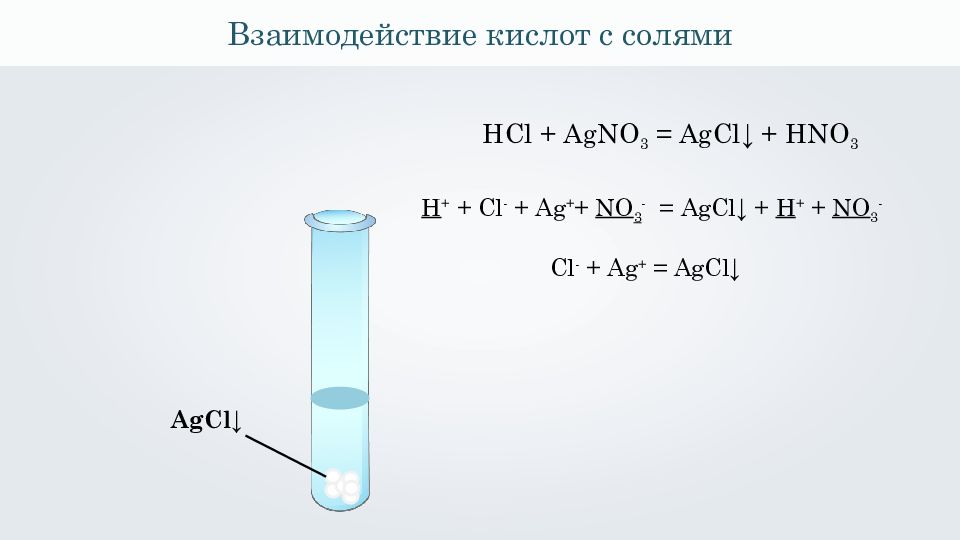
Взаимодействие кислот с солями HCl + AgNO 3 = AgCl ↓ + HNO 3 AgCl ↓ H + + Cl - + Ag + + NO 3 - = AgCl ↓ + H + + NO 3 - Cl - + Ag + = AgCl ↓
Слайд 22
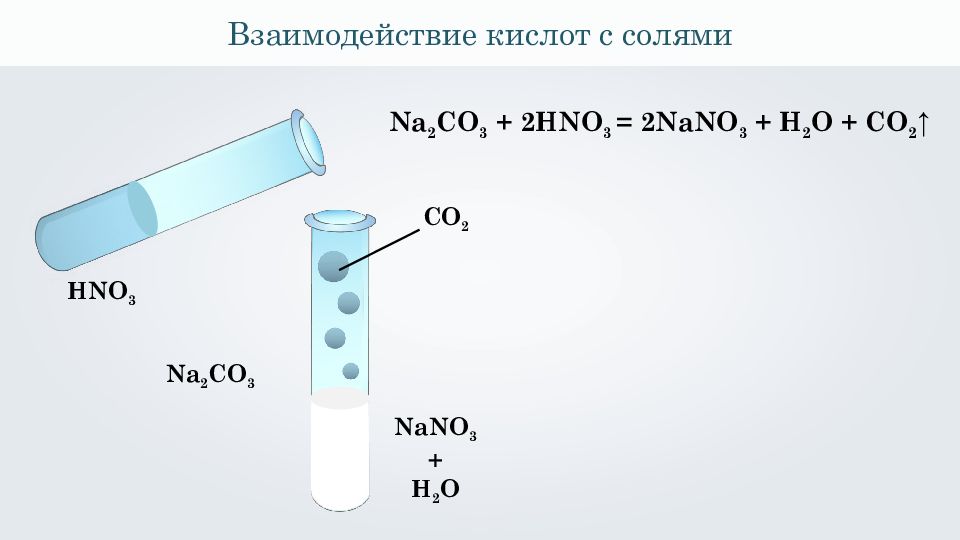
Взаимодействие кислот с солями Na 2 CO 3 HNO 3 NaNO 3 + H 2 O CO 2 Na 2 CO 3 + 2 HNO 3 = 2 NaNO 3 + H 2 O + CO 2 ↑
Слайд 23
Na 2 CO 3 + 2 HNO 3 = 2 NaNO 3 + H 2 O + CO 2 ↑ 2Na + +CO 3 2- + 2 H + + 2NO 3 - = 2 Na + + 2NO 3 - + H 2 O + CO 2 ↑ CO 3 2- + 2 H + = H 2 O + CO 2 ↑
Слайд 24
Кислоты взаимодействуют: с основаниями, металлами, стоящими в ряду активности до Н 2, оксидами металлов солями, если образуется осадок или газ.
Слайд 25
С какими из веществ реагирует раствор серной кислоты: 1) серебро 2) азотная кислота 3) гидроксид магния 4) оксид цинка 5) оксид углерода 6) цинк
Последний слайд презентации: Кислоты, их классификация и свойства
Задание 1.Прочитать п. 39 учебника 2.На обучающей платформе «ЯКласс», Раздел II Классы неорганических веществ, урок 6 «Кислоты» изучить теорию (задания выполнять не нужно) Ссылка https://www.yaklass.ru/p/himija/89-klass/klassy-neorganicheskikh-veshchestv-14371/kisloty-13840 3. 15 апреля с 16.00 до 17.00 выполнить проверочную работу «Кислоты» Ссылка на работу в дневнике дистанционного обучения 8а, 8б, 8г ссылка https://www.yaklass.ru/TestWork/Join/WwkPQ44TbUKfb0TXqNtaDg