Первый слайд презентации
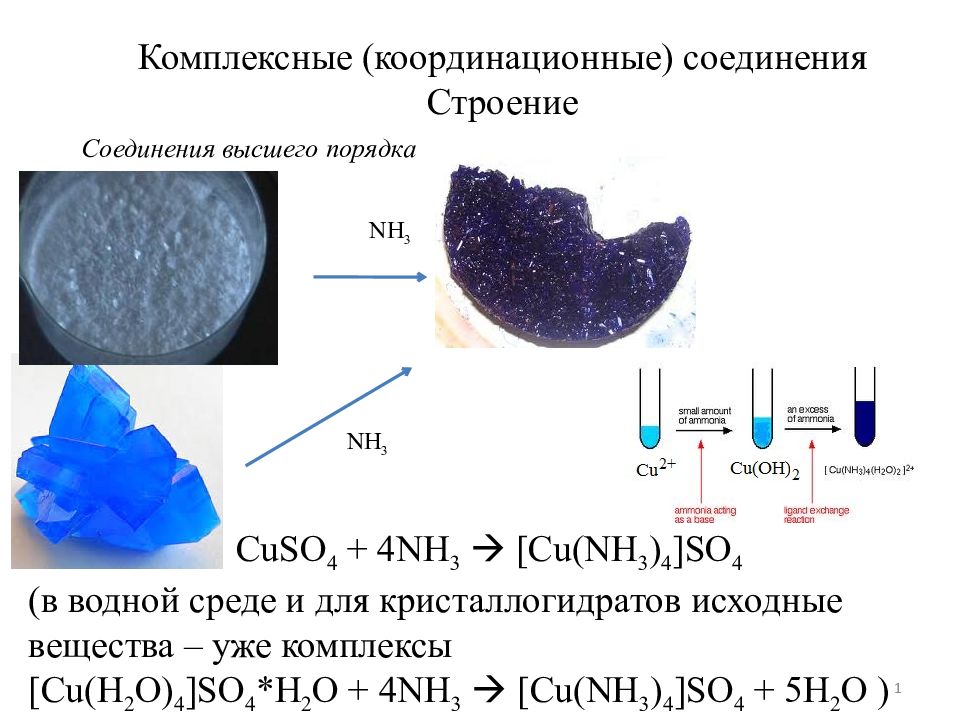
Комплексные (координационные) соединения Строение Соединения высшего порядка NH 3 CuSO 4 + 4NH 3 [Cu(NH 3 ) 4 ]SO 4 ( в водной среде и для кристаллогидратов исходные вещества – уже комплексы [Cu(H 2 O) 4 ]SO 4 *H 2 O + 4NH 3 [Cu(NH 3 ) 4 ]SO 4 + 5H 2 O ) NH 3 1
Слайд 2
2 [Co(NH 3 ) 6 ]Cl 3 ( ортофосфат тетрааквоуранила) K 3 [Fe(CN) 6 ] K 4 [Fe(CN) 6 ] [Fe(H 2 O) 6 ]SO 4 *H 2 O
Слайд 3
3 Литература •Басоло Ф., Джонсон Р. Химия координационных соединений. – М.: Мир, 1966. • Гринберг А.А. Введение в химию координационных соединений. М. – Л.: Химия, 1966. • Кукушкин Ю.Н. Химия координационных соединений. – М.: Высш. шк., 1985. •Костромина Н.А., Кумок В.Н., Скорик Н.А. Химия координационных соединений. М.: Высш. шк., 1990. •Скопенко В.В., Григорьева В.В. Координационная химия. Киев: Вища школа, 1987. •Кукушкин В.Ю., Кукушкин Ю.Н. Теория и практика синтеза координационных соединений. Л.: Наука, 1990. •Бек М., Надьпал И. Исследование комплексообразования новейшими методами: Пер. с англ. – М: Мир, 1989. •Березин Б.Д. Координационные соединения порфиринов и фталоцианина. – М: Наука, 1978. •Бальхаузен К., Введение в теорию поля лигандов, М.: Мир, 1964. •Берсукер И.Б., Электронное строение и свойства координационных соединений, Л.: Химия, 1986. •Ливер Э., Электронная спектроскопия неорганических соединений, М.: Мир, 1987, тт.1,2. •Свиридов Д.Т., Свиридова Р.К., Смирнов Ю.Ф., Оптические спектры ионов переходных металлов в кристаллах, М.: Наука, 1976. •Хартли Ф.,Беогес К., Олкок Р., Равновесия в растворах, М.: Мир, 1983. •Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н., Цивадзе А.Ю. Неорганическая химия. Кн. I., II. М. Химия. 2001. •Координационная химия редкоземельных элементов. Под ред. В.И. Спицына.М. МГУ. 1979. 252 С.
Слайд 4
“ соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома (акцептора электронов), окруженного лигандами (донорами электронов). Лиганды способны ступенчато и обратимо отщепляться от центрального иона по гетеролитическому типу. В большинстве случаев в молекулярном виде координационные соединения могут рассматриваться как состоящие из молекул, способных к самостоятельному существованию. ” ( Ю.Н. Кукушкин, 1985) Комплексные соединения это… 4
Слайд 5
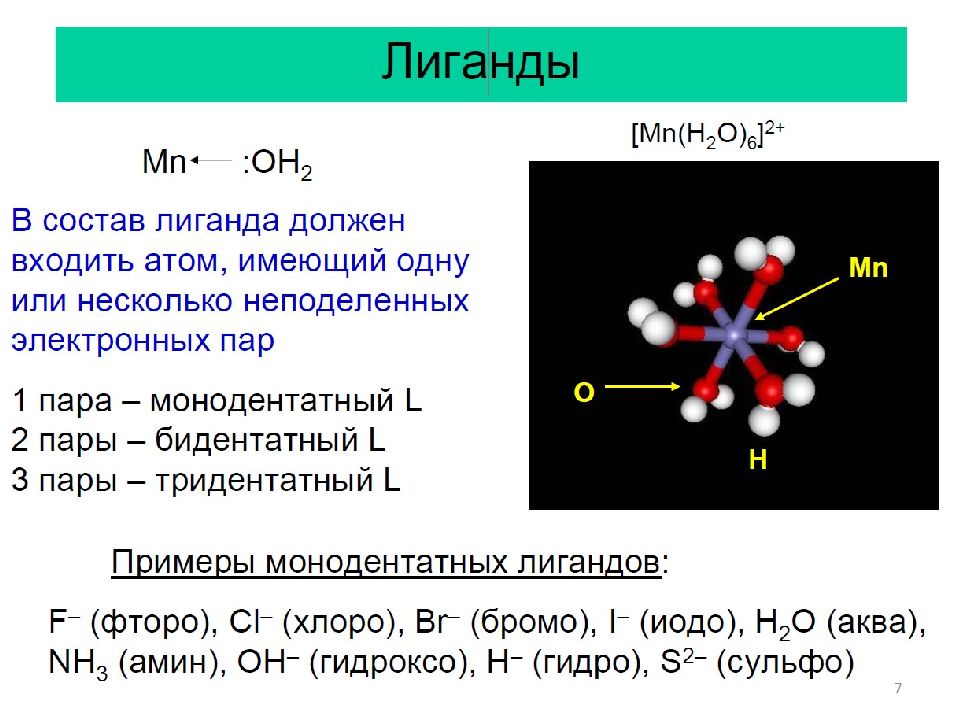
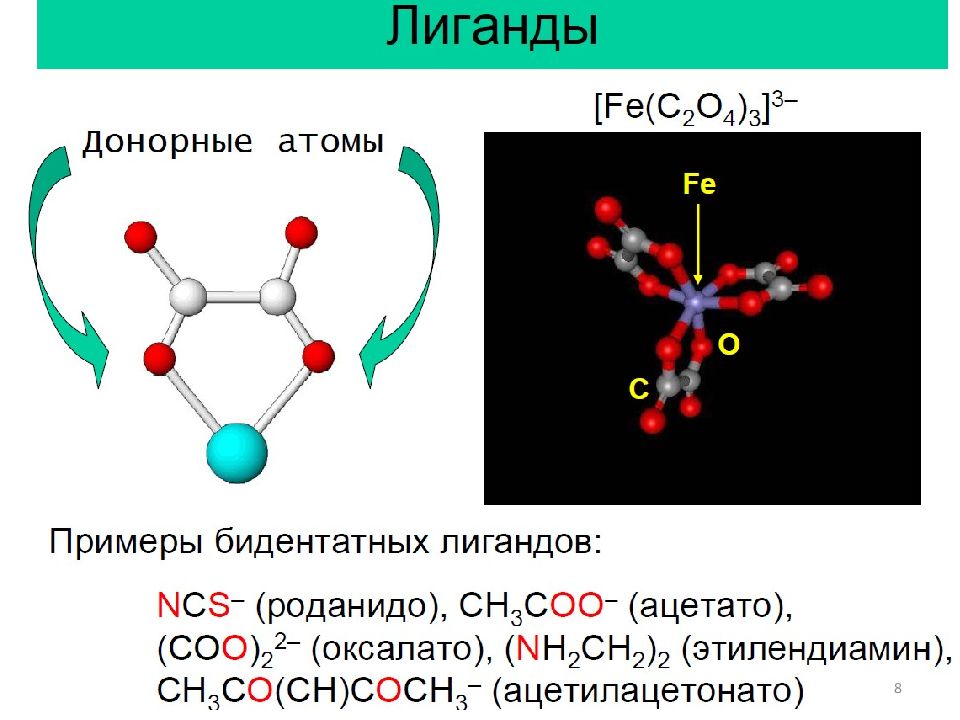
Основные понятия: 1. Центральный атом. 2. Лиганды. 3. Дентатность. 4. Координационная сфера, координационное число. 5. Классификация комплексов. 5
Слайд 6
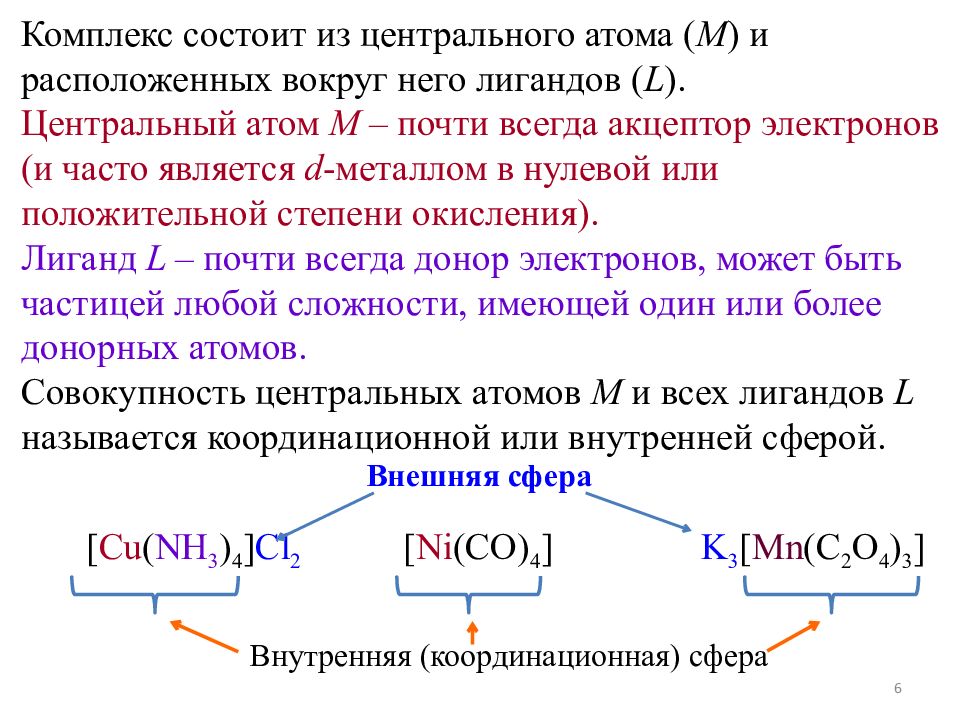
Комплекс состоит из центрального атома ( M ) и расположенных вокруг него лигандов ( L ). Центральный атом M – почти всегда акцептор электронов (и часто является d - металлом в нулевой или положительной степени окисления). Лиганд L – почти всегда донор электронов, может быть частицей любой сложности, имеющей один или более донорных атомов. Совокупность центральных атомов М и всех лигандов L называется координационной или внутренней сферой. [ Cu ( NH 3 ) 4 ] Cl 2 [ Ni (CO) 4 ] K 3 [ Mn (C 2 O 4 ) 3 ] Внешняя сфера Внутренняя (координационная) сфера 6
Слайд 10
Определение по О.В. Михайлову: Комплекс – это химическое соединение, отличительной особенностью которого является наличие как минимум одного центрального атома ( комплексообразователя ), окруженного определенным образом частицами ( лигандами ), способными к самостоятельному существованию и равновесному отщеплению от этого комплексобразователя. Как правило, хотя бы часть связей между комплексообразователем и лигандами осуществляется по донорно-акцепторному механизму. 10
Слайд 12
12 Амбидентатность лиганда – это способность лигандов, содержащих два и более донорных атома, присоединяться к центральному атому (иону) разными способами. В этом случае также говорят о конкурентной координации. Есть и другое определение амбидентатного лиганда: амбидентатный лиганд это лиганд, содержащий несколько (два или более) электронодонорных центров, но в координации участвует один из них.
Слайд 13
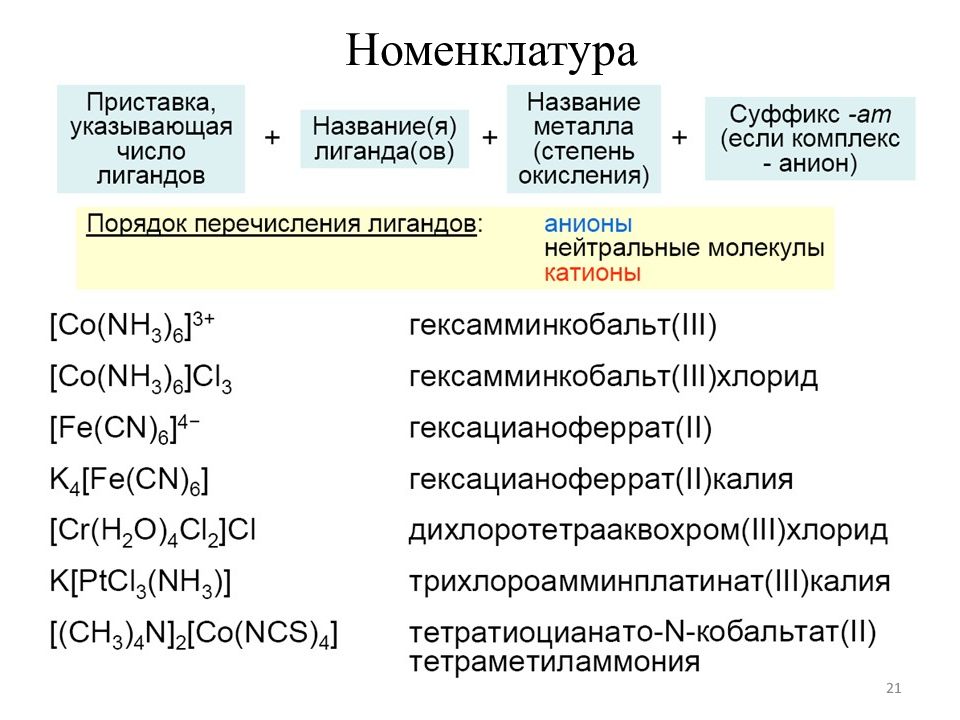
13 1) В названии комплексного соединения первым указывают отрицательно заряженную часть — анион, затем положительную часть — катион. 2) Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды — анионы, прибавляя к их латинскому названию окончание «о». Например: Cl − — хлоро, CN − — циано, SCN− — тиоцианато, NO 3 − — нитрато, SO 3 2− — сульфито, OH − — гидроксо и т. д. При этом пользуются терминами: для координированного аммиака — аммин, для воды — аква, для оксида углерода(II) — карбонил. 3) Число монодентатных лигандов указывают греческими числительными: 1 — моно, 2 — ди, 3 — три, 4 — тетра, 5 — пента, 6 — гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис -, тетракис - и т. д. 4) Затем называют комплексообразователь, используя корень его латинского названия и окончание - ат, после чего римскими цифрами указывают (в скобках) С.О. комплексообразователя.
Слайд 14
14 5) После обозначения состава внутренней сферы называют внешнюю сферу. 6) В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса. Примеры: K 3 [Fe(CN) 6 ] — гексацианоферрат (III) калия (NH 4 ) 2 [PtCl 4 (OH) 2 ] — дигидроксотетрахлороплатинат (IV) аммония [ Сr (H 2 O) 3 F 3 ] — трифторотриаквахром [Co(NH 3 ) 3 Cl(NO 2 ) 2 ] — динитритохлоротриамминкобальт [ Pt (NH 3 ) 4 Cl 2 ]Cl 2 — хлорид дихлоротетраамминплатины (IV) [Li(H 2 O) 4 ]NO 3 — нитрат тетрааквалития
Слайд 17
17 Диссоциация комплексов и константа нестойкости Рассмотрим на примере: [Ag(NH 3 ) 2 ]Cl [Ag(NH 3 ) 2 ] + + Cl – практически необратимо Константа равновесия не определяется.
Слайд 18
18 Диссоциация комплексов и константа нестойкости Рассмотрим на примере: [Ag(NH 3 ) 2 ]Cl [Ag(NH 3 ) 2 ] + + Cl – практически необратимо Константа равновесия не определяется. Далее: идёт обратимый распад внутренней сферы комплекса. [Ag(NH 3 ) 2 ] + р-р ⇄ [Ag(NH 3 )] + р-р + NH 3 р-р – 1- ая ступень ; C [Ag(NH 3 )] + C NH 3 ; (константа нестойкости по первой ступени) K H 1 = C [Ag(NH 3 ) 2 ] + Константа нестойкости – частный случай константы равновесия ( K C ).
Слайд 19
19 Диссоциация комплексов и константа нестойкости Рассмотрим на примере: [Ag(NH 3 ) 2 ]Cl [Ag(NH 3 ) 2 ] + + Cl – практически необратимо Константа равновесия не определяется. Далее: идёт обратимый распад внутренней сферы комплекса. [Ag(NH 3 ) 2 ] + р-р ⇄ [Ag(NH 3 )] + р-р + NH 3 р-р – 1- ая ступень ; C [Ag(NH 3 )] + C NH 3 ; (константа нестойкости по первой ступени) K H 1 = C [Ag(NH 3 ) 2 ] + [Ag(NH 3 )] + р-р ⇄ Ag + р-р + NH 3 р-р – 2 - ая ступень ; C Ag + C NH 3 ; (константа нестойкости по второй ступени) K H 2 = C [Ag(NH 3 )] +
Слайд 20
20 Диссоциация комплексов и константа нестойкости Рассмотрим на примере: [Ag(NH 3 ) 2 ]Cl [Ag(NH 3 ) 2 ] + + Cl – практически необратимо Константа равновесия не определяется. Далее: идёт обратимый распад внутренней сферы комплекса. [Ag(NH 3 ) 2 ] + р-р ⇄ [Ag(NH 3 )] + р-р + NH 3 р-р – 1- ая ступень ; C [Ag(NH 3 )] + C NH 3 ; (константа нестойкости по первой ступени) K H 1 = C [Ag(NH 3 ) 2 ] + [Ag(NH 3 )] + р-р ⇄ Ag + р-р + NH 3 р-р – 2 - ая ступень ; C Ag + C NH 3 ; (константа нестойкости по второй ступени) K H 2 = C [Ag(NH 3 )] + Комбинируя реакции 1 и 2, записываем общее уравнение: [Ag(NH 3 ) 2 ] + р-р ⇄ Ag + р-р + 2 NH 3 р-р C Ag + ( C NH 3 ) 2 ; (общая константа нестойкости) K H = C [Ag(NH 3 ) 2 ] +
Слайд 23
Становление химии комплексных соединений. Этапы получения все более сложных соединений 1702, Diesbach, - т.н. кровяные соли K 3 [Fe(CN) 6 ] и K 4 [Fe(CN) 6 ] 3–, а также “ берлинская лазурь ”, она же “ турнбулева синь ” KFe [Fe(CN) 6 ] 1763, Lewis, K 2 [PtCl 6 ] 1798 Tassaert, [Co(NH 3 ) 6 ]Cl 3 1 828, Magnus, [Pt(NH 3 ) 4 ][PtCl 4 ] Zeise, K[PtCl 3 (C 2 H 4 )]·H 2 O 1849, Playfair, Na 2 [Fe(CN) 5 (NO)]·2H 2 O 1858, Roussin, [Fe 2 S 2 (NO) 4 ] 2– 1869, Schützenberger, [Pt(CO) 2 Cl 2 ] 1888 Mond [Ni(CO) 4 ] ( 1919, Hein, - комплексы Cr(0) с C 6 H 6 ) 1963-65, Vaska, [Ir(CO)Cl(P(C 6 H 5 ) 3 ) 2 (O 2 )], Allen, Senoff, [Ru(NH 3 ) 5 (N 2 )] 2+ (!) 1984, Kubas, [ W(CO) 3 ( P ( C 6 H 5 ) 3 ) 2 ( H 2 )] 2000, Seidel, Seppelt, [AuXe 4 ] 2+ – ксенон как лиганд! ( [AuXe 4 ] 2 [SbF 6 ] 2 ) 2004 - von Schleyer [Ti(P 5 ) 2 ] –, P 5 – - аналог С 5 Н 5 – 23
Слайд 24
24 Химическая связь в комплексных (координационных) соединениях Теория В. Косселя. «Элементы, стремясь образовать завершенную электронную оболочку, либо присоединяют электроны, преобразуясь в анионы, либо теряют электроны, превращаясь в катионы. Затем катионы и анионы объединяются за счет электростатического ненаправленного взаимодействия. Катионы окружают себя некоторым количеством анионов (чаще 6 или 4), аналогично ведут себя и анионы. Заряженные частицы могут упаковываться в кристаллические структуры. Внутреннюю сферу комплексов обычно образуют катионы металла и анионы (или полярные дипольные молекулы), поэтому связь во внутренней сфере комплекса имеет электростатическую природу (ионная связь).»
Слайд 25
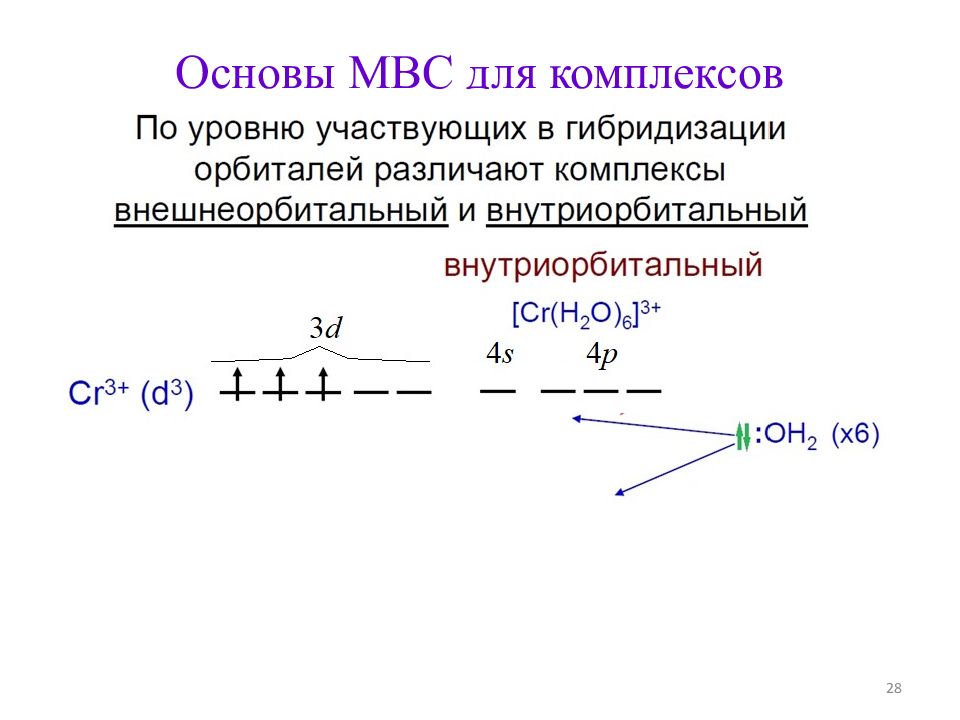
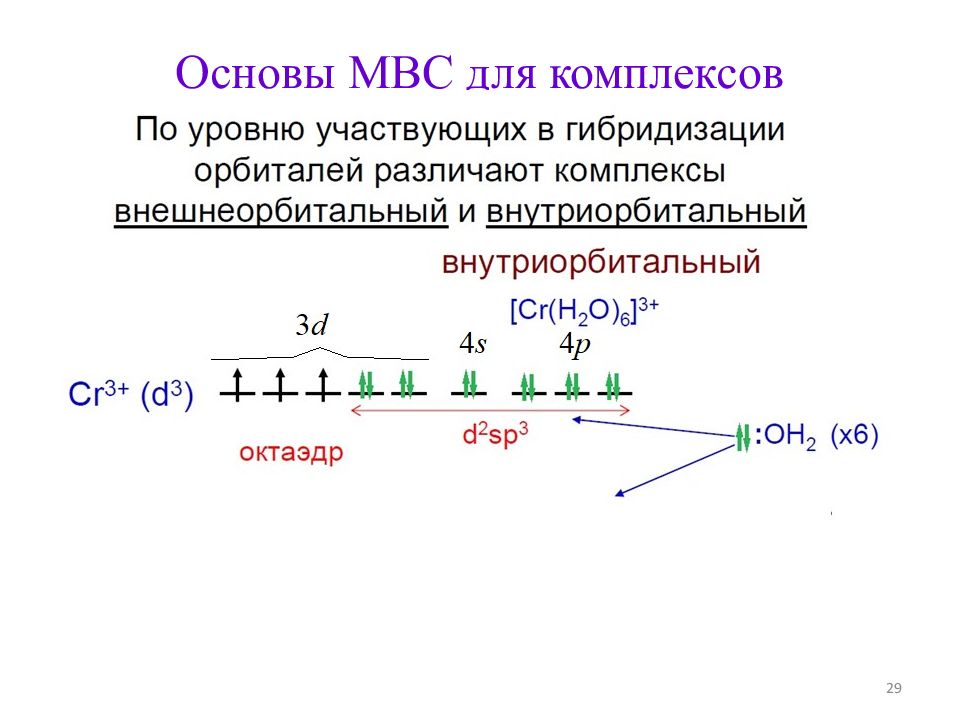
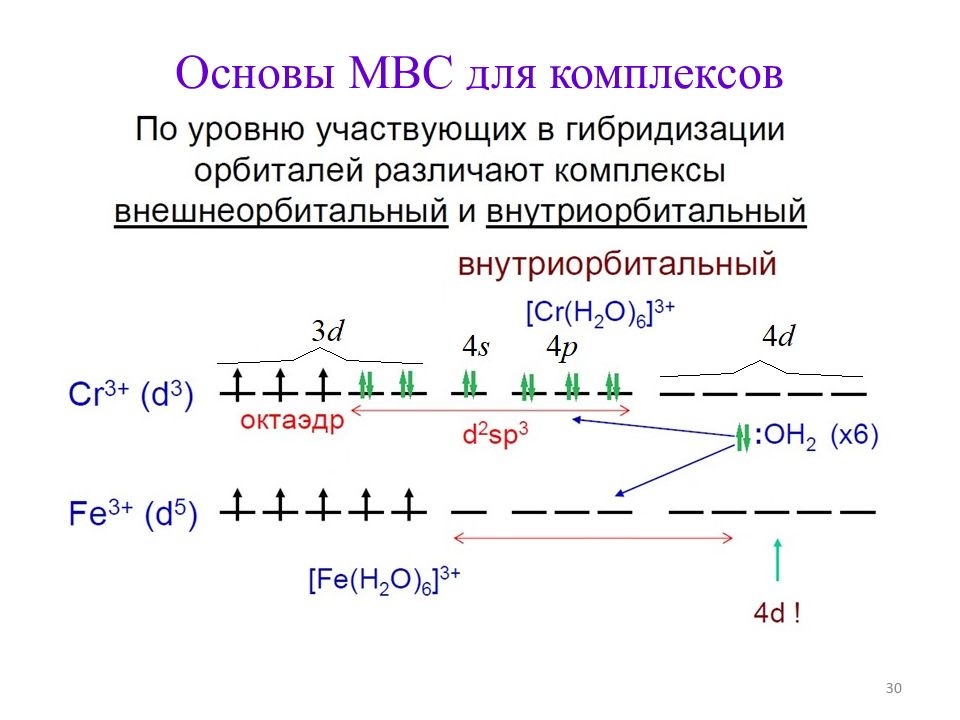
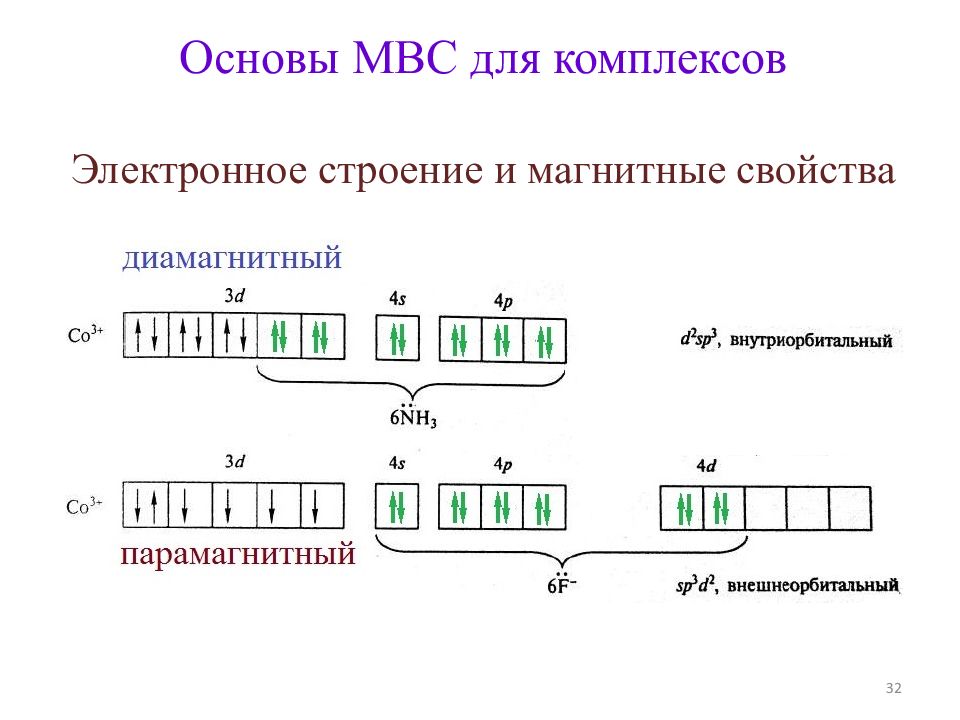
Строение комплексов d - металлов (по МВС ) 1. Не определяется правилами Гиллеспи. 2. В первом приближении основано на донорно-акцепторном взаимодействии металл – лиганд. 3. Учитывает степень окисления и электронную конфигурацию центрального атома 25
Слайд 33
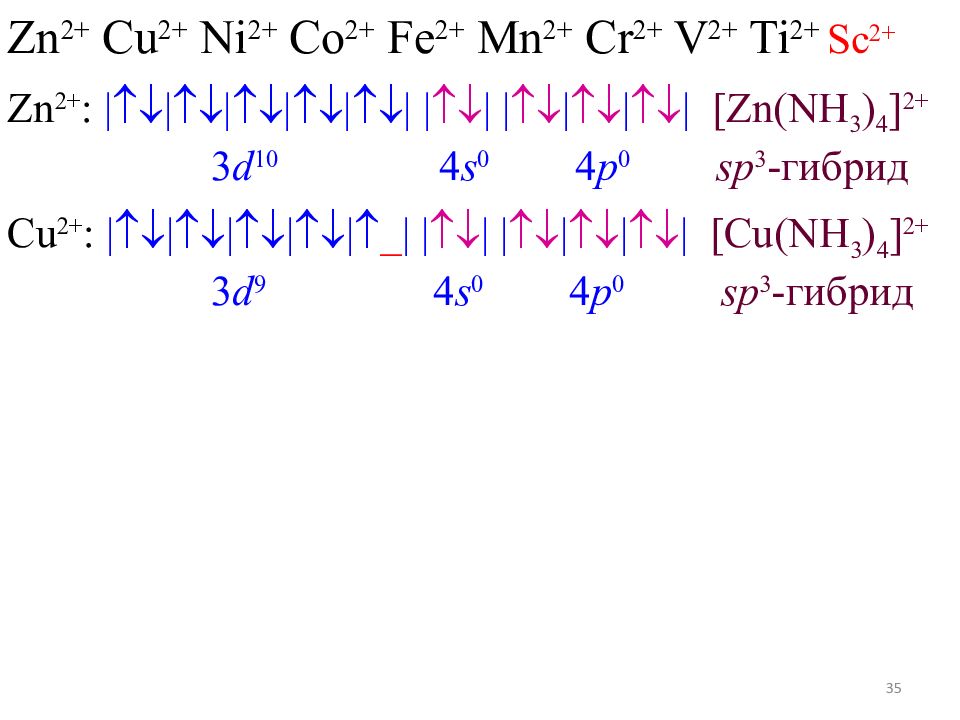
33 Zn 2+ Cu 2+ Ni 2+ Co 2+ Fe 2+ Mn 2+ Cr 2+ V 2+ Ti 2+ Sc 2+ Zn 2+ : |||||| |__| |__|__|__| [Zn(NH 3 ) 4 ] 2+ 3 d 10 4 s 0 4 p 0
Слайд 34
34 Zn 2+ Cu 2+ Ni 2+ Co 2+ Fe 2+ Mn 2+ Cr 2+ V 2+ Ti 2+ Sc 2+ Zn 2+ : |||||| | | | | | | [Zn(NH 3 ) 4 ] 2+ 3 d 10 4 s 0 4 p 0 sp 3 - гибрид
Слайд 35
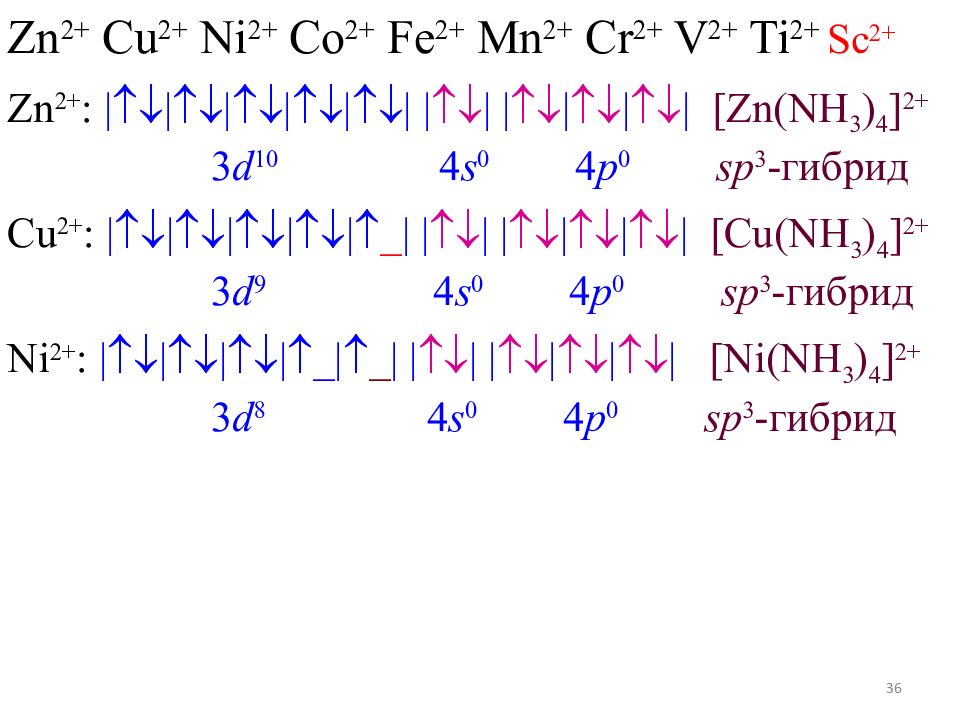
35 Zn 2+ Cu 2+ Ni 2+ Co 2+ Fe 2+ Mn 2+ Cr 2+ V 2+ Ti 2+ Sc 2+ Zn 2+ : |||||| | | | | | | [Zn(NH 3 ) 4 ] 2+ 3 d 10 4 s 0 4 p 0 sp 3 - гибрид Cu 2+ : ||||| _ | | | | | | | [Cu(NH 3 ) 4 ] 2+ 3 d 9 4 s 0 4 p 0 sp 3 - гибрид
Слайд 36
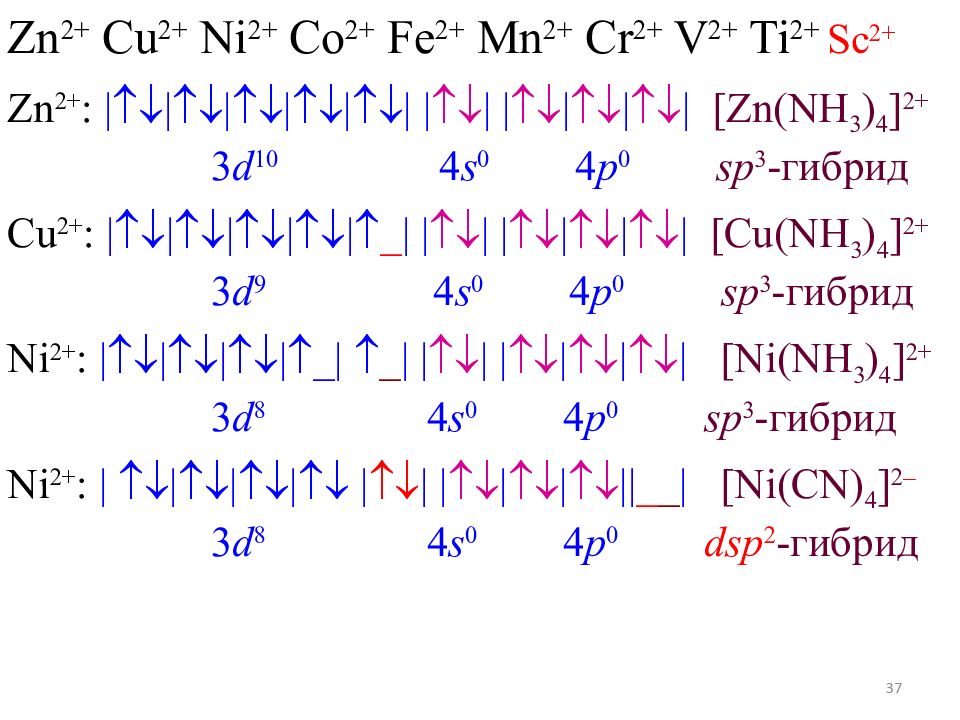
36 Zn 2+ Cu 2+ Ni 2+ Co 2+ Fe 2+ Mn 2+ Cr 2+ V 2+ Ti 2+ Sc 2+ Zn 2+ : |||||| | | | | | | [Zn(NH 3 ) 4 ] 2+ 3 d 10 4 s 0 4 p 0 sp 3 - гибрид Cu 2+ : ||||| _ | | | | | | | [Cu(NH 3 ) 4 ] 2+ 3 d 9 4 s 0 4 p 0 sp 3 - гибрид Ni 2+ : |||| _ | _ | | | | | | | [Ni(NH 3 ) 4 ] 2+ 3 d 8 4 s 0 4 p 0 sp 3 - гибрид
Слайд 37
37 Zn 2+ Cu 2+ Ni 2+ Co 2+ Fe 2+ Mn 2+ Cr 2+ V 2+ Ti 2+ Sc 2+ Zn 2+ : |||||| | | | | | | [Zn(NH 3 ) 4 ] 2+ 3 d 10 4 s 0 4 p 0 sp 3 - гибрид Cu 2+ : ||||| _ | | | | | | | [Cu(NH 3 ) 4 ] 2+ 3 d 9 4 s 0 4 p 0 sp 3 - гибрид Ni 2+ : |||| _ | _ | | | | | | | [Ni(NH 3 ) 4 ] 2+ 3 d 8 4 s 0 4 p 0 sp 3 - гибрид Ni 2+ : | ||| | | | | | || _ _ | [Ni(CN) 4 ] 2 – 3 d 8 4 s 0 4 p 0 dsp 2 - гибрид
Слайд 38
38 Zn 2+ Cu 2+ Ni 2+ Co 2+ Fe 2+ Mn 2+ Cr 2+ V 2+ Ti 2+ Sc 2+ Zn 2+ : |||||| | | | | | | [Zn(NH 3 ) 4 ] 2+ 3 d 10 4 s 0 4 p 0 sp 3 - гибрид Cu 2+ : ||||| _ | | | | | | | [Cu(NH 3 ) 4 ] 2+ 3 d 9 4 s 0 4 p 0 sp 3 - гибрид Ni 2+ : |||| _ | _ | | | | | | | [Ni(NH 3 ) 4 ] 2+ 3 d 8 4 s 0 4 p 0 sp 3 - гибрид Ni 2+ : | ||| | | | | | || _ _ | [Ni(CN) 4 ] 2 – 3 d 8 4 s 0 4 p 0 dsp 2 - гибрид Fe 2+ : |||| | | | || | | | [Fe(CN) 6 ] 2– 3 d 6 4 s 0 4 p 0 d 2 sp 3 - гибрид
Слайд 41
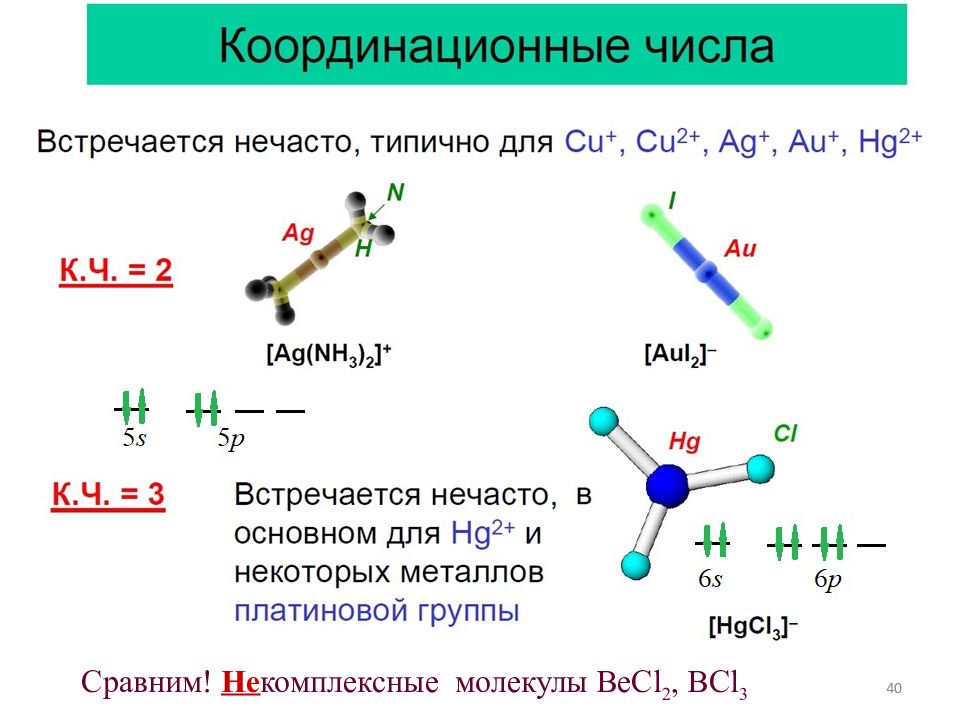
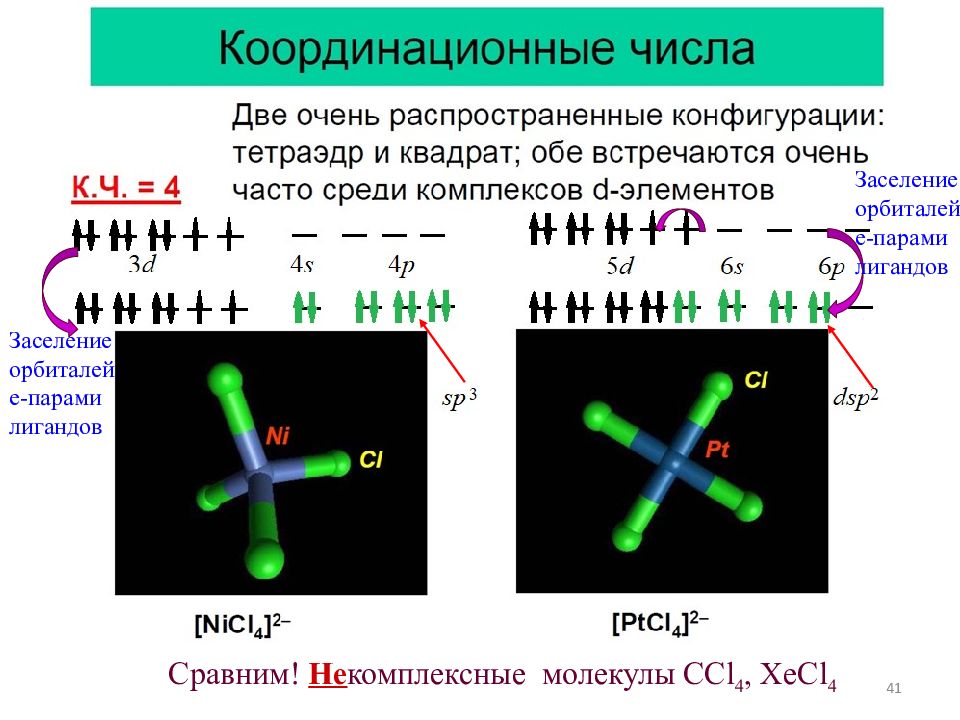
41 Сравним ! Не комплексные молекулы СС l 4, XeCl 4 Заселение орбиталей е-парами лигандов Заселение орбиталей е-парами лигандов
Слайд 44
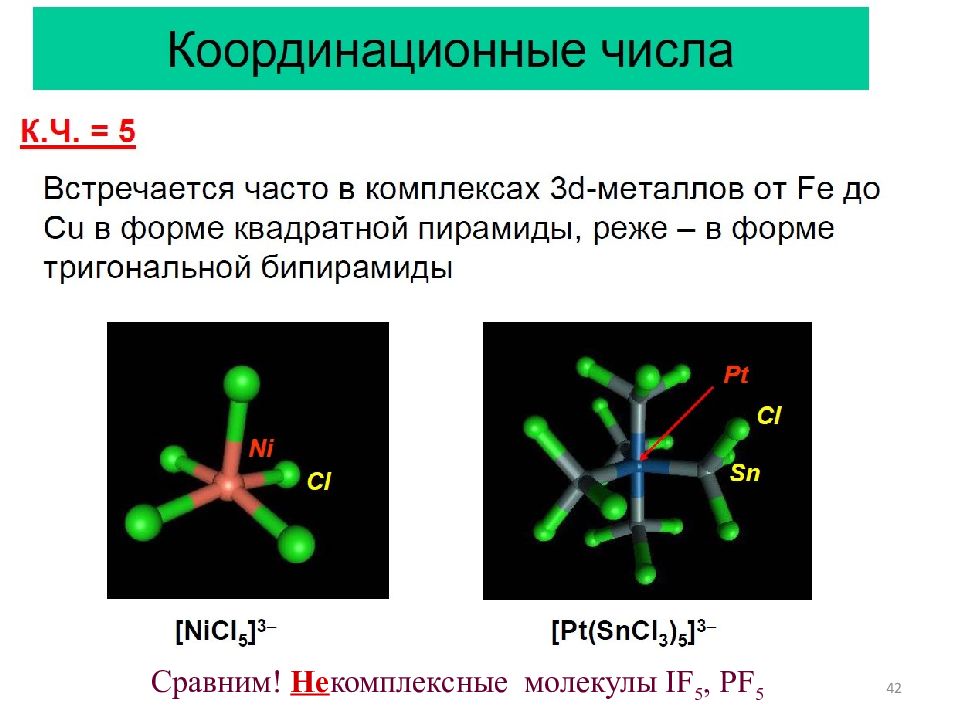
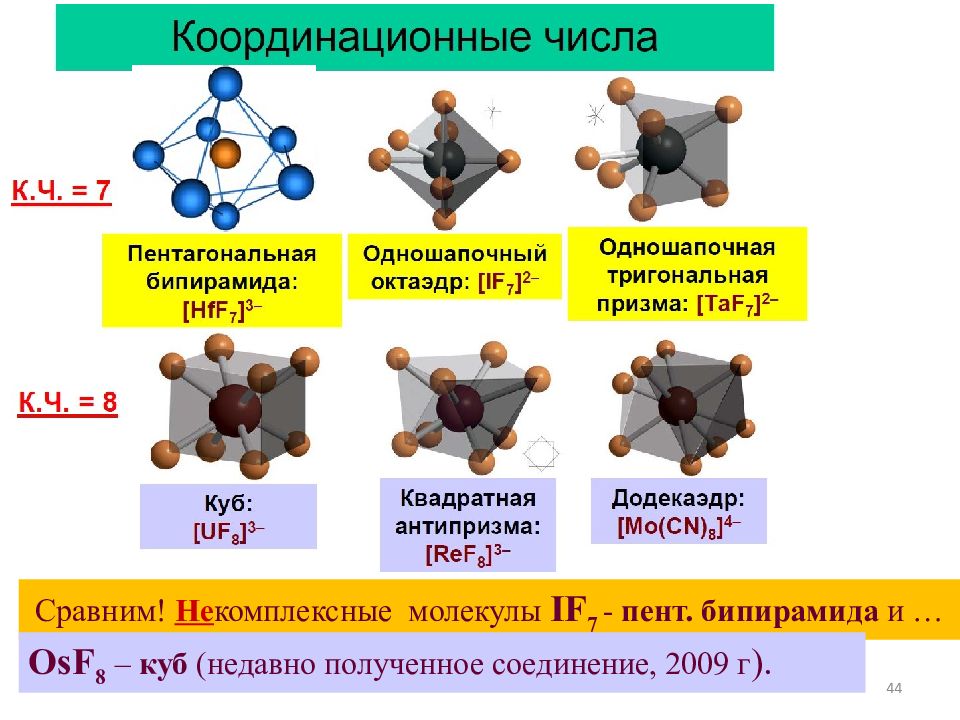
44 Сравним ! Не комплексные молекулы IF 7 - пент. бипирамида и … OsF 8 – куб (недавно полученное соединение, 2009 г ).
Слайд 45
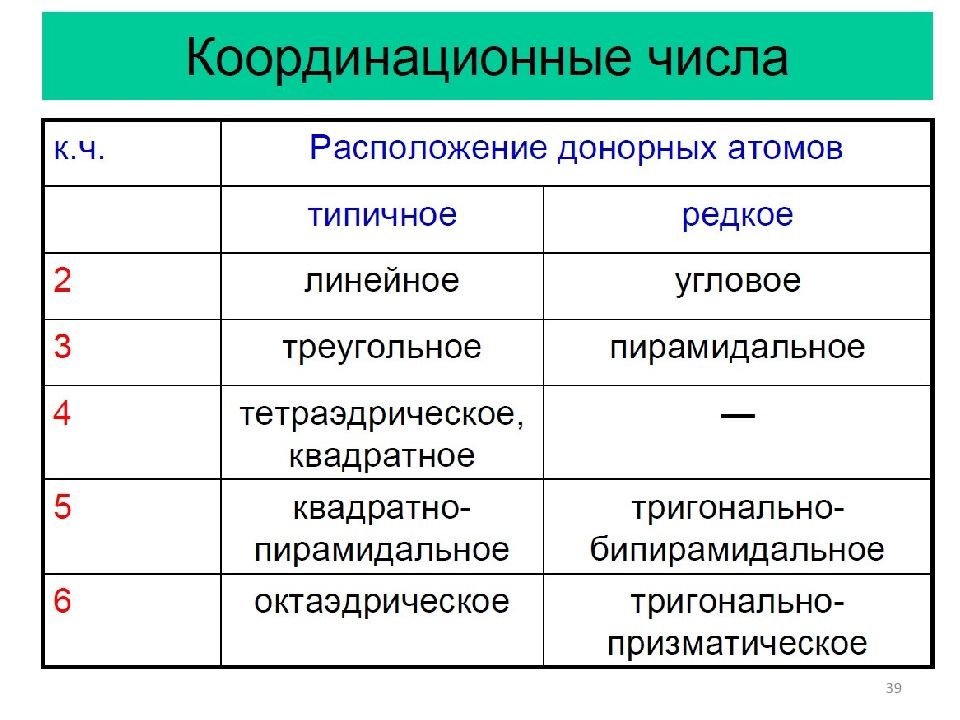
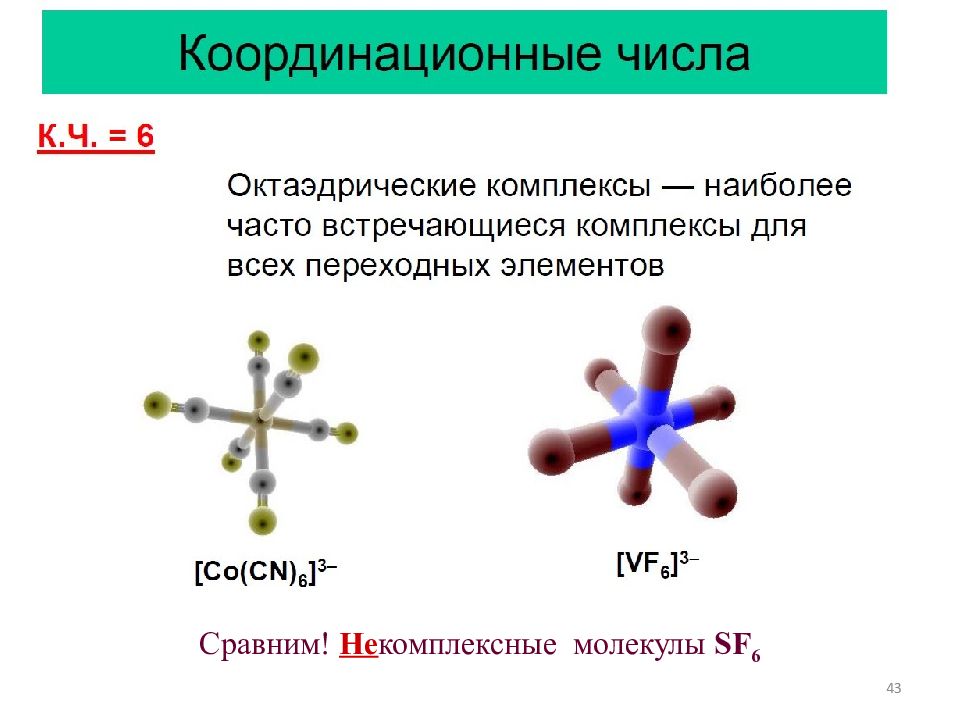
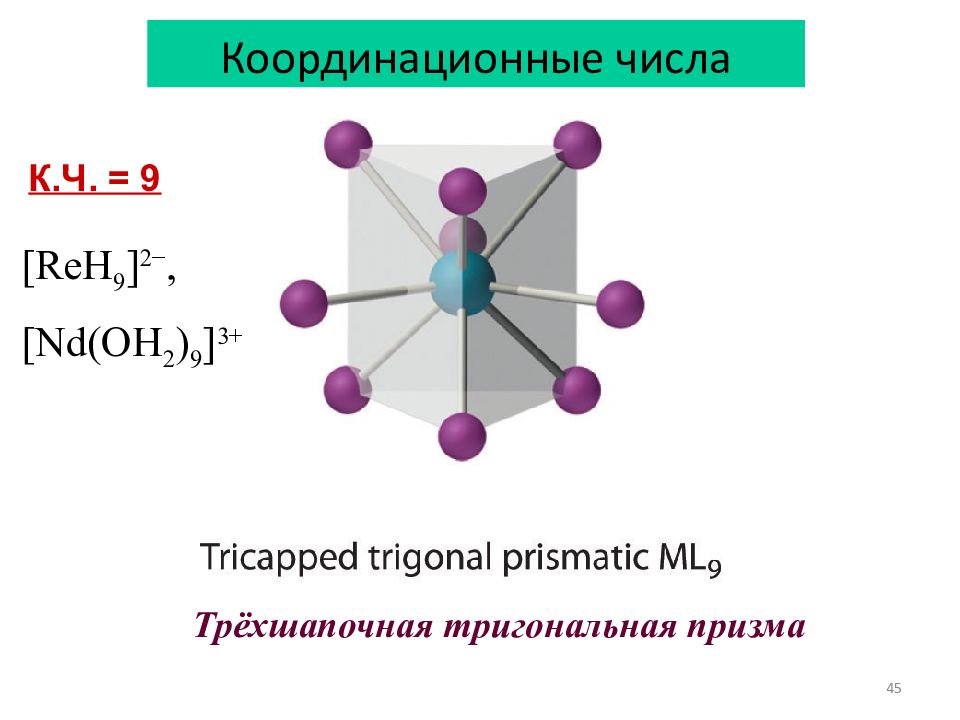
45 Координационные числа К.Ч. = 9 [ReH 9 ] 2−, [Nd(OH 2 ) 9 ] 3+ Трёхшапочная тригональная призма
Слайд 46
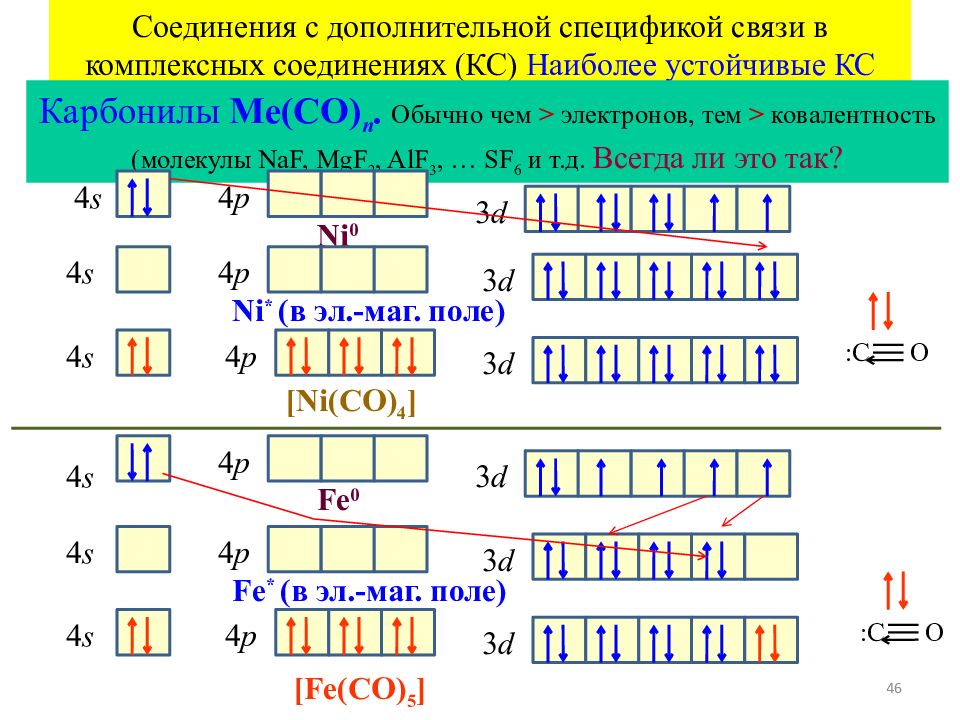
46 Соединения с дополнительной спецификой связи в комплексных соединениях (КС) Наиболее устойчивые КС Карбонилы Me(CO) n. Обычно чем > электронов, тем > ковалентность (молекулы NaF, MgF 2, AlF 3, … SF 6 и т.д. Всегда ли это так? Fe 0 4 s 4 p 3 d Fe * ( в эл.-маг. поле) 4 p 3 d 4 p 3 d 4 s 4 s [Fe(CO) 5 ] :C O Ni 0 4 p 3 d Ni * ( в эл.-маг. поле) 4 p 3 d 4 p 3 d 4 s [Ni(CO) 4 ] 4 s 4 s :C O
Слайд 47
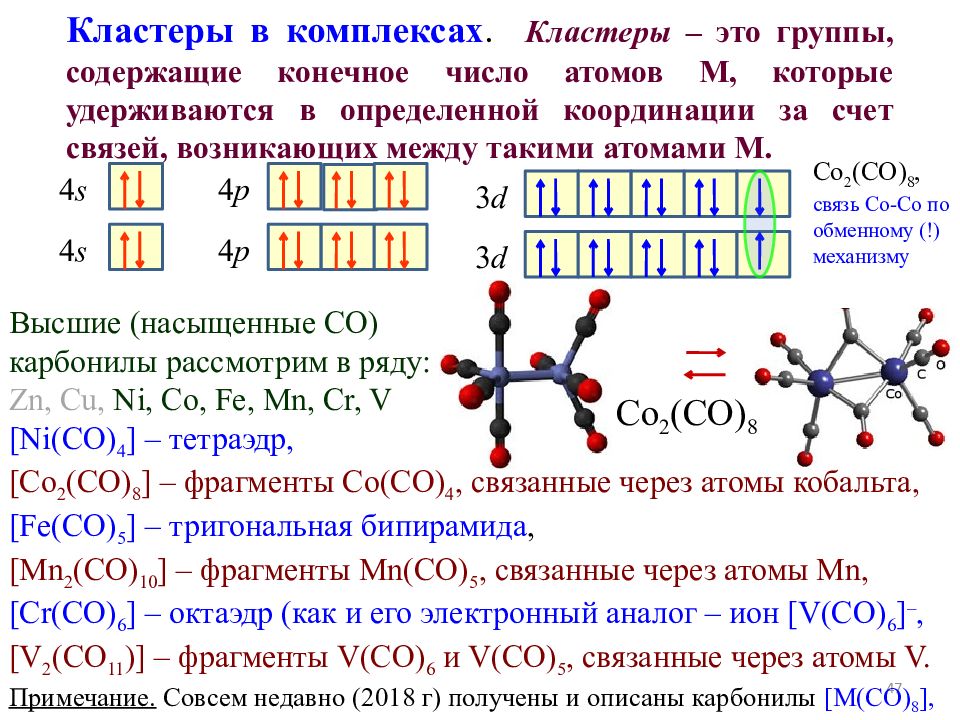
47 Кластеры в комплексах. Кластеры – это группы, содержащие конечное число атомов М, которые удерживаются в определенной координации за счет связей, возникающих между такими атомами М. 4 p 3 d 4 s 4 p 3 d 4 s Высшие (насыщенные С O) карбонилы рассмотрим в ряду: Zn, Cu, Ni, Co, Fe, Mn, Cr, V [Ni(CO) 4 ] – тетраэдр, [Co 2 (CO) 8 ] – фрагменты Co(CO) 4, связанные через атомы кобальта, [Fe(CO) 5 ] – тригональная бипирамида, [Mn 2 (CO) 10 ] – фрагменты Mn (CO) 5, связанные через атомы Mn, [Cr(CO) 6 ] – октаэдр (как и его электронный аналог – ион [V(CO) 6 ] –, [V 2 (CO 11 )] – фрагменты V(CO) 6 и V(CO) 5, связанные через атомы V. Примечание. Совсем недавно (2018 г) получены и описаны карбонилы [M(CO) 8 ], где М = Ca, Sr или Ba, которые укладываются в приведенную выше схему. Co 2 (CO) 8 Co 2 (CO) 8, связь Co-Co по обменному (!) механизму
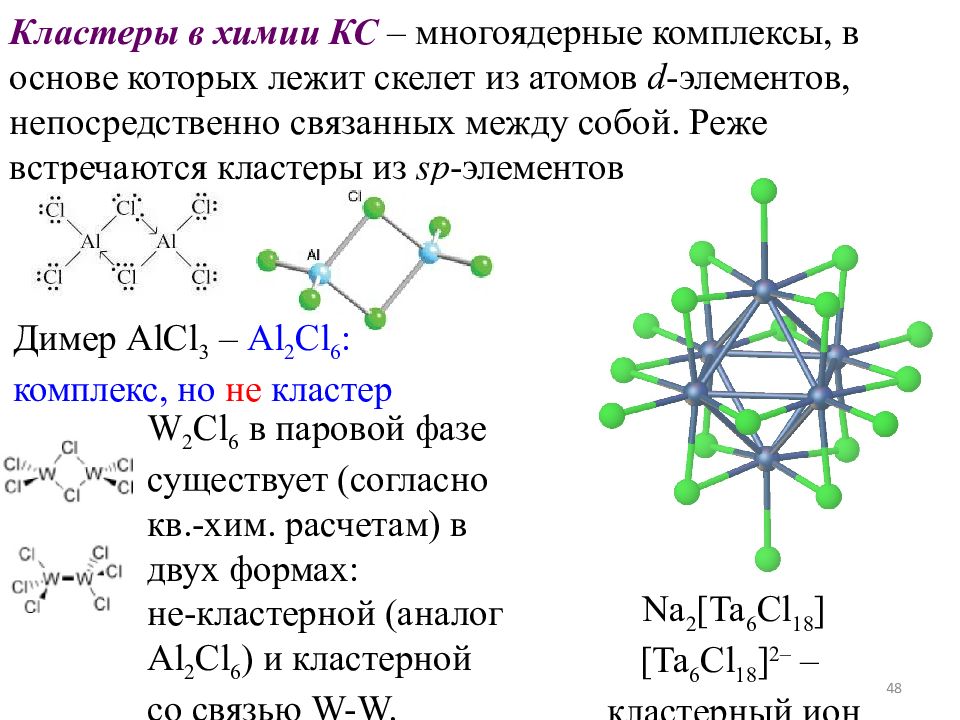
Слайд 48
48 Na 2 [Ta 6 Cl 18 ] [Ta 6 Cl 18 ] 2– – кластерный ион Кластеры в химии КС – многоядерные комплексы, в основе которых лежит скелет из атомов d - элементов, непосредственно связанных между собой. Реже встречаются кластеры из sp - элементов W 2 Cl 6 в паровой фазе существует (согласно кв.-хим. расчетам) в двух формах: не-кластерной (аналог Al 2 Cl 6 ) и кластерной со связью W-W. Димер AlCl 3 – Al 2 Cl 6 : комплекс, но не кластер
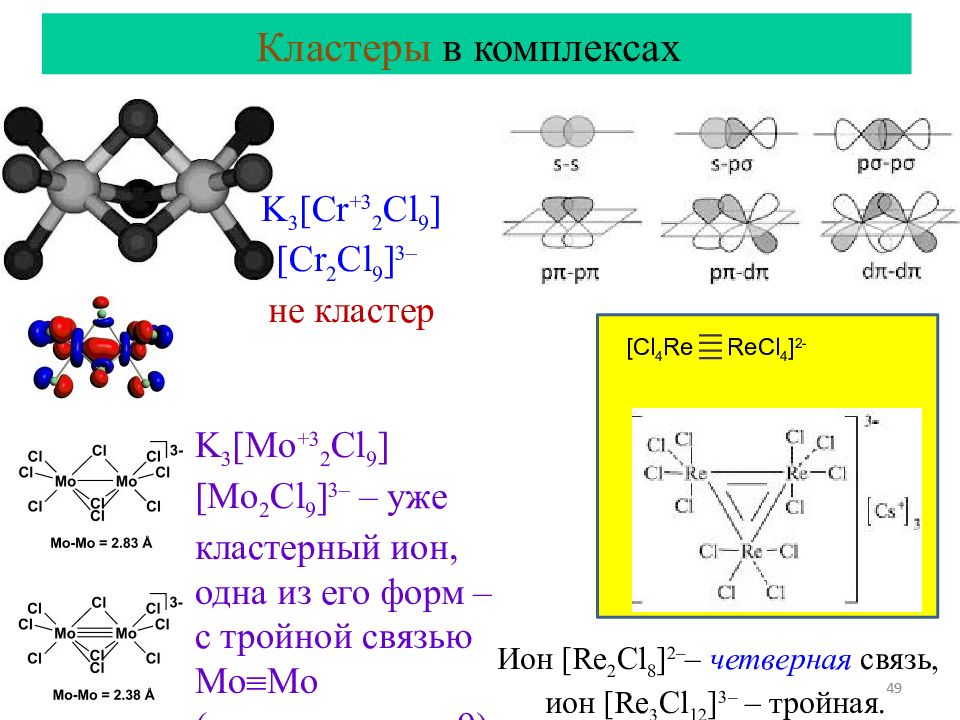
Слайд 49
49 Кластеры в комплексах [Cl 4 Re ReCl 4 ] 2- K 3 [Cr +3 2 Cl 9 ] [Cr 2 Cl 9 ] 3– не кластер K 3 [Mo +3 2 Cl 9 ] [Mo 2 Cl 9 ] 3– – уже кластерный ион, одна из его форм – с тройной связью Mo Mo (ковалентность=9) Ион [Re 2 Cl 8 ] 2– – четверная связь, ион [Re 3 Cl 12 ] 3– – тройная.
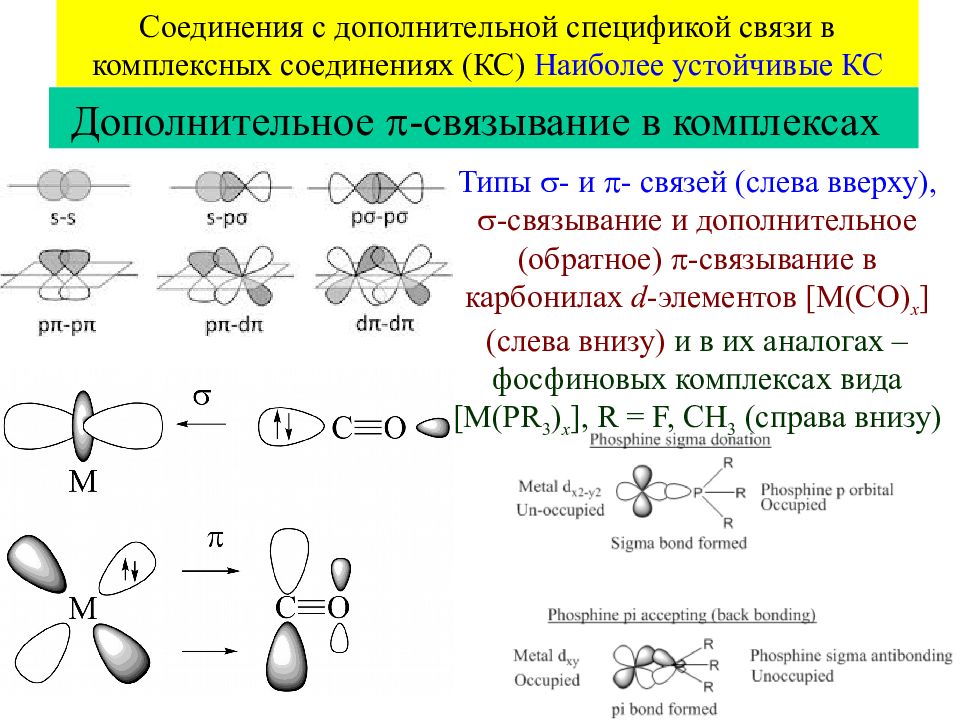
Слайд 50
50 Соединения с дополнительной спецификой связи в комплексных соединениях (КС) Наиболее устойчивые КС Дополнительное -связывание в комплексах Типы - и - связей (слева вверху), -связывание и дополнительное (обратное) -связывание в карбонилах d - элементов [M(CO) x ] (слева внизу) и в их аналогах – фосфиновых комплексах вида [M(PR 3 ) x ], R = F, CH 3 ( справа внизу)
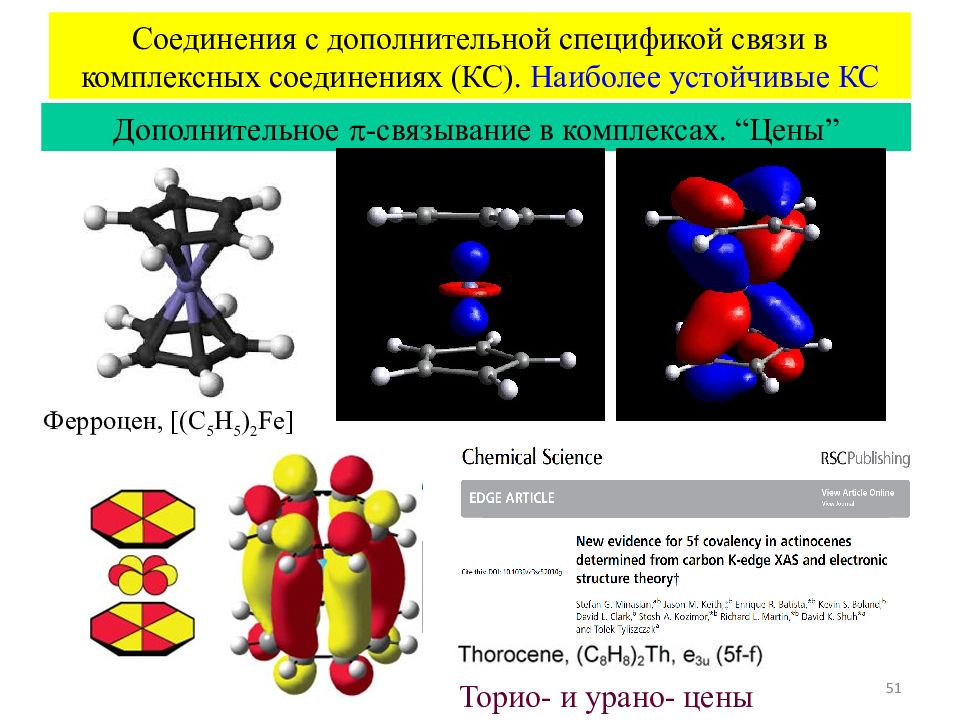
Слайд 51
51 Соединения с дополнительной спецификой связи в комплексных соединениях (КС). Наиболее устойчивые КС Дополнительное -связывание в комплексах. “ Цены ” Ферроцен, [ ( C 5 H 5 ) 2 Fe] Торио - и урано - цены
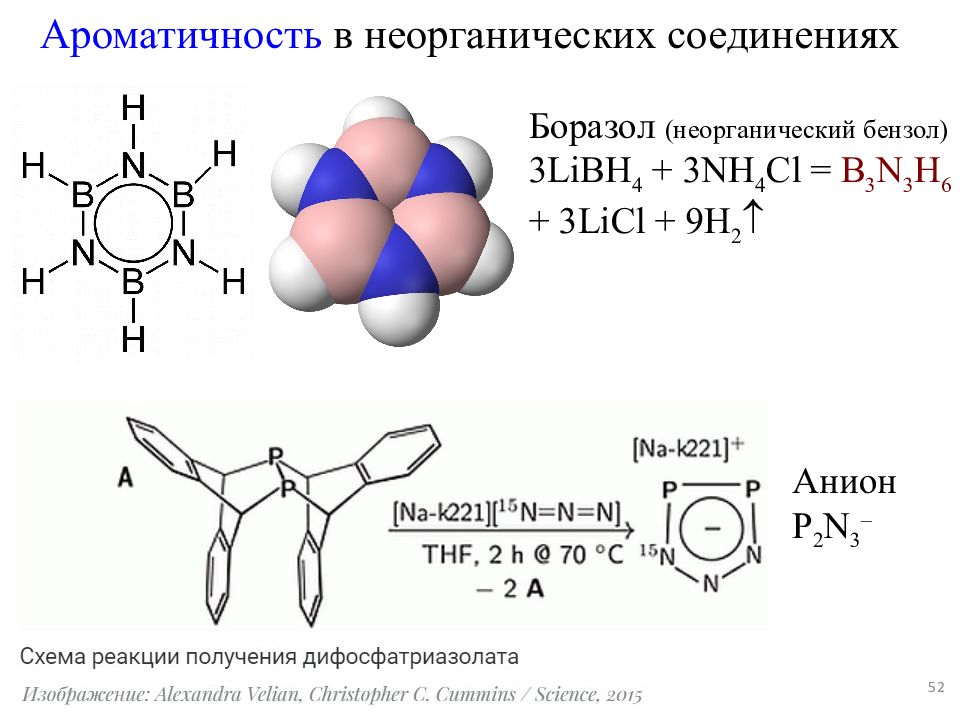
Слайд 52
52 Ароматичность в неорганических соединениях Анион P 2 N 3 – Боразол (неорганический бензол) 3LiBH 4 + 3NH 4 Cl = B 3 N 3 H 6 + 3LiCl + 9H 2
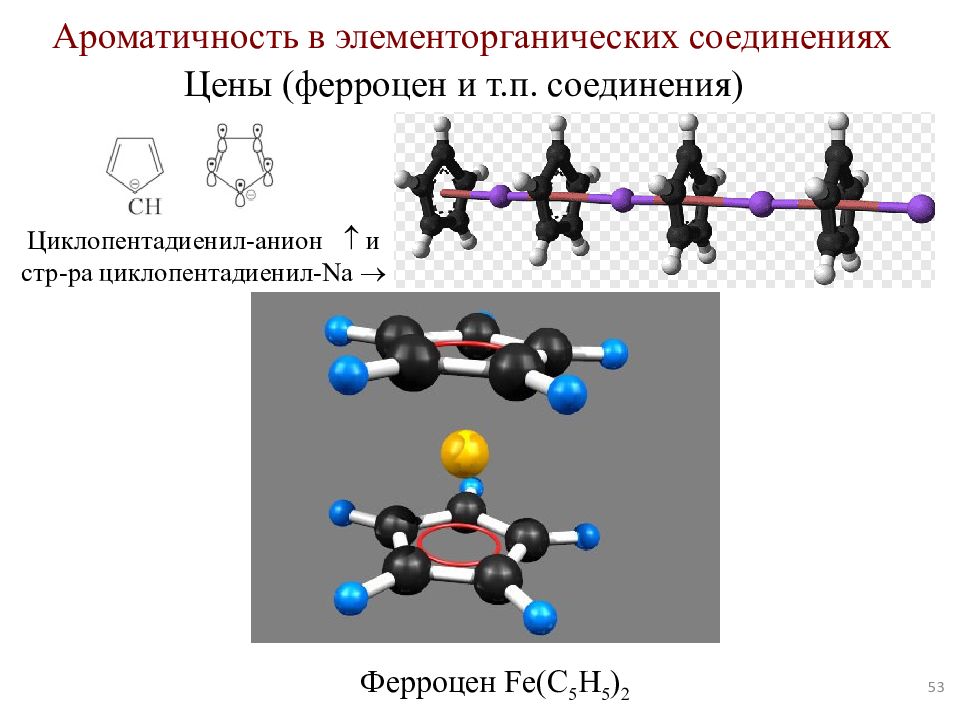
Слайд 53
53 Ароматичность в элементорганических соединениях Цены ( ферроцен и т.п. соединения) Циклопентадиенил -анион и c тр - ра циклопентадиенил - Na Ферроцен Fe(C 5 H 5 ) 2
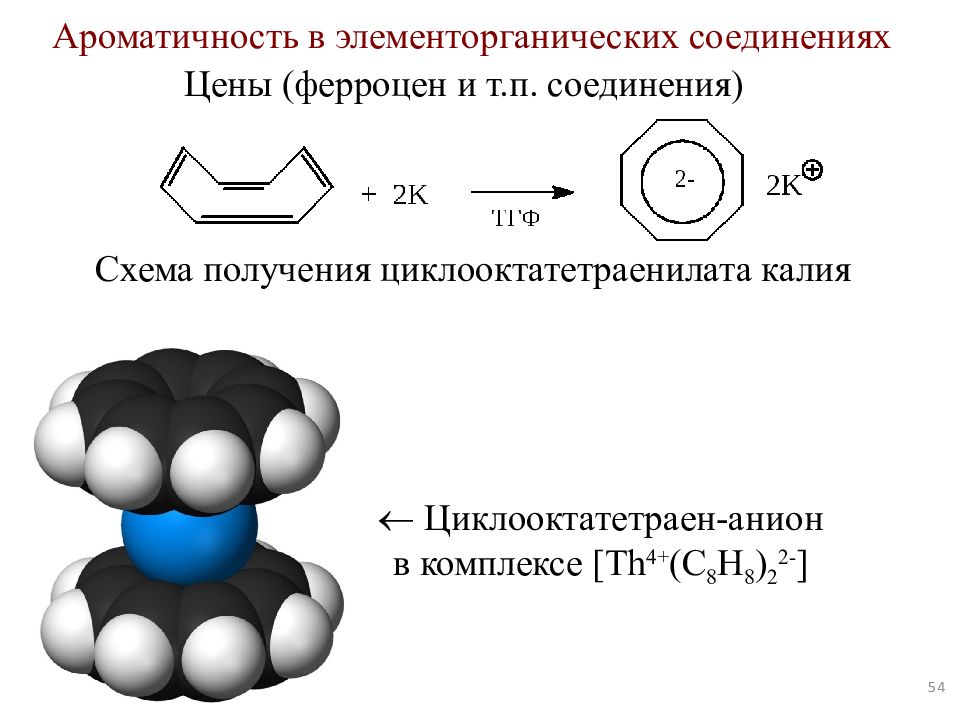
Слайд 54
54 Ароматичность в элементорганических соединениях Цены ( ферроцен и т.п. соединения) Циклооктатетраен -анион в комплексе [ Th 4+ (C 8 H 8 ) 2 2- ] Схема получения циклооктатетраенилата калия
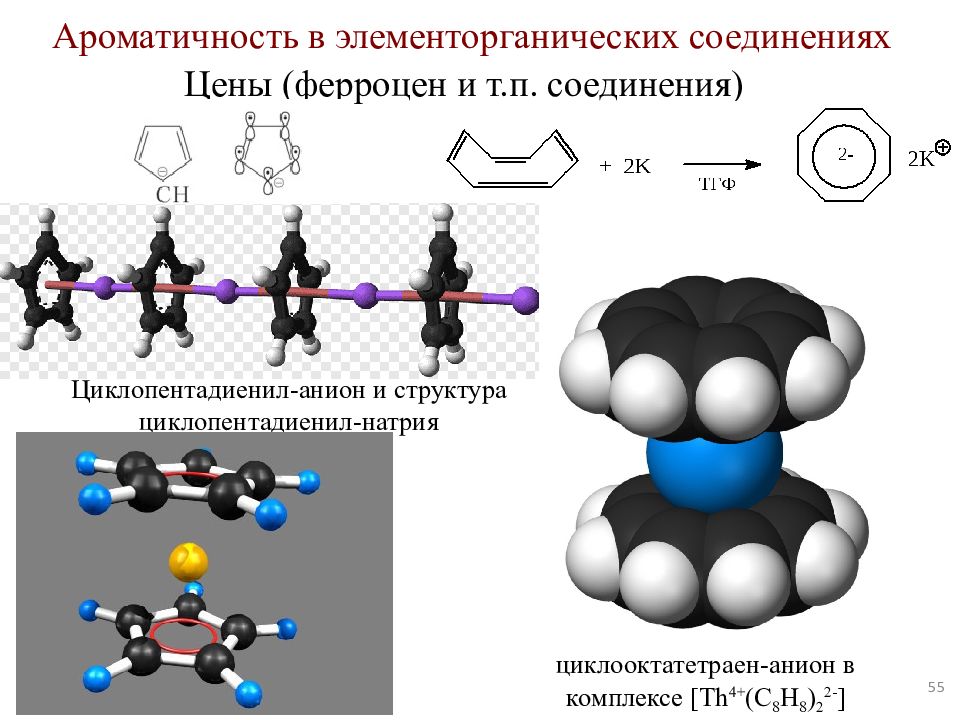
Слайд 55
55 Ароматичность в элементорганических соединениях Цены ( ферроцен и т.п. соединения) циклооктатетраен -анион в комплексе [ Th 4+ (C 8 H 8 ) 2 2- ] Циклопентадиенил -анион и структура циклопентадиенил -натрия
Слайд 56
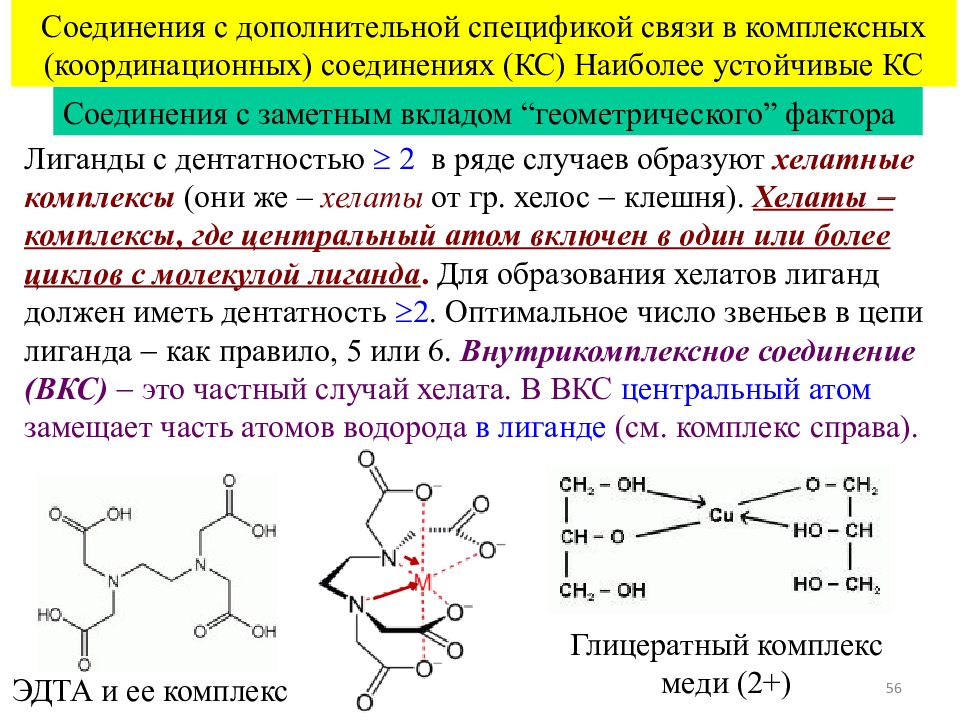
56 Соединения с дополнительной спецификой связи в комплексных (координационных) соединениях (КС) Наиболее устойчивые КС Соединения с заметным вкладом “ геометрического ” фактора Лиганды с дентатностью 2 в ряде случаев образуют хелатные комплексы (они же – хелаты от гр. хелос клешня). Хелаты комплексы, где центральный атом включен в один или более циклов с молекулой лиганда. Для образования хелатов лиганд должен иметь дентатность 2. Оптимальное число звеньев в цепи лиганда как правило, 5 или 6. Внутрикомплексное соединение ( ВКС ) это частный случай хелата. В ВКС центральный атом замещает часть атомов водорода в лиганде (см. комплекс справа). ЭДТА и ее комплекс Глицератный комплекс меди (2+)
Слайд 57
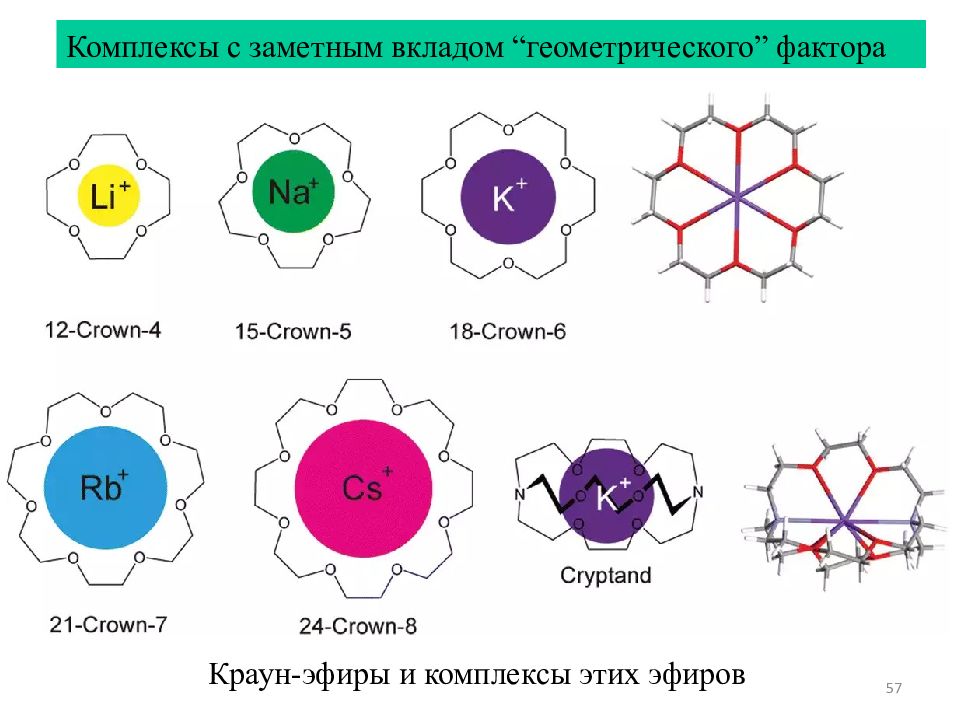
57 Комплексы с заметным вкладом “ геометрического ” фактора Краун-эфиры и комплексы этих эфиров
Слайд 58
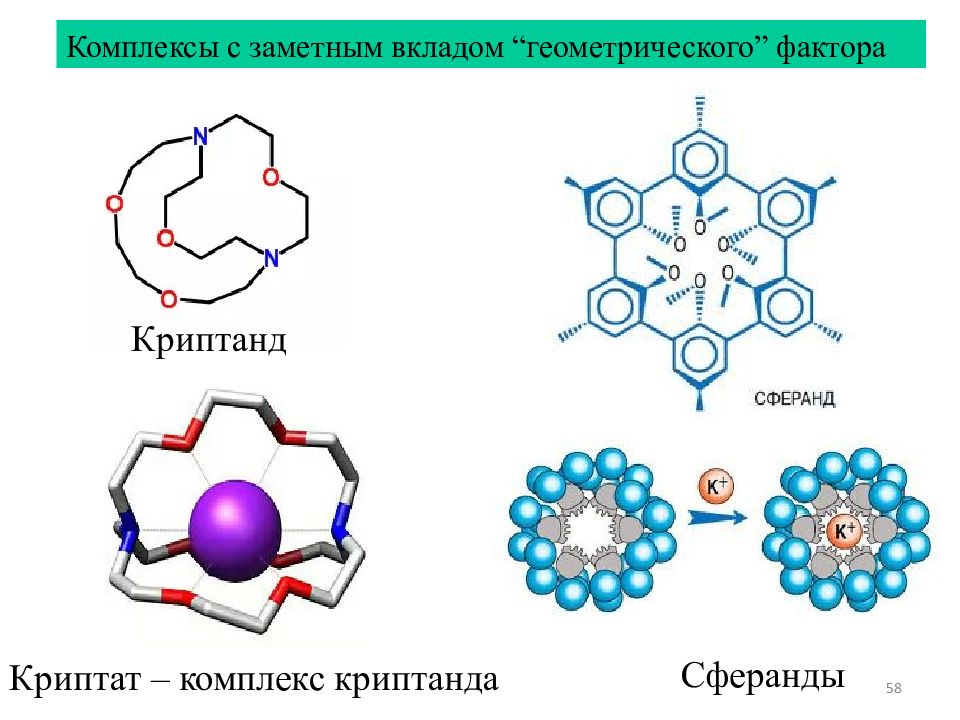
58 Комплексы с заметным вкладом “ геометрического ” фактора Криптат – комплекс криптанда Сферанды Криптанд
Слайд 59
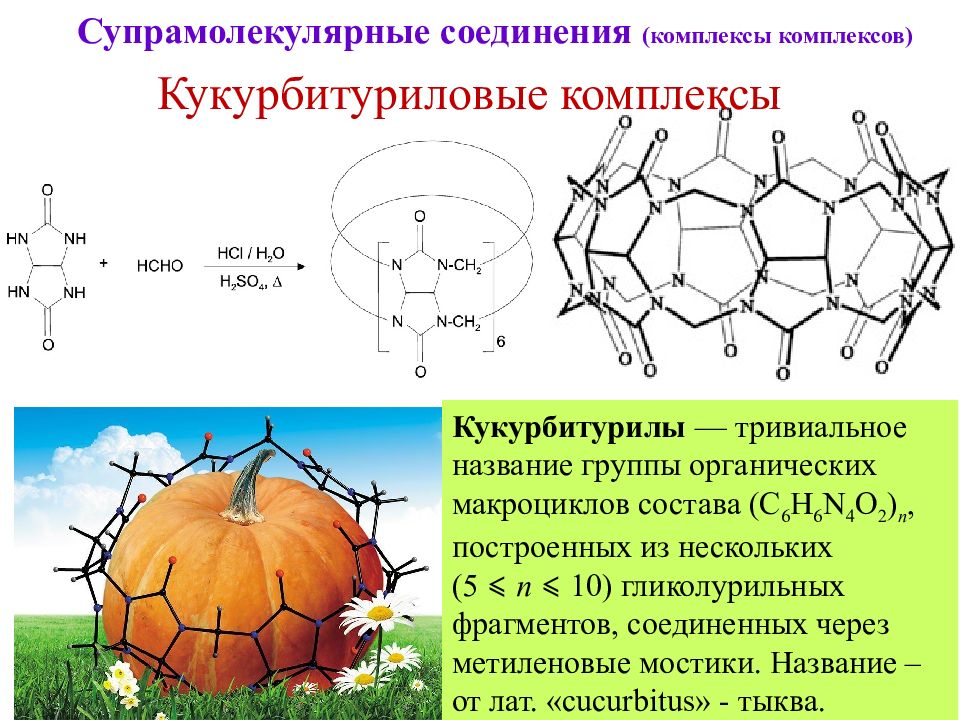
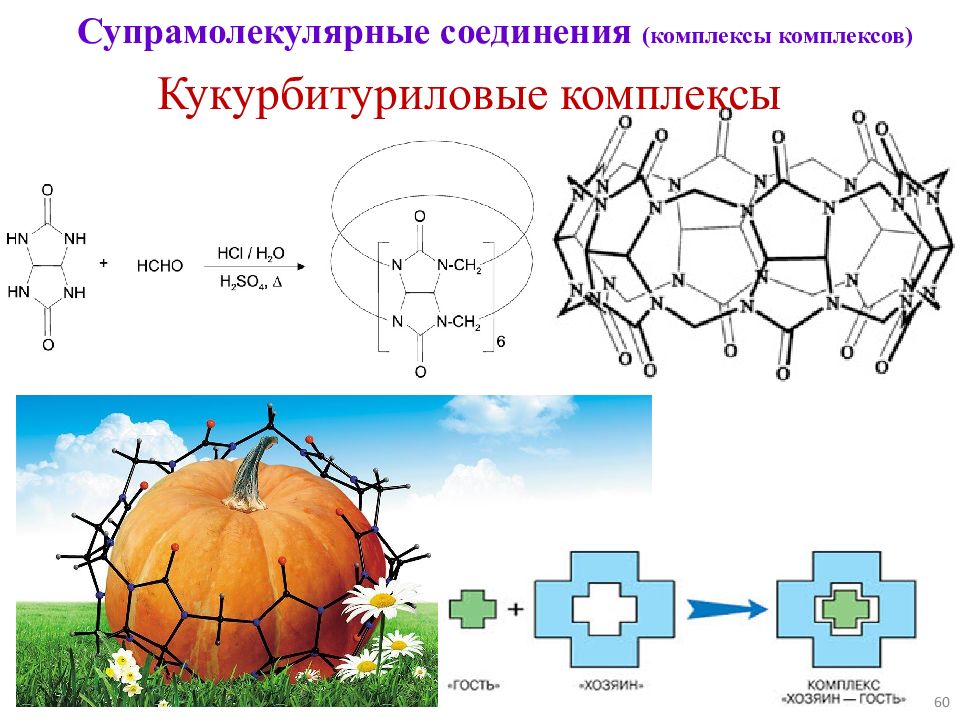
59 Супрамолекулярные соединения (комплексы комплексов) Кукурбитуриловые комплексы Кукурбитурилы — тривиальное название группы органических макроциклов состава (C 6 H 6 N 4 O 2 ) n, построенных из нескольких (5 ⩽ n ⩽ 10) гликолурильных фрагментов, соединенных через метиленовые мостики. Название – от лат. « cucurbitus » - тыква.
Слайд 60
60 Супрамолекулярные соединения (комплексы комплексов) Кукурбитуриловые комплексы
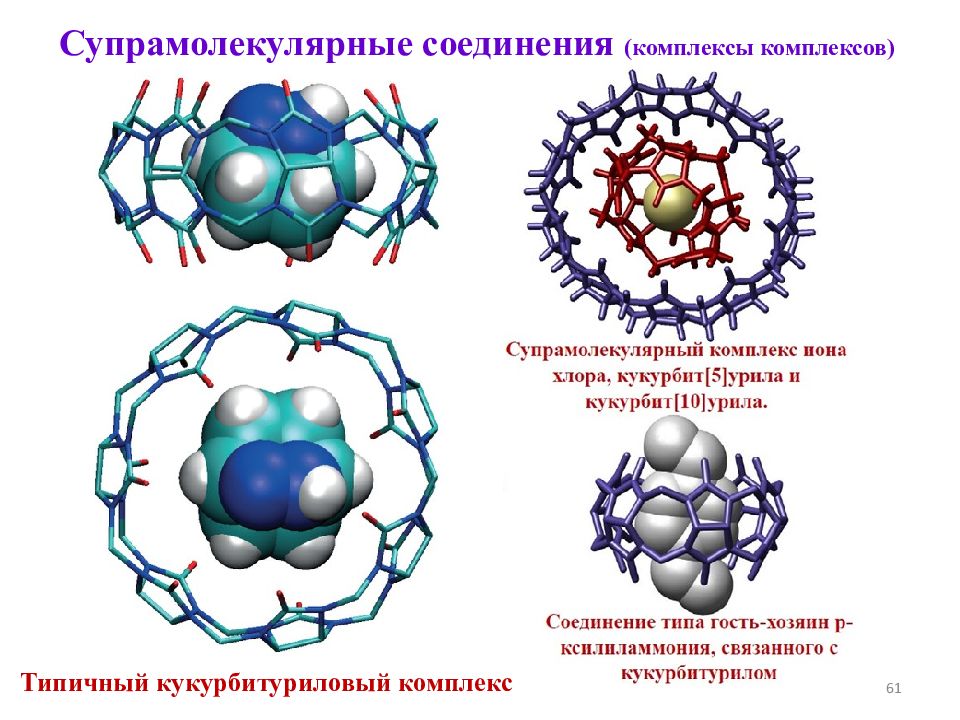
Слайд 61
61 Супрамолекулярные соединения (комплексы комплексов) Типичный кукурбитуриловый комплекс
Последний слайд презентации: Комплексные (координационные) соединения Строение Соединения высшего порядка NH
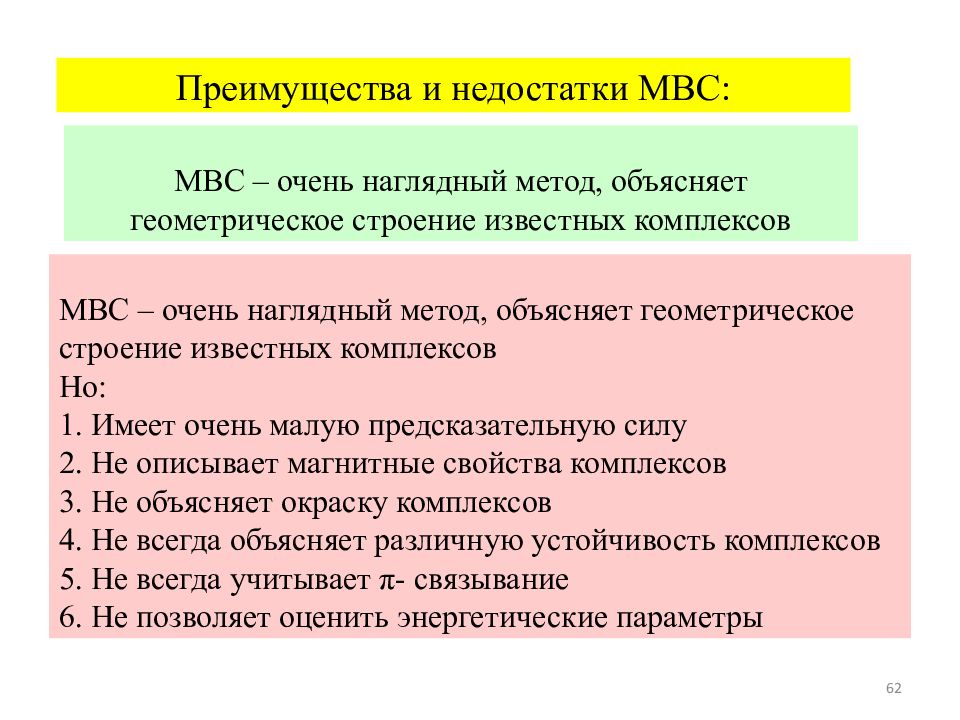
62 МВС – очень наглядный метод, объясняет геометрическое строение известных комплексов Но: 1. Имеет очень малую предсказательную силу 2. Не описывает магнитные свойства комплексов 3. Не объясняет окраску комплексов 4. Не всегда объясняет различную устойчивость комплексов 5. Не всегда учитывает π- связывание 6. Не позволяет оценить энергетические параметры МВС – очень наглядный метод, объясняет геометрическое строение известных комплексов Преимущества и недостатки МВС: