Слайд 2
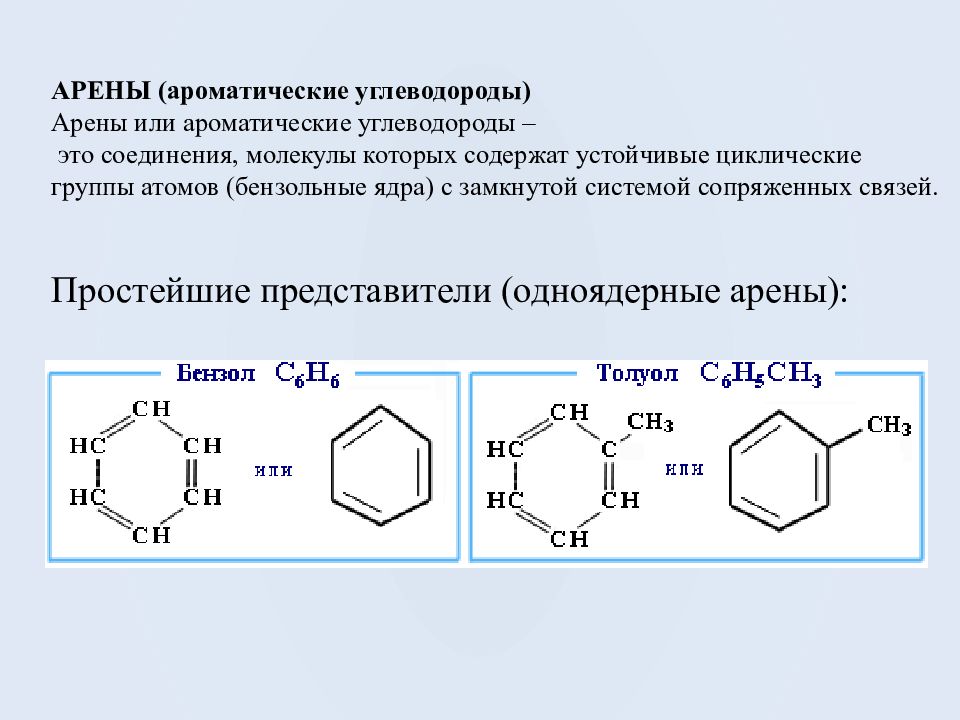
АРЕНЫ (ароматические углеводороды) Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов ( бензольные ядра) с замкнутой системой сопряженных связей. Простейшие представители (одноядерные арены ):
Слайд 4
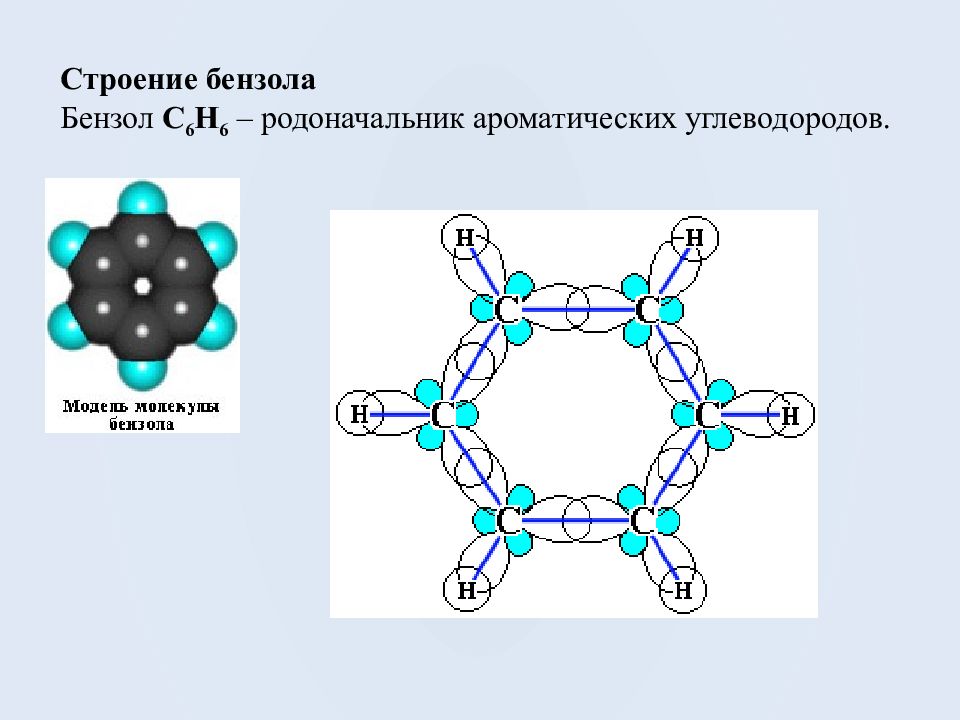
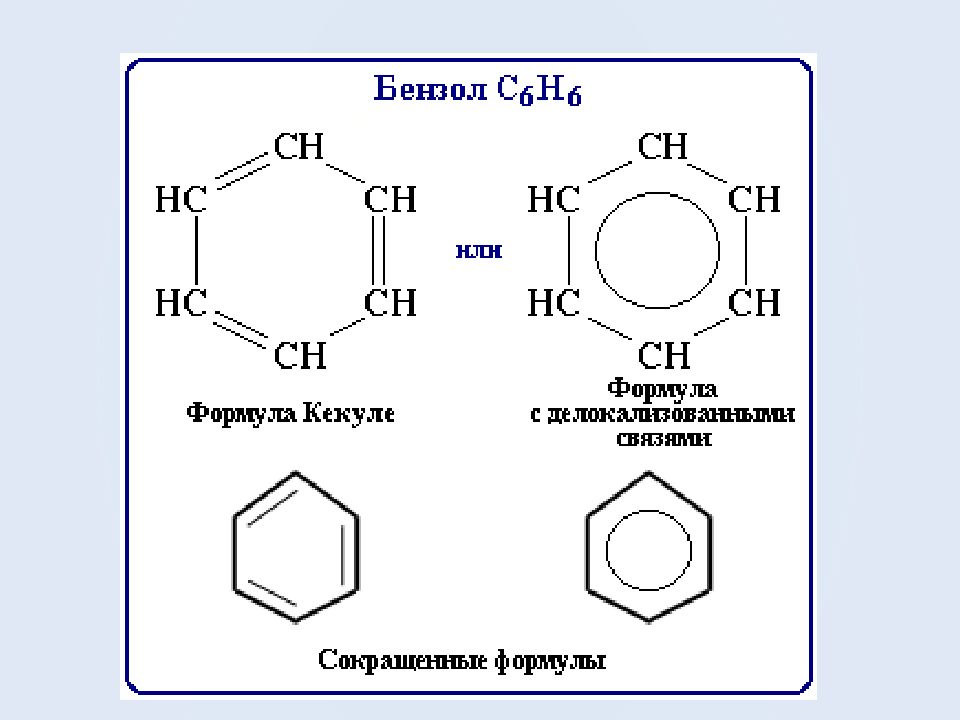
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией π-электронов в циклической системе. Критерии ароматичности аренов : Атомы углерода в sp 2 -гибридизованном состоянии образуют циклическую систему. Атомы углерода располагаются в одной плоскости ( цикл имеет плоское строение). Замкнутая система сопряженных связей содержит 4n+2 π-электронов ( n – целое число). Этим критериям полностью соответствует молекула бензола С 6 Н 6.
Слайд 5
Строение бензола Бензол С 6 Н 6 – родоначальник ароматических углеводородов.
Слайд 8
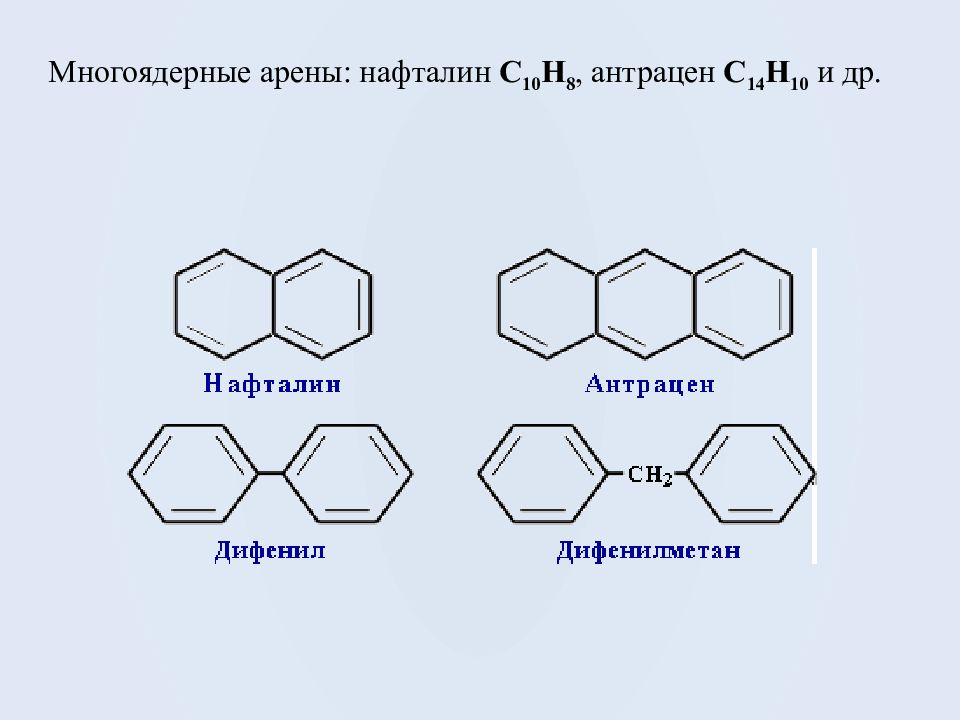
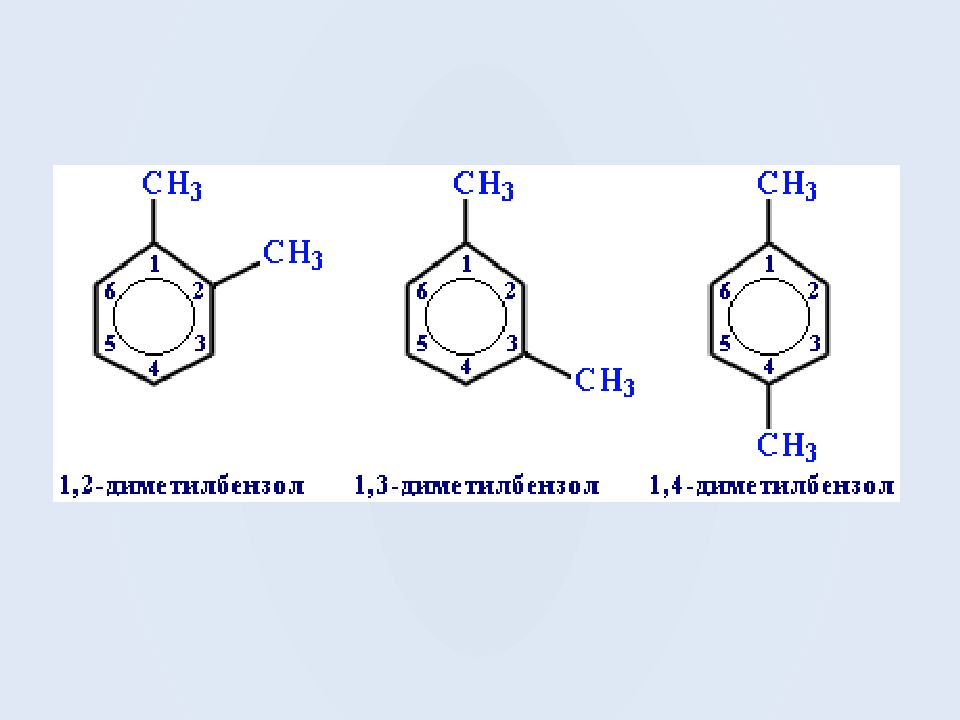
Гомологи бензола. Номенклатура и изомерия Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): Общая формула гомологического ряда бензола C n H 2n-6 ( n ≥ 6 ). Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка ) и слова бензол (корень):
Слайд 10
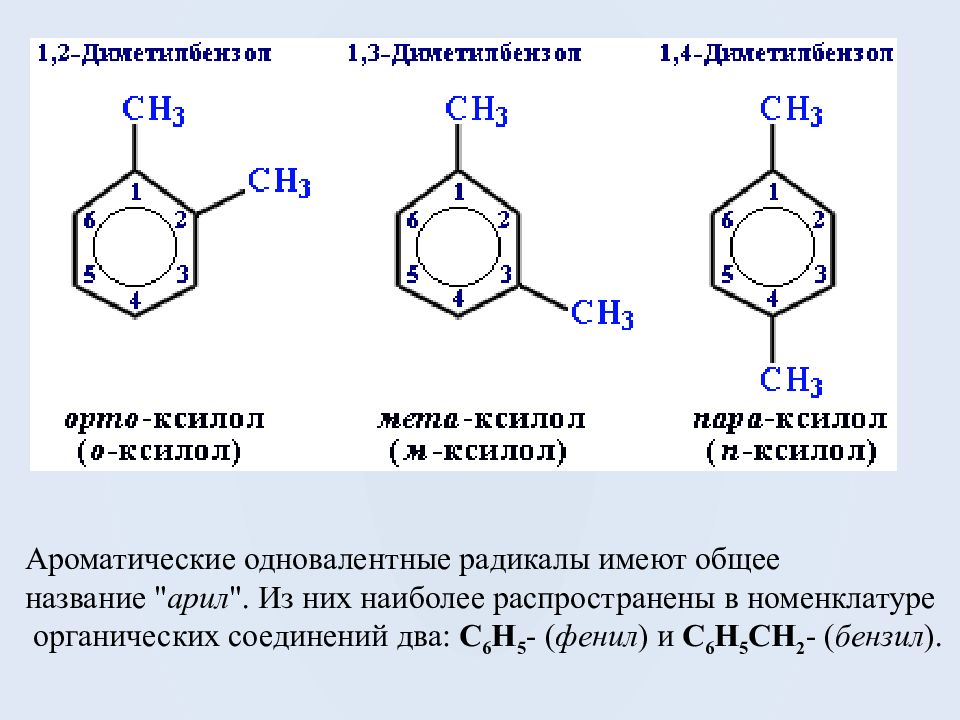
Ароматические одновалентные радикалы имеют общее название " арил ". Из них наиболее распространены в номенклатуре органических соединений два: C 6 H 5 - ( фенил ) и C 6 H 5 CH 2 - ( бензил ).
Слайд 11
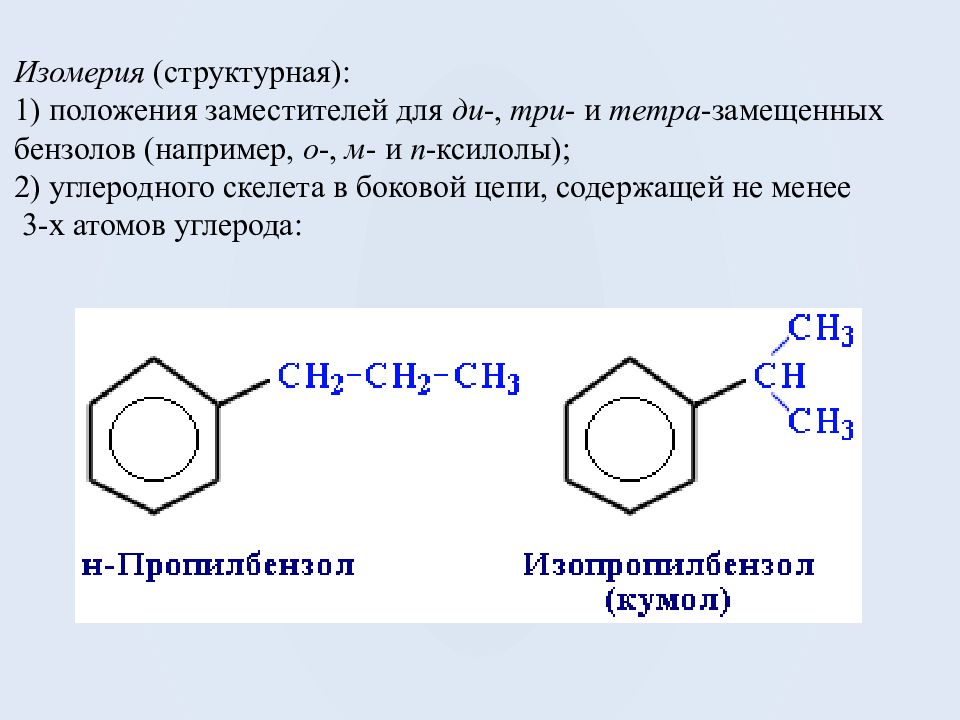
Изомерия (структурная): 1) положения заместителей для ди -, три - и тетра -замещенных бензолов (например, о -, м - и п -ксилолы ); 2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода:
Слайд 12
3) изомерия заместителей R, начиная с R = С 2 Н 5. Например, молекулярной формуле С 8 Н 10 соответствуют 4 изомера: три ксилола CH 3 -C 6 H 4 -CH 3 ( о-, м-, п - ) и этилбензол C 6 H 5 -C 2 H 5. Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.
Слайд 13
Свойства аренов Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкие вещества (см. табл.), нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен ( поражает почки, печень, костный мозг, кровь).
Слайд 15
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Делокализация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность ) бензола и его гомологов. Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности.
Слайд 17
Для аренов более характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Другие реакции ( присоединение, окисление ), в которых участвуют делокализованные углерод-углеродные связи бензольного кольца и нарушается его ароматичность, идут с трудом.
Слайд 18
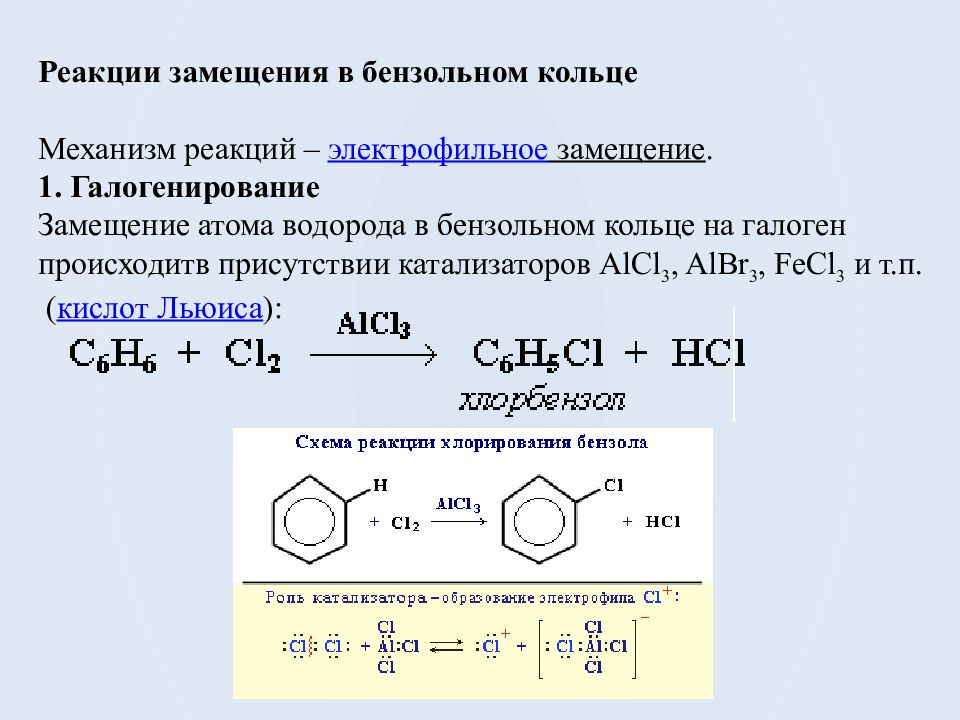
Реакции замещения в бензольном кольце Механизм реакций – электрофильное замещение. 1. Галогенирование Замещение атома водорода в бензольном кольце на галоген происходитв присутствии катализаторов AlCl 3, AlBr 3, FeCl 3 и т.п. ( кислот Льюиса ):
Слайд 20
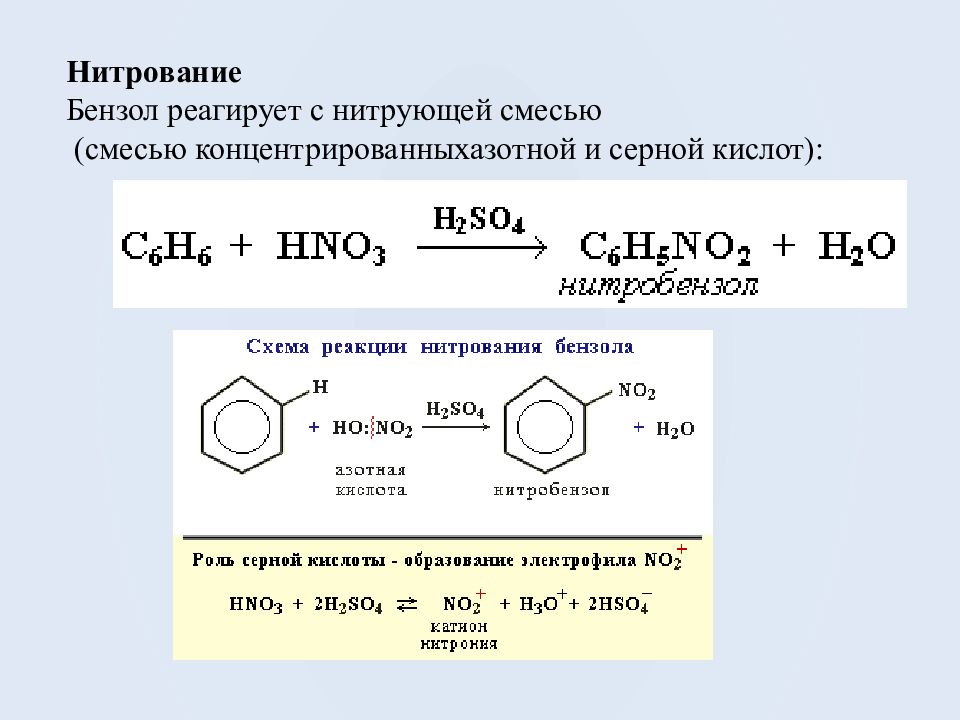
Нитрование Бензол реагирует с нитрующей смесью (смесью концентрированныхазотной и серной кислот):
Слайд 21
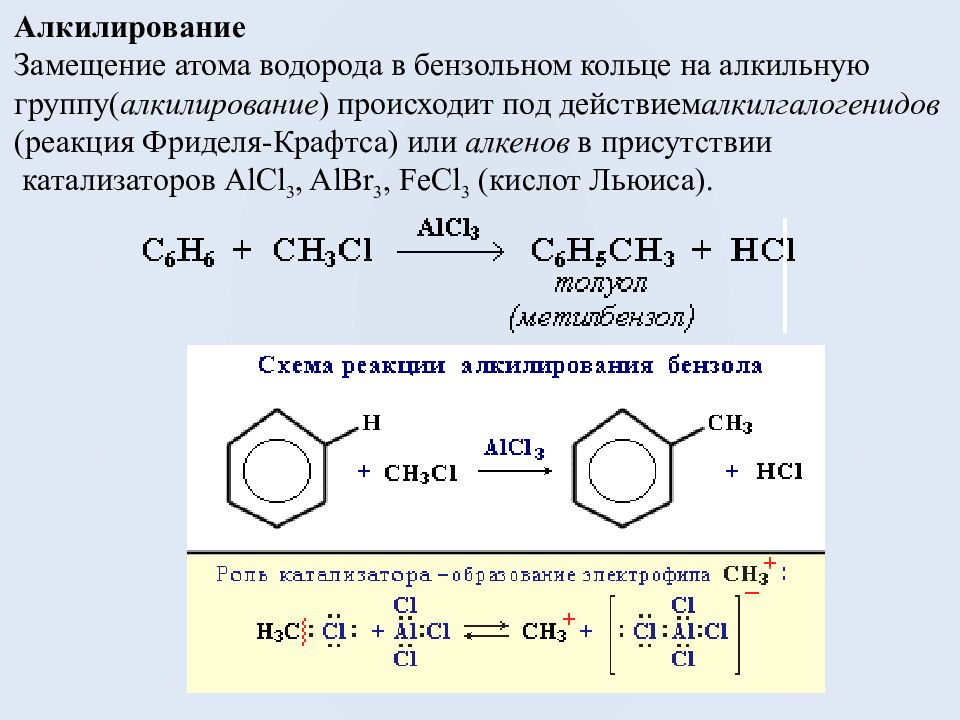
Алкилирование Замещение атома водорода в бензольном кольце на алкильную группу( алкилирование ) происходит под действием алкилгалогенидов ( реакция Фриделя-Крафтса ) или алкенов в присутствии катализаторов AlCl 3, AlBr 3, FeCl 3 (кислот Льюиса).
Слайд 22
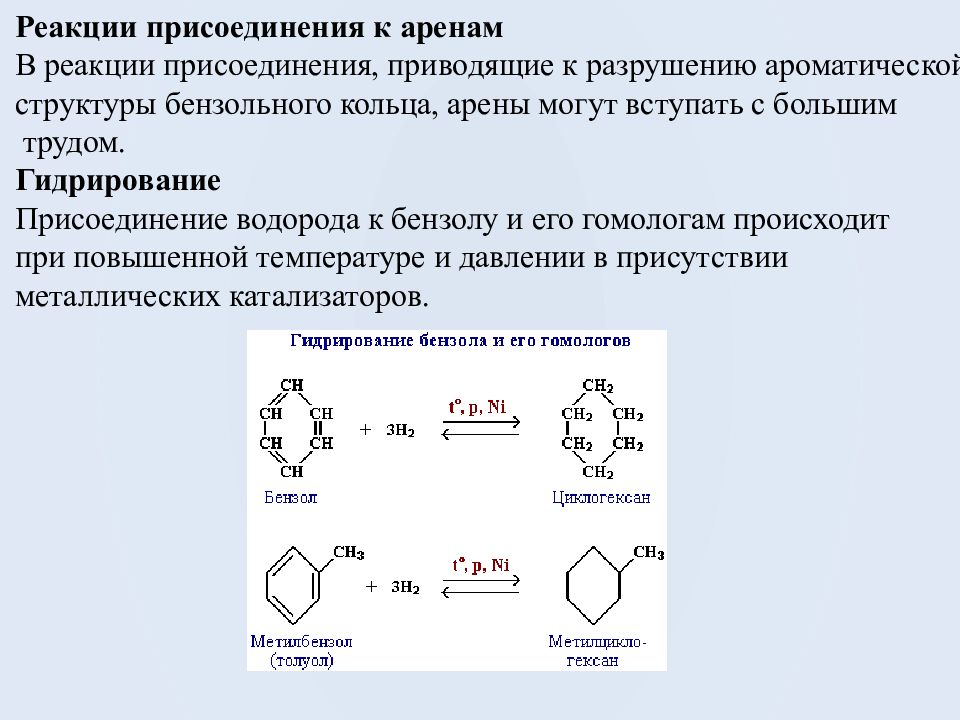
Реакции присоединения к аренам В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом. Гидрирование Присоединение водорода к бензолу и его гомологам происходит при повышенной температуре и давлении в присутствии металлических катализаторов.
Слайд 23
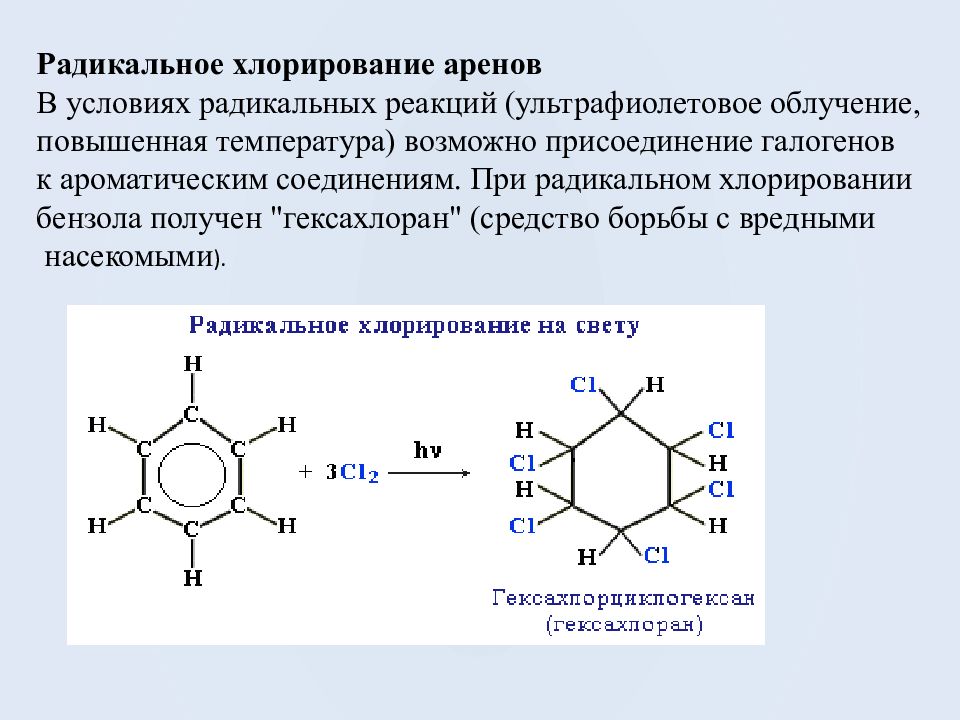
Радикальное хлорирование аренов В условиях радикальных реакций (ультрафиолетовое облучение, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. При радикальном хлорировании бензола получен "гексахлоран" (средство борьбы с вредными насекомыми ).
Слайд 24
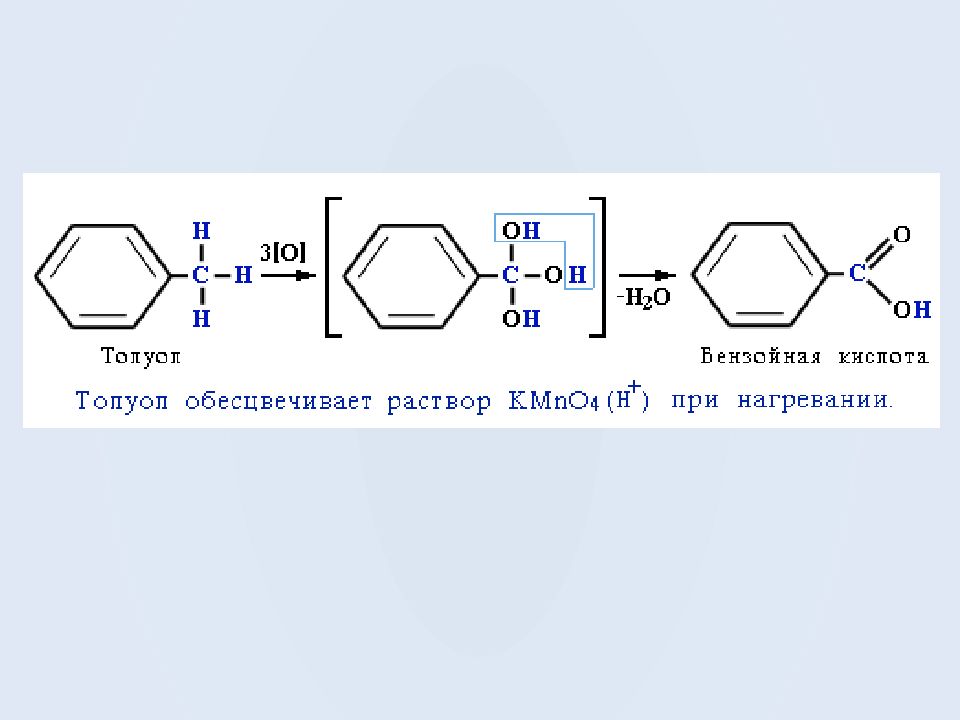
Реакции окисления аренов Бензол не окисляется даже под действием сильных окислителей ( KMnO 4, K 2 Cr 2 O 7 и т.п.). Поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко. При действии раствора KMnO 4 в кислой среде и нагревании в гомологах бензола окислению подвергаются только боковые цепи:
Слайд 26
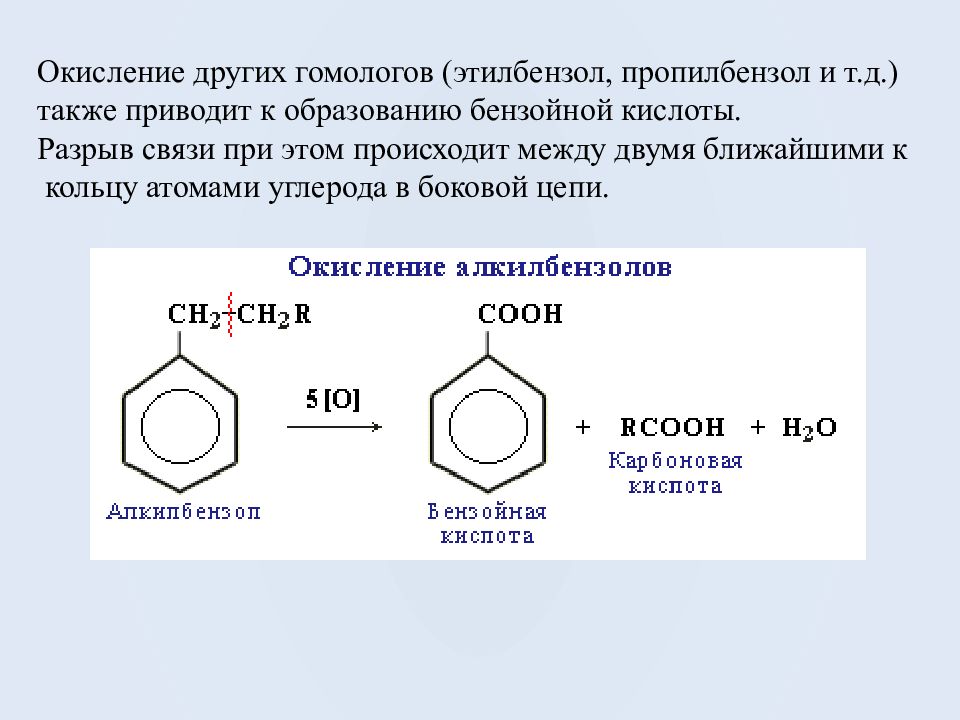
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи.
Слайд 27
Бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах: Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
Слайд 28
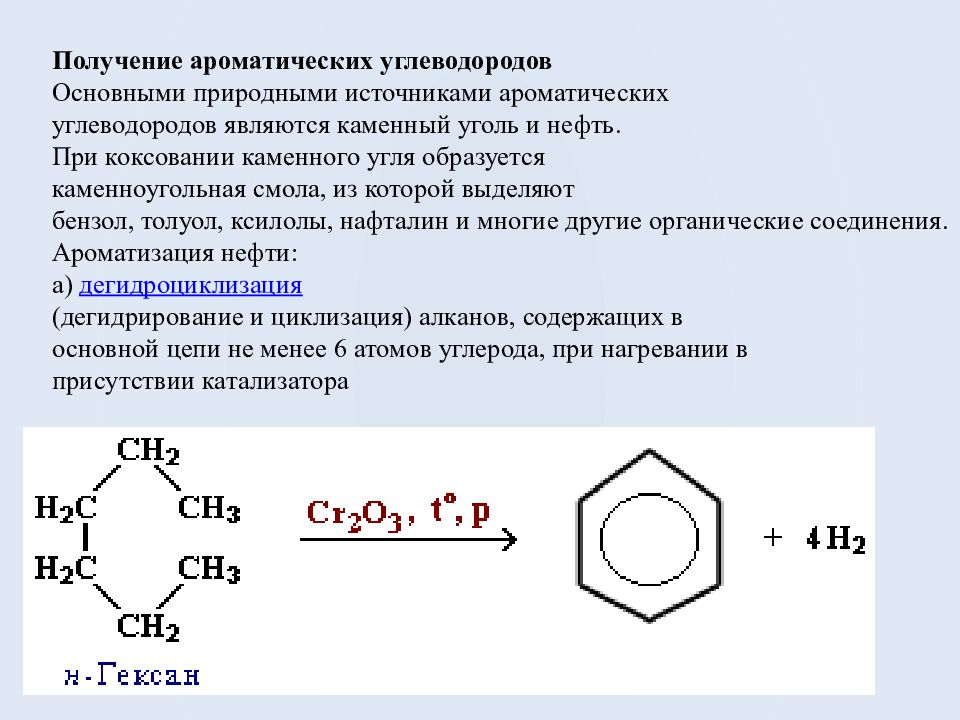
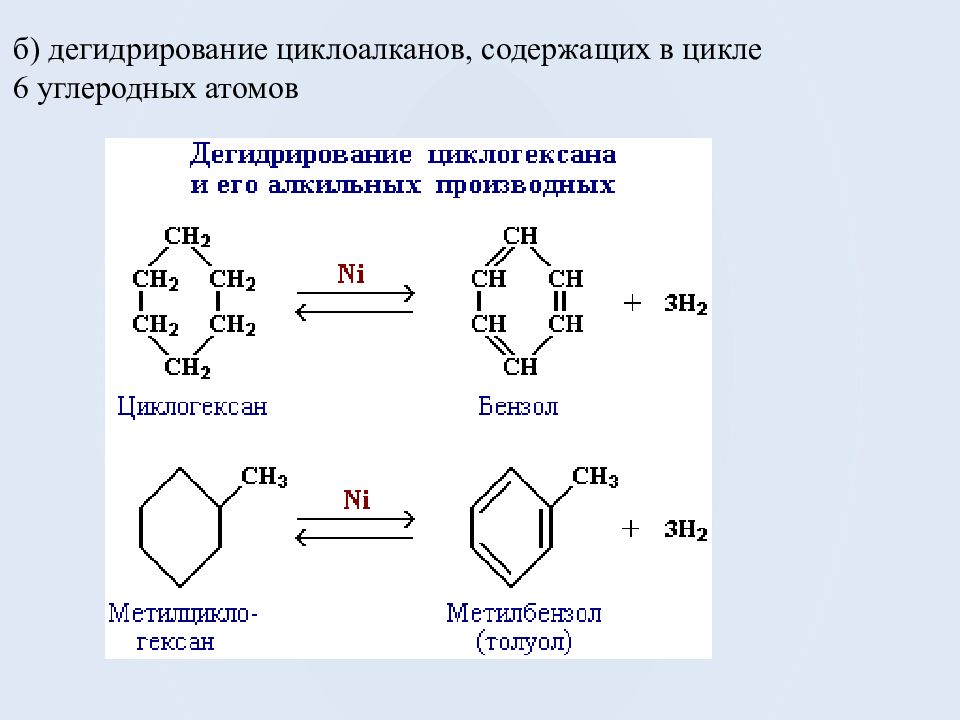
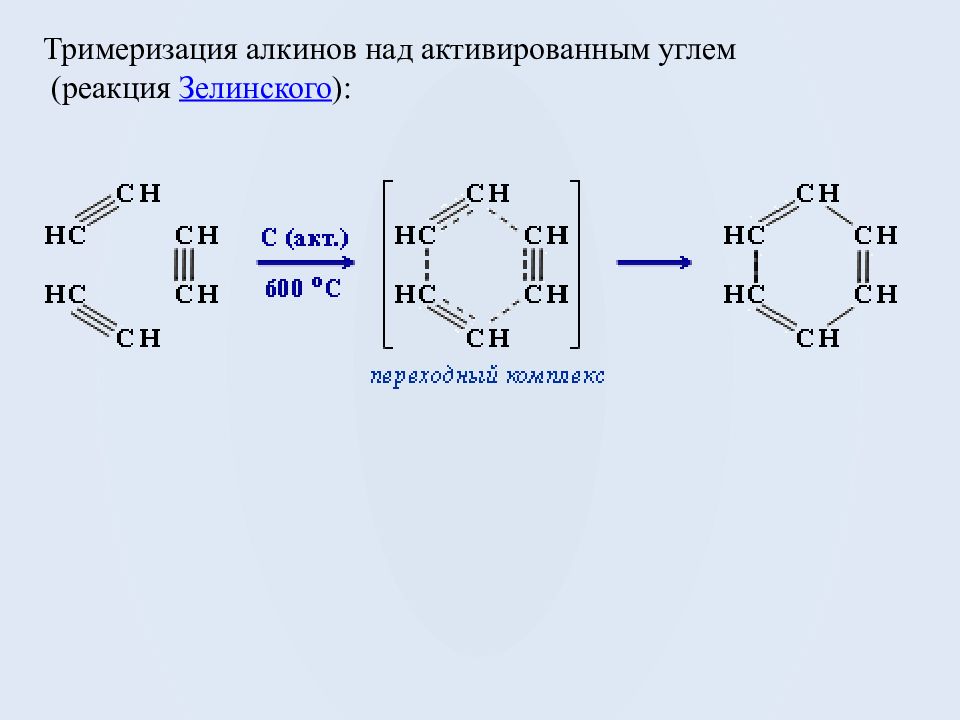
Получение ароматических углеводородов Основными природными источниками ароматических углеводородов являются каменный уголь и нефть. При коксовании каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения. Ароматизация нефти : а ) дегидроциклизация ( дегидрирование и циклизация) алканов, содержащих в основной цепи не менее 6 атомов углерода, при нагревании в присутствии катализатора
Слайд 31
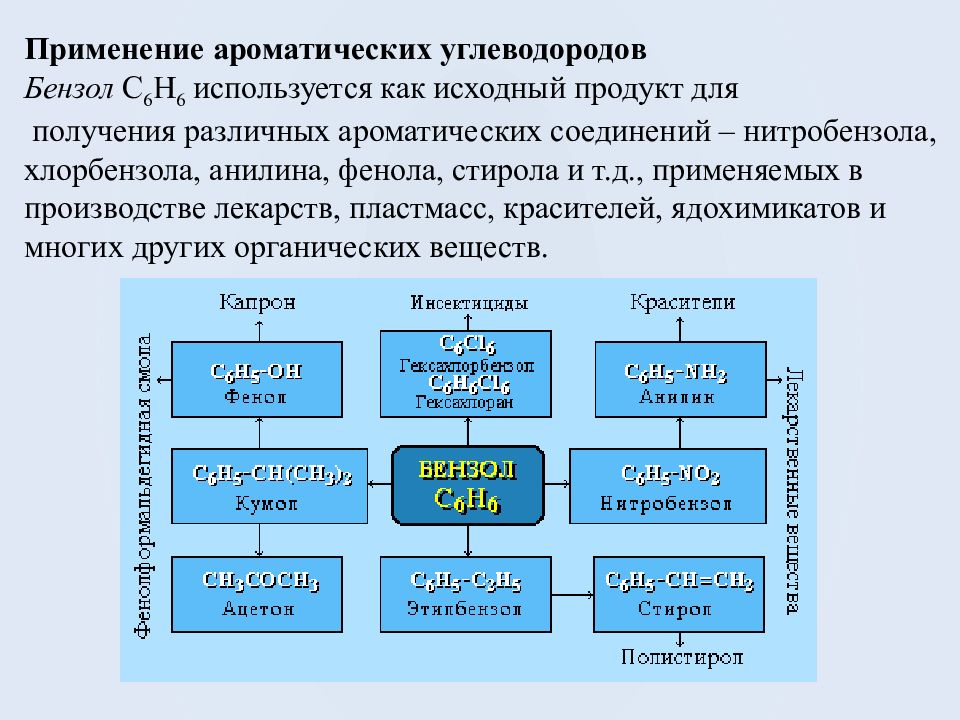
Применение ароматических углеводородов Бензол С 6 Н 6 используется как исходный продукт для получения различных ароматических соединений – нитробензола, хлорбензола, анилина, фенола, стирола и т.д., применяемых в производстве лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ.