Первый слайд презентации: Арены Бензол
Слайд 2: Запишите уравнения реакций:
1 вариант бутан бутен бутадиен 1,3 1,4-дибромбутен-2. Получение этина. 2 вариант 1.Пропен пропин хлор-пропен дихлорпропан. 2. Горение ацетилена. Почему ацетилен горит сильно коптящим пламенем?
Слайд 4
Среди 18 миллионов известных на сегодняшний день органических соединений немного найдется таких, который повлияли бы на развитие органической химии сильнее, чем бензол. Полученный впервые в 1825 году, он более века был постоянной головной болью химиков. Сначала не могли понять как выглядит молекула бензола. Потом десятилетиями пытались объяснить его уникальные свойства. За сто лет, прошедших после его открытия ему было посвящено более 1300 статей.
Слайд 5: История открытия
Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно-угольной смолы. Но ни названия вещество не получило, ни состав его не был известен.
Слайд 6: Второе рождение
Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа.
Слайд 7: Новое получение
В 1833 году немецкий физико-химик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
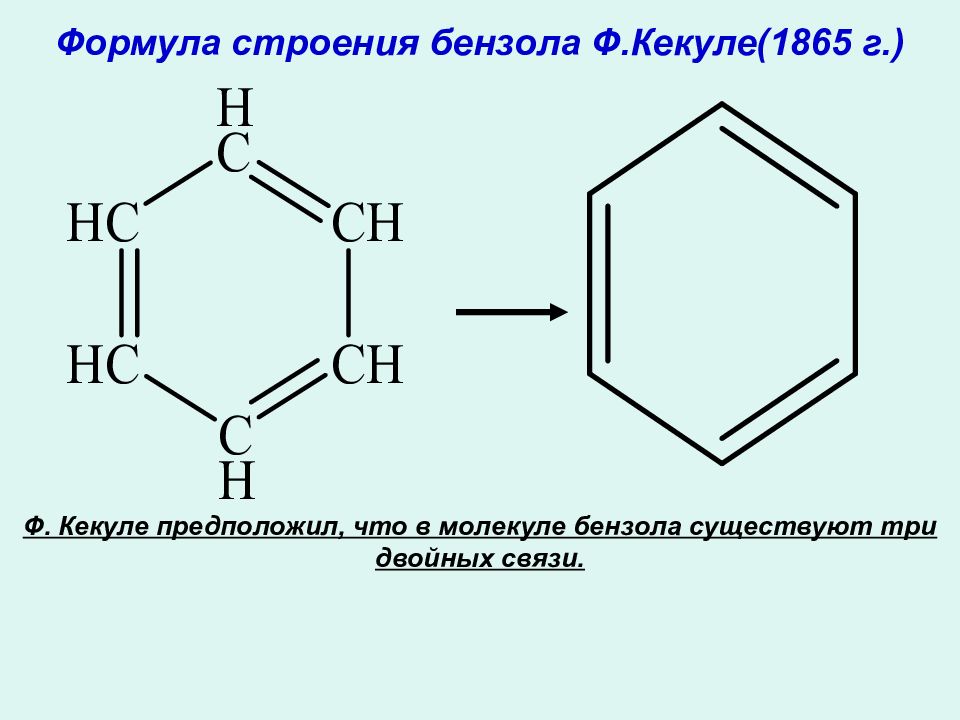
Слайд 8: Фридрих Кекуле
Фридрих Август Кекуле фон Штрадониц ( нем. Friedrich August Kekulé von Stradonitz, 7 сентября 1829, Дармштадт — 13 июля 1896, Бонн ) — немецкий химик -органик, создатель теории валентности.
Ф. Кекуле предположил, что в молекуле бензола существуют три двойных связи.
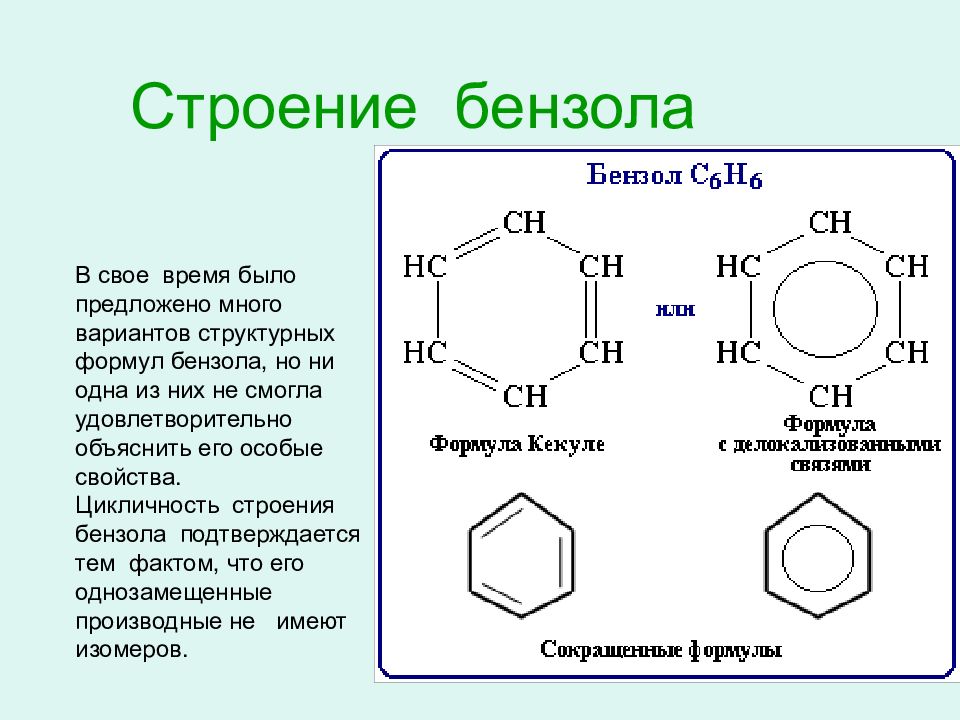
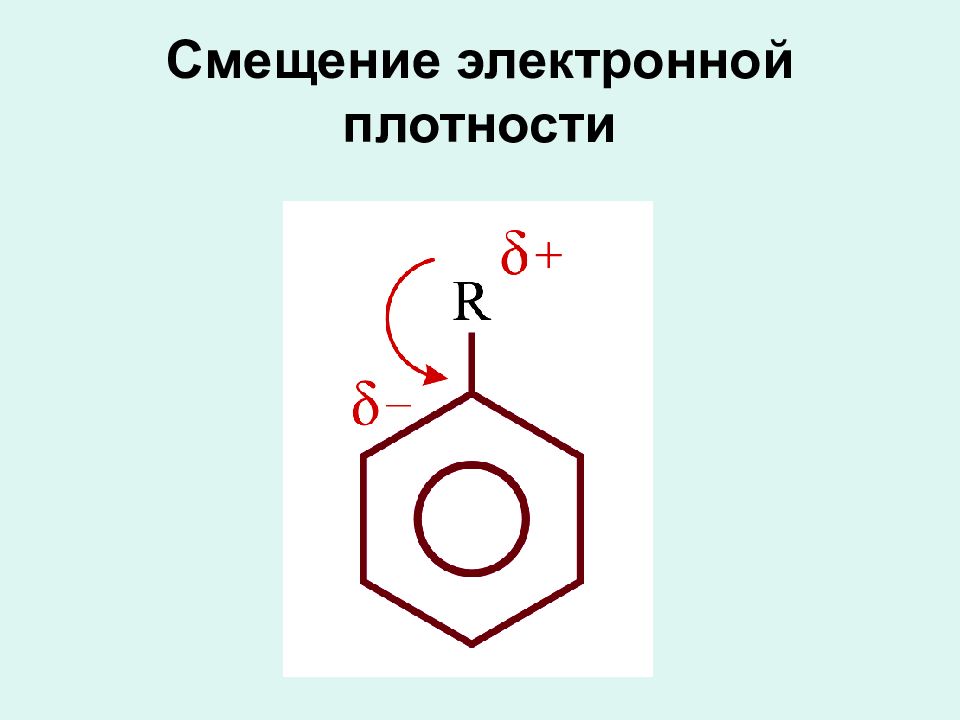
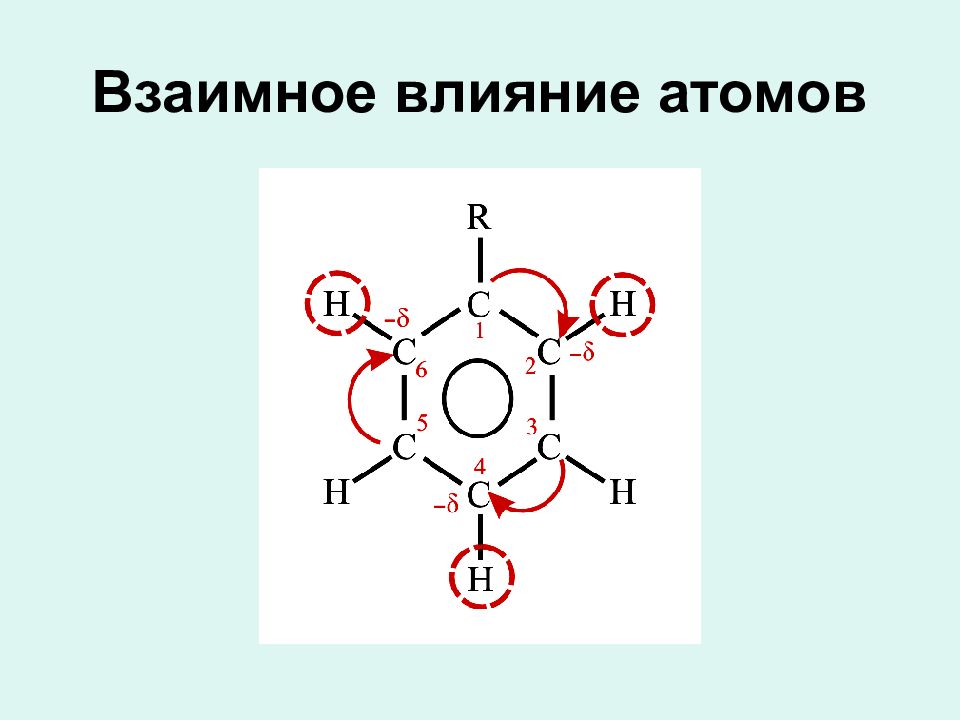
Слайд 10: Строение бензола
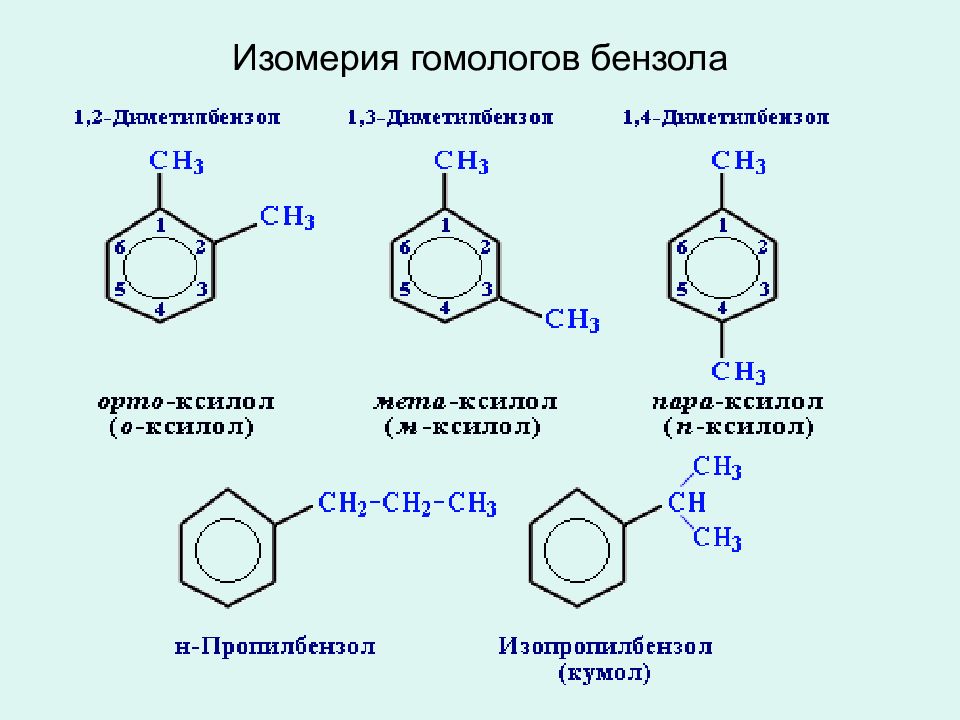
В свое время было предложено много вариантов структурных формул бензола, но ни одна из них не смогла удовлетворительно объяснить его особые свойства. Цикличность строения бензола подтверждается тем фактом, что его однозамещенные производные не имеют изомеров.
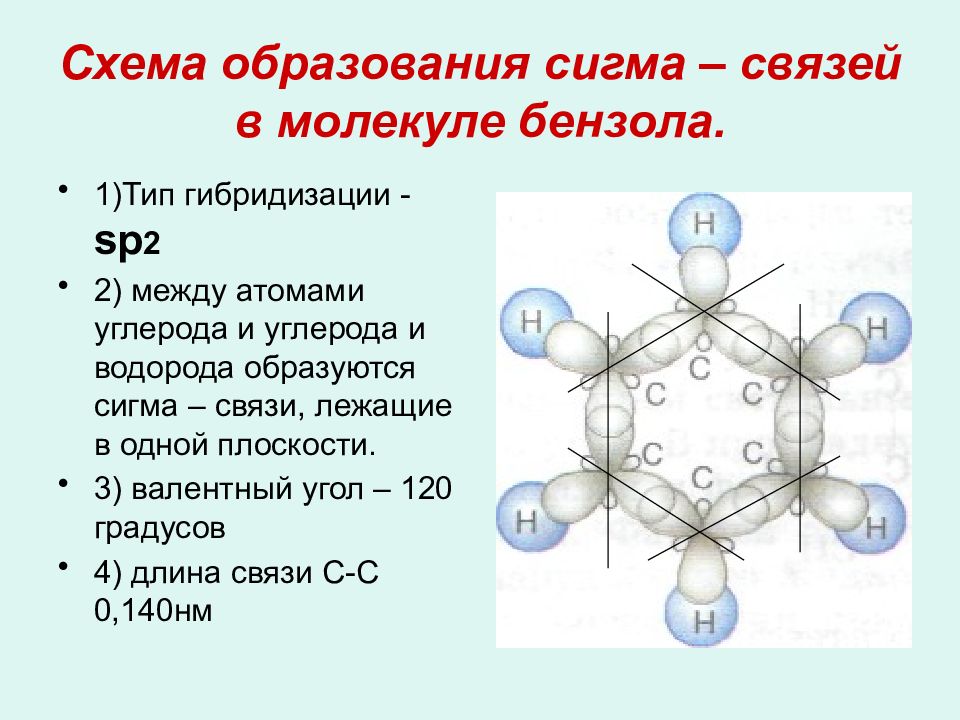
Слайд 11: Схема образования сигма – связей в молекуле бензола
1)Тип гибридизации - s р 2 2) между атомами углерода и углерода и водорода образуются сигма – связи, лежащие в одной плоскости. 3) валентный угол – 120 градусов 4) длина связи С-С 0,140нм
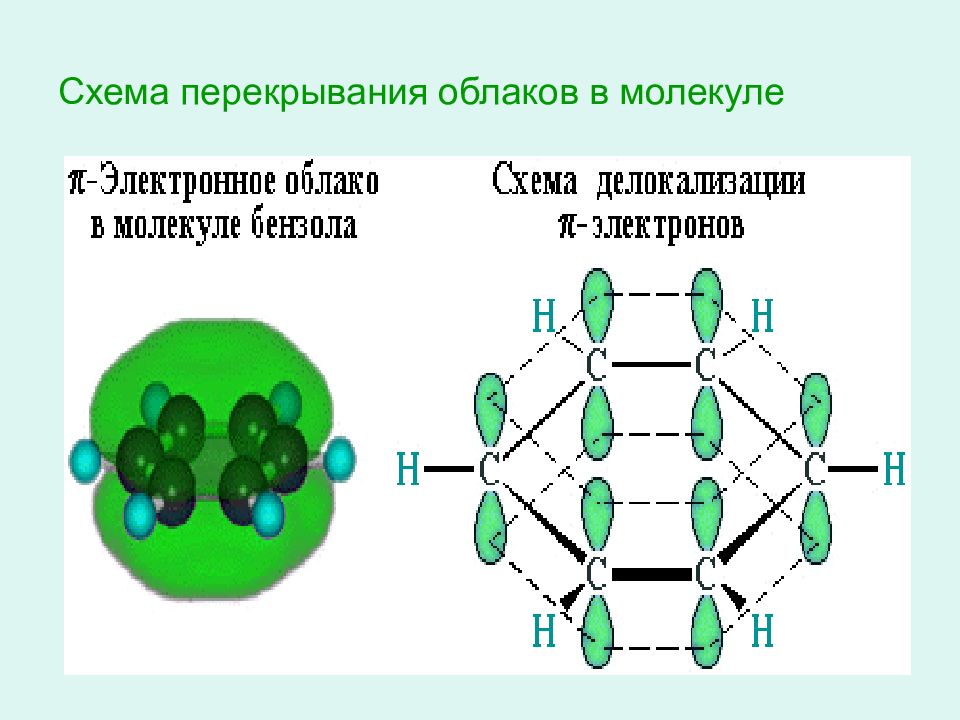
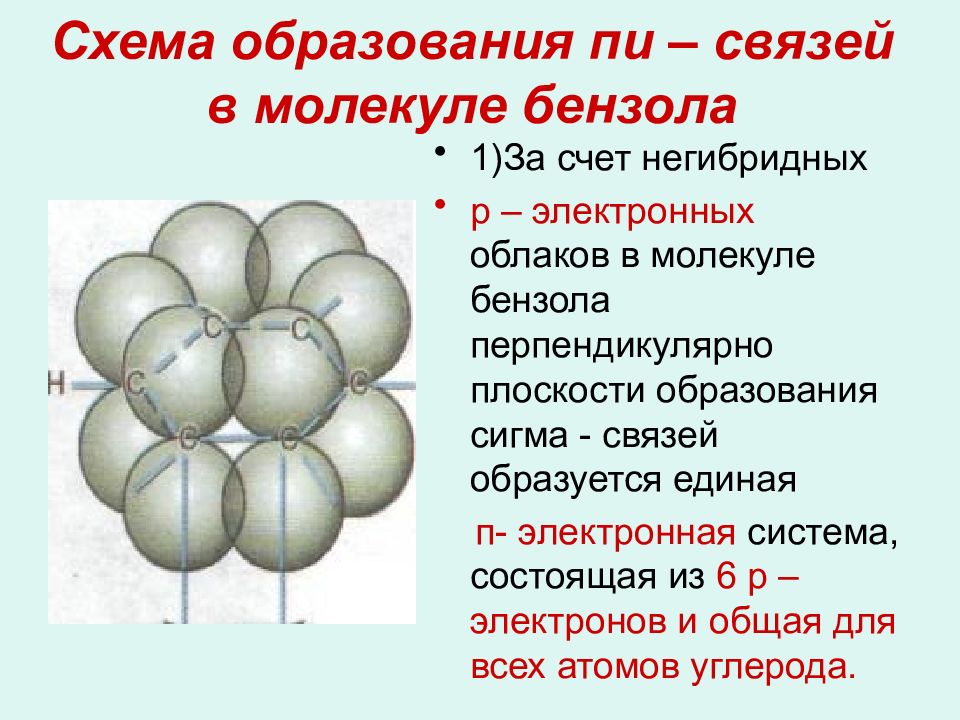
Слайд 13: Схема образования пи – связей в молекуле бензола
1)За счет негибридных р – электронных облаков в молекуле бензола перпендикулярно плоскости образования сигма - связей образуется единая п- электронная система, состоящая из 6 р – электронов и общая для всех атомов углерода.
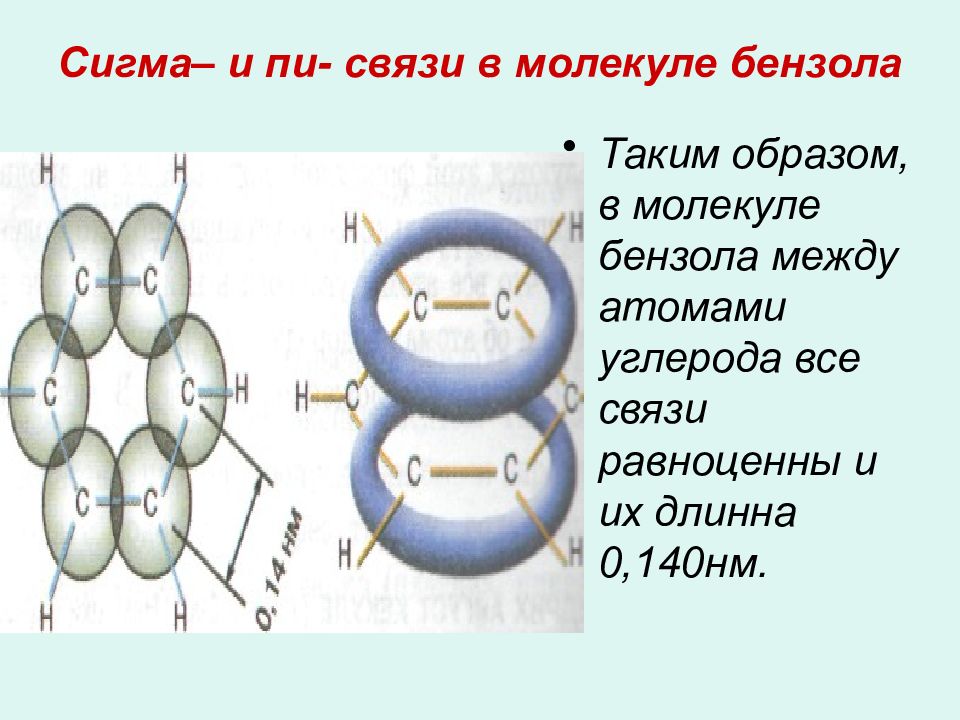
Слайд 14: Сигма– и пи- связи в молекуле бензола
Таким образом, в молекуле бензола между атомами углерода все связи равноценны и их длинна 0,140нм.
Слайд 15: Квантовомеханическая теория и молекула бензола
Немецкий химик Э. Хюккель применил к ароматическим соединениям квантовомеханическую теорию и показал, что шесть π -электронов молекулы бензола располагаются в плоскости, перпендикулярной плоскости молекулы, взаимно перекрываются и образуют замкнутое электронное облако.
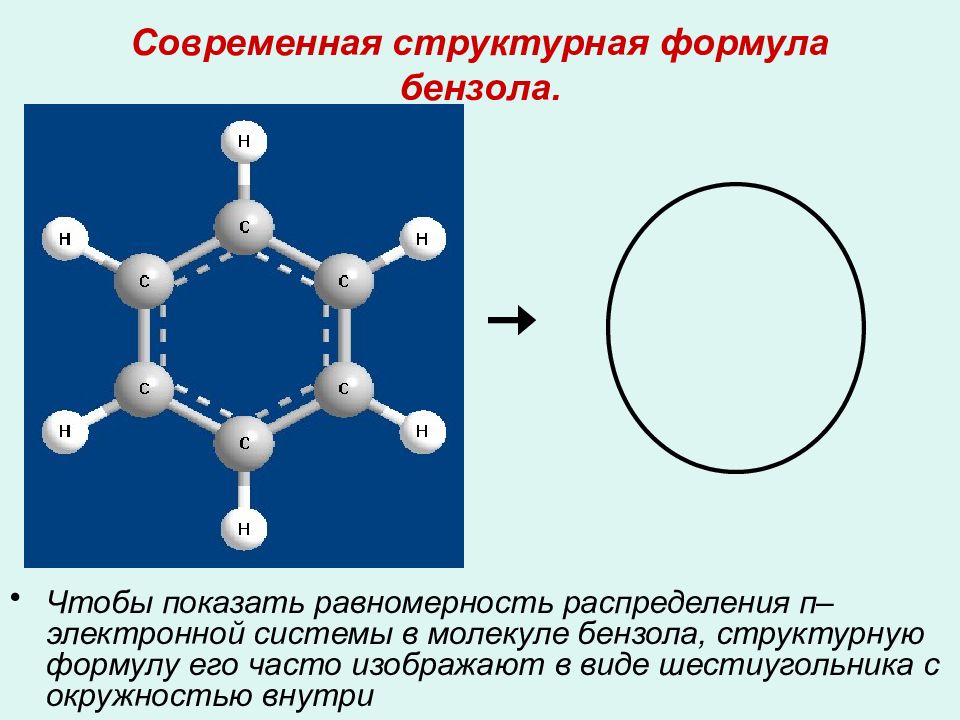
Слайд 16: Современная структурная формула бензола
Чтобы показать равномерность распределения п–электронной системы в молекуле бензола, структурную формулу его часто изображают в виде шестиугольника с окружностью внутри
Слайд 17: Современная структурная формула бензола
Сочетание шести сигма – связей с единой п – системой называется ароматической связью Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом или бензольным ядром.
Слайд 22: Получение
Бензол получают из каменноугольной смолы, образующейся при коксовании угля. В настоящее время бензол получают из нефти. Бензол получают синтетическими методами.
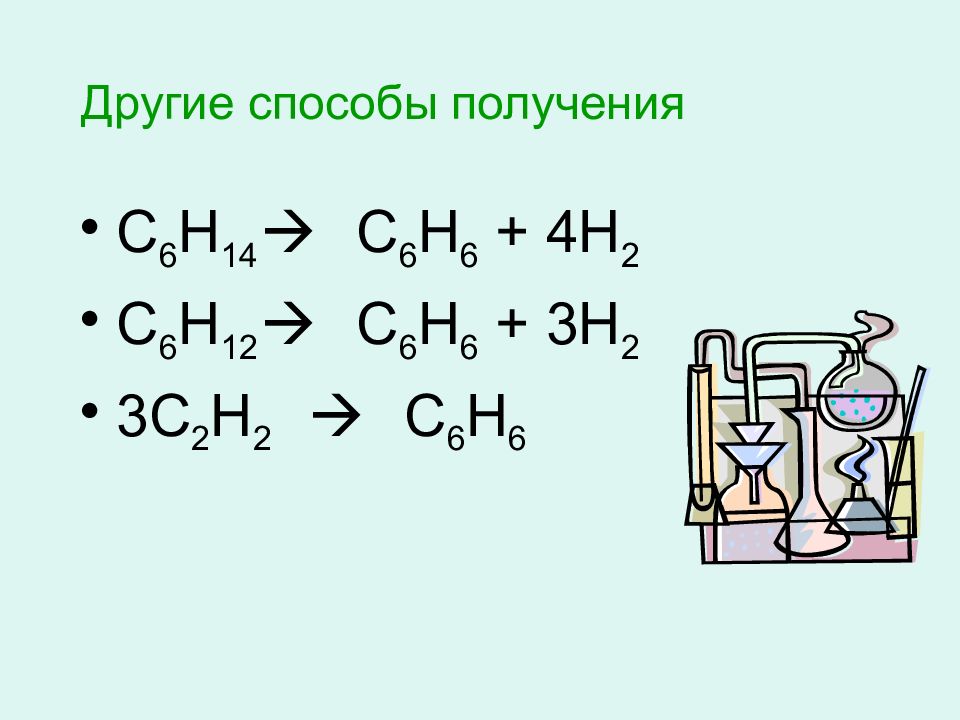
Слайд 23: Другие способы получения
С 6 Н 14 С 6 Н 6 + 4Н 2 С 6 Н 12 С 6 Н 6 + 3Н 2 3С 2 Н 2 С 6 Н 6
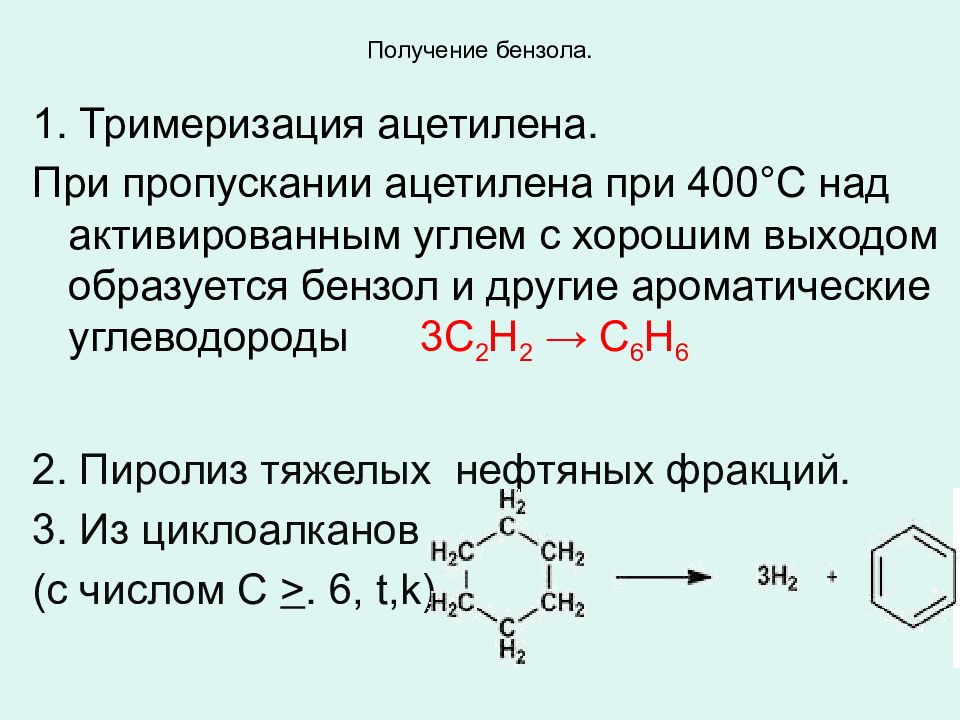
Слайд 24: Получение бензола
1. Тримеризация ацетилена. При пропускании ацетилена при 400°C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды 3С 2 Н 2 → С 6 H 6 2. Пиролиз тяжелых нефтяных фракций. 3. Из циклоалканов (с числом С >. 6, t,k )
Слайд 25: Природные источники получения :
Природные и попутные газы Нефть Каменный уголь
Слайд 26: Физические свойства
Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения +80 º С и температурой плавления + 5 º С. Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней. Пары бензола с воздухом образуют взрывчатую смесь.
Слайд 27: Физические свойства
Бесцветная жидкость со своеобразным резким запахом. Температура плавления 5,5 °C, температура кипения 80,1 °C, плотность 0,879 г/см³, молярная масса 78,11 г/моль. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями. Растворимость в воде 1,79 г/л (при 25 °C).
Слайд 28: Предельным или непредельным должен быть бензол?
По формуле С 6 Н 6 – непредельный. А по химическим свойствам?
Слайд 29: Химические свойства бензола
Реакции присоединения гидрирование хлорирование Реакции замещения по бензольному кольцу бромирование нитрование алкилирование
Слайд 30: Бензол и бромная вода
Бензол и перманганат калия Предельный или непредельный?
Слайд 31: Предельный или непредельный?
Если непредельный,… то почему не обесцвечивает бромную воду?
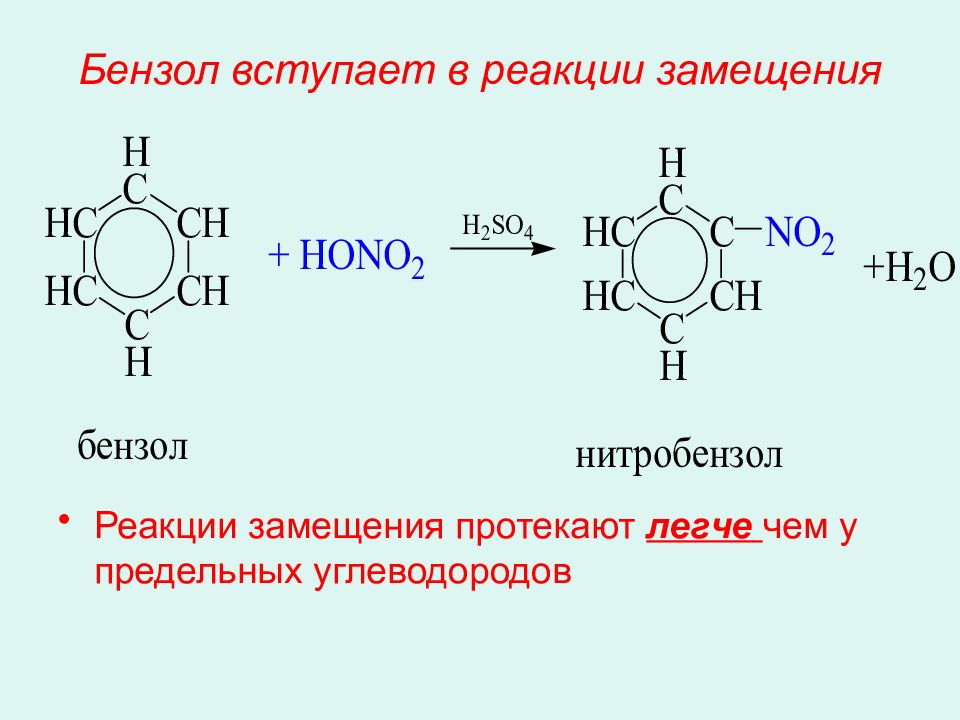
Слайд 32: Бензол вступает в реакции замещения
Реакции замещения протекают легче чем у предельных углеводородов
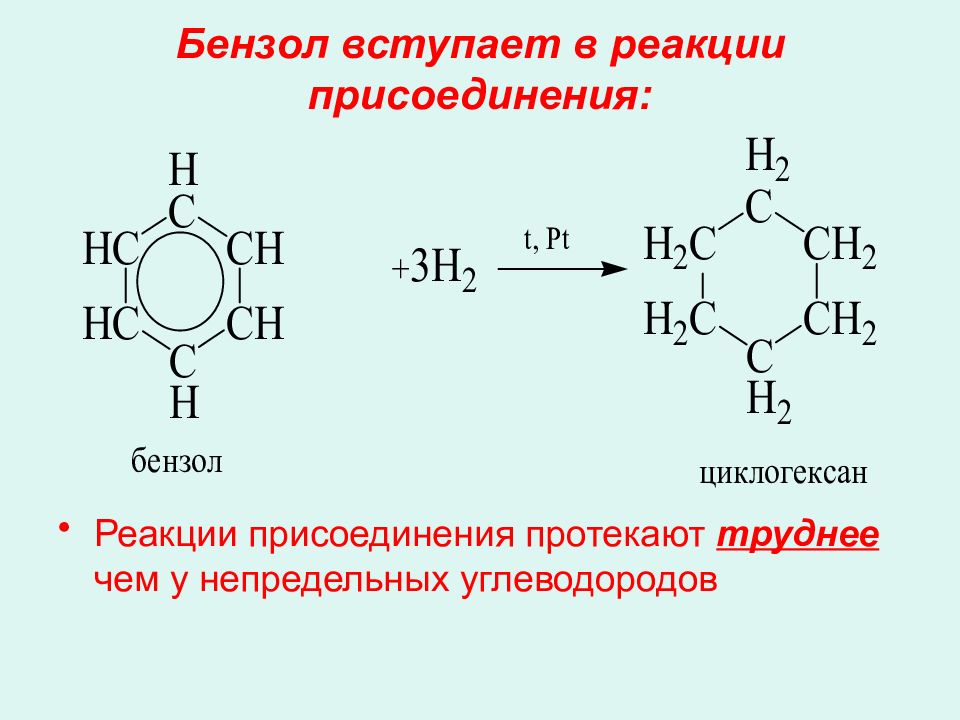
Слайд 33: Бензол вступает в реакции присоединения:
Реакции присоединения протекают труднее чем у непредельных углеводородов
Слайд 34: Химические свойства
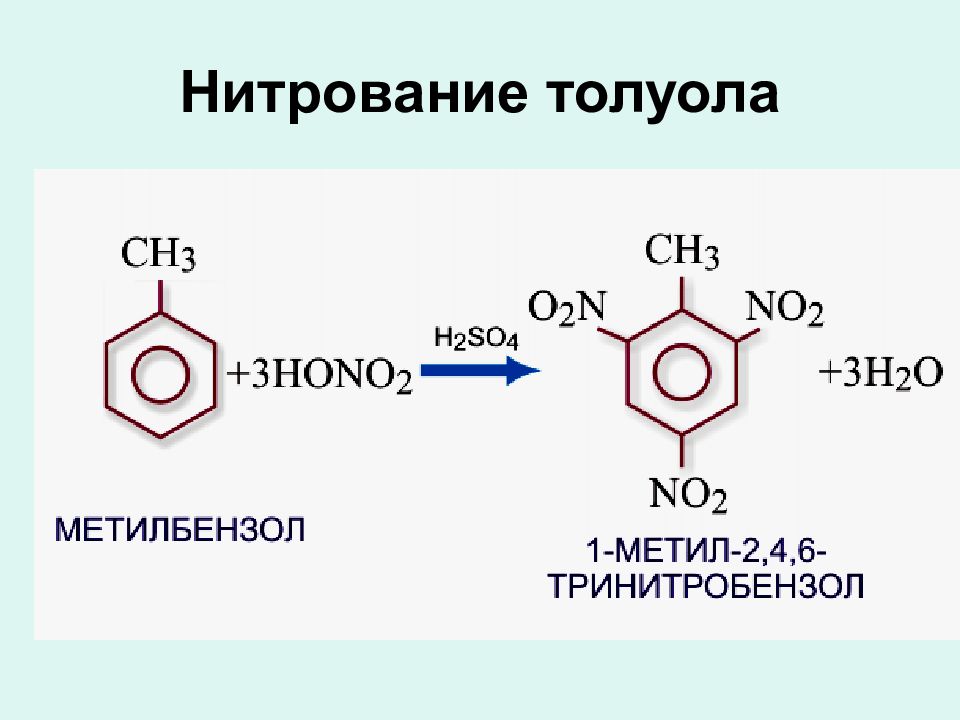
1.Горение бензола: 2С 6 Н 6 + 15О 2 = 12СО 2 + 6Н 2 О 2. Реакция замещения: С 6 Н 6 + Br 2 C 6 H 5 Br + HBr 3. Нитрование: С 6 Н 6 + НО N О 2 С 6 Н 5 N О 2 + Н 2 О 4. Гидрирование: С 6 Н 6 + 3Н 2 С 6 Н 12 5. Хлорирование: С 6 Н 6 + 3 Cl 2 C 6 H 6 Cl 6
Слайд 35
4. Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя-Крафтса ) в присутствии AlCl 3 : С 6 H 6 + С 2 H 5 Cl → С 6 H 5 С 2 H 5 + HCl образуется этилбензол 5. Реакция нитрования в присутствии конц серной кислоты С 6 H 6 + HNO 3 → С 6 H 5 NO 2 + H 2 O образуется нитробенол.
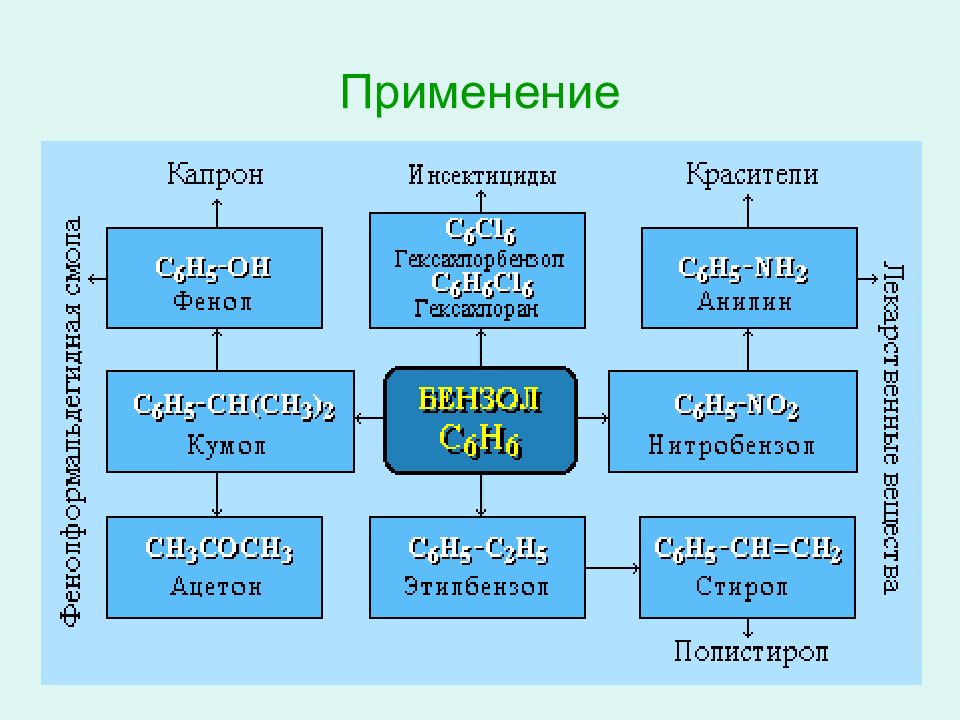
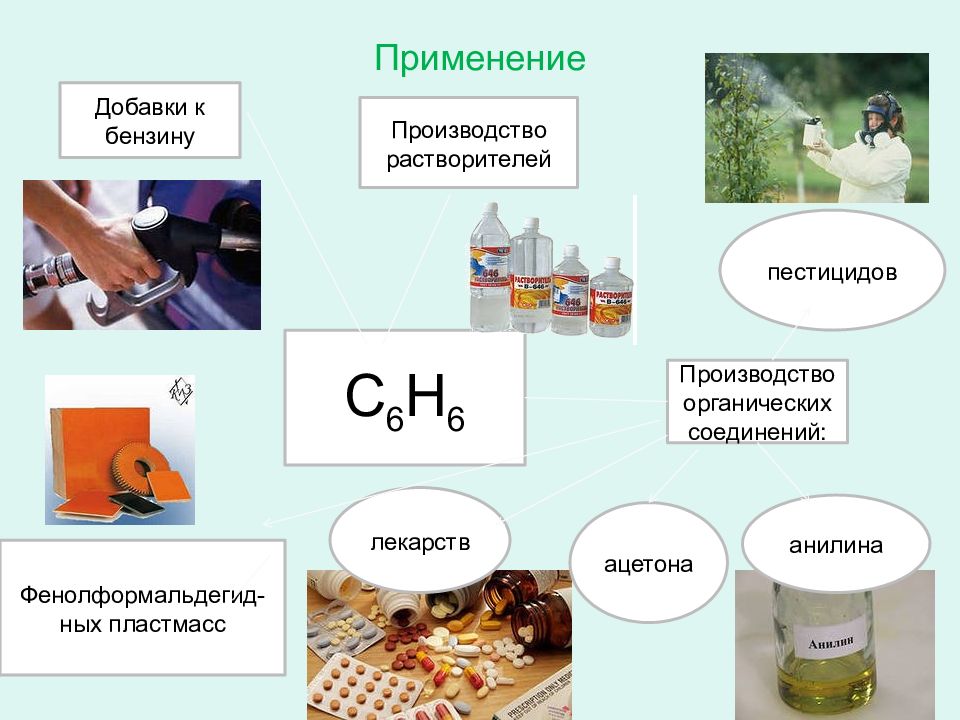
Слайд 37: Применение
С 6 Н 6 Добавки к бензину Производство растворителей Производство органических соединений: ацетона анилина пестицидов лекарств Фенолформальдегид - ных пластмасс
Слайд 38
Бензол необходим не только теоретикам, но и практикам: из него делают лекарства, красители, взрывчатые вещества. Аспирин, ванилин и множество других производных бензола прочно вошли в нашу повседневную жизнь.
Слайд 47: Основными источниками углеводородов являются газообразные вещества – горючие природные и попутные газы, газы переработки нефти и каменного угля
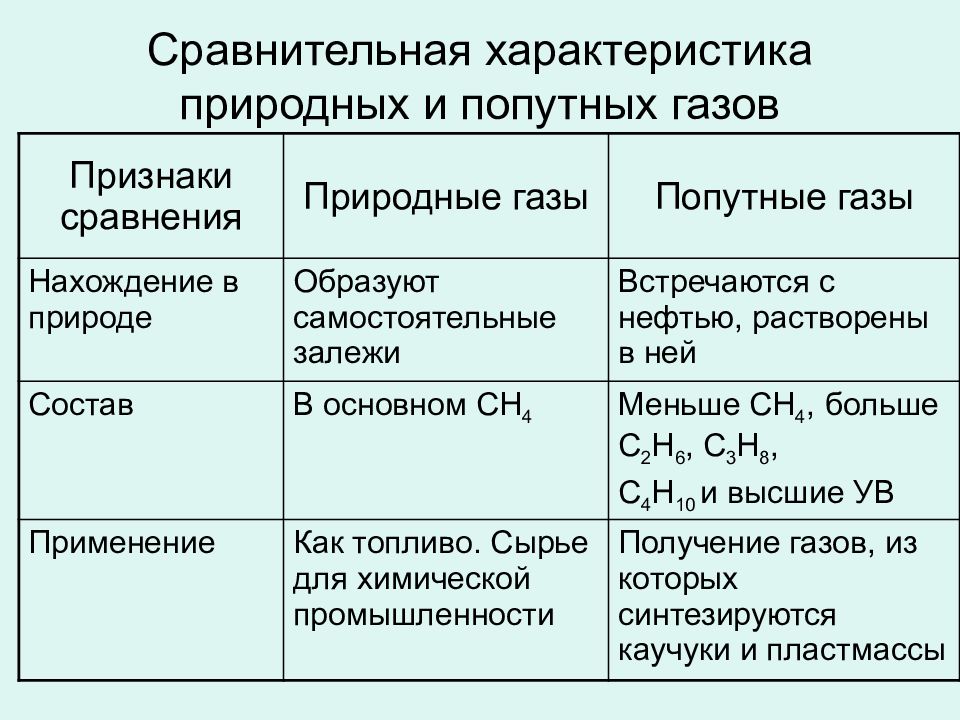
Слайд 48: Сравнительная характеристика природных и попутных газов
Признаки сравнения Природные газы Попутные газы Нахождение в природе Образуют самостоятельные залежи Встречаются с нефтью, растворены в ней Состав В основном СН 4 Меньше СН 4, больше С 2 Н 6, С 3 Н 8, С 4 Н 10 и высшие УВ Применение Как топливо. Сырье для химической промышленности Получение газов, из которых синтезируются каучуки и пластмассы
Слайд 49: ПРИРОДНЫЙ ГАЗ
В природном газе содержатся углеводороды с низкой молекулярной массой, основными компонентами является метан. Его содержание в газе различных месторождений колеблется от 80% до 97%. Кроме метана – этан, пропан, бутан. Неорганические: азот– 2%; СО 2 ; Н 2 О; Н 2 S, благородные газы. Природные газы заполняют пустоты, образующиеся в горных породах под землей. При сгорании природного газа выделяется много тепла.
Слайд 50: Попутные или нефтяные газы
По происхождению это тоже природные газы, встречаются вместе с нефтью – растворены в ней или образуют над ней газовую «пленку». Нефтяной газ является сырьем для получения газового бензина, этилена, пропилена, бутилена, используемых для получения высокомолекулярных соединений.
Слайд 51: КАМЕННЫЙ УГОЛЬ,
твердое горючее полезное ископаемое растительного происхождения, одна из разновидностей ископаемых углей (средней степени метаморфизма). Представляет собой плотную породу черного, иногда серо-черного цвета с блестящей, полуматовой или матовой поверхностью.
Слайд 53
Существует 2 основных способа добычи каменного угля: открытый (карьерный) и закрытый (шахтный). Используется в коксохимическом производстве, как энергетическое топливо, а также для полукоксования, газификации, получения жидкого топлива, смазочных масел, пластмасс и т.п.
Слайд 54
НЕФТЬ (тур. neft, от перс. нефт), - темная маслянистая жидкость, не растворяющаяся в воде; горючая смесь парафиновых, нафтеновых и реже ароматических УВ; распространена в осадочной оболочке Земли; важнейшее полезное ископаемое. О существовании нефти было известно еще в древнем Египте.
Слайд 55
Мировые запасы нефти — около 500 млрд т. Всего насчитывается около 50 тыс. месторождений, из них разведано около 600, разрабатывается 450; из них приблизительно половина — на Ближнем Востоке. Наибольшие запасы сосредоточены в Северном полушарии. По запасам лидируют: Саудовская Аравия, Мексика, Россия,Иран, США ; при этом в странах ОПЕК — 103 млрд. тонн, в развивающихся странах — 120 млрд т.
Слайд 58: Перегонка нефти
Это первичная переработка нефти, которая осуществляется на нефтеперерабатывающих заводах после отделения попутных газов. Первый перегонный аппарат был построен в середине XIX в. в штате Пенсильвания. Тогда впервые был получен керосин.
Слайд 59: Фракции перегонки нефти
Название фракции t° С Углерод. состав Применение Бензин Керосин Соляровое масло Газойль Парафин Асфальт (гудрон) 40-200 180-300 до 360 270-300 320-500 - С 2 –С 12 С 12 – С 18 С 16 и более С 1 – С 6 С 26 – С 38 - Моторное топливо Топливо, в т.ч. дизельное Смазочные материалы Газообраз.топливо, сырье для получения Н 2 Свечи, спичечный парафин, гуталин Дорожные покрытия
Слайд 60
КРЕКИНГ (англ. cracking, букв. — расщепление), переработка нефти или ее фракций для получения главным образом моторных топлив, а также сырья для химической промышленности. Различают 2 основных вида крекинга: термический, осуществляемый под действием высокой температуры и давления; каталитический, происходящий при одновременном воздействии высокой температуры, давления и катализатора.
Слайд 61: Два вида крекинга
Термический Каталитический Сырье Мазут Керосин и газойль Температура 450-550 ° С 450 ° С Давление 2-7 мПа Атмосферное Продукт получения Автомобильный бензин Авиационный бензин
Слайд 62
РИФОРМИНГ (англ. reforming), переработка нефтепродуктов (главным образом бензиновых и лигроиновых фракций нефти) при 490-540 °С с целью получения высокооктановых автомобильных бензинов, ароматических углеводородов и технического водорода.
Слайд 63: Экологическая катастрофа
в Керченском проливе в ноябре 2007 года. В воду попали 2 тысячи тонн нефтепродуктов и около 7 тысяч тонн серы. Больше всего из-за катастрофы пострадали коса Тузла, которая находится на стыке Чёрного и Азовского морей, и коса Чушка. После аварии мазут осел на дно из-за чего погибла мелкая ракушка-сердцевидка – основная еда обитателей моря. На восстановление экосистемы уйдет 10 лет. Погибло более 15 тысяч птиц.
Слайд 64
МЕТАН CH 4, бесцветный газ, t кип 164 °C. Основной компонент природных (77-99%), попутных нефтяных (31-90%), рудничного и болотного газов. Горит бесцветным пламенем. С воздухом образует взрывоопасные смеси. Сырье для получения многих ценных продуктов химической промышленности — формальдегида, ацетилена, сероуглерода, хлороформа, синильной кислоты, сажи. Применяется как топливо.
Слайд 65
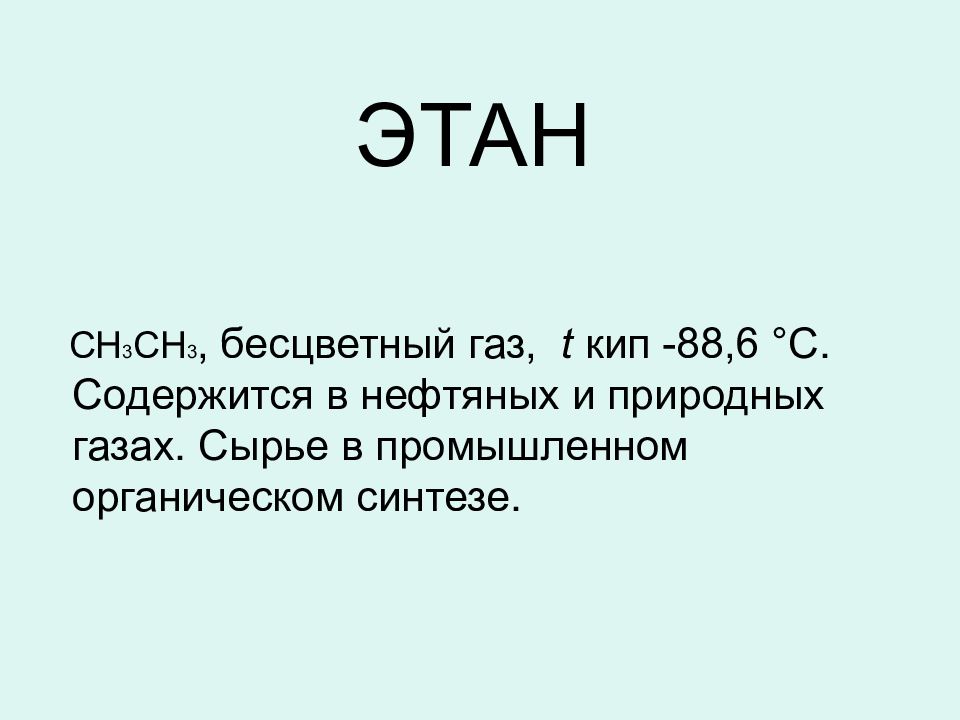
ЭТАН СН 3 СН 3, бесцветный газ, t кип -88,6 °С. Содержится в нефтяных и природных газах. Сырье в промышленном органическом синтезе.
Слайд 66
ПРОПАН СН 3 СН 2 СН 3, бесцветный газ, t кип -42,1 °С. Содержится в природных и нефтяных газах, образуется при крекинге нефтепродуктов. Применяется, напр., для получения пропилена, нитрометана. В смеси с бутаном используется как бытовой газ.
Слайд 67: Экологические проблемы
Несовершенство технологии добычи нефти и газа, их транспортировки обуславливает постоянное сжигание объёма газа на тепло-агрегатах компрессорных станций и в факелах. На долю компрессорных станций приходится около 30% этих выбросов. На факельных установках ежегодно сжигается около 450 тыс. тонн природного и попутного газа, при этом в атмосферу поступает более 60 тыс. тонн загрязняющих веществ. Добыча угля приводит к образованию «лунных» ландшафтов – терриконов, т.е. отвалов пустой породы.
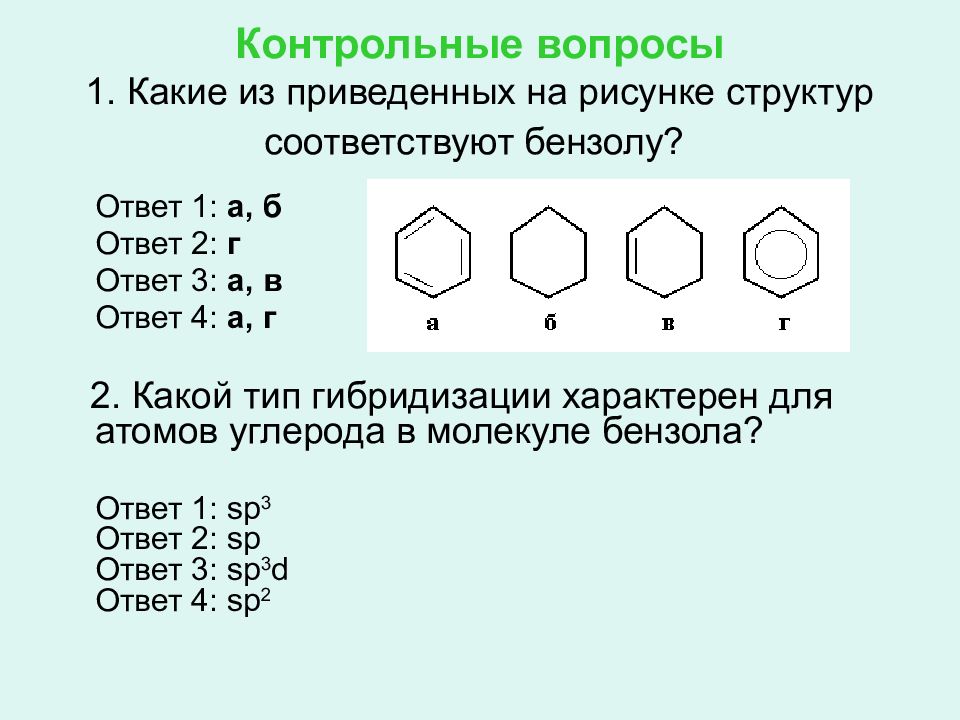
Слайд 68: Контрольные вопросы 1. Какие из приведенных на рисунке структур соответствуют бензолу?
Ответ 1: а, б Ответ 2: г Ответ 3: а, в Ответ 4: а, г 2. Какой тип гибридизации характерен для атомов углерода в молекуле бензола? Ответ 1: sp 3 Ответ 2: sp Ответ 3: sp 3 d Ответ 4: sp 2
Слайд 69: Вопросы для самоконтроля:
1)Какова общая формула гомологического ряда аренов? 2) Какова молекулярная формула бензола? 3) Какое противоречие существует между структурной формулой Кекуле и свойствами бензола? Как это противоречие объясняет электронная теория? 4) Структурную формулу бензола представляют в виде шестиугольника с окружностью внутри. Что обозначает окружность? 5) Как распознать на основании химических свойств бензол и гексен?
Слайд 70
Задания для зачета: В.1: а) Строение этилена. б) Химические свойства этилена. в) Применение алкенов. В.2: а) Строение ацетилена. б) Химические свойства ацетилена. в) Применение алкинов.
Слайд 71
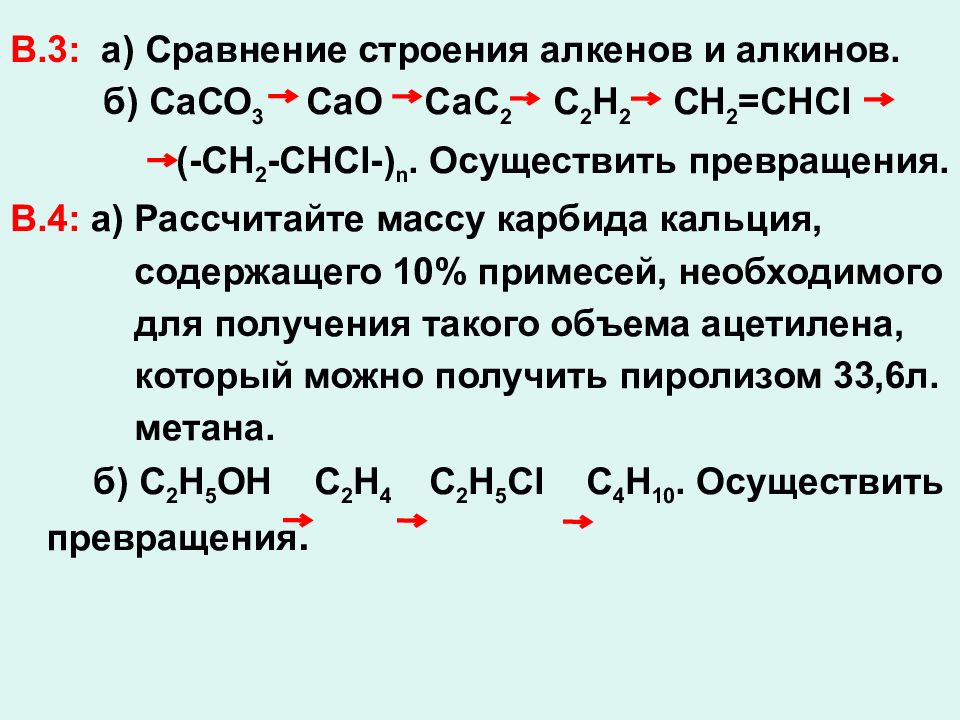
В.3: а) Сравнение строения алкенов и алкинов. б) СаСО 3 СаО СаС 2 С 2 Н 2 СН 2 =СНС l (-CH 2 -CHCl-) n. Осуществить превращения. В.4: а) Рассчитайте массу карбида кальция, содержащего 10% примесей, необходимого для получения такого объема ацетилена, который можно получить пиролизом 33,6л. метана. б) С 2 Н 5 ОН С 2 Н 4 С 2 Н 5 С l C 4 H 10. Осуществить превращения.
Слайд 72: Задание: выведите формулу бензола, если известно, что он состоит только из атомов водорода и кислорода и содержит 92,3 % водорода. Плотность по водороду равна 39
С 6 Н 6