Слайд 2
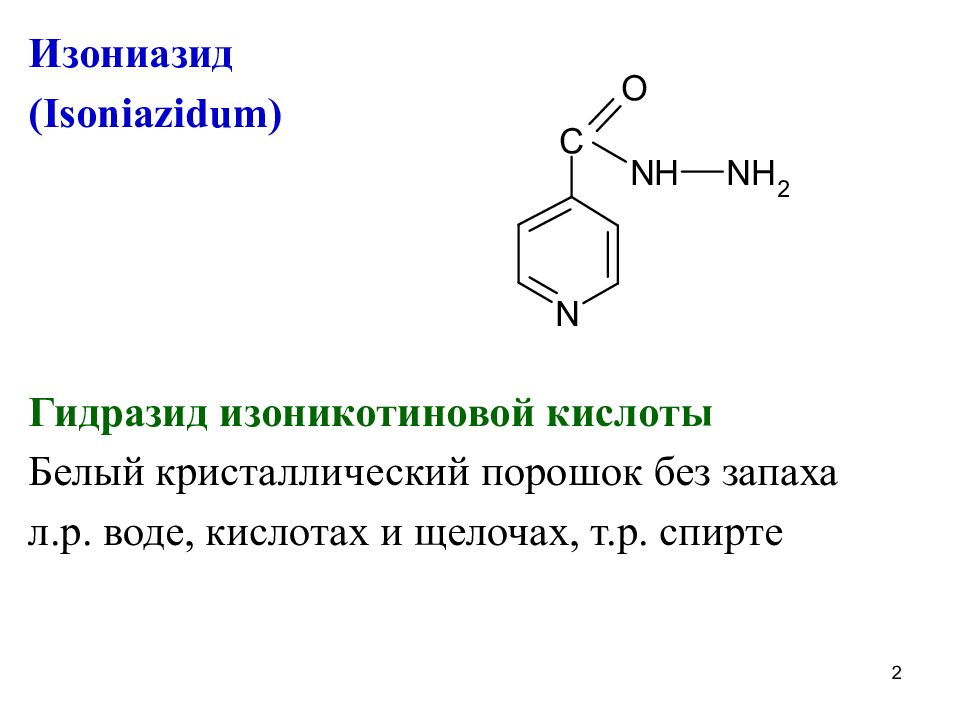
Изониазид ( Isoniazidum) Гидразид изоникотиновой кислоты Белый кристаллический порошок без запаха л.р. воде, кислотах и щелочах, т.р. спирте 2
Слайд 3
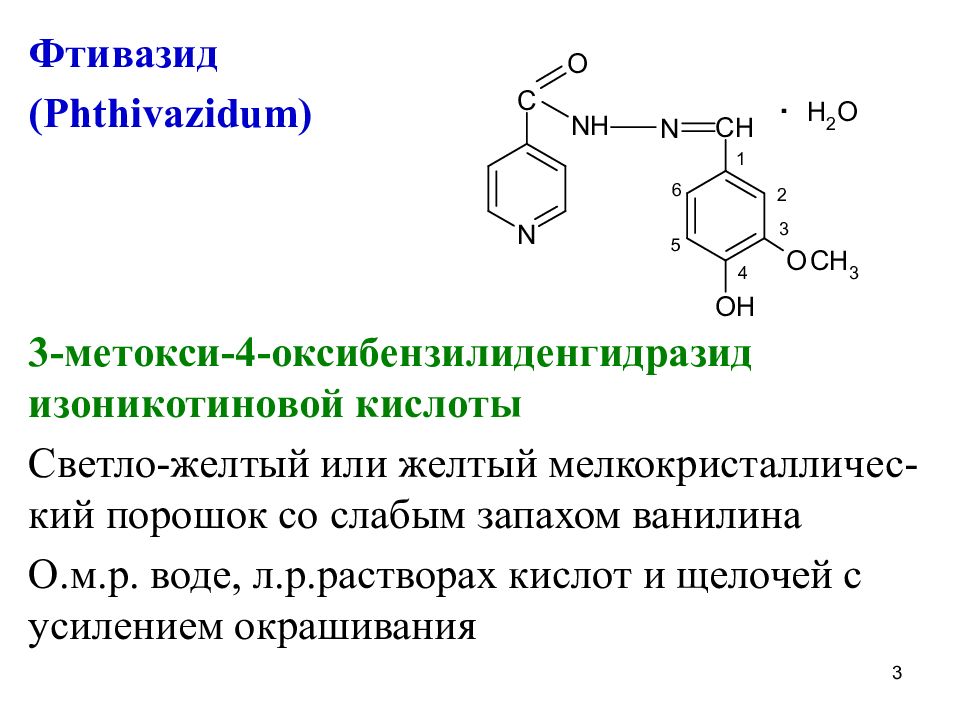
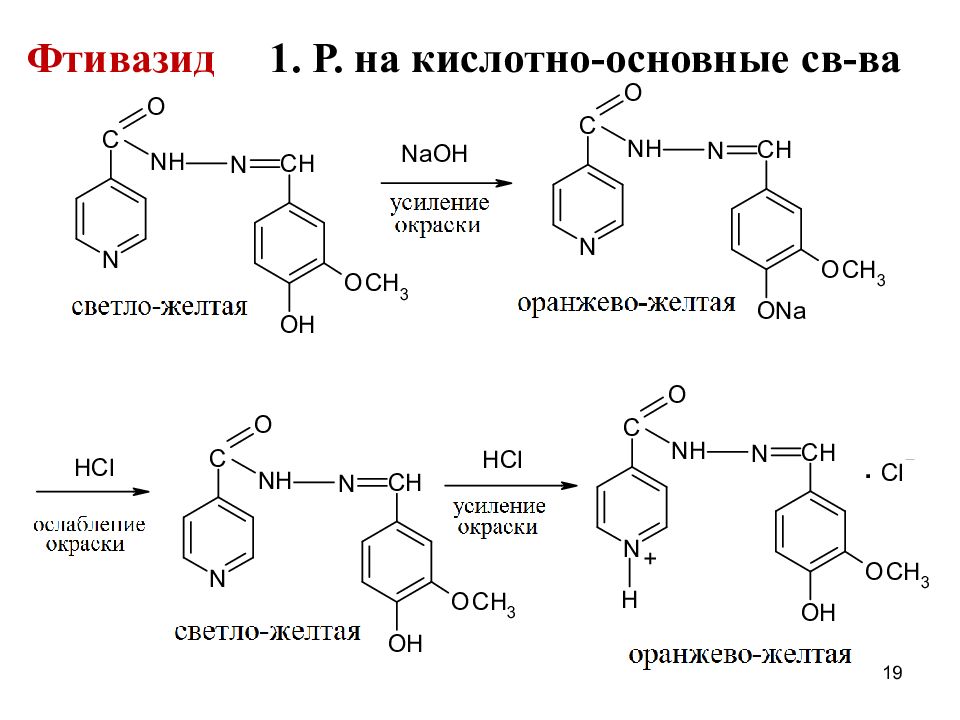
Фтивазид ( Phthivazidum) 3- метокси-4-оксибензилиденгидразид изоникотиновой кислоты Светло-желтый или желтый мелкокристалличес-кий порошок со слабым запахом ванилина О.м.р. воде, л.р.растворах кислот и щелочей с усилением окрашивания 3
Слайд 4
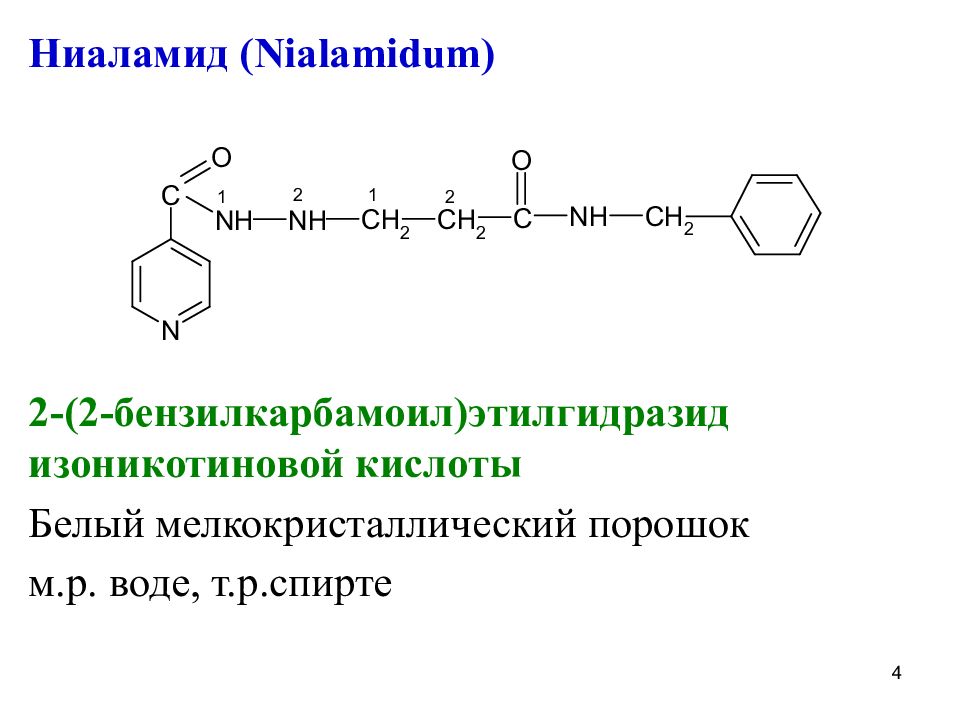
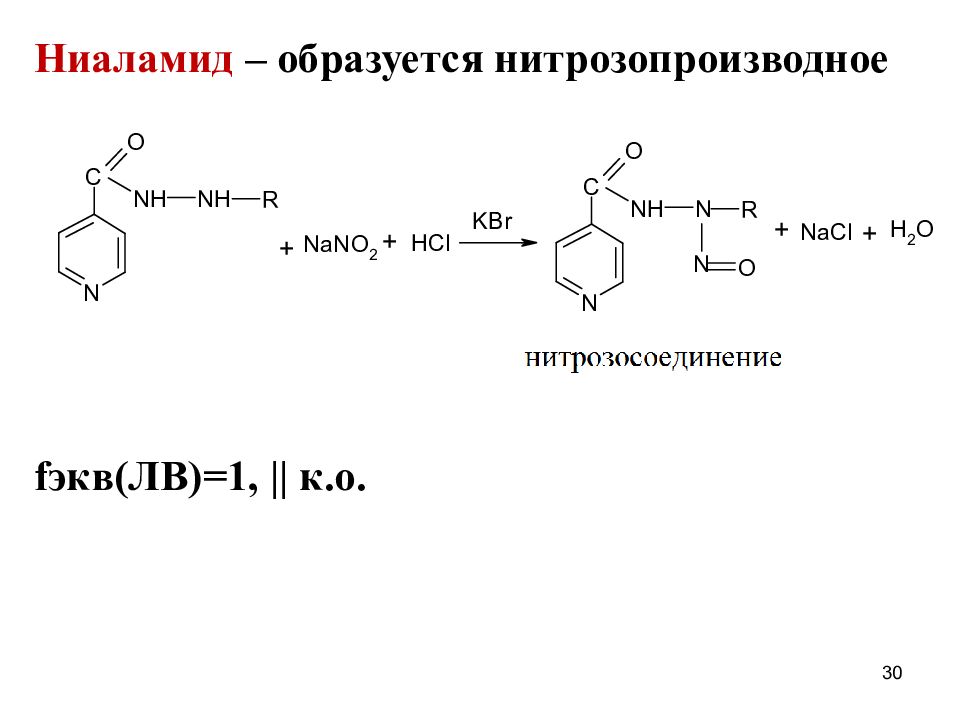
Ниаламид ( Nialamidum) 2-(2- бензилкарбамоил)этилгидразид изоникотиновой кислоты Белый мелкокристаллический порошок м.р. воде, т.р.спирте 4
Слайд 5
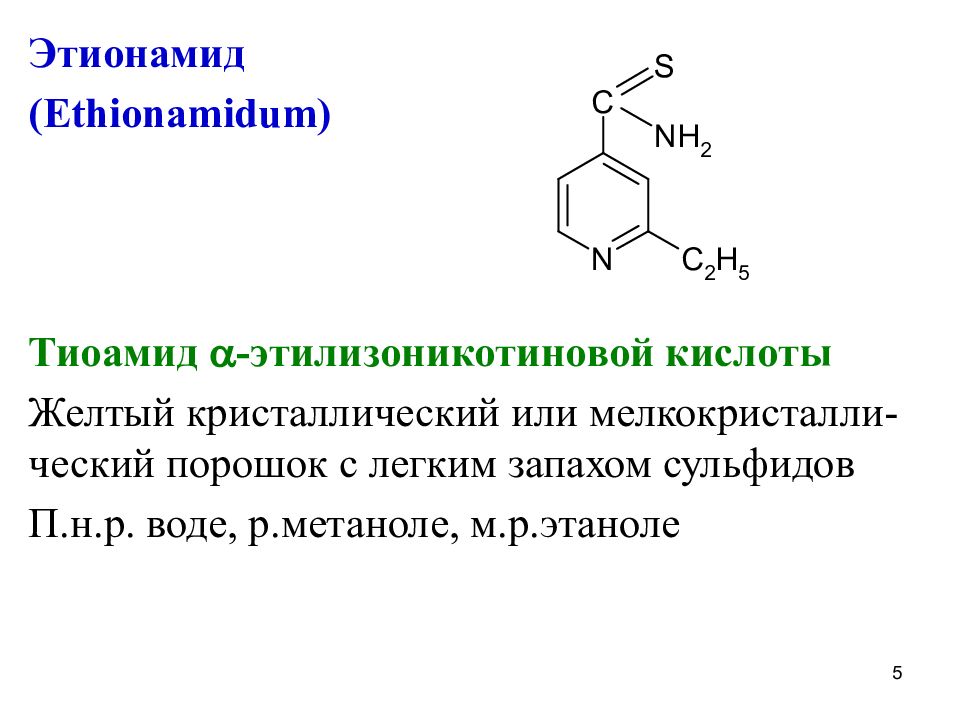
Этионамид ( Ethionamidum) Тиоамид -этилизоникотиновой кислоты Желтый кристаллический или мелкокристалли-ческий порошок с легким запахом сульфидов П.н.р. воде, р.метаноле, м.р.этаноле 5
Слайд 6
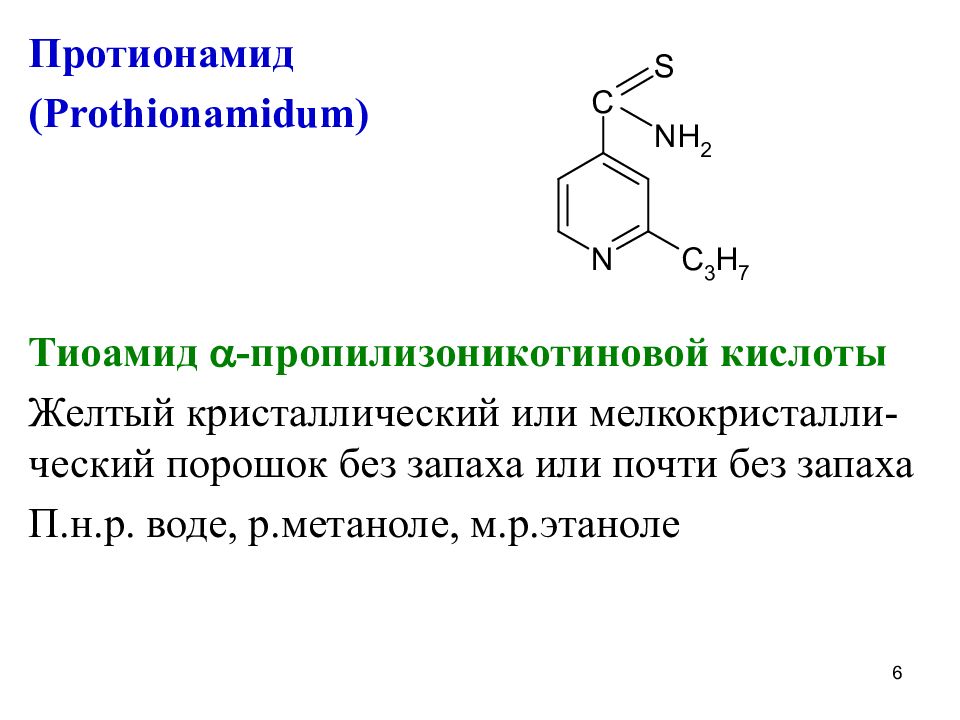
Протионамид ( Prothionamidum) Тиоамид -пропилизоникотиновой кислоты Желтый кристаллический или мелкокристалли-ческий порошок без запаха или почти без запаха П.н.р. воде, р.метаноле, м.р.этаноле 6
Слайд 7
Изониазид и фтивазид относятся к п/туберку-лезным препаратам 1-го ряда. Наличие гидразид-ной группы позволяет проникать внутрь туб. палочки, образуя хелатные соединения с ионами т.м., т.обр., угнетая деятельность ферментов и п рекращая жизнь туб.бактерии. Изоник.к-та – удачный носительгидразидной группы: с одной стороны она обеспечивает проникновение препарата в микобактерию туберкулеза с другой – малотоксична для организма. Т.обр., изониазид и фтивазид проявляют бактерицидный эффект. 7
Слайд 8
Этионамид и протионамид также проявляют п/туберкулезную активность Ниаламид – антидепрессант, игибитор моноаминооксидазы, которая дезаминирует моноамин и т.обр. инактивирует дофамин, норадреналин, серотонин. Под влиянием ингибиторов МАО замедляется их метаболизм и они накапливаются в мозге. Ф/кологичекое действие ниаламида связано с наличием карбамидной группы в молекуле препарата. 8
Слайд 10
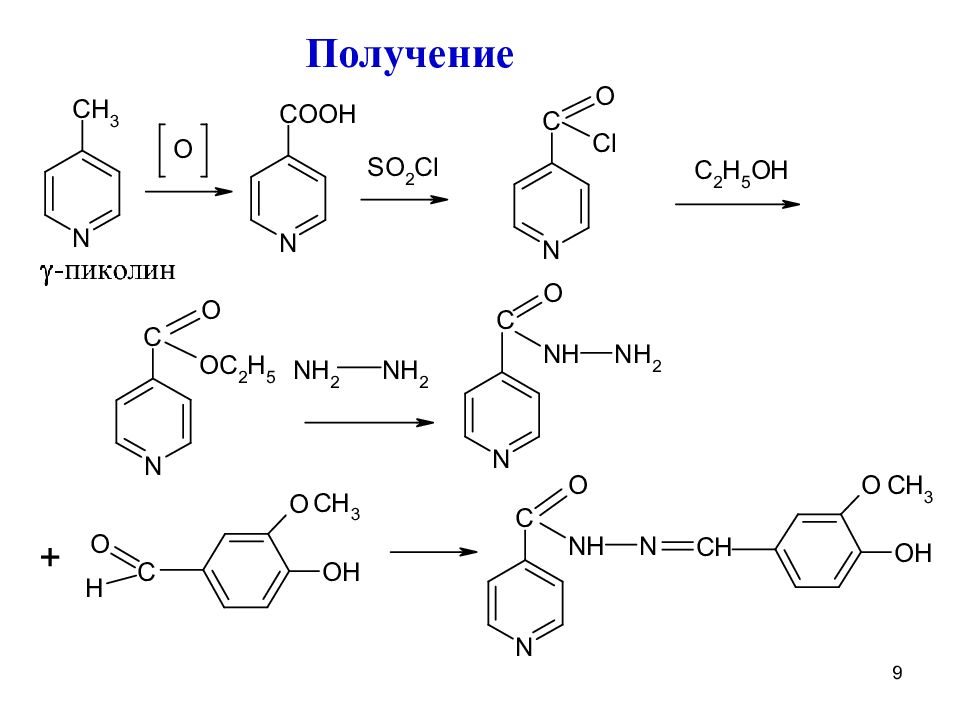
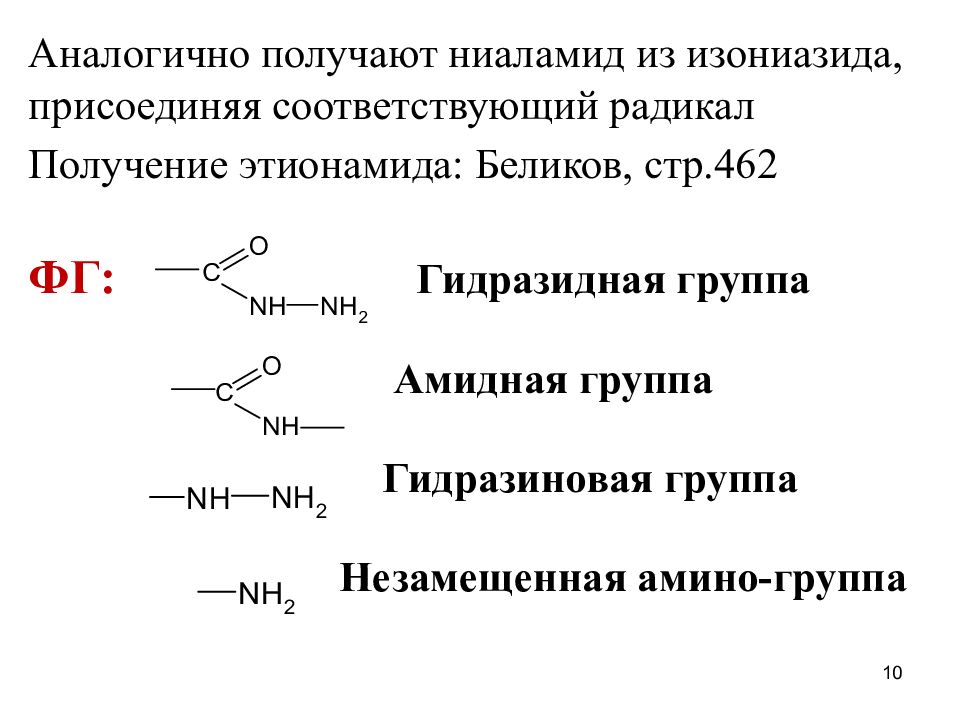
Аналогично получают ниаламид из изониазида, присоединяя соответствующий радикал Получение этионамида: Беликов, стр.462 ФГ: Гидразидная группа Амидная группа Гидразиновая группа Незамещенная амино-группа 10
Слайд 11
У фтивазида: азометиновая группа фенольный гидроксил У этионамида и протионамида: тиоамидная группа У всех – пиридиновый цикл 11
Слайд 12
Качественный анализ По Т плавления 2. СПФ в УФ-области спектра 3. ИК-спектроскопия 4. ТСХ, ВЭЖХ Изониазид и фтивазид являются амфолитами : пиридин.цикл ( изониазид, фтивазид ) и амино-гр в гидразиновом фрагменте ( изониазид ) обуславливают основные св-ва, кислотные св-ва – амидная гр ( изониазид ) и фенол. гидроксил ( фтивазид ) 12
Слайд 13
Реакции подлинности: 1. Реакции на пиридиновый цикл Образование глутаконового альдегида Пирролиз С лимонной кислотой и уксусным ангидридом 2. На третичный ат. N – с общеалкалоидными реактивами; Изониазид + (NH 4 ) 2 MoO 4 +H 2 SO 4 бурый Фтивазид + H 2 SO 4 (к) желтое окрашивание 13
Слайд 14
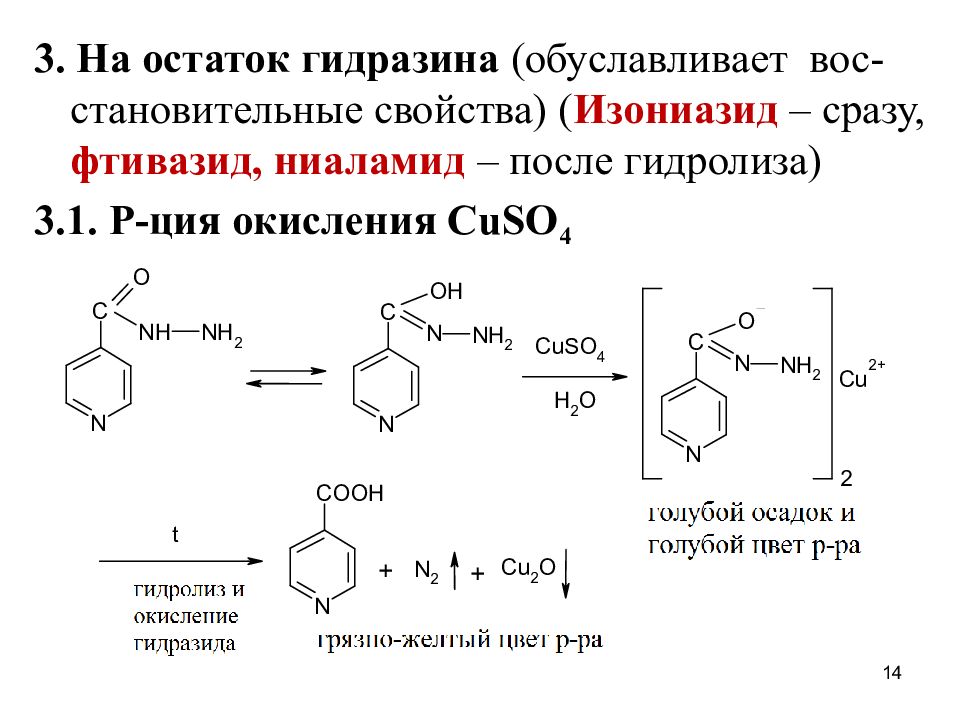
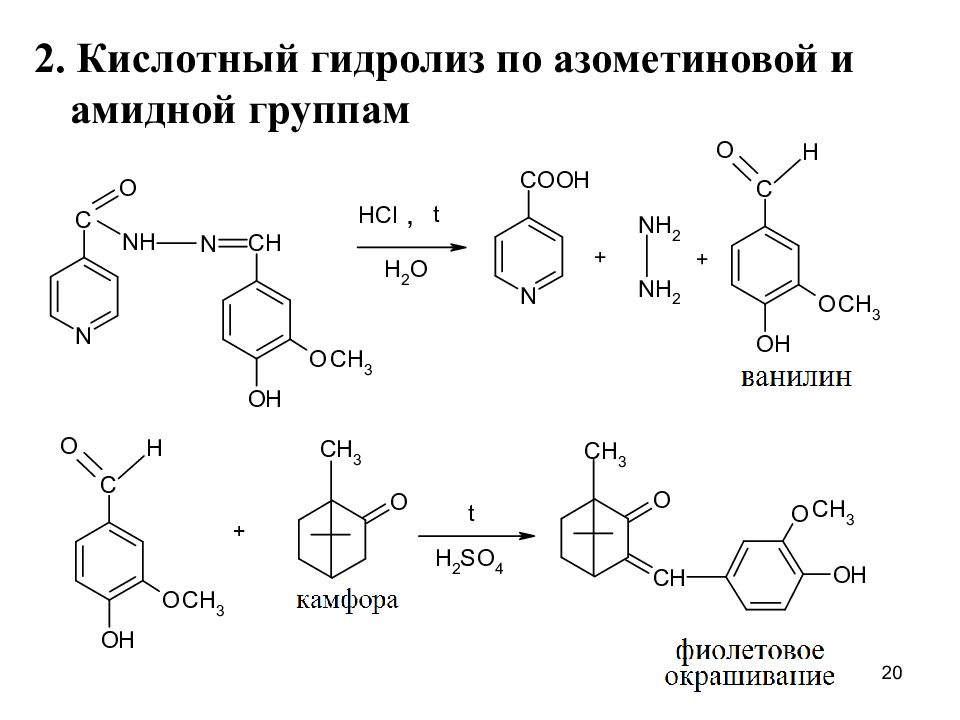
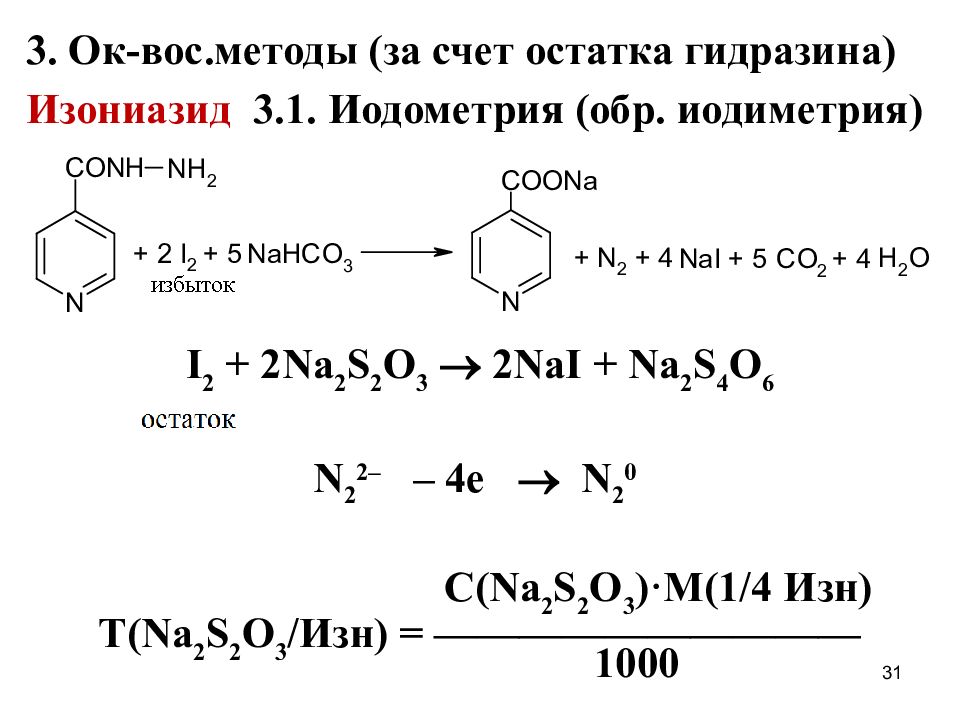
3. На остаток гидразина (обуславливает вос-становительные свойства) ( Изониазид – сразу, фтивазид, ниаламид – после гидролиза) 3.1. Р-ция окисления CuSO 4 14
Слайд 15
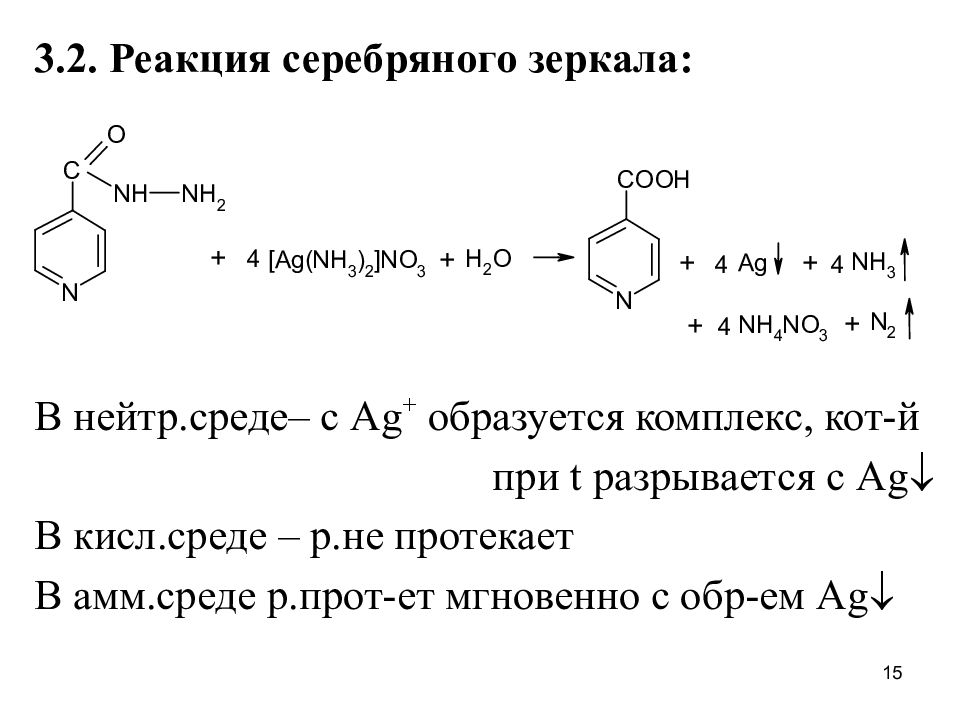
3.2. Реакция серебряного зеркала: В нейтр.среде– с Ag + образуется комплекс, кот-й при t разрывается с Ag В кисл.среде – р.не протекает В амм.среде р.прот-ет мгновенно с обр-ем Ag 15
Слайд 17
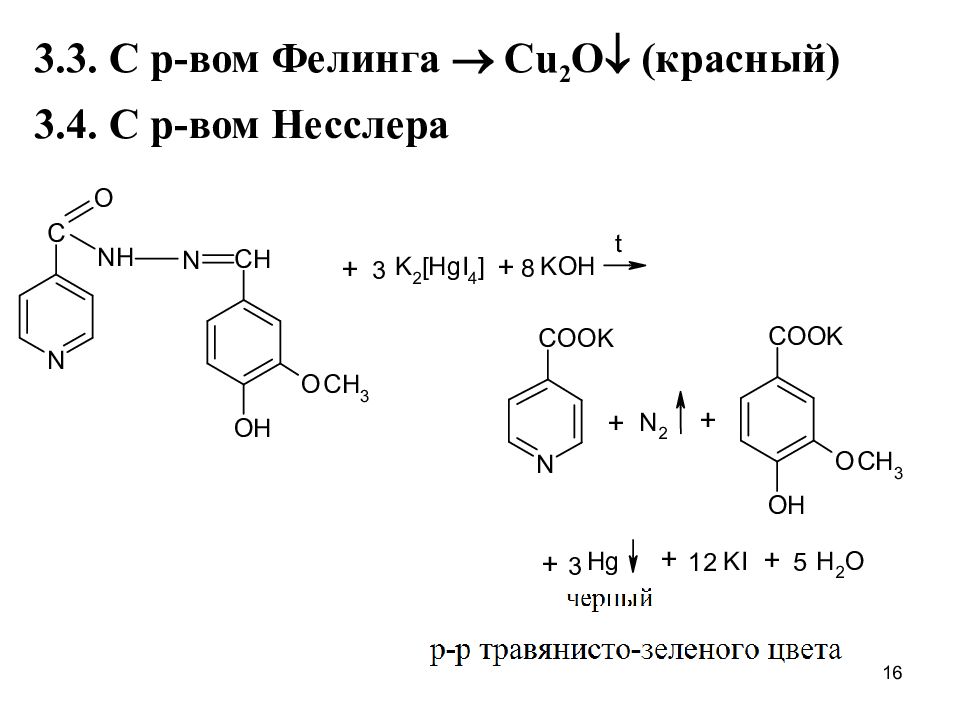
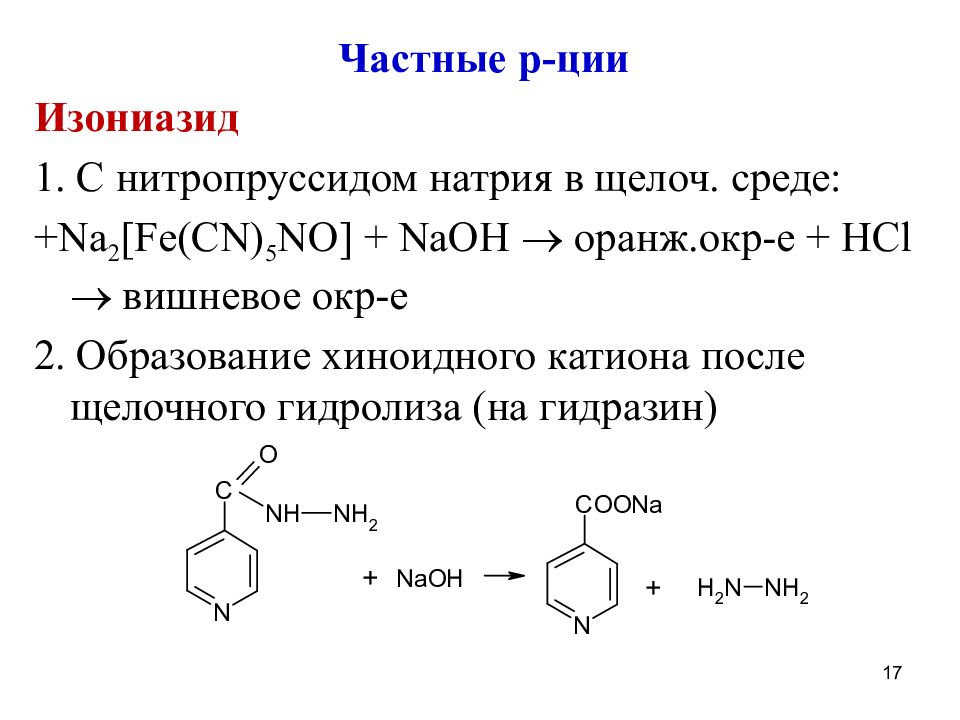
Частные р-ции Изониазид 1. С нитропруссидом натрия в щелоч. среде: + Na 2 [Fe(CN) 5 NO] + NaOH оранж.окр-е + HCl вишневое окр-е 2. Образование хиноидного катиона после щелочного гидролиза (на гидразин) 17
Слайд 18
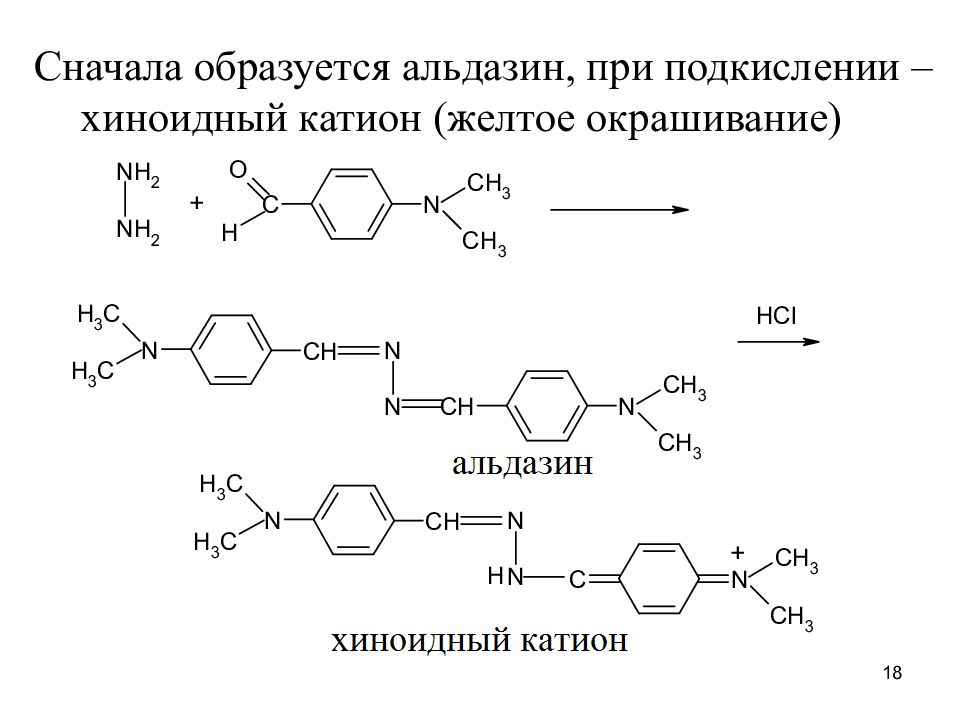
Сначала образуется альдазин, при подкислении – хиноидный катион (желтое окрашивание) 18
Слайд 21
3. Образование хиноидного катиона после гидролиза (на гидразин) 4. На фенольный гидроксил с FeCl 3 – фиол.окр. Этионамид, протионамид 1. При нагревнии с HCl образуется H 2 S H 2 S + (CH 3 COO) 2 Pb PbS + 2CH 3 COOH Фильтр-я бумага, пропитанная (CH 3 COO) 2 Pb, окрашивается в черный цвет 21
Слайд 22
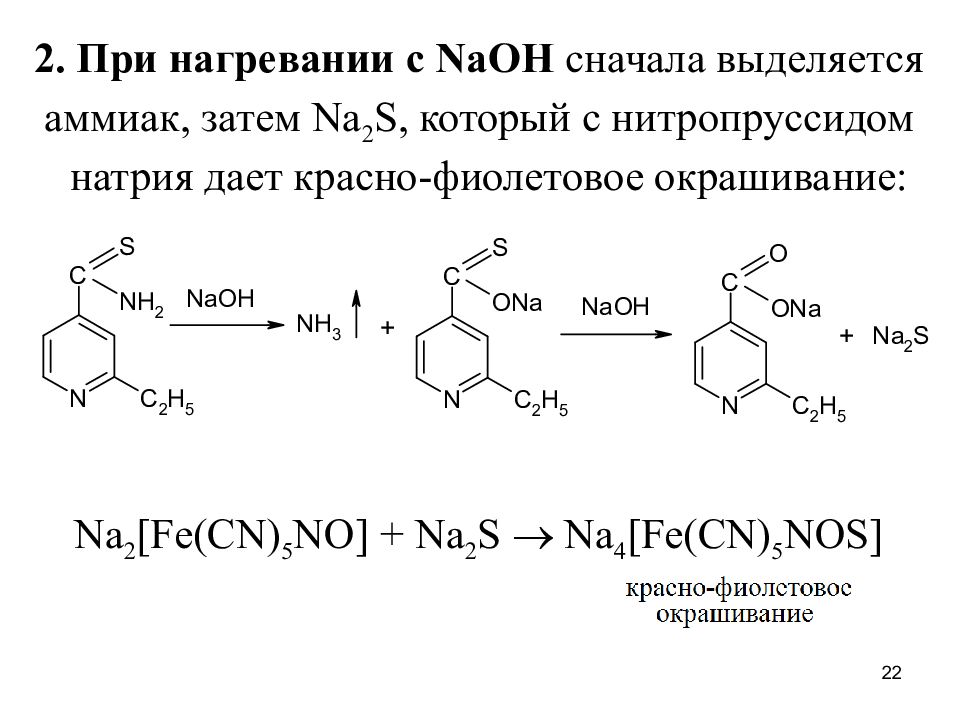
2. При нагревании с NaOH сначала выделяется аммиак, затем N a 2 S, который с нитропруссидом натрия дает красно-фиолетовое окрашивание: Na 2 [Fe(CN) 5 NO] + Na 2 S Na 4 [Fe(CN) 5 NOS] 22
Слайд 23
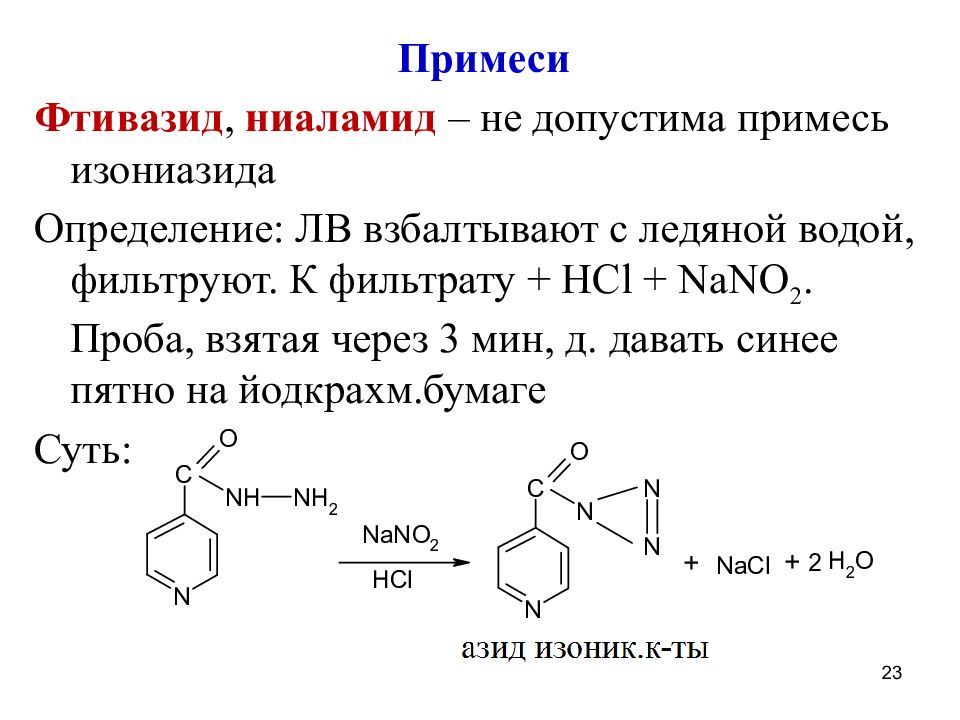
Примеси Фтивазид, ниаламид – не допустима примесь изониазида Определение: ЛВ взбалтывают с ледяной водой, фильтруют. К фильтрату + Н Cl + NaNO 2. Проба, взятая через 3 мин, д. давать синее пятно на йодкрахм.бумаге Суть: 23
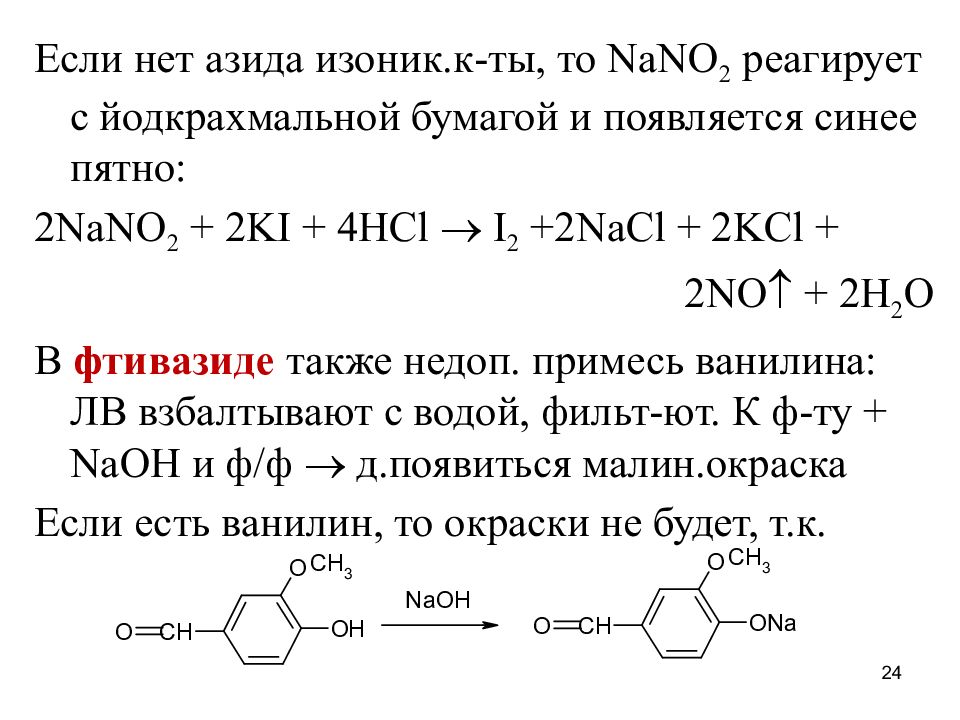
Слайд 24
Если нет азида изоник.к-ты, то NaNO 2 реагирует с йодкрахмальной бумагой и появляется синее пятно: 2NaNO 2 + 2KI + 4HCl I 2 +2NaCl + 2KCl + 2NO + 2H 2 O В фтивазиде также недоп. примесь ванилина: ЛВ взбалтывают с водой, фильт-ют. К ф-ту + NaOH и ф/ф д.появиться малин.окраска Если есть ванилин, то окраски не будет, т.к. 24
Слайд 25
Изониазид – примесь гидразина (доп), ТСХ Этионамид, протионамид – посторонние примеси (доп), ТСХ 25
Слайд 26
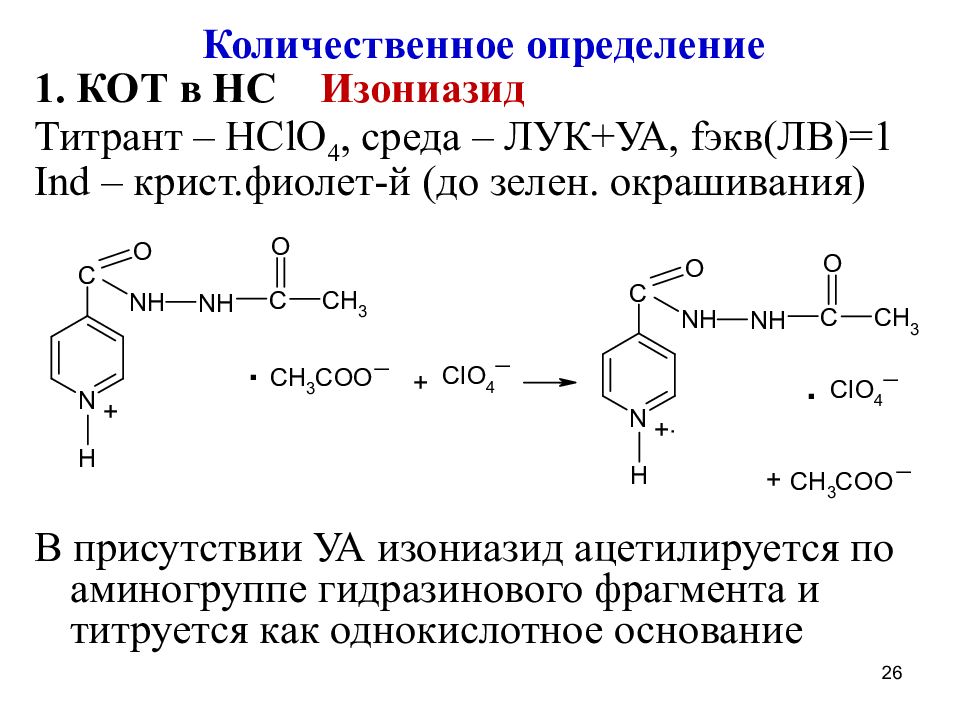
Количественное определение 1. КОТ в НС Изониазид Титрант – HClO 4, среда – ЛУК+УА, f экв(ЛВ)=1 Ind – крист.фиолет-й (до зелен. окрашивания) В присутствии УА изониазид ацетилируется по аминогруппе гидразинового фрагмента и титруется как однокислотное основание 26
Слайд 28
Этионамид, протионамид Титрант – HClO 4, среда – ЛУК, f экв (ЛВ)=1 Ind – крист.фиолетовый 28
Слайд 29
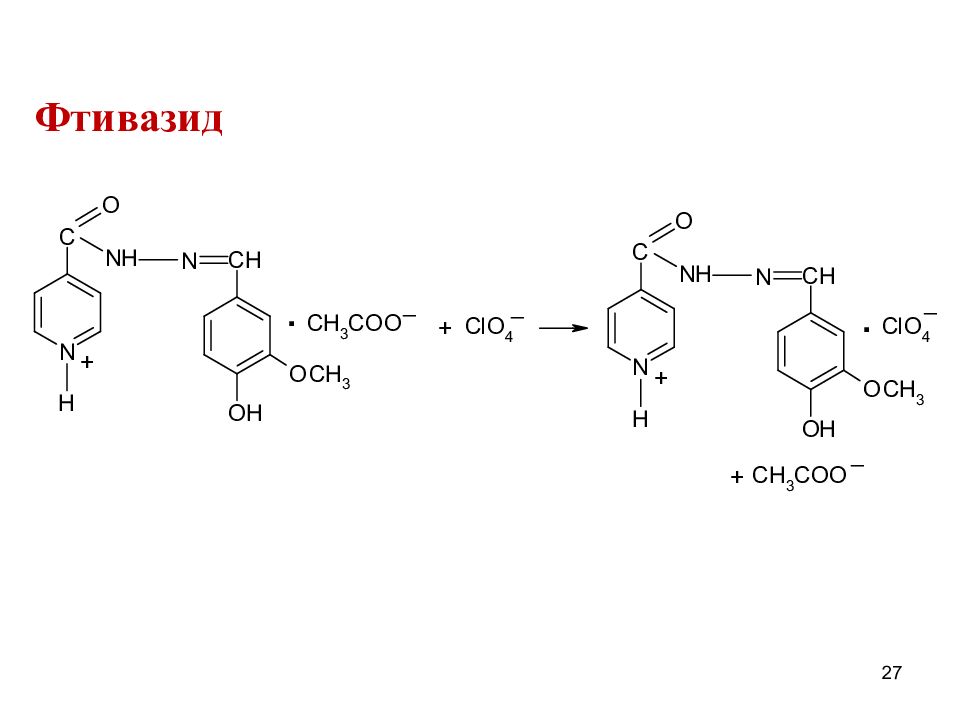
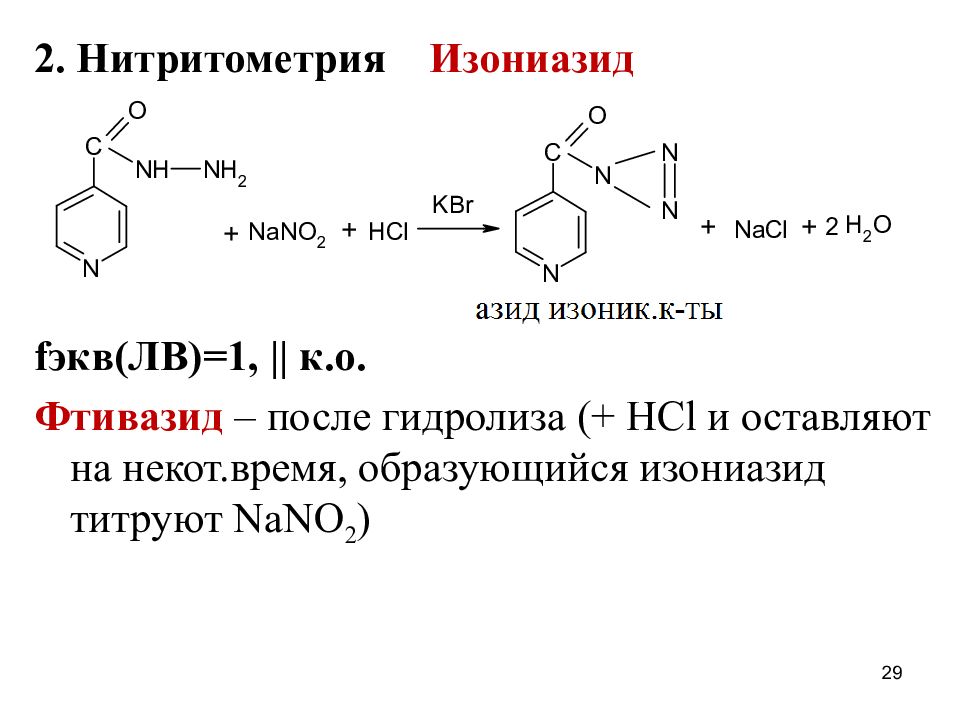
2. Нитритометрия Изониазид f экв(ЛВ)=1, || к.о. Фтивазид – после гидролиза (+ HCl и оставляют на некот.время, образующийся изониазид титруют NaNO 2 ) 29
Слайд 31
31 3. Ок-вос.методы (за счет остатка гидразина) Изониазид 3.1. Иодометрия (обр. иодиметрия) I 2 + 2Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 N 2 2– – 4 е N 2 0 С( Na 2 S 2 O 3 ) ·M ( 1/4 Изн ) Т( Na 2 S 2 O 3 / Изн ) = —————————— 1000
Слайд 32
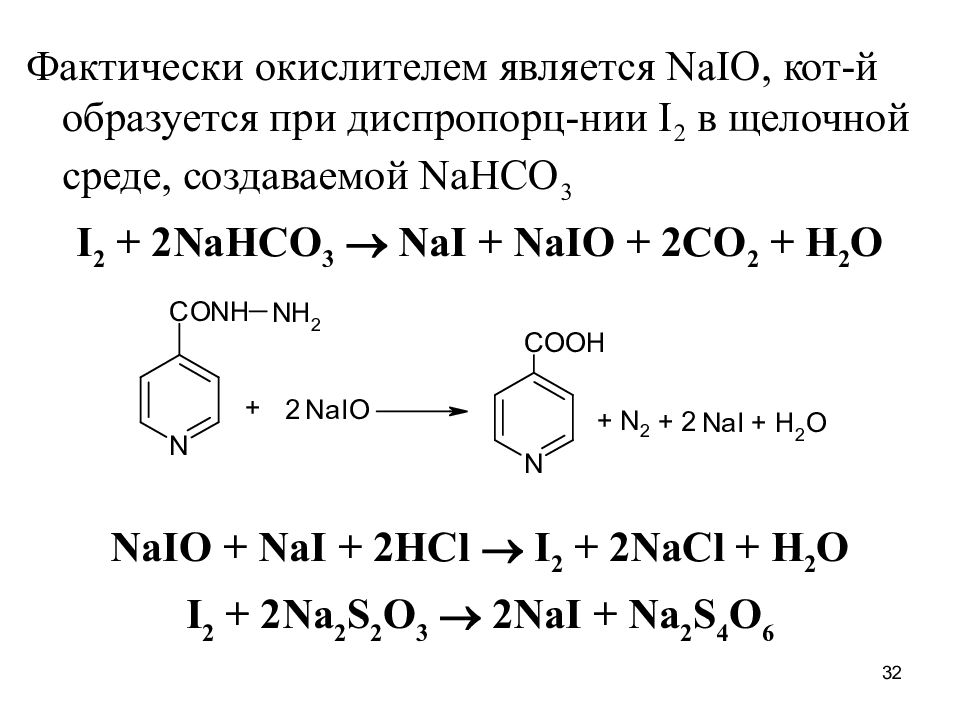
32 Фактически окислителем является NaIO, кот - й образуется при диспропорц - нии I 2 в щелочной среде, создаваемой NaHCO 3 I 2 + 2NaHCO 3 NaI + NaIO + 2CO 2 + H 2 O NaIO + NaI + 2HCl I 2 + 2NaCl + H 2 O I 2 + 2Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6
Слайд 33
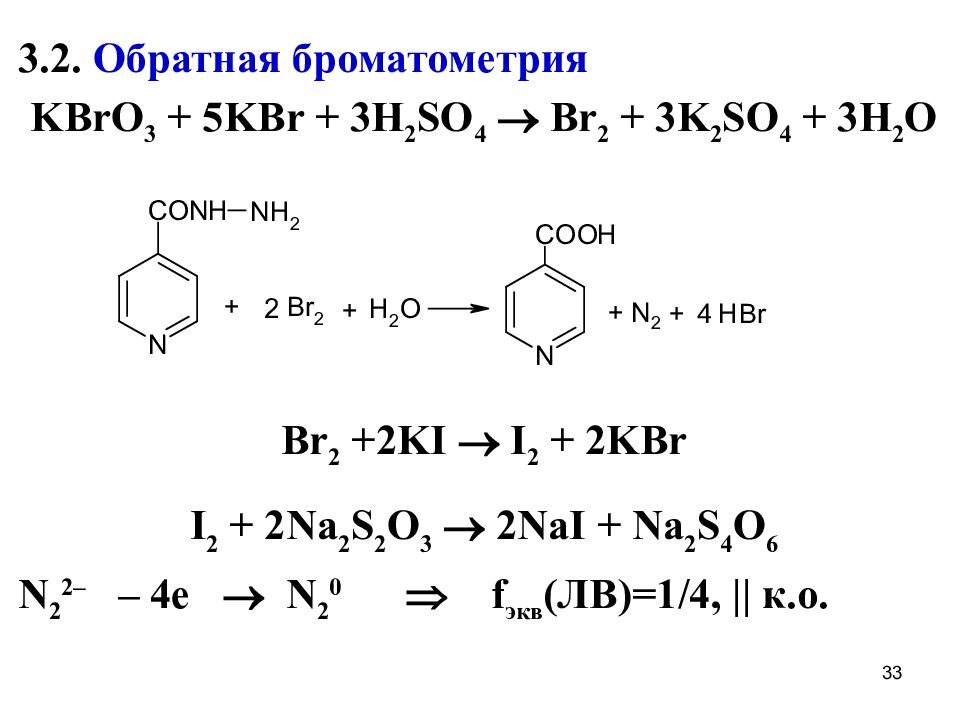
3.2. Обратная броматометрия KBrO 3 + 5KBr + 3H 2 SO 4 Br 2 + 3K 2 SO 4 + 3H 2 O Br 2 +2KI I 2 + 2KBr I 2 + 2Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 N 2 2– – 4 е N 2 0 f экв (ЛВ)=1/4, || к.о. 33
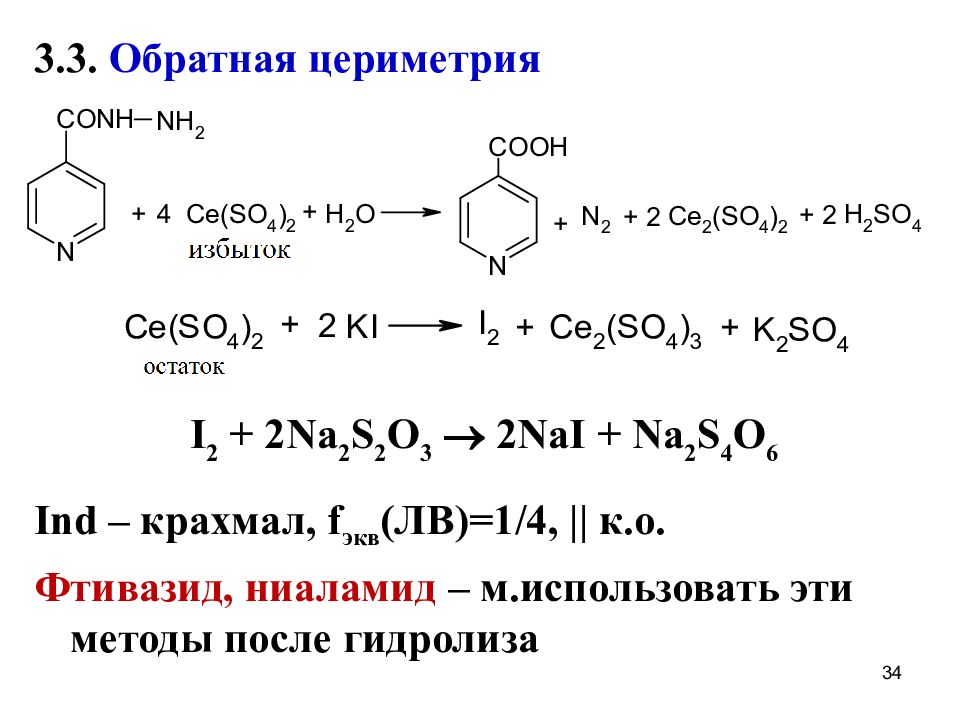
Слайд 34
3.3. Обратная цериметрия I 2 + 2Na 2 S 2 O 3 2NaI + Na 2 S 4 O 6 Ind – крахмал, f экв (ЛВ)=1/4, || к.о. Фтивазид, ниаламид – м.использовать эти методы после гидролиза 34
Слайд 35
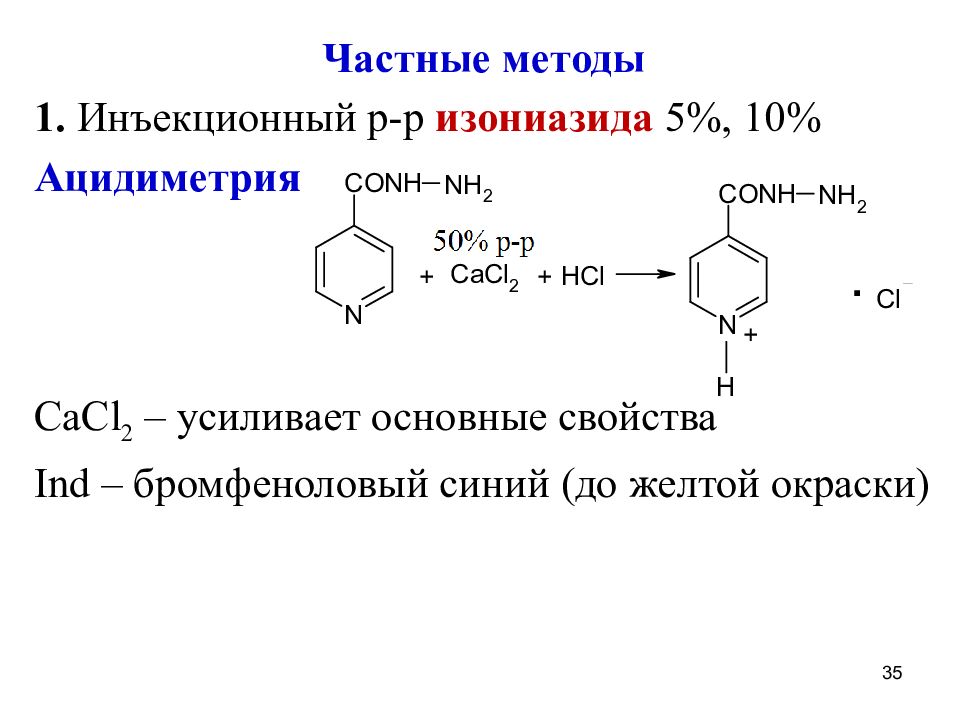
Частные методы 1. Инъекционный р-р изониазида 5%, 10% Ацидиметрия CaCl 2 – усиливает основные свойства Ind – бромфеноловый синий (до желтой окраски) 35
Слайд 36
2. Фтивазид – иодатометрия (после гидролиза) Сначала проводят кислотный гидролиз при кипячении (образуется гидразин), р-р охл-ют и титруют гидразин иодатом калия: 5 NH 2 NH 2 + 4KIO 3 +4HCl 5N 2 + 2I 2 +4KCl + 12H 2 O Незадолго до конца титрования в р-р + хлф, в котором I 2 р-ется лучше, чем в воде, хлф слой окрашивается в фиолетовый цвет и далее титруют KIO 3 до обесцвечивания хлф слоя 2 I 2 + KIO 3 + 6HCl 5ICl + KCl + 3H 2 O 36
Слайд 37
Суммарная реакция: NH 2 NH 2 + KIO 3 +2HCl N 2 + ICl + KCl + 3H 2 O I +5 + 4e I +1 f экв (ЛВ)=1/4, || к.о. 4. Физ-хим. методы (СПФ, ВЭЖХ) 37
Слайд 38
Хранение Сп. Б, в ХУТ, прохл, защищ. от света, сухом месте Применение Изониазид, фтивазид, этионамид, протионамид – п/туберкулезные средства, внутрь по по 0,3 г (изон) и 0,5 г (фтив) 2-3 р/день Этионамид, протионамид менее активны, чем изониазид и стрептомицин, но действуют на устойчивые к ним микобактерии Ниаламид – в психиатрической практике при депрессивных состояниях (тб по 0,025 г) 38