Первый слайд презентации: Биологические функции углеводов
Функции углеводов 1. Энергетическая. Углеводы – главный вид клеточного топлива. При сгорании 1 моль глюкозы выделяется 3060 Дж энергии, которая расходуется в эндотермических биологических процессах и частично аккумулируется в АТФ.
Слайд 2: Биологические функции углеводов
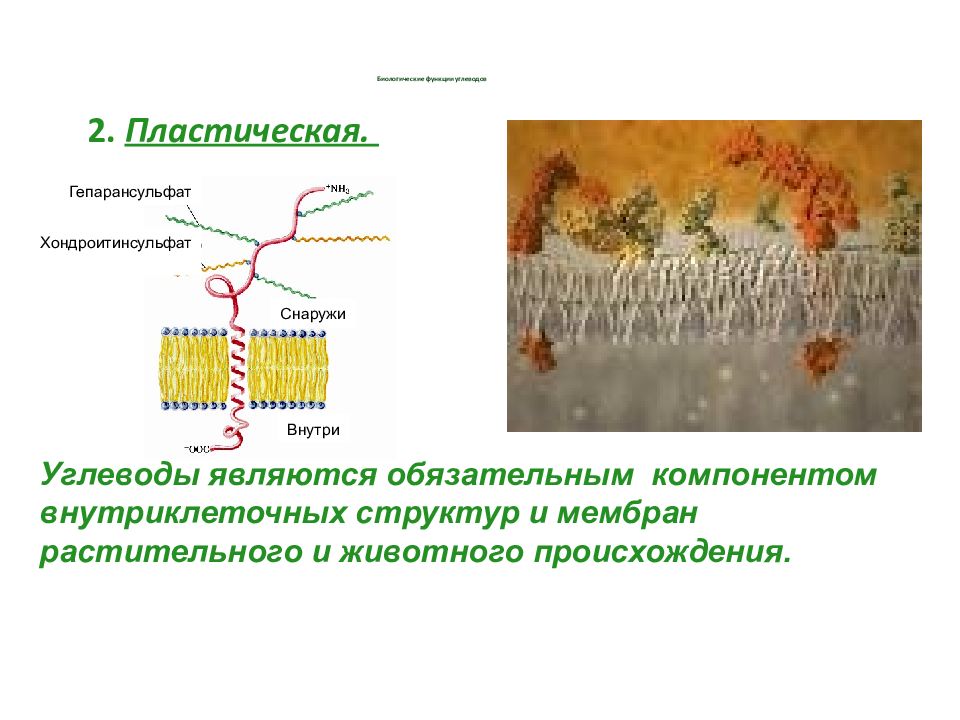
2. Пластическая. Углеводы являются обязательным компонентом внутриклеточных структур и мембран растительного и животного происхождения. Хондроитинсульфат Снаружи Внутри Гепарансульфат
Слайд 3
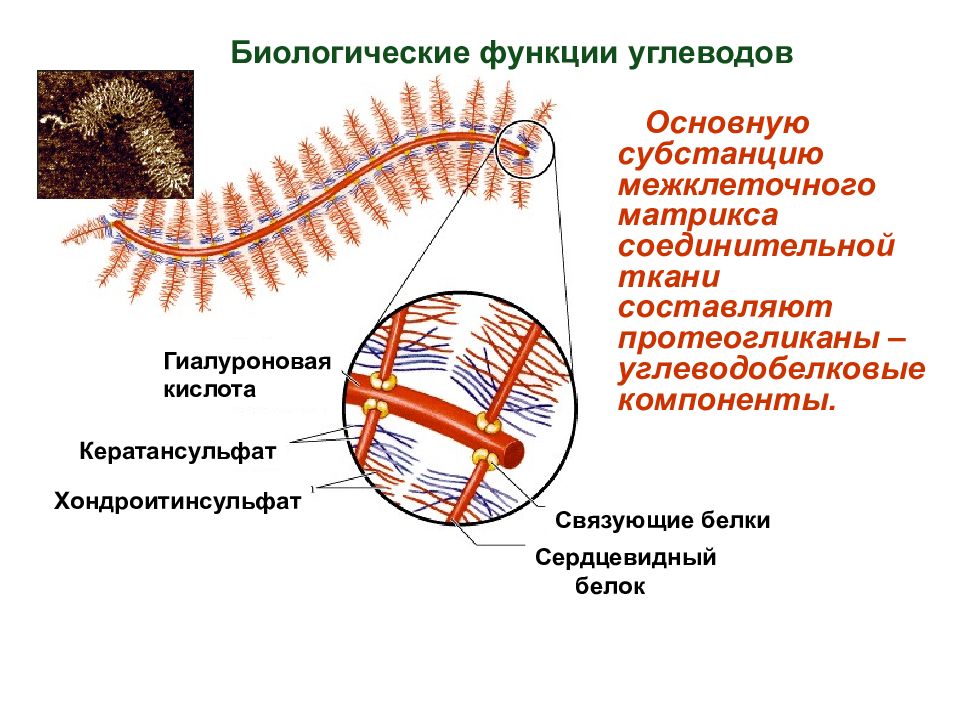
Кератансульфат Хондроитинсульфат Гиалуроновая кислота Связующие белки Сердцевидный белок Основную субстанцию межклеточного матрикса соединительной ткани составляют протеогликаны – углеводобелковые компоненты. Биологические функции углеводов
Слайд 4
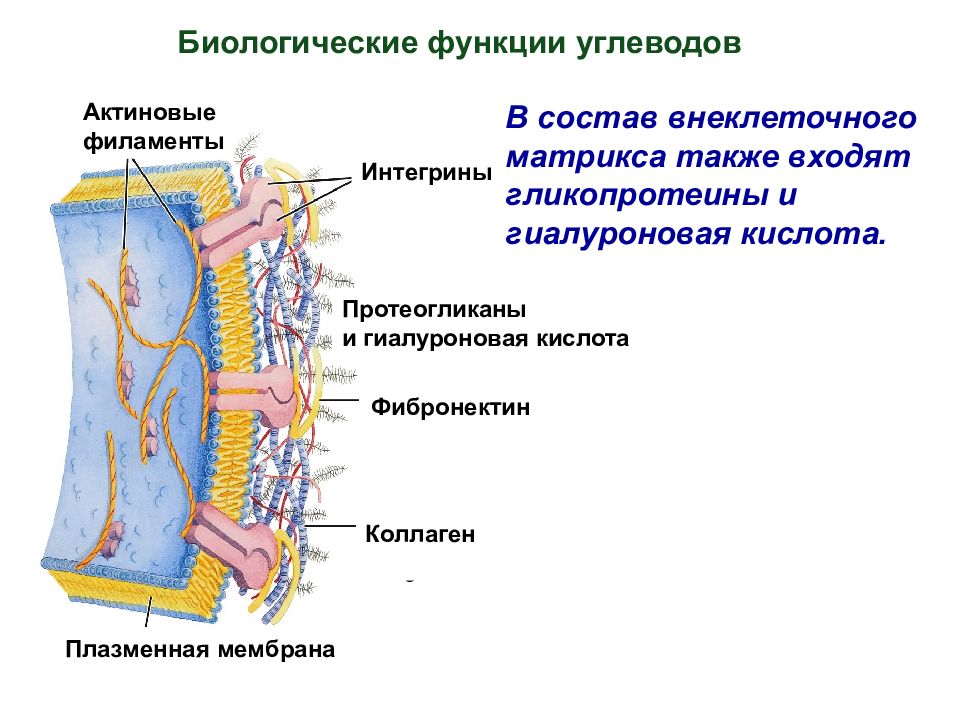
В состав внеклеточного матрикса также входят гликопротеины и гиалуроновая кислота. Биологические функции углеводов Плазменная мембрана Протеогликаны и гиалуроновая кислота Фибронектин Интегрины Коллаген Актиновые филаменты
Слайд 5
Полисахарид хитин (C 8 H 13 NO 5 )n (от греч. χιτών: хитон — одежда, кожа, оболочка) — основной компонент кутикулы членистоногих и ряда других беспозвоночных, входит в состав клеточной стенки грибов и бактерий. Биологические функции углеводов
Слайд 6: Биологические функции углеводов
3. Синтетическая. Углеводы участвуют в синтезе нуклеиновых кислот, входят в состав коферментов, гликолипидов, гликопротеинов. β 2 - Гликопротеин I
Слайд 7: Биологические функции углеводов
4. Защитная. Углеводы участвуют в поддержании иммунитета организма. Н апример, тиреотропный гормон, контролирующий функцию и развитие щитовидной железы, является гликопротеином. Тиреотропный гормон
Слайд 8: Биологические функции углеводов
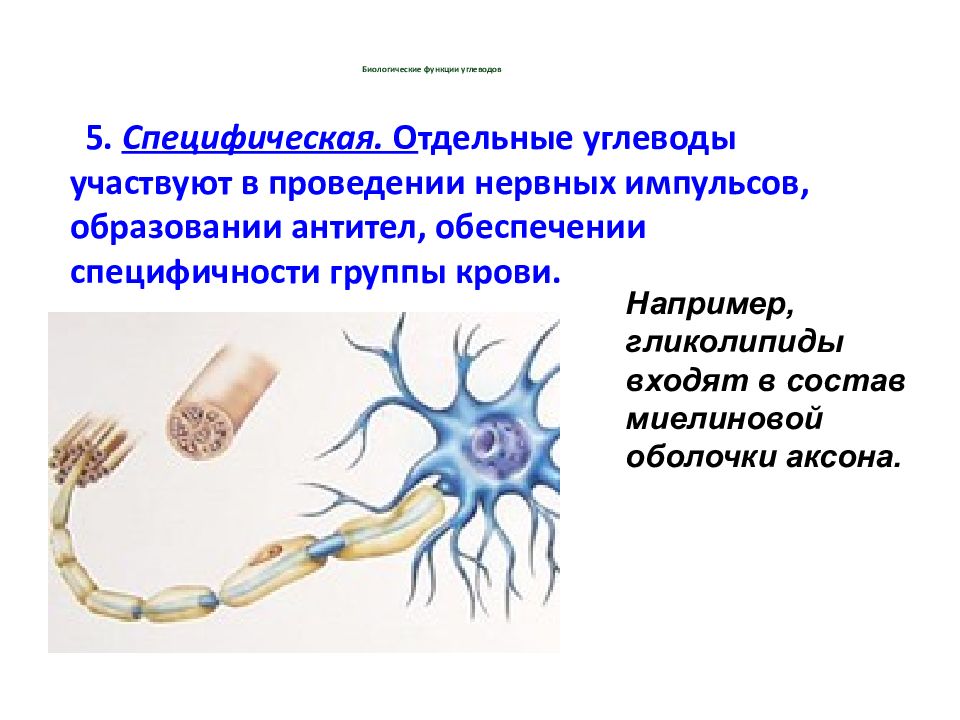
5. Специфическая. О тдельные углеводы участвуют в проведении нервных импульсов, образовании антител, обеспечении специфичности группы крови. Например, гликолипиды входят в состав миелиновой оболочки аксона.
Слайд 9: Биологические функции углеводов
6. Регуляторная. Растительная пища содержит полисахарид - целлюлозу, которая улучшает работу кишечника и повышает секрецию в желудке.
Слайд 10: Биологические функции углеводов
Для оптимального обеспечения организма человека углеводами в среднем необходимо 450 г. в сутки. Высокоуглеводный рацион питания может привести к ожирению.
Слайд 11
Углеводы входят в состав фарм. препаратов. Медико-биологическое значение темы Моносахариды
Слайд 13
Находит применение бактериальная целлюлоза. Чайный гриб – симбиоз дрожжеподобного гриба Saccharomycodes ludwigii и бактерий Acetobacter xylinum Медико-биологическое значение темы
Слайд 14: Образование углеводов
6 CO 2 + 6 H 2 O → C 6 H 12 O 6 + 6 O 2 1. Углеводы образуются в процессе фотосинтеза в хлоропластах клеток растений (от греч. Φ ωτο - свет и σύνθεσις - синтез, совмещение, помещение вместе) из углекислого газа и воды на свету при участии фотосинтетических пигментов. Хлоропласты в клетках листа
Слайд 15
Elysia chlorotica Elysia chlorotica — вид морских слизней, относящийся к морским брюхоногим моллюскам, способным к осуществлению фотосинтеза. Геном молюска кодирует некоторые белки, необходимые хлоропластам для фотосинтеза. Образование углеводов Моллюск использует хлоропласты морской водоросли Vaucheria litorea, которую употребляет в пищу.
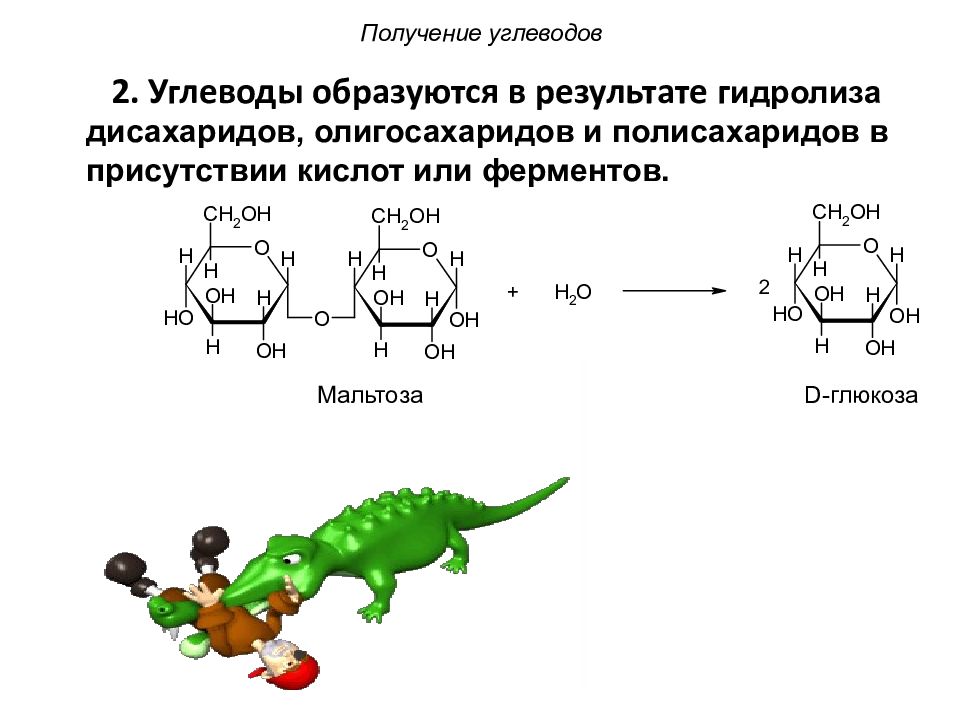
Слайд 16: 2. Углеводы образуются в результате г идролиза дисахаридов, олигосахаридов и полисахаридов в присутствии кислот или ферментов
Получение углеводов Мальтоза D- глюкоза
Слайд 17: Моносахариды
Углеводы Углеводы - гетерофункциональные соединения полигидроксикарбонильного ряда и их производные. Общая формула простых моносахаридов: C n ( H 2 O ) m Ранее сахара считали гидратированными формами углерода, что объясняет этимологию слова “углевод”. Англ. Carbohydrate происходит от carbon (углерод) и гидрат (от греч. udor – вода).
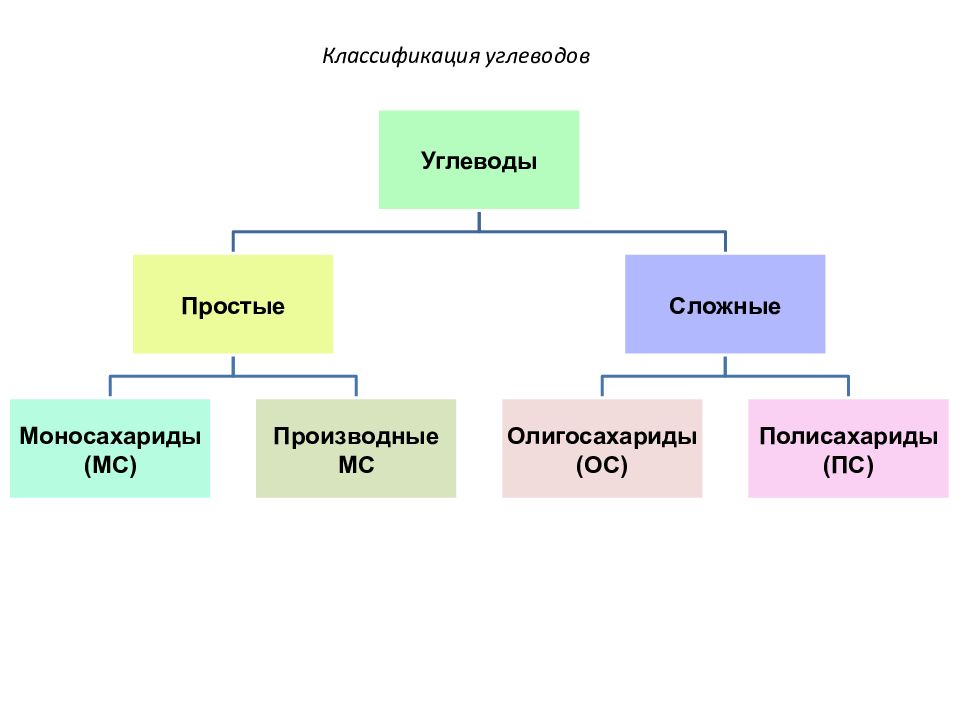
Слайд 18: Классификация углеводов
По способности к гидролизу углеводы делятся на 2 класса: 1. Простые (греч. mono – один) – не подвергаются гидролизу; 2. сложные - гидролизуются с образованием простых углеводов.
Слайд 20: Классификация углеводов
Олигосахариды содержат от 2 до 10 остатков моносахаридов, а полисахариды – несколько десятков тысяч. И те, и другие являются продуктами поликонденсации моносахаридов. Полисахариды подразделяются на: - гомополисахариды - однородные по составу сложные углеводы; - гетерополисахариды - сложные углеводы, включающие остатки разных моносахаридов.
Слайд 21: Моносахариды
Моносахариды о тносятся к полигидроксикарбонильным соединениям. Классификация моносахаридов : Моносахариды делят по функциональной принадлежности на: 1. альдозы – полигидроксиальдегиды ; 2. кетозы – полигидроксикетоны. По числу атомов углерода в цепи различают: 1. триозы ; 2. тетрозы ; 3. пентозы; 4. гексозы; 5. высшие сахара.
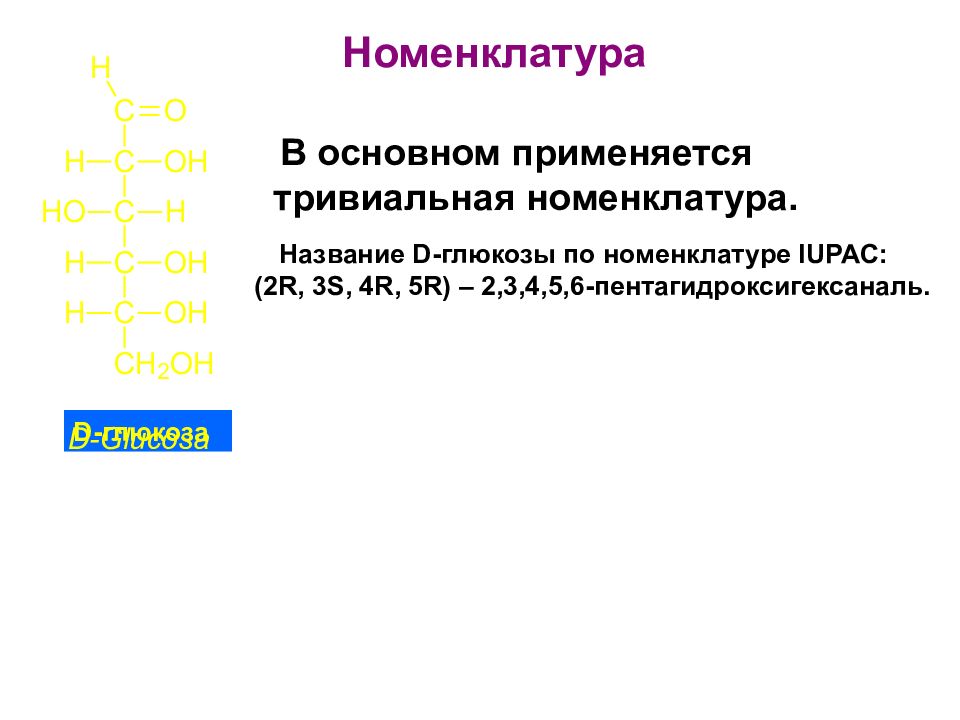
Слайд 22
Номенклатура Название D -глюкозы по номенклатуре IUPAC : (2 R, 3 S, 4 R, 5 R ) – 2,3,4,5,6-пентагидроксигексаналь. D -глюкоза В основном применяется тривиальная номенклатура.
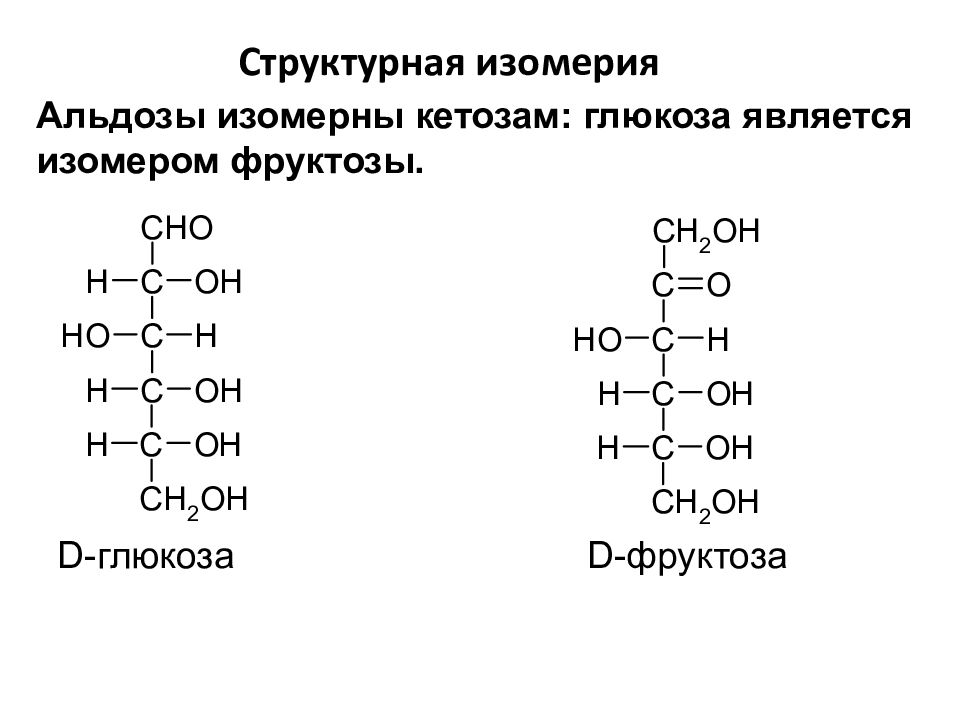
Слайд 23
Структурная изомерия А льдозы изомерны кетозам : глюкоза является изомером фруктозы. D- глюкоза D -фруктоза
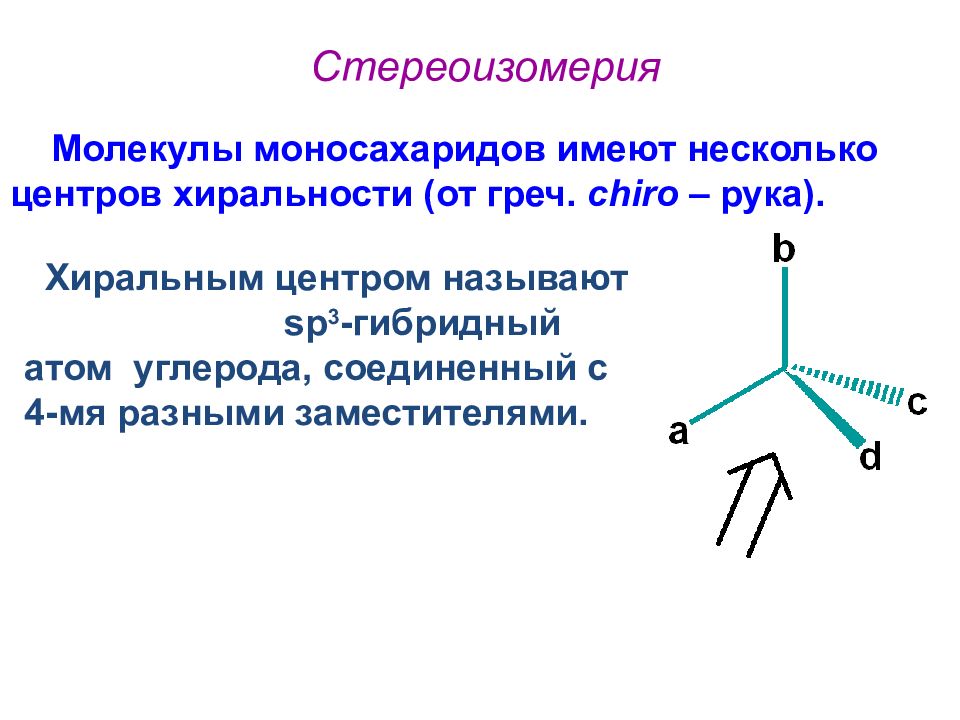
Слайд 24: Стереоизомерия
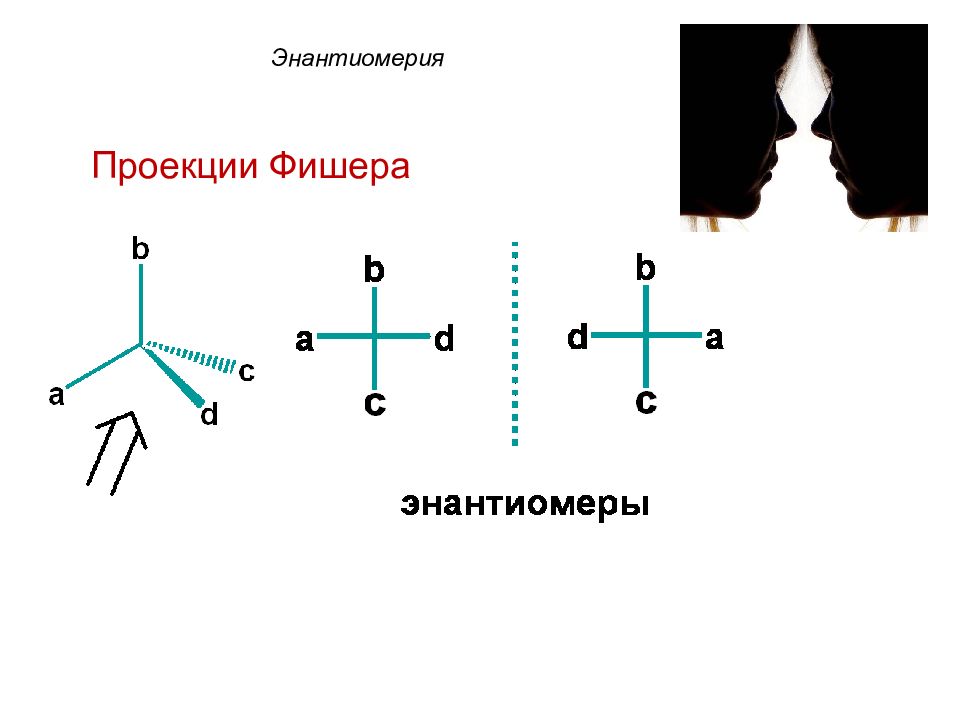
Молекулы моносахаридов имеют несколько центров хиральности (от греч. с hiro – рука). Хиральным центром называют sp 3 - гибридный атом углерода, соединенный с 4-мя разными заместителями.
Слайд 25
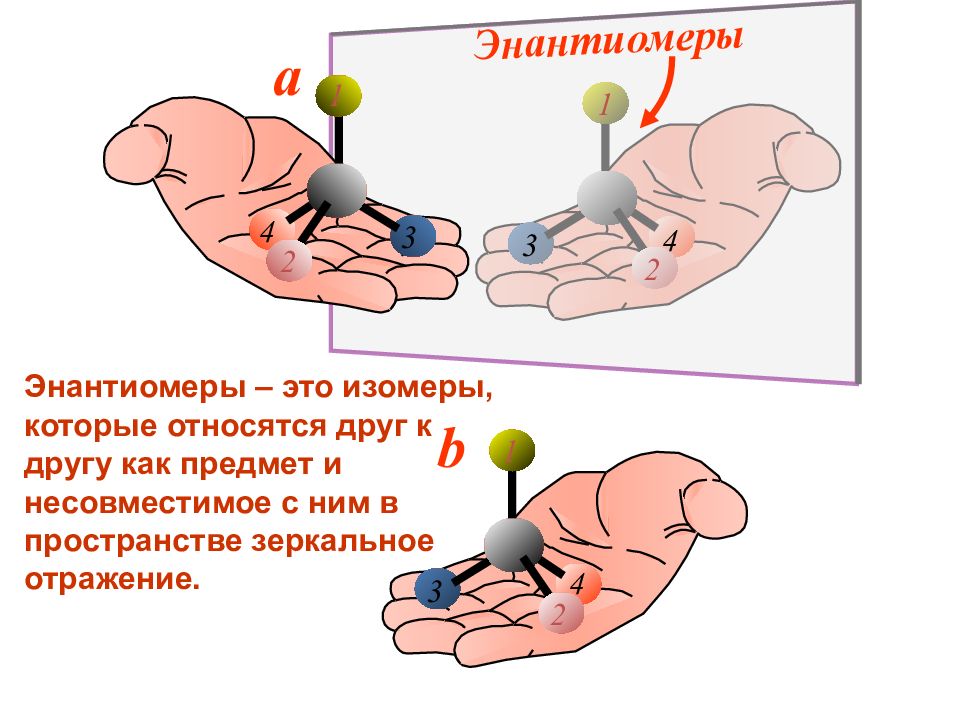
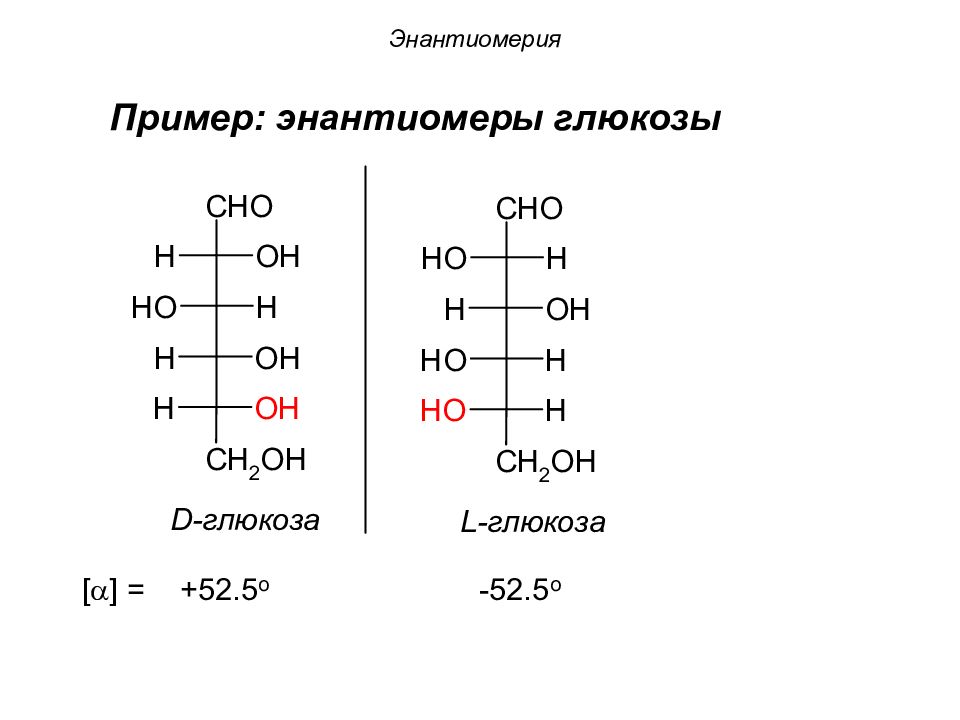
Энантиомеры 1 2 3 4 a 1 2 3 4 b 4 2 3 1 Энантиомеры – это изомеры, которые относятся друг к другу как предмет и несовместимое с ним в пространстве зеркальное отражение.
Слайд 27: Энантиомерия
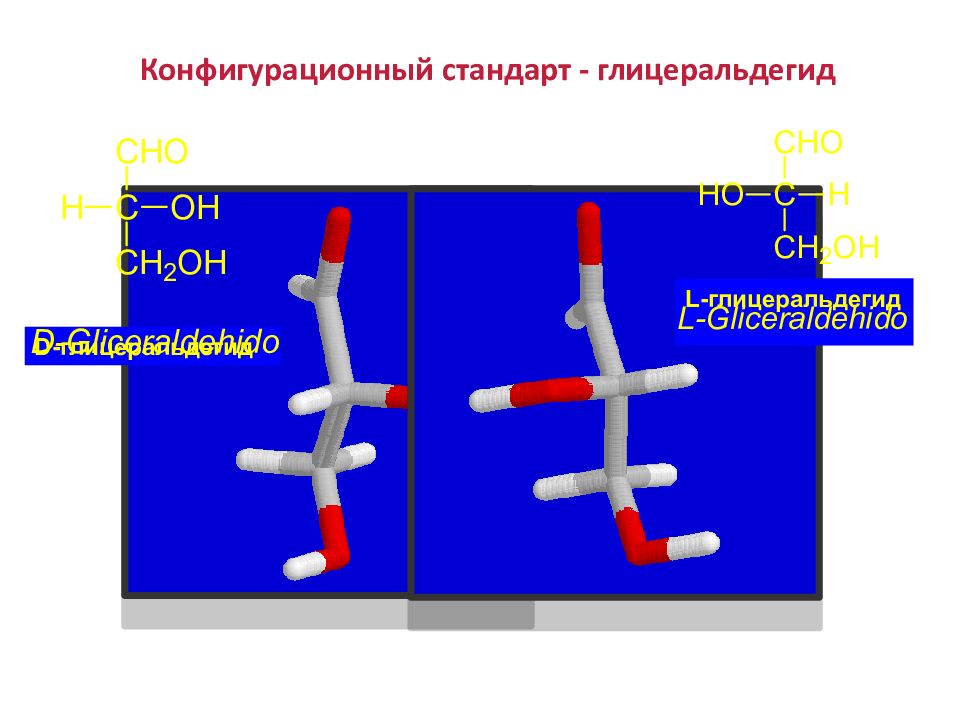
В зависимости от конфигурации хирального центра различают D - и L - конфигурации (формы). В D -форме гидроксильная (- ОН) функциональная группа хирального центра располагается справа от углеродной цепи; В L -форме – функциональная гидроксильная (- ОН) группа хирального центра располагается слева от углеродной цепи.
Слайд 28: Конфигурационный стандарт - глицеральдегид
D -глицеральдегид L -глицеральдегид
Слайд 29
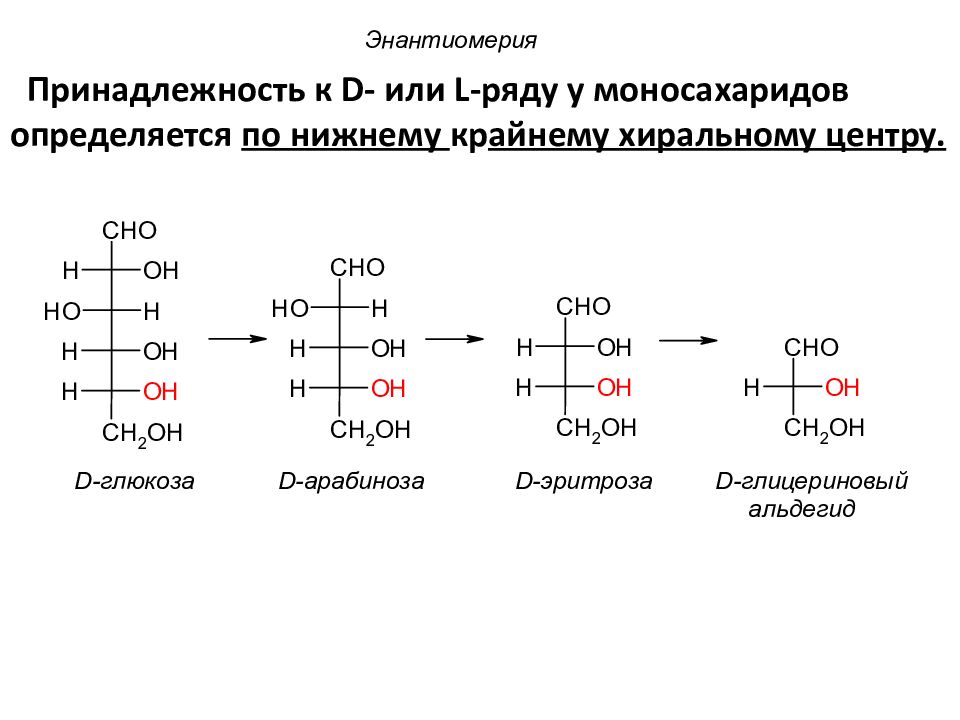
Энантиомерия Принадлежность к D - или L -ряду у моносахаридов определяется по нижнему кр айнему хиральному центру.
Слайд 30: Энантиомерия
Энантиомерам D -ряда углеводов соответствует энантиомер L -ряда с противоположной конфигурацией всех центров хиральности. Большинство природных моносахаридов принадлежат D -ряду.
Слайд 32: Энантиомерия
Энантиомеры обладают одинаковыми физическими и химическими свойствами, но являются оптическими антиподами и имеют различную физиологическую активность. Энантиомерия
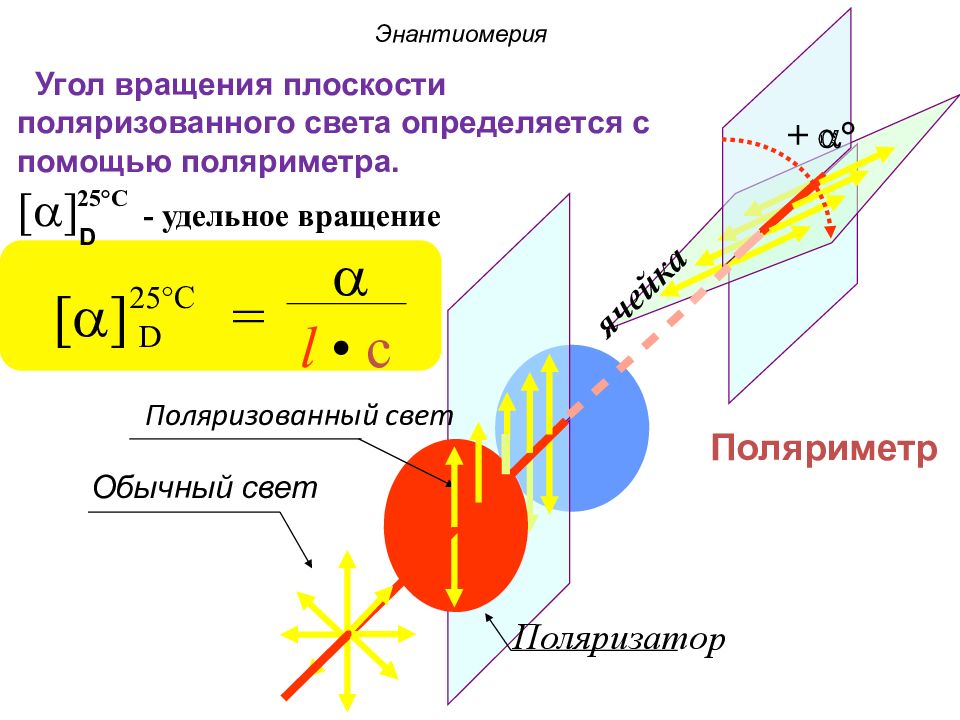
Слайд 33
+ a ° ячейка Поляризатор Поляризованный свет Обычный свет [ a ] = a l • c 25°C D Поляриметр Угол вращения плоскости поляризованного света определяется с помощью поляриметра. [ a ] - удельное вращение Энантиомерия 25°C D
Слайд 34
σ - Диастереомеры – оптические изомеры, не являющиеся зеркальным изображением друг друга. σ - Диастереомерия σ - Диастереомерия возникает в молекулах с 2 и более центрами хиральности.
Слайд 35
Число стереоизомеров рассчитывают по формуле Фишера: Z =2 n, где n -число центров хиральности. σ - Диастереомерия σ – Диастереомеры имеют разные физические и химические свойства и физиологическое действие.
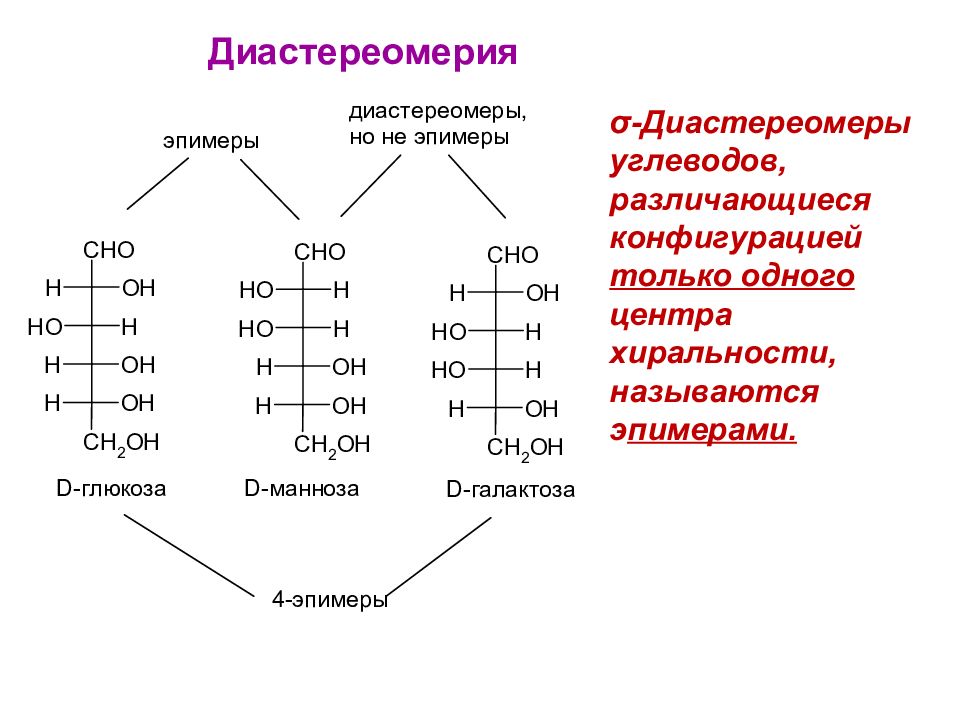
Слайд 36
Диастереомерия σ -Диастереомеры углеводов, различающиеся конфигурацией только одного центра хиральности, называются э пимерами.
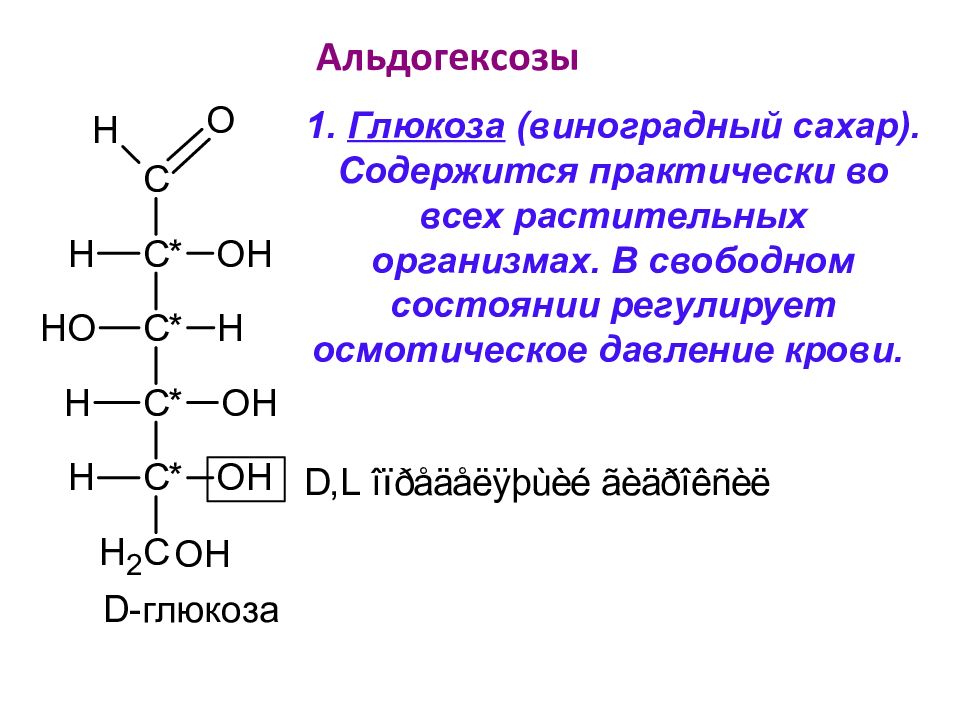
Слайд 37: Альдогексозы
D -глюкоза 1. Глюкоза (виноградный сахар). Содержится практически во всех растительных организмах. В свободном состоянии регулирует осмотическое давление крови.
Слайд 38: Альдогексозы
Глюкоза Международное наименование: Декстроза ( Dextrose) 5% Раствор глюкозы оказывает дезинтоксикационное, метаболическое действие, является источником энергии. Гипертонические растворы (10%, 20%, 40%) повышают осмотическое давление крови, улучшают обмен веществ; повышают сократимость миокарда; улучшают антитоксическую функцию печени, расширяют сосуды, увеличивают диурез.
Слайд 39: Альдогексозы
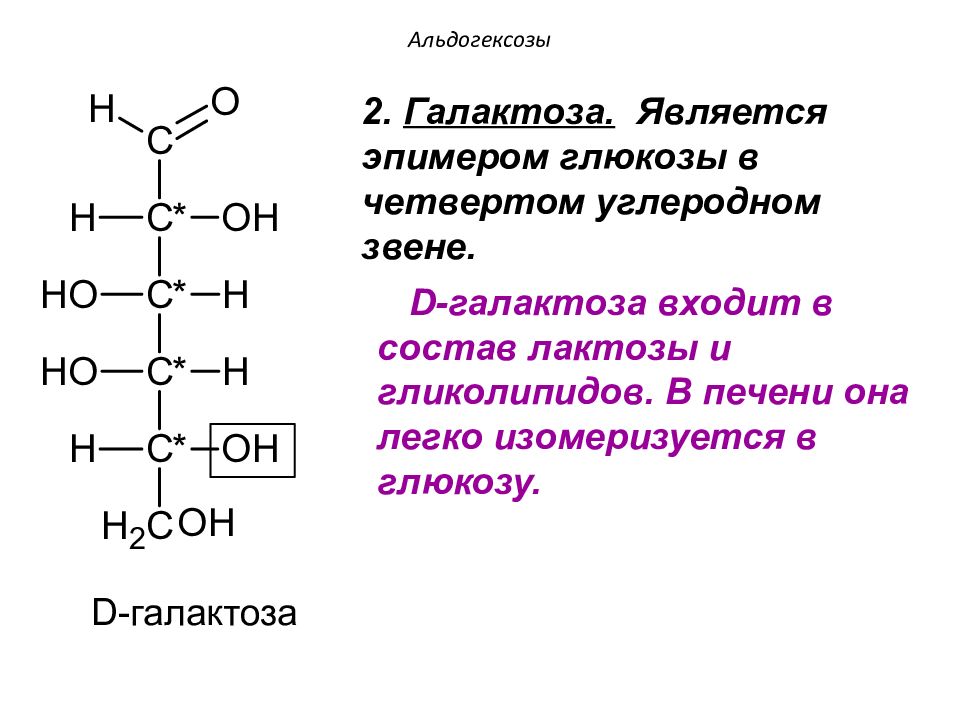
D -галактоза D -галактоза входит в состав лактозы и гликолипидов. В печени она легко изомеризуется в глюкозу. 2. Галактоза. Является эпимером глюкозы в четвертом углеродном звене.
Слайд 40: Альдогексозы
Галактоза ( Galactose ) – ультразвуковое контрастно-диагностическое средство.
Слайд 41: Альдогексозы
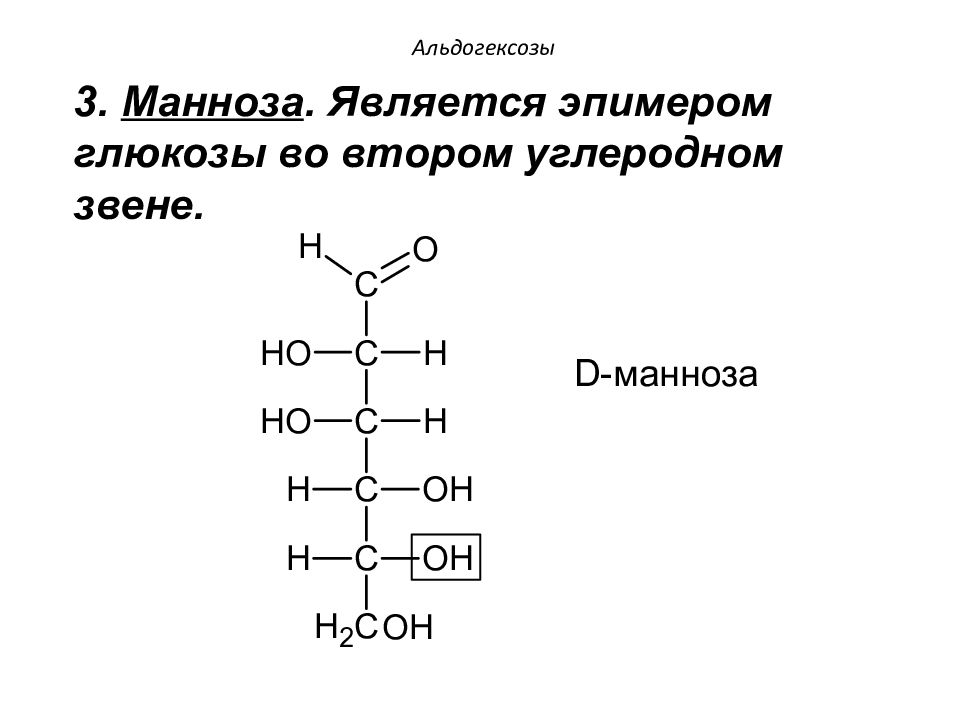
3. Манноза. Является эпимером глюкозы во втором углеродном звене. Альдогексозы D - манноза
Слайд 42: Альдопентозы
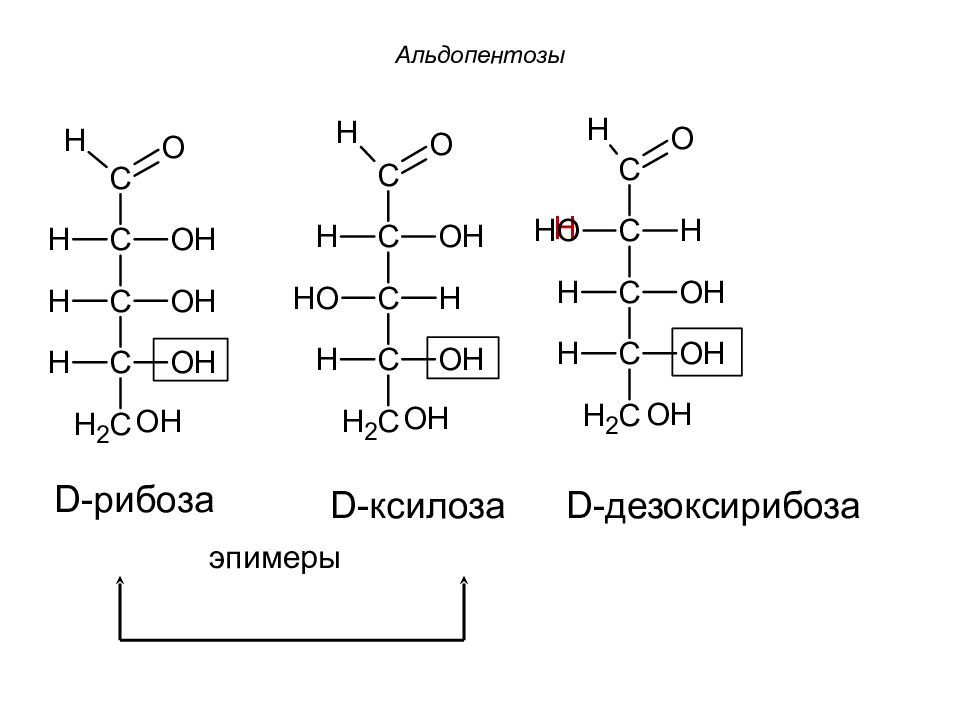
1. D -рибоза. Входит в состав нуклеотидов РНК. 2. D -ксилоза – эпимер рибозы в третьем углеродном звене. 3. Производным рибозы является дезоксисахар – 2-дезокси- D -рибоза (дезоксирибоза) - входит в состав ДНК.
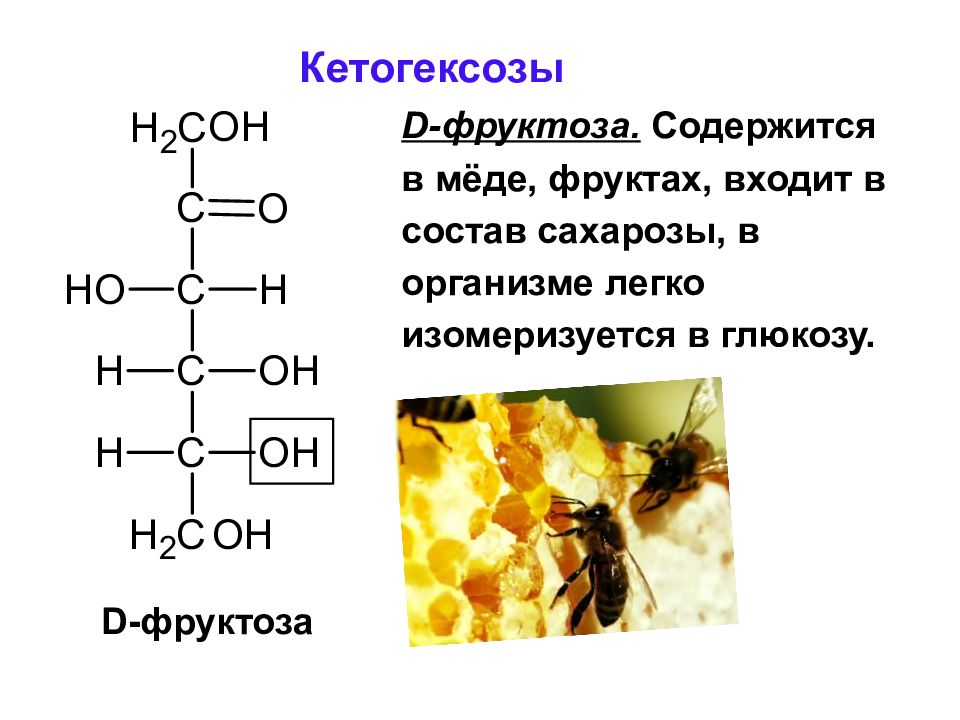
Слайд 44: Кетогексозы
D-фруктоза. Содержится в мёде, фруктах, входит в состав сахарозы, в организме легко изомеризуется в глюкозу. D -фруктоза
Слайд 45
Фруктоза - парентеральное средство для регидратации и дезинтоксикации. Кетогексозы
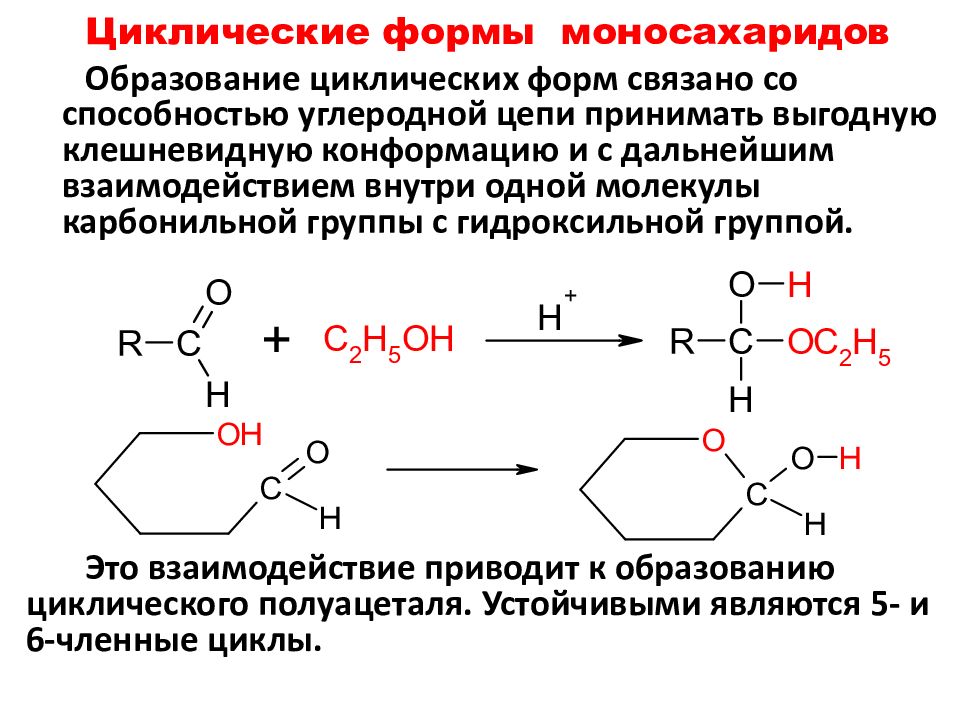
Слайд 46: Циклические формы моносахаридов
Образование циклических форм связано со способностью углеродной цепи принимать выгодную клешневидную конформацию и с дальнейшим взаимодействием внутри одной молекулы карбонильной группы с гидроксильной группой. Это взаимодействие приводит к образованию циклического полуацеталя. Устойчивыми являются 5- и 6-членные циклы.
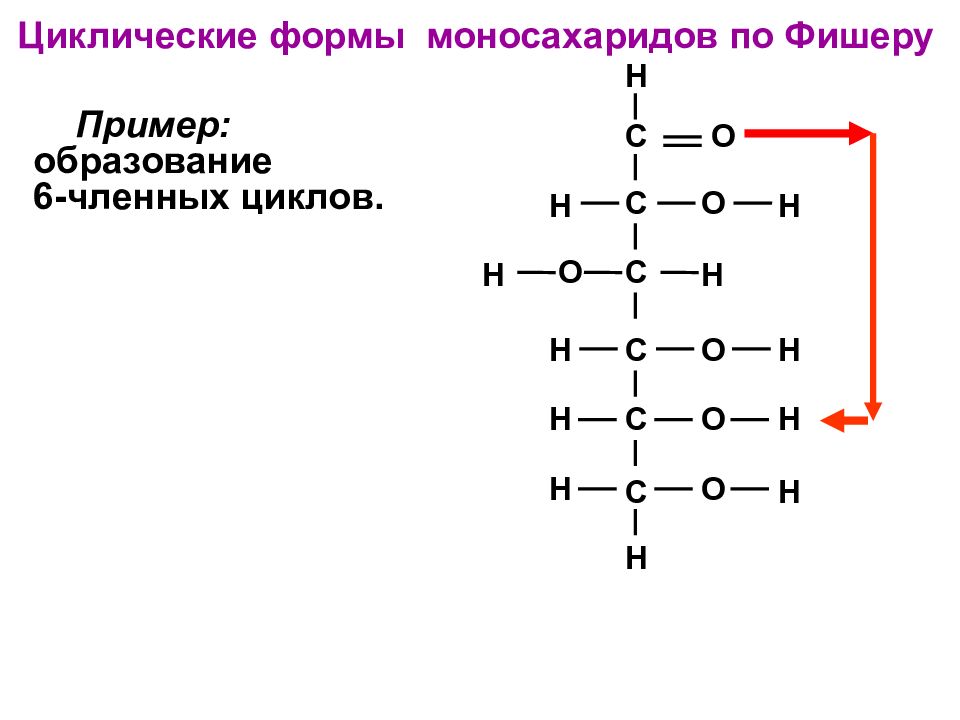
Слайд 47
C C C C C C O O O O O O H H H H H H H H H H H H Пример: образование 6-членных циклов. Циклические формы моносахаридов по Фишеру
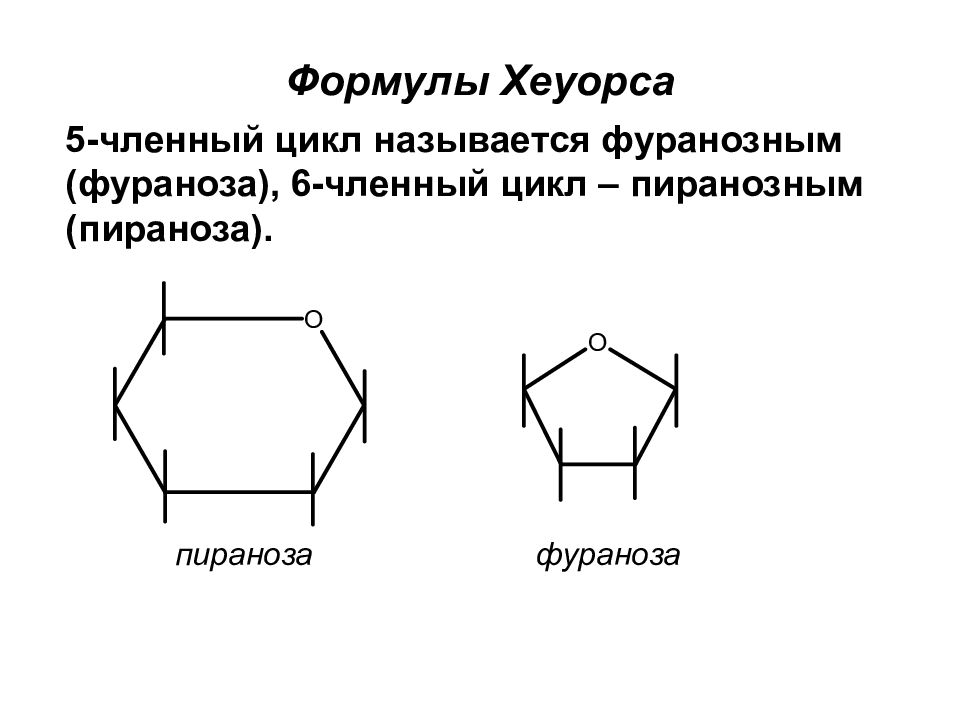
Слайд 48
пираноза фураноза Формулы Хеуорса 5-членный цикл называется фуранозным (фураноза), 6-членный цикл – пиранозным (пираноза).
Слайд 49
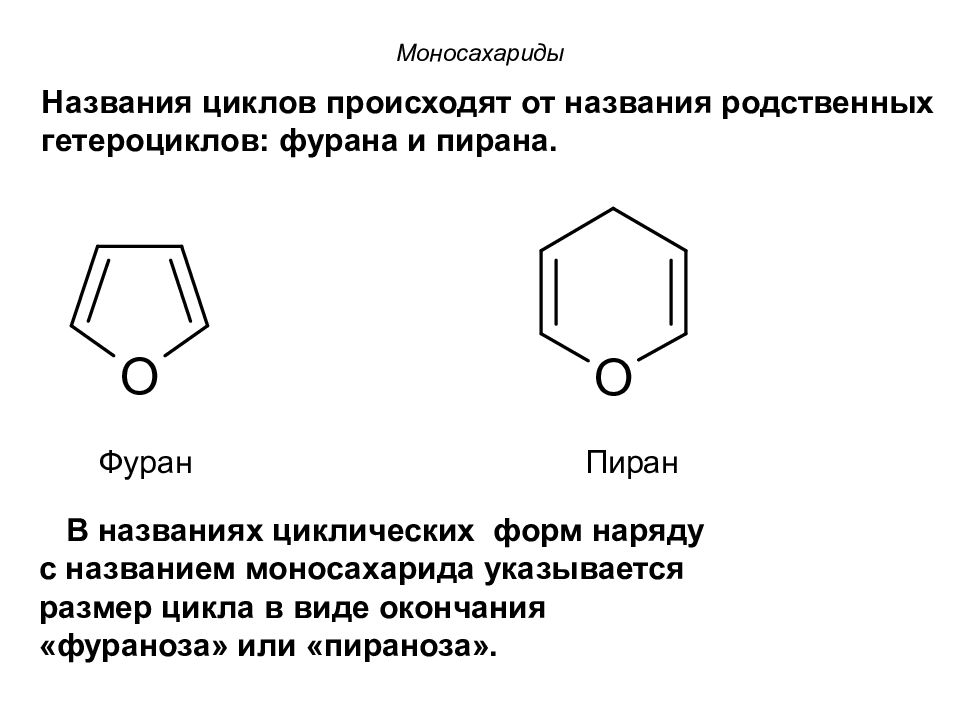
Фуран Пиран Моносахариды Названия циклов происходят от названия родственных гетероциклов: фурана и пирана. В названиях циклических форм наряду с названием моносахарида указывается размер цикла в виде окончания «фураноза» или «пираноза».
Слайд 50: Моносахариды
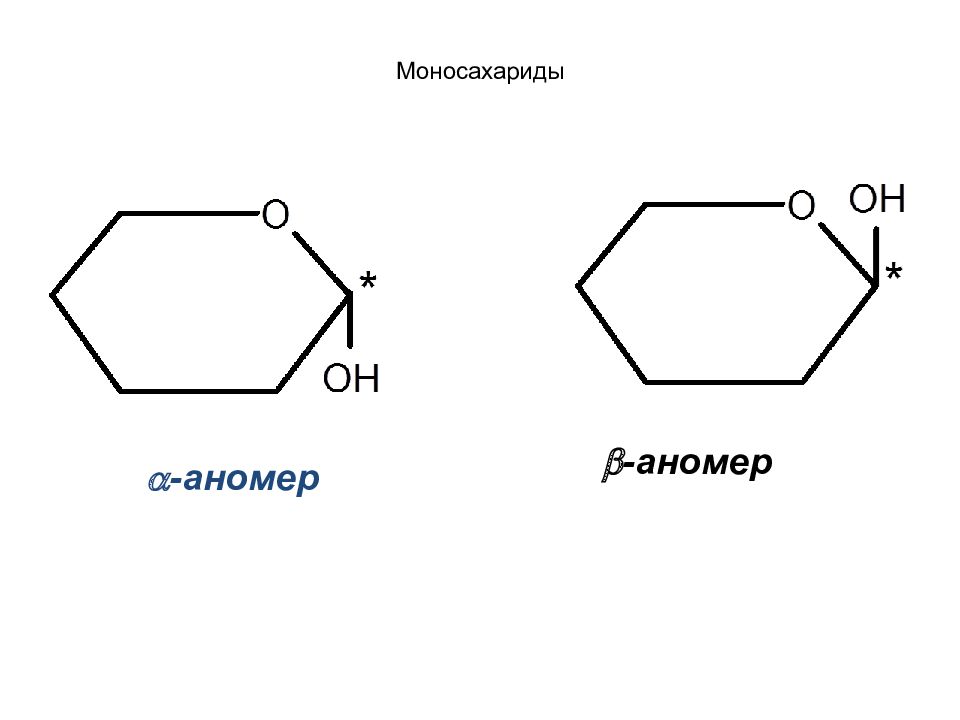
Нумерацию цепи в формулах Хеуорса ведут от крайнего правого положения по часовой стрелке. Последнее звено -СН 2 ОН выносят над плоскостью цикла, что является дополнительным D -признаком по Хеуорсу. Если полуацетальный гидроксил расположен под плоскостью цикла, то имеем -аномер. Если полуацетальный гидроксил расположен над плоскостью цикла - -аномер.
Слайд 52
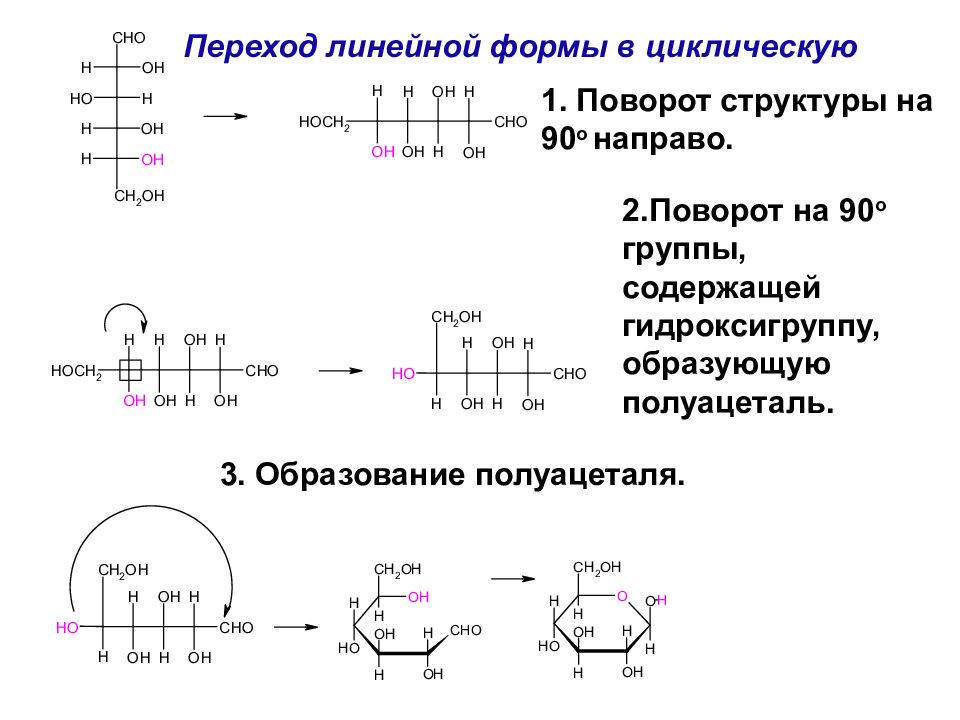
Переход линейной формы в циклическую 1. Поворот структуры на 90 o направо. 2.Поворот на 90 o группы, содержащей гидроксигруппу, образующую полуацеталь. 3. Образование полуацеталя.
Слайд 53
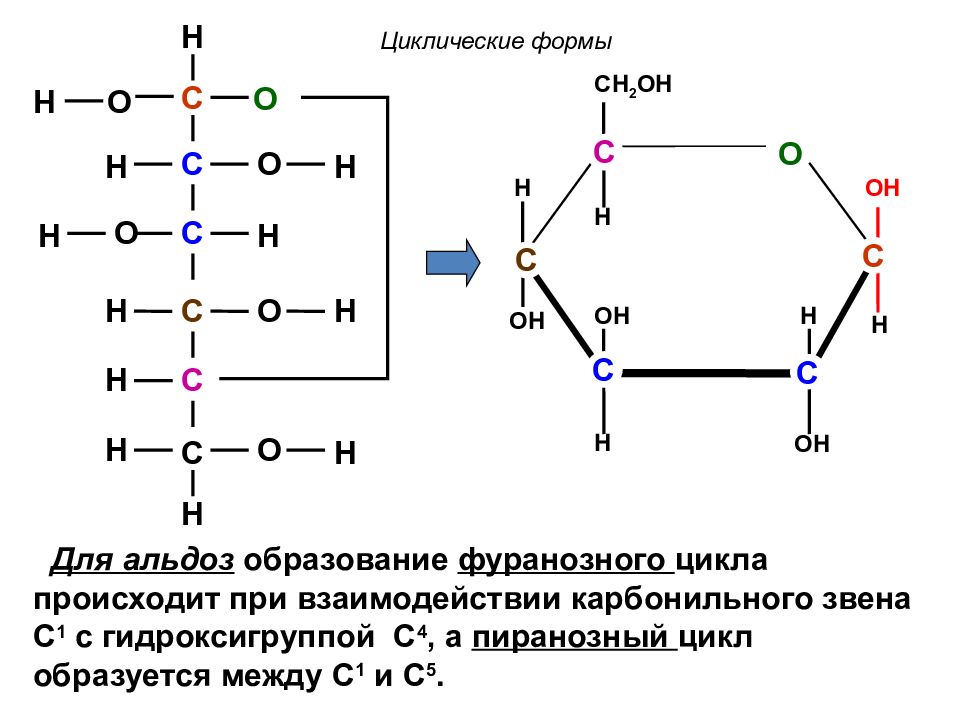
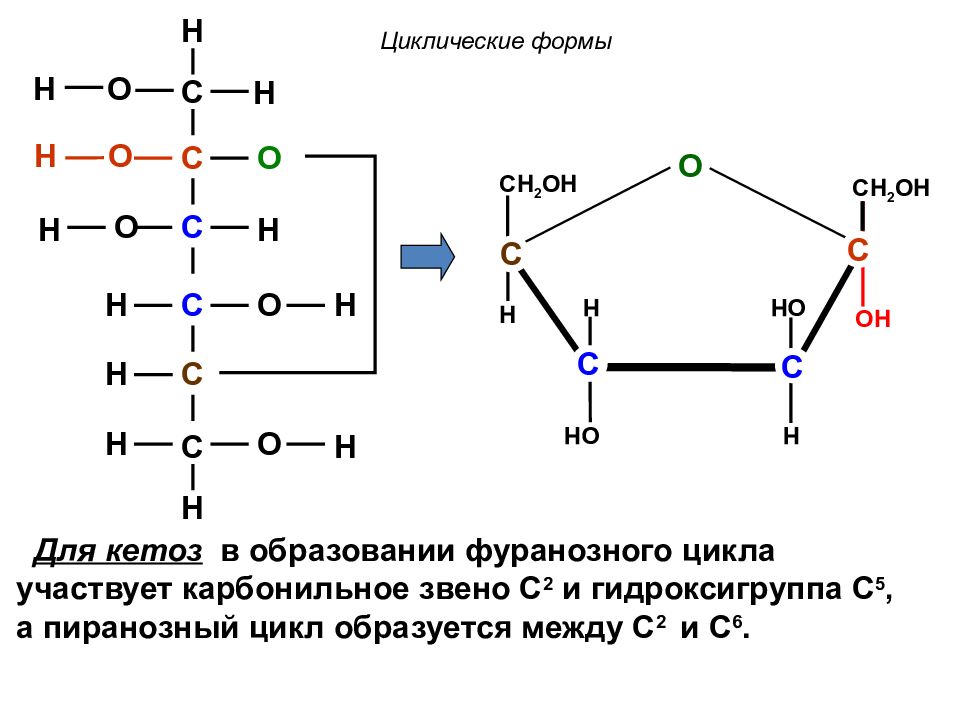
C C C C C C O O O O O H H H H O H H H H H H H H O OH H OH H H CH 2 OH H OH C C C OH H C C Для альдоз образование фуранозного цикла происходит при взаимодействии карбонильного звена С 1 с гидроксигруппой С 4, а пиранозный цикл образуется между С 1 и С 5. Циклические формы
Слайд 54
C C C C C C O O O O H H H H O H H H H H H H O OH H OH CH 2 OH H C C C OH H C CH 2 OH O H Для кетоз в образовании фуранозного цикла участвует карбонильное звено С 2 и гидроксигруппа С 5, а пиранозный цикл образуется между С 2 и С 6. Циклические формы
Слайд 55: Моносахариды
В растворе моносахариды присутствуют в открытых и циклических формах, способных свободно переходить друг в друга. Такой вид изомерии называется цикло-оксо-таутомерией (кольчато-цепной таутомерией). Изомеры, взаимно переходящие друг в друга и находящиеся в состоянии динамического равновесия, называются таутомерами.
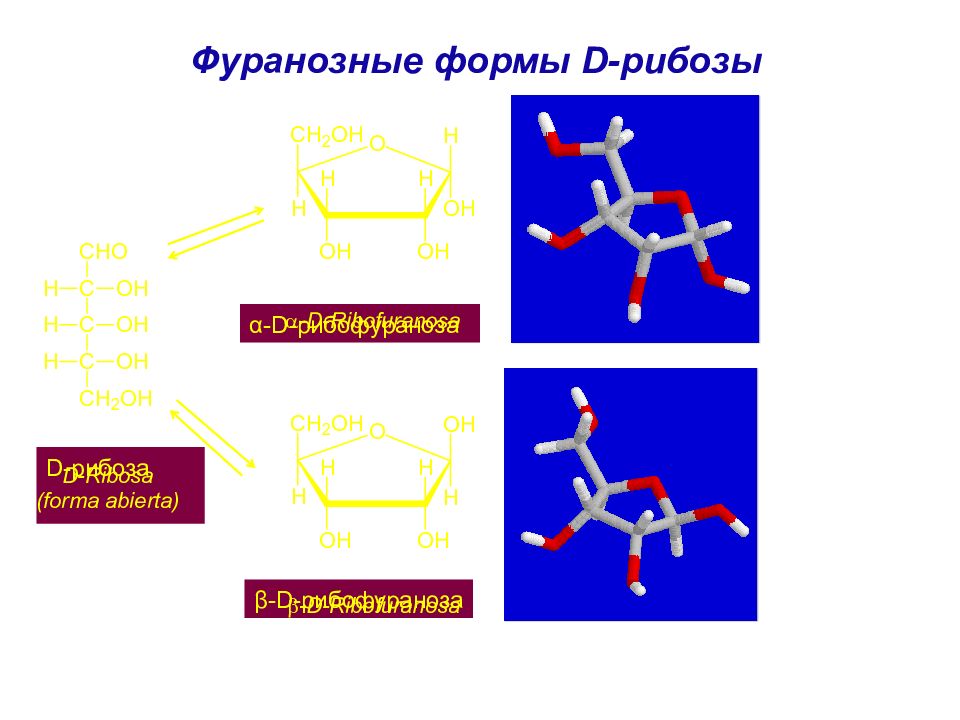
Слайд 56: Фуранозные формы D -рибозы
D -рибоза α - D -рибофураноза β - D -рибофураноза
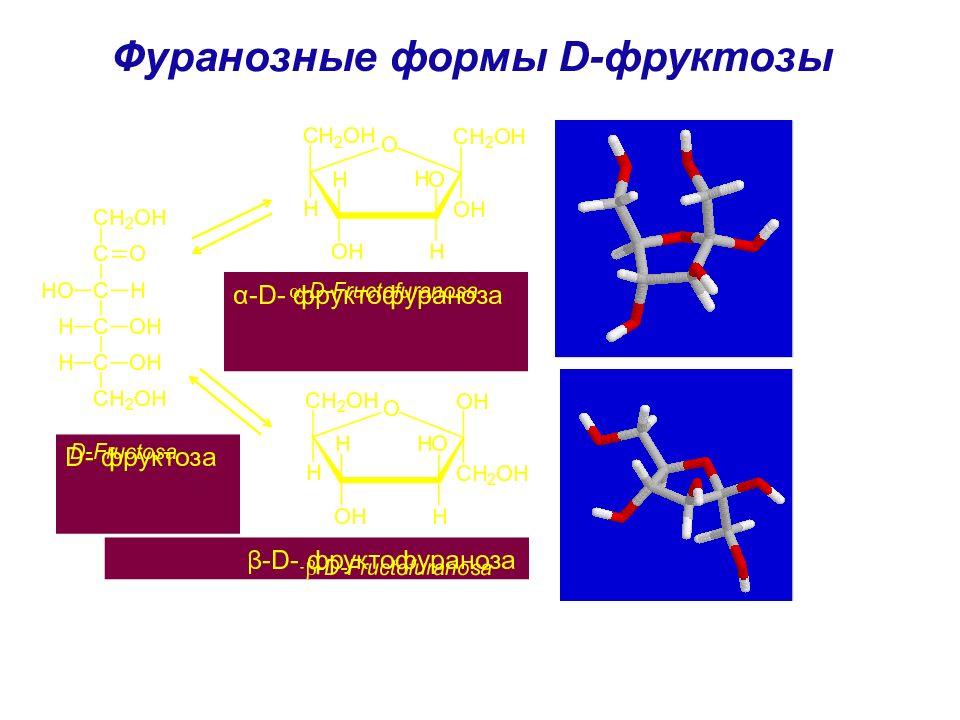
Слайд 57: Фуранозные формы D- фруктозы
α - D - фруктофураноза β - D - фруктофураноза D - фруктоза
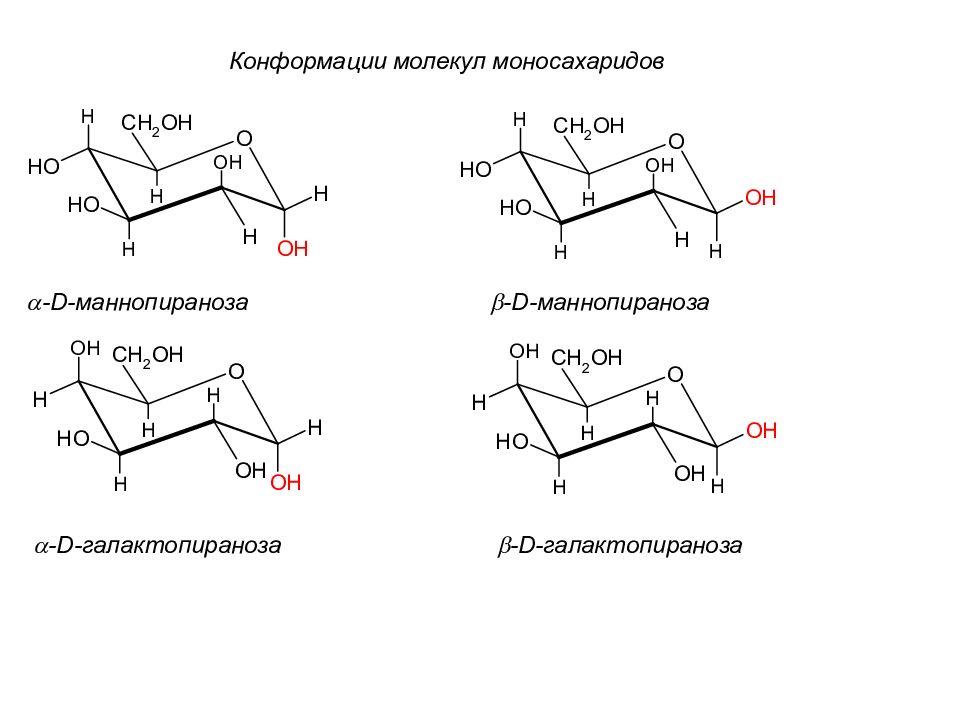
Слайд 58
a -D- маннопираноза b -D- маннопираноза a - D -галактопираноза b - D -галактопираноза Конформации молекул моносахаридов
Слайд 59: Физические свойства
Моносахариды представляют собой бесцветные кристаллические вещества очень хорошо растворимые в воде. Моносахариды трудно растворяются в спирте, очень плохо в гидрофобных растворителях. Концентрированные растворы сахаров в воде называются сиропами.
Слайд 60
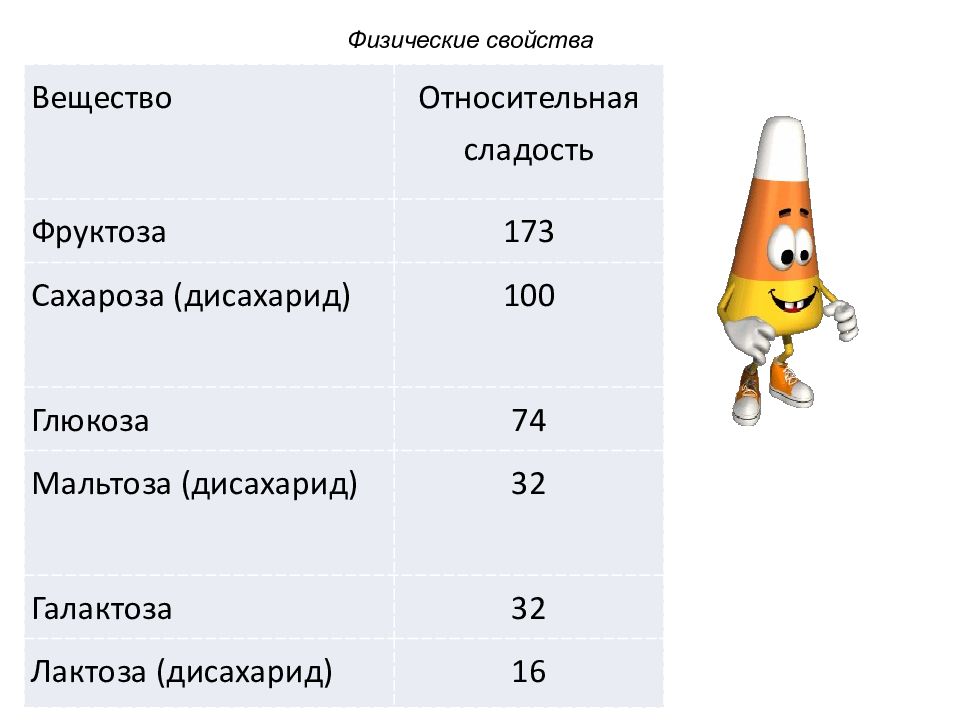
Вещество Относительная сладость Фруктоза 173 Сахароза (дисахарид) 100 Глюкоза 74 Мальтоза (дисахарид) 32 Галактоза 32 Лактоза (дисахарид) 16 Физические свойства
Слайд 61
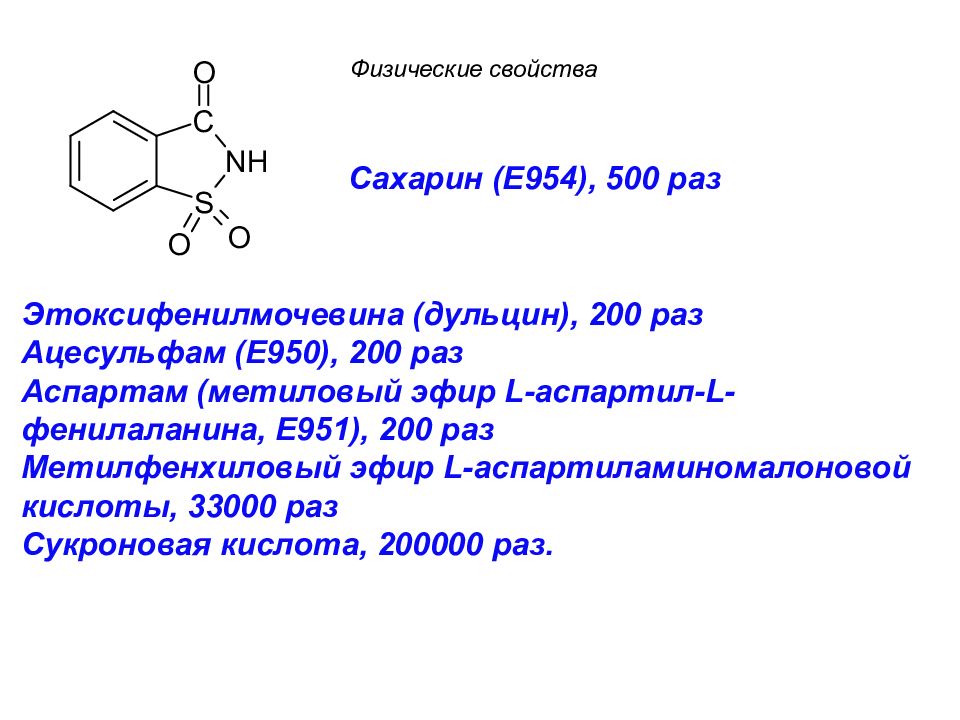
Сахарин ( E 954), 500 раз Этоксифенилмочевина (дульцин), 200 раз Ацесульфам (E950), 200 раз Аспартам (метиловый эфир L -аспартил- L -фенилаланина, E 951), 200 раз Метилфенхиловый эфир L -аспартиламиномалоновой кислоты, 33000 раз Сукроновая кислота, 200000 раз. Физические свойства
Слайд 62
Белок монеллин из тропического растения Dioscoreophyllum cumminsii в 3000 раз слаще сахарозы. Физические свойства
Слайд 63
Белок тауматин ( E957 ) из тропического растения Thaumacoccus daniellii слаще сахарозы в 750-1000 раз, а его комплекс с ионами алюминия – талин – уже в 35000 раз. Thaumacoccus daniellii Физические свойства
Слайд 64
Белок миракулин из Synsepalum dulcificum имеет уникальное свойство воздействовать на вкусовые рецепторы, отключая на время восприятие кислого и горького вкусов, при этом все остальные вкусовые ощущения остаются. Synsepalum dulcificum Физические свойства
Слайд 65
Физические свойства Фрукт Synsepalum dulcificum сам по себе не сладкий, но может использоваться как натуральный подсластитель.
Слайд 66: Производные моносахаридов
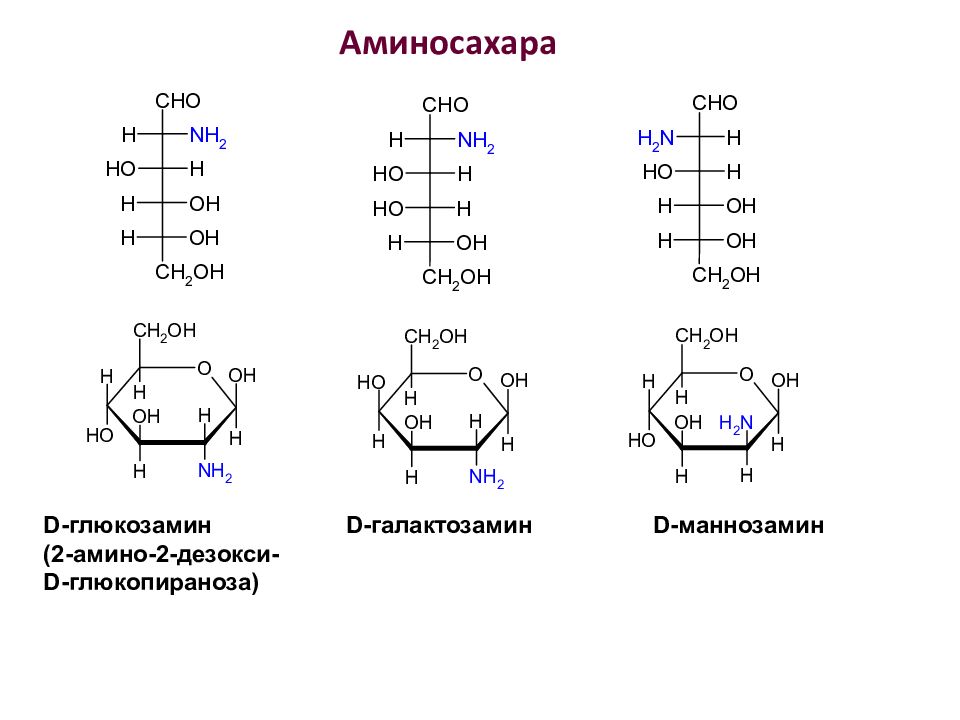
Аминосахара – образуются на основе моносахаридов, в молекулах которых OH -группа второго звена замещена аминогруппой - NH 2. α - D- глюкозамин
Слайд 67
Аминосахара D -глюкозамин D -галактозамин D -маннозамин (2-амино-2-дезокси- D -глюкопираноза)
Слайд 68: Глюкозамин
Глюкозамин применяется в качестве лекарственного средства группы нестероидных противовоспалительных препаратов для восполнения его эндогенного дефицита.
Слайд 69: Химические свойства моносахаридов
Исходя из функционального состава, моносахариды проявляют свойства многоатомных спиртов, карбонильных соединений, полуацеталей и специфические свойства.
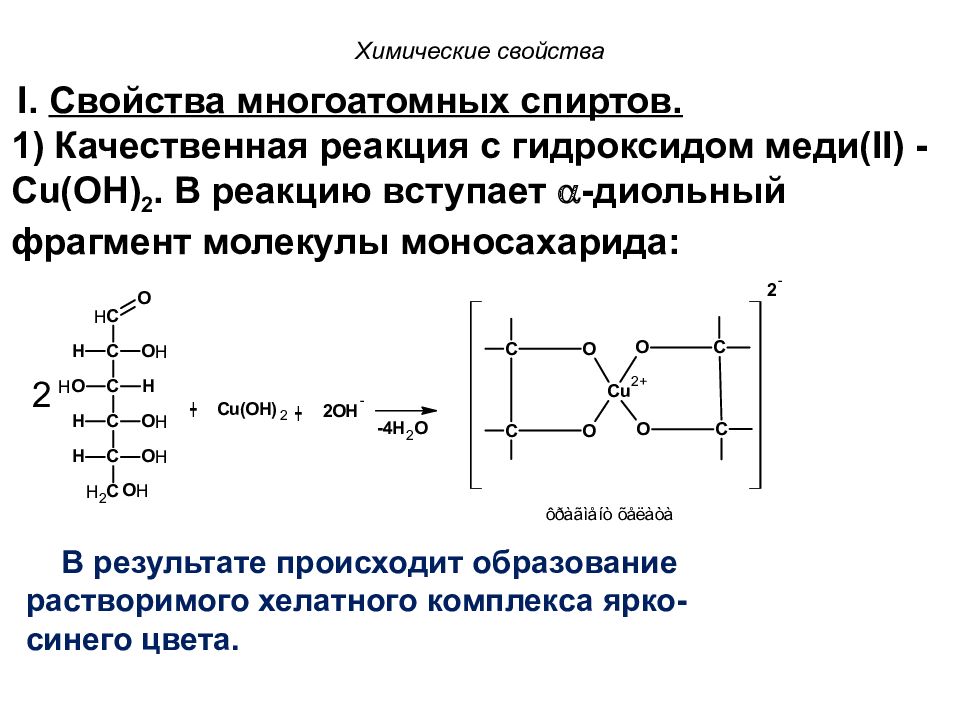
Слайд 70
Химические свойства I. Свойства многоатомных спиртов. 1) Качественная реакция с гидроксидом меди( II ) - С u ( OH ) 2. В реакцию вступает -диольный фрагмент молекулы моносахарида: В результате происходит образование растворимого хелатного комплекса ярко-синего цвета.
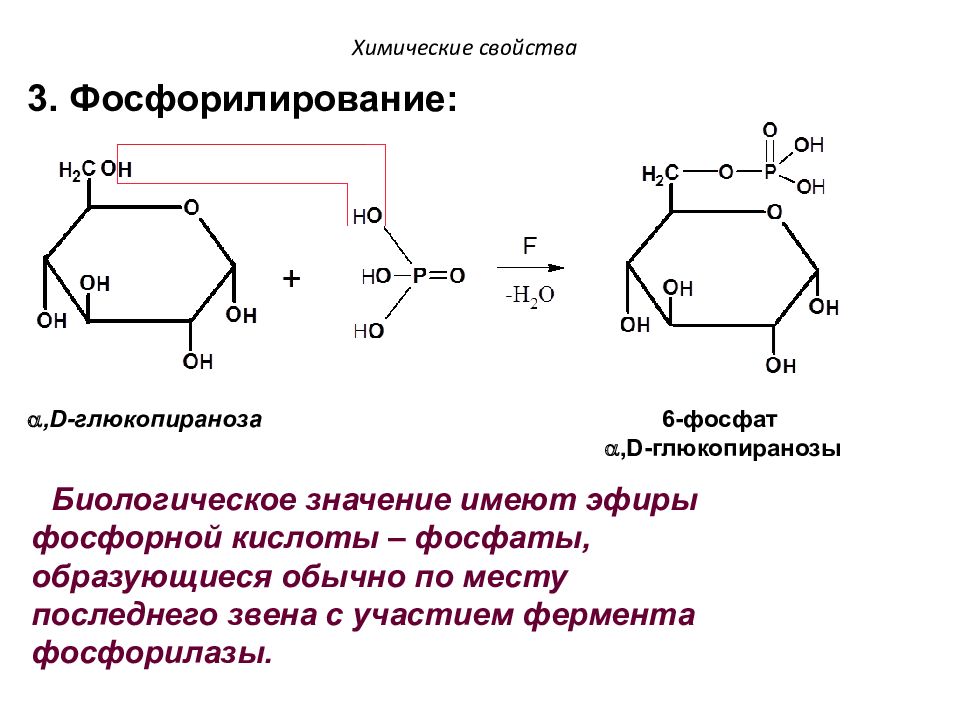
Слайд 71: Химические свойства
, D -глюкопираноза 6-фосфат , D -глюкопиранозы Химические свойства 3. Фосфорилирование: Биологическое значение имеют эфиры фосфорной кислоты – фосфаты, образующиеся обычно по месту последнего звена с участием фермента фосфорилазы.
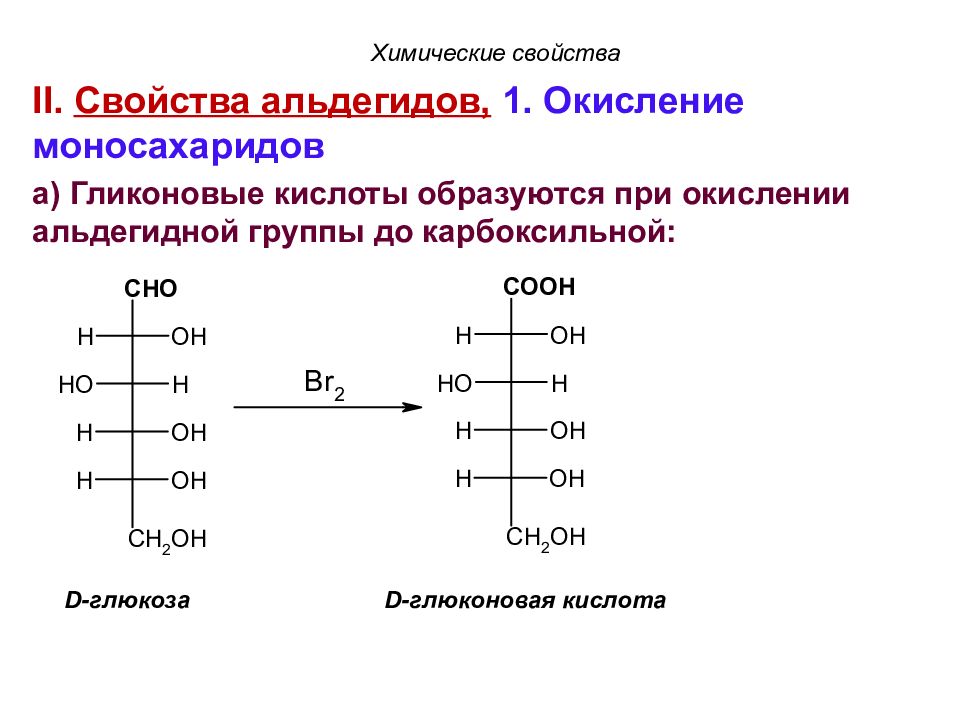
Слайд 72
II. Свойства альдегидов, 1. Окисление моносахаридов а) Гликоновые кислоты образуются при окислении альдегидной группы до карбоксильной: D- глюкоза D- глюконовая кислота Химические свойства
Слайд 73
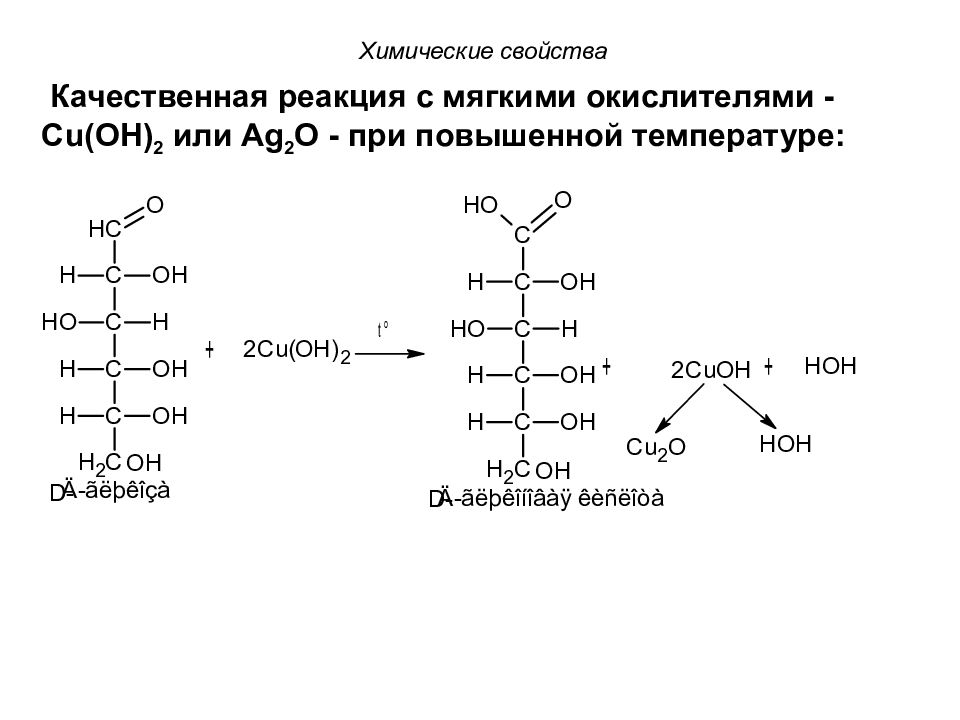
Химические свойства Качественная реакция с мягкими окислителями - С u ( OH ) 2 или Ag 2 O - при повышенной температуре: D - D-
Слайд 74
Реакция с Cu(OH) 2 называется пробой Троммера и используется для обнаружения глюкозы в моче. Химические свойства
Слайд 75
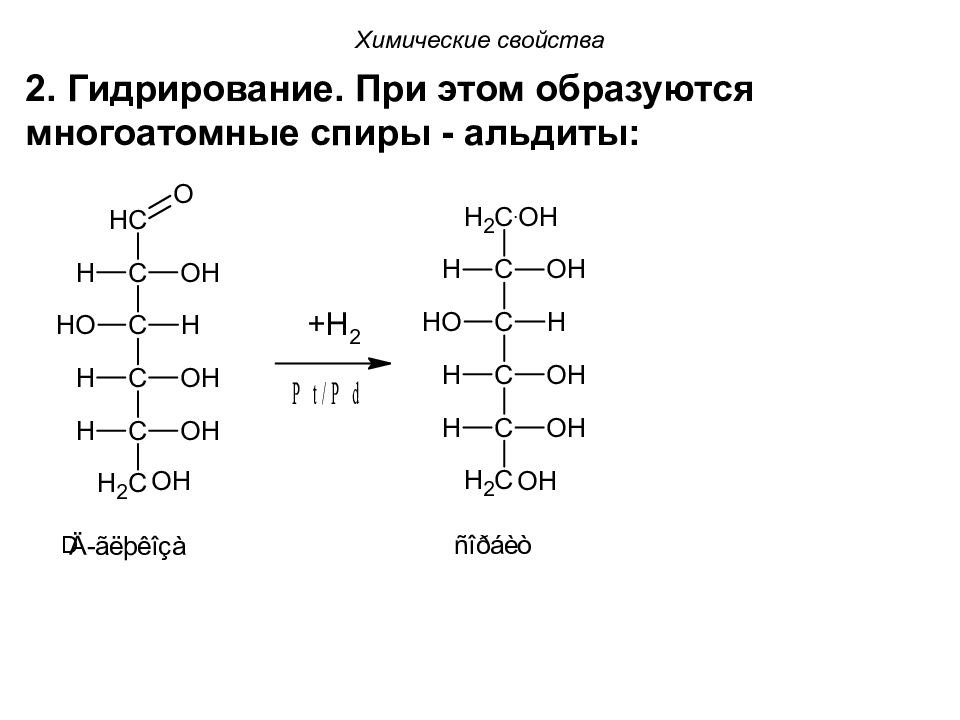
Химические свойства 2. Гидрирование. При этом образуются многоатомные спиры - альдиты: D
Слайд 76
D -глюкоза образует глицит (сорбит, E420 ), D -манноза - маннит, D -ксилоза - ксилит ( E967 ), D- галактоза - дульцит. Химические свойства
Слайд 77
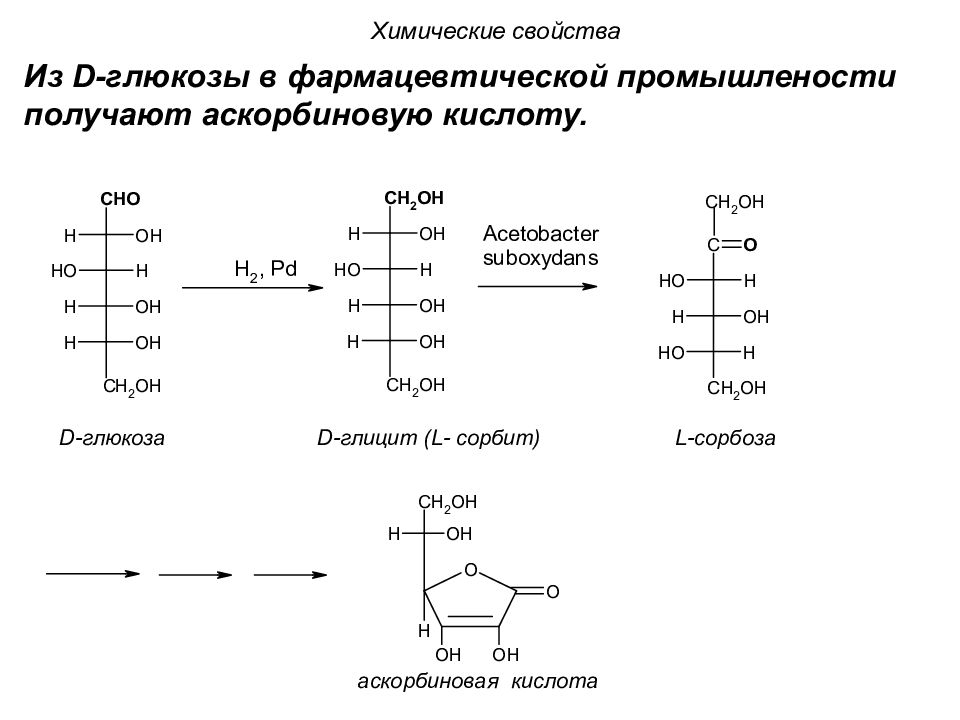
Химические свойства Из D- глюкозы в фармацевтической промышлености получают аскорбиновую кислоту.
Слайд 78
Аскорбиновая кислота (а – отрицающая частица и scorbutus – цинга) (витамин С) - водорастворимый витамин. Химические свойства
Слайд 79
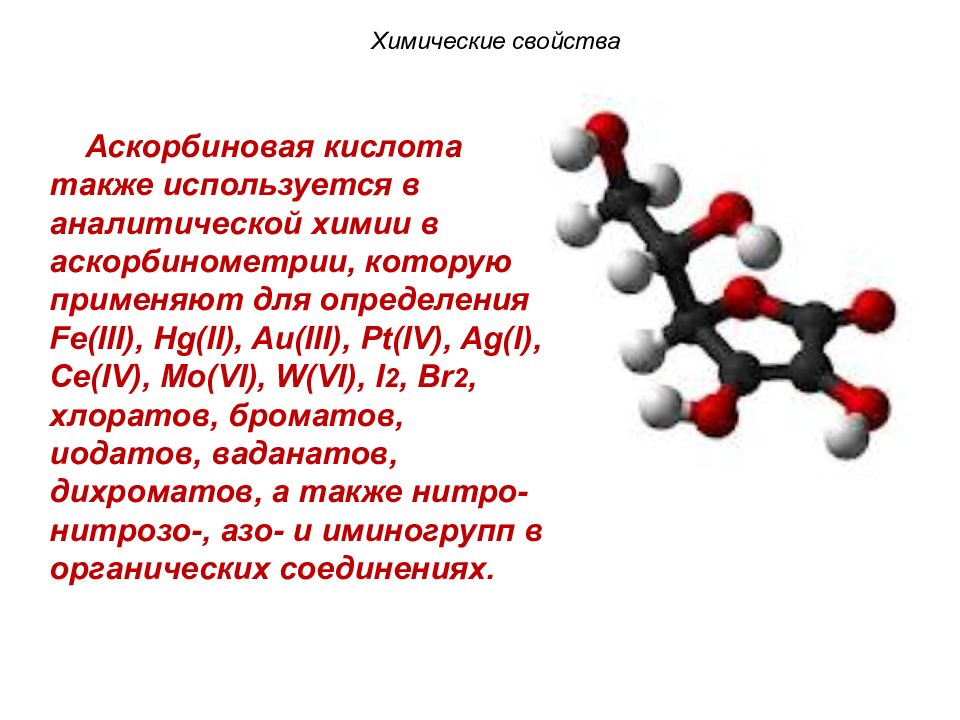
Аскорбиновая кислота также используется в аналитической химии в аскорбинометрии, которую применяют для определения Fe ( III ), Hg ( II ), Au ( III ), Pt ( IV ), Ag ( I ), Ce ( IV ), Mo ( VI ), W ( VI ), I 2, Br 2, хлоратов, броматов, иодатов, ваданатов, дихроматов, а также нитро- нитрозо-, азо- и иминогрупп в органических соединениях. Химические свойства
Слайд 80
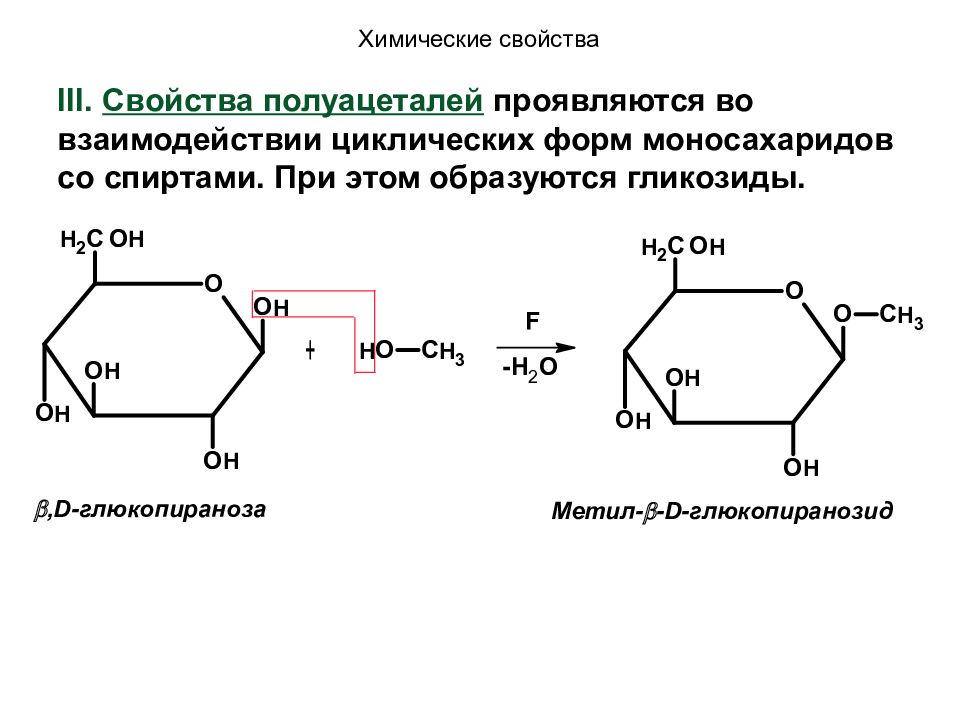
, D -глюкопираноза Метил- - D -глюкопиранозид Химические свойства III. Свойства полуацеталей проявляются во взаимодействии циклических форм моносахаридов со спиртами. При этом образуются гликозиды.
Слайд 81: IV. Специфические свойства
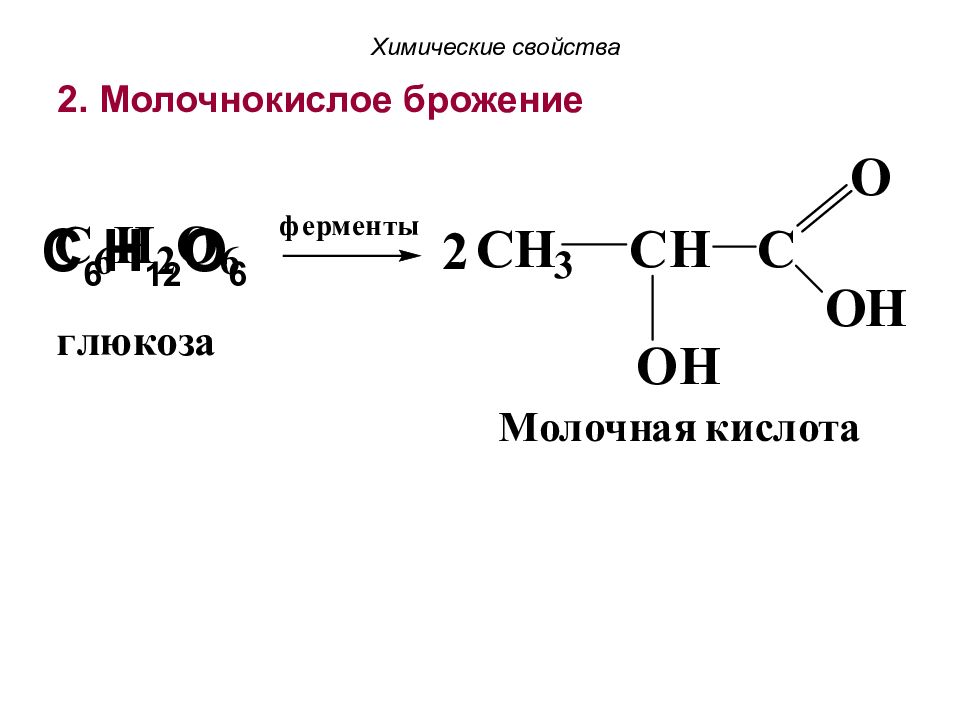
1. Спиртовое брожение Химические свойства C 6 H 1 2 O 6 → 2C 2 H 5 OH + 2 CO 2 ↑ Фермент дрожжей