Первый слайд презентации: Механизмы реакций органических соединений проф. Кацев А.М
Радикальное замещение (S R ) – алканы Электрофильное присоединение (A E ) – алкены Электрофильное замещение (S E ) – арены Нуклеофильное замещение (S N ) – спирты Нуклеофильное присоединение (A N ) – альдегиды, кетоны
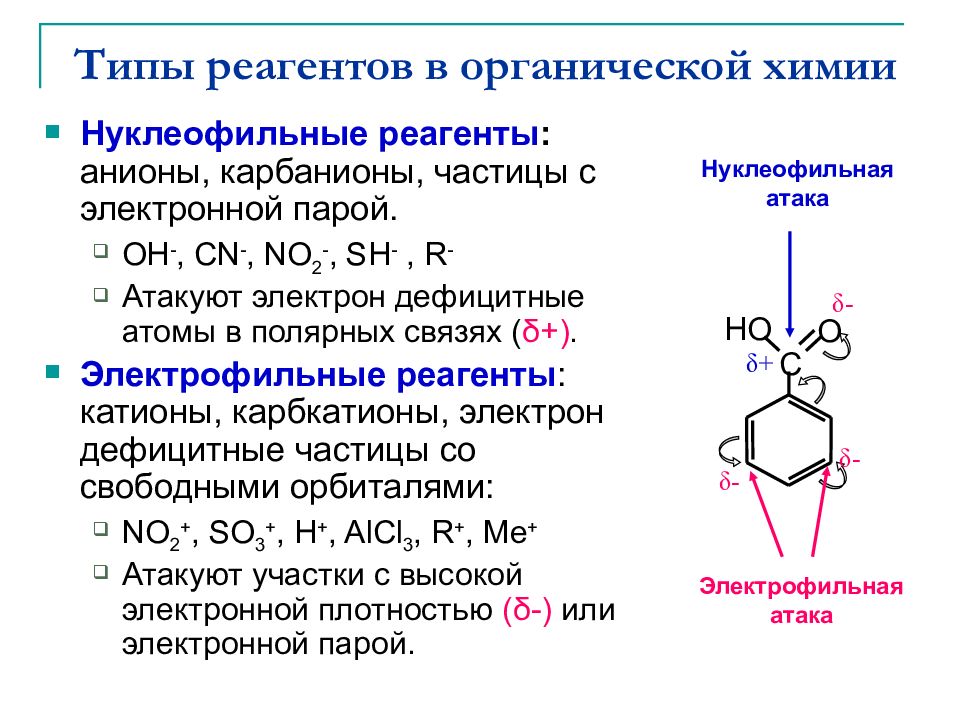
Слайд 2: Типы реагентов в органической химии
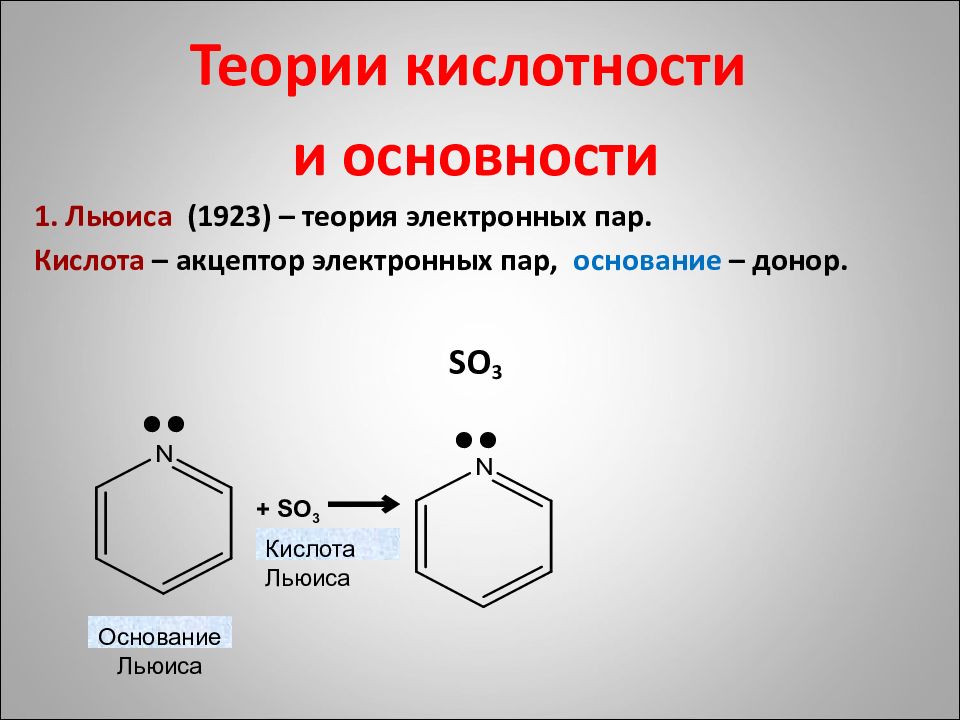
Нуклеофильные реагенты : анионы, карбанионы, частицы с электронной парой. OH -, CN -, NO 2 -, SH -, R - Атакуют электрон дефицитные атомы в полярных связях ( δ +). Электрофильные реагенты : катионы, карбкатионы, электрон дефицитные частицы со свободными орбиталями: NO 2 +, SO 3 +, H +, AlCl 3, R +, Me + Атакуют участки с высокой электронной плотностью ( δ -) или электронной парой. C δ - δ - O HO Электрофильная атака δ - δ + Нуклеофильная атака
Слайд 3: Радикальное замещение - S r ( Алканы )
Радикалы – высокоактивные частицы с неспаренными электронами. CH 4 + Cl 2 →CH 3 Cl+HCl Механизм радикального замещения : Инициирование цепи : Cl 2 → 2 Cl. ( Молекула Радикалы ) Рост цепи : Cl. + CH 4 → HCl + CH 3. CH 3. + Cl 2 → CH 3 Cl + Cl. Обрыв цепи : Cl. + CH 3. → CH 3 Cl ( Р адикалы Молекула ) hν hν
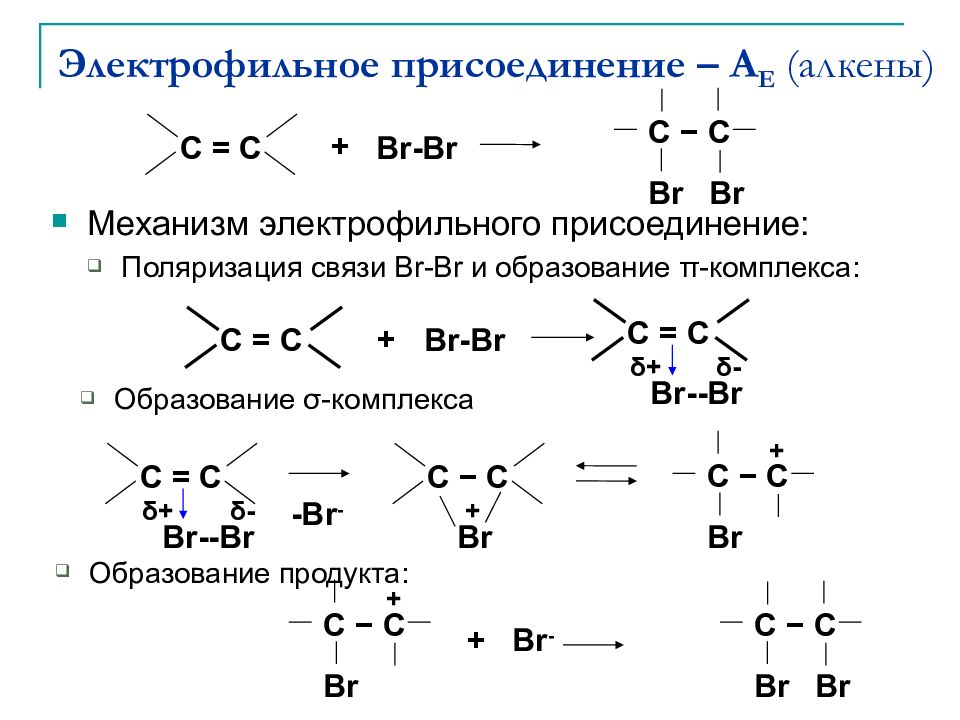
Механизм электрофильного присоединение : Поляризация связи Br-Br и образование π - комплекса : C = C + Br-Br C = C Br--Br δ + δ - C = C Br--Br δ + δ - C − C Br + -Br - C − C Br + Образование σ - комплекса Образование продукта : C = C + Br-Br Br C − C Br Br - + C − C Br + Br C − C Br
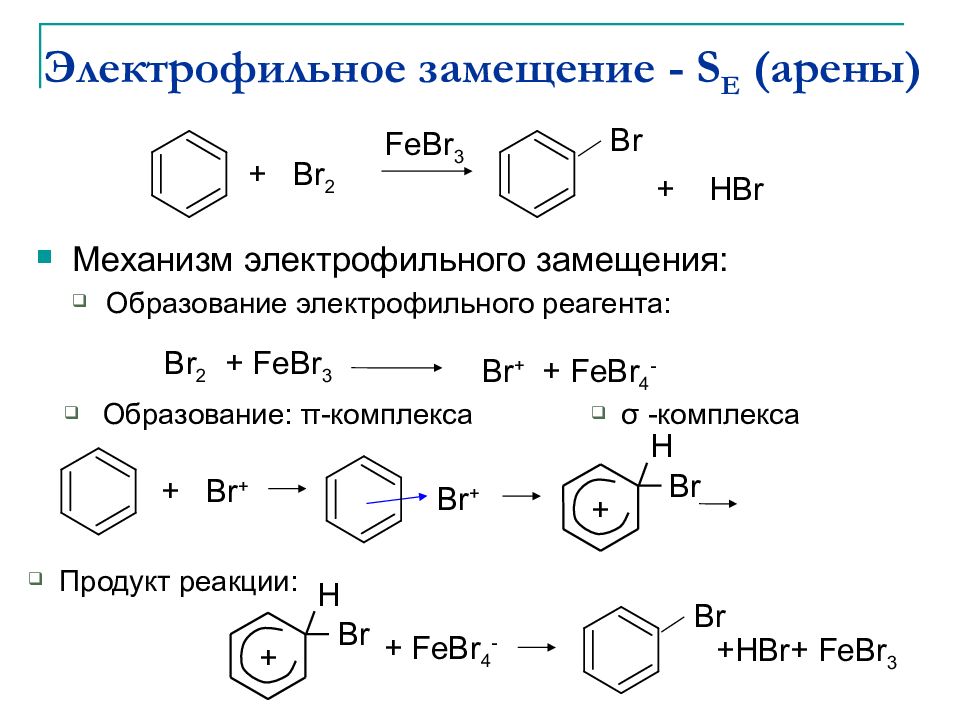
Механизм электрофильного замещения : Образование электрофильного реагента: + Br 2 Br + HBr FeBr 3 Br 2 + FeBr 3 Br + + FeBr 4 - Образование: π - комплекса Продукт реакции : σ - комплекса + Br + Br + Br H + Br Br H + + FeBr 4 - +HBr+ FeBr 3
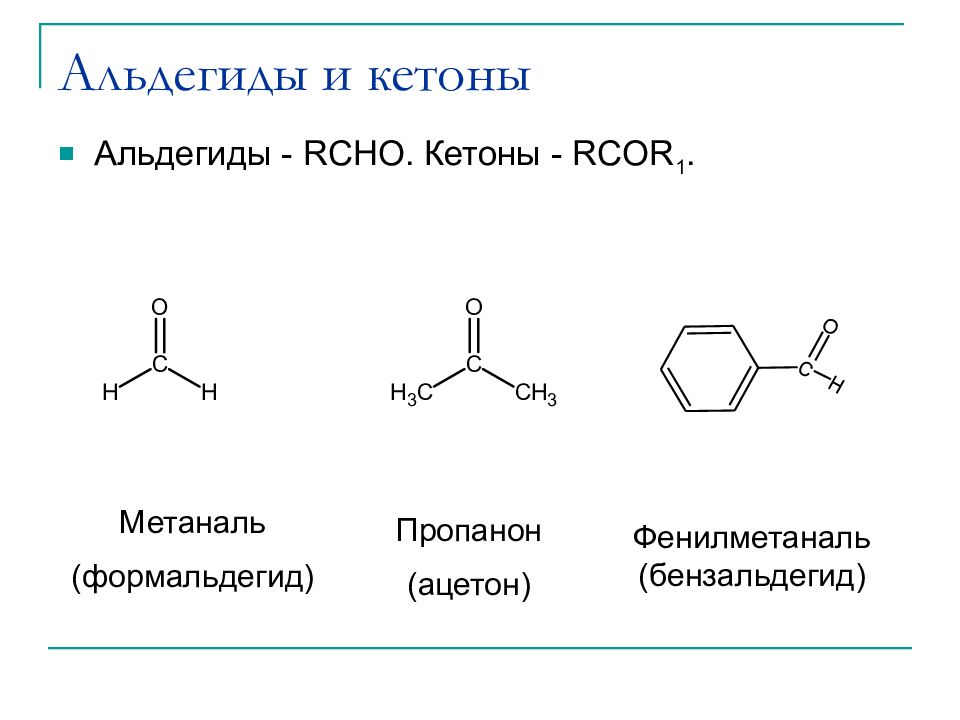
Слайд 6: Альдегиды и кетоны
Альдегиды - RCHO. Кетоны - RCOR 1. C O H Пропанон ( ацетон ) Фенилметаналь ( бензальдегид ) Метаналь ( формальдегид )
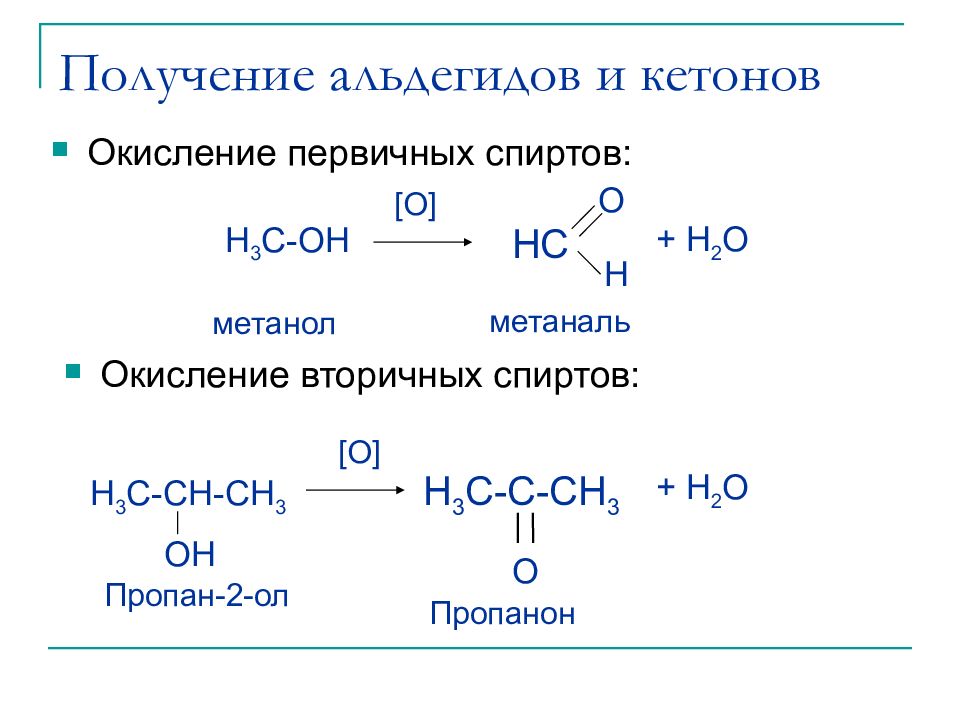
Слайд 7: Получение альдегидов и кетонов
[O] метаналь метанол H 3 C-OH + H 2 O HC O H Окисление первичных спиртов : Окисление вторичных спиртов : H 3 C-C-CH 3 O [O] Пропанон Пропан-2-ол H 3 C-CH-CH 3 + H 2 O OH
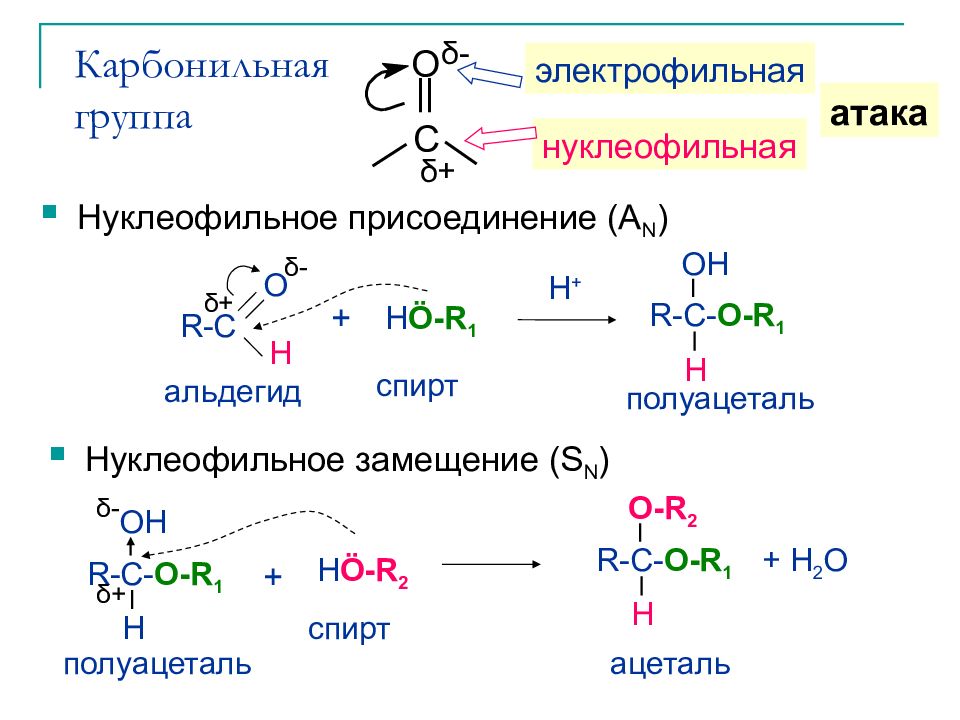
Слайд 8: Карбонильная группа
Нуклеофильное присоединение (A N ) H + полуацеталь альдегид H Ö -R 1 R-C O H R-C- O-R 1 H OH спирт δ + δ - + OH полуацеталь R-C- O-R 1 H H Ö -R 2 спирт + δ - δ + ацеталь R-C- O-R 1 H O-R 2 + H 2 O Нуклеофильное замещение (S N ) C O δ + δ - нуклеофильная электрофильная атака
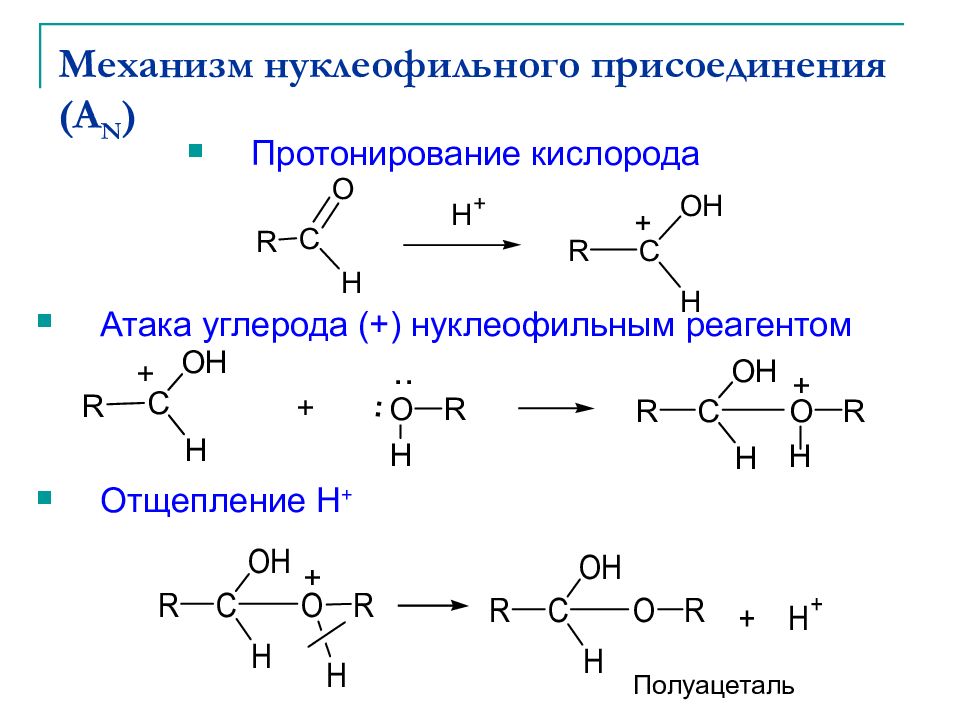
Слайд 9: Механизм нуклеофильного присоединения (A N )
Протонирование кислорода Атака углерода (+) нуклеофильным реагентом Отщепление Н + + + Полуацеталь
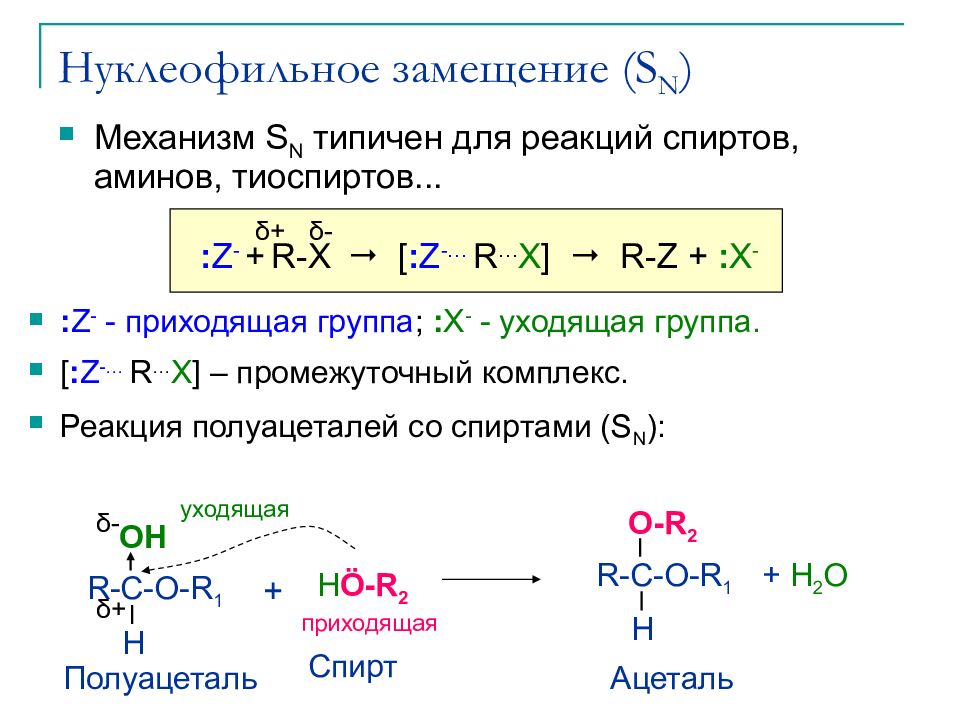
Слайд 10: Нуклеофильное замещение (S N )
Механизм S N типичен для реакций спиртов, аминов, тиоспиртов... OH Полуацеталь R-C-O-R 1 H H Ö -R 2 Спирт + δ - δ + Ацеталь R-C-O-R 1 H O-R 2 + H 2 O уходящая приходящая δ - δ + : Z - + R- X [ : Z -… R … X ] R-Z + : X - : Z - - приходящая группа ; : X - - уходящая группа. [ : Z -… R … X ] – промежуточный комплекс. Реакция полуацеталей со спиртами ( S N ) :
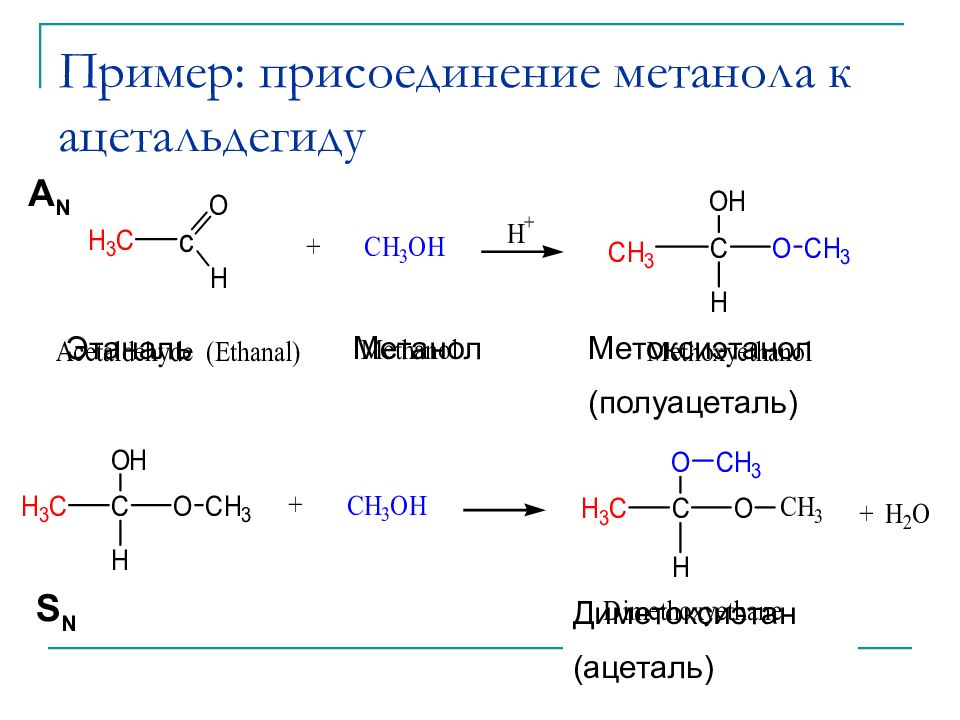
Слайд 11: Пример: присоединение метанола к ацетальдегиду
(Hemiacetal) (Acetal) A N S N Этаналь Метанол Метоксиэтанол (полуацеталь) Диметоксиэтан (ацеталь)
Слайд 13: Углеводы (сахара)
Углеводы широко распространены в растительном и животном мире. Основной источник углеводов – это растения, которые синтезируют их путем фотосинтеза: энергия (h ν ) + CO 2 + H 2 O углеводы + O 2 Животные употребляя углеводы окисляют их до CO 2 и воды, получая при этом энергию : углеводы + O 2 энергия (AT Ф ) + CO 2 + H 2 O
Слайд 14: Углеводы
Углеводы – это гетерофункциональные органические соединения, содержащие несколько спиртовых групп и карбонильную группу (альдегидную или кетонную). Классификация углеводов : Моносахариды – содержат одну полигидрокси- альдегидную или кетонную структурную единицу. Дисахариды содержат две моносахаридные единицы, соединенные гликозидной связью. Олигосахариды содержат 3-10 моносахаридных остатков. Полисахариды содержат более 10 моносахаридных остатков.
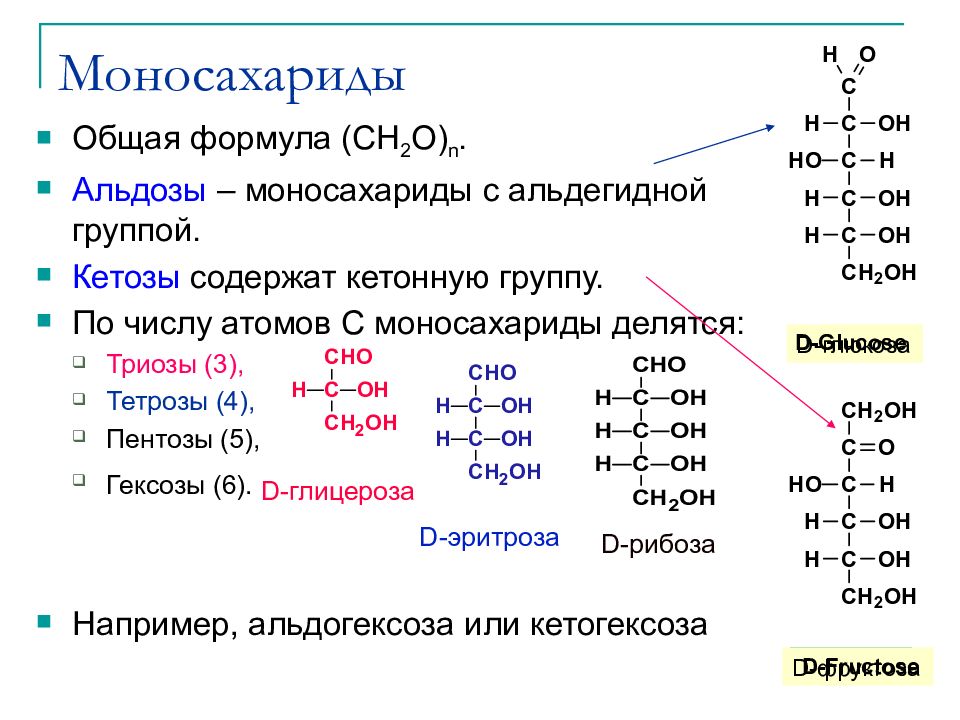
Слайд 15: Моносахариды
Общая формула (CH 2 O) n. Альдозы – моносахариды с альдегидной группой. Кетозы содержат кетонную группу. По числу атомов C моносахариды делятся : Триозы (3), Тетрозы (4), Пентозы (5), Гексозы (6). Например, альдогексоза или кетогексоза D -глюкоза D -фруктоза D-глицероза D-эритроза D-рибоза
Слайд 16: Изомерия моносахаридов
Основной тип изомерии моносахаридов – это стереоизомерия. Стереоизмеры отличаются различным пространственным расположением атомов или функциональных групп. Основой стереоизомерии являются ассиметрические или хиральные центры в молекуле. Углерод, связанный с четырьмя различными заместителями, называется хиральным центром. Количество стереоизомеров составляет 2 n, где n – количество хиральных углеродов. Изомерия моносахаридов * * n=1; изомеров =2 1 =2 D глицеральдегид L
Слайд 17: Оптическая изомерия
Стереоизомеры, которые являются зеркальными отображениями, называются энантиомерами. Энантиомеры обладают одинаковыми химическими и физическими свойствами и отличаются по оптической активности – способности вращать плоскость поляризации света. Правовращающие изомеры обозначаются (+), левовращающие - (-). Остальные стереоизомеры называются диастереомерами. Диастереомеры являются различными химическими соединениями, с различными физическими и химическими свойствами.
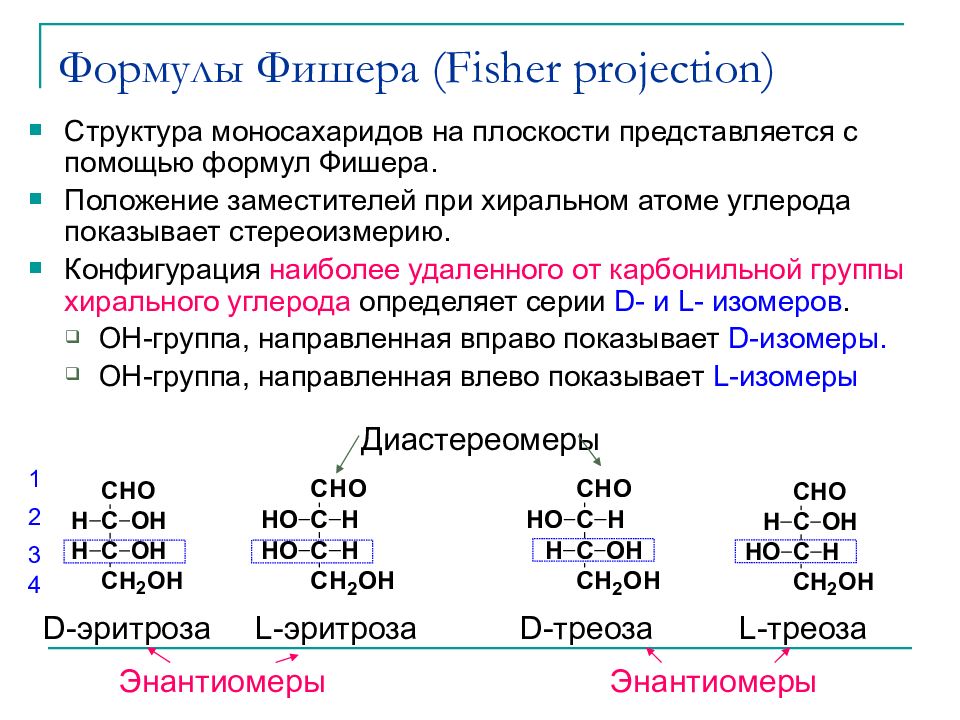
Слайд 18: Формулы Фишера ( Fisher projection )
Структура моносахаридов на плоскости представляется с помощью формул Фишера. Положение заместителей при хиральном атоме углерода показывает стереоизмерию. Конфигурация наиболее удаленного от карбонильной группы хирального углерода определяет серии D- и L - изомеров. ОН-группа, направленная вправо показывает D- изомеры. ОН-группа, направленная влево показывает L- изомеры D- эритроза L- эритроза L- треоза D- треоза Диастереомеры Энантиомеры Энантиомеры 1 2 3 4
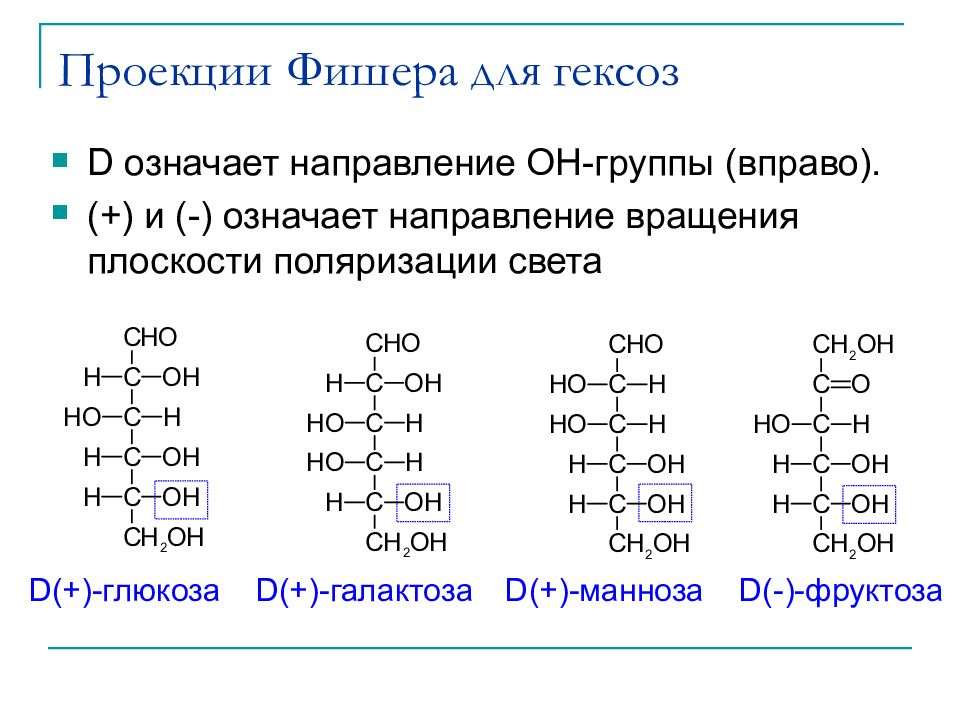
Слайд 19: Проекции Фишера для гексоз
D означает направление OH- группы (вправо). (+) и (-) означает направление вращения плоскости поляризации света D(+)- глюкоза D(+)- галактоза D(+)- манноза D(-)- фруктоза
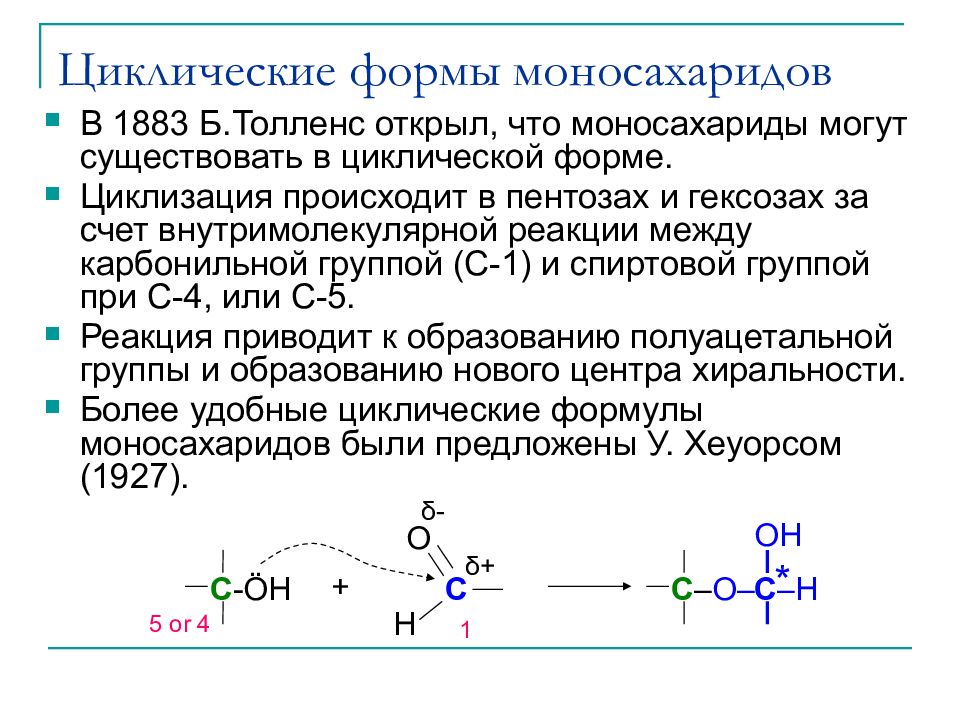
Слайд 20: Циклические формы моносахаридов
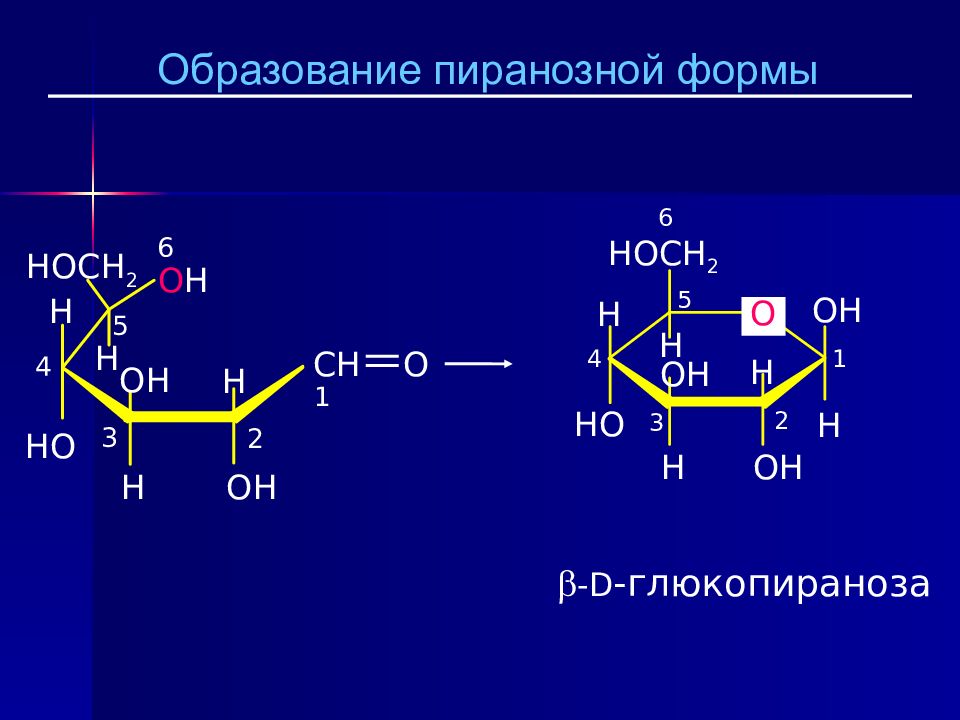
В 1883 Б.Толленс открыл, что моносахариды могут существовать в циклической форме. Циклизация происходит в пентозах и гексозах за счет внутримолекулярной реакции между карбонильной группой (C-1) и спиртовой группой при C-4, или С- 5. Реакция приводит к образованию полуацетальной группы и образованию нового центра хиральности. Более удобные циклические формулы моносахаридов были предложены У. Хеуорсом (1927). C O H + C - Ö H C – O– C –H OH * δ + δ - 1 5 or 4
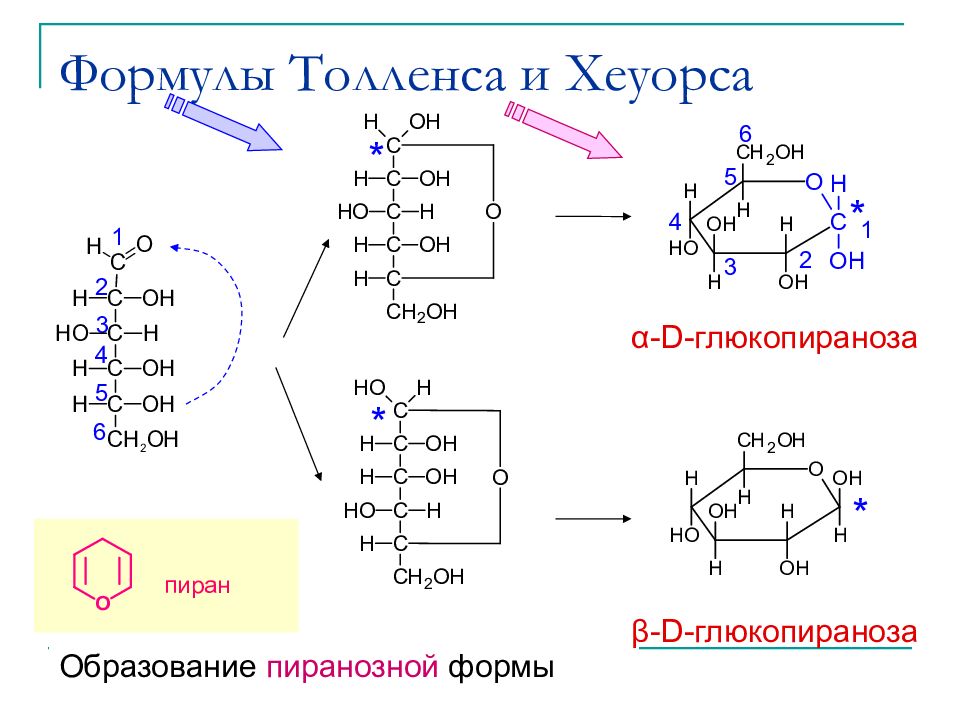
Слайд 21: Формулы Толленса и Хеуорса
* * * * 1 2 3 4 5 6 1 2 3 4 5 6 Образование пиранозной формы пиран α -D-глюкопираноза β -D-глюкопираноза
Слайд 22: Правила написания формул Хеуорса
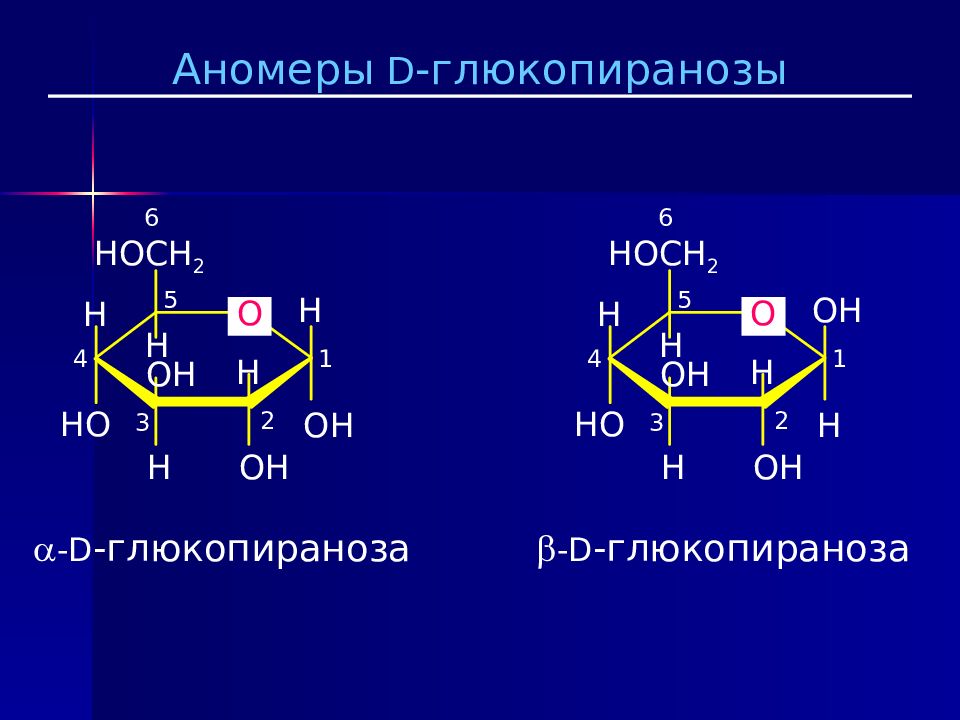
Возможно образование только 5- членных циклов ( фуранозная форма ) и 6 -членных циклов ( пиранозная форма ). Полуацетальная группа записывается справа. Гидроксил, направленный в формуле Фишера вправо, по Хеуорсу должен быть направлен вниз. Гидроксил, направленный в формуле Фишера влево, по Хеуорсу должен быть направлен вверх. Нумерация начинается с полуацетального углерода. Положение гидроксила при новом хиральном центре образует два новых стереоизомера, которые называются аномеры. α - аномер содержит OH- группу, направленную вниз. β - аномер содержит OH- группу, направленную вверх.
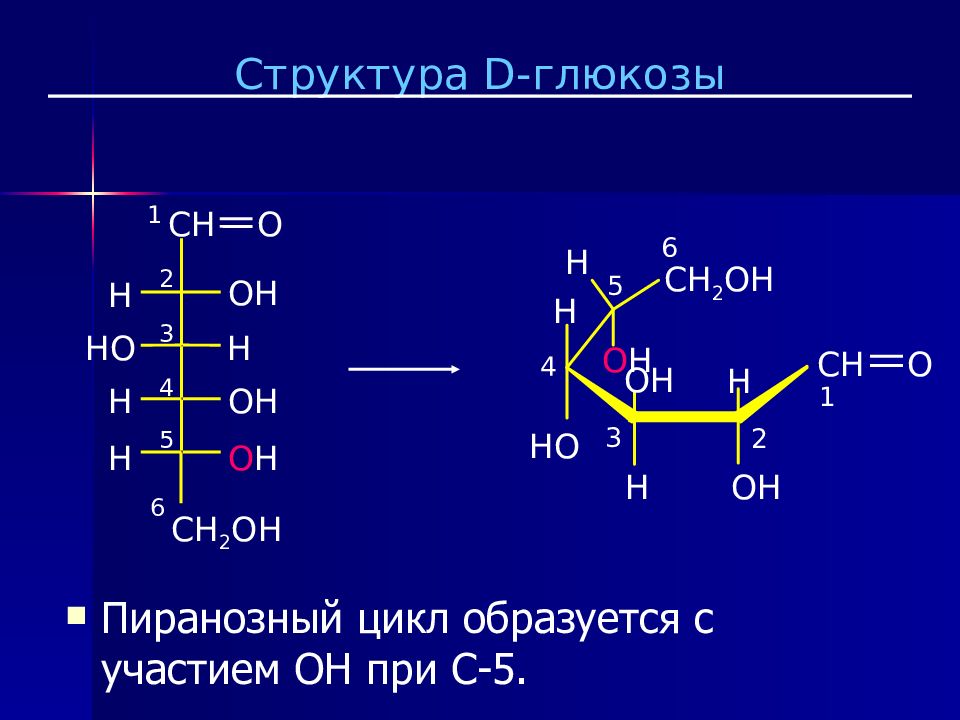
Слайд 23
CH O CH 2 OH 1 2 3 4 5 H HO H OH H OH H O H 6 O H CH O H OH H CH 2 OH OH H HO 1 2 3 4 5 6 H Пиранозный цикл образуется с участием OH при C-5. Структура D - глюкозы
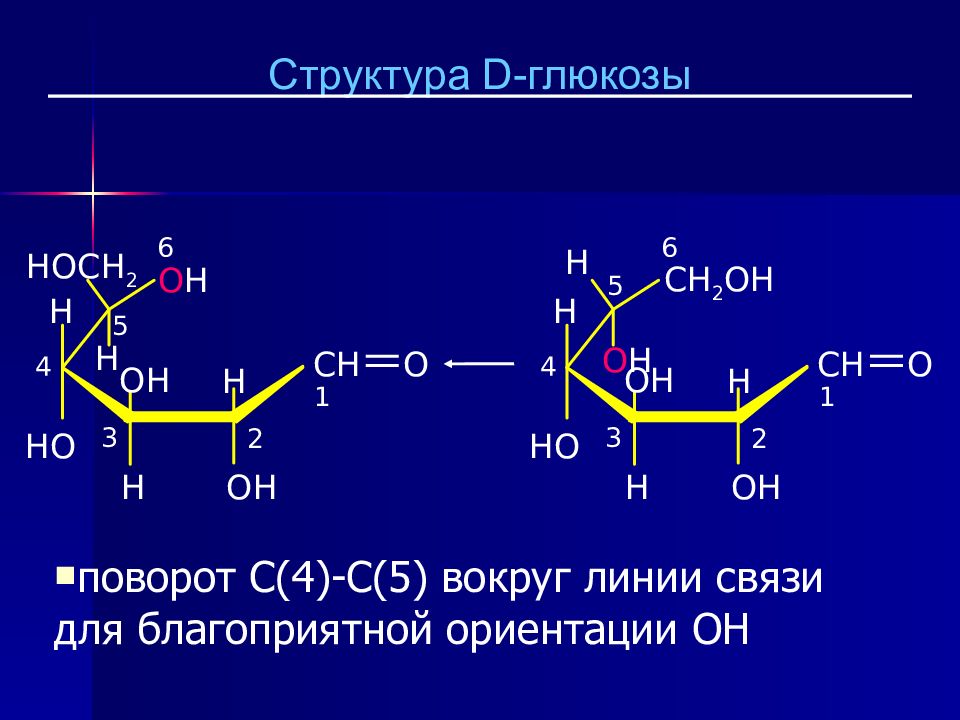
Слайд 24
CH O H OH H CH 2 OH OH H HO 1 2 3 4 5 6 H O H CH O H OH H HOCH 2 OH H HO 1 2 3 4 5 6 H O H поворот C(4)-C(5) вокруг линии связи для благоприятной ориентации OH Структура D - глюкозы
Слайд 25
CH O H OH H HOCH 2 OH H HO 1 2 3 4 5 6 H O H -D - глюкопираноза H OH O 1 2 3 4 OH H HO H OH H H HOCH 2 5 6 Образование пиранозной формы
Слайд 26
-D - глюкопираноза H OH O 1 2 3 4 OH H HO H OH H H HOCH 2 5 6 -D - глюкопираноза OH H O 1 2 3 4 OH H HO H OH H H HOCH 2 5 6 Аномеры D - глюкопиранозы
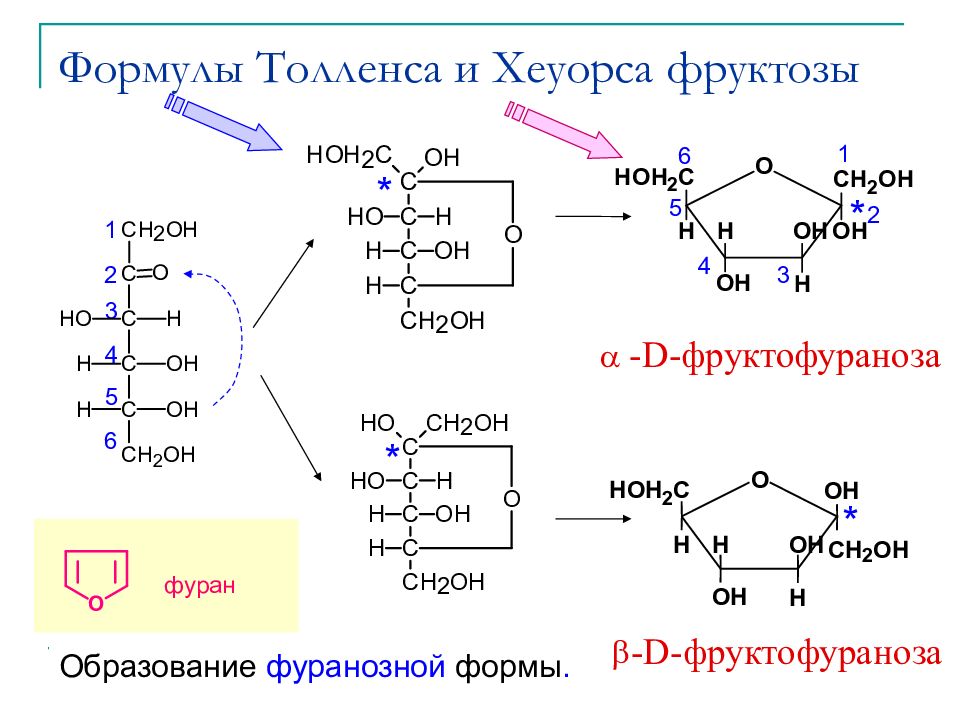
Слайд 27: Формулы Толленса и Хеуорса фруктозы
* * * * 1 2 3 4 5 6 1 2 3 4 5 6 Образование фуранозной формы. фуран a -D-фруктофураноза b -D-фруктофураноза H O H CH 2 OH O H O H H H HOH 2 C O
Слайд 28: Мутаротация
В водном растворе устанавливается равновесие между циклическими и линейными структурами моносахаридов, которое носит название мутаротация. -D- глюкоза D- глюкоза ( линейная ) β-D- глюкоза (36%) ( следы) (64%) Например в водном растворе глюкозы наблюдается равновесие, при котором, α-формы - 36%, β - 64% (>99% глюкозы находится в пиранозной форме). В ряде случаев мутаротация приводит к изменению угла вращения плоскости поляризации света во времени.
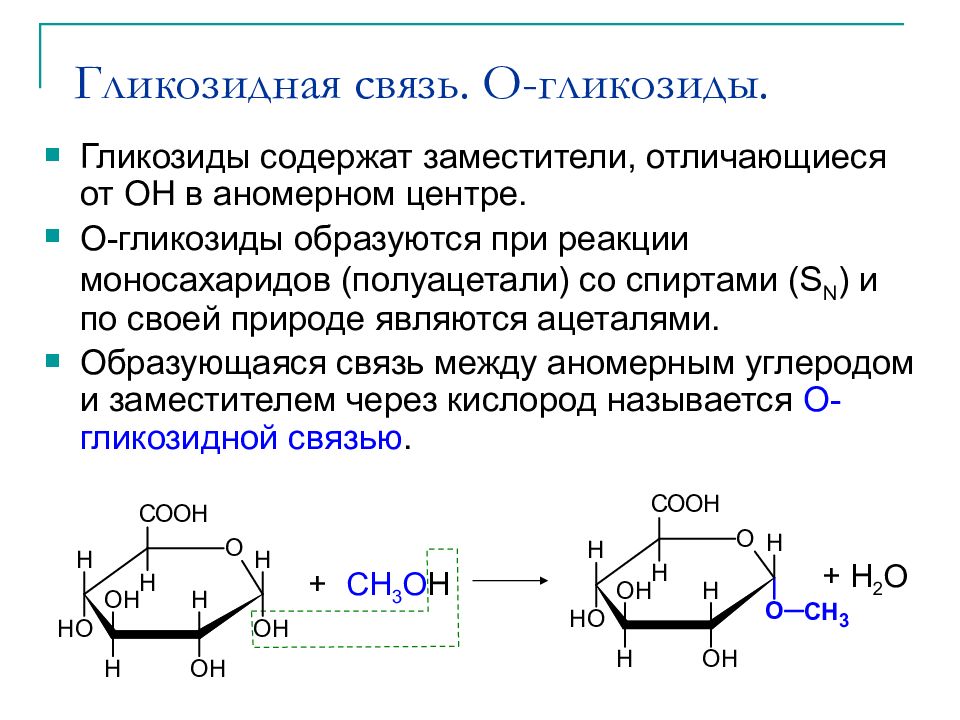
Слайд 29: Гликозидная связь. O- гликозиды
Гликозиды содержат заместители, отличающиеся от ОН в аномерном центре. O- гликозиды образуются при реакции моносахаридов (полуацетали) со спиртами (S N ) и по своей природе являются ацеталями. Образующаяся связь между аномерным углеродом и заместителем через кислород называется O- гликозидной связью. + CH 3 O H + H 2 O
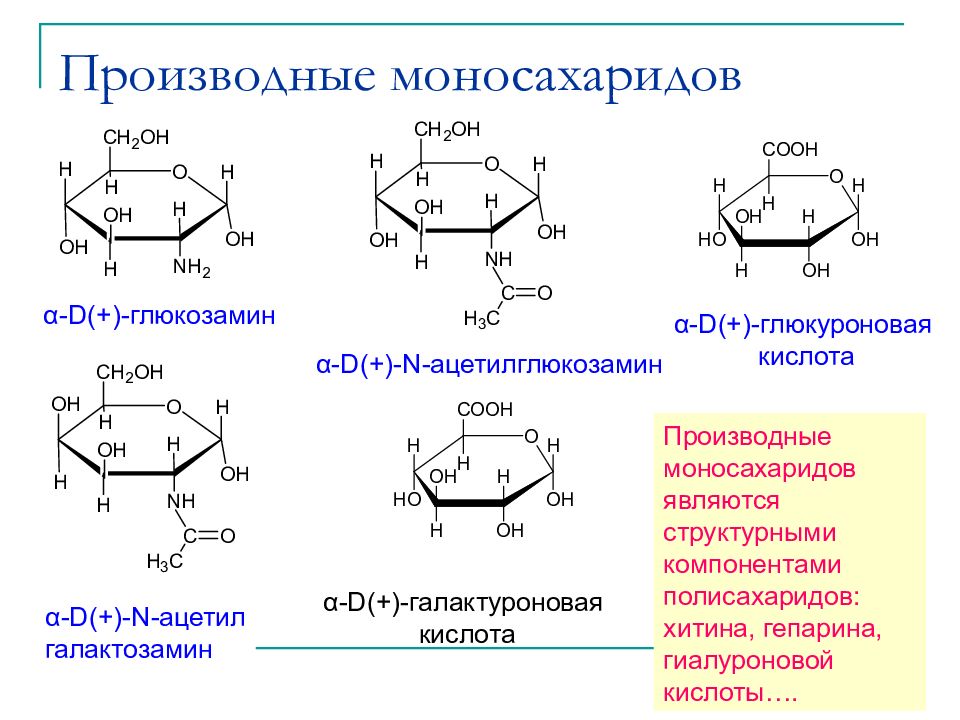
Слайд 30: Производные моносахаридов
α-D(+)- глюкозамин α-D(+)-N- ацетилглюкозамин α-D(+)-N- ацетил галактозамин α-D(+)- глюкуроновая кислота α-D(+)- галактуроновая кислота Производные моносахаридов являются структурными компонентами полисахаридов: хитина, гепарина, гиалуроновой кислоты….
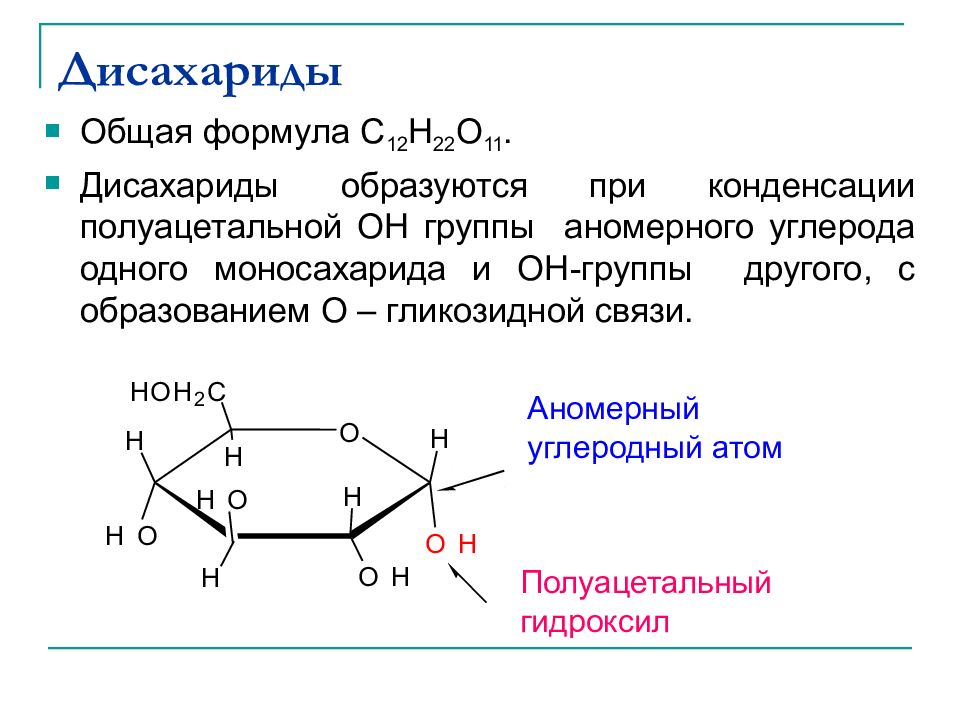
Слайд 31: Дисахариды
Общая формула C 12 H 22 O 11. Дисахариды образуются при конденсации полуацетальной ОН группы аномерного углерода одного моносахарида и ОН-группы другого, с образованием O – гликозидной связи. O H O H O H H H H H O H H O H 2 C H O Аномерный углеродный атом Полуацетальный гидроксил
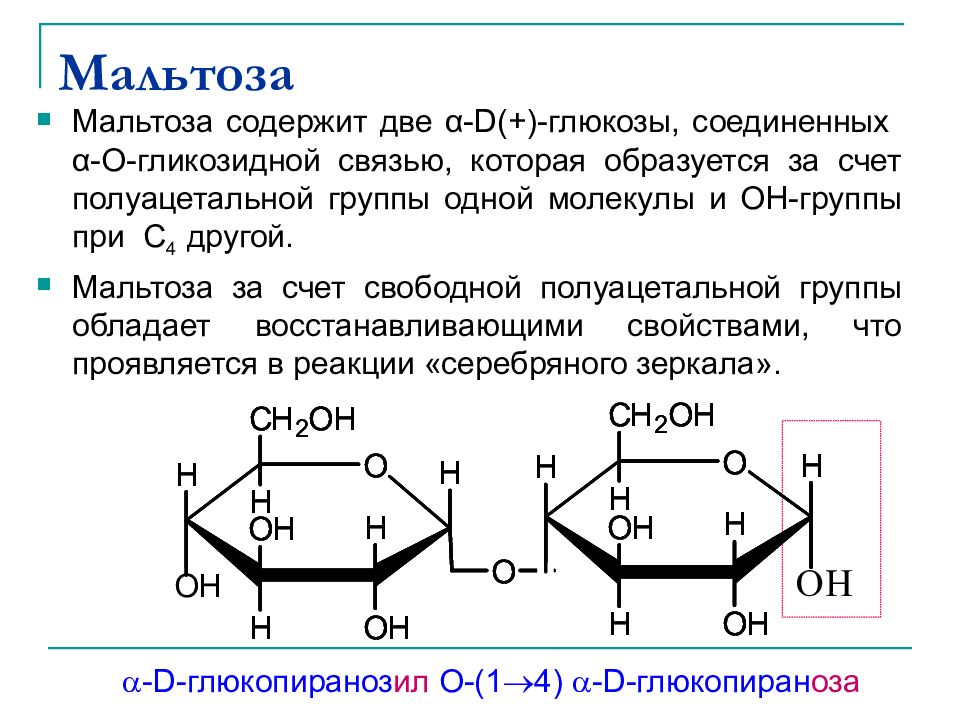
Слайд 32: Мальтоза
Мальтоза содержит две α-D(+) -глюкозы, соединенных α -О-гликозидной связью, которая образуется за счет полуацетальной группы одной молекулы и ОН-группы при C 4 другой. Мальтоза за счет свободной полуацетальной группы обладает восстанавливающими свойствами, что проявляется в реакции «серебряного зеркала». -D- глюкопираноз ил O-(1 4) -D- глюкопиран оза
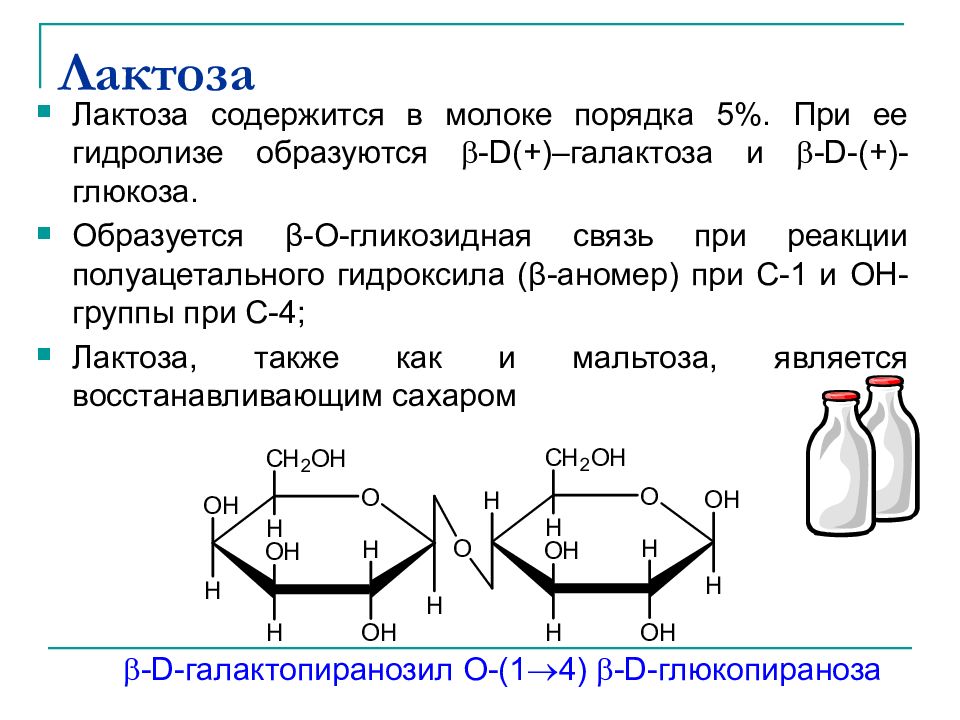
Слайд 33: Лактоза
Лактоза содержится в молоке порядка 5%. При ее гидролизе образуются -D(+)– галактоза и -D-(+)- глюкоза. Образуется β -О-гликозидная связь при реакции полуацетального гидроксила ( β -аномер) при С-1 и OH -группы при C-4; Лактоза, также как и мальтоза, является восстанавливающим сахаром -D- галактопиранозил O-(1 4) -D- глюкопираноза
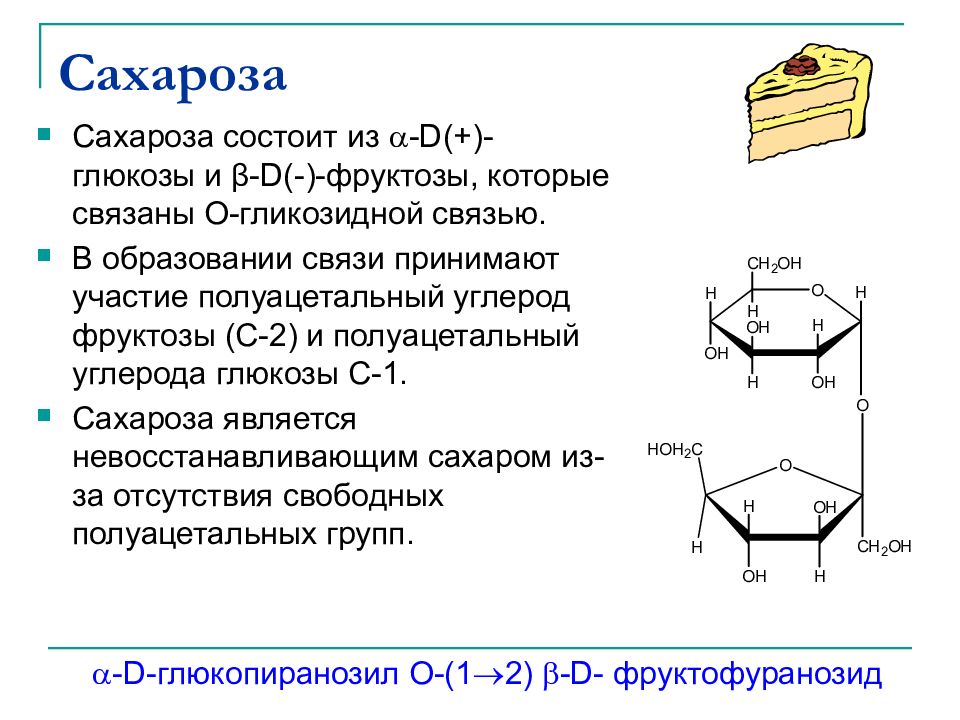
Слайд 34: Сахароза
Сахароза состоит из -D(+)- глюкозы и β-D(-)- фруктозы, которые связаны О-гликозидной связью. В образовании связи принимают участие полуацетальный углерод фруктозы ( C-2 ) и полуацетальный углерода глюкозы С-1. Сахароза является невосстанавливающим сахаром из-за отсутствия свободных полуацетальных групп. -D- глюкопиранозил O-(1 2) -D- фруктофуранозид
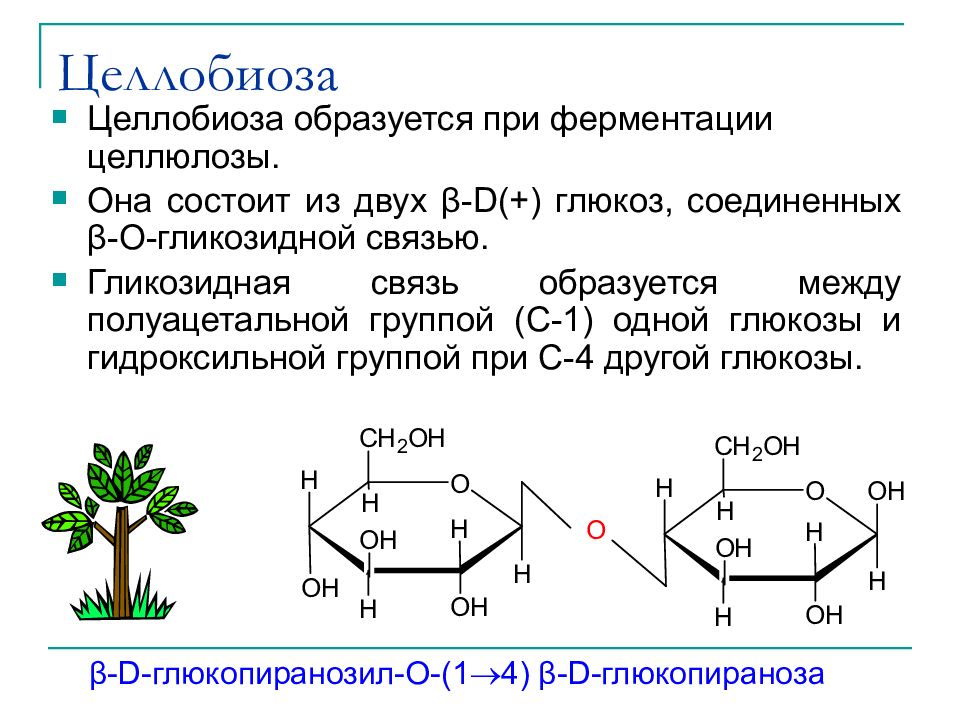
Слайд 35: Целлобиоза
Целлобиоза образуется при ферментации целлюлозы. Она состоит из двух β-D(+) глюкоз, соединенных β- О-гликозидной связью. Гликозидная связь образуется между полуацетальной группой (С-1) одной глюкозы и гидроксильной группой при С-4 другой глюкозы. β-D- глюкопиранозил -O-(1 4) β-D- глюкопираноза
Слайд 36: Полисахариды
Общая формула (C 6 H 10 O 5 )n. Полисахариды делятся на: Гомополисахариды ( крахмал, целлюлоза, гликоген, хитин), состоящие только из одного типа моносахаридов. Гетерополисахариды ( гиалуроновая кислота, хондроитин-4-сульфат, гепарин), состоящие из двух или более типов моносахаридов.
Слайд 37: Гомополисахариды
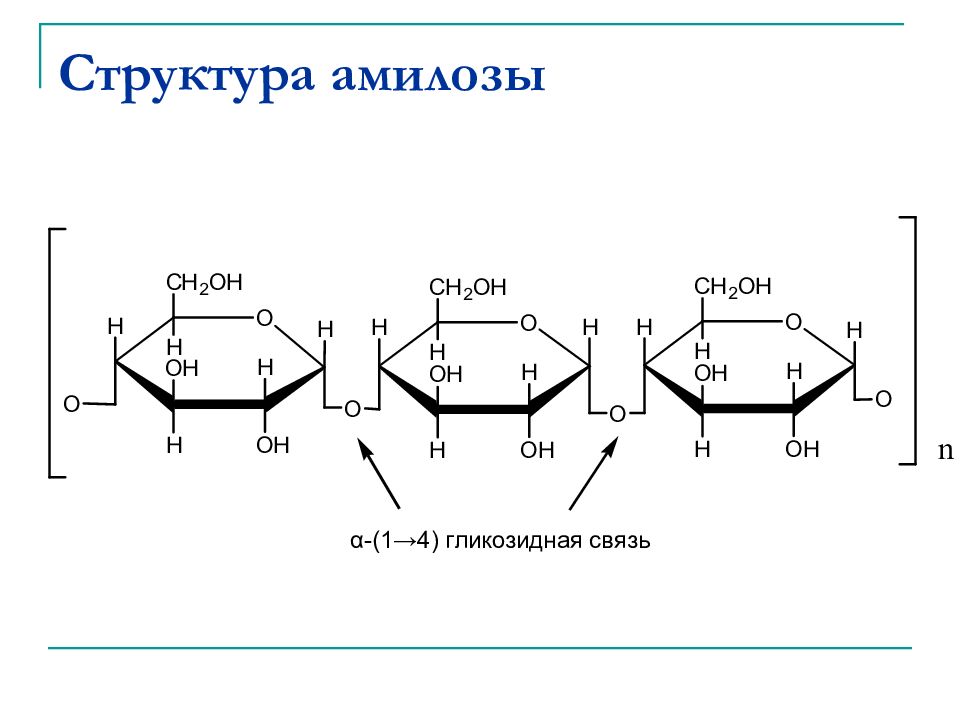
Крахмал - состоит из двух компонентов: амилозы, растворимой в воде (15-20%), и амилопектина, нерастворимого в воде (85-80%). Амилоза состоит из неразветвленных цепей, построенных из молекул α- глюкозы, соединенных 1→4 гликозидными связями. Амилопектин c остоит из разветвленных цепей α- глюкозы, построенных за счет 1→4 гликозидных связей, и соединенных между собой 1→6 связями.
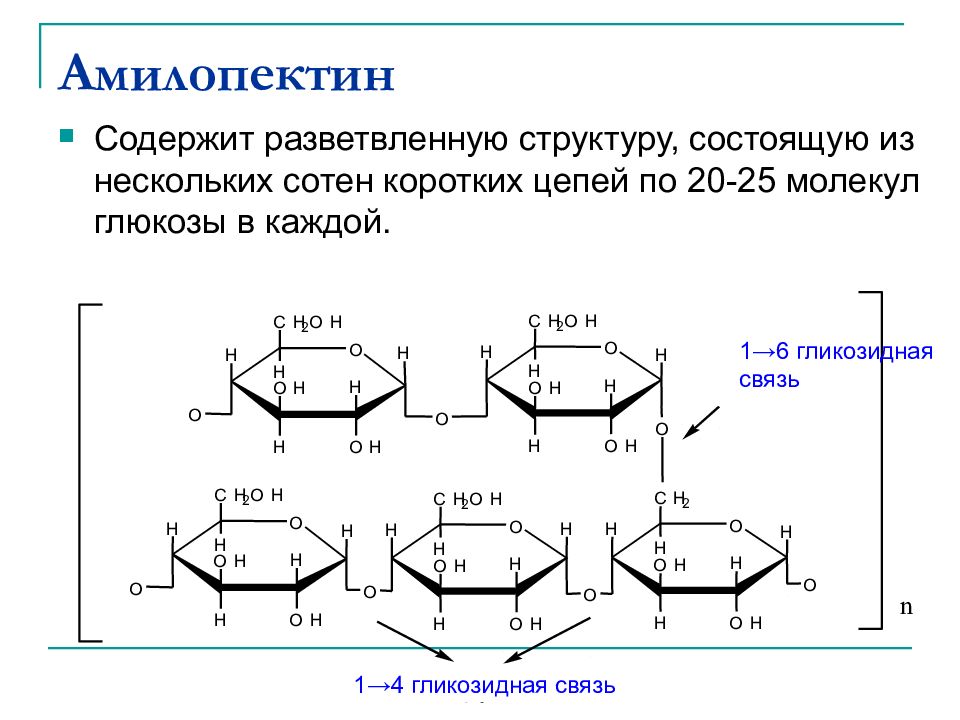
Слайд 39: Амилопектин
Содержит разветвленную структуру, состоящую из нескольких сотен коротких цепей по 20-25 молекул глюкозы в каждой. O H H O H H O H C H 2 O H H O H O H H O H C H 2 O H H H O H O O H H O H H O H C H 2 H H H O O O H H O H H O H C H 2 O H H H O O H H O H H O H C H 2 O H H O H O 1 - 4 g l y c o s i d i c b o n d n 1 →6 гликозидная связь 1 →4 гликозидная связь
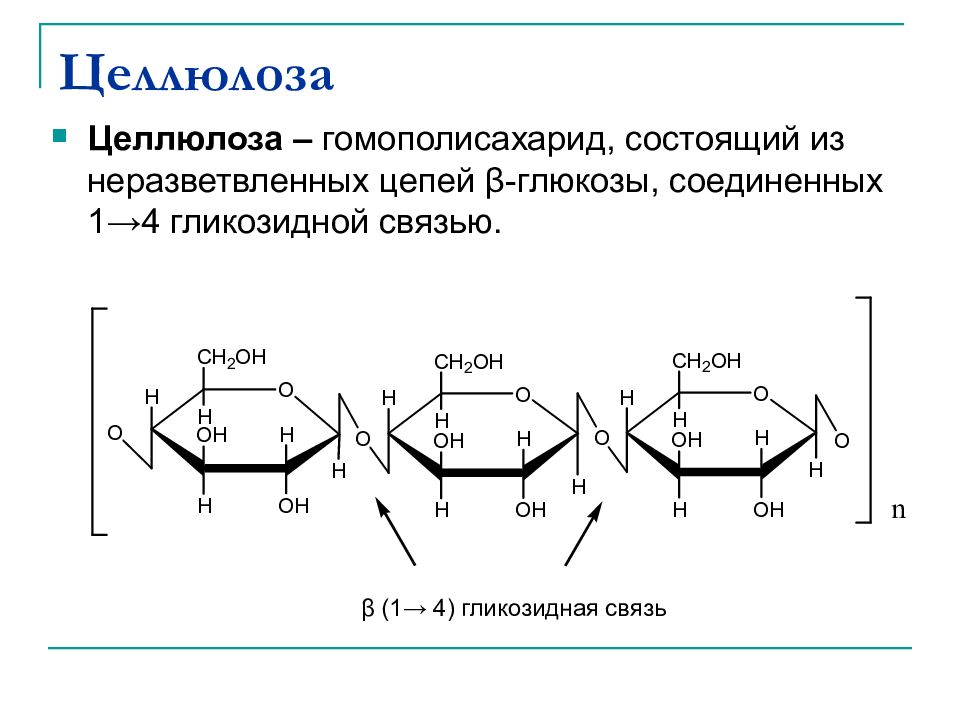
Слайд 40: Целлюлоза
Целлюлоза – гомополисахарид, состоящий из неразветвленных цепей β - глюкозы, соединенных 1→4 гликозидной связью. β (1→ 4) гликозидная связь
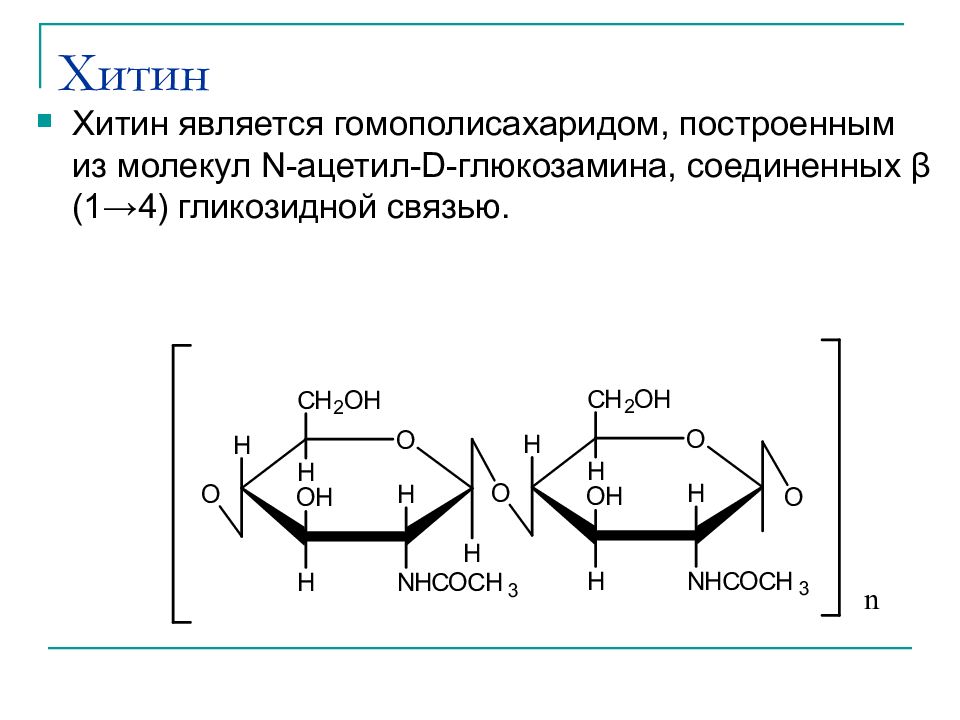
Слайд 41: Хитин
Хитин является гомополисахаридом, построенным из молекул N- ацетил -D- глюкозамина, соединенных β (1→4) гликозидной связью.
Слайд 42: Гетерополисахариды
Гетерополисахариды построены из различных моносахаридов и их производных. Гиалуроновая кислота ( β - глюкуроновая кислота и N- ацетил глюкозамин ). Хондроитин - 4-сульфат ( β - глюкуроновая кислота и N- ацетил галактозамин-4-сульфат ). Гепарин ( α-D-глюкозамин и уроновые кислоты).
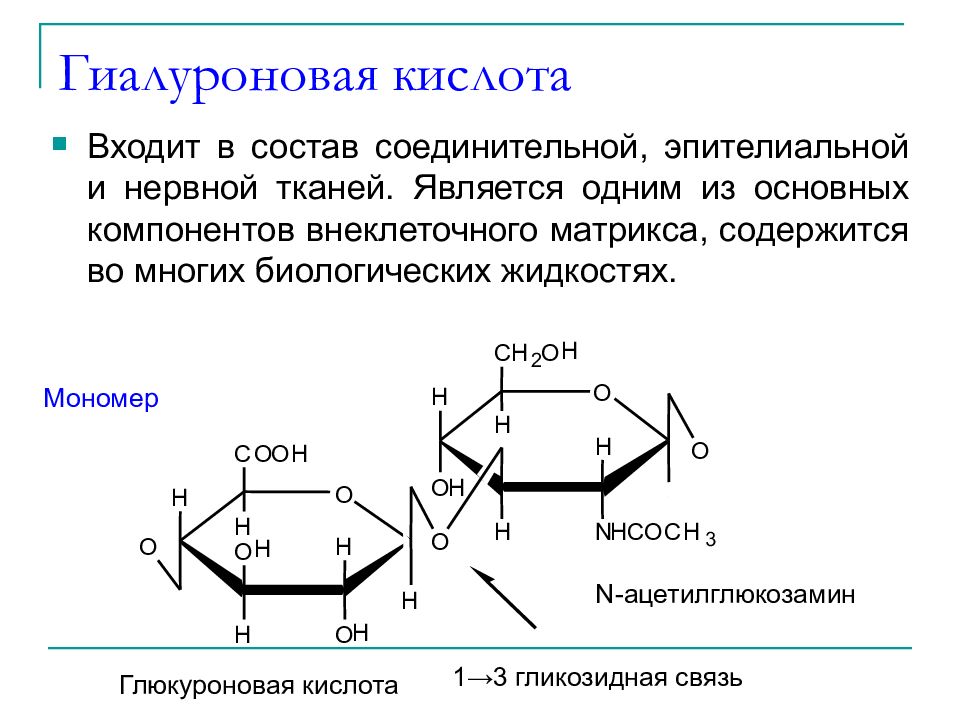
Слайд 43: Гиалуроновая кислота
Входит в состав соединительной, эпителиальной и нервной тканей. Является одним из основных компонентов внеклеточного матрикса, содержится во многих биологических жидкостях. Мономер O H O H H O H C O O H H H O O O H H N H C O C H 3 H C H 2 O H H H H O O N-ацетилглюкозамин Глюкуроновая кислота 1 →3 гликозидная связь
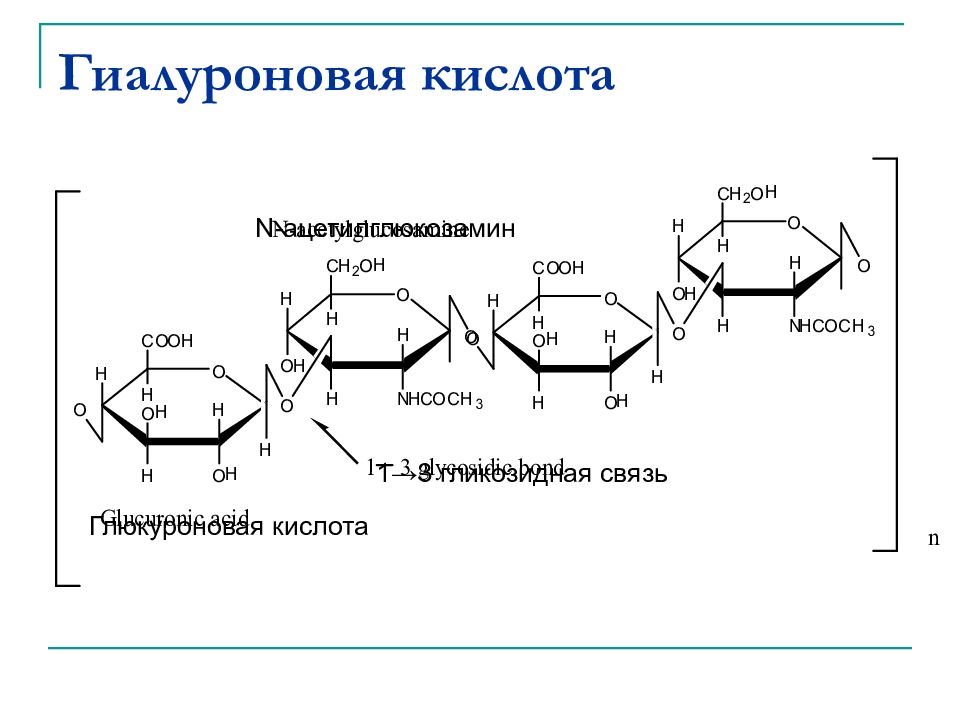
Слайд 44: Гиалуроновая кислота
N-ацетилглюкозамин Глюкуроновая кислота 1 →3 гликозидная связь
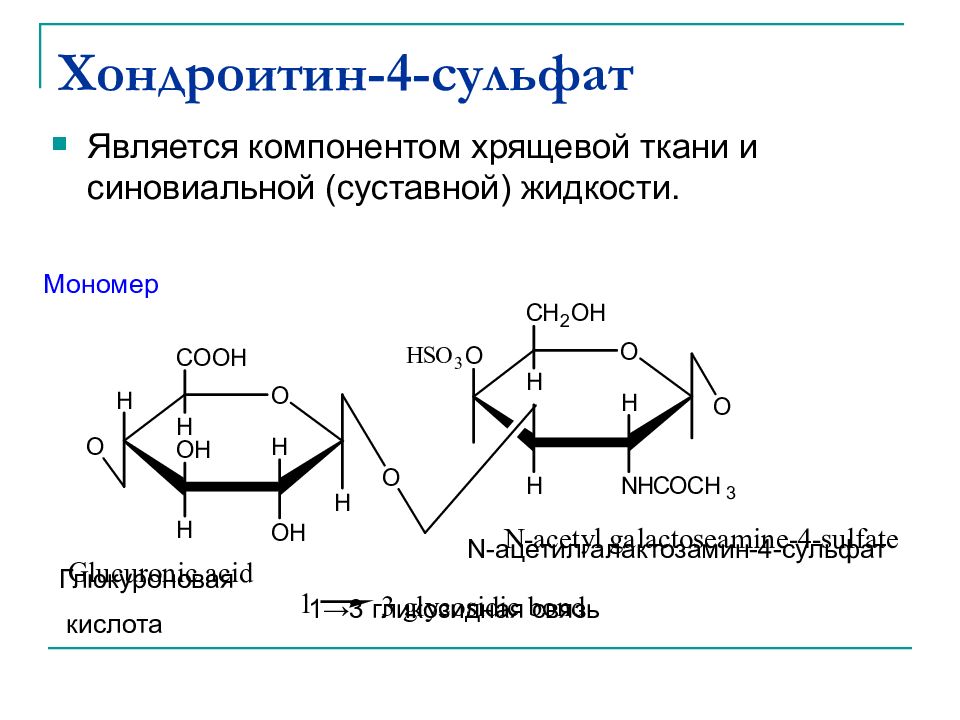
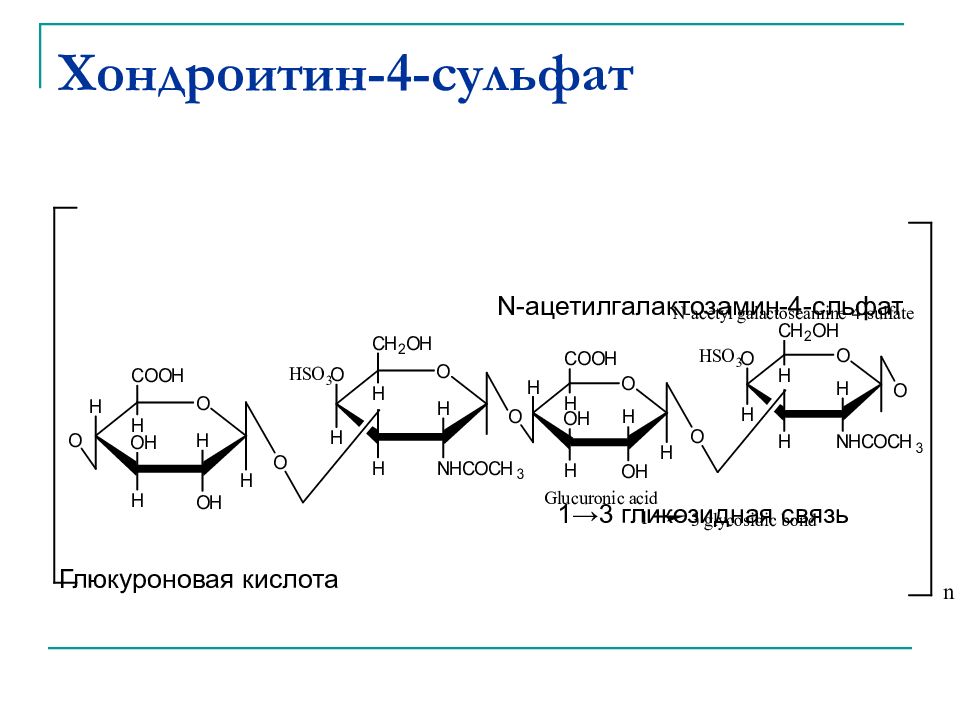
Слайд 45: Хондроитин - 4-сульфат
Является компонентом хрящевой ткани и синовиальной (суставной) жидкости. Мономер Глюкуроновая кислота 1 →3 гликозидная связь N-ацетилгалактозамин-4-сульфат