Первый слайд презентации: Актуальные задачи химии природных соединений автор доцент КХПС химфака ЮФУ Викрищук Н.И
Слайд 3: Место химии природных веществ в системе наук. Предмет химии природных веществ
Химия природных соединений – самый крупный раздел органической химии, выделившийся из нее на определенном этапе развития Предметом химии природных веществ является изучение структуры, свойств и механизмов функционирования биологически активных природных соединений, веществ, составляющих живые организмы
Слайд 4: Задачи химии природных веществ
Выяснить химическую сущность важных биологических процессов (механизм действия ферментов, сущность процессов старения, проблемы передачи наследственных признаков, проблемы нервной передачи ). Для успешного лечения таких болезней как рак, гипертония, лучевая болезнь, некоторые нервные и психические заболевания, инфекционные заболевания необходимо глубокое изучение стероидов, антибиотиков, алка-лоидов и других природных биологически активных соединений.
ФИШЕР Эмиль Герман (1852-1919), немецкий химик-органик, создатель научной школы, основоположник химии природных соединений. Исследовал строение и синтезировал ряд производных пурина: кофеин, гуанин, аденин и др. Ввел номенклатуру, создал рациональную классификацию и осуществил синтез многих углеводов. Открыл специфичность действия ферментов. Основополагающие исследования по химии белков. Нобелевская премия (1902).
Слайд 6: Выдающиеся ученые в области химии природных веществ
Роберт Робинсон. Нобелевская премия по химии, 1947 г. Роберт Робинсон получил премию за исследования растительных продуктов большой биологической важности, особенно алкалоидов. Осуществлённый с помощью изотопного индикатора анализ реакций, происходящих в живых растениях позволил Робинсону синтезировать, а затем установить структуру многих алкалоидов, в том числе морфина, стрихнина, бруцина, акуамицина.
Слайд 7: Выдающиеся ученые в области химии природных веществ
Роберт Бернс Вудворд. Нобелевская премия по химии, 1965 г. Роберт Бернс Вудворд за выдающийся вклад в искусство органического синтеза удостоен премии. Синтезировал хинин и создал его белковый аналог, используемый при производстве пластмасс и искусственных антибиотиков. Вудворд осуществил кажущиеся невозможными синтезы, причем синтез стрихнина, до сих пор повторить не удалось. Он получил соединения хлорофилла, ланостерина, резерпина, колхицина и витамина B 12.
Слайд 8: Выдающиеся ученые в области химии природных веществ
Артур ГАРДЕН. Нобелевская премия по химии, 1929 г. Артур Гарден награждён премией за исследование ферментации сахара и ферментов брожения. Гарден сделал открытие: процесс ферментации требует наличия фосфата, молекулы которого связываются с молекулами сахара, создавая условия для ферментативного индуцирования брожения. Работа Гардена позволила сделать важные выводы об основных путях метаболизма углеводов растений и животных.
Слайд 9: Выдающиеся ученые в области химии природных веществ
Адольф Виндаус Нобелевская премия по химии, 1928 г. Адольф Виндаус удостоен премии за работы по изучению строения стеринов и их связи с витаминной группой. Он получил холановую кислоту из холестерина, это ясно указывало на тесную связь между холестерином и желчными кислотами. Определил химическую структуру витамина D и его провитамина.
Слайд 10: Выдающиеся ученые в области химии природных веществ
Леопольд Ружичка Нобелевская премия по химии, 1939 г. (Совместно с А.Бутенандтом) Леопольд Ружичка за работы по полиметиленам и высшим терпенам удостоен премии. Приобрел известность благодаря исследованиям терпенов – органических соединений, которые были обнаружены в маслах, выделяемых из растений. Частично синтезировал мужские гормоны – андростерон и тестостерон, определил молекулярную структуру тестостерона.
Слайд 11: Выдающиеся ученые в области химии природных веществ
Адольф Бутенандт (Германия) Нобелевская премия по химии, 1939 г. Адольф Бутенандт за работы по половым гормонам удостоен премии. Занимался проблемой выделения и химической идентификации половых гормонов, синтезировал эстрогены и андростерон. В ходе исследований определил, что холестерин представляет собой биохимическое исходное вещество мужского и женского половых гормонов.
Слайд 12: Выдающиеся ученые в области химии природных веществ
Винсент дю Виньо (США). Нобелевская премия по химии, 1955 г. За работу с биологически активными соединениями, и прежде всего за впервые осуществленный синтез полипептидного гормона Винсент дю Виньо удостоен премии. Полученный кристаллический окситоцин испытали на женщинах для стимуляции родов и доказали, что он является эффективным для клинического применения
Слайд 13: Выдающиеся ученые в области химии природных веществ
Джон К. КЕНДРЮ. Нобелевская премия по химии, 1962 г. Джон Коудери Кендрю за исследования структуры глобу-лярных белков был удостоен премии. Кендрю обнаружил нечто, чего никто ранее не видел, – это была трехмерная структура молекулы белка во всей ее сложности. Наиболее порази-тельной особенностью этой молекулы была ее упорядоченность и полное отсутствие симметрии.
Слайд 14: Выдающиеся ученые в области химии природных веществ
Академик Кочетков Н.К. (Россия) Основные научные работы Н. К. Кочеткова относятся к химии углеводов. Он открыл в растительном мире природные гликозиды нового типа - олигозиды, разработал методы синтеза малодоступных моносахаридов и их производных, разработал способ удлинения углеродной цепи моносахаридов на два звена, новые методы синтеза гликозидной связи, осуществил первые синтезы микробных полисахаридов с высокой биологической а ктивностью
Слайд 15: Выдающиеся ученые в области химии природных веществ
Преображенский Николай Алексеевич (1896–1968). (Россия) Основная область научных исследований – хими я алколоидов, витаминов, липидов, хромопротеидов. Один из организаторов советской витаминной промышленности.
Слайд 16: Основные классы природных соединений
В природе биологически значимые органические вещества широко представлены как в растительном, так и в животном мире и относятся к самым разным классам органических соединений.
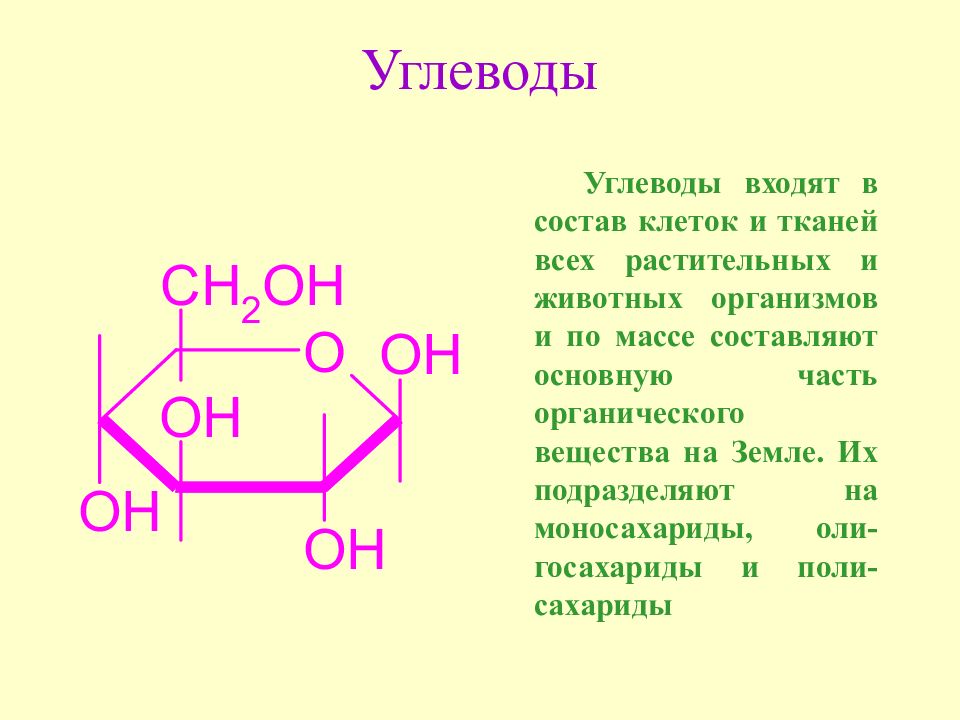
Слайд 17: Углеводы
Углеводы входят в состав клеток и тканей всех растительных и животных организмов и по массе составляют основную часть органического вещества на Земле. Их подразделяют на моносахариды, оли-госахариды и поли-сахариды
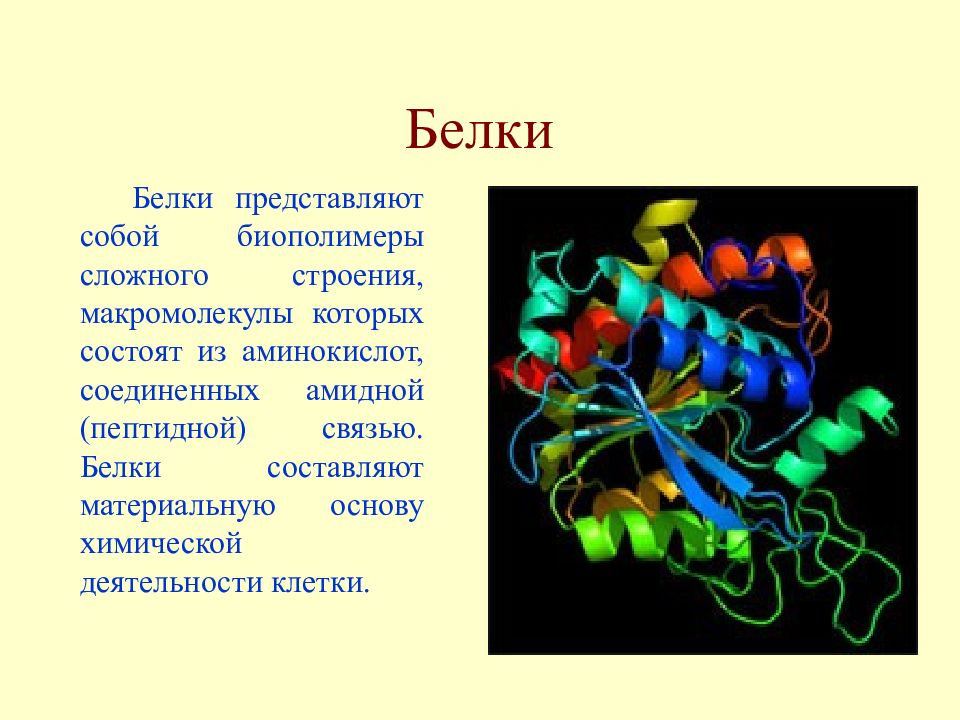
Слайд 18: Белки
Белки представляют собой биополимеры сложного строения, макромолекулы которых состоят из аминокислот, соединенных амидной (пептидной) связью. Белки составляют материальную основу химической деятельности клетки.
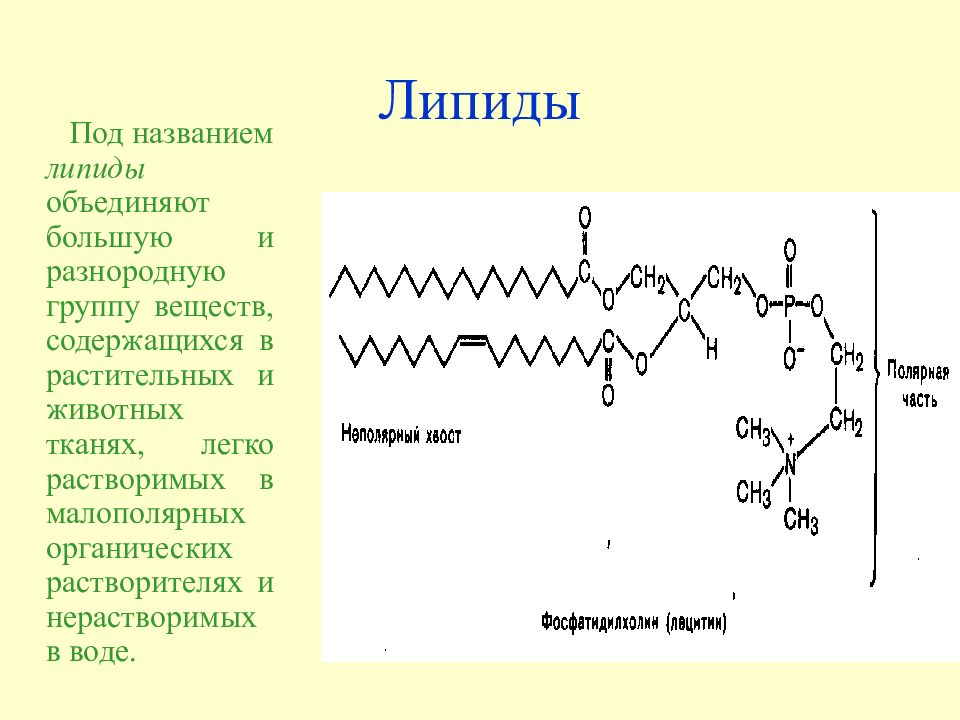
Слайд 19: Липиды
Под названием липиды объединяют большую и разнородную группу веществ, содержащихся в растительных и животных тканях, легко растворимых в малополярных органических растворителях и нерастворимых в воде.
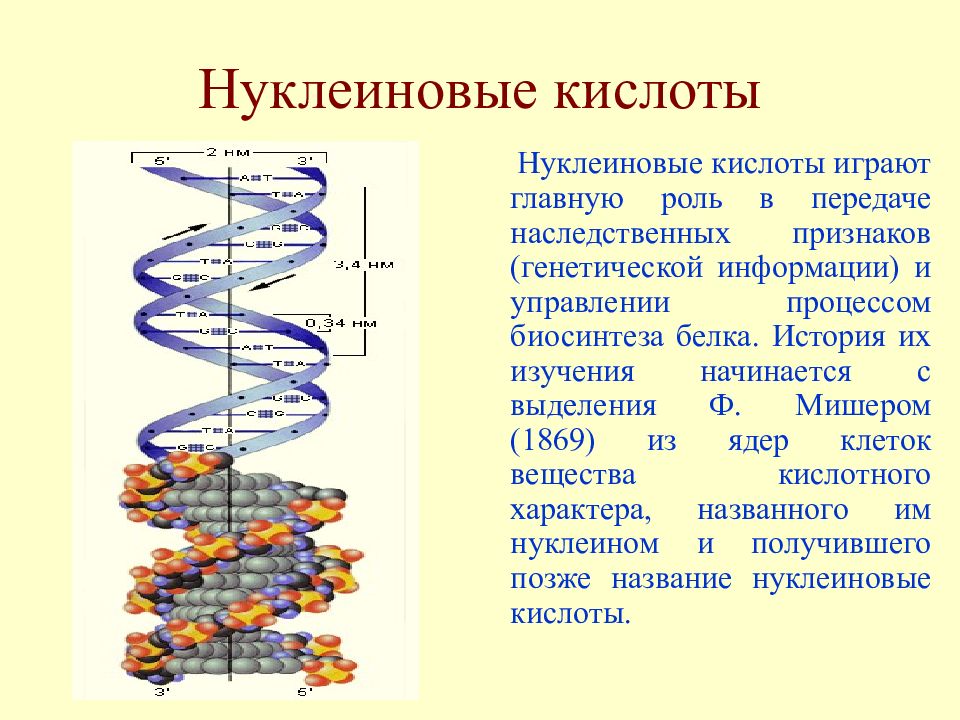
Слайд 20: Нуклеиновые кислоты
Нуклеиновые кислоты играют главную роль в передаче наследственных признаков (генетической информации) и управлении процессом биосинтеза белка. История их изучения начинается с выделения Ф. Мишером (1869) из ядер клеток вещества кислотного характера, названного им нуклеином и получившего позже название нуклеиновые кислоты.
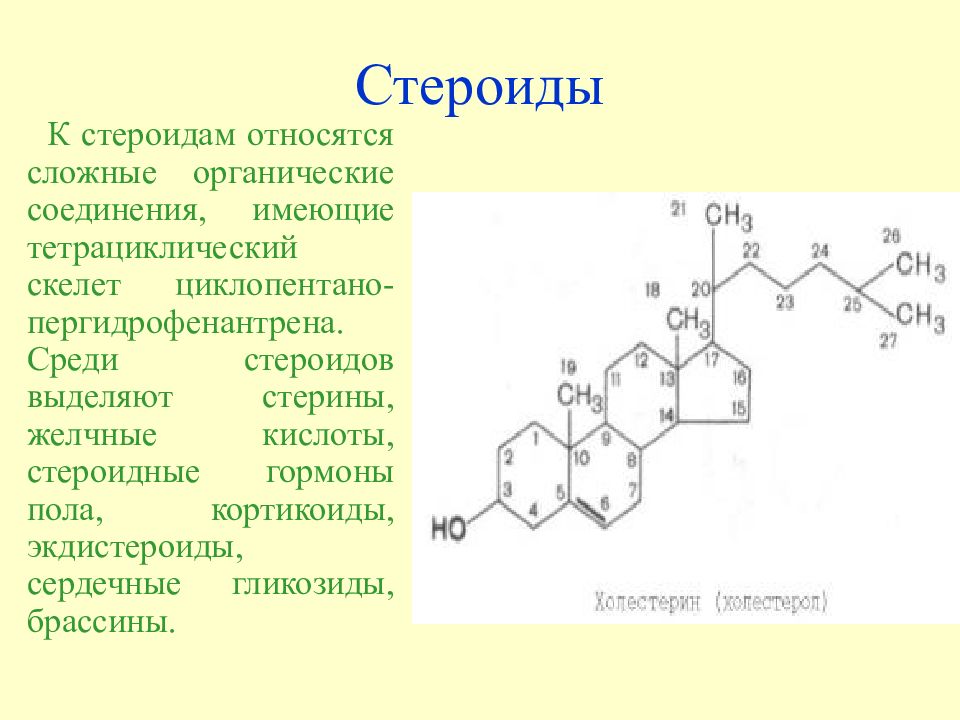
Слайд 21: Стероиды
К стероидам относятся сложные органические соединения, имеющие тетрациклический скелет циклопентано-пергидрофенантрена. Среди стероидов выделяют стерины, желчные кислоты, стероидные гормоны пола, кортикоиды, экдистероиды, сердечные гликозиды, брассины.
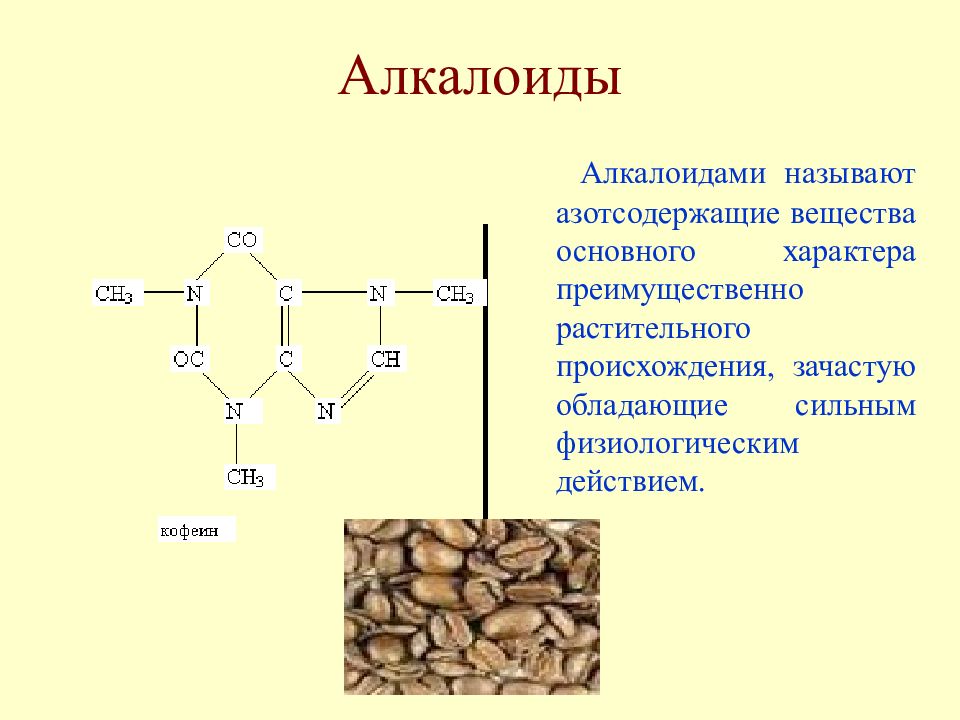
Слайд 22: Алкалоиды
Алкалоидами называют азотсодержащие вещества основного характера преимущественно растительного происхождения, зачастую обладающие сильным физиологическим действием.
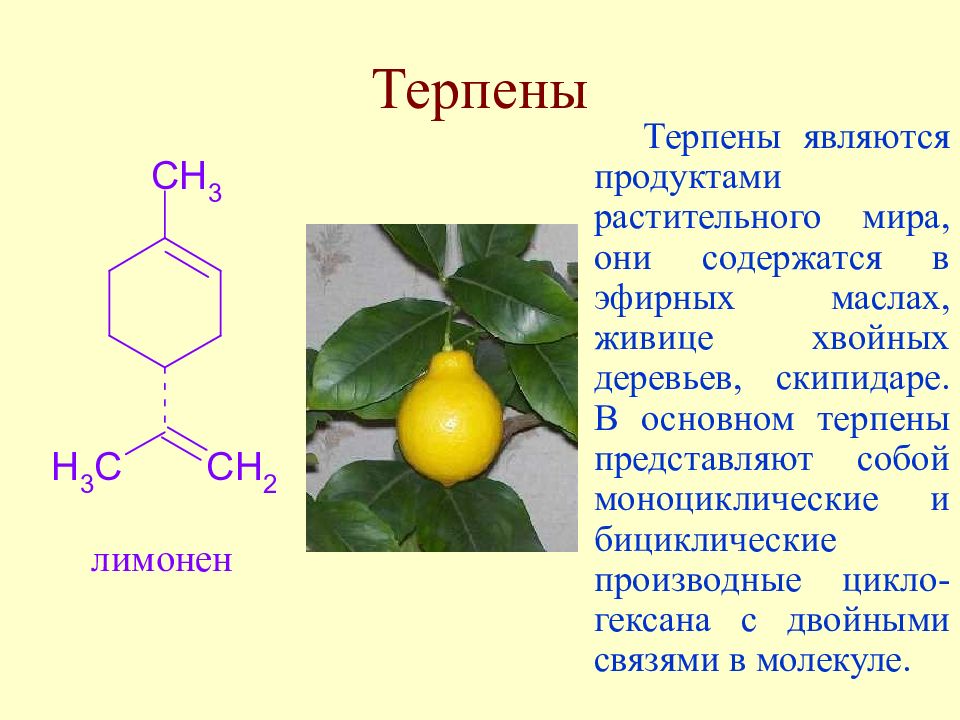
Слайд 23: Терпены
Терпены являются продуктами растительного мира, они содержатся в эфирных маслах, живице хвойных деревьев, скипидаре. В основном терпены представляют собой моноциклические и бициклические производные цикло-гексана с двойными связями в молекуле.
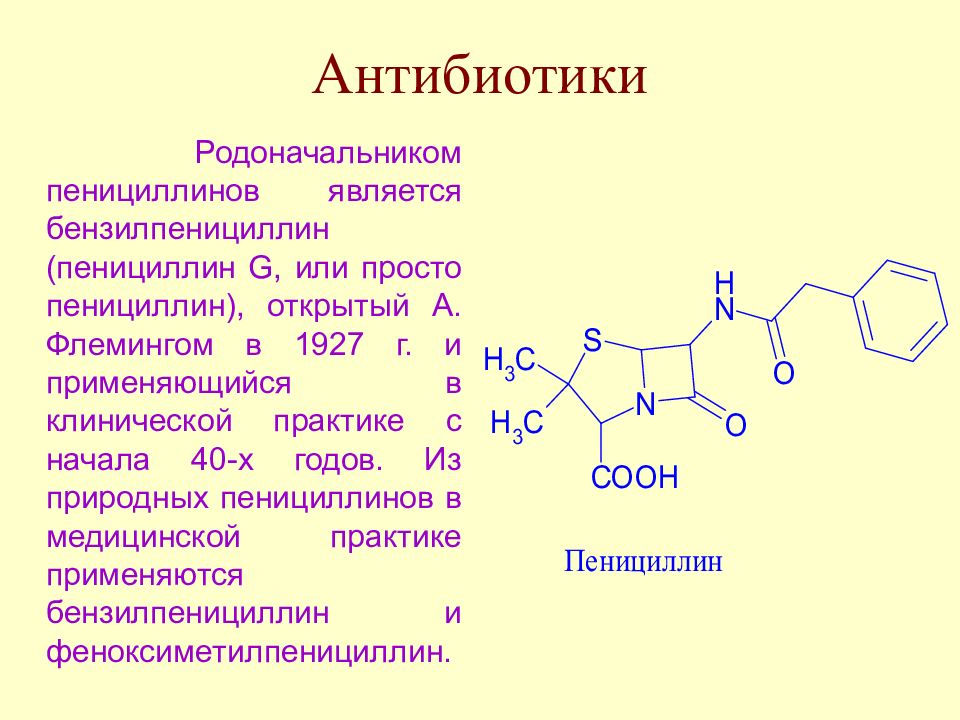
Слайд 24: Антибиотики
Родоначальником пенициллинов является бензилпенициллин (пенициллин G, или просто пенициллин), открытый А. Флемингом в 1927 г. и применяющийся в клинической практике с начала 40-х годов. Из природных пенициллинов в медицинской практике применяются бензилпенициллин и феноксиметилпенициллин.
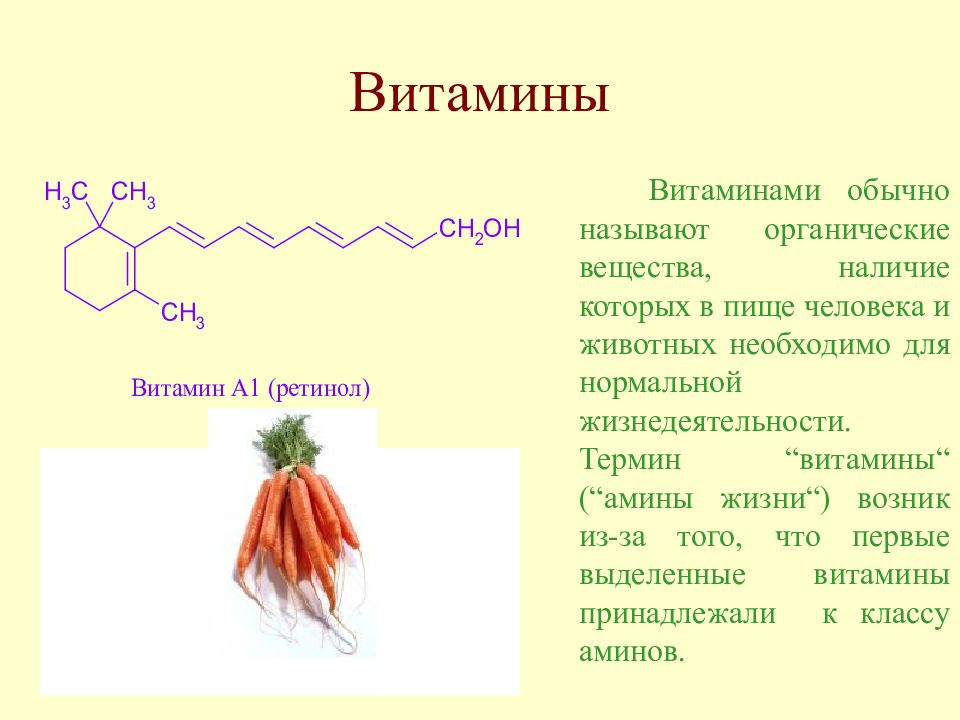
Слайд 25: Витамины
Витаминами обычно называют органические вещества, наличие которых в пище человека и животных необходимо для нормальной жизнедеятельности. Термин “ витамины “ ( “ амины жизни “ ) возник из-за того, что первые выделенные витамины принадлежали к классу аминов.
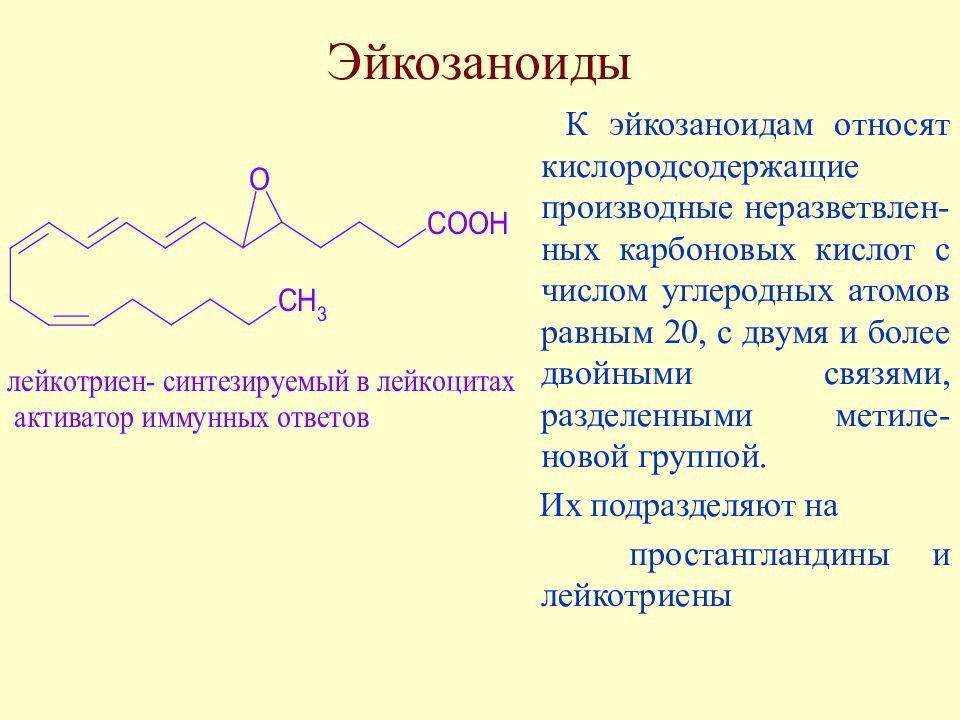
Слайд 26: Эйкозаноиды
К эйкозаноидам относят кислородсодержащие производные неразветвлен-ных карбоновых кислот с числом углеродных атомов равным 20, с двумя и более двойными связями, разделенными метиле-новой группой. Их подразделяют на простангландины и лейкотриены
Слайд 27: В 1959 г. в Москве был создан Институт биоорганической химии. Возглавил его академик Михаил Михайлович Шемякин
Вид здания института с высоты птичьего полета. Контуры здания напоминают фрагмент двухцепочечной спирали ДНК. Академик М.М. Шемякин
Слайд 28: Лекция 2
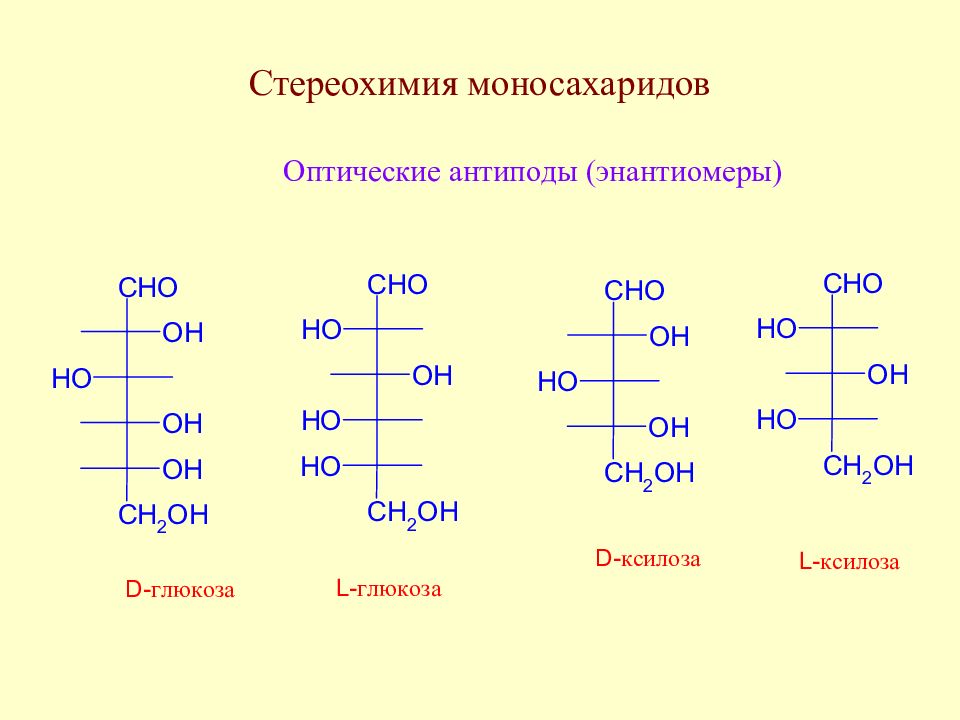
Углеводы. История открытия, классификация, биологическая роль. Стереохимия моносахаридов.
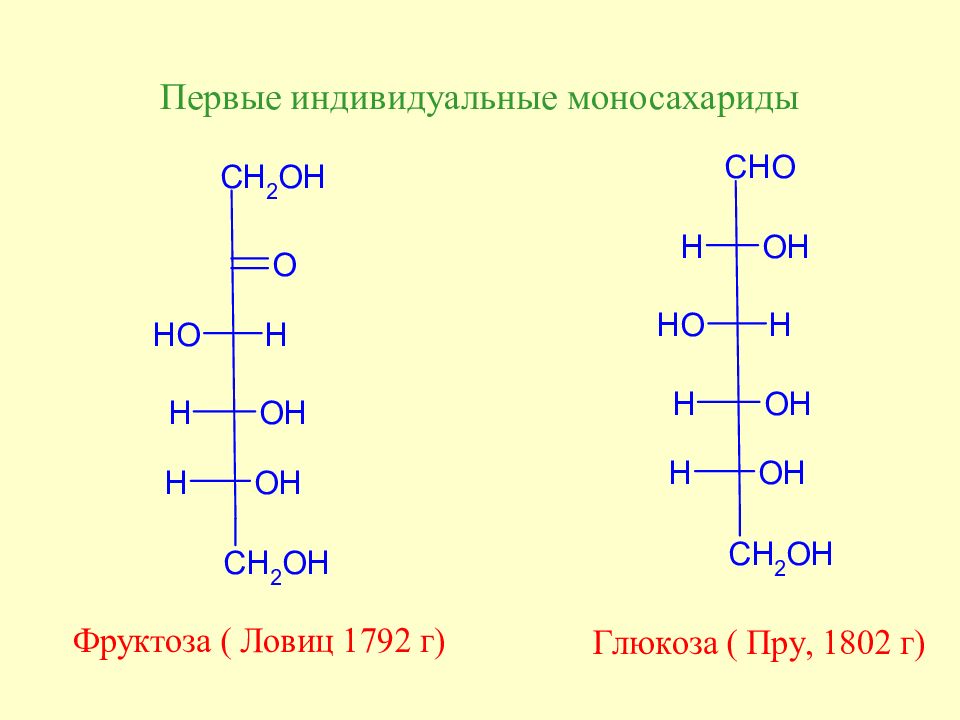
Слайд 29: Углеводы. История открытия
Первым природным веществом, выделен-ным человеком в чистом виде, была сахароза. Она была выделена из сахарного тростника в Китае еще в VIII ст. На фото - сборка сахарного тростника
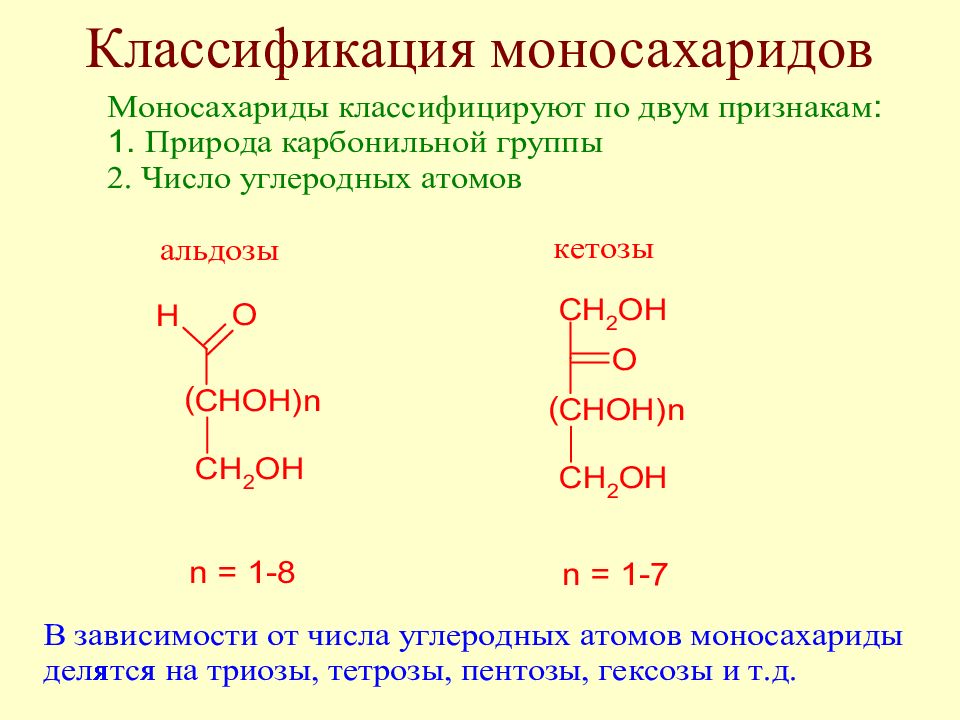
Слайд 30: Классификация углеводов
Моносахариды – полиоксиальдегиды или полиоксикетоны Олигосахариды содержат от 2 до 10 моносахаридных остатков Полисахариды – высокомолекулярные соединения, продукты поликонденсации моноз
Слайд 31: Биологическая роль углеводов
Строительный материал клетки Энергетическая кладовая организма Регулятор биохимических процессов Транспорт в клетки биологически активных веществ Составные элементы жизненно важных веществ (нуклеиновые кислоты, коферменты, витамины)
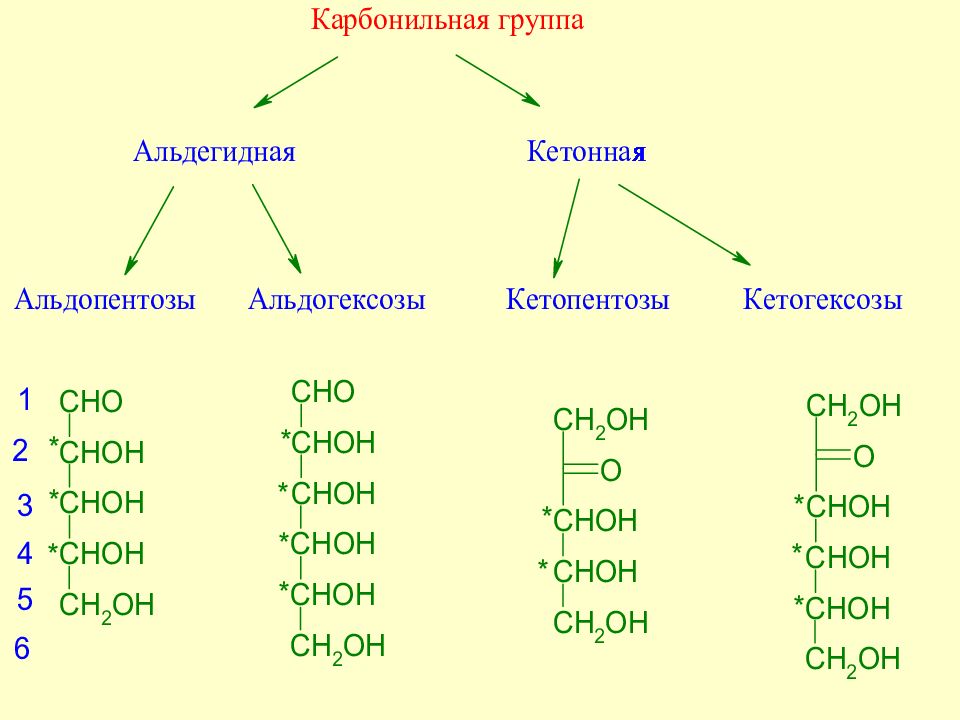
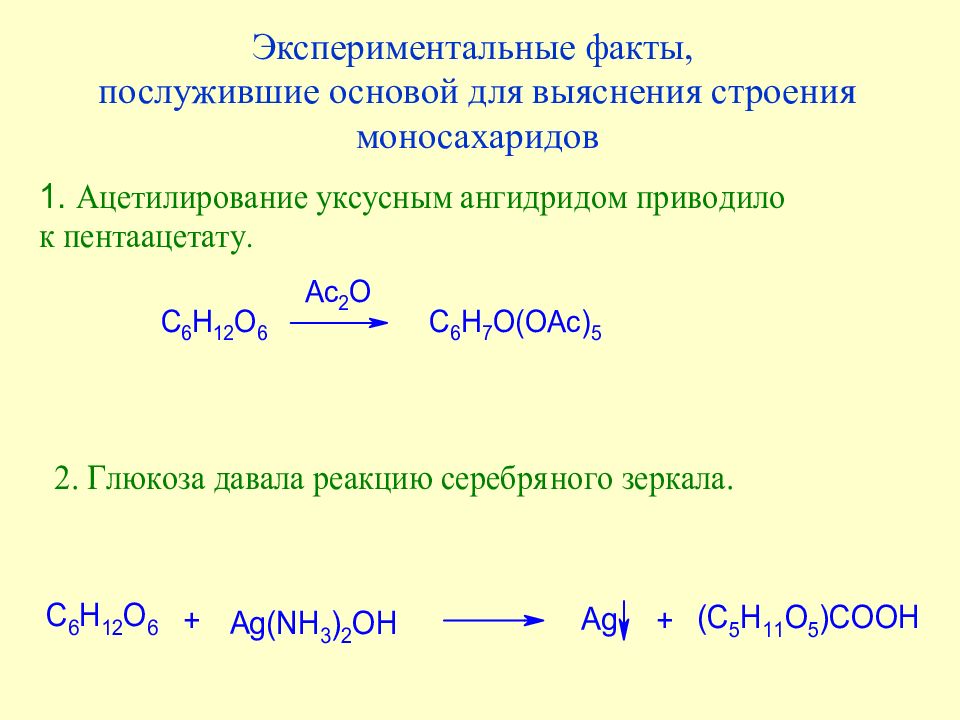
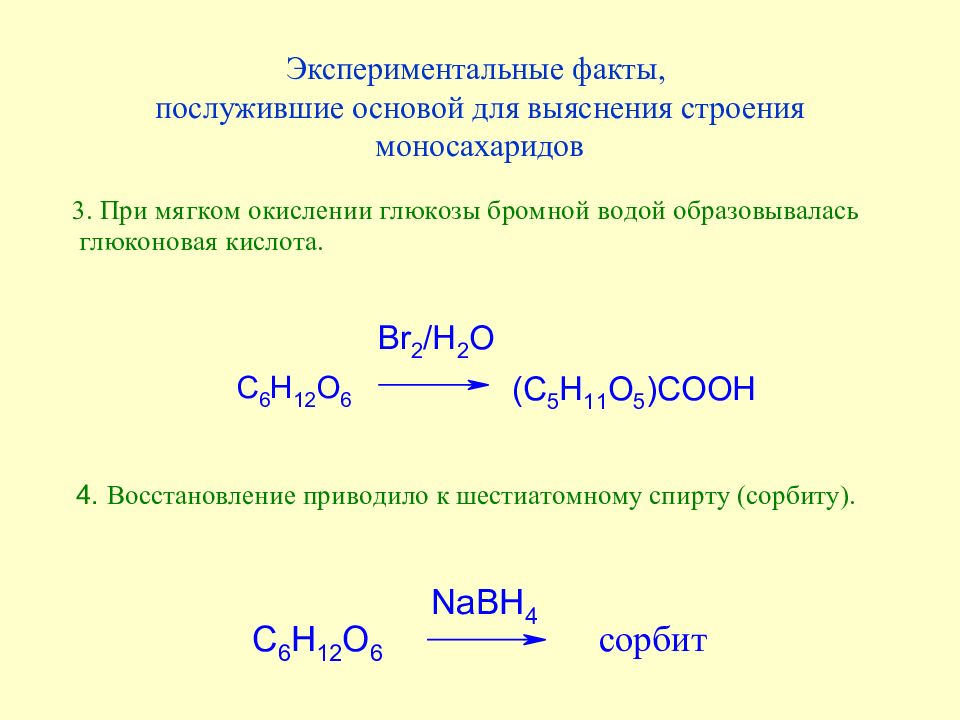
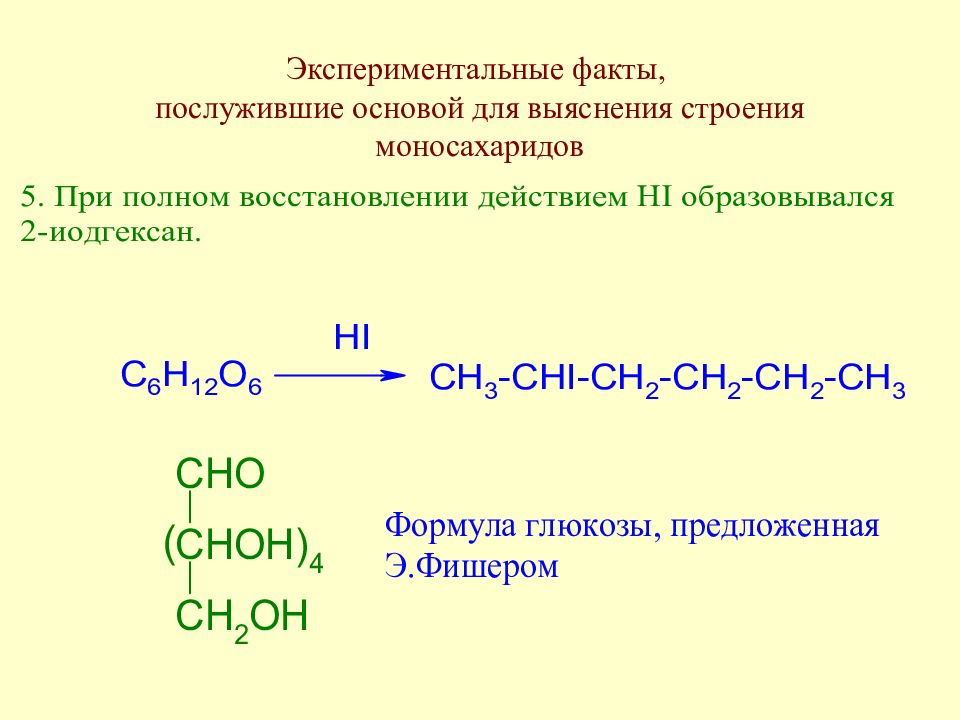
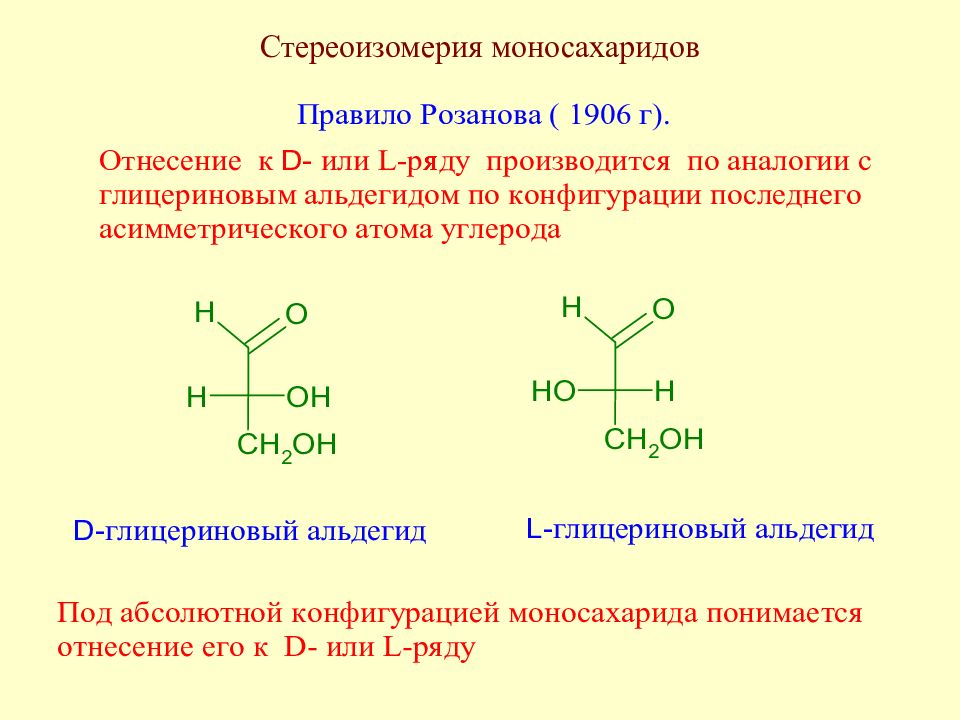
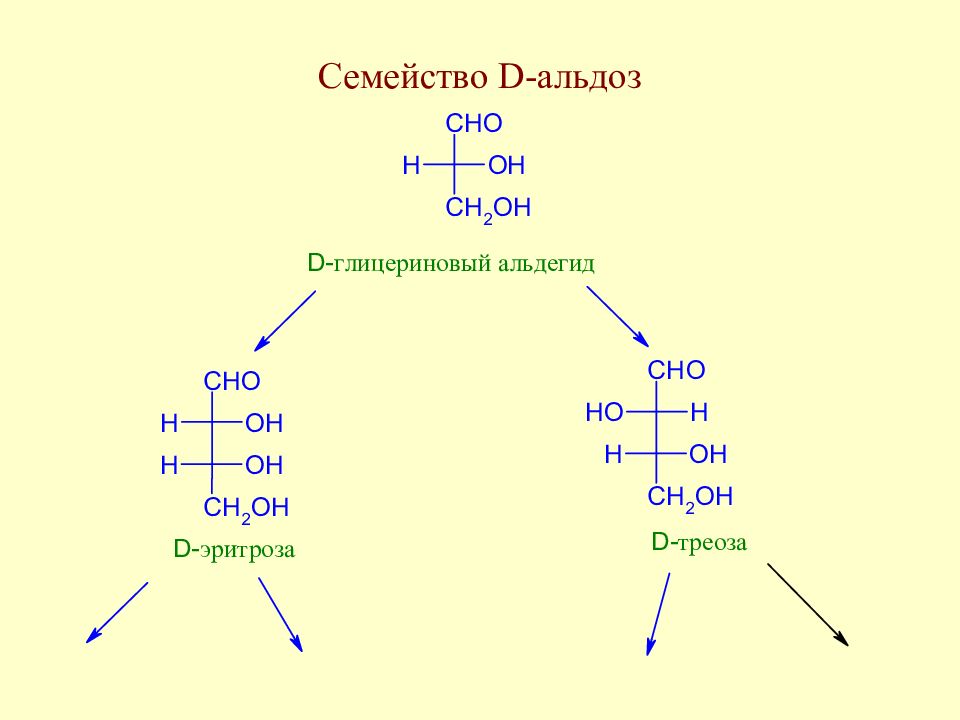
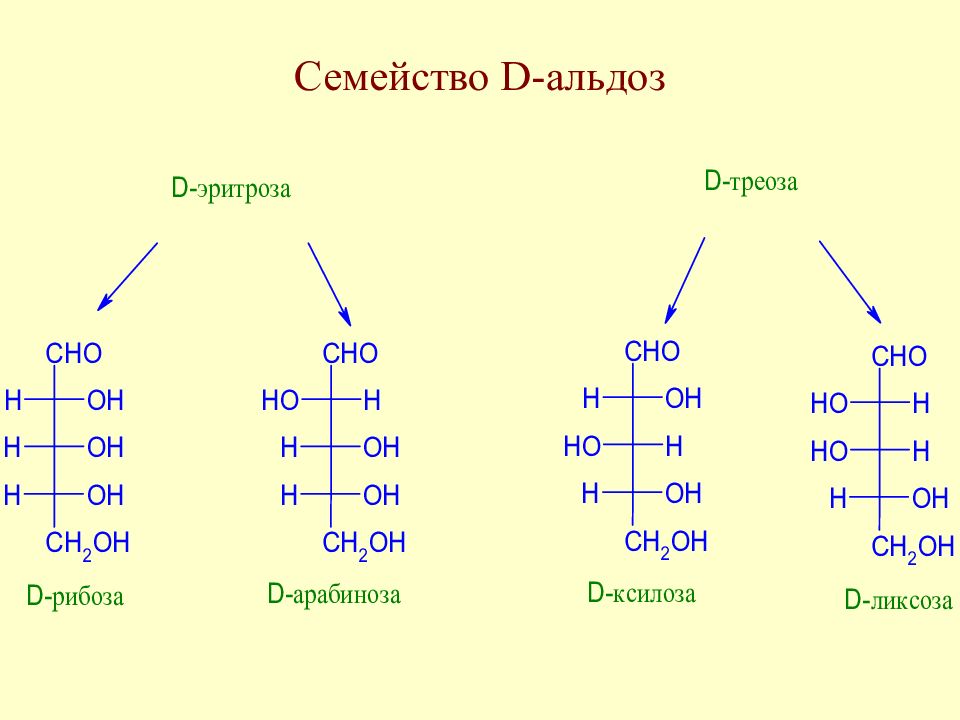
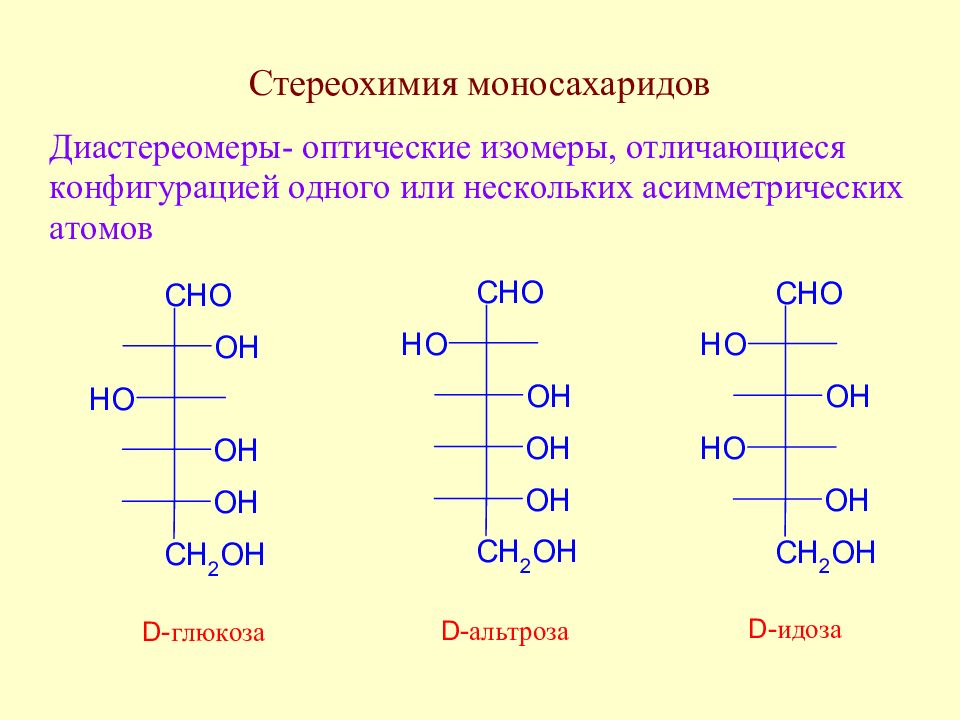
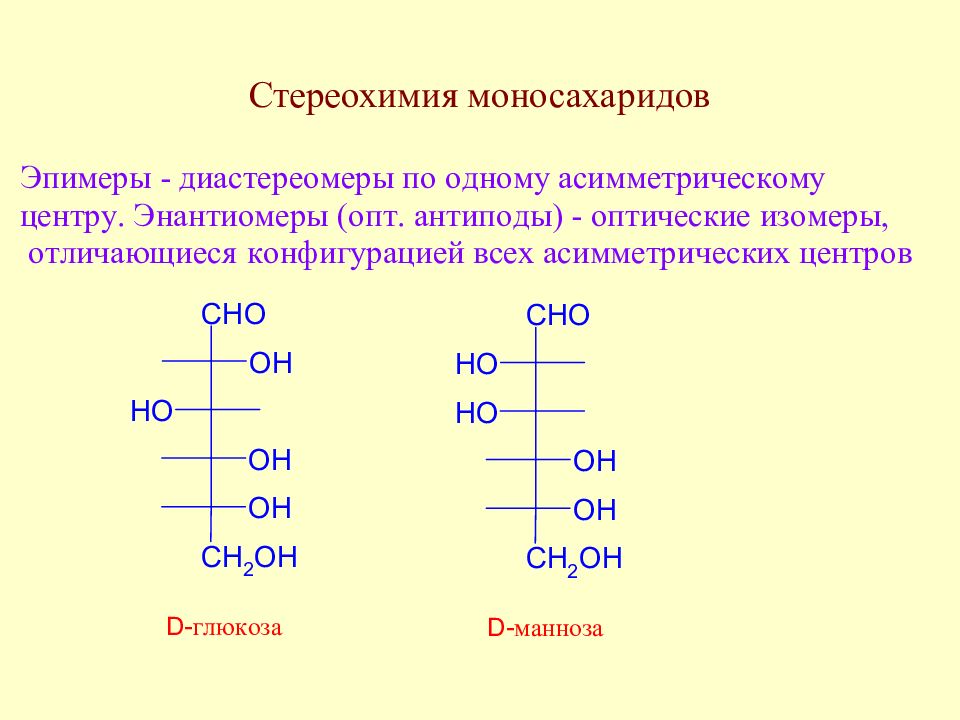
Слайд 35: Экспериментальные факты, послужившие основой для выяснения строения моносахаридов
Слайд 36: Экспериментальные факты, послужившие основой для выяснения строения моносахаридов
Слайд 37: Экспериментальные факты, послужившие основой для выяснения строения моносахаридов
Слайд 47: Экспериментальные факты, которые невозможно объяснить, исходя из формул Фишера
Количество изомеров у моносахаридов оказалось вдвое больше, чем следует из формул Фишера. В растворах моносахаридов наблюдается явление мутаротации. Моносахариды не проявляют некоторые типичные альдегидные реакции. Один из гидроксилов проявляет специфические свойства.
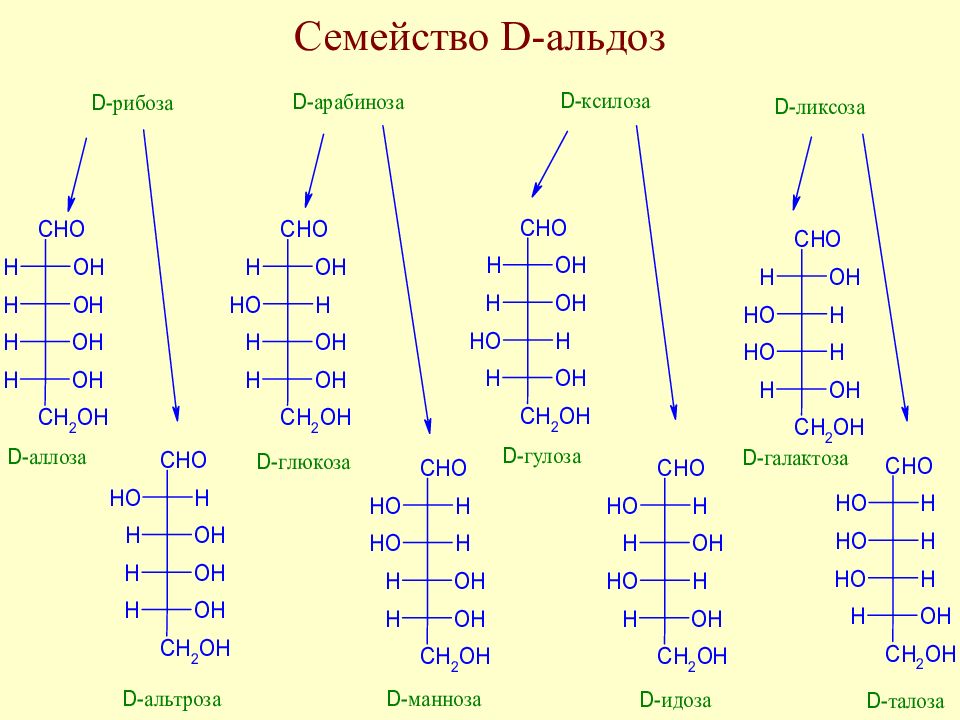
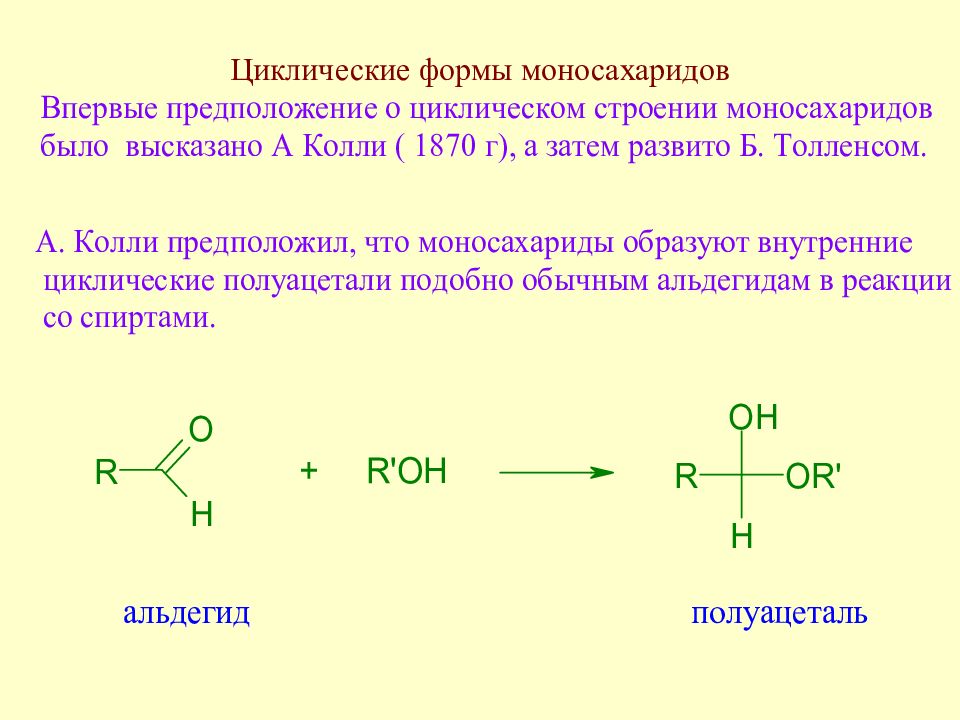
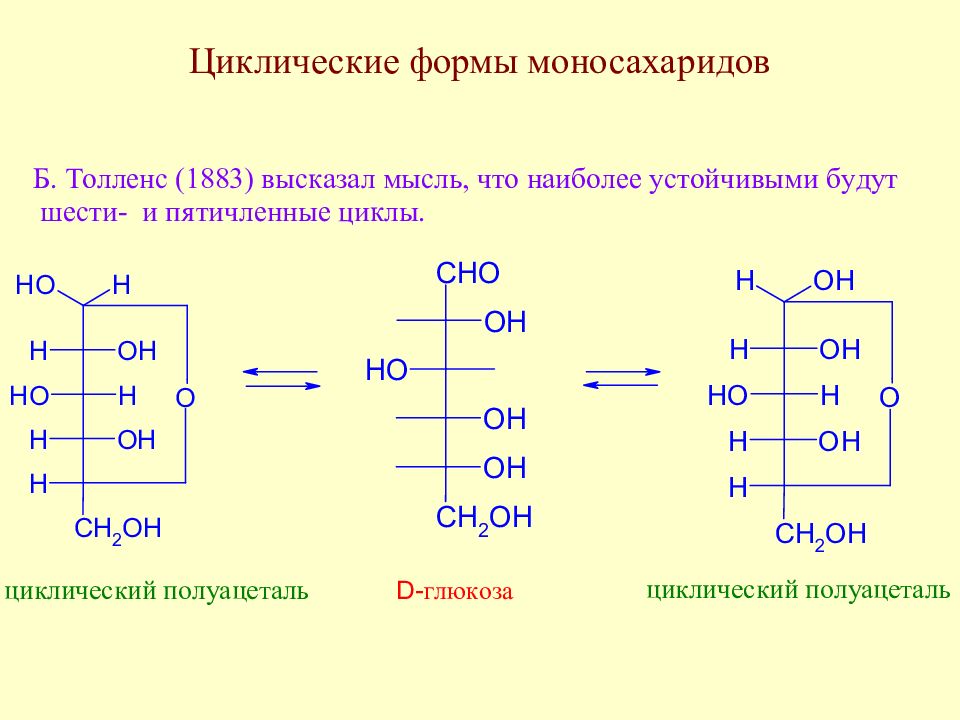
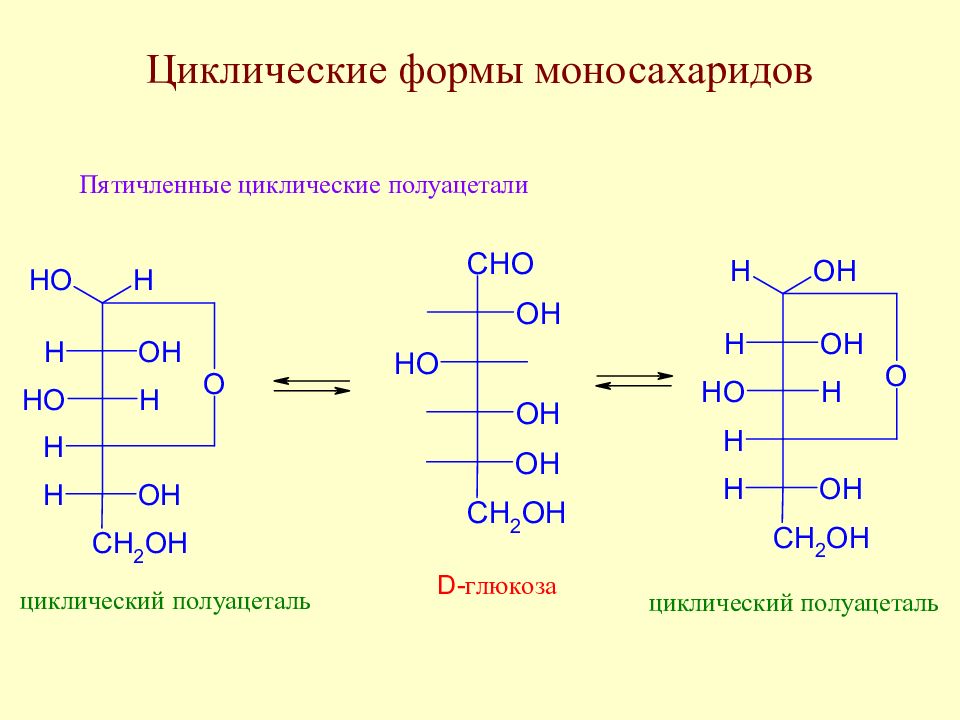
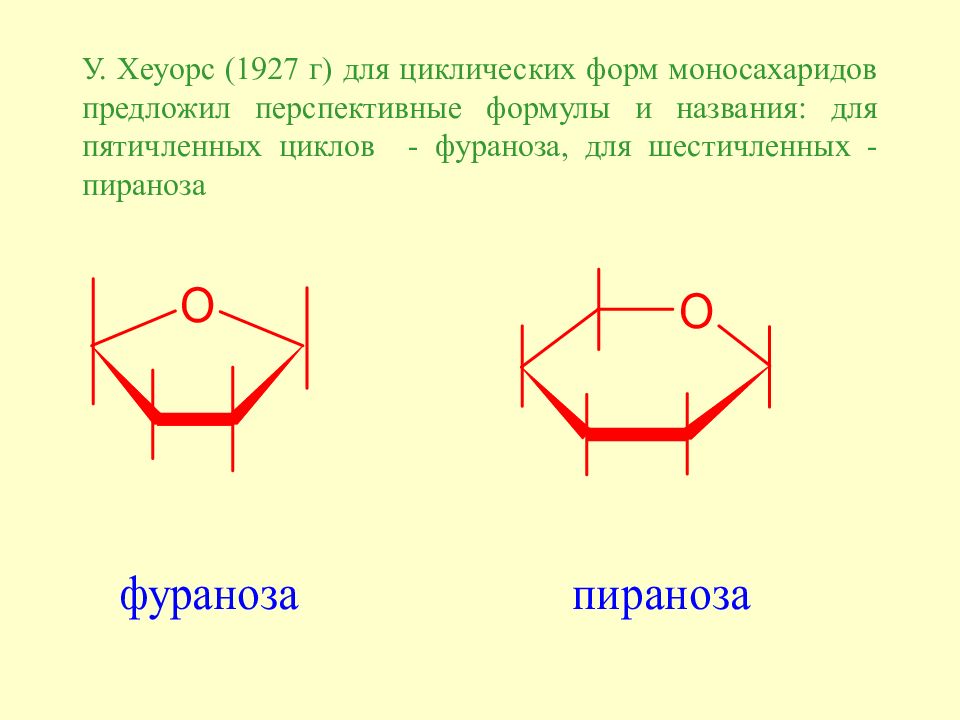
Слайд 51: У. Хеуорс (1927 г) для циклических форм моносахаридов предложил перспективные формулы и названия : для пятичленных циклов - фураноза, для шестичленных - пираноза
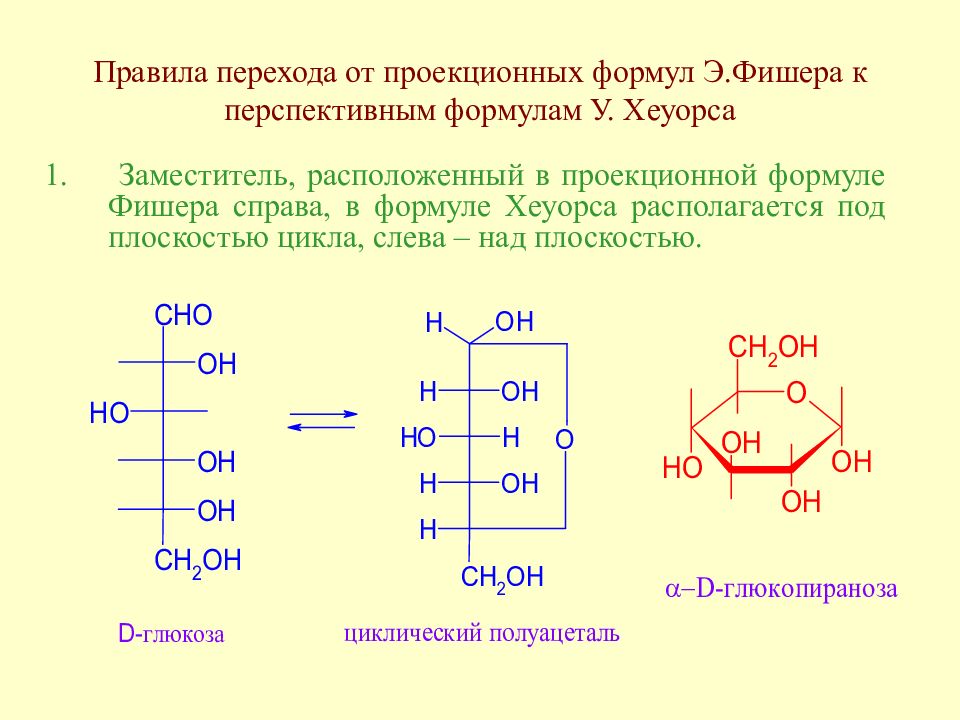
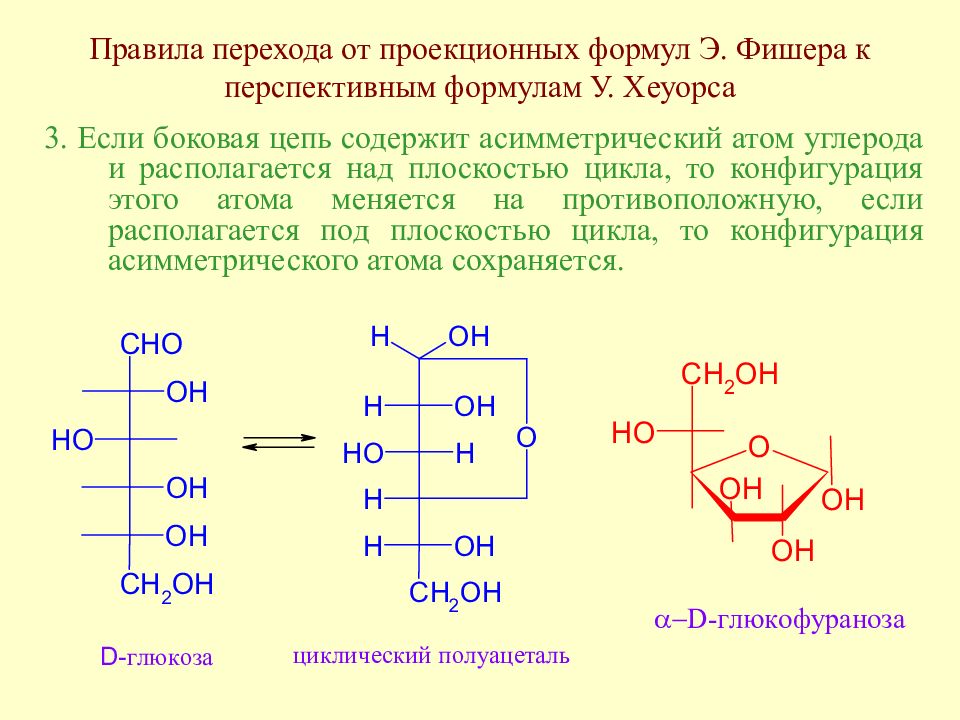
Слайд 52: Правила перехода от проекционных формул Э.Фишера к перспективным формулам У. Хеуорса
Заместитель, расположенный в проекционной формуле Фишера справа, в формуле Хеуорса располагается под плоскостью цикла, слева – над плоскостью.
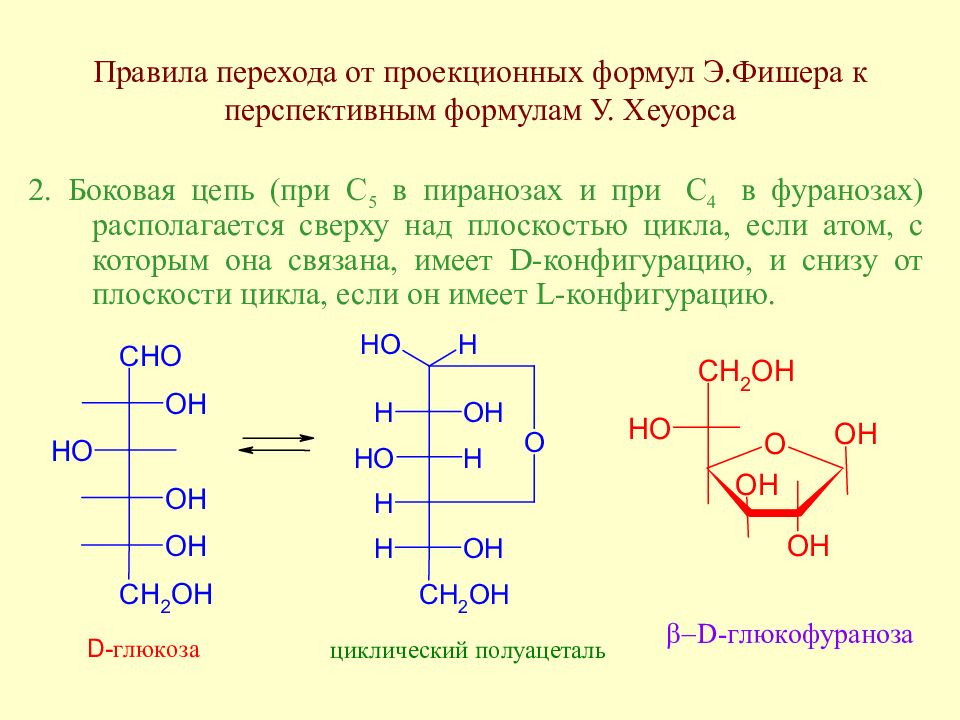
Слайд 53: Правила перехода от проекционных формул Э.Фишера к перспективным формулам У. Хеуорса
2. Боковая цепь (при С 5 в пиранозах и при С 4 в фуранозах) располагается сверху над плоскостью цикла, если атом, с которым она связана, имеет D- конфигурацию, и снизу от плоскости цикла, если он имеет L- конфигурацию.
Слайд 54: Правила перехода от проекционных формул Э. Фишера к перспективным формулам У. Хеуорса
3. Если боковая цепь содержит асимметрический атом углерода и располагается над плоскостью цикла, то конфигурация этого атома меняется на противоположную, если располагается под плоскостью цикла, то конфигурация асимметрического атома сохраняется.
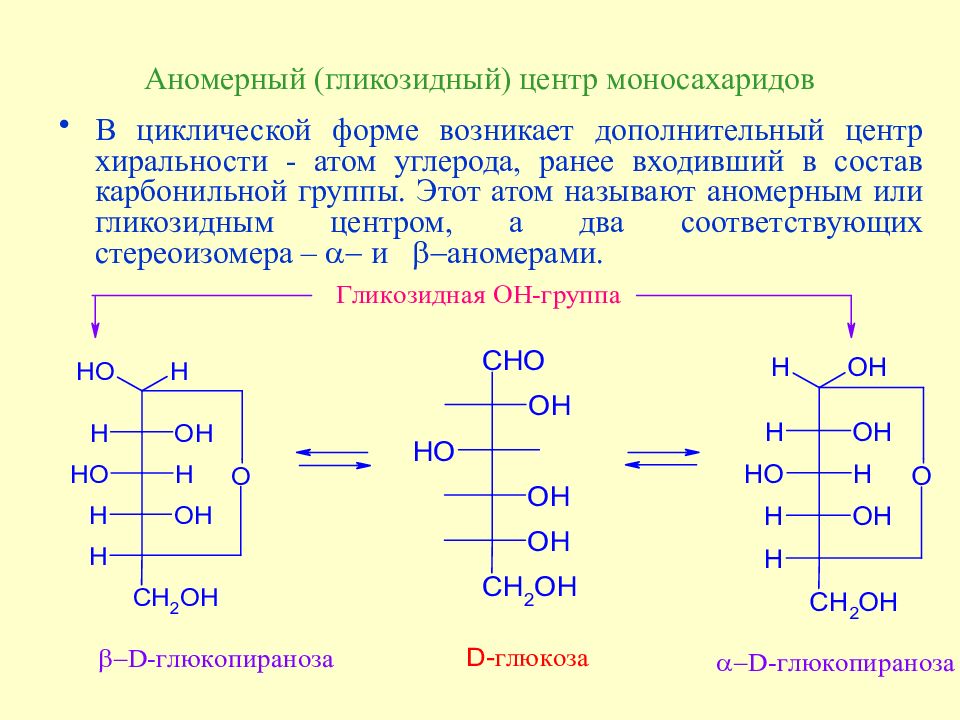
Слайд 56: Аномерный (гликозидный) центр моносахаридов
В циклической форме возникает дополнительный центр хиральности - атом углерода, ранее входивший в состав карбонильной группы. Этот атом называют аномерным или гликозидным центром, а два соответствующих стереоизомера – a- и b- аномерами.
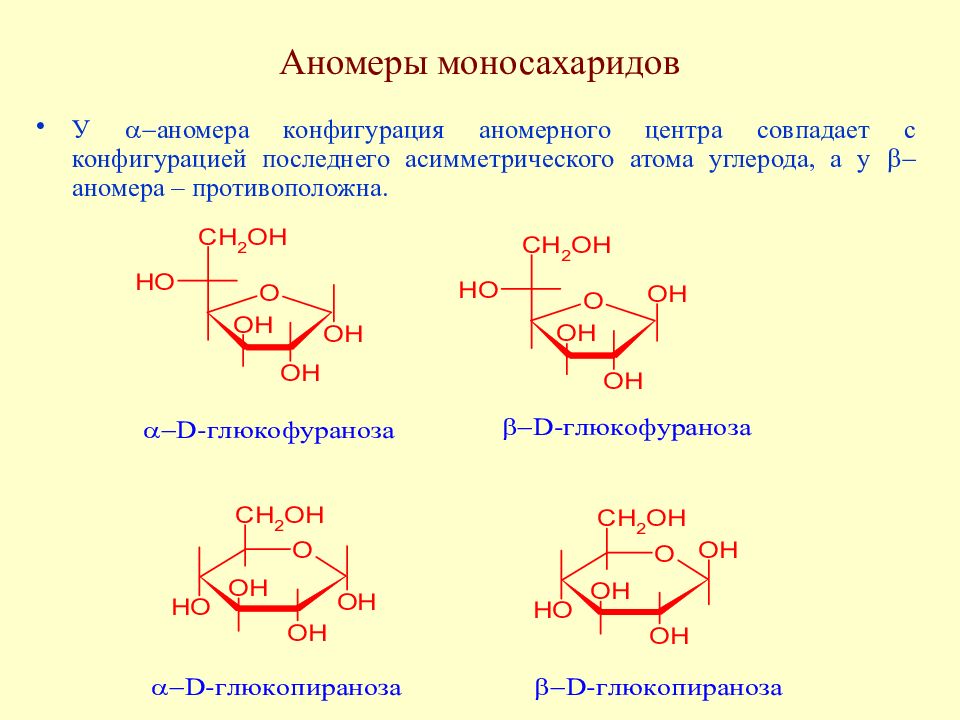
Слайд 57: Аномеры моносахаридов
У a - аномера конфигурация аномерного центра совпадает с конфигурацией последнего асимметрического атома углерода, а у b- аномера – противоположна.
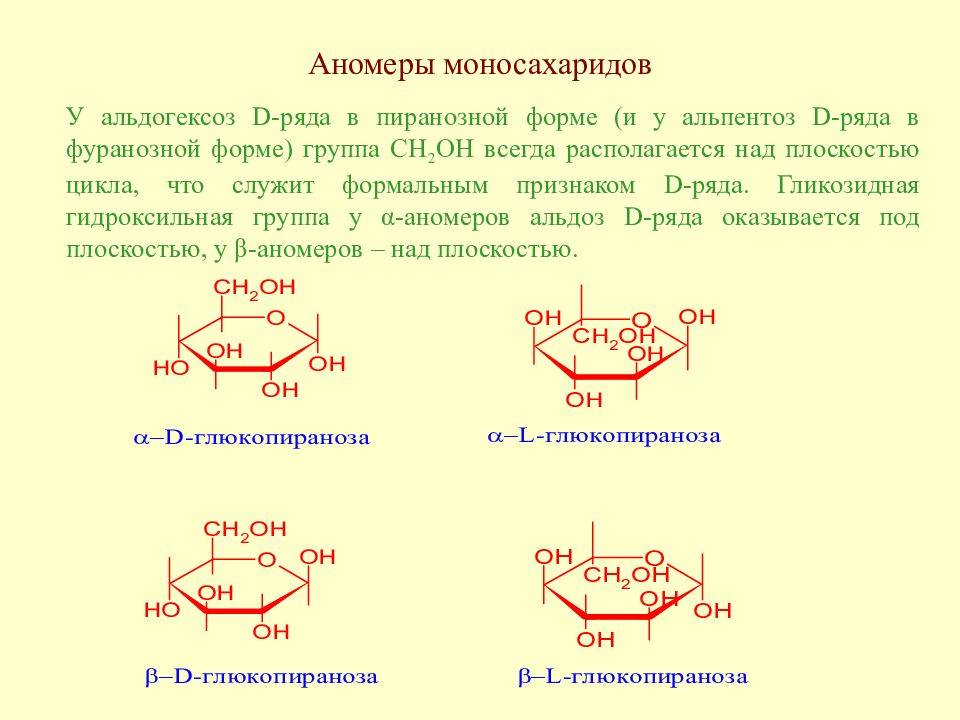
Слайд 58: Аномеры моносахаридов
У альдогексоз D -ряда в пиранозной форме (и у альпентоз D -ряда в фуранозной форме) группа CH 2 OH всегда располагается над плоскостью цикла, что служит формальным признаком D -ряда. Гликозидная гидроксильная группа у α-аномеров альдоз D -ряда оказывается под плоскостью, у β-аномеров – над плоскостью.
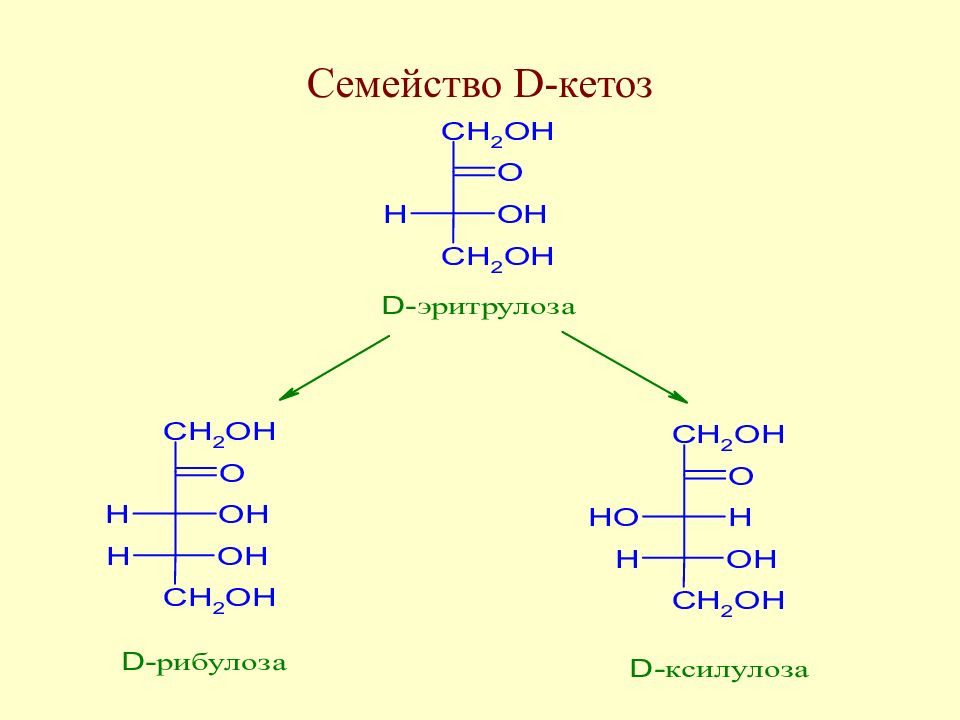
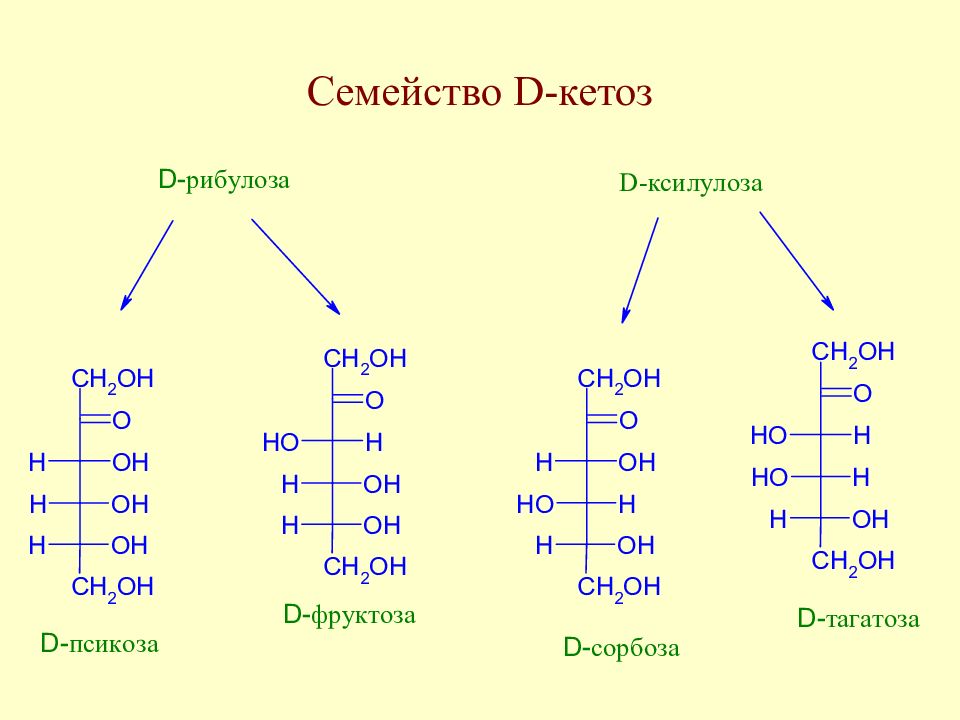
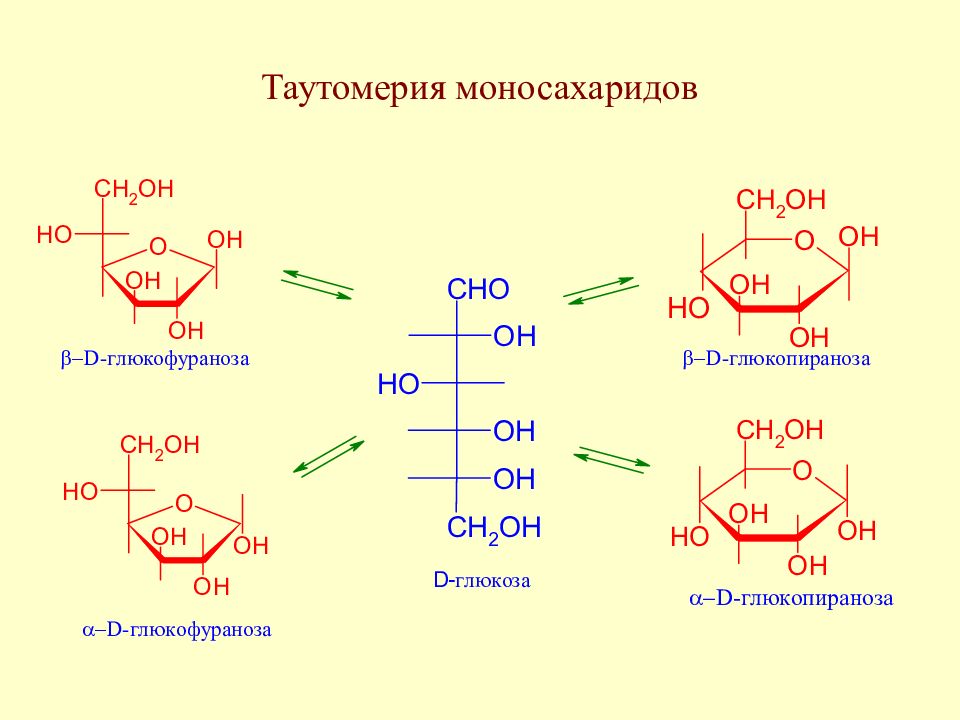
Слайд 59: Таутомерия моносахаридов
В твердом состоянии моносахариды находятся в циклической форме. У свежеприготовленного раствора моносахарида наблюдается постепенное изменение удельного вращения до достижения определенного значения. Изменение во времени угла вращения плоскости поляризации света растворами углеводов называется мутаротацией. Химическая сущность мутаротации состоит в способности моносахаридов к существованию в виде равновесной смеси таутомеров - открытой и циклических форм. Такой вид таутомерии называется цикло-оксо-таутомерией (кольчато-цепная таутомерия).
Слайд 61: Таутомерия моносахаридов
В смеси таутомеров преобладают пиранозные формы (36% для α- D -глюкопиранозы и 64% для β- D -глюкопиранозы). Оксо-форма, а также фуранозы содержатся в малых количествах (0,02 % для открытой формы D -глюкозы и по 0,1 % для D -глюкофураноз). Важно, однако, не абсолютное содержание того или иного таутомера, а возможность их перехода друг в друга. Моносахариды, в зависимости от условий реакции и применяемых реагентов, взаимодействуют в одной из таутомерных форм: фуранозной, пиранозной или ациклической. Например, несмотря на незначительное содержание оксо-формы, глюкоза вступает в реакции, характерные для альдегидной группы. Это обусловлено сдвигом равновесия в сторону открытой формы по мере ее расходования. Таутомерия лежит в основе множественности химических свойств моносахаридов.
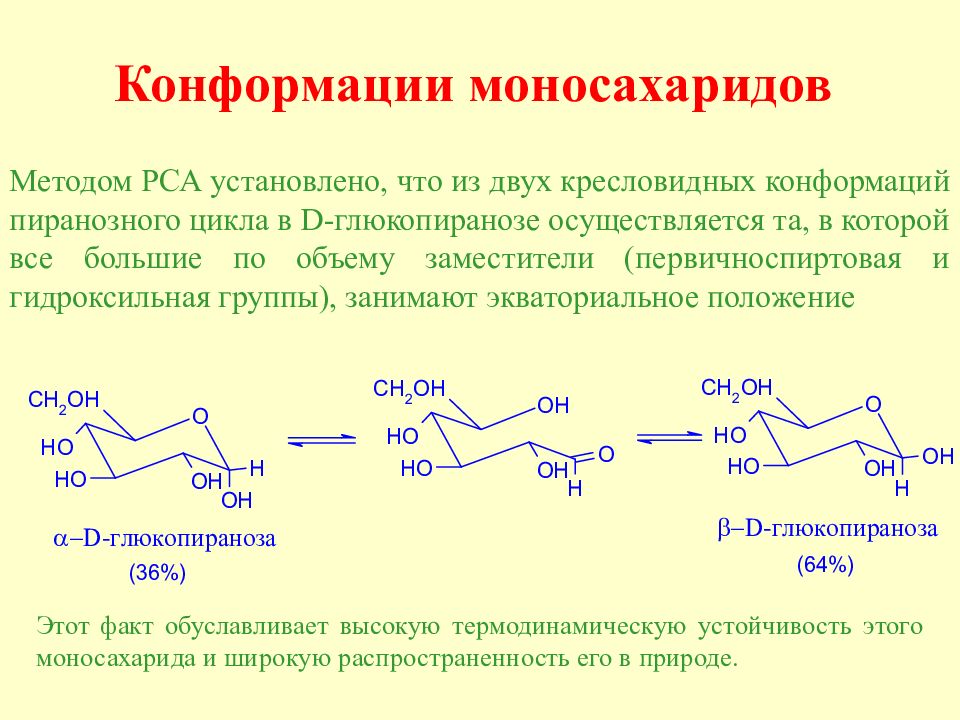
Слайд 62: Конформации моносахаридов
Методом РСА установлено, что из двух кресловидных конформаций пиранозного цикла в D -глюкопиранозе осуществляется та, в которой все большие по объему заместители (первичноспиртовая и гидроксильная группы), занимают экваториальное положение Этот факт обуславливает высокую термодинамическую устойчивость этого моносахарида и широкую распространенность его в природе.
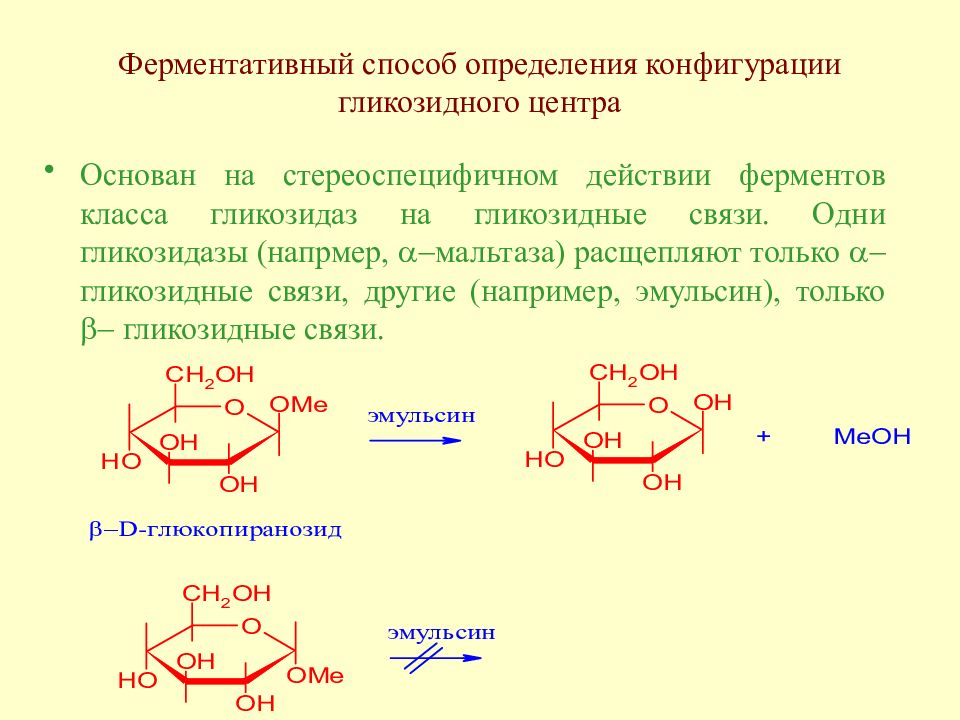
Слайд 63: Ферментативный способ определения конфигурации гликозидного центра
Основан на стереоспецифичном действии ферментов класса гликозидаз на гликозидные связи. Одни гликозидазы (напрмер, a - мальтаза) расщепляют только a- гликозидные связи, другие (например, эмульсин), только b - гликозидные связи.
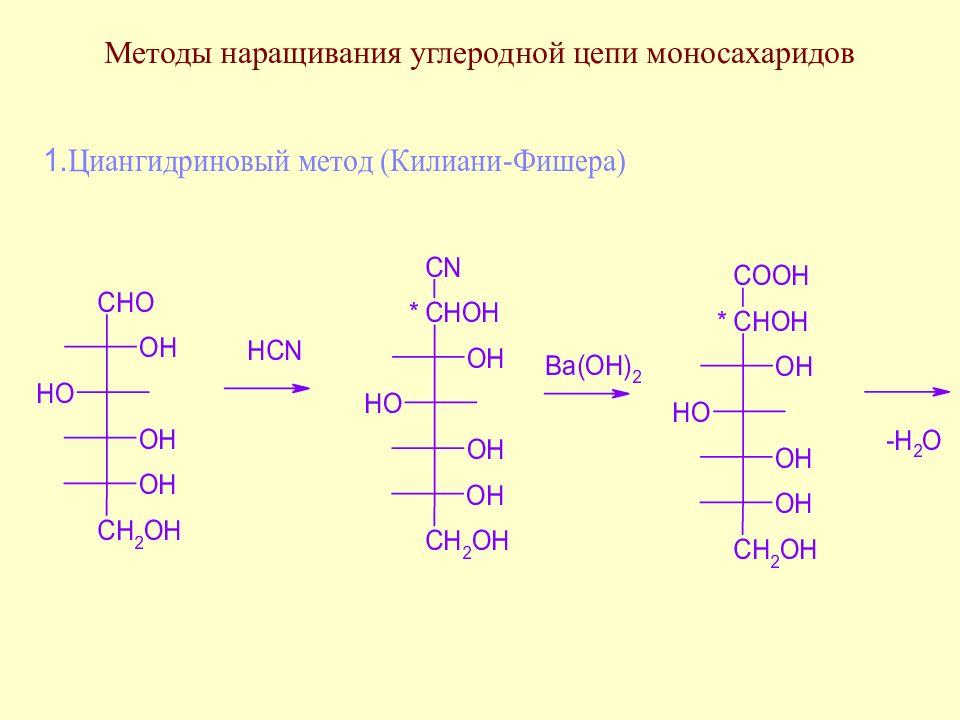
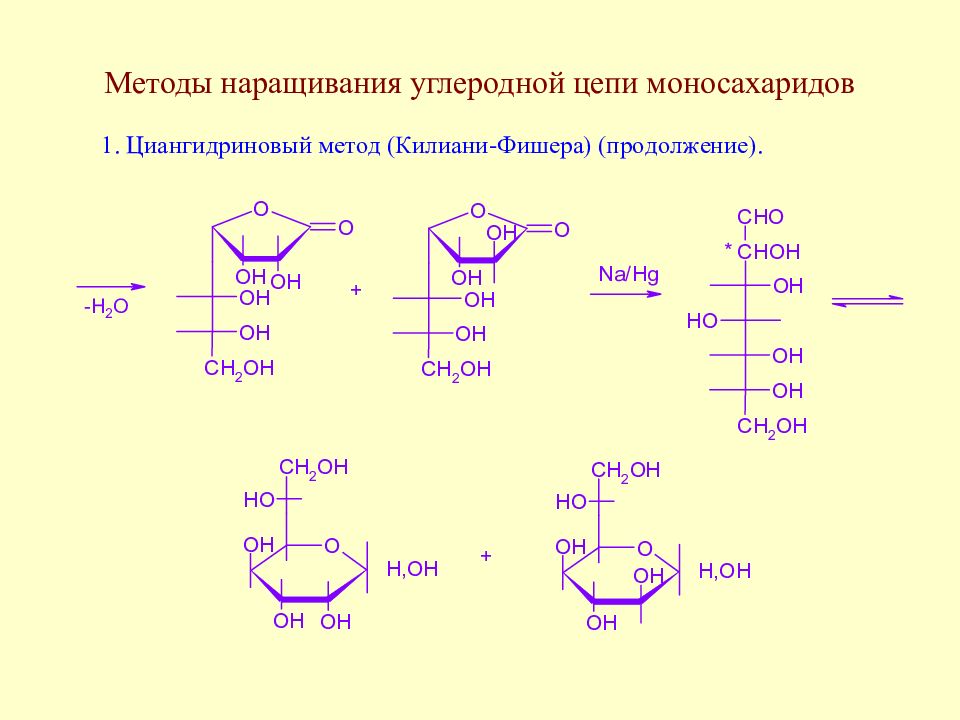
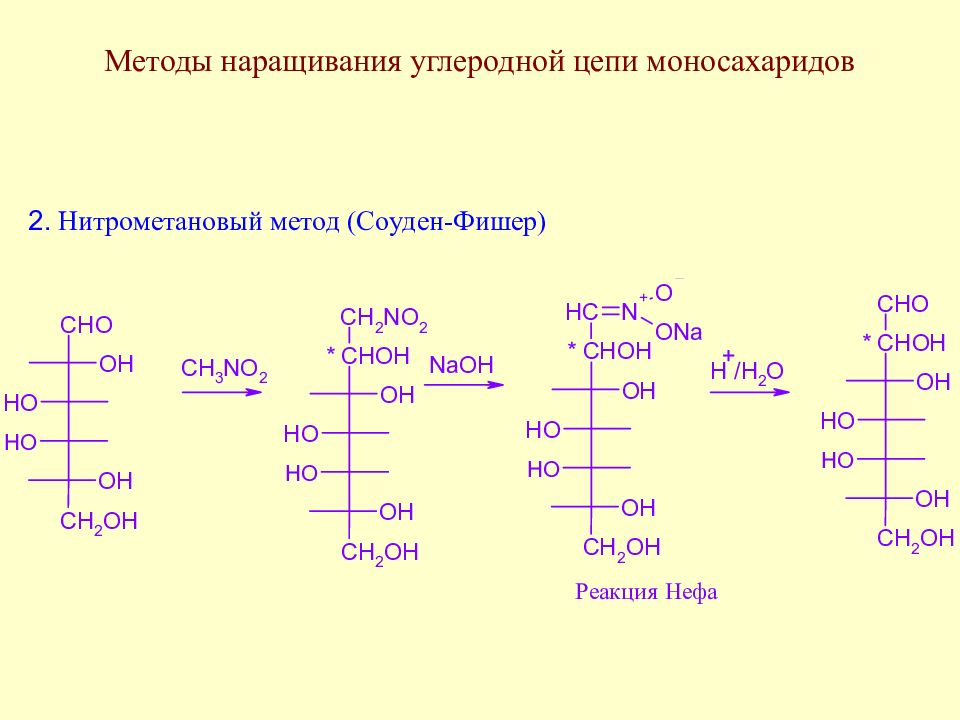
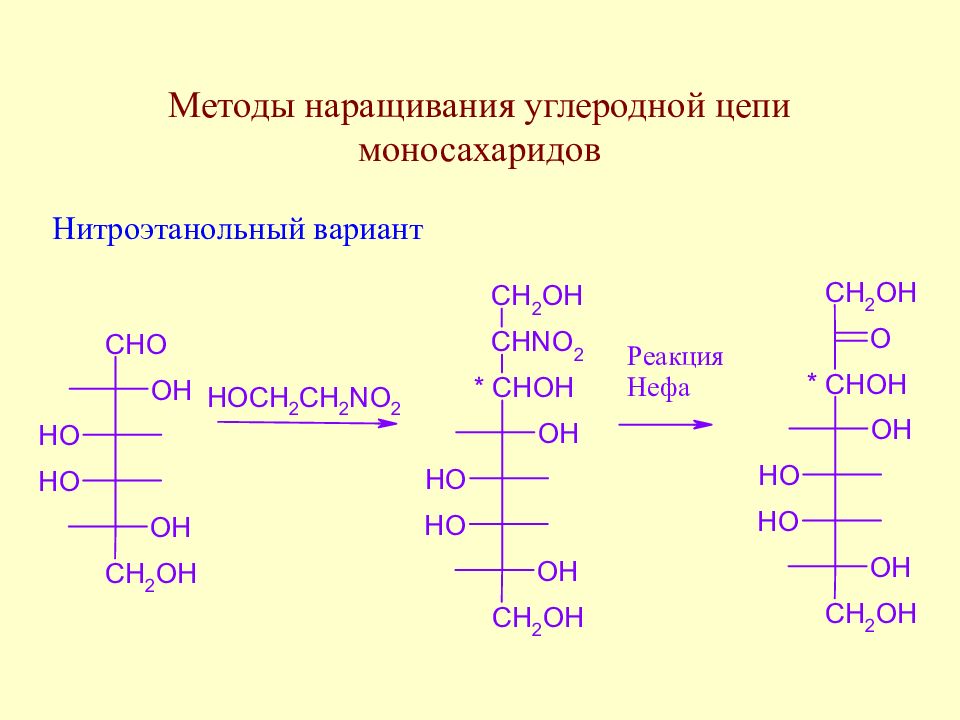
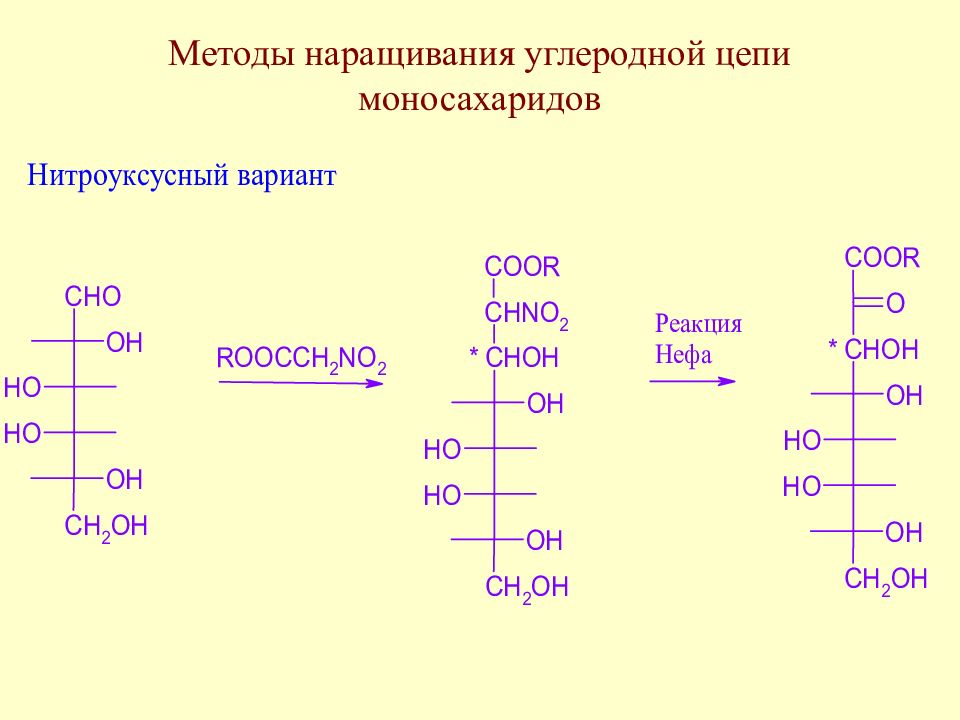
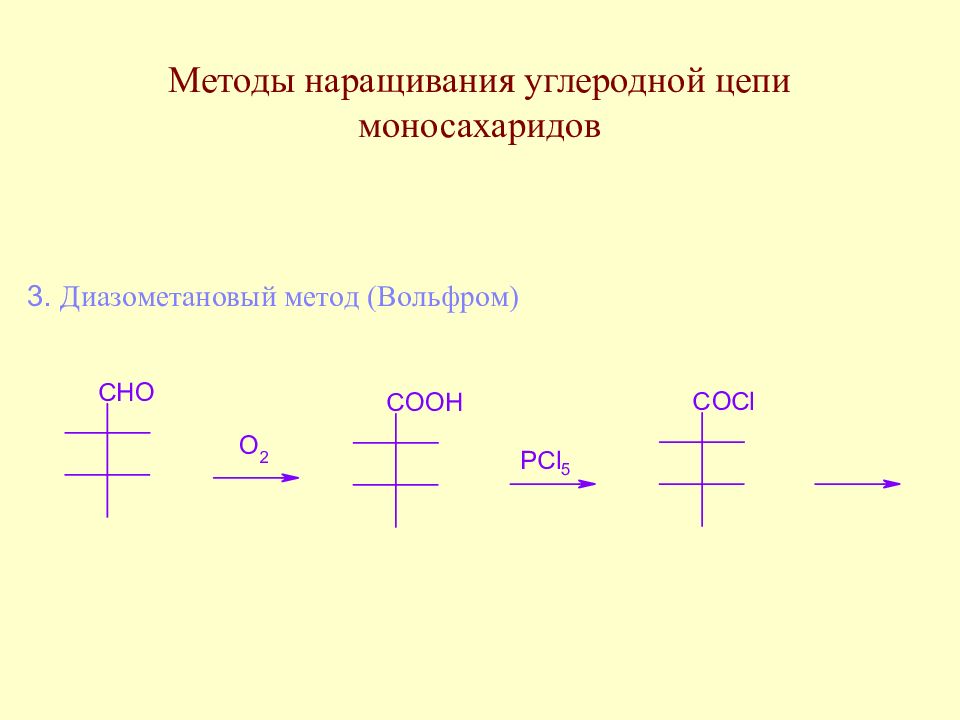
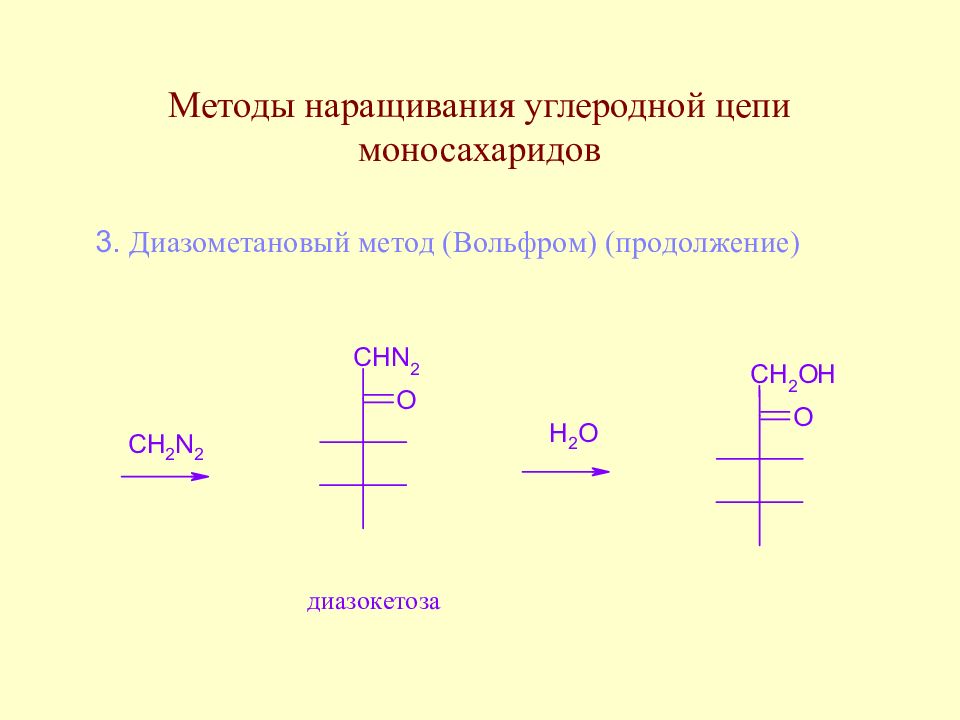
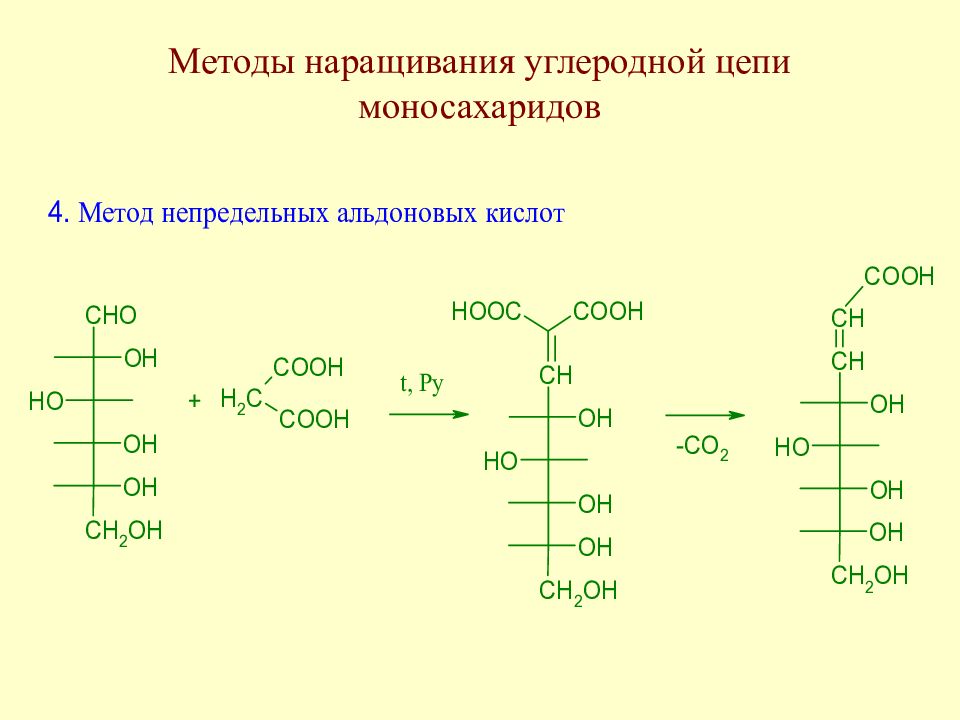
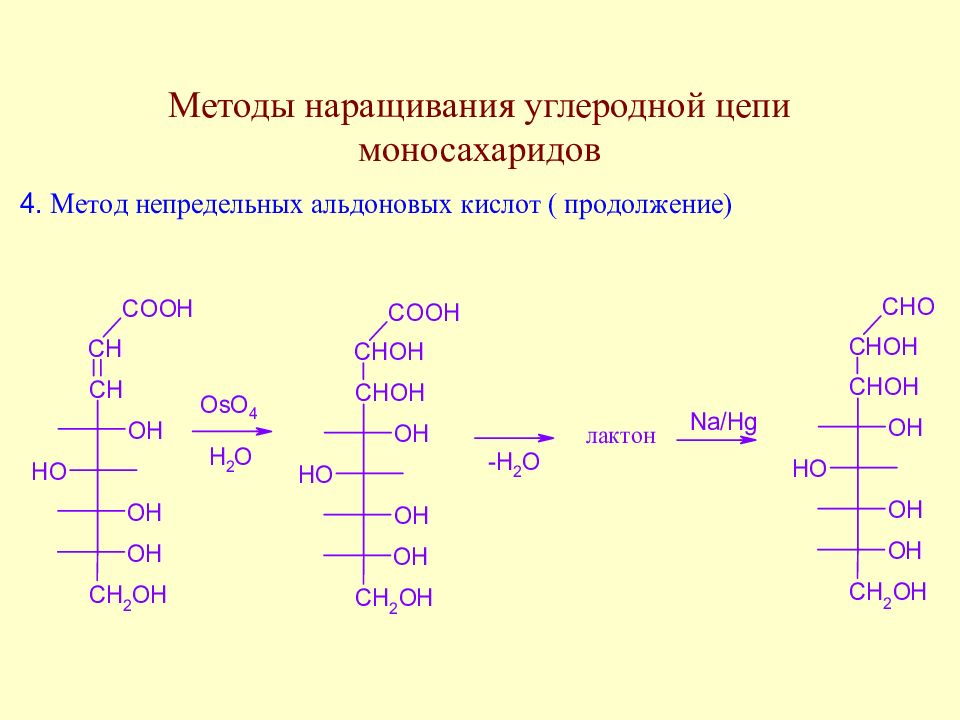
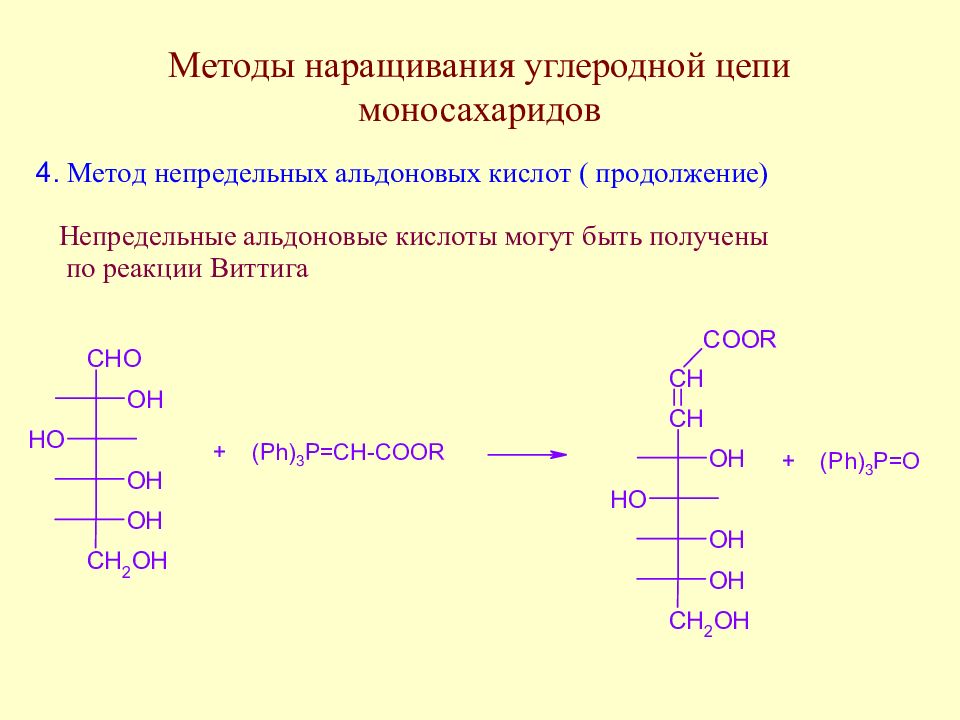
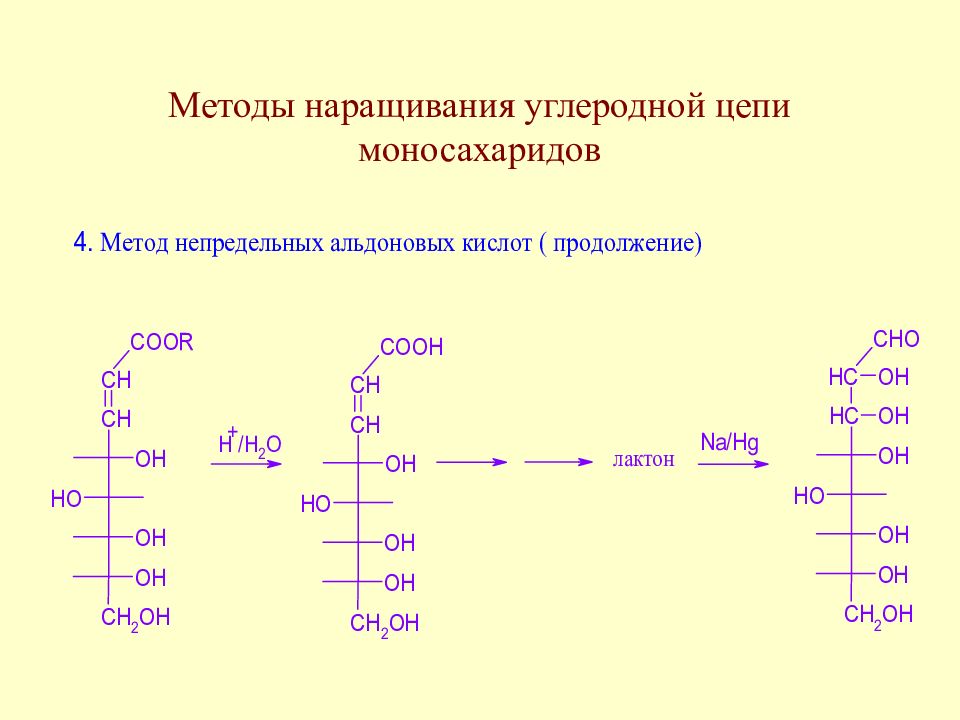
Слайд 64: Методы наращивания углеродной цепи моносахаридов
В начальной стадии развития химии методы наращивания углеродной цепи моносахаридов позволили Э. Фишеру установить строение ряда моносахаридов. В настоящее время эти методы служат как для целей установления строения сложных сахаров, так и для синтеза производных моносахаридов, часто встречающихся в природе.
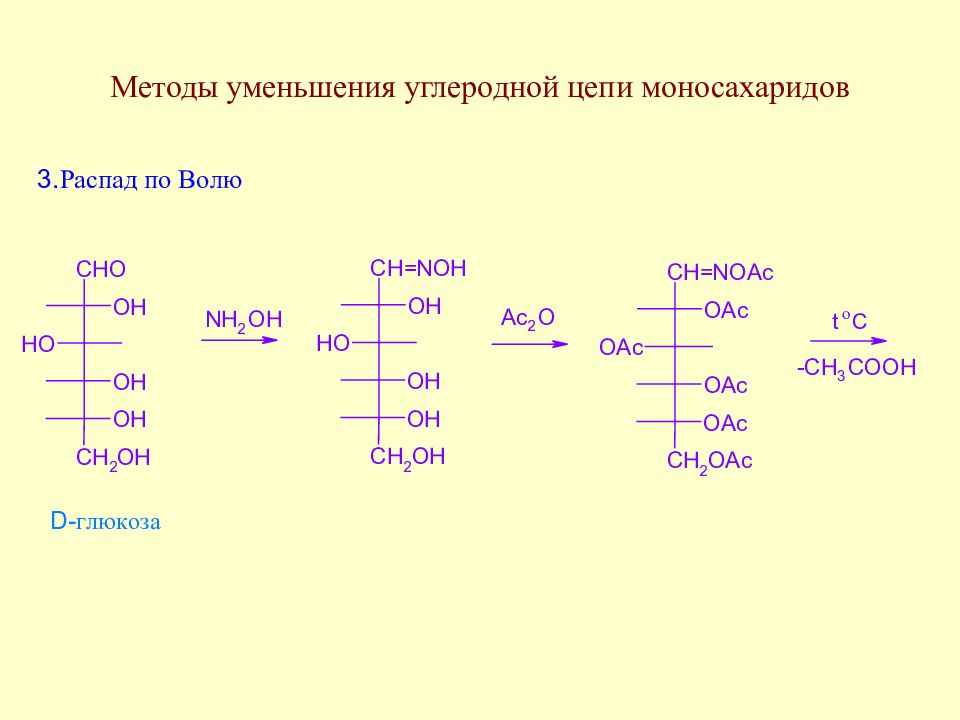
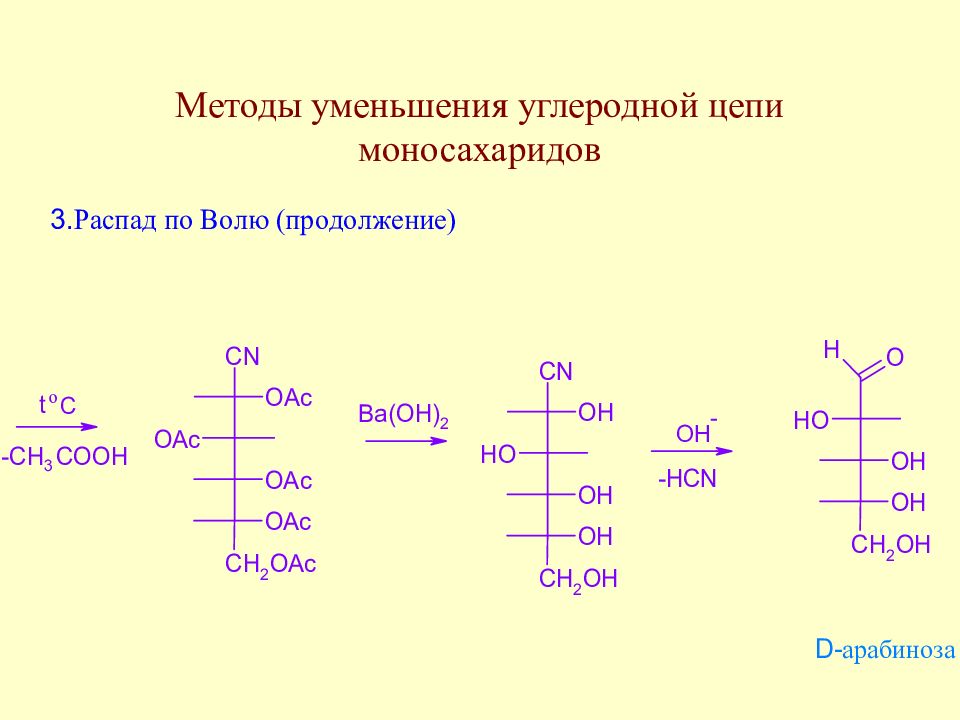
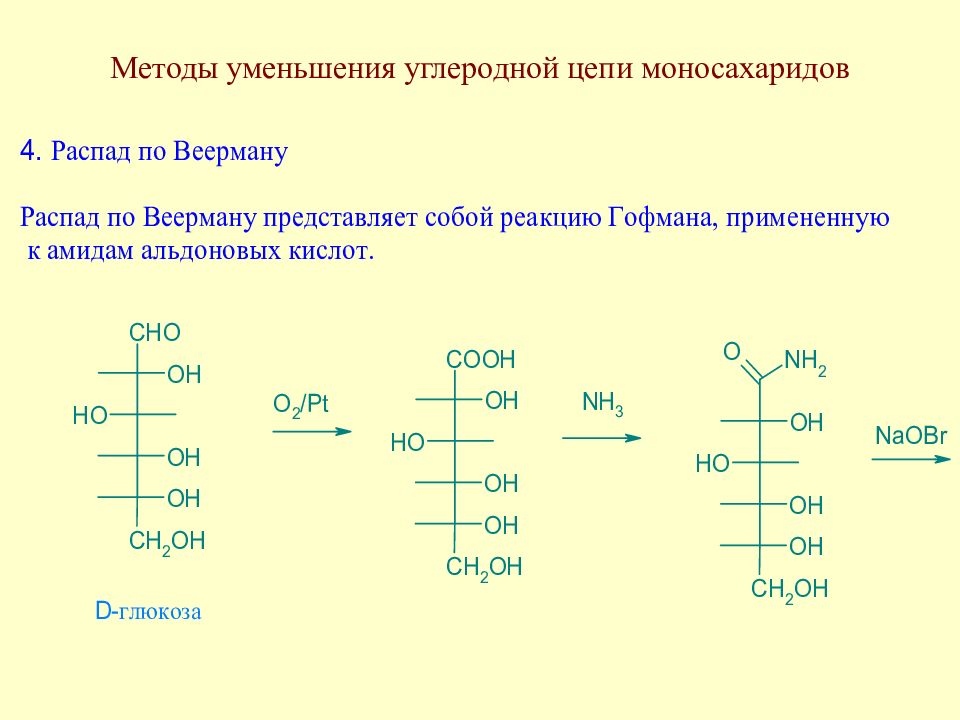
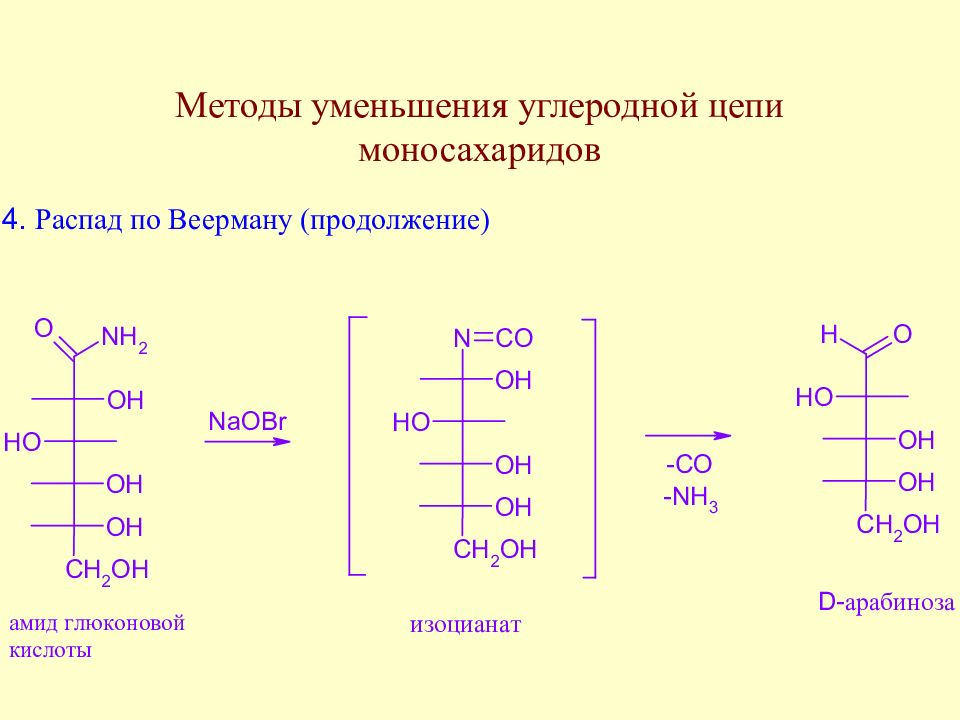
Слайд 76: Лекция 4
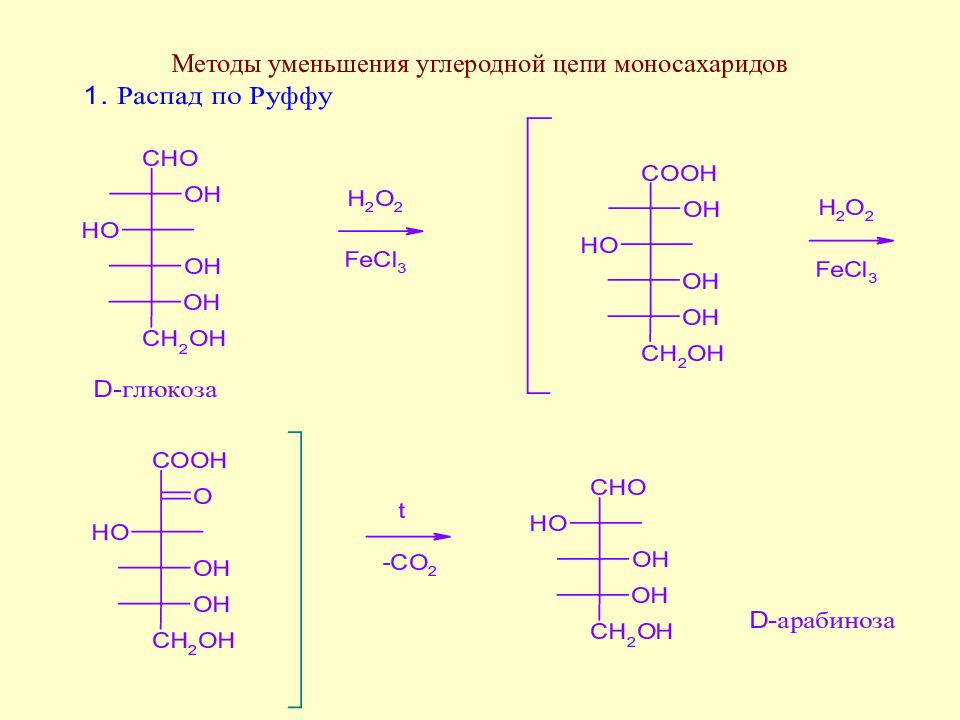
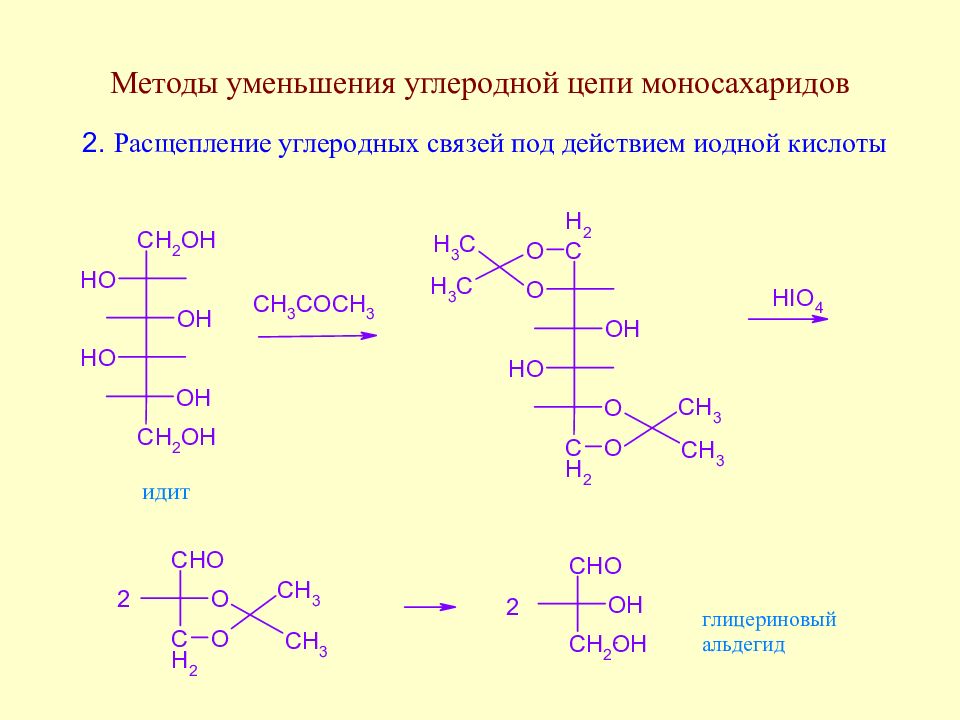
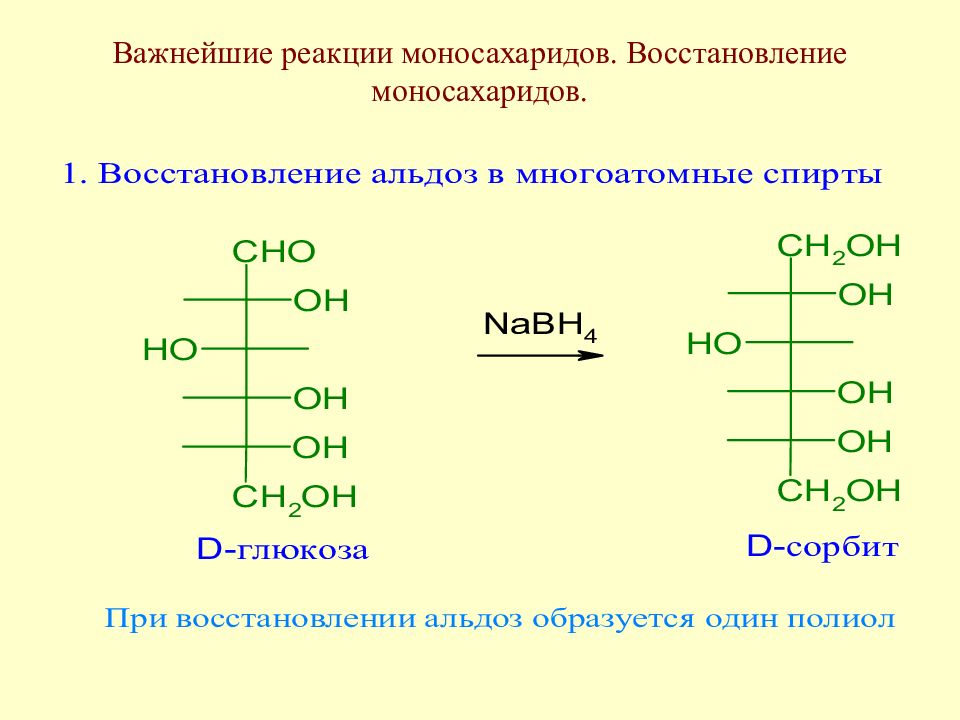
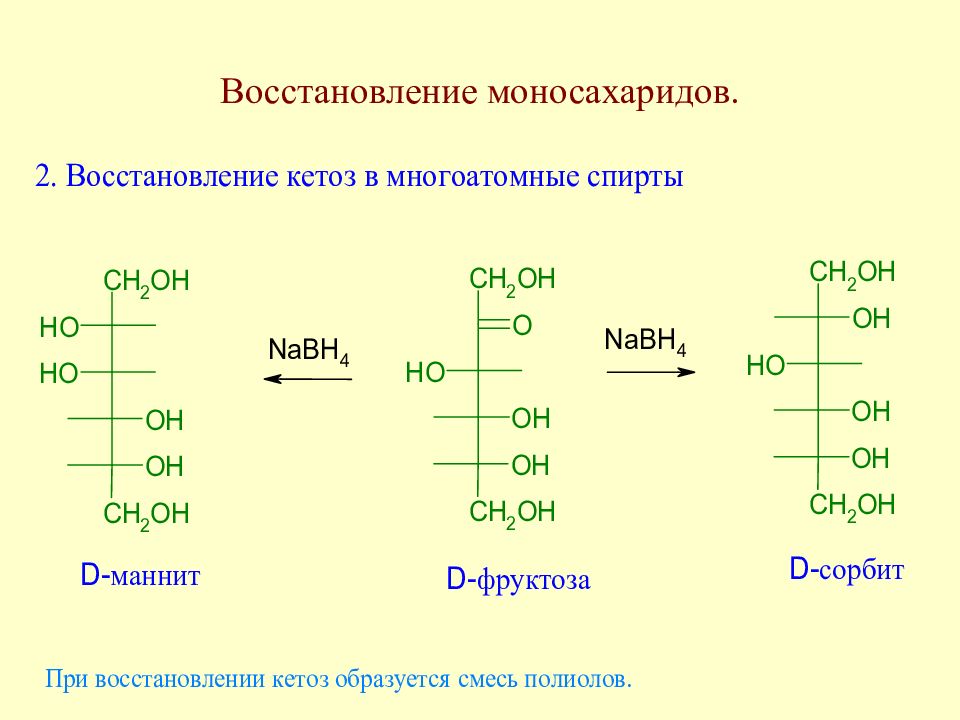
Методы уменьшения углеродной цепи моносахаридов. Важнейшие реакции моносахаридов
Слайд 85: Полиолы
Полиолы широко представлены в природе. В плодах рябины найдены сорбит и идит, в водорослях - маннит, в состав кофермента рибофлавина входит рибит
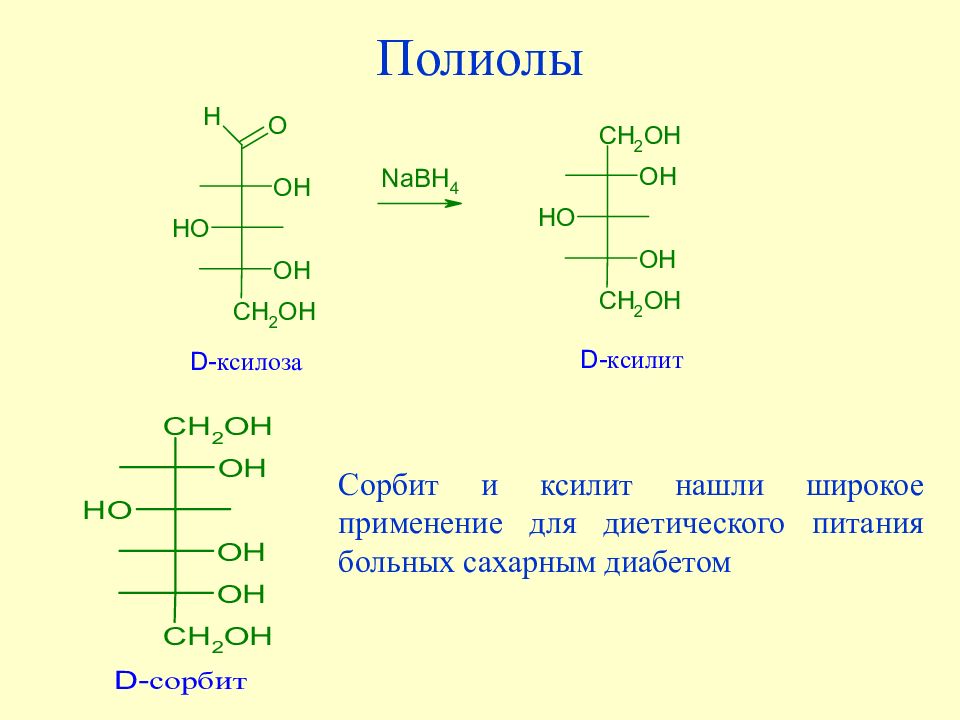
Слайд 86: Полиолы
Сорбит и ксилит нашли широкое применение для диетического питания больных сахарным диабетом
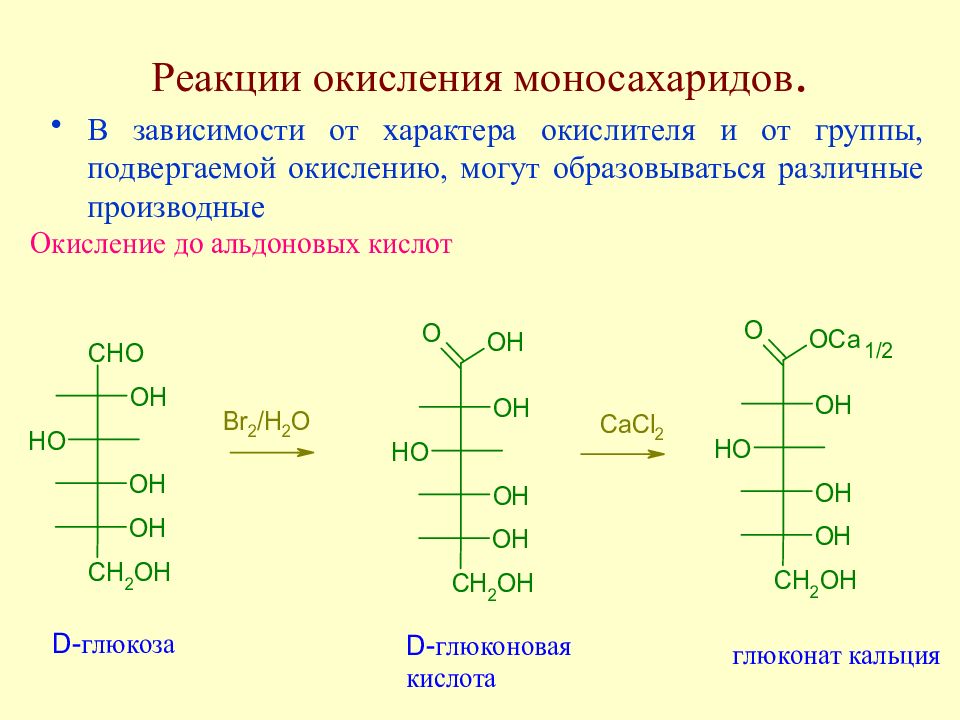
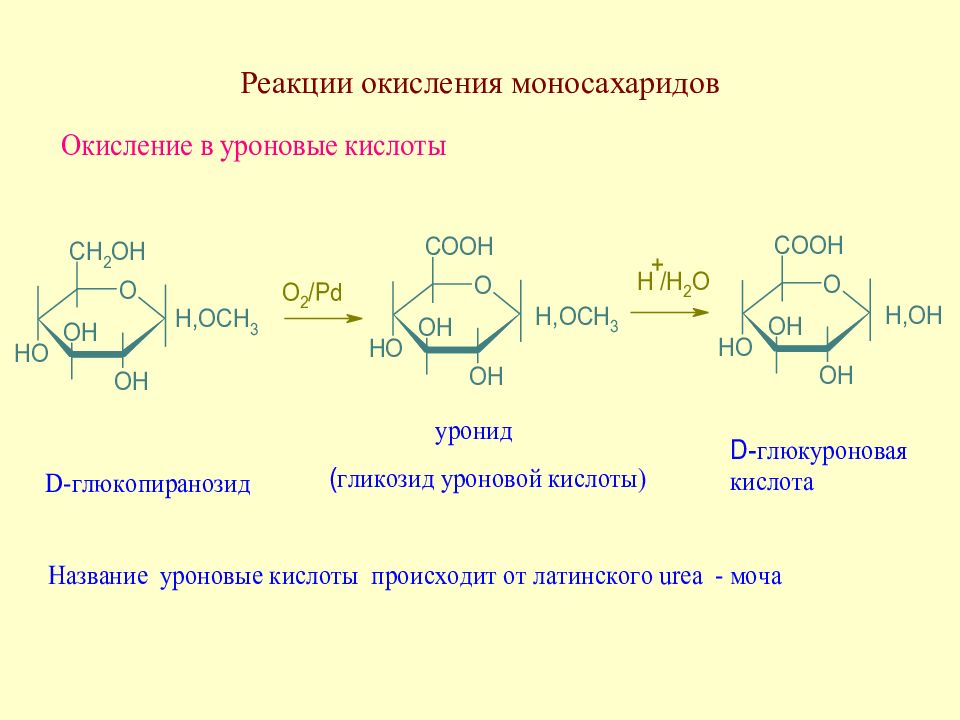
Слайд 87: Реакции окисления моносахаридов
В зависимости от характера окислителя и от группы, подвергаемой окислению, могут образовываться различные производные
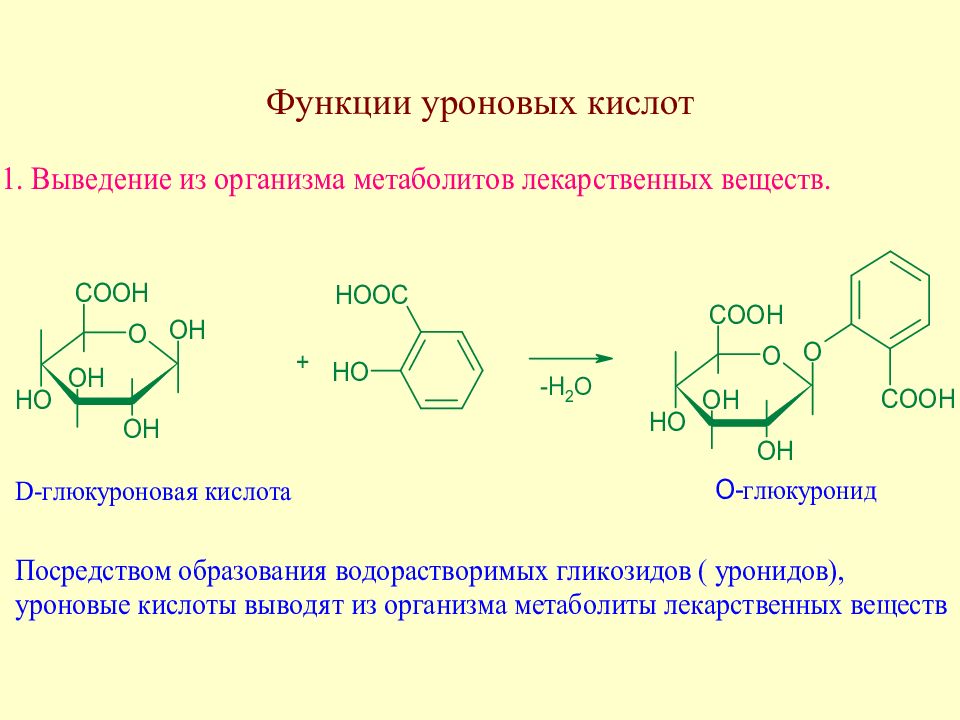
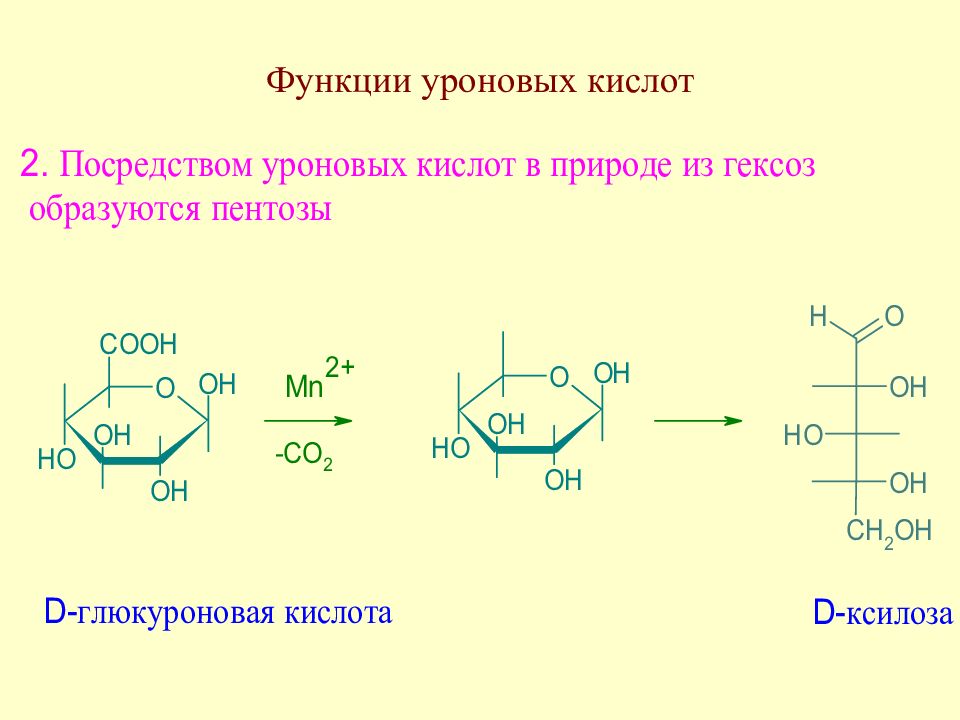
Слайд 89: Уроновые кислоты. Распространение в природе
В небольших коли-чествах уроновые кислоты содержатся в крови и моче человека и животных. Кроме того, уроновые кислоты входят в состав ряда растительных гликозидов (например, тритерпеновых сапо-нинов, выделенных из аралии маньчжурской и некоторых других растений), бакте-риальных гликозидов и мукополисахаридов.
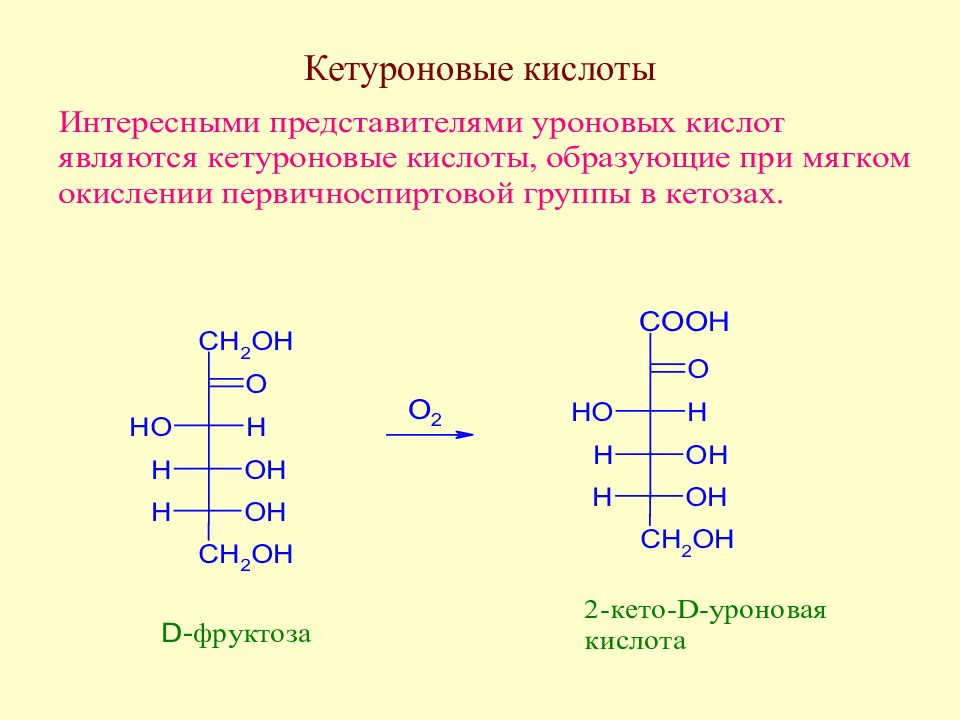
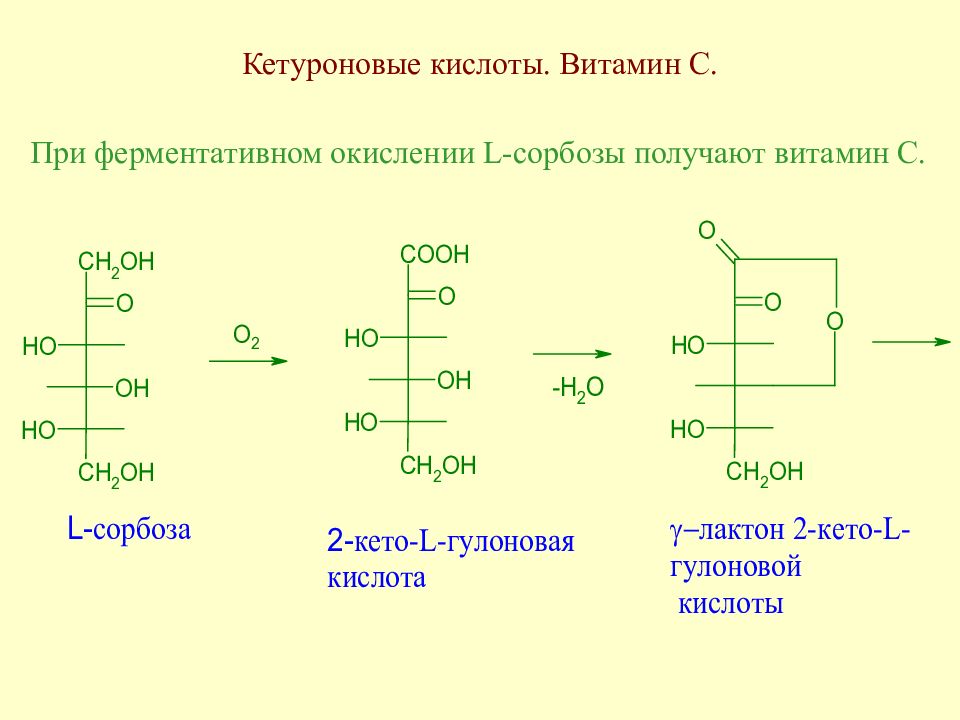
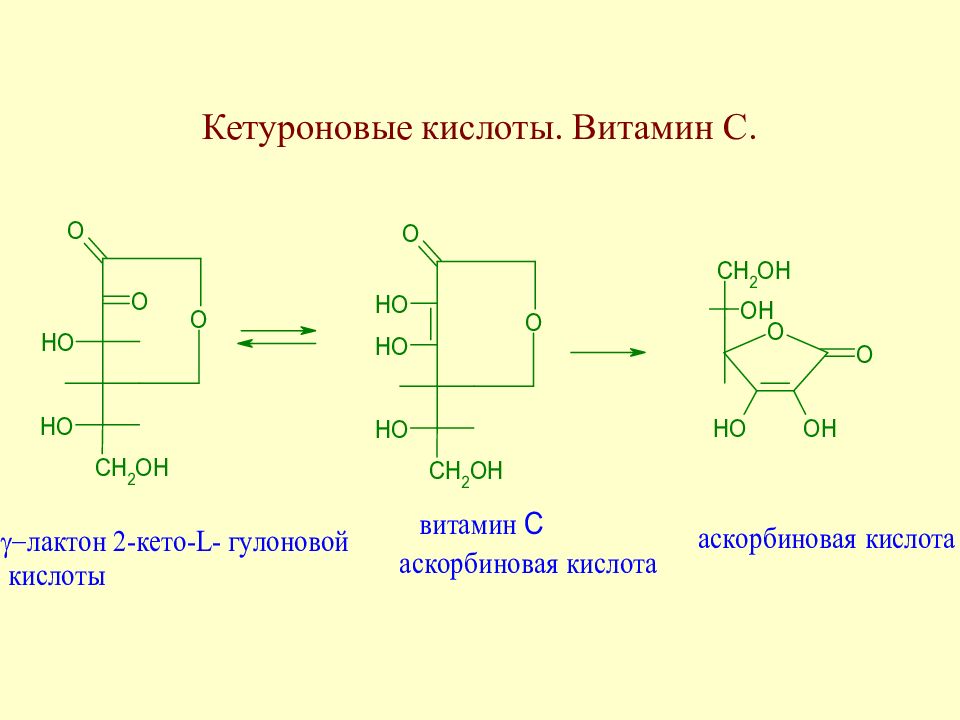
Слайд 93: Кетуроновые кислоты. Витамин С
При ферментативном окислении L -сорбозы получают витамин С.
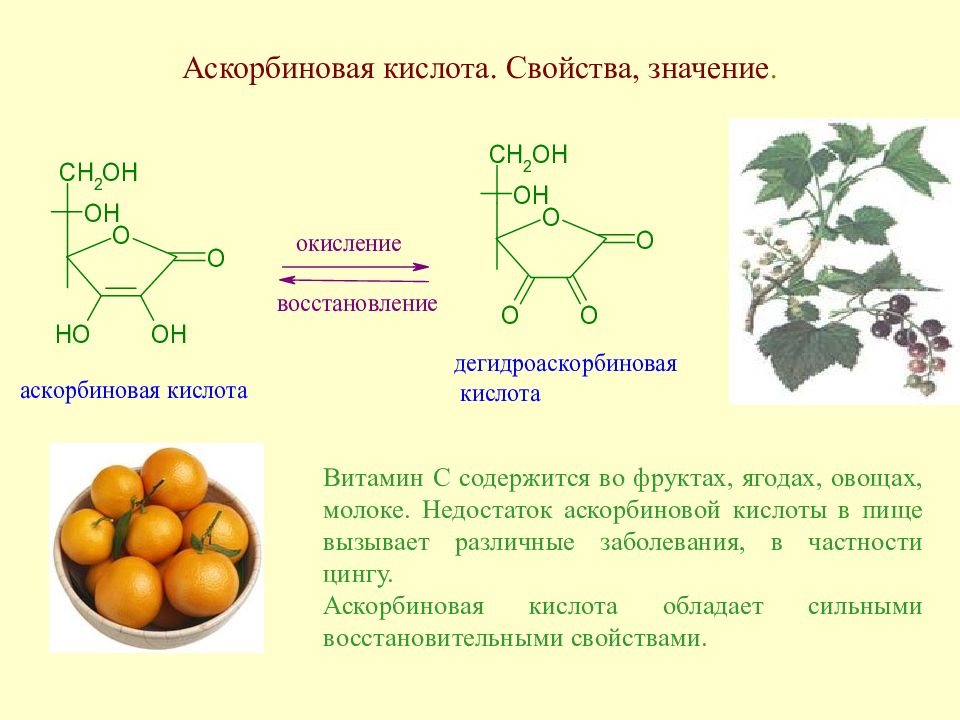
Слайд 95: Аскорбиновая кислота. Свойства, значение
Витамин С содержится во фруктах, ягодах, овощах, молоке. Недостаток аскорбиновой кислоты в пище вызывает различные заболевания, в частности цингу. Аскорбиновая кислота обладает сильными восстановительными свойствами.
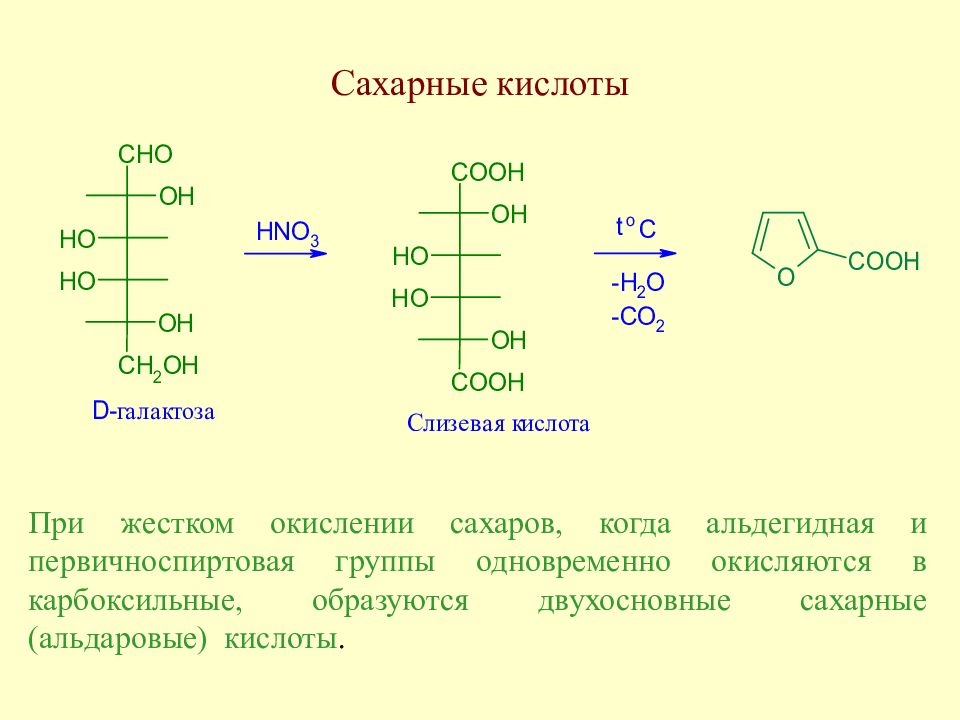
Слайд 96: Сахарные кислоты
При жестком окислении сахаров, когда альдегидная и первичноспиртовая группы одновременно окисляются в карбоксильные, образуются двухосновные сахарные (альдаровые) кислоты.
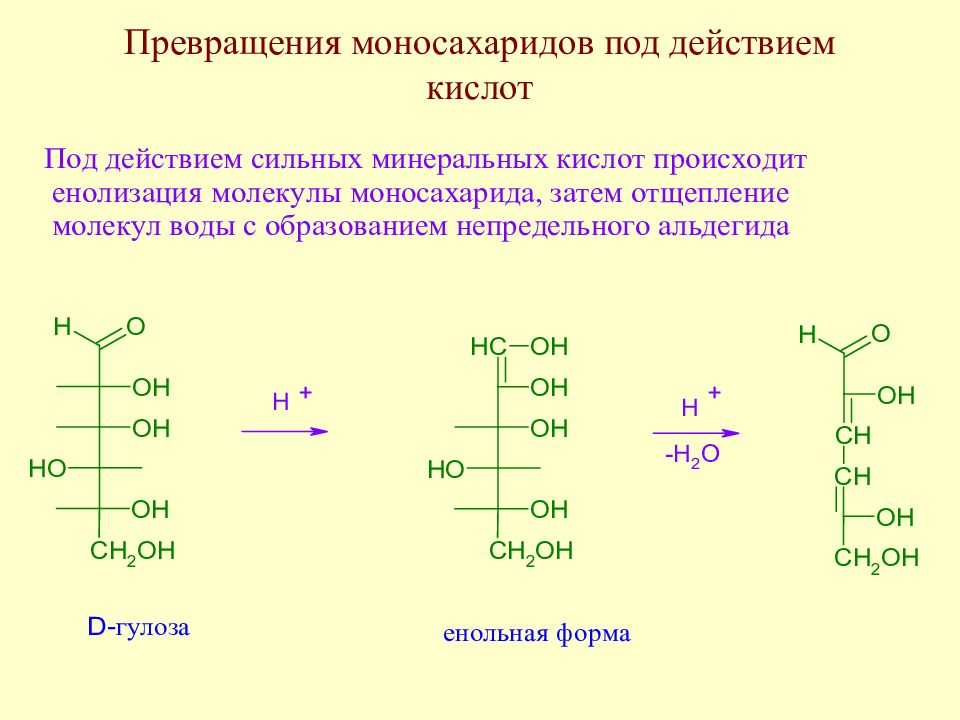
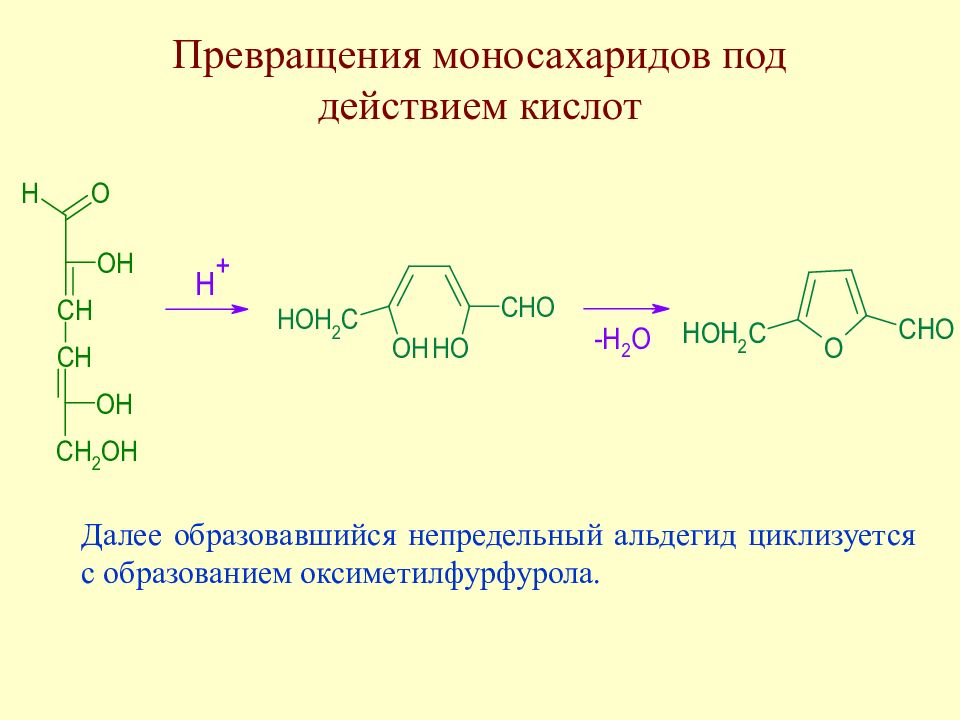
Слайд 98: Превращения моносахаридов под действием кислот
Далее образовавшийся непредельный альдегид циклизуется с образованием оксиметилфурфурола.
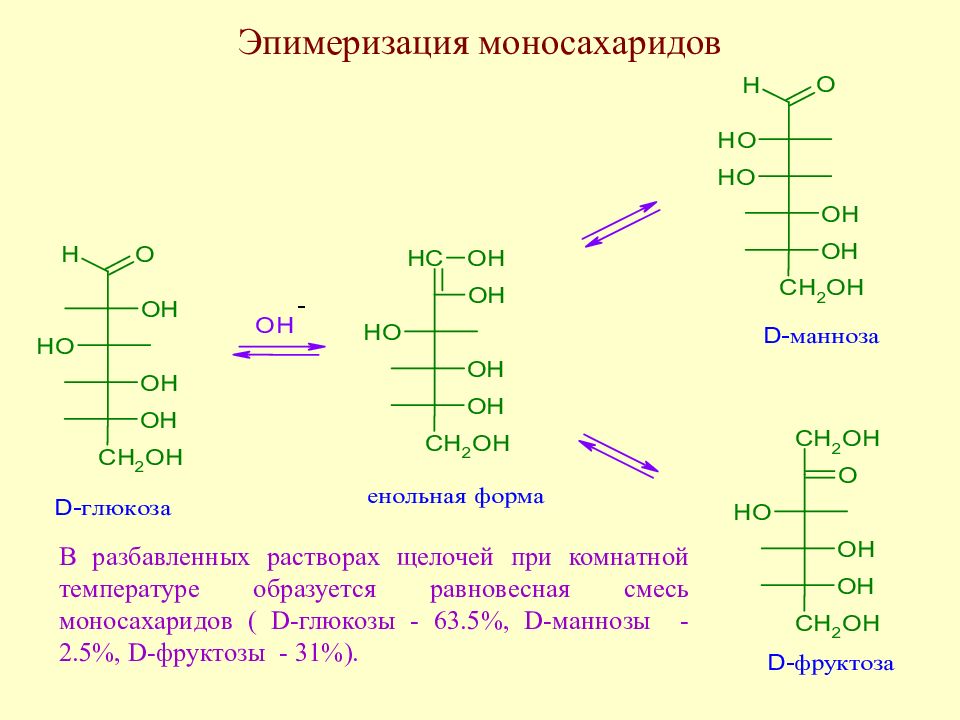
Слайд 99: Эпимеризация моносахаридов
В разбавленных растворах щелочей при комнатной температуре образуется равновесная смесь моносахаридов ( D -глюкозы - 63.5%, D -маннозы - 2.5%, D -фруктозы - 31%).
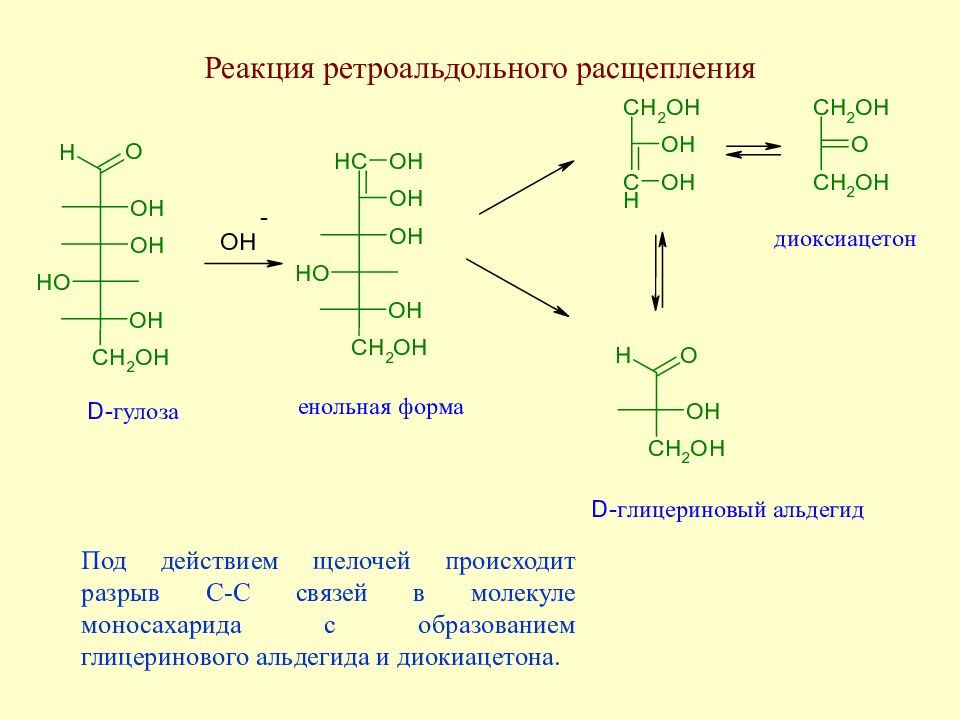
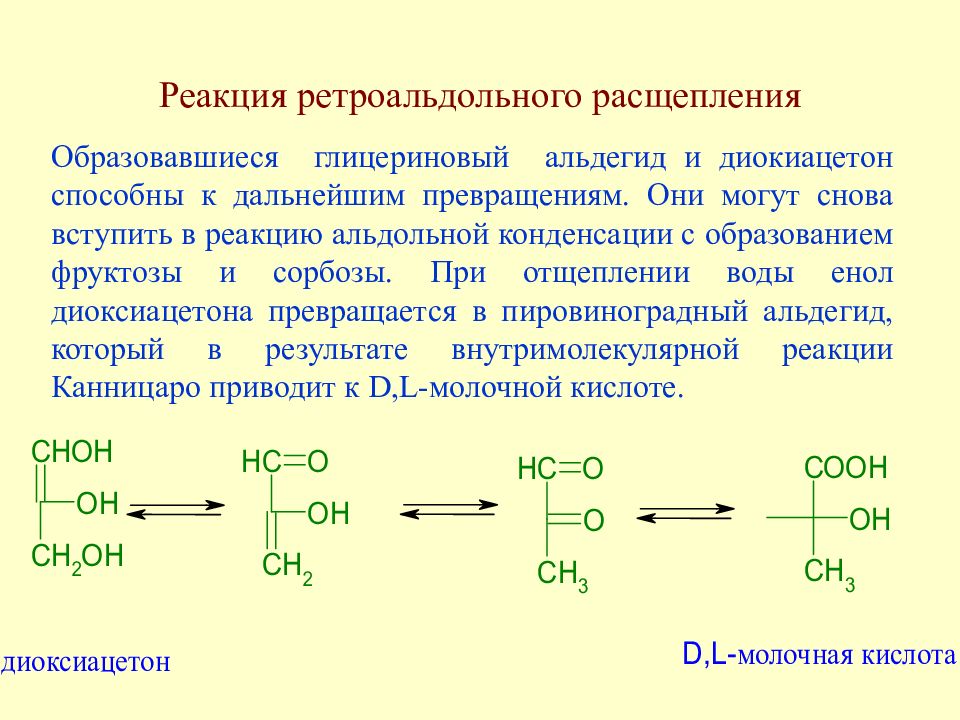
Слайд 100: Реакция ретроальдольного расщепления
Под действием щелочей происходит разрыв С-С связей в молекуле моносахарида с образованием глицеринового альдегида и диокиацетона.
Слайд 101: Реакция ретроальдольного расщепления
Образовавшиеся глицериновый альдегид и диокиацетон способны к дальнейшим превращениям. Они могут снова вступить в реакцию альдольной конденсации с образованием фруктозы и сорбозы. При отщеплении воды енол диоксиацетона превращается в пировиноградный альдегид, который в результате внутримолекулярной реакции Канницаро приводит к D, L -молочной кислоте.
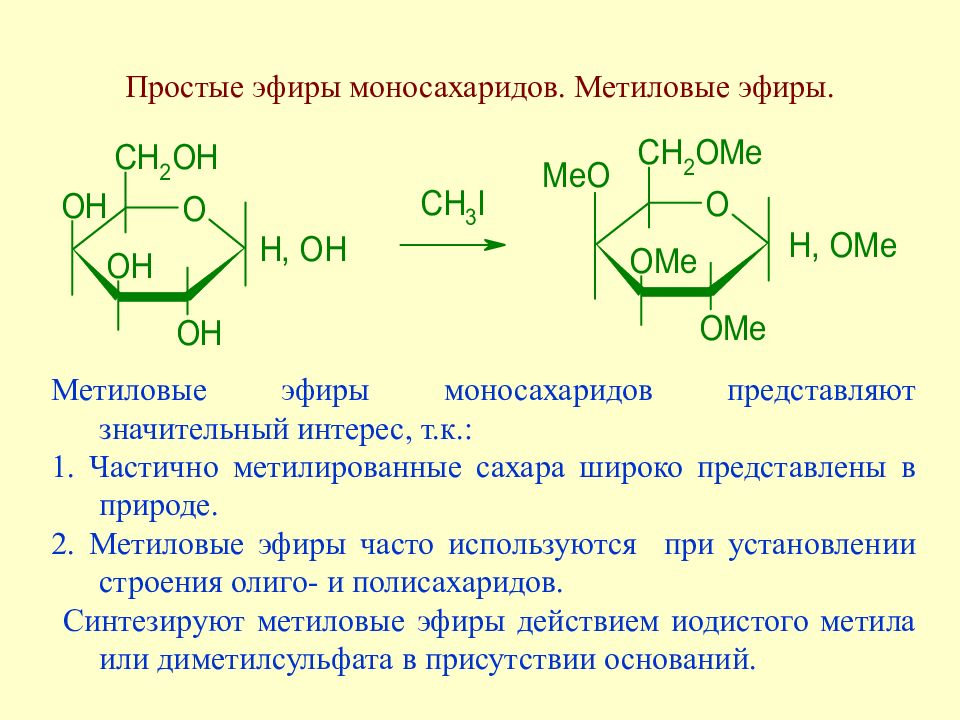
Слайд 103: Простые эфиры моносахаридов. Метиловые эфиры
Метиловые эфиры моносахаридов представляют значительный интерес, т.к.: 1. Частично метилированные сахара широко представлены в природе. 2. Метиловые эфиры часто используются при установлении строения олиго- и полисахаридов. Синтезируют метиловые эфиры действием иодистого метила или диметилсульфата в присутствии оснований.
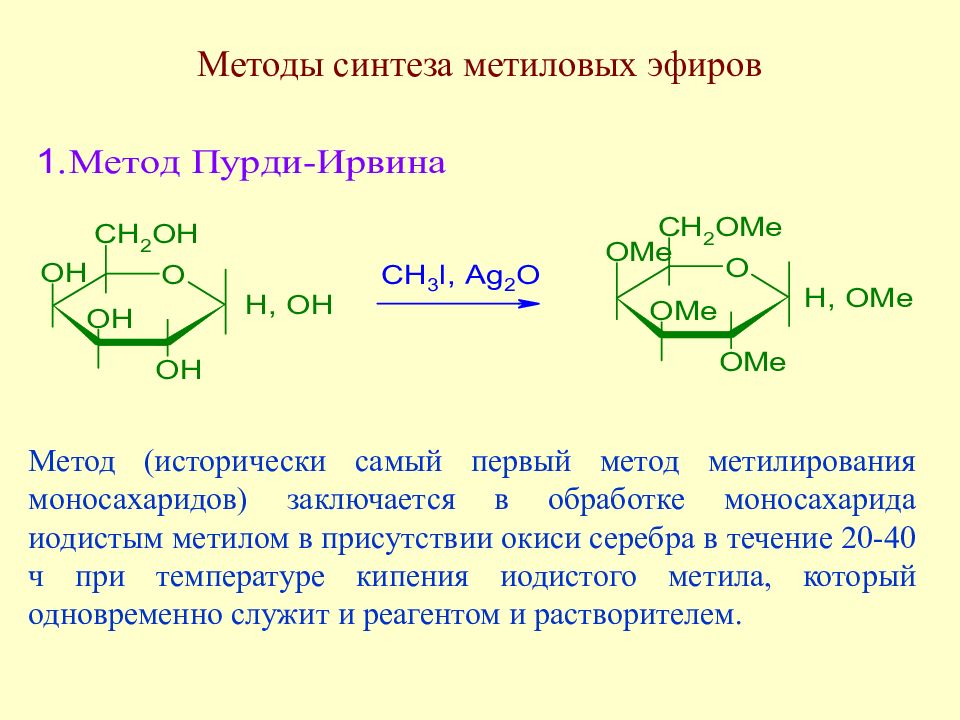
Слайд 104: Методы синтеза метиловых эфиров
Метод (исторически самый первый метод метилирования моносахаридов) заключается в обработке моносахарида иодистым метилом в присутствии окиси серебра в течение 20-40 ч при температуре кипения иодистого метила, который одновременно служит и реагентом и растворителем.
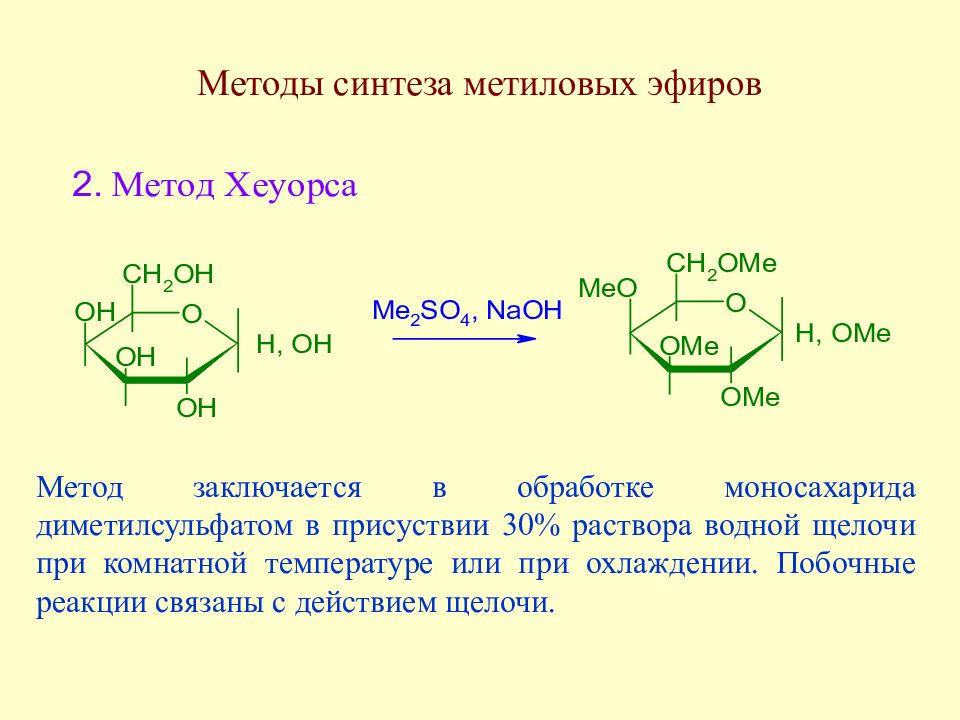
Слайд 105: Методы синтеза метиловых эфиров
Метод заключается в обработке моносахарида диметилсульфатом в присуствии 30% раствора водной щелочи при комнатной температуре или при охлаждении. Побочные реакции связаны с действием щелочи.
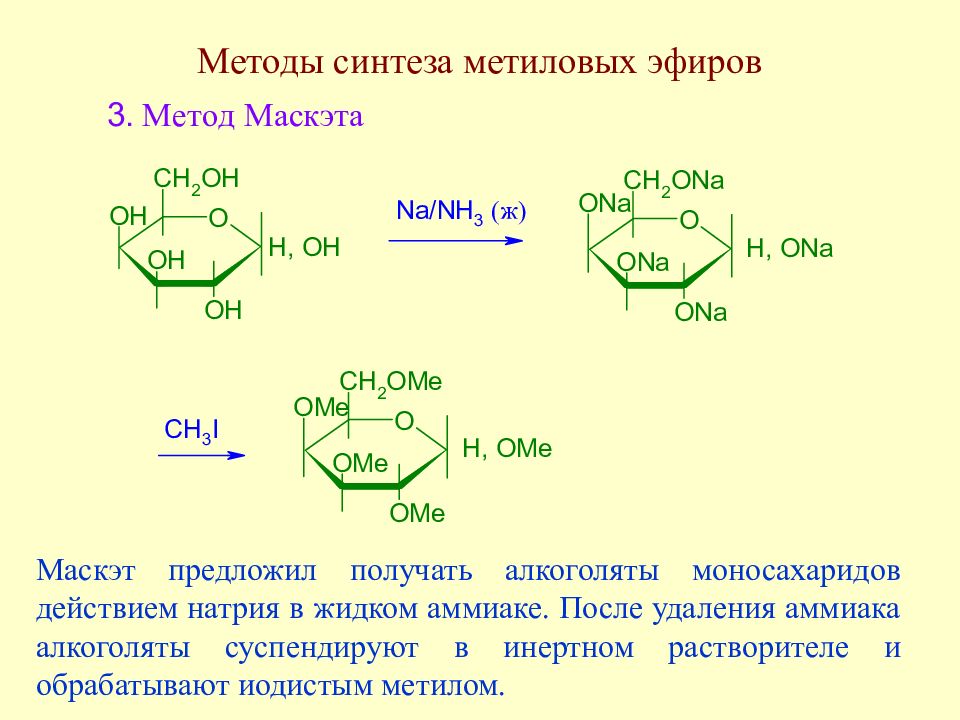
Слайд 106: Методы синтеза метиловых эфиров
Маскэт предложил получать алкоголяты моносахаридов действием натрия в жидком аммиаке. После удаления аммиака алкоголяты суспендируют в инертном растворителе и обрабатывают иодистым метилом.
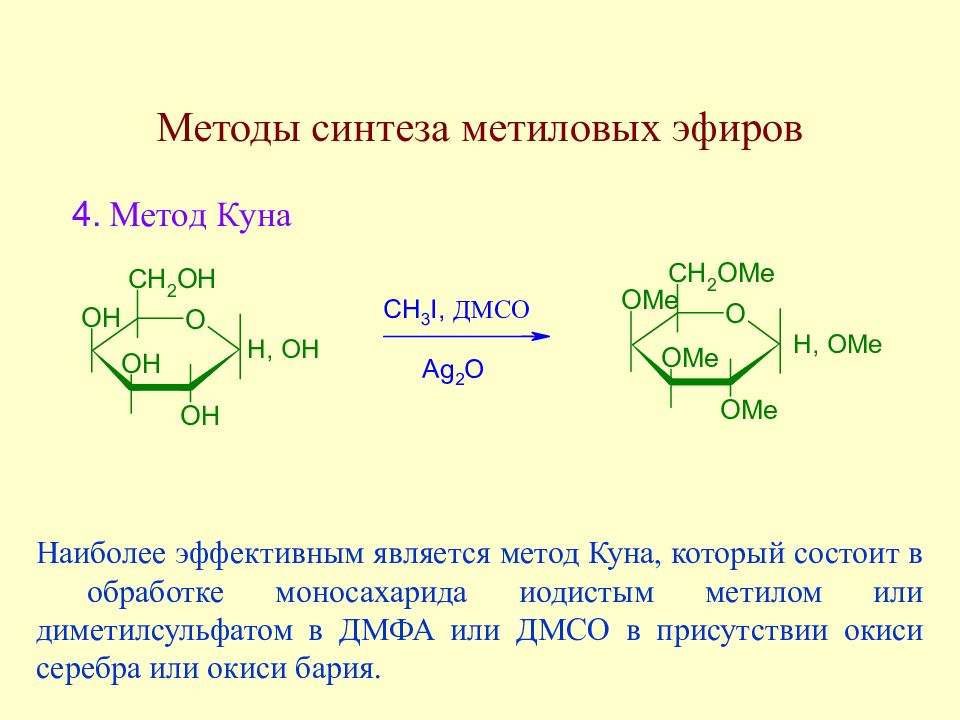
Слайд 107: Методы синтеза метиловых эфиров
Наиболее эффективным является метод Куна, который состоит в обработке моносахарида иодистым метилом или диметилсульфатом в ДМФА или ДМСО в присутствии окиси серебра или окиси бария.
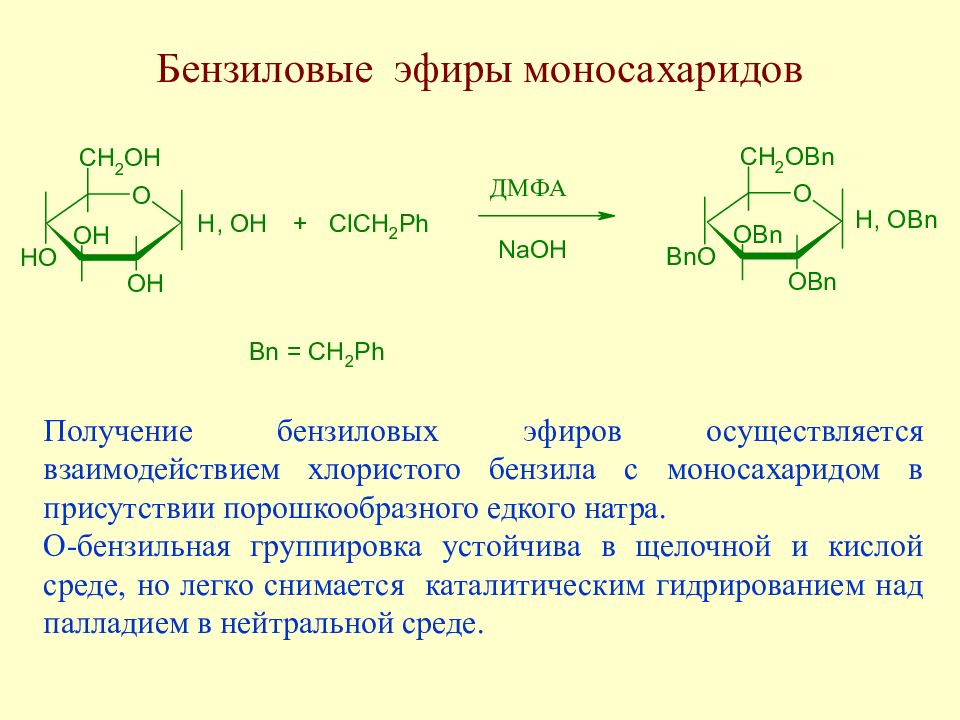
Слайд 108: Бензиловые эфиры моносахаридов
Получение бензиловых эфиров осуществляется взаимодействием хлористого бензила с моносахаридом в присутствии порошкообразного едкого натра. О-бензильная группировка устойчива в щелочной и кислой среде, но легко снимается каталитическим гидрированием над палладием в нейтральной среде.
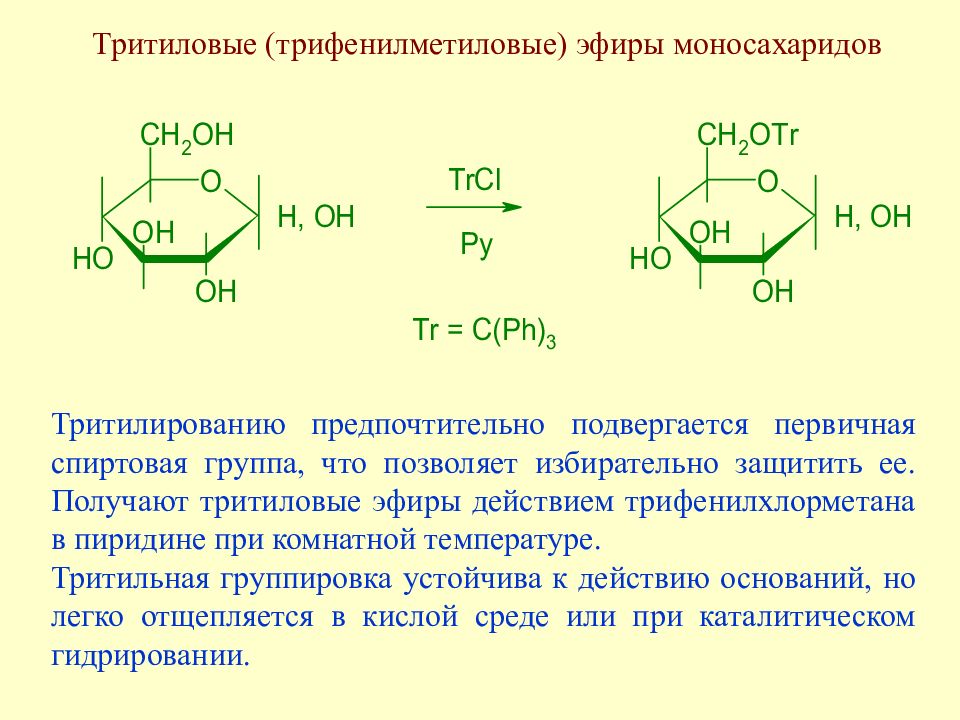
Слайд 109: Тритиловые (трифенилметиловые) эфиры моносахаридов
Тритилированию предпочтительно подвергается первичная спиртовая группа, что позволяет избирательно защитить ее. Получают тритиловые эфиры действием трифенилхлорметана в пиридине при комнатной температуре. Тритильная группировка устойчива к действию оснований, но легко отщепляется в кислой среде или при каталитическом гидрировании.
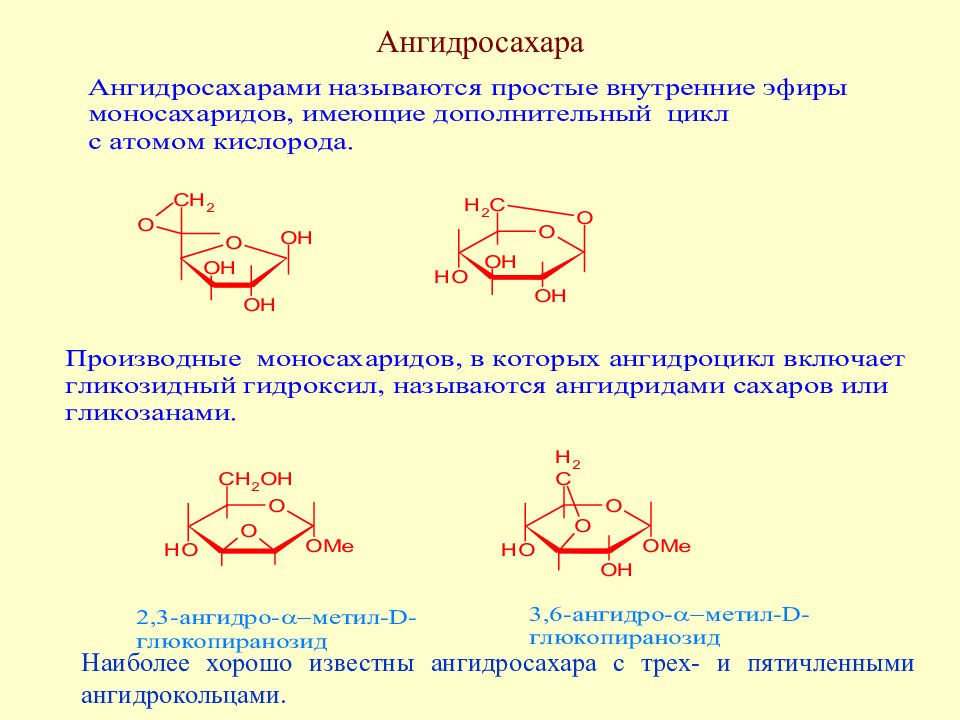
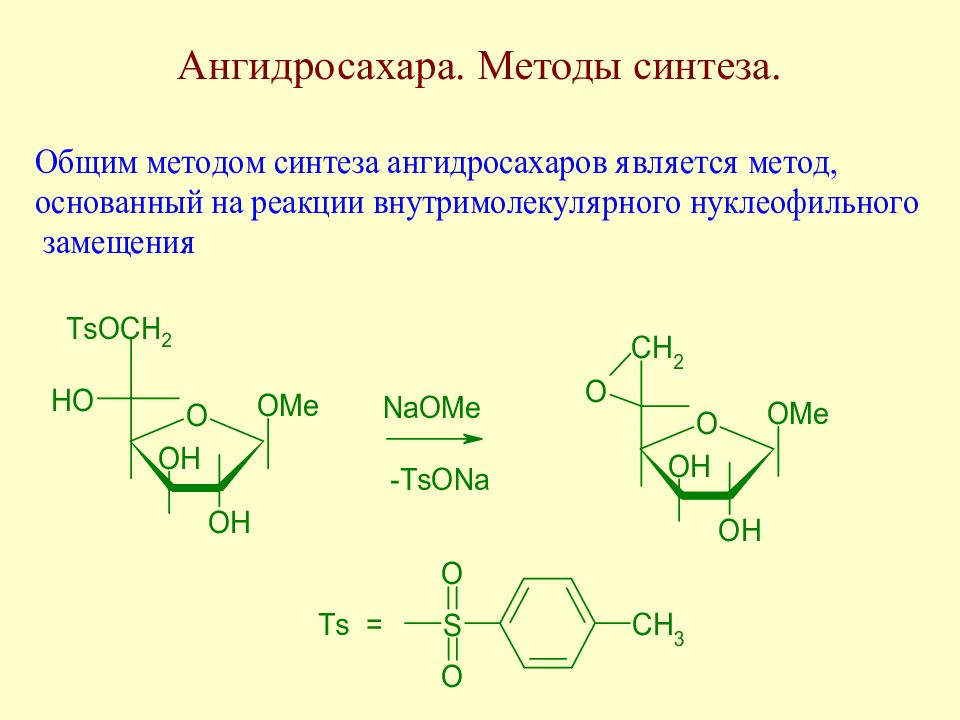
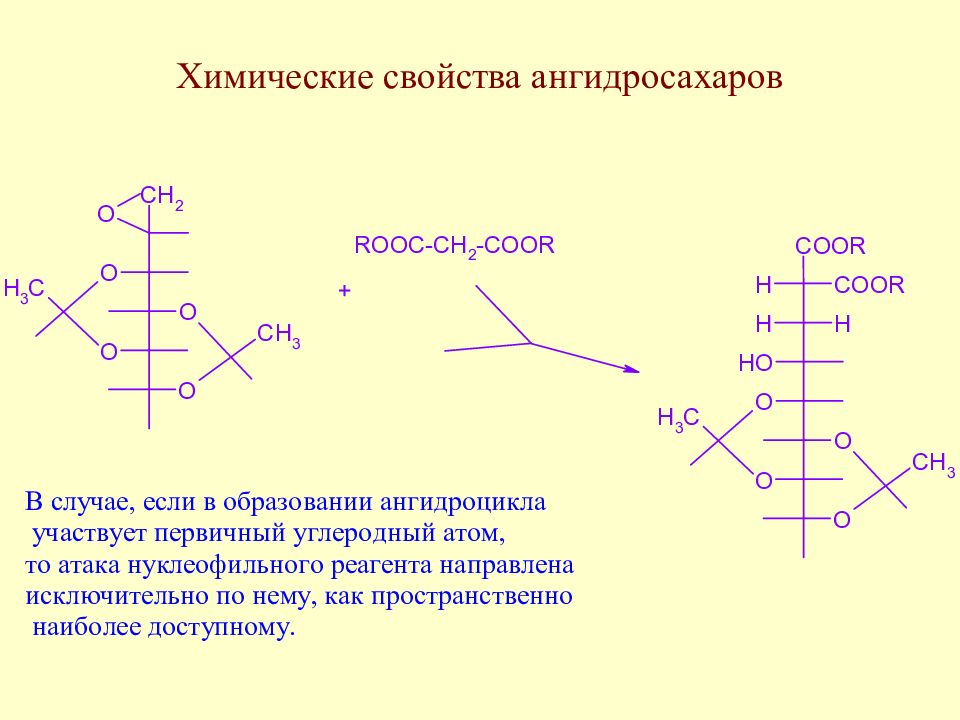
Слайд 110: Ангидросахара
Наиболее хорошо известны ангидросахара с трех- и пятичленными ангидрокольцами.
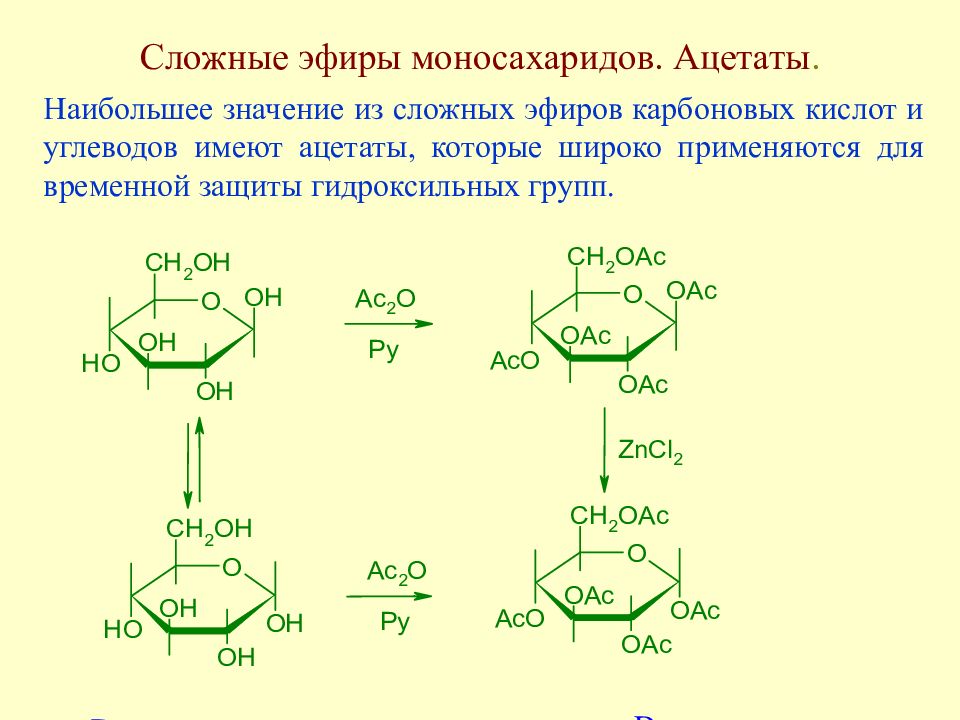
Слайд 116: Сложные эфиры моносахаридов. Ацетаты
Наибольшее значение из сложных эфиров карбоновых кислот и углеводов имеют ацетаты, которые широко применяются для временной защиты гидроксильных групп.
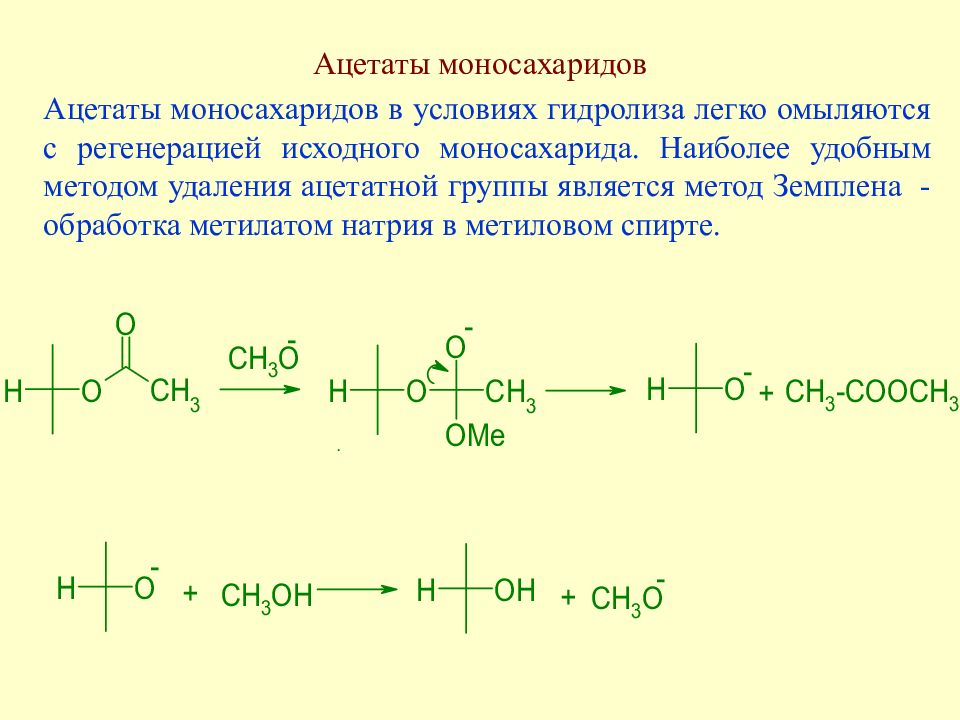
Слайд 117: Ацетаты моносахаридов
Ацетаты моносахаридов в условиях гидролиза легко омыляются с регенерацией исходного моносахарида. Наиболее удобным методом удаления ацетатной группы является метод Земплена - обработка метилатом натрия в метиловом спирте.
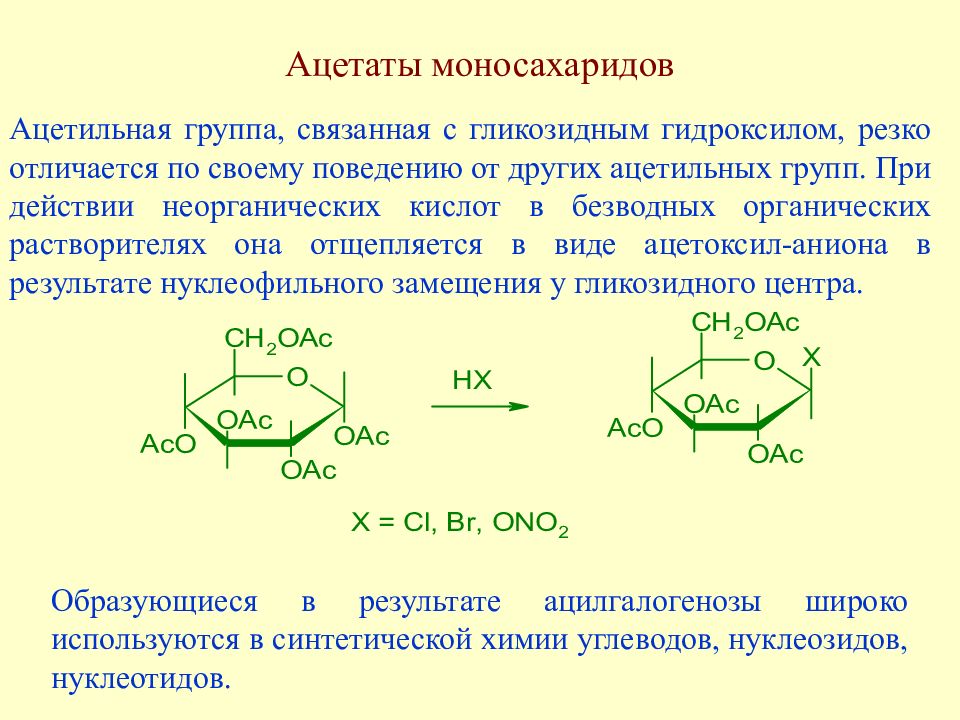
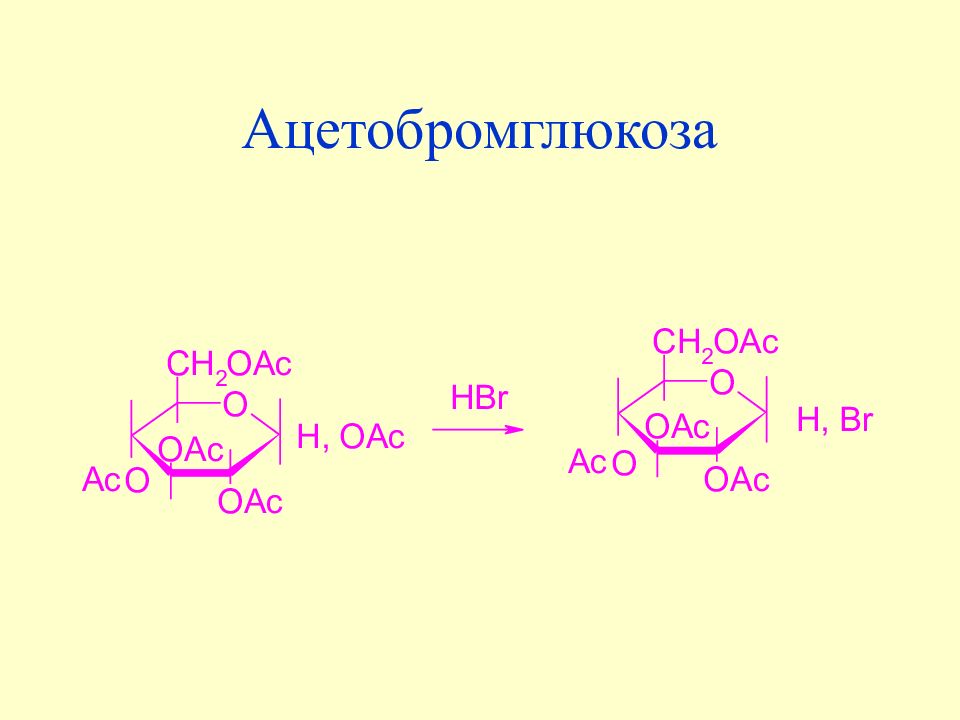
Слайд 118: Ацетаты моносахаридов
Ацетильная группа, связанная с гликозидным гидроксилом, резко отличается по своему поведению от других ацетильных групп. При действии неорганических кислот в безводных органических растворителях она отщепляется в виде ацетоксил-аниона в результате нуклеофильного замещения у гликозидного центра. Образующиеся в результате ацилгалогенозы широко используются в синтетической химии углеводов, нуклеозидов, нуклеотидов.
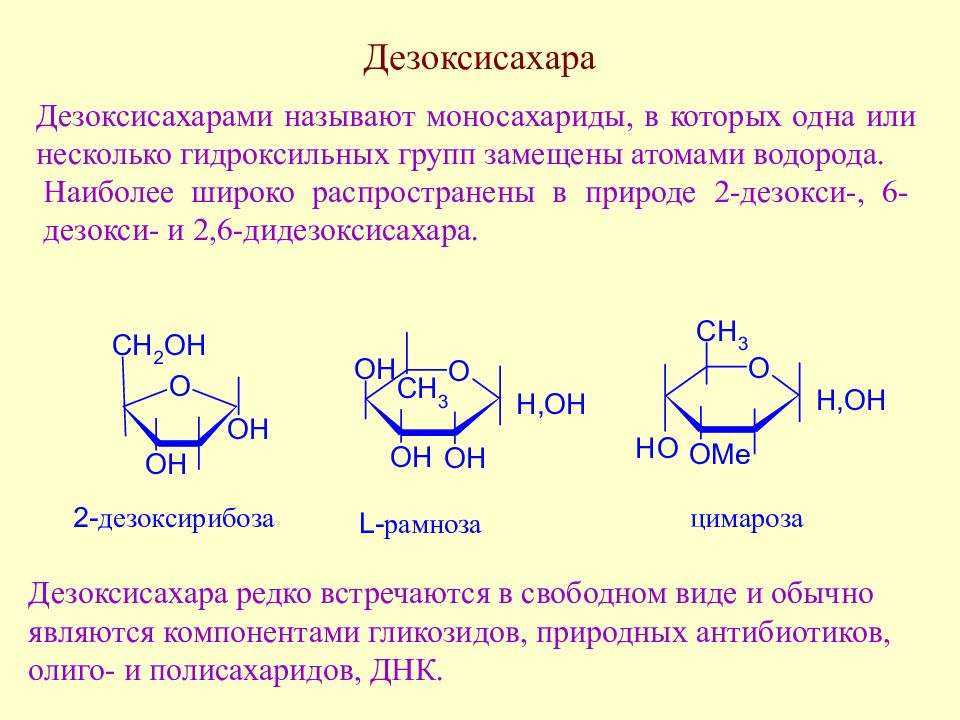
Слайд 120: Дезоксисахара
Дезоксисахарами называют моносахариды, в которых одна или несколько гидроксильных групп замещены атомами водорода. Наиболее широко распространены в природе 2-дезокси-, 6-дезокси- и 2,6-дидезоксисахара. Дезоксисахара редко встречаются в свободном виде и обычно являются компонентами гликозидов, природных антибиотиков, олиго- и полисахаридов, ДНК.
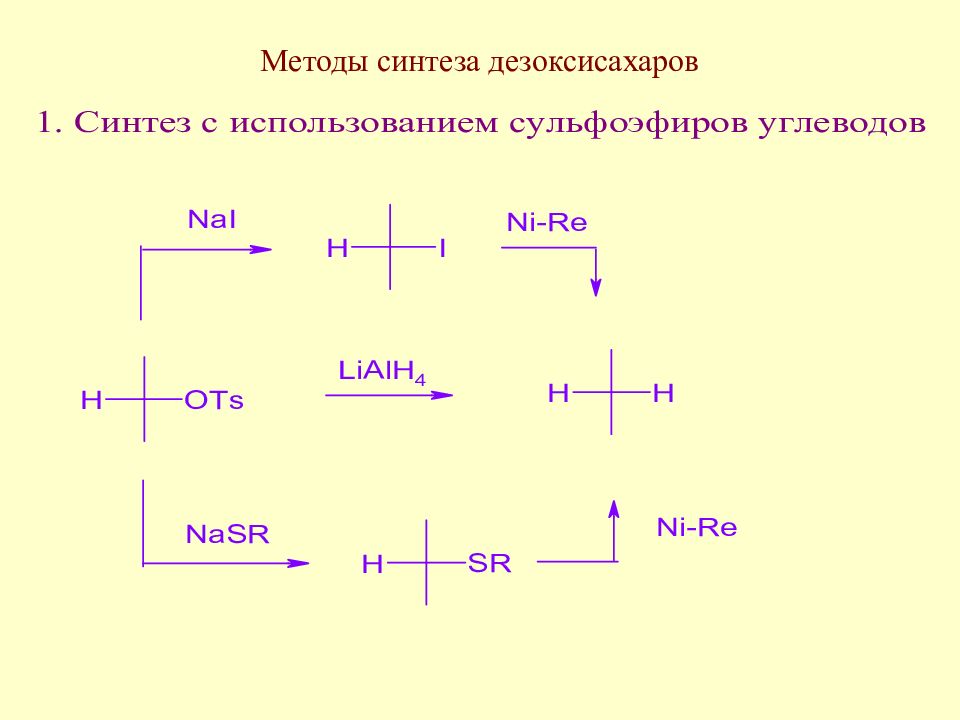
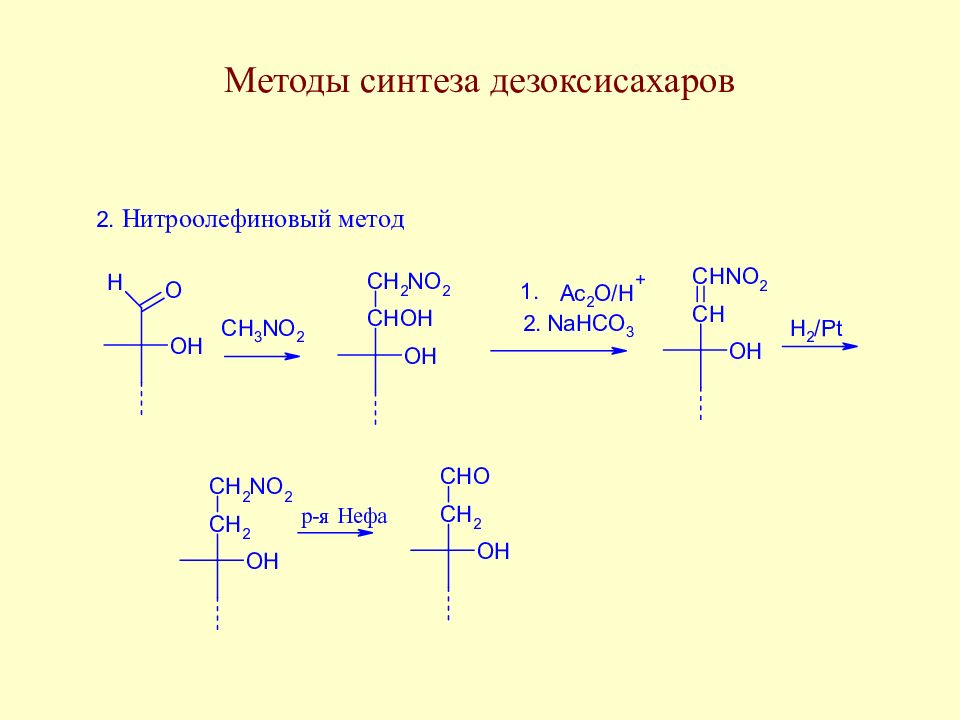
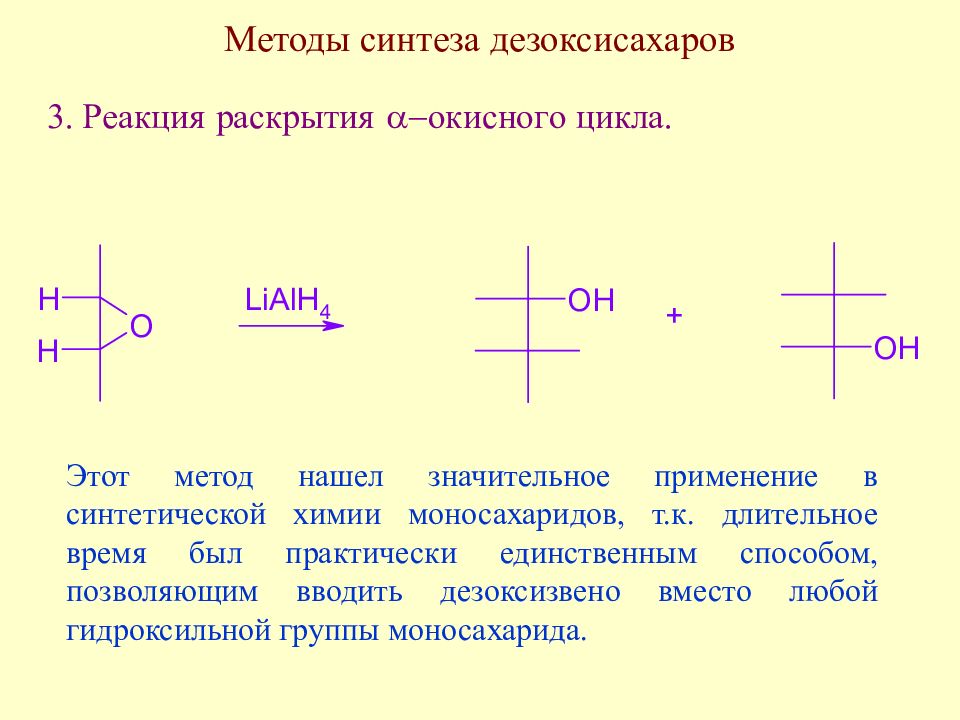
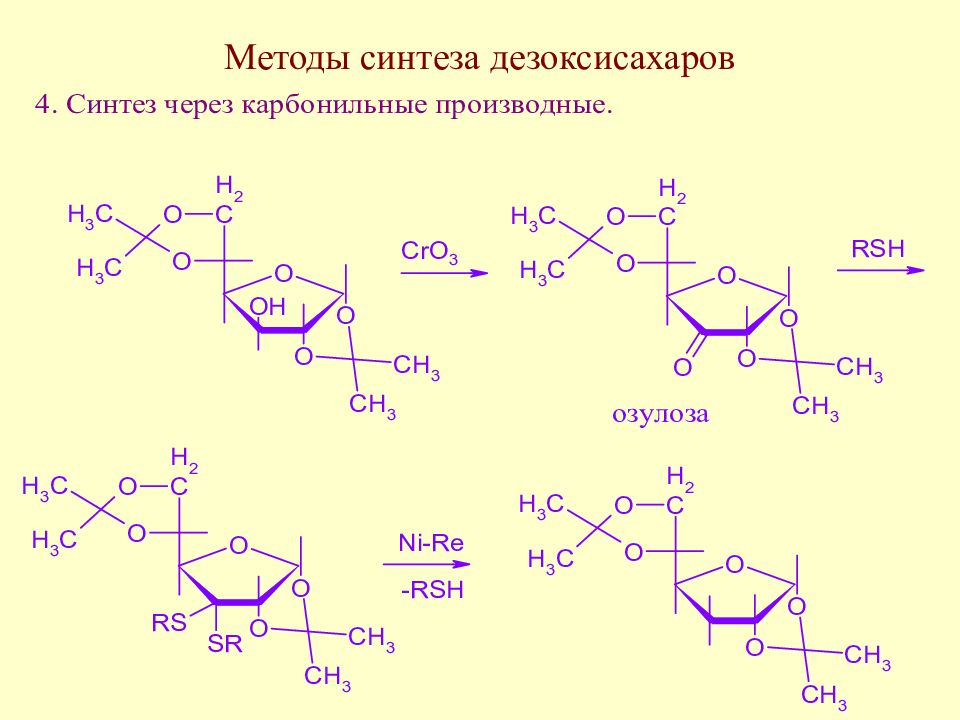
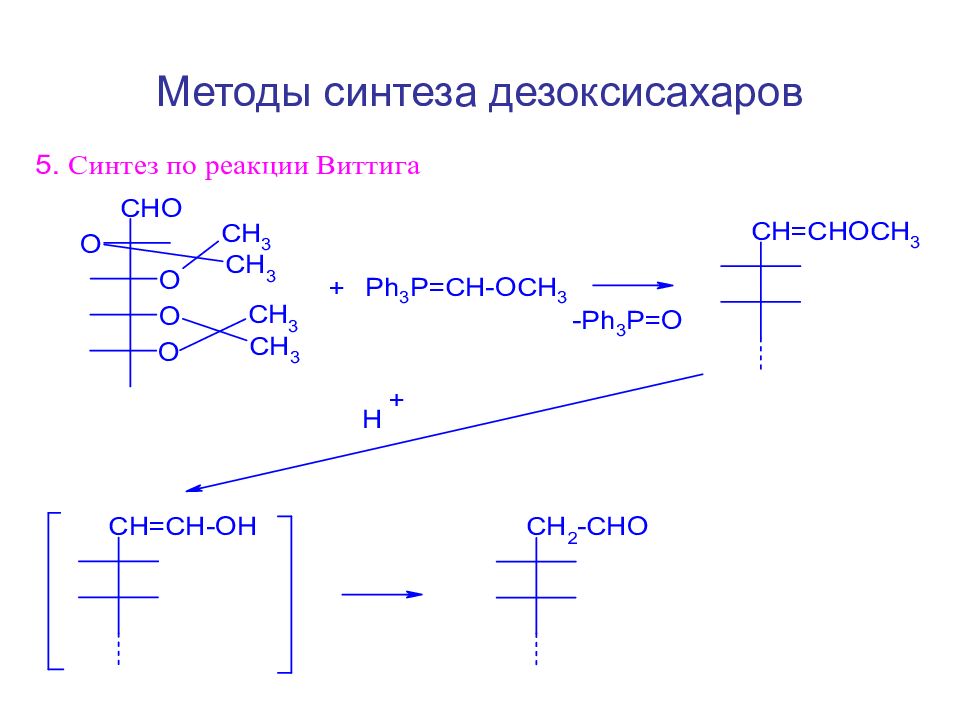
Слайд 123: Методы синтеза дезоксисахаров
Этот метод нашел значительное применение в синтетической химии моносахаридов, т.к. длительное время был практически единственным способом, позволяющим вводить дезоксизвено вместо любой гидроксильной группы моносахарида.
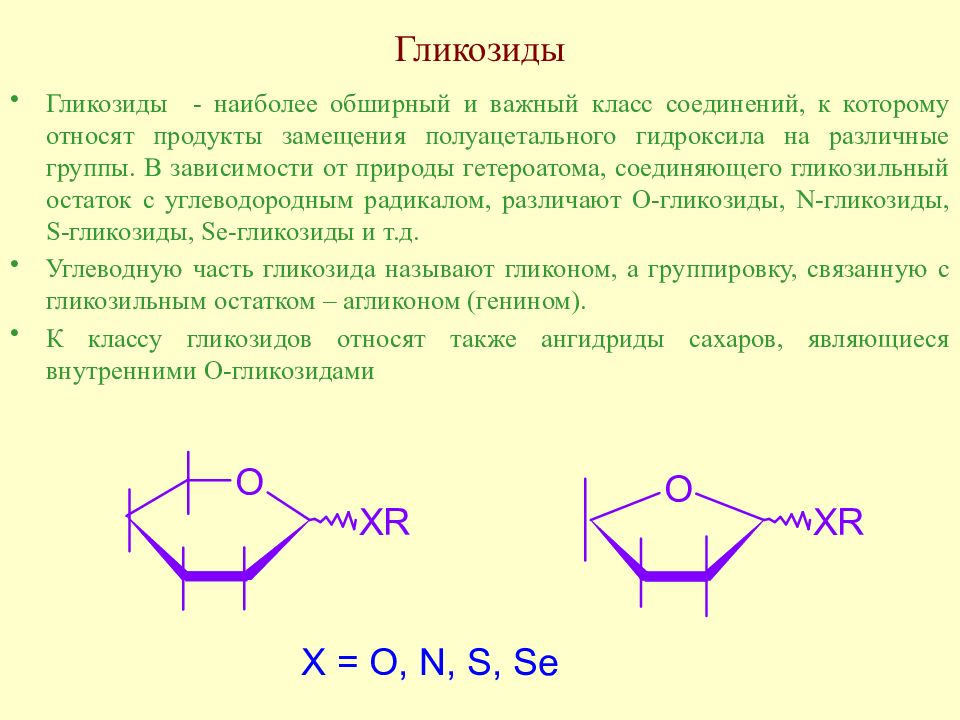
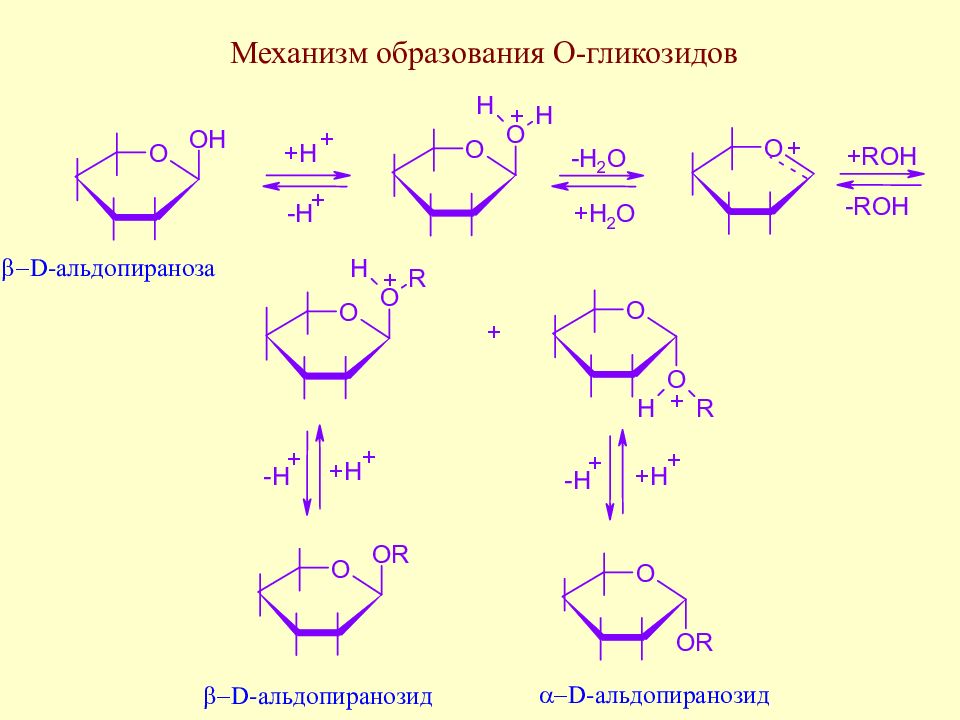
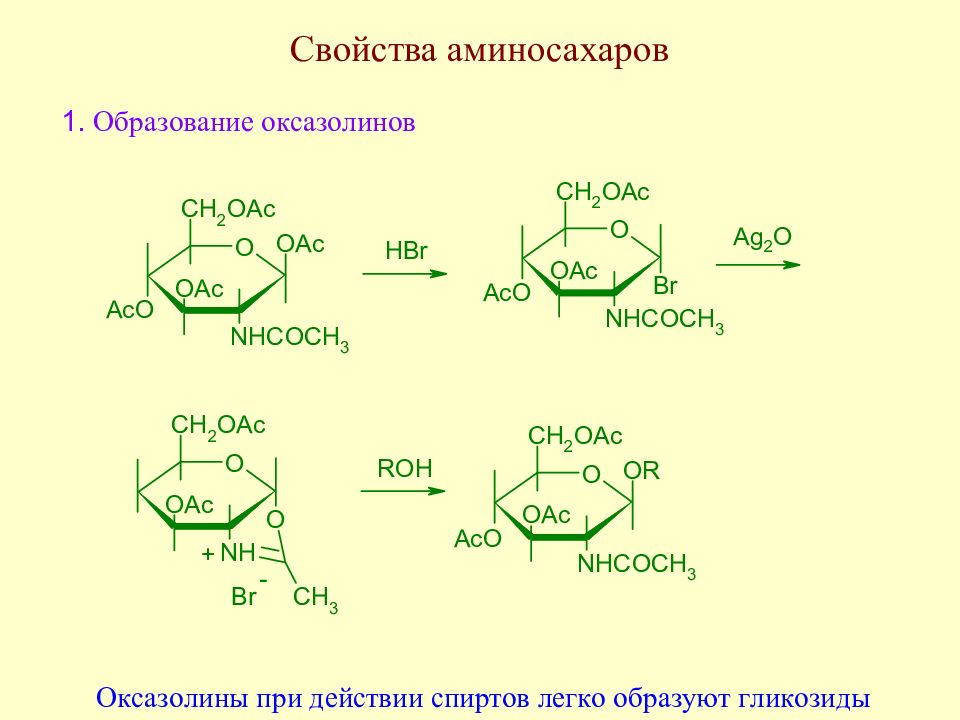
Слайд 126: Гликозиды
Гликозиды - наиболее обширный и важный класс соединений, к которому относят продукты замещения полуацетального гидроксила на различные группы. В зависимости от природы гетероатома, соединяющего гликозильный остаток с углеводородным радикалом, различают О-гликозиды, N- гликозиды, S- гликозиды, Se- гликозиды и т.д. Углеводную часть гликозида называют гликоном, а группировку, связанную с гликозильным остатком – агликоном (генином). К классу гликозидов относят также ангидриды сахаров, являющиеся внутренними О-гликозидами
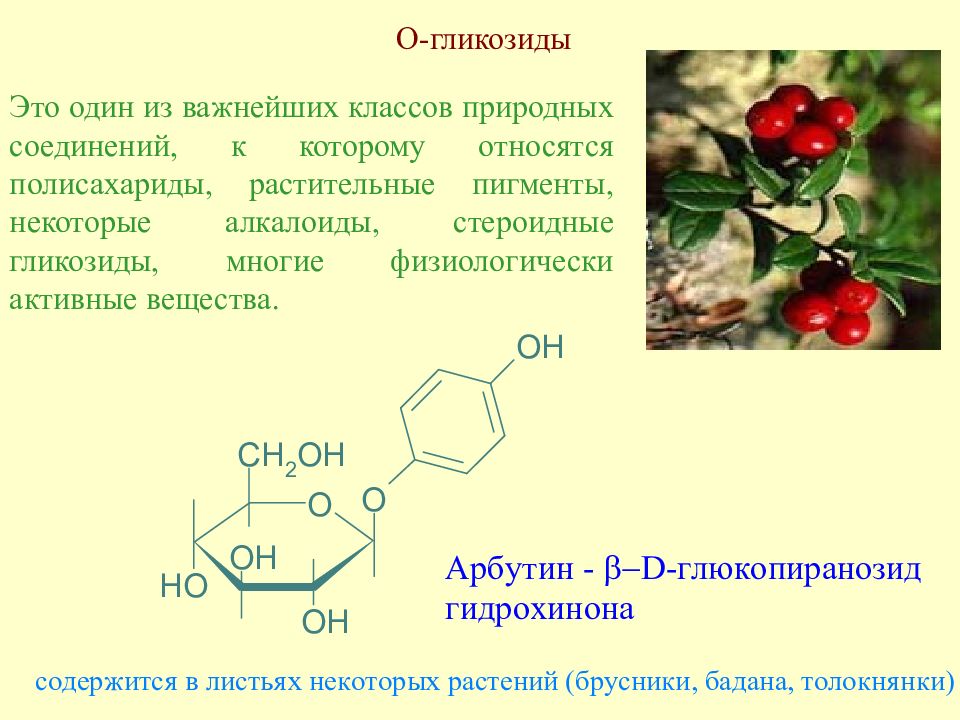
Слайд 127: О-гликозиды
Это один из важнейших классов природных соединений, к которому относятся полисахариды, растительные пигменты, некоторые алкалоиды, стероидные гликозиды, многие физиологически активные вещества.
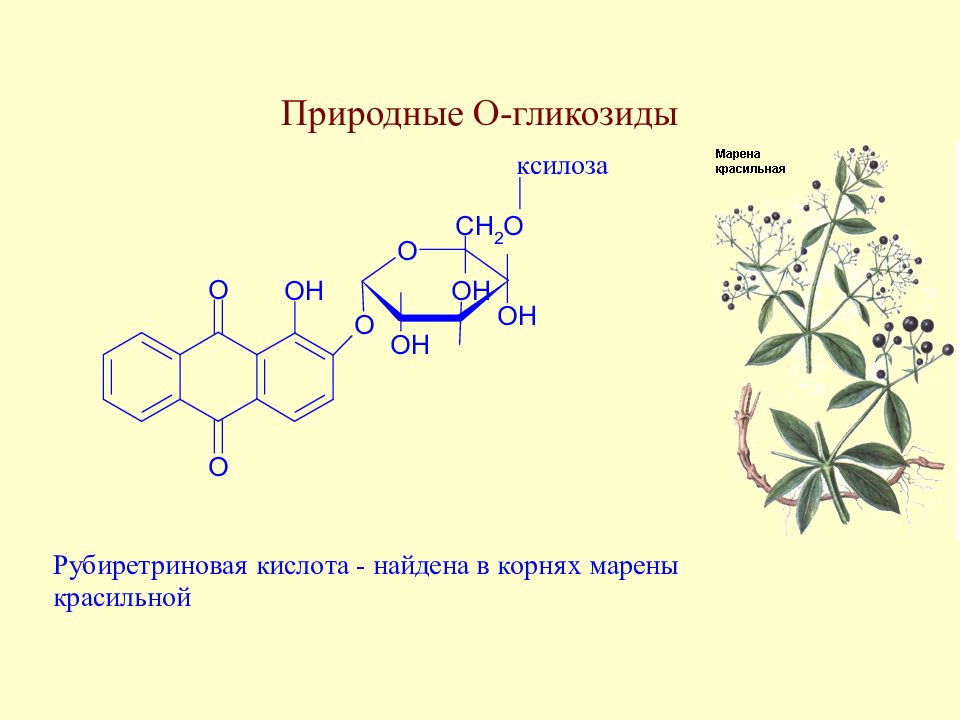
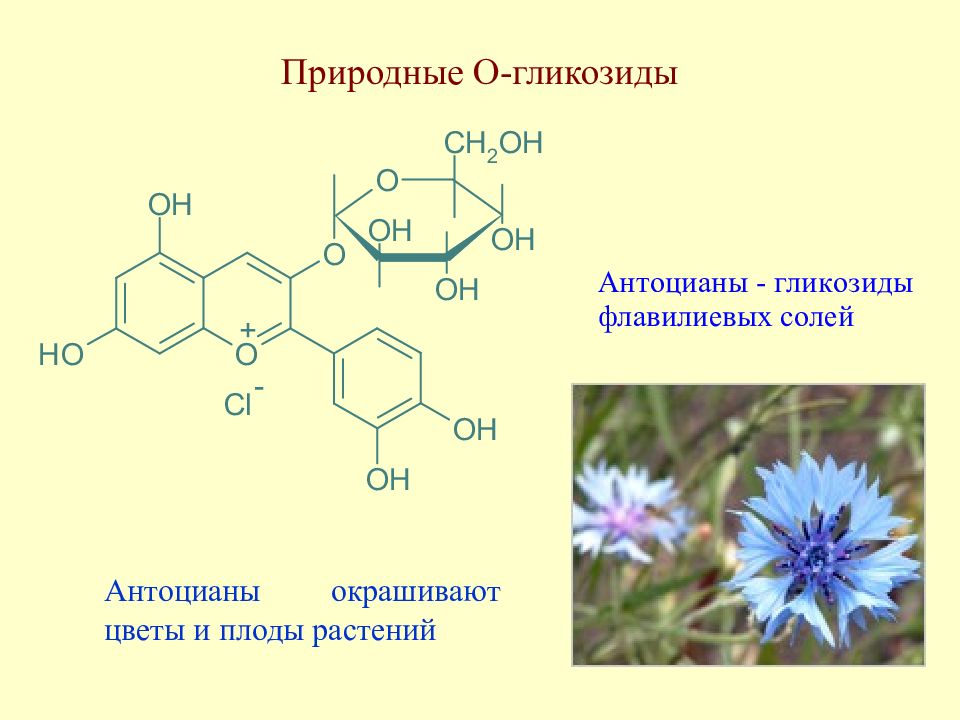
Слайд 130: Природные О-гликозиды
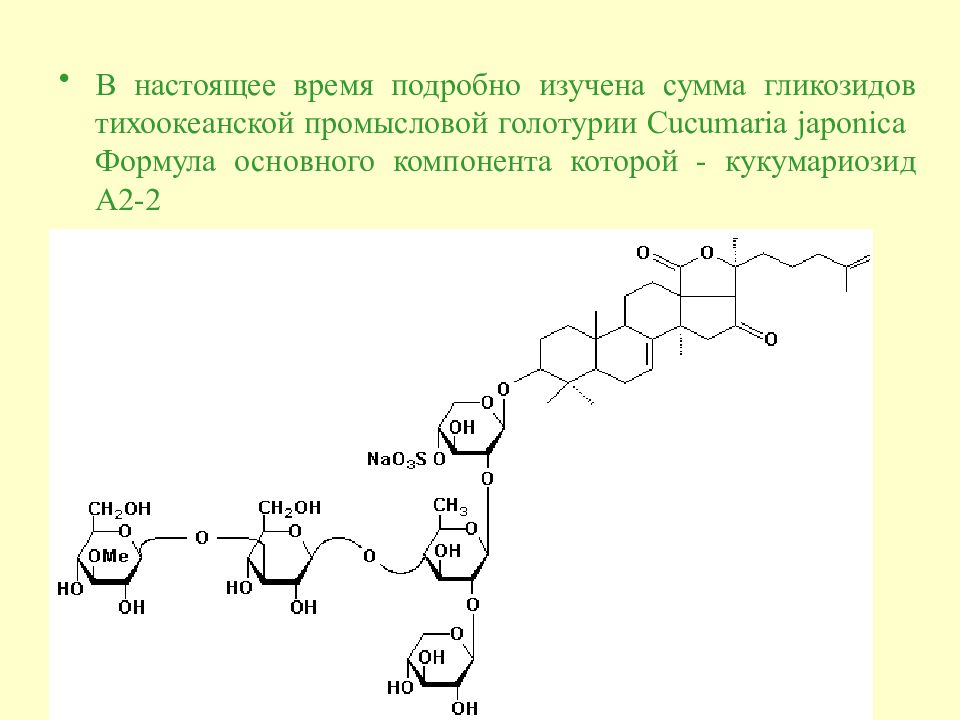
Тихоокеанская промысловая голотурия Cucumaria japonica оказалась способна к наработке тритерпеновых гликозидов. Эта способность крайне редка для животных и более характерна для растений. Тритерпеновые гликозиды обладают гемолитическим, ихтиоток-сическим, антигрибковым и противоопухолевым действием, а в последние годы открыто, что они обладают иммуностимулирующими, адьювантными и радиопротекторным свойствами.
Слайд 131
В настоящее время подробно изучена сумма гликозидов тихоокеанской промысловой голотурии Cucumaria japonica Формула основного компонента которой - кукумариозид А2-2
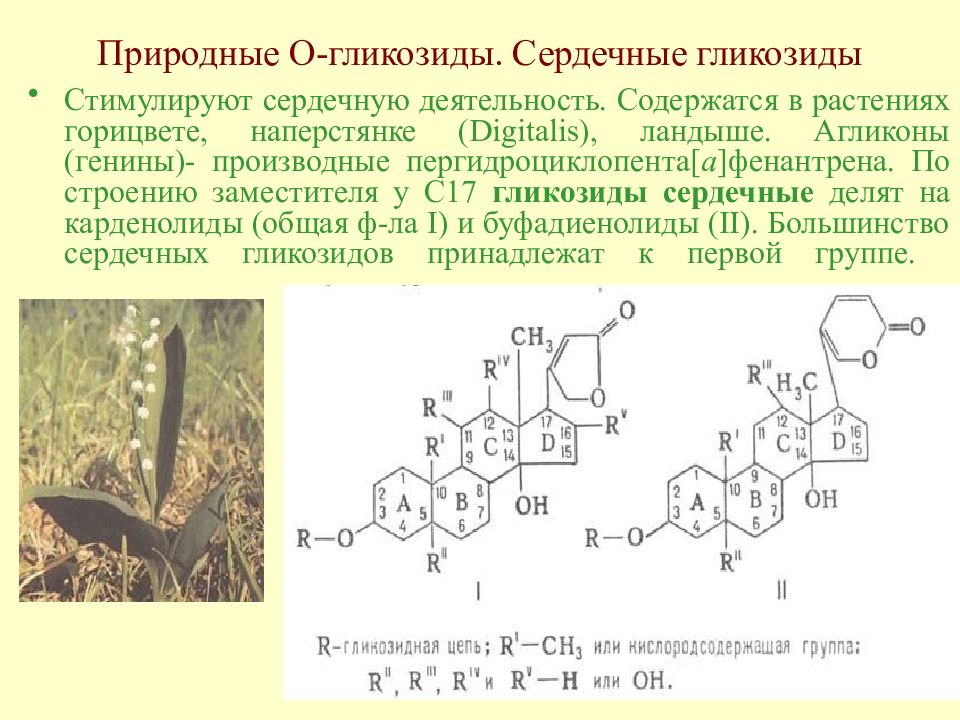
Слайд 132: Природные О-гликозиды. Сердечные гликозиды
Стимулируют сердечную деятельность. Содержатся в растениях горицвете, наперстянке (Digitalis), ландыше. Агликоны (генины)- производные пергидроциклопента[ а ]фенантрена. По строению заместителя у С17 гликозиды сердечные делят на карденолиды (общая ф-ла I) и буфадиенолиды (II). Большинство сердечных гликозидов принадлежат к первой группе.
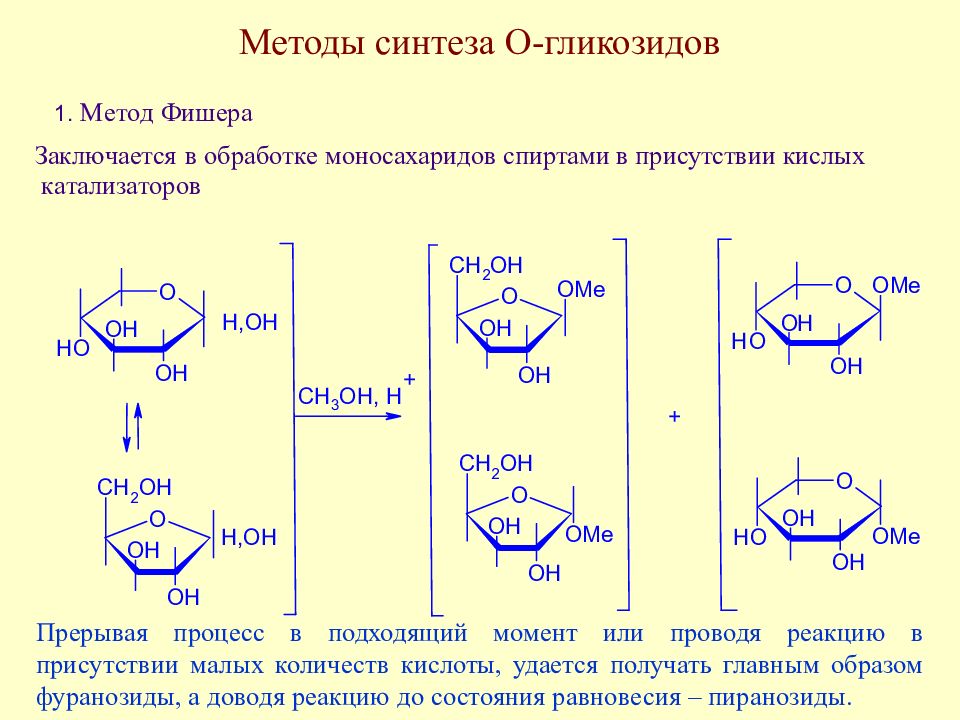
Слайд 134: Методы синтеза О-гликозидов
Прерывая процесс в подходящий момент или проводя реакцию в присутствии малых количеств кислоты, удается получать главным образом фуранозиды, а доводя реакцию до состояния равновесия – пиранозиды.
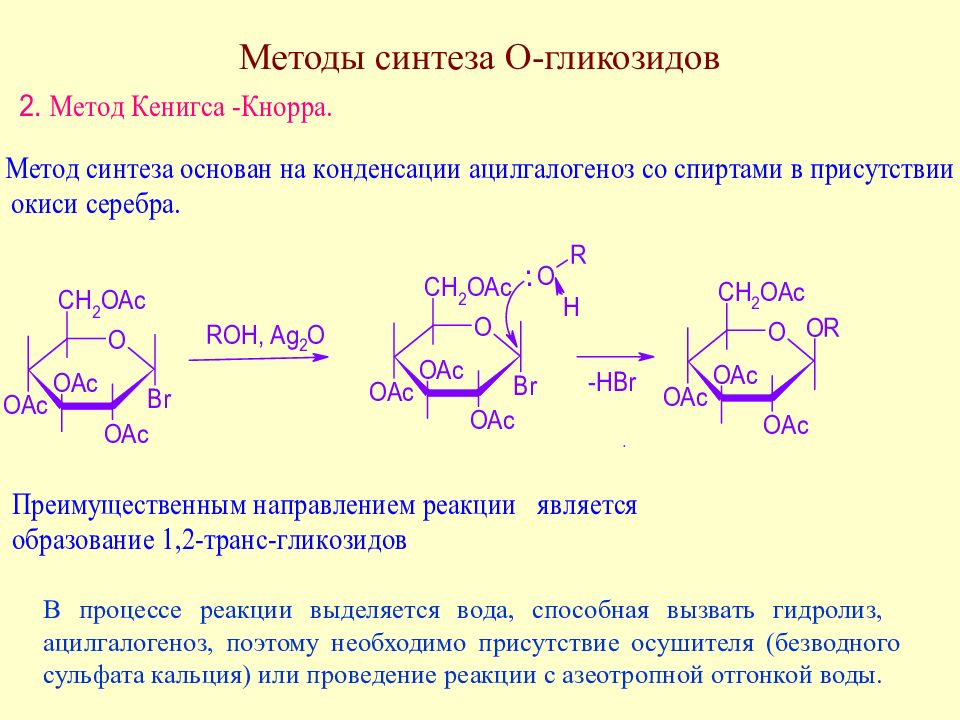
Слайд 135: Методы синтеза О-гликозидов
В процессе реакции выделяется вода, способная вызвать гидролиз, ацилгалогеноз, поэтому необходимо присутствие осушителя (безводного сульфата кальция) или проведение реакции с азеотропной отгонкой воды.
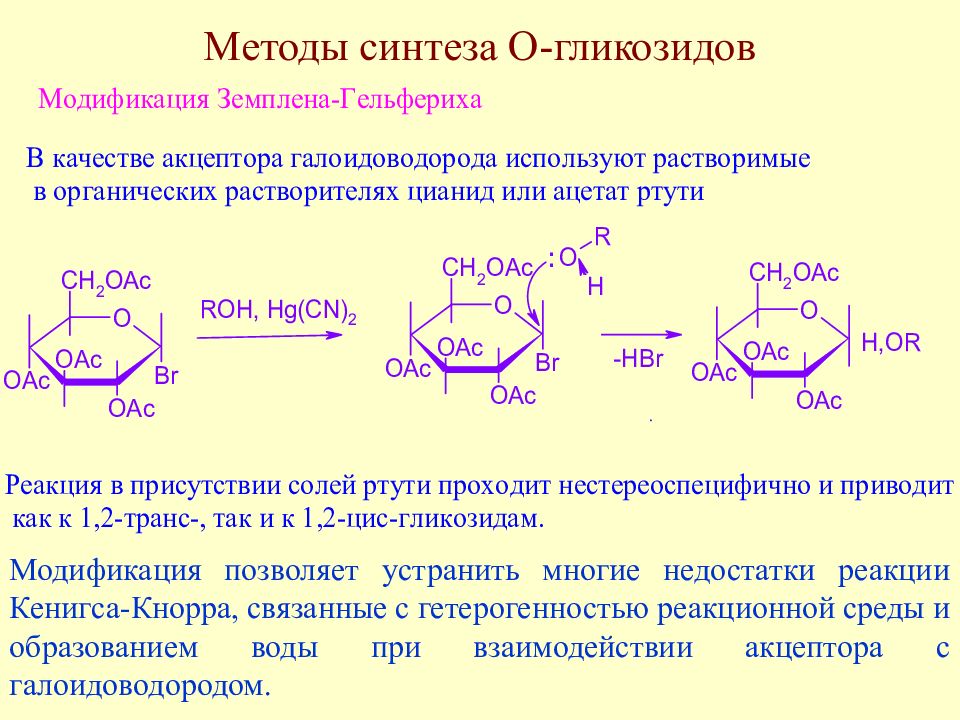
Слайд 136: Методы синтеза О-гликозидов
Модификация позволяет устранить многие недостатки реакции Кенигса-Кнорра, связанные с гетерогенностью реакционной среды и образованием воды при взаимодействии акцептора с галоидоводородом.
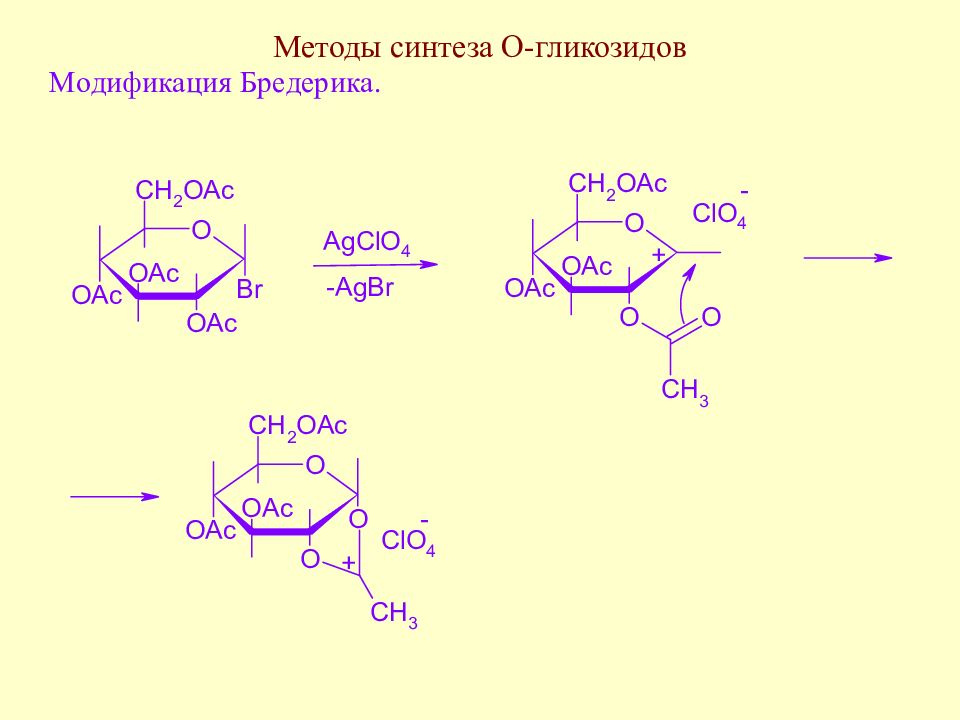
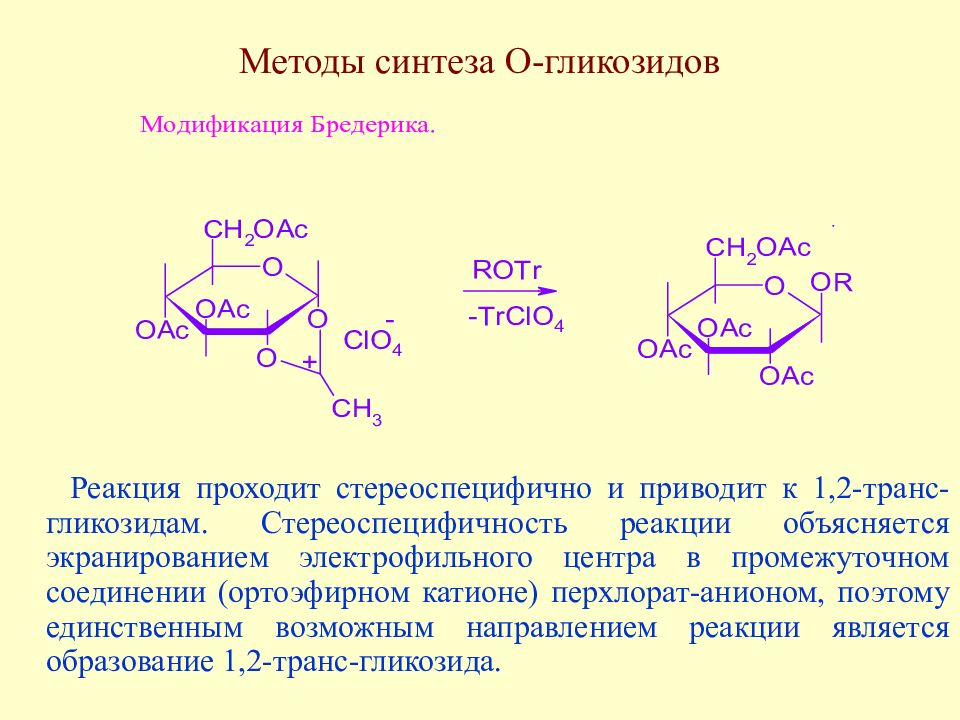
Слайд 138: Методы синтеза О-гликозидов
Реакция проходит стереоспецифично и приводит к 1,2-транс-гликозидам. Стереоспецифичность реакции объясняется экранированием электрофильного центра в промежуточном соединении (ортоэфирном катионе) перхлорат-анионом, поэтому единственным возможным направлением реакции является образование 1,2-транс-гликозида.
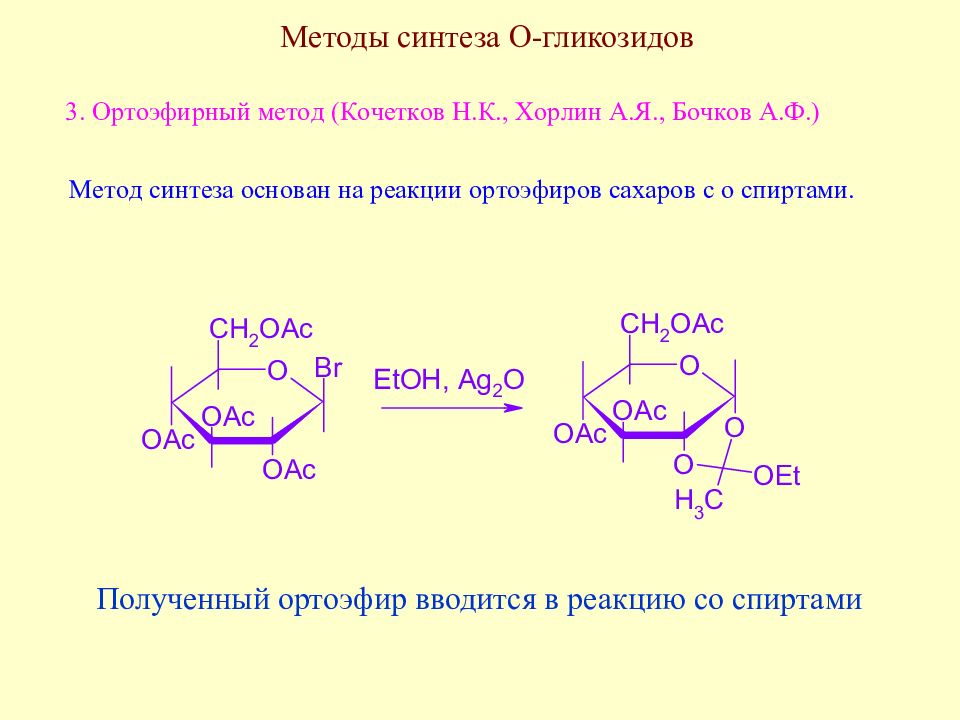
Слайд 139: Методы синтеза О-гликозидов
Полученный ортоэфир вводится в реакцию со спиртами
Слайд 140: Методы синтеза О-гликозидов
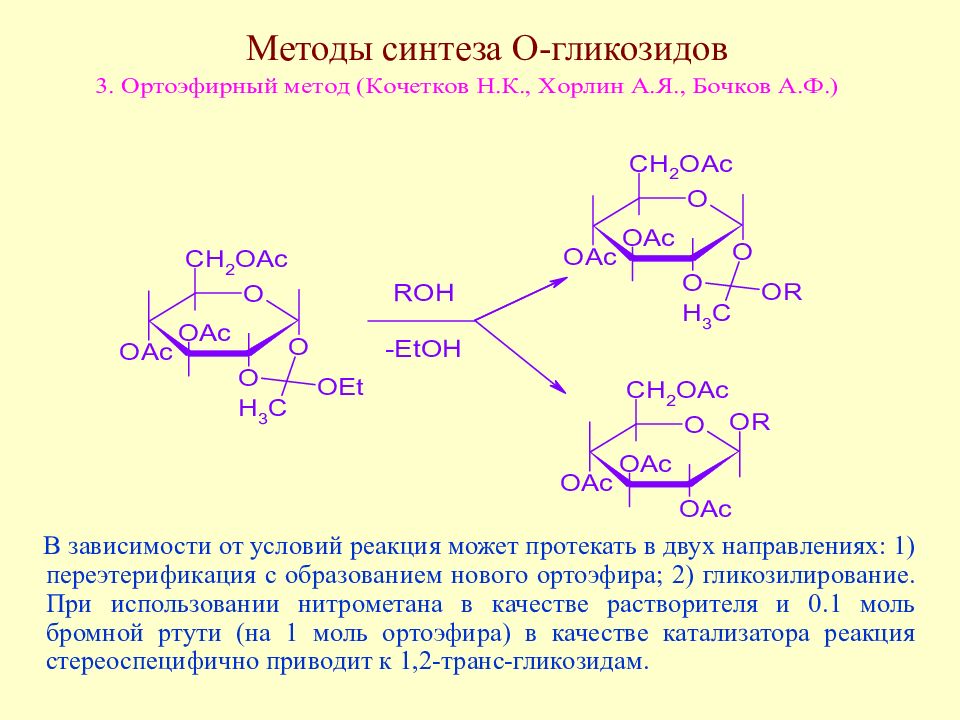
В зависимости от условий реакция может протекать в двух направлениях: 1) переэтерификация с образованием нового ортоэфира; 2) гликозилирование. При использовании нитрометана в качестве растворителя и 0.1 моль бромной ртути (на 1 моль ортоэфира) в качестве катализатора реакция стереоспецифично приводит к 1,2-транс-гликозидам.
Слайд 141: Методы синтеза О-гликозидов
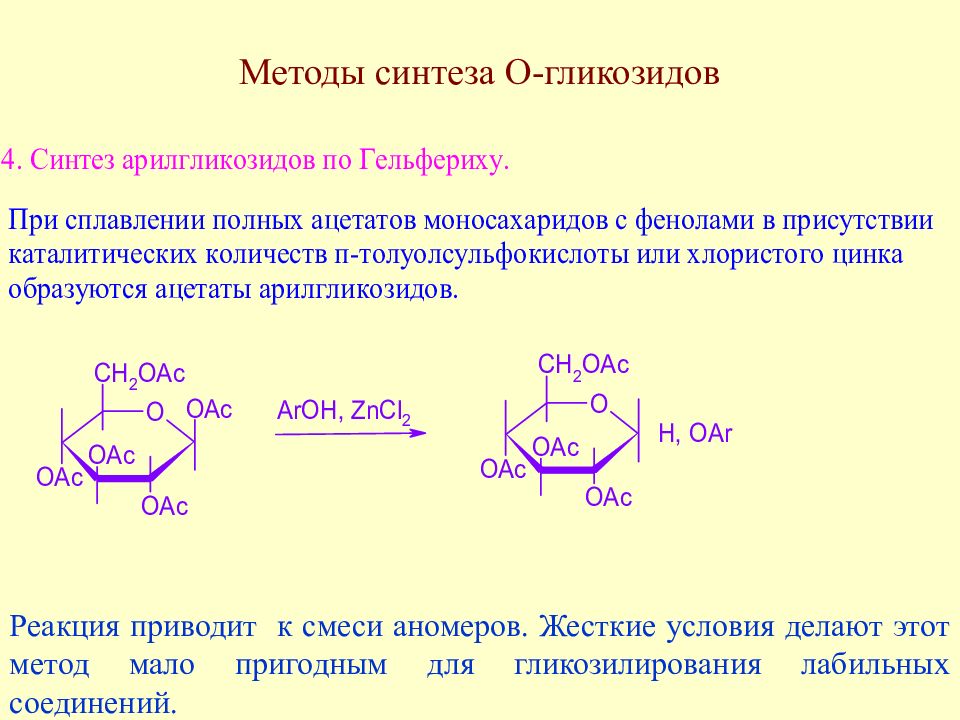
Реакция приводит к смеси аномеров. Жесткие условия делают этот метод мало пригодным для гликозилирования лабильных соединений.
Слайд 142: Химические свойства О-гликозидов
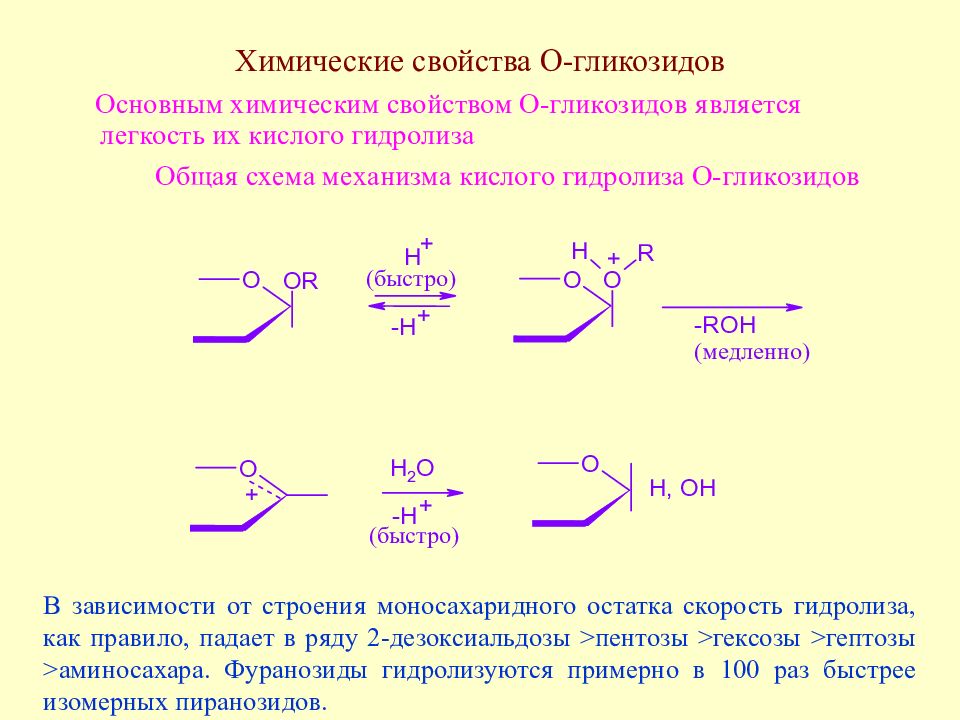
В зависимости от строения моносахаридного остатка скорость гидролиза, как правило, падает в ряду 2-дезоксиальдозы >пентозы >гексозы >гептозы >аминосахара. Фуранозиды гидролизуются примерно в 100 раз быстрее изомерных пиранозидов.
Слайд 143: Аминосахара
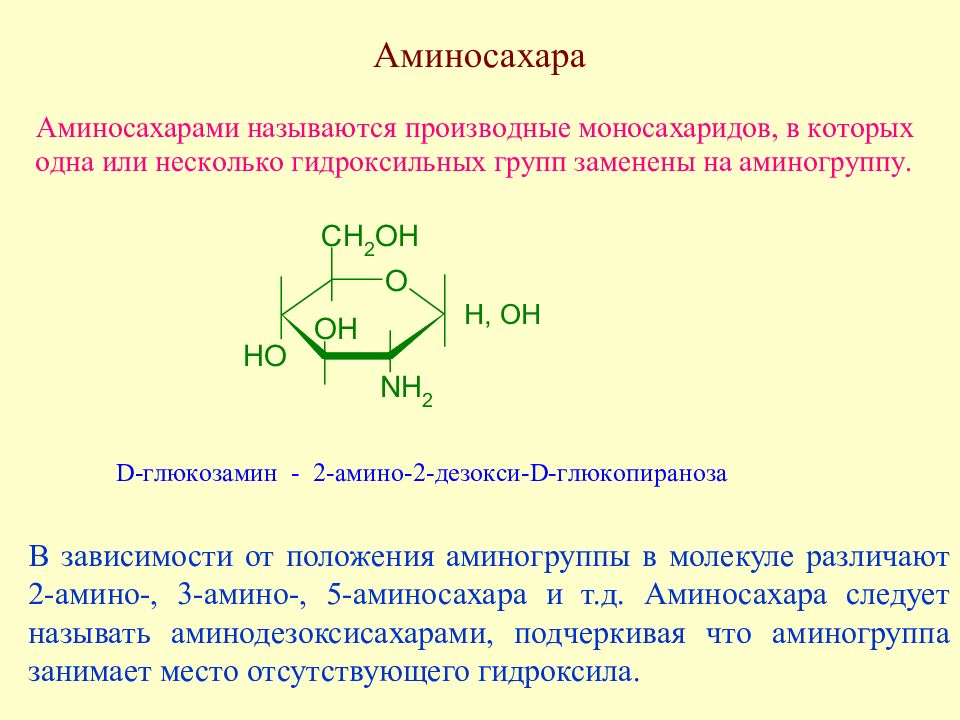
В зависимости от положения аминогруппы в молекуле различают 2-амино-, 3-амино-, 5-аминосахара и т.д. Аминосахара следует называть аминодезоксисахарами, подчеркивая что аминогруппа занимает место отсутствующего гидроксила.
Слайд 144: Аминосахара. Распространение в природе
Хитин является основой панциря насекомых и ракообразных, а также входит в состав клеточных стенок грибов. Гепарин препятствует свертыванию крови, т.е. проявляет антикоагулянтные свойства. В состав различных мукополисахаридов входит также D- галактозамин.
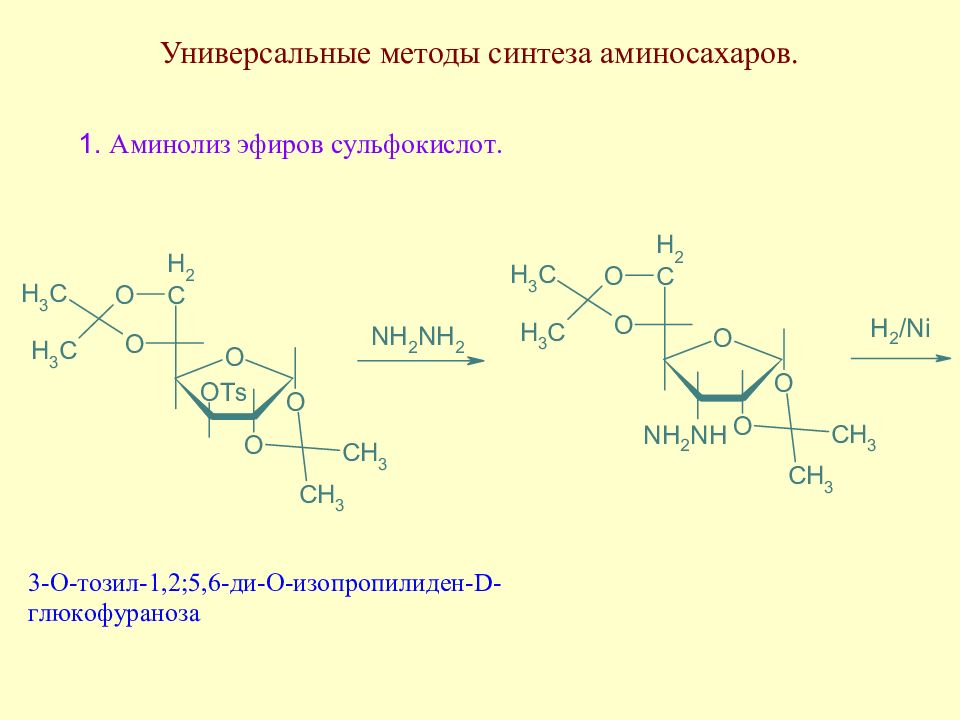
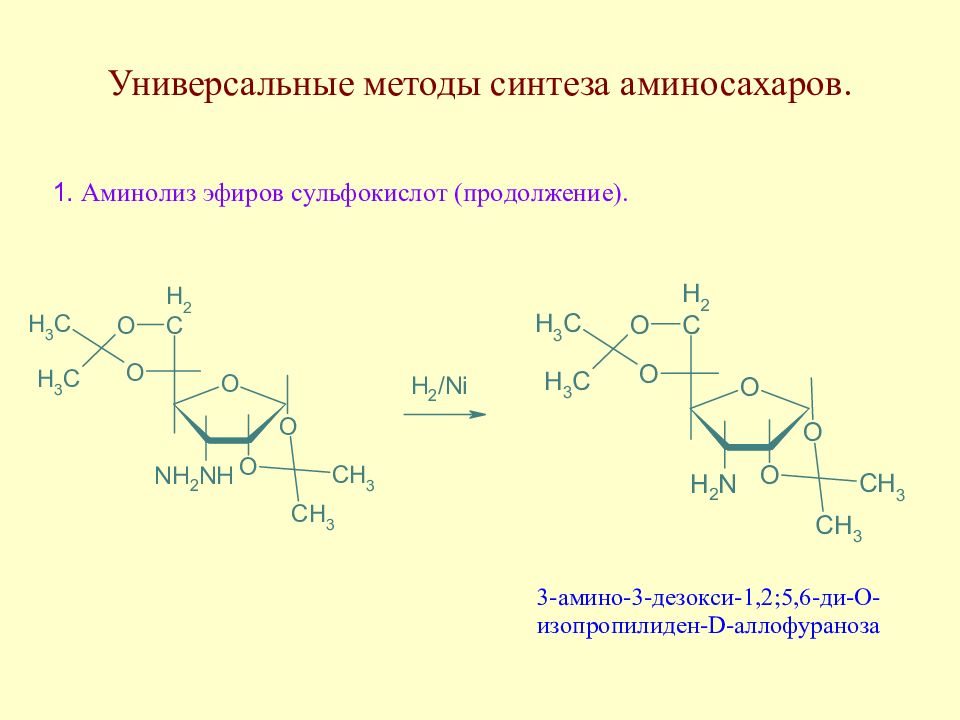
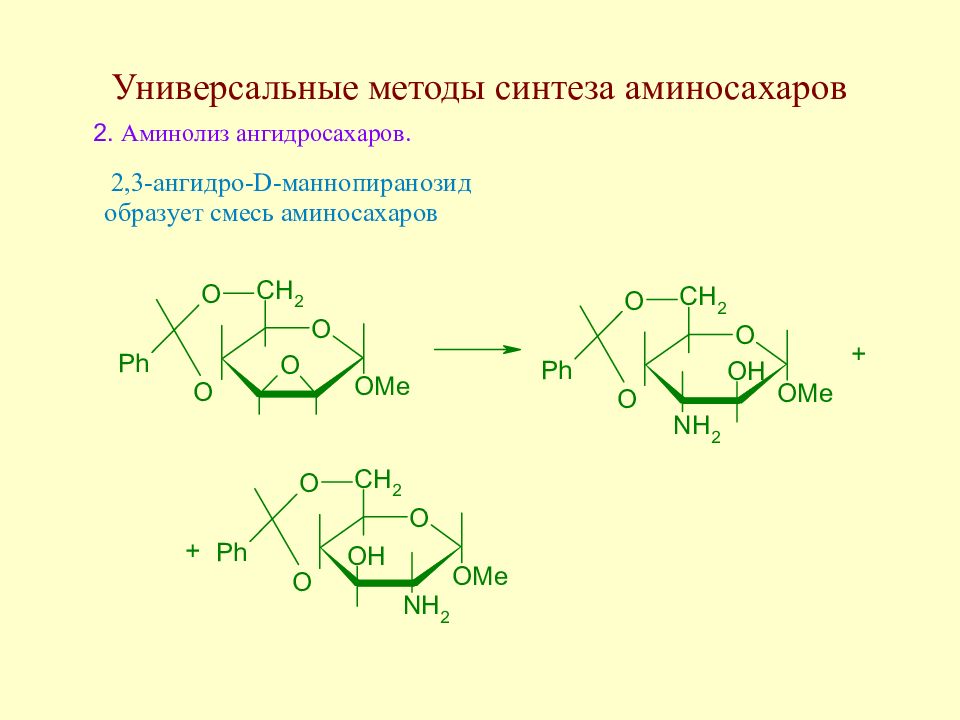
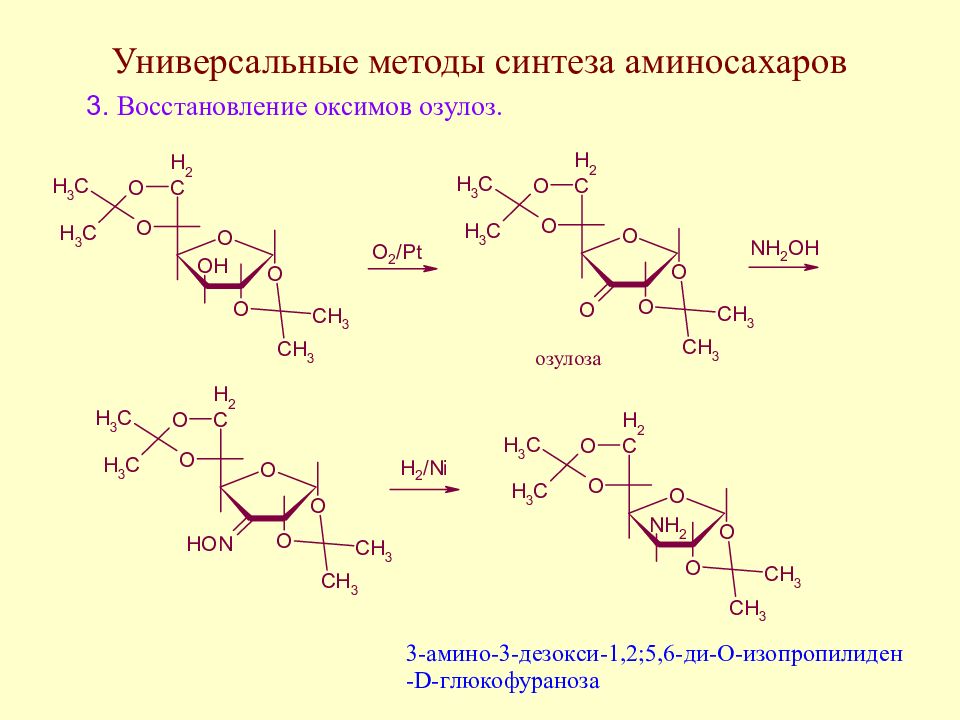
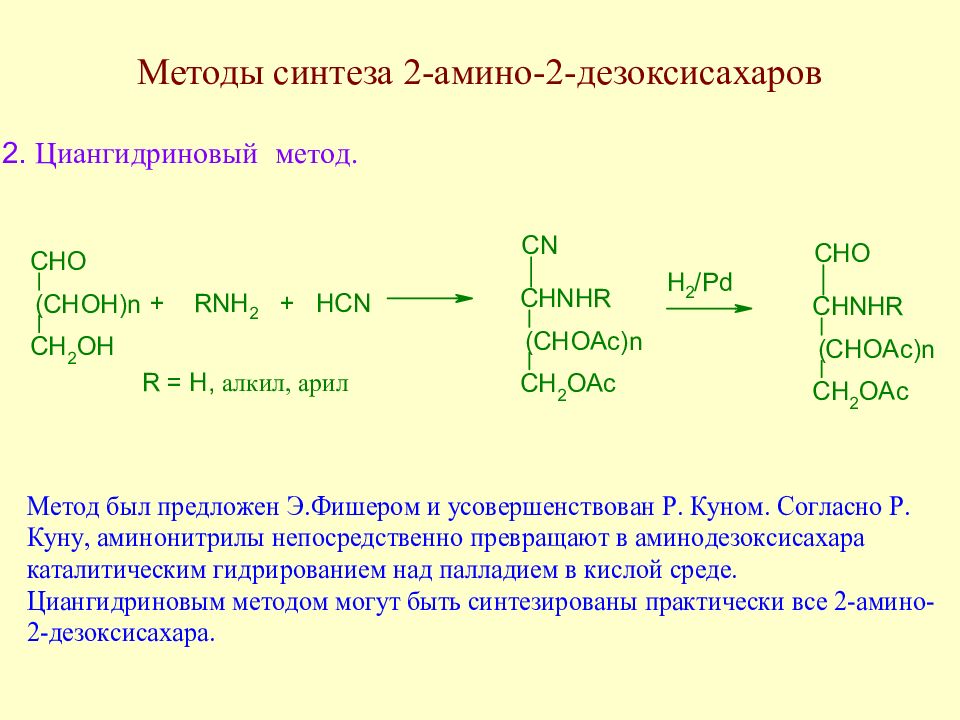
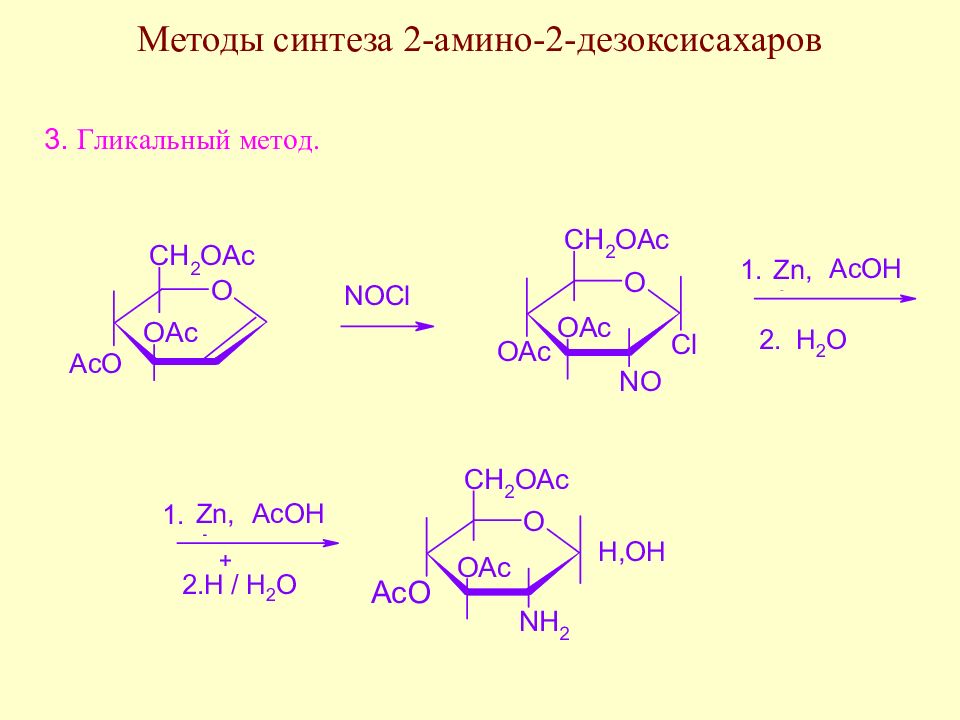
Слайд 145: Методы синтеза аминосахаров
Методы синтеза аминосахаров делятся на универсальные, позволяющие вводить аминогруппу в любое положение молекулы моносахарида, и специфические, позволяющие вводить аминогруппу только в одно определенное место молекулы моносахарида. Методы второй группы в основном направлены на получение 2-амино-2-дезоксисахаров ввиду особой важности аминосахаров этого типа.
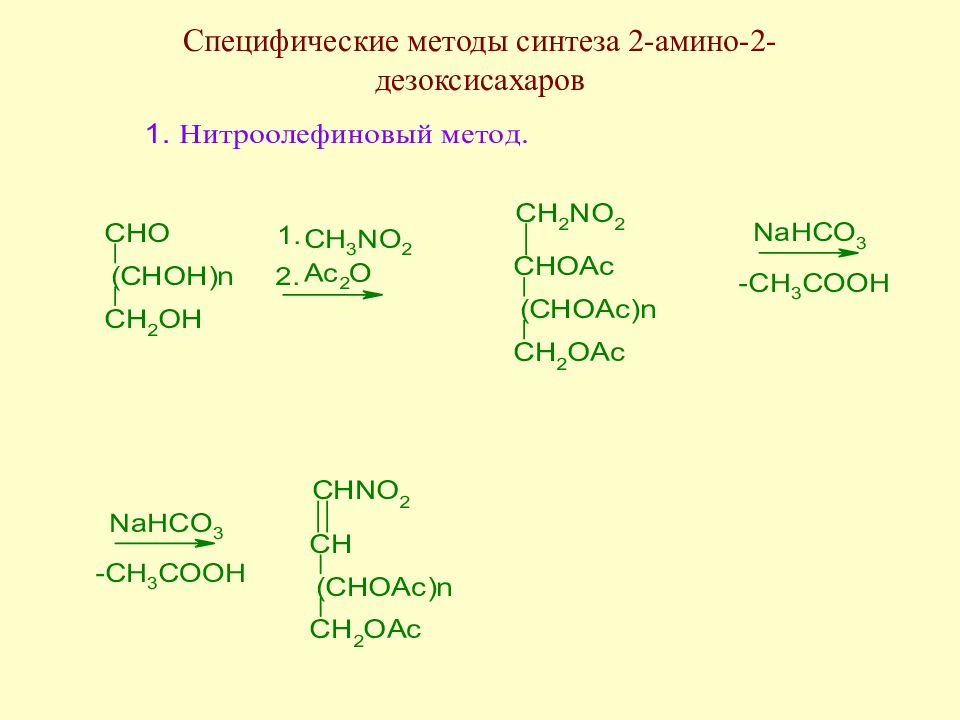
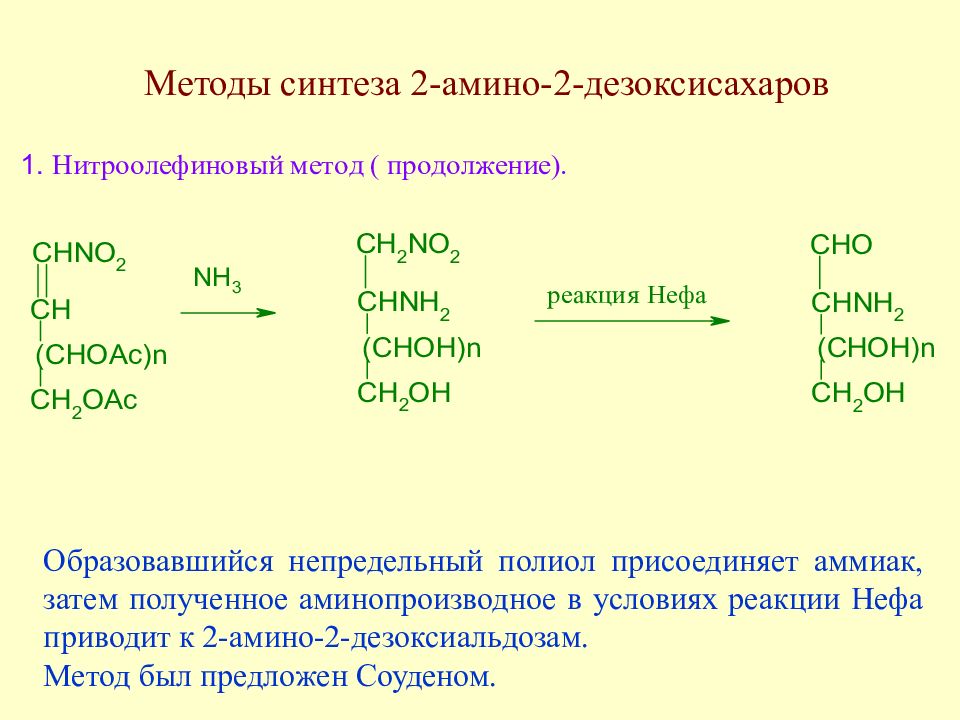
Слайд 151: Методы синтеза 2-амино-2-дезоксисахаров
Образовавшийся непредельный полиол присоединяет аммиак, затем полученное аминопроизводное в условиях реакции Нефа приводит к 2-амино-2-дезоксиальдозам. Метод был предложен Соуденом.
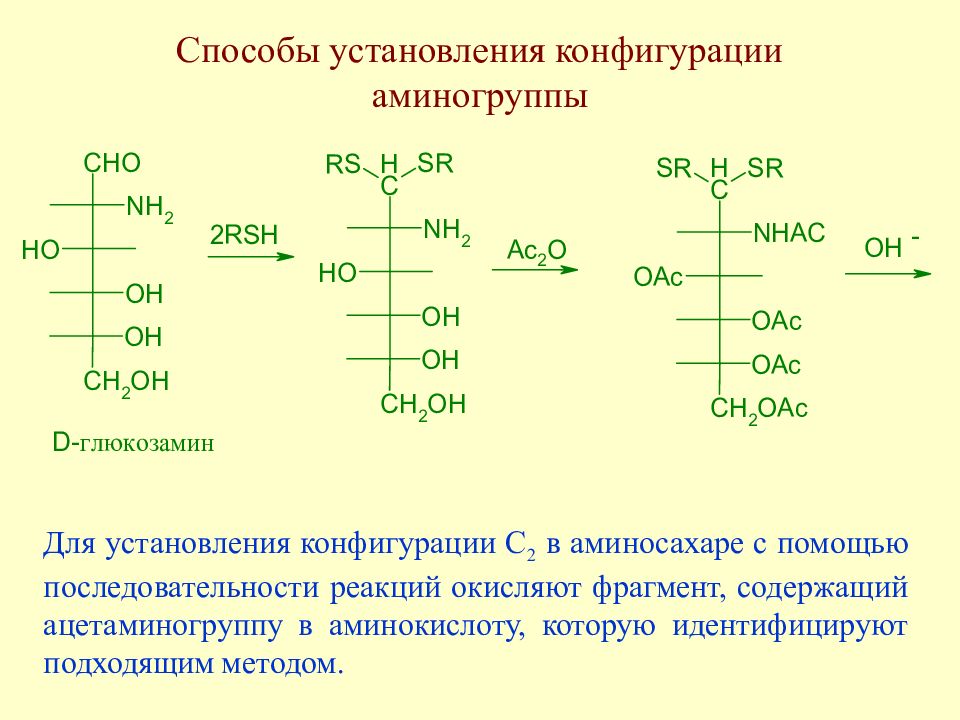
Слайд 154: Способы установления конфигурации аминогруппы
Для установления конфигурации С 2 в аминосахаре с помощью последовательности реакций окисляют фрагмент, содержащий ацетаминогруппу в аминокислоту, которую идентифицируют подходящим методом.
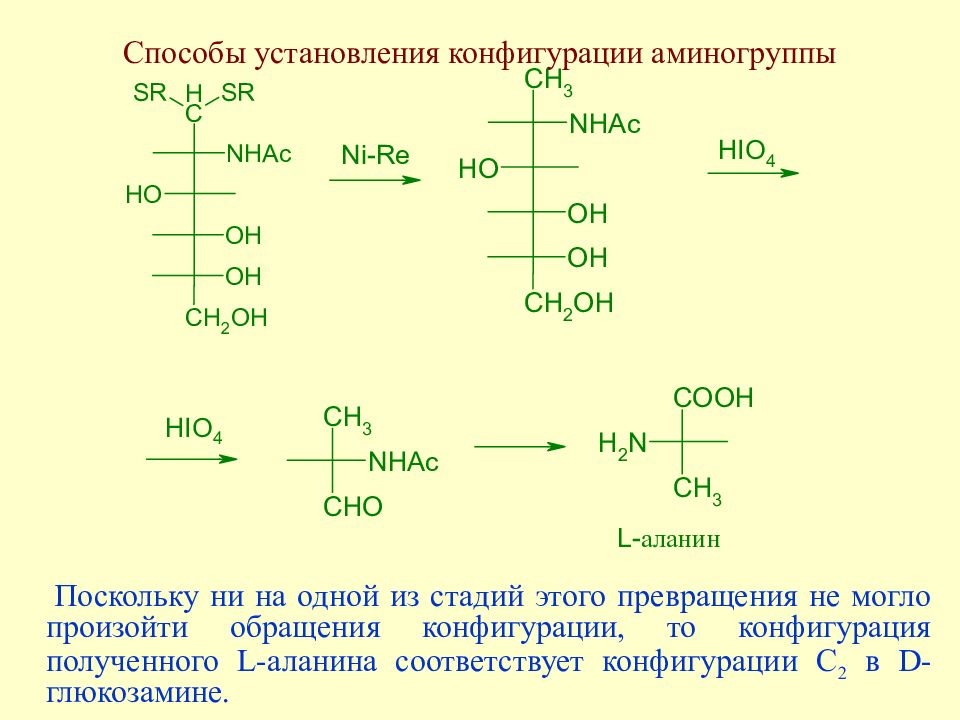
Слайд 155: Способы установления конфигурации аминогруппы
Поскольку ни на одной из стадий этого превращения не могло произойти обращения конфигурации, то конфигурация полученного L -аланина соответствует конфигурации С 2 в D -глюкозамине.
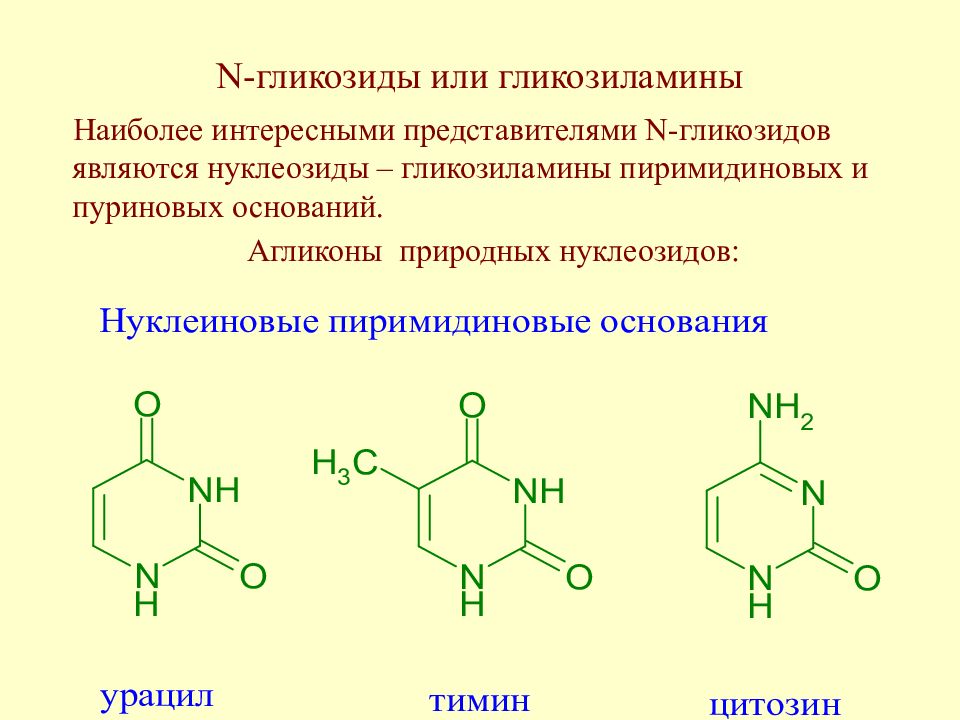
Слайд 158: N -гликозиды или гликозиламины
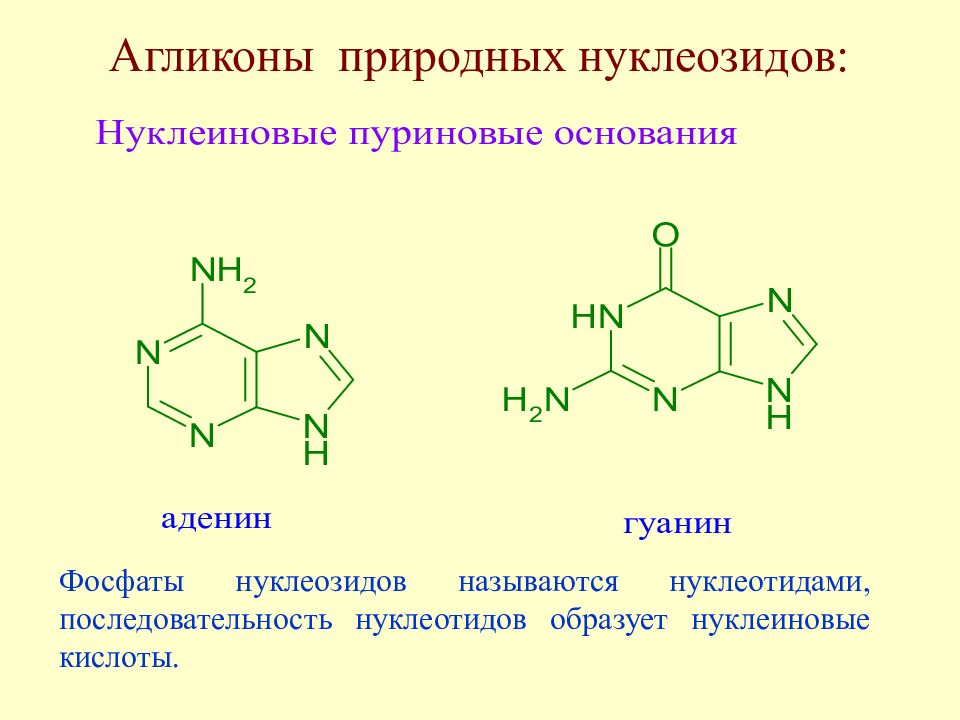
Наиболее интересными представителями N -гликозидов являются нуклеозиды – гликозиламины пиримидиновых и пуриновых оснований. Агликоны природных нуклеозидов :
Слайд 159: Агликоны природных нуклеозидов :
Фосфаты нуклеозидов называются нуклеотидами, последовательность нуклеотидов образует нуклеиновые кислоты.
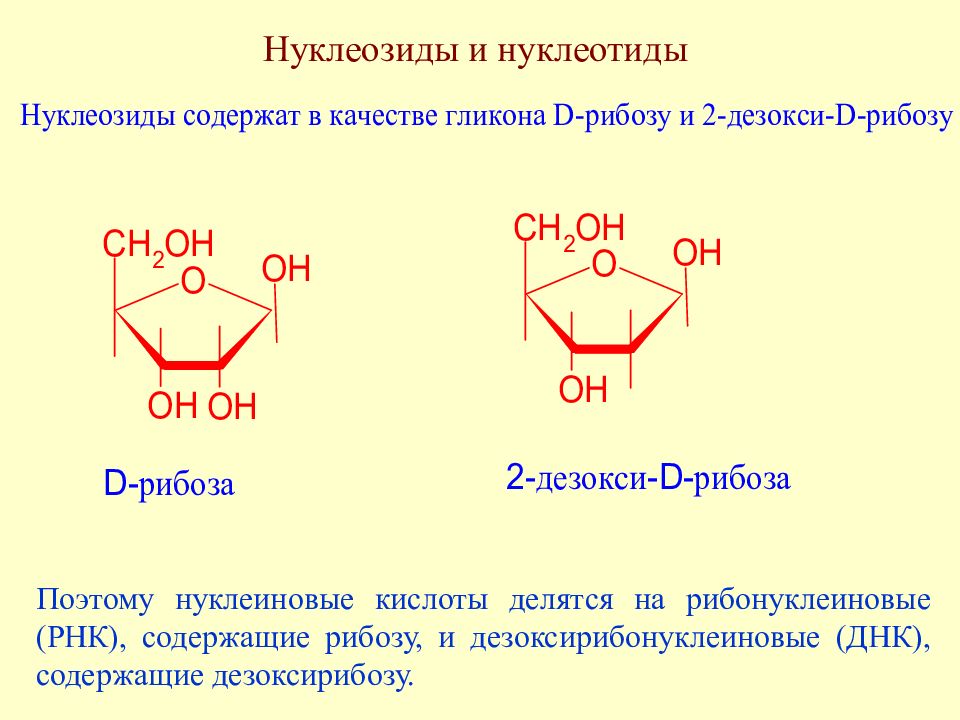
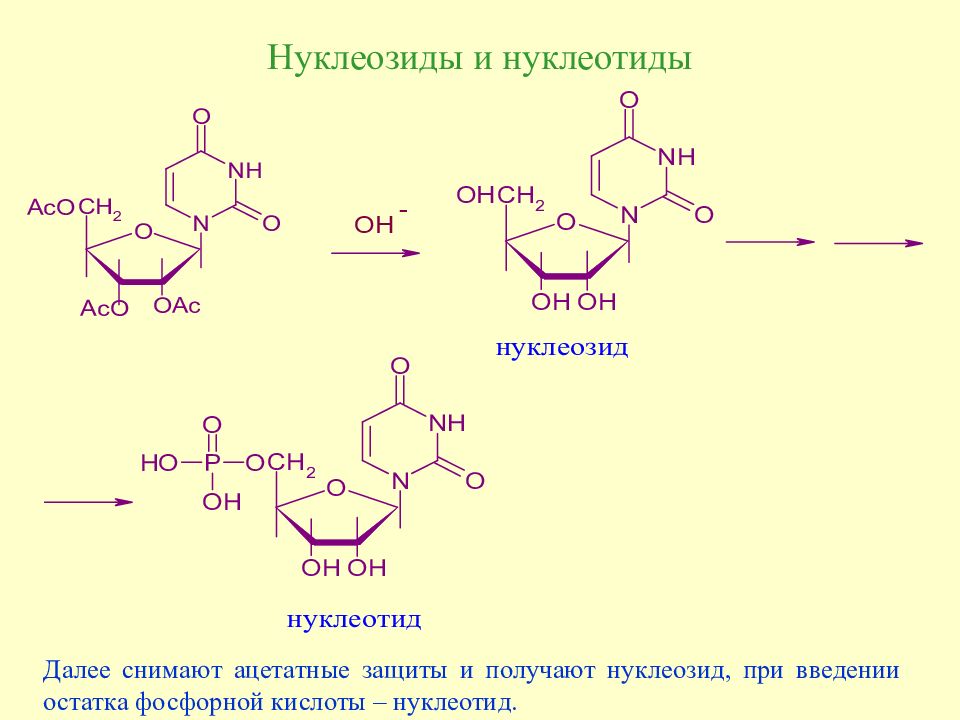
Слайд 160: Нуклеозиды и нуклеотиды
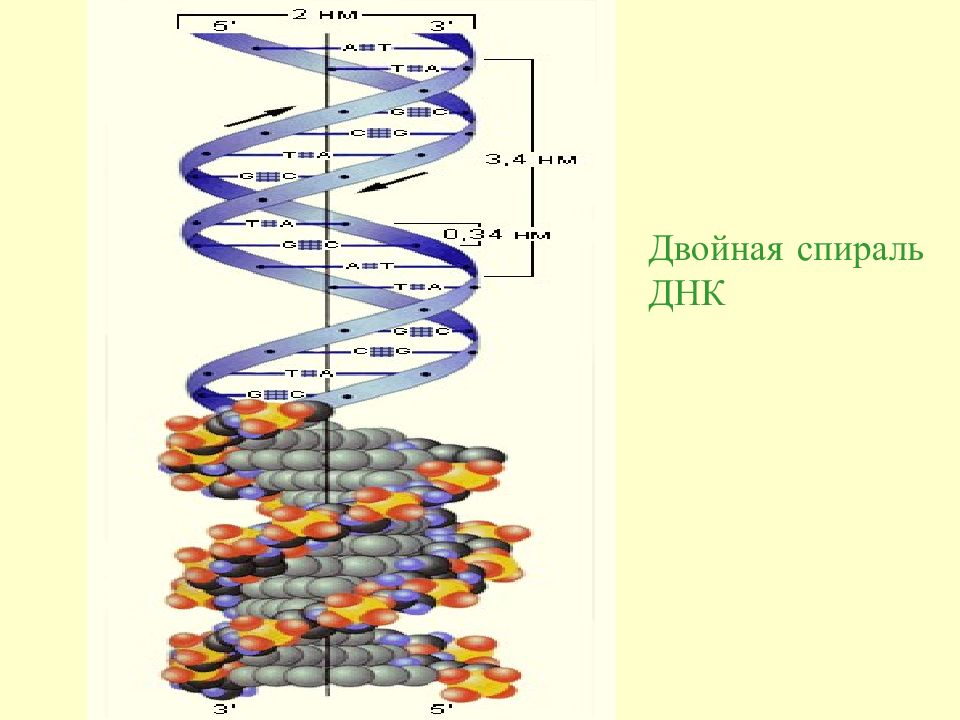
Поэтому нуклеиновые кислоты делятся на рибонуклеиновые (РНК), содержащие рибозу, и дезоксирибонуклеиновые (ДНК), содержащие дезоксирибозу.
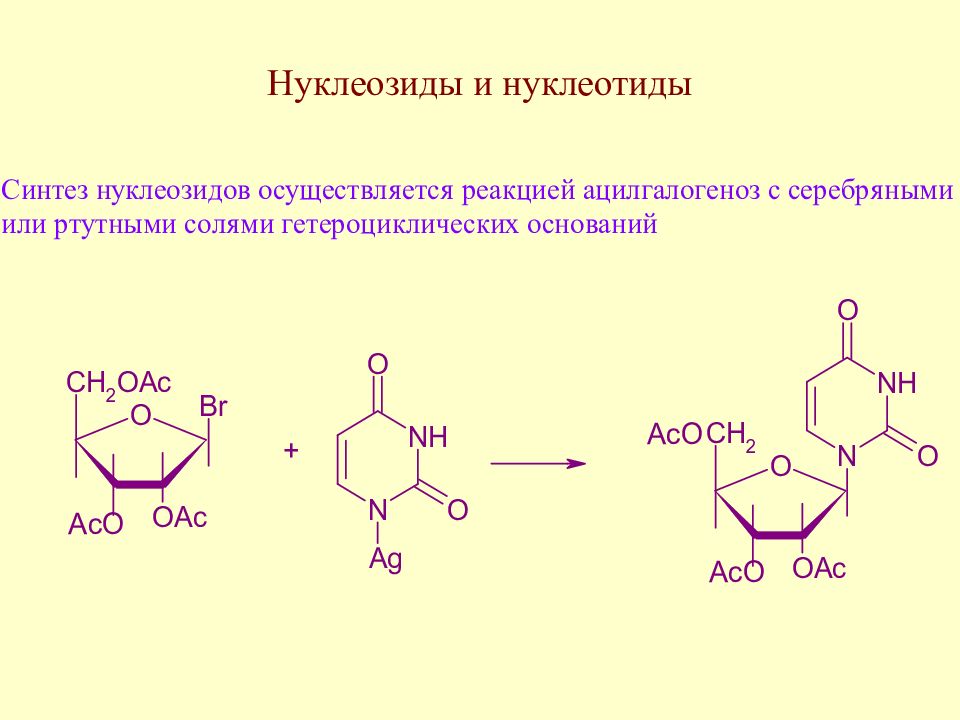
Слайд 162: Нуклеозиды и нуклеотиды
Далее снимают ацетатные защиты и получают нуклеозид, при введении остатка фосфорной кислоты – нуклеотид.
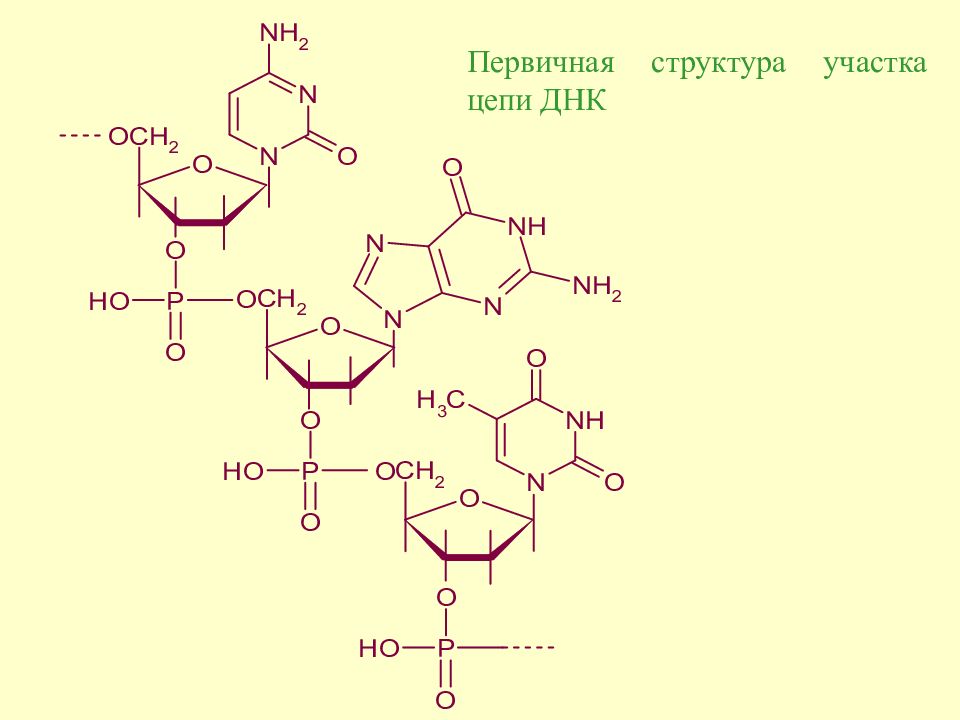
Слайд 163: Строение полинуклеотидной цепи
В полинуклеотидных цепях нуклеотидные звенья связываются через фосфатную группу. Фосфатная группа образует две сложноэфирные связи: c C -3 предыдущего и c C -5 последущего нуклеотидных звеньев. Каркас цепи состоит из чередующихся пентозных и фосфатных остатков, а гетероциклические основания являются боковыми группами, присоединенными к пентозным остаткам.
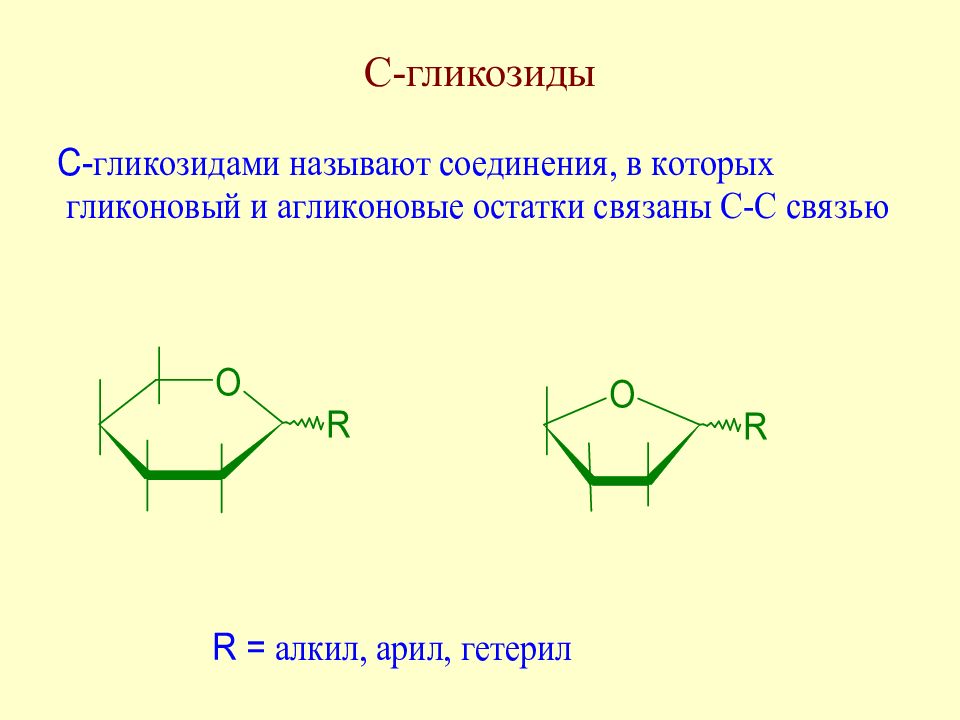
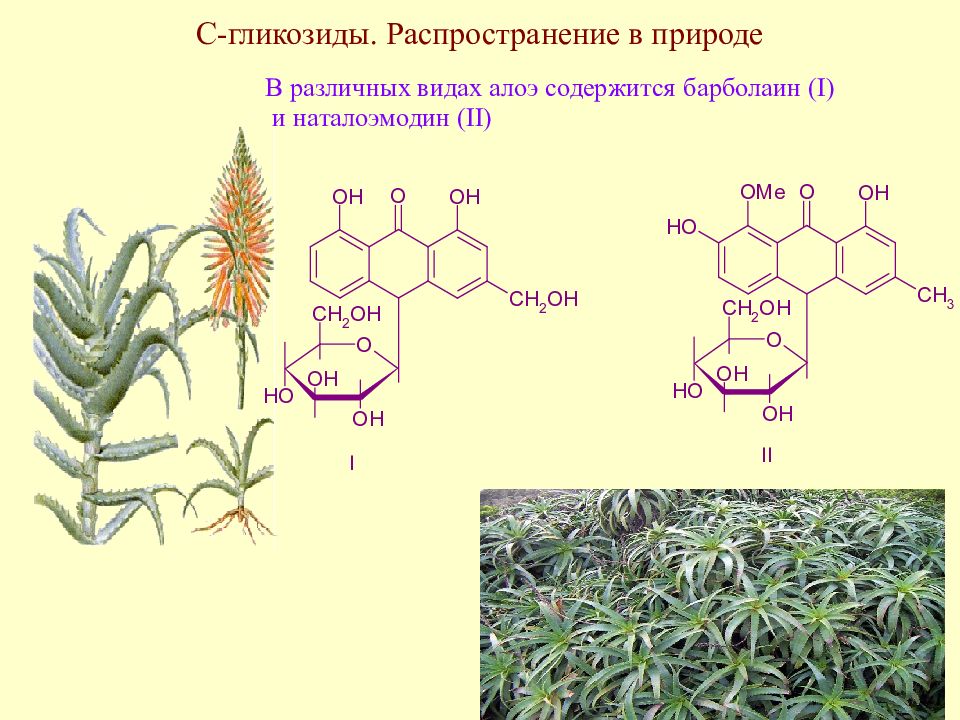
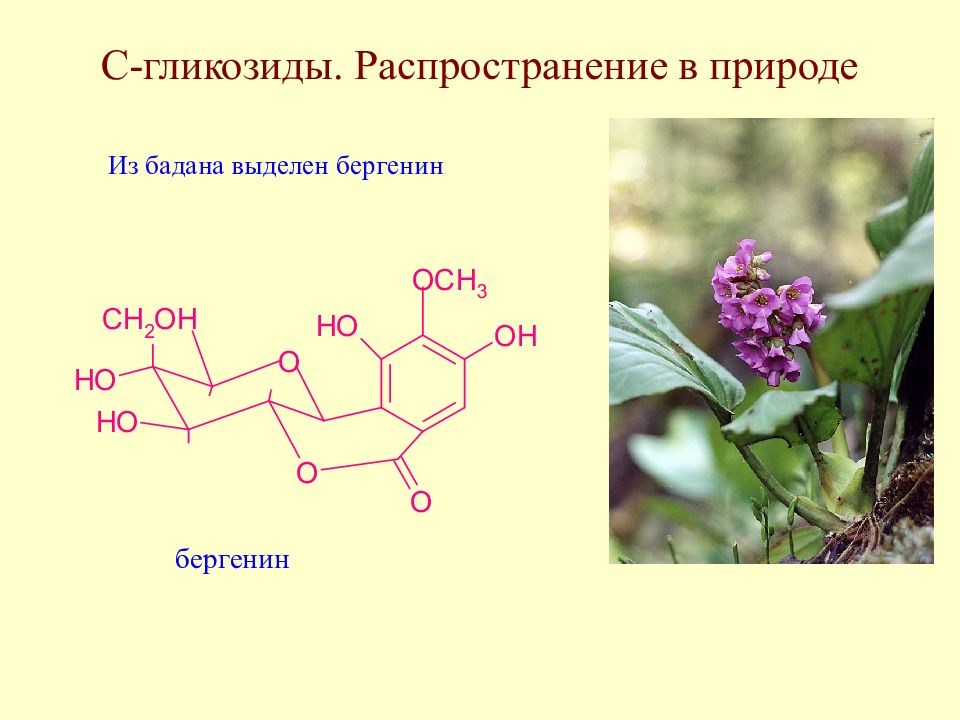
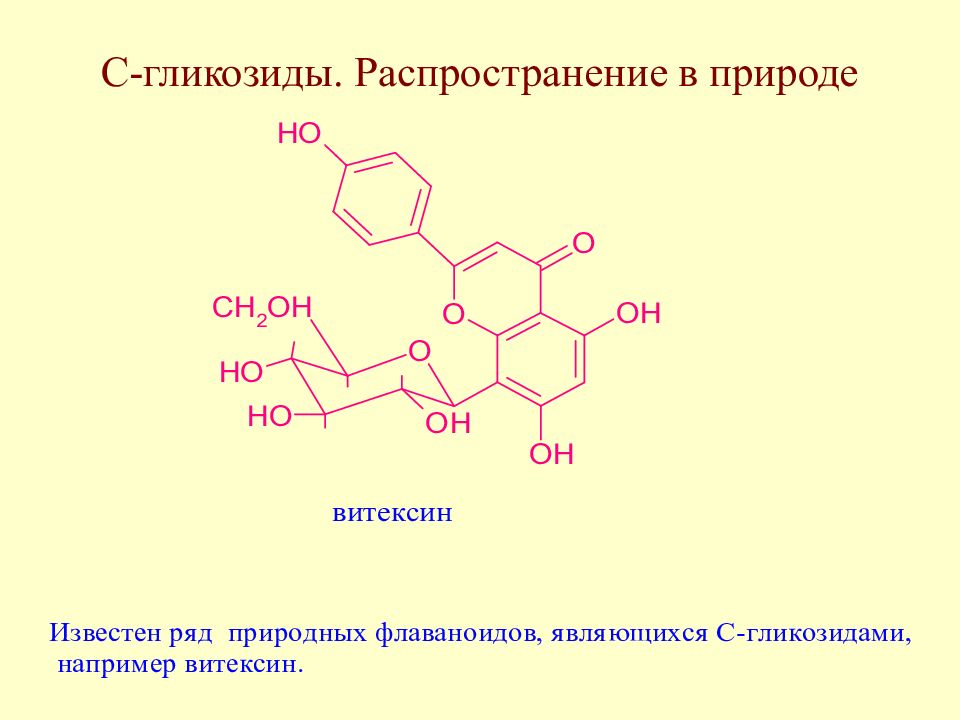
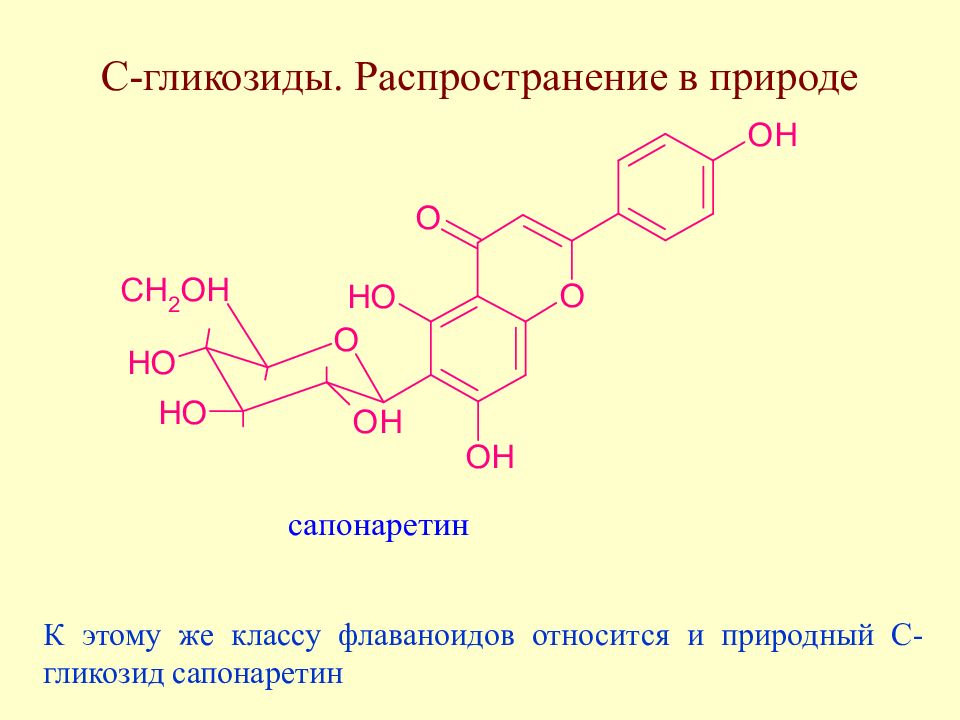
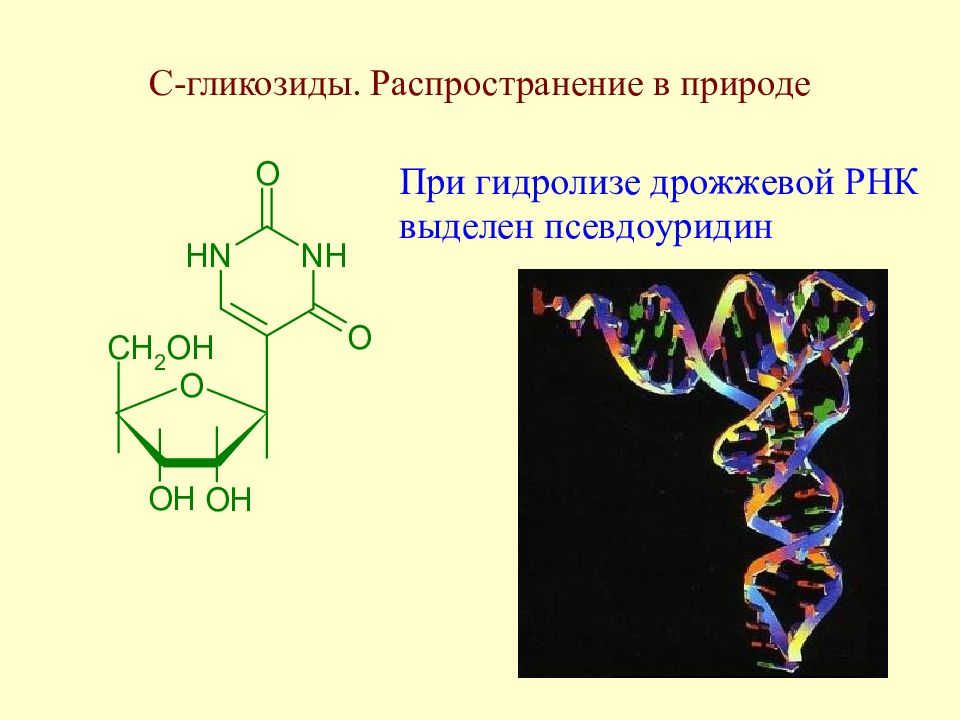
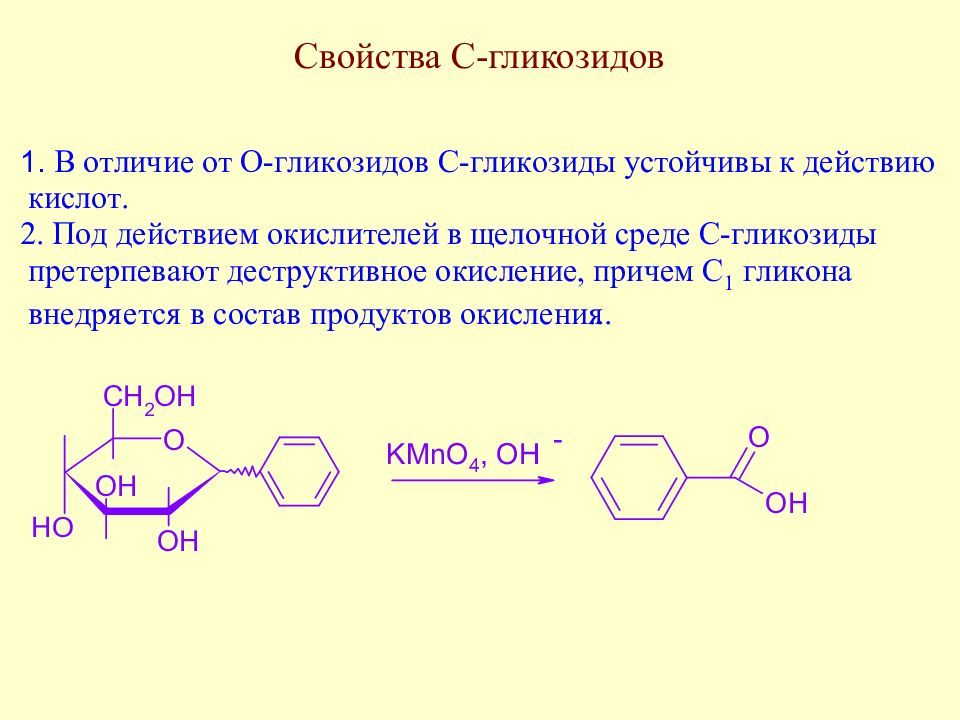
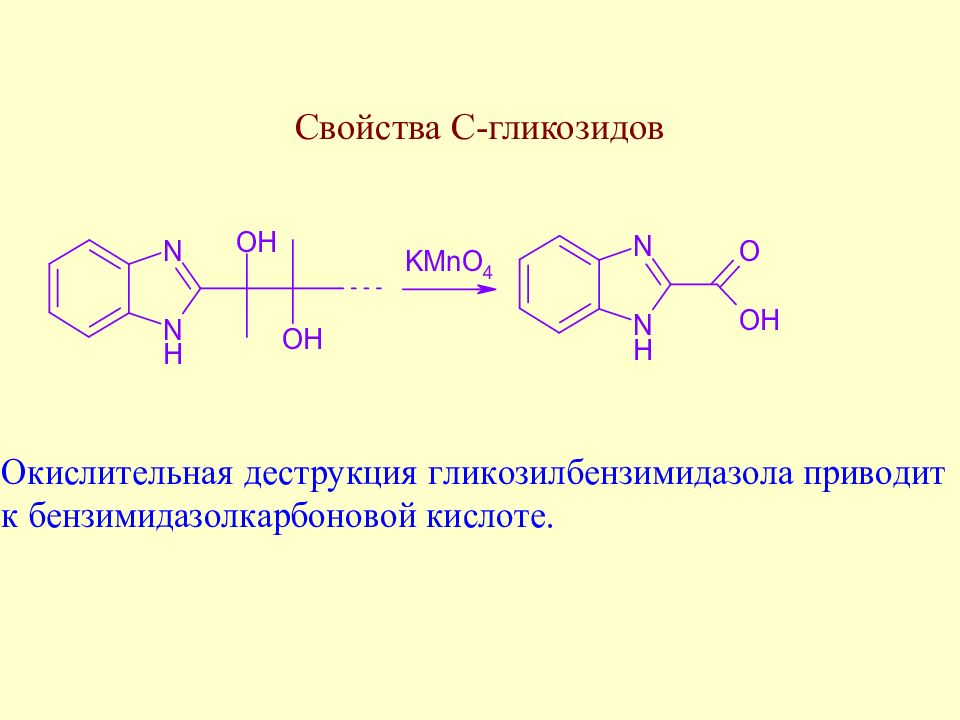
Слайд 171: С-гликозиды. Распространение в природе
К этому же классу флаваноидов относится и природный С-гликозид сапонаретин
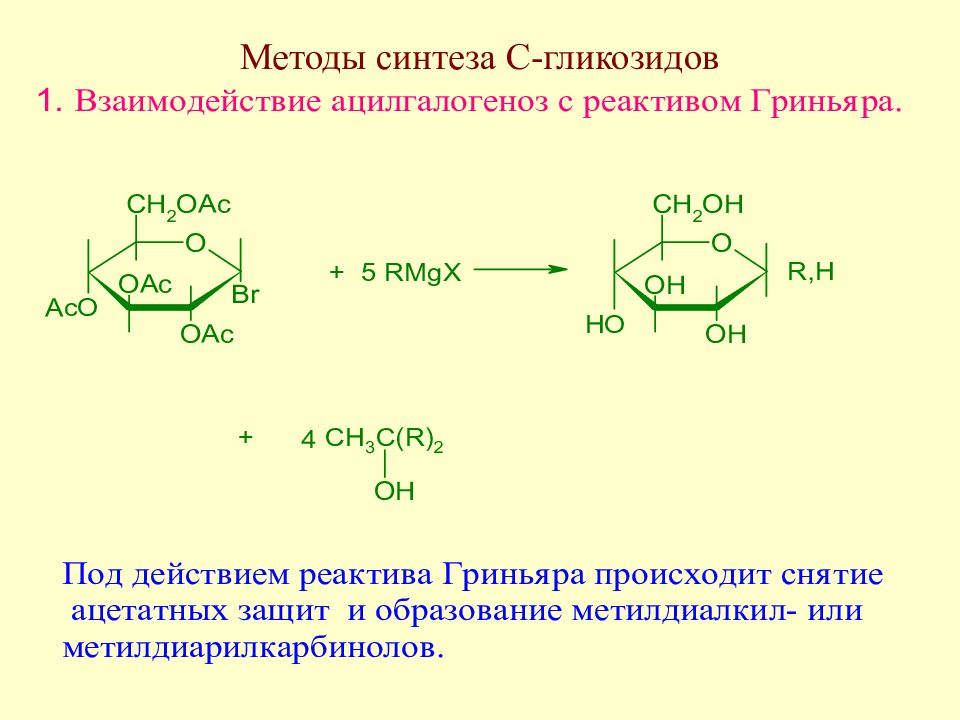
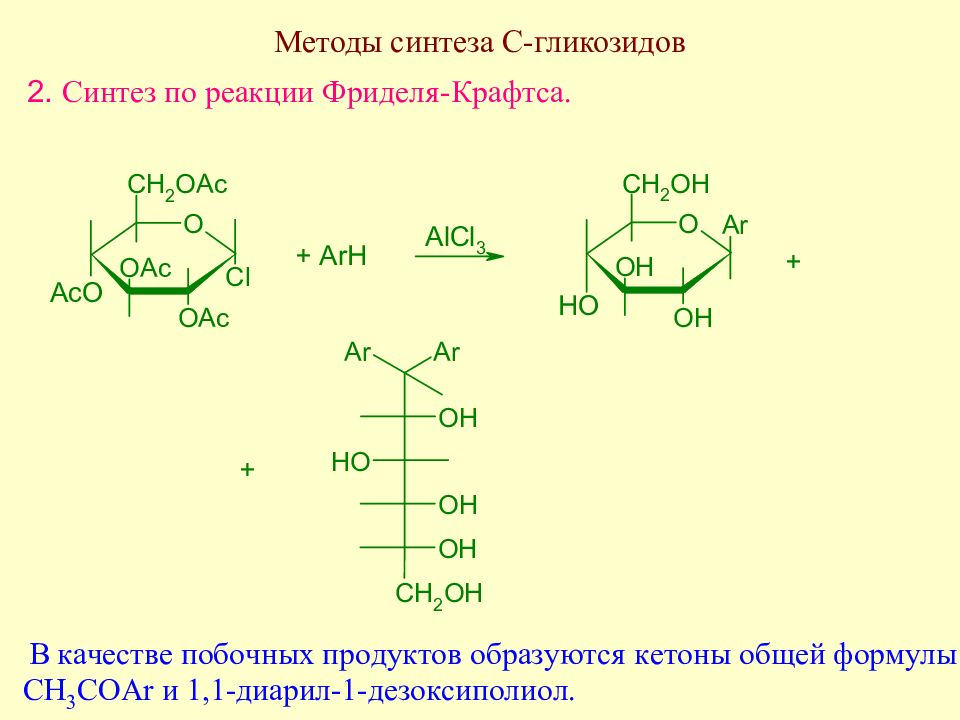
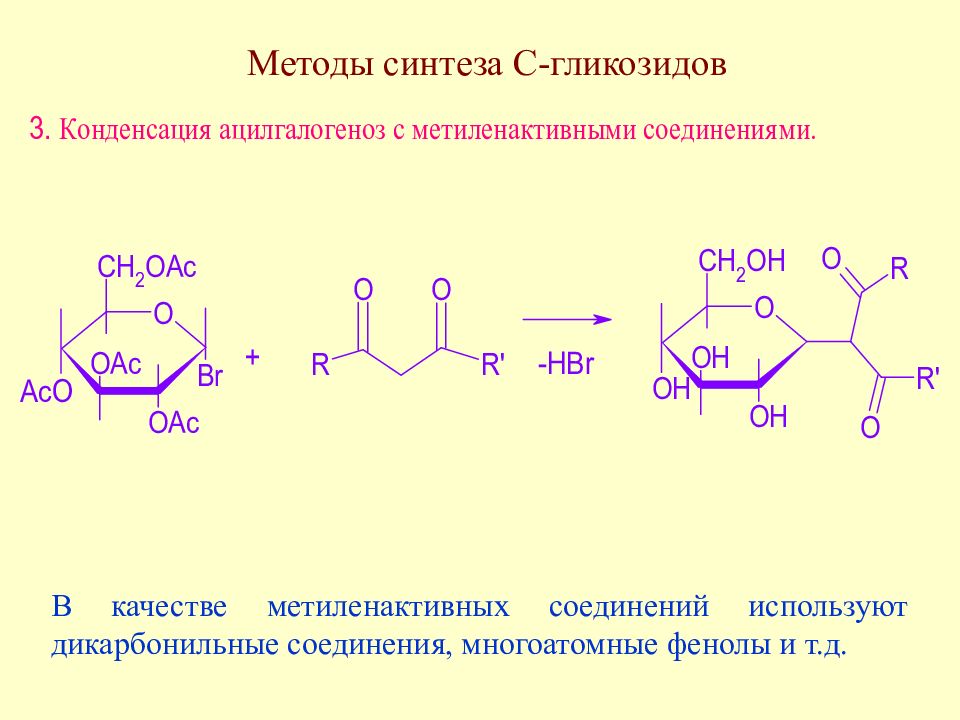
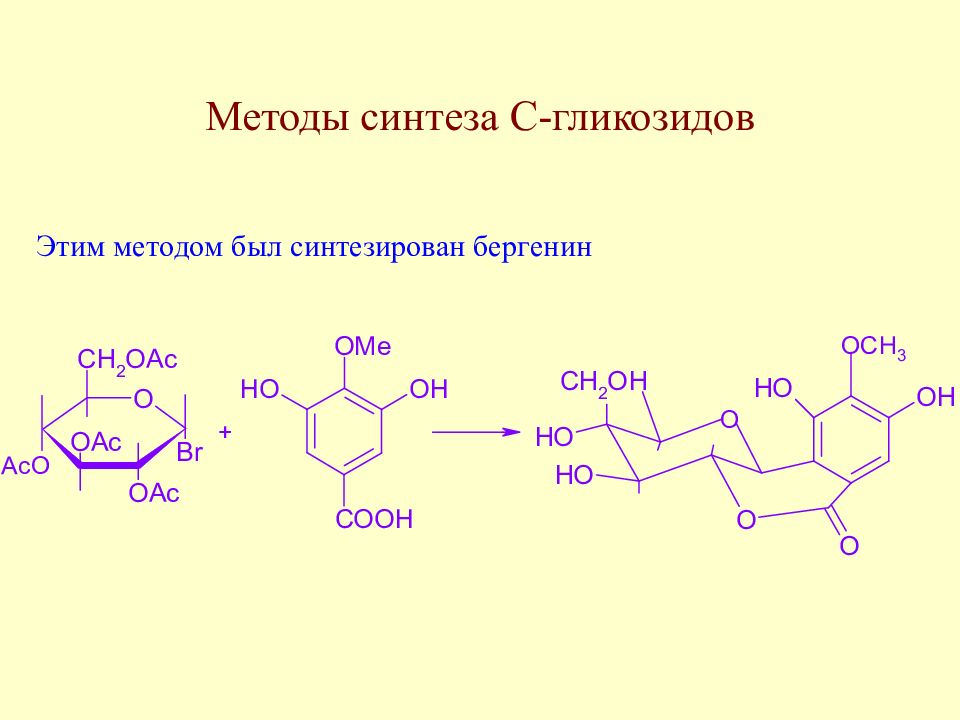
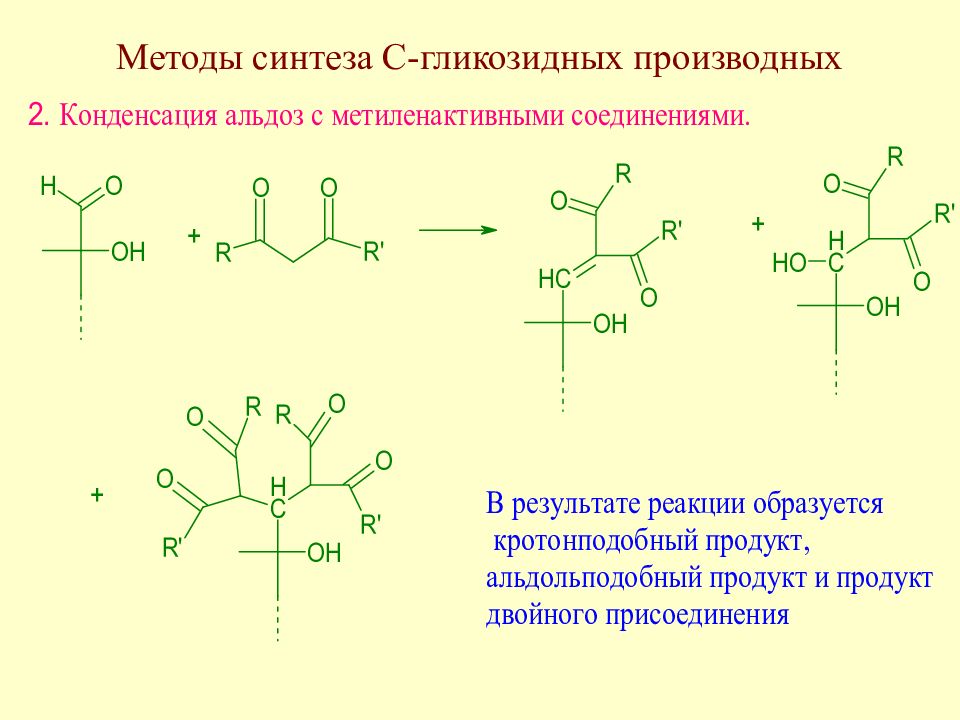
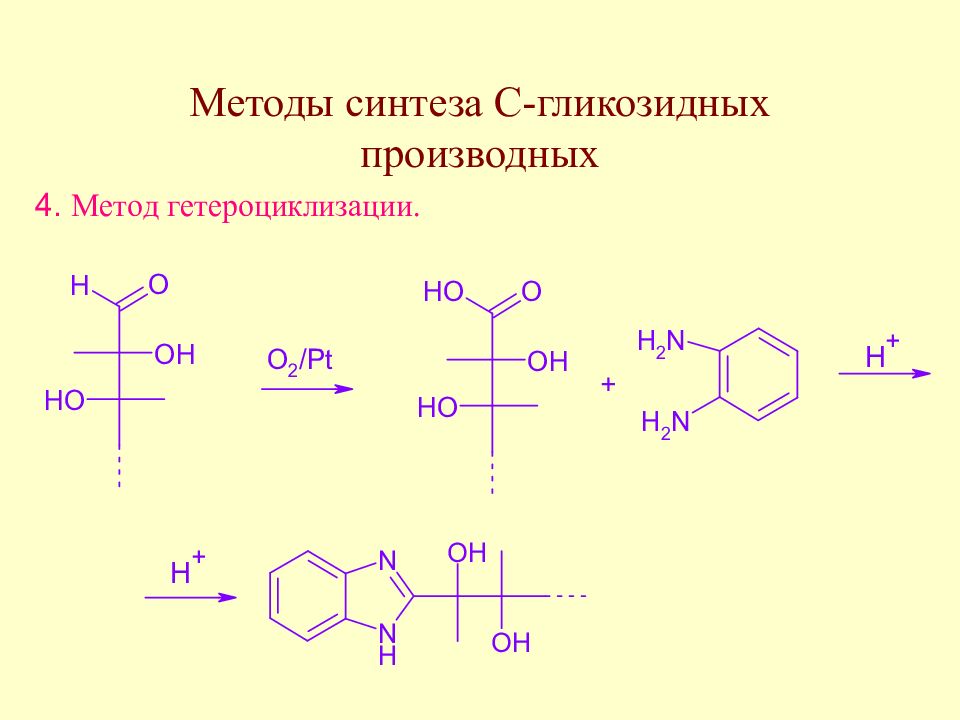
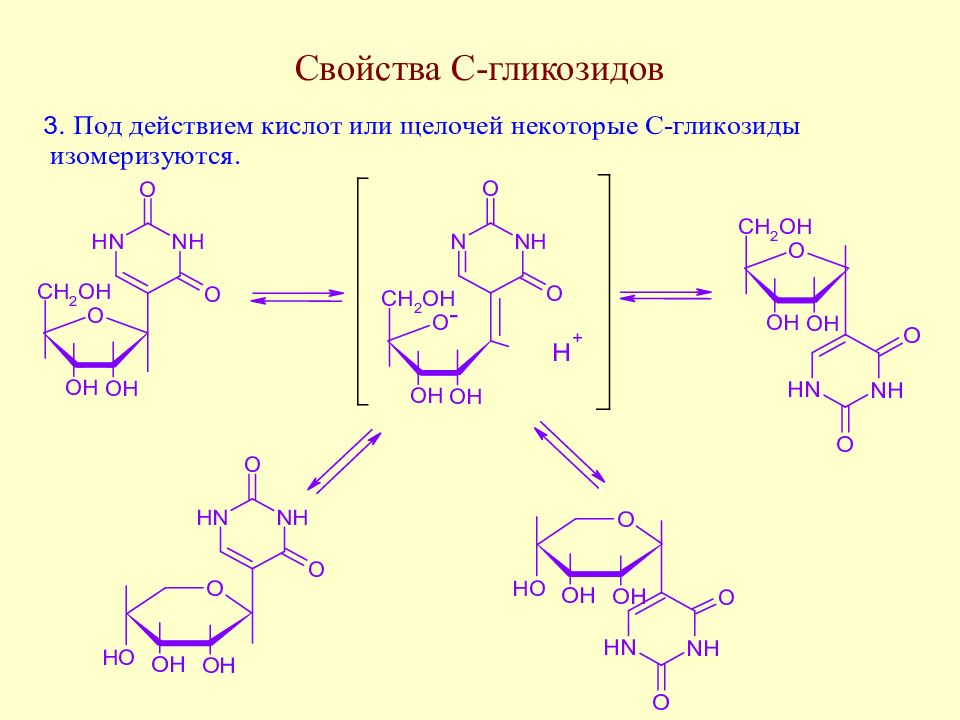
Слайд 175: Методы синтеза С-гликозидов
В качестве метиленактивных соединений используют дикарбонильные соединения, многоатомные фенолы и т.д.
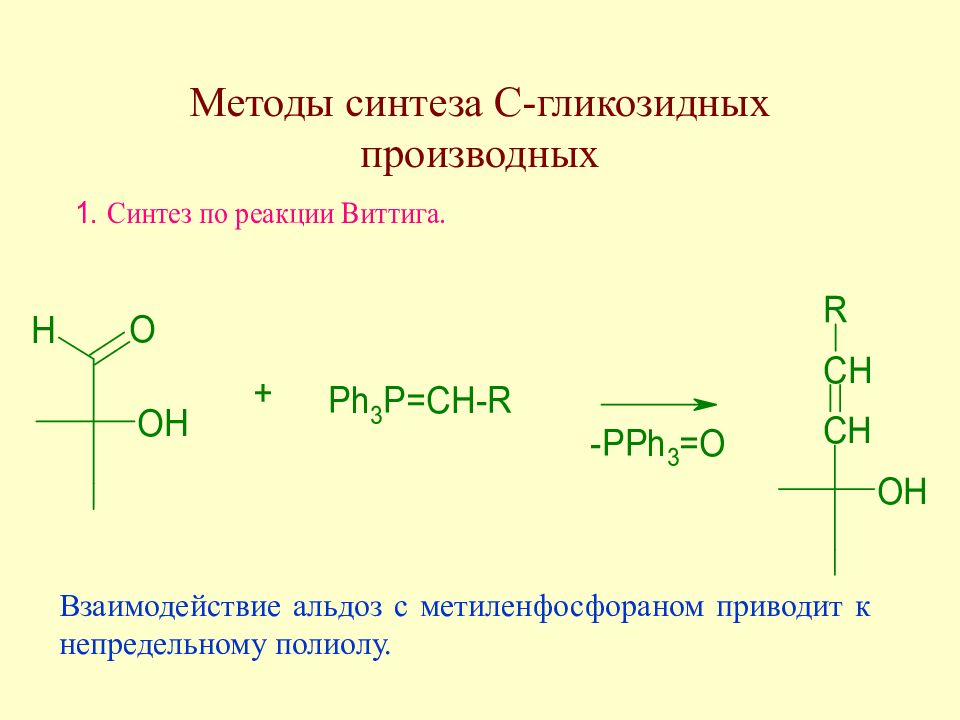
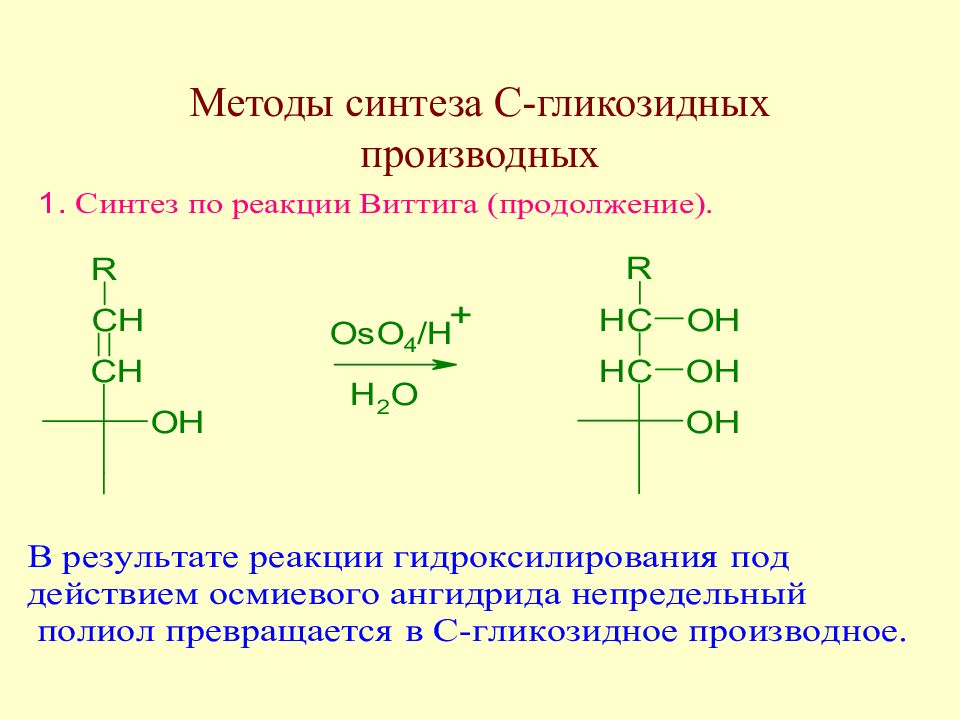
Слайд 177: Методы синтеза С-гликозидных производных
Взаимодействие альдоз с метиленфосфораном приводит к непредельному полиолу.
Слайд 180: Методы синтеза С-гликозидных производных
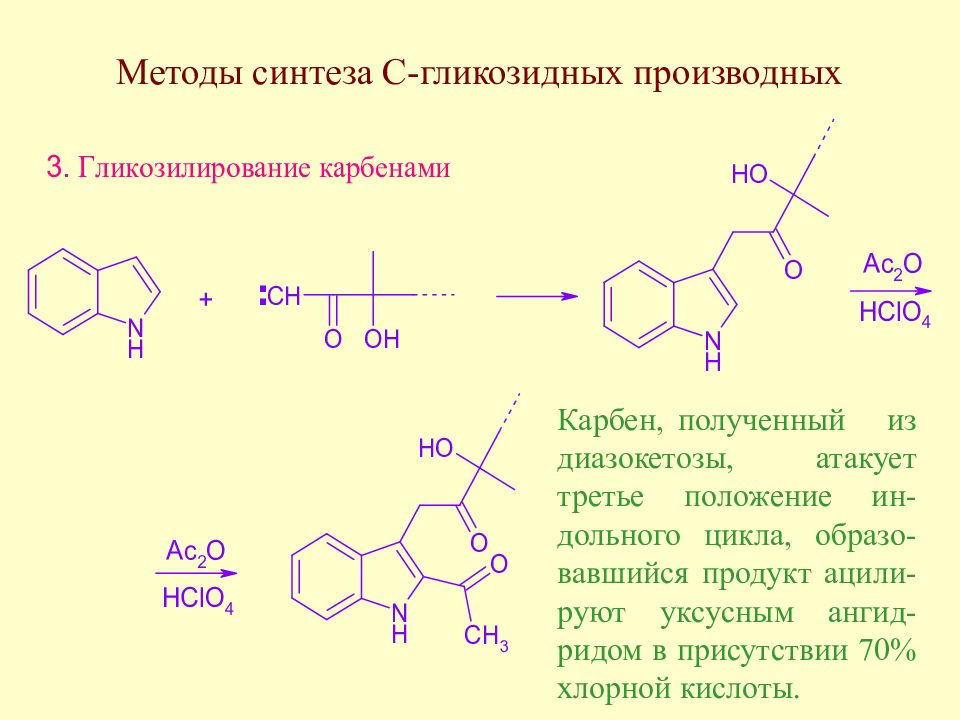
Карбен, полученный из диазокетозы, атакует третье положение ин-дольного цикла, образо-вавшийся продукт ацили-руют уксусным ангид-ридом в присутствии 70% хлорной кислоты.
Слайд 181: Методы синтеза С-гликозидных производных
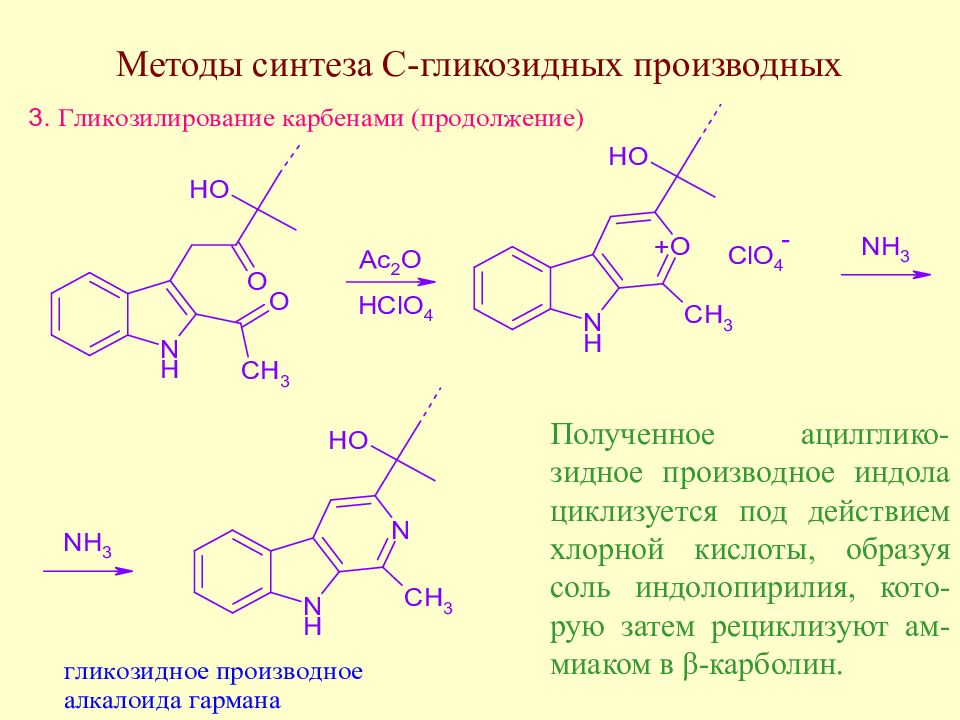
Полученное ацилглико-зидное производное индола циклизуется под действием хлорной кислоты, образуя соль индолопирилия, кото-рую затем рециклизуют ам-миаком в β-карболин.