Слайд 2
А + В = С + D Условная реакция Чем быстрее происходит процесс изменения концентраций веществ, тем больше скорость химической реакции.
Слайд 3
Δ n Для того чтобы определить скорость химической реакции нужно знать изменение химического количества ∆ n одного из веществ, которое произошло за определённый промежуток времени ∆t, и объём сосуда V, в котором протекает данная реакция. V ∙ Δ t Математическое выражение скорости химической реакции в указанном промежутке времени
Слайд 4
Скорость химической реакции — это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени, в течение которого произошло данное изменение. _______ n (вещества) V = с (вещества) _______ моль л ∙ с ___ Δ с Δ t ν = ±
Слайд 5
Гомогенные реакции — это реакции, протекающие в однородной среде, т.е. там, где нет поверхности раздела реагирующих веществ. Гетерогенные реакции — это реакции, протекающие между веществами в неоднородной среде, т.е. там, где есть поверхность раздела реагирующих веществ.
Слайд 6
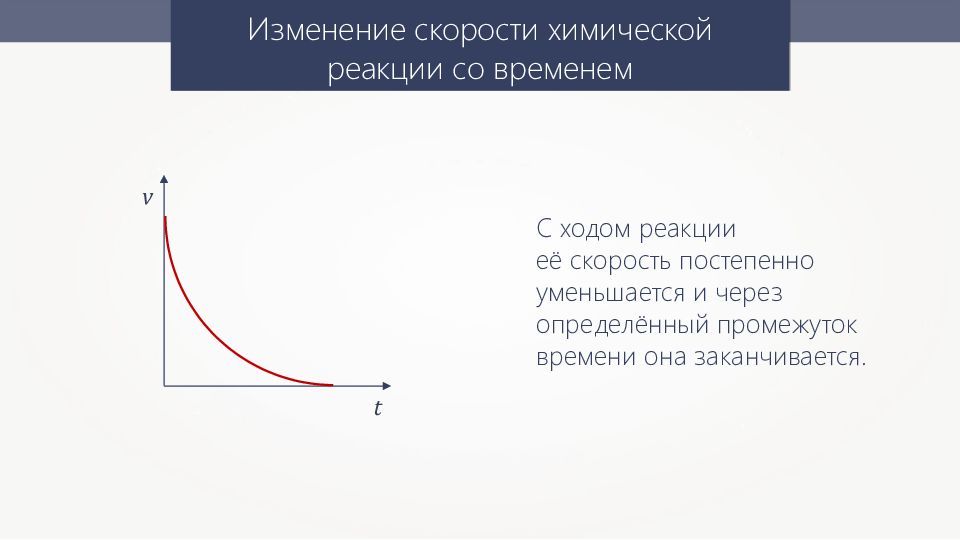
Изменение скорости химической реакции со временем v t С ходом реакции её скорость постепенно уменьшается и через определённый промежуток времени она заканчивается.
Слайд 7
Химическая кинетика — раздел химии, который изучает скорость химических реакций.
Слайд 8
Факторы, которые оказывают влияние на скорость химических реакций: – природа реагирующих веществ; – их концентрация; – температура; – использование катализаторов; – площадь поверхности соприкосновения реагентов.
Слайд 10
2. Температура H 2 SO 4 Свинец ( Pb ) C увеличением температуры скорость химических реакций увеличивается.
Слайд 11
Якоб Хендрик Вант-Гофф 1852–1911 гг. Голландский учёный. Установил количественную зависимость скорости реакций от температуры в 1884 году.
Слайд 12
Правило Вант-Гоффа: при изменении температуры (повышении либо понижении) на каждые 10°С скорость реакции соответственно изменяется (увеличивается или уменьшается) в 2–4 раза. Уравнение Вант-Гоффа ______ t 2 – t 1 10 ____ ν t ν t = γ 2 1
Слайд 13
γ — температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на 10°С. ______ t 2 – t 1 10 ____ ν t ν t = γ 2 1 Уравнение Вант-Гоффа
Слайд 14
3. Концентрация исходных веществ Чем выше молярные концентрации исходных веществ, тем больше скорость химической реакции.
Слайд 15
К. Гульдберг и П. Вааге Зависимость скорости химической реакции от концентрации реагирующих веществ описана основным законом химической кинетики (закон действующих масс), который был сформулирован норвежскими учёными К. Гульдбергом и П. Вааге в 1867 г.
Слайд 16
Закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам. aA + bB → cC + dD v – скорость реакции; k – константа скорости химической реакции равная скорости химической реакции при концентрации реагирующих веществ 1 моль/л ; C A и C B – концентрации реагентов A и B; a и b – стехиометрические коэффициенты в уравнении реакции. v = k ∙ C A a ∙ C B b
Слайд 17
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий.
Слайд 18
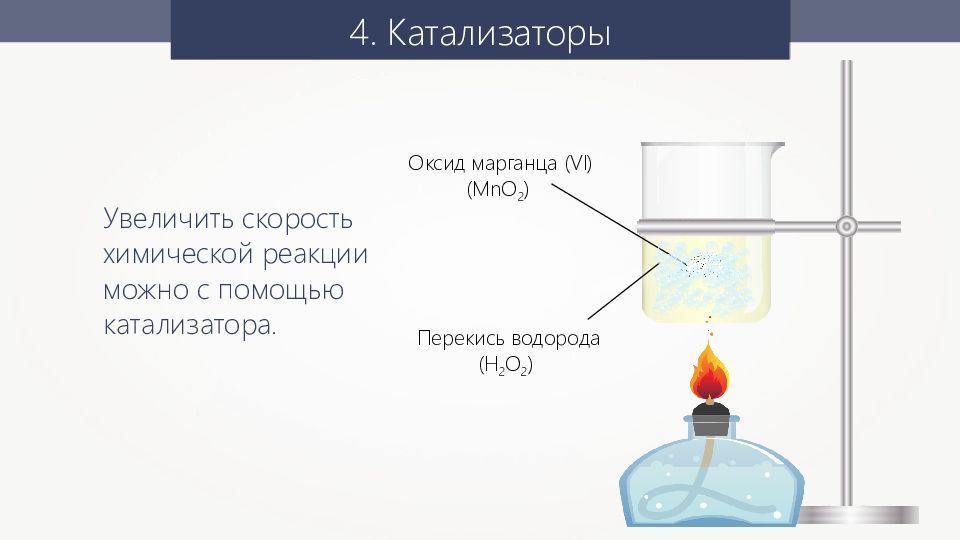
4. Катализаторы Увеличить скорость химической реакции можно с помощью катализатора. Перекись водорода ( H 2 О 2 ) Оксид марганца (VI) ( MnO 2 )
Слайд 19
Катализатор — вещество, которое увеличивает скорость химической реакции, но само при этом не расходуется и в конечные продукты не входит.
Слайд 20
Катализ — процесс изменения скорости химической реакции добавлением катализатора. Каталитические реакции — реакции с участием катализаторов.
Слайд 22
Ферменты действуют только в определённом интервале температур и определённой среде, что связано с их белковым происхождением.
Последний слайд презентации: Химические реакции протекают с разной скоростью
5. Площадь поверхности соприкосновения исходных веществ Соляная кислота ( HCl) Чем больше площадь поверхности соприкосновения исходных веществ, тем больше частиц веществ сталкиваются друг с другом, тем выше скорость их взаимодействия, т.е. скорость реакции.