Первый слайд презентации
1 "Химическая кинетика и катализ" Кафедра общей и медицинской химии
Слайд 4
4 ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ Химическая кинетика - учение о скорости химических реакций и зависимости ее от различных факторов - природы и концентрации реагирующих веществ, давления, температуры, катализаторов. Взрыв - тысячные доли секунды Управление химическим процессом является главной задачей химической кинетики. Ржавчина - несколько часов Антрацит - сотни, тысячи лет.
Слайд 5
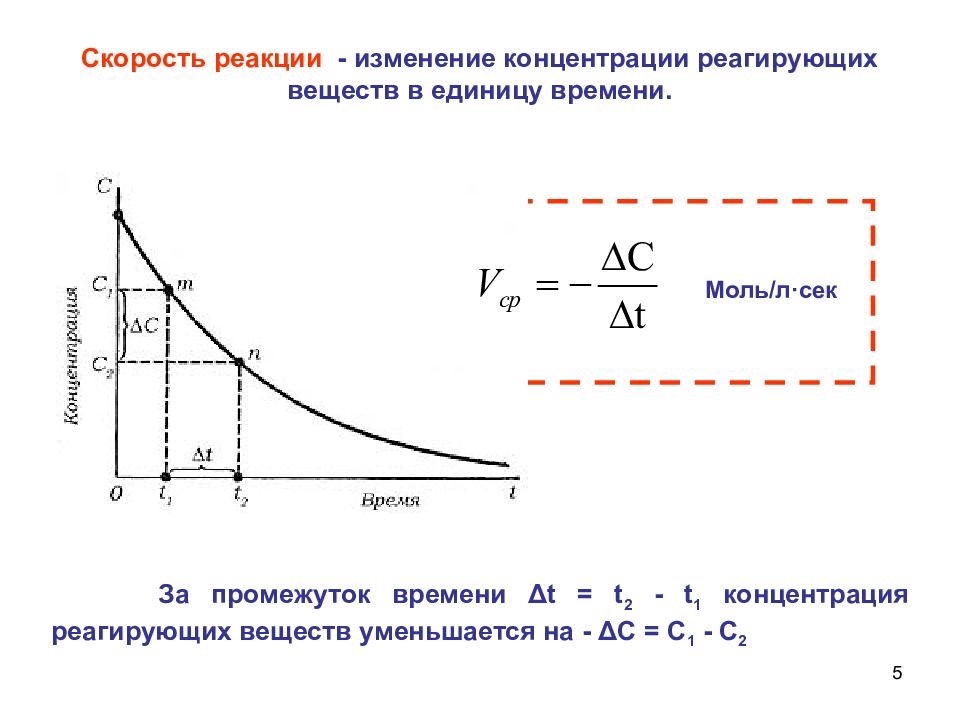
5 Скорость реакции - изменение концентрации реагирующих веществ в единицу времени. За промежуток времени Δ t = t 2 - t 1 концентрация реагирующих веществ уменьшается на - Δ С = С 1 - С 2 Моль/л · сек
Слайд 6
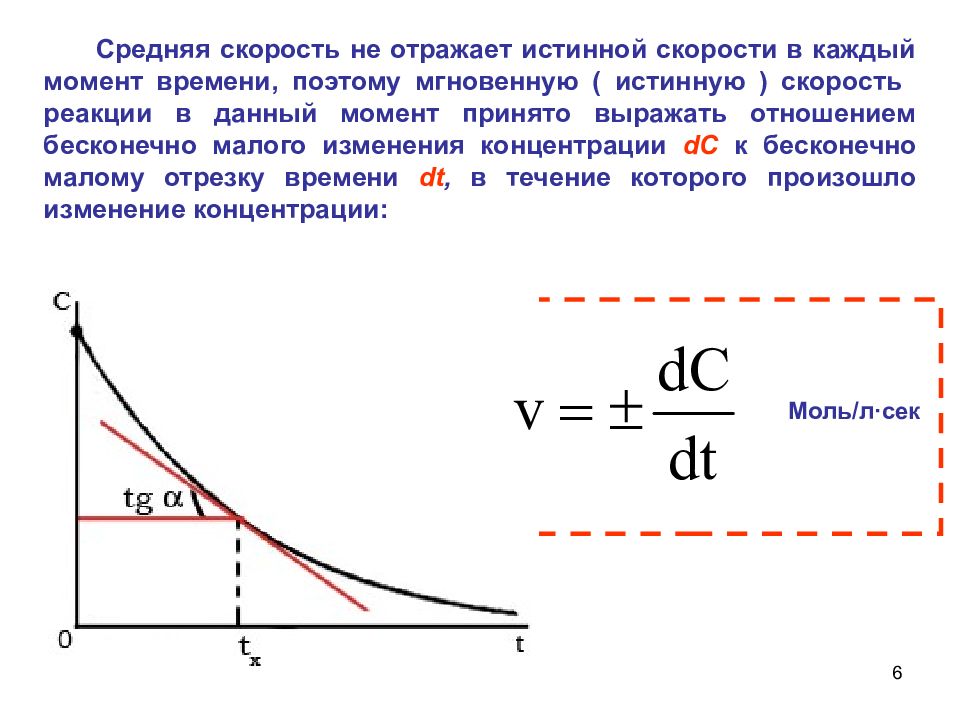
6 Средняя скорость не отражает истинной скорости в каждый момент времени, поэтому мгновенную ( истинную ) скорость реакции в данный момент принято выражать отношением бесконечно малого изменения концентрации dC к бесконечно малому отрезку времени dt, в течение которого произошло изменение концентрации: Моль/л · сек
Слайд 7
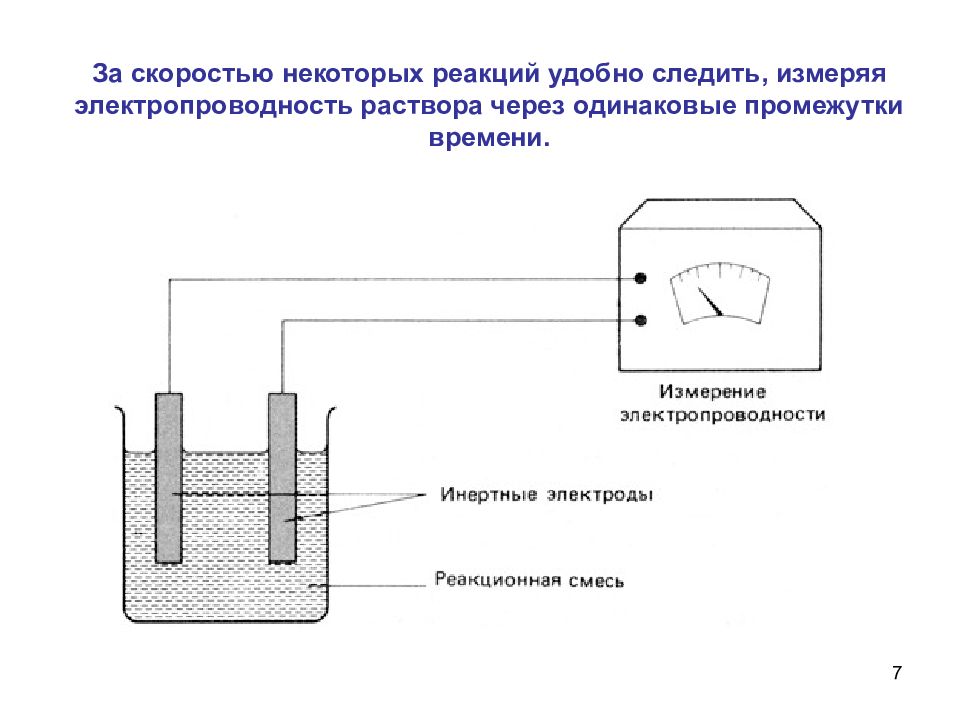
7 За скоростью некоторых реакций удобно следить, измеряя электропроводность раствора через одинаковые промежутки времени.
Слайд 8
8 Классификация химических реакций Молекулярность: Важно, чтобы столкновение произошло теми частями молекулы, которые способны реагировать – стерический (пространственный) фактор! Бимолекулярные - в элементарном акте взаимодействия встречаются две молекулы. Мономолекулярные - в элементарном акте взаимодействия участвует одна молекула
Слайд 9
9 Влияние стерического фактора при взаимодействии Н 2 и I 2 Одновременная встреча в элементарном акте трех молекул случается довольно редко. Реально реакции протекают через две и большее число промежуточных стадий моно- или бимолекулярных реакций. Тримолекулярные – в элементарном акте взаимодействия участвуют три молекулы.
Слайд 10
10 Скорость реакции, в целом, определяется лимитирующей стадией - самой медленной стадией реакции.
Слайд 11
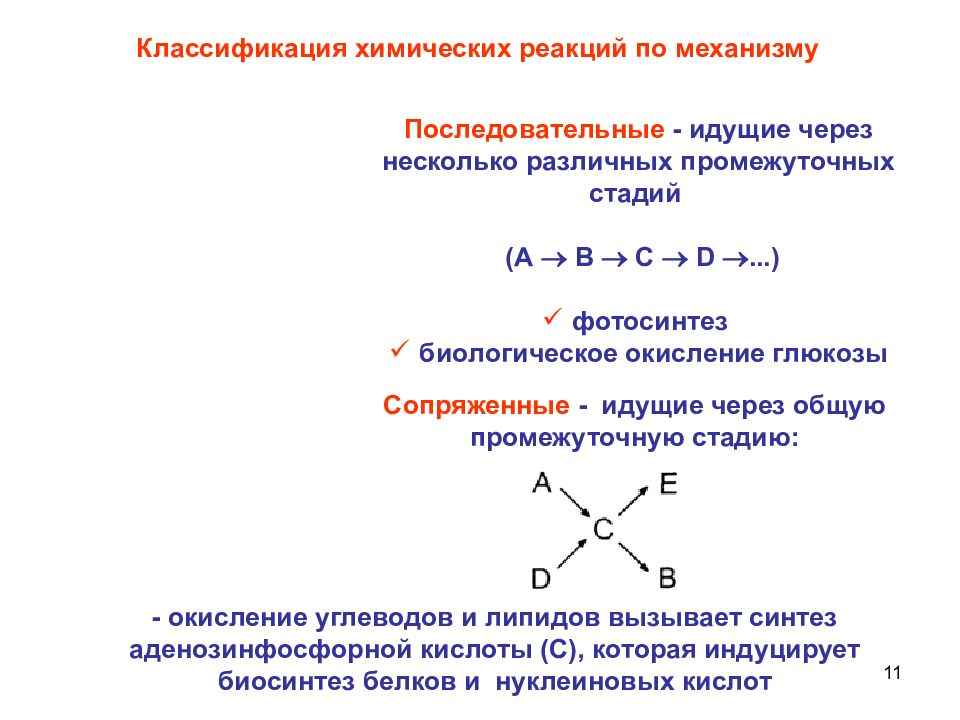
11 Сопряженные - идущие через общую промежуточную стадию: Классификация химических реакций по механизму Последовательные - идущие через несколько различных промежуточных стадий (А В С D ...) фотосинтез биологическое окисление глюкозы - окисление углеводов и липидов вызывает синтез аденозинфосфорной кислоты (С), которая индуцирует биосинтез белков и нуклеиновых кислот
Слайд 12
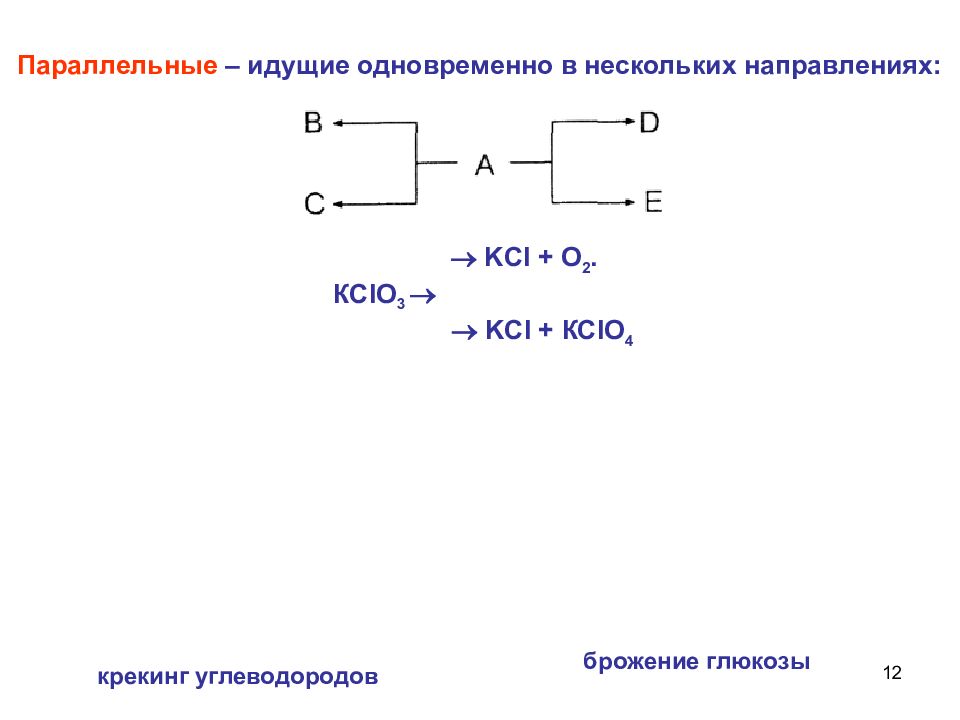
12 Параллельные – идущие одновременно в нескольких направлениях: KCl + О 2. КС lO 3 KCl + КС lO 4 крекинг углеводородов брожение глюкозы
Слайд 13
13 Цепные - стадии превращения исходных соединений в продукты многократно повторяются: Окончил Петроградский университет в 1917 году. Разработанная им теория цепных реакций позволила управлять химическими процессами: ускорять, замедлять, подавлять вовсе, обрывать на любой желаемой стадии. Нобелевская премия (1956 г.). Николай Семенов (15.04.1896 -25.09.1986)
Слайд 14
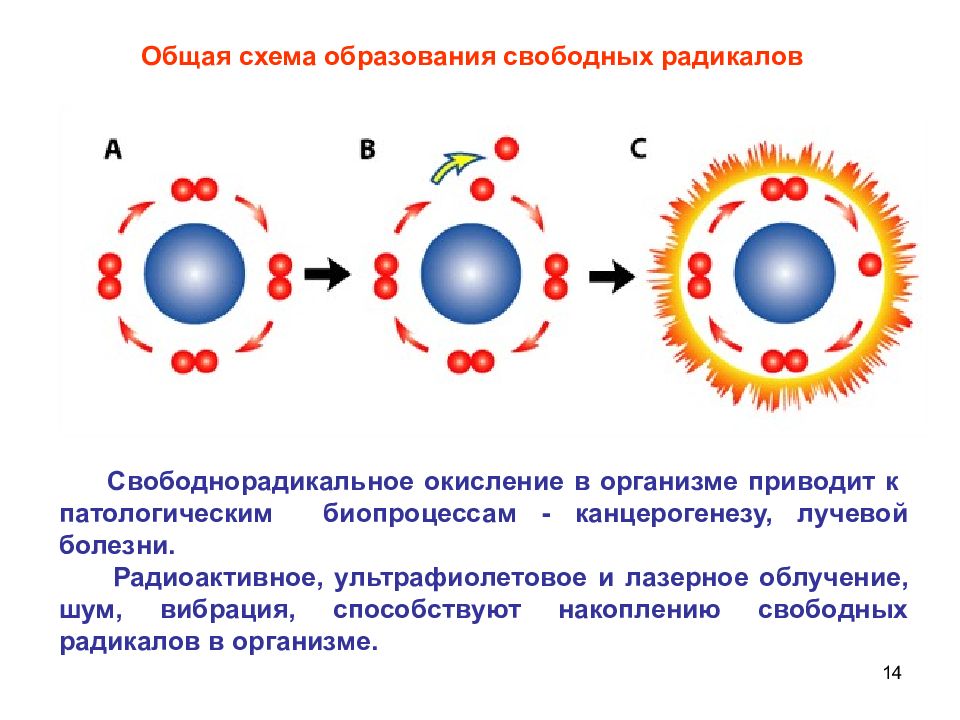
14 Свободнорадикальное окисление в организме приводит к патологическим биопроцессам - канцерогенезу, лучевой болезни. Радиоактивное, ультрафиолетовое и лазерное облучение, шум, вибрация, способствуют накоплению свободных радикалов в организме. Общая схема образования свободных радикалов
Слайд 15
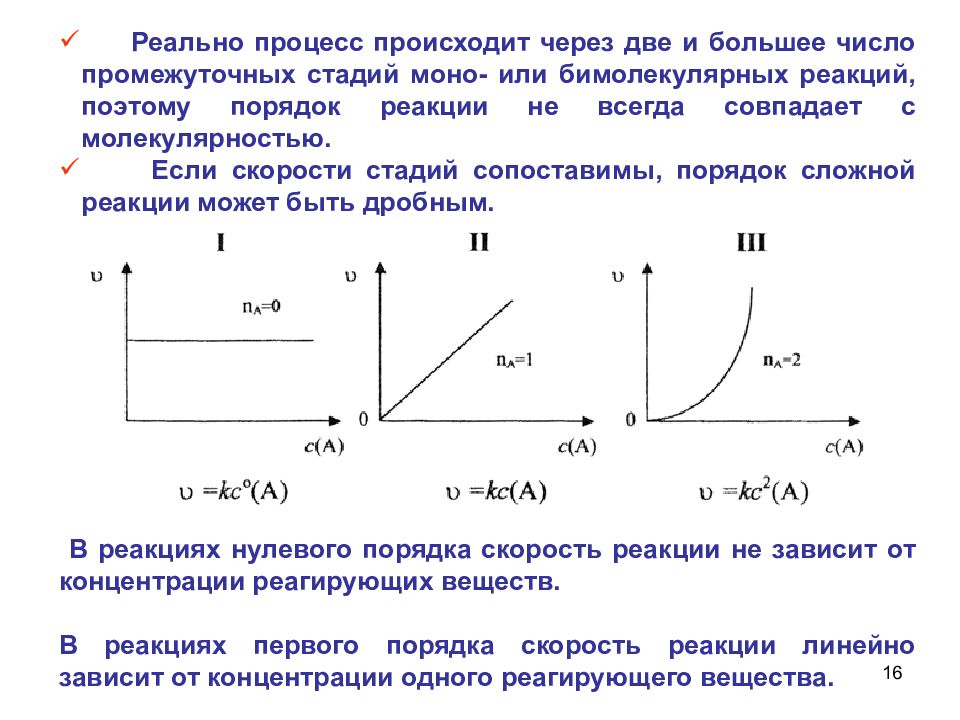
15 Порядок реакции Порядок реакции - сумма показателей степеней, с которыми концентрации реагентов входят в экспериментально найденное кинетическое уравнение Стехиометрическое уравнение реакции описывает процесс в целом и не отражает истинного механизма реакции. n = n 1 + n 2
Слайд 16
16 В реакциях нулевого порядка скорость реакции не зависит от концентрации реагирующих веществ. В реакциях первого порядка скорость реакции линейно зависит от концентрации одного реагирующего вещества. Реально процесс происходит через две и большее число промежуточных стадий моно- или бимолекулярных реакций, поэтому порядок реакции не всегда совпадает с молекулярностью. Если скорости стадий сопоставимы, порядок сложной реакции может быть дробным.
Слайд 17
17 ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННЫХ РЕАКЦИЙ природа реагирующих веществ концентрация реагентов температура катализатор
Слайд 18
18 ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ Скорость химической реакции зависит от природы химических соединений, подобно тому, как скорость физических процессов определяется свойствами веществ. Например, скорость истечения жидкостей зависит от их вязкости.
Слайд 19
19 Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: Природу реагирующих веществ учитывает константа скорости реакции k
Слайд 20
20 Влияние концентрации реагентов Скорость химической реакции зависит от концентрации реагирующих веществ - чем выше концентрация, тем больше скорость реакции, что связано с увеличением числа эффективных соударений молекул.
Слайд 21
21 Закон действия масс ( ЗДМ ) Скорость гомогенной реакции при постоянной температуре пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам. k - константа скорости химической реакции ГУЛЬДБЕРГ Като Максимилиан (2.08.1836-14.1.1902) Основные научные работы – в области химической кинетики и термодинамики.
Слайд 22
22 k - константа скорости химической реакции (удельная скорость реакции) численно равна скорости химической реакции при концентрациях всех реагирующих веществ, равных 1 моль/л и зависит от: природы реагирующих веществ температуры катализатора k не зависит от концентрации реагирующих веществ!
Слайд 23
23 Скорость образования желтого осадка А s 2 S 3 при пропускании H 2 S через растворы тиосульфата и арсената натрия разных исходных концентраций С 1 > С 2
Слайд 24
24 Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия, так как они учитываются величинами константы скорости гетерогенной реакции: - реакция нулевого порядка - реакция первого порядка
Слайд 25
25 Вместе с тем, чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
Слайд 27
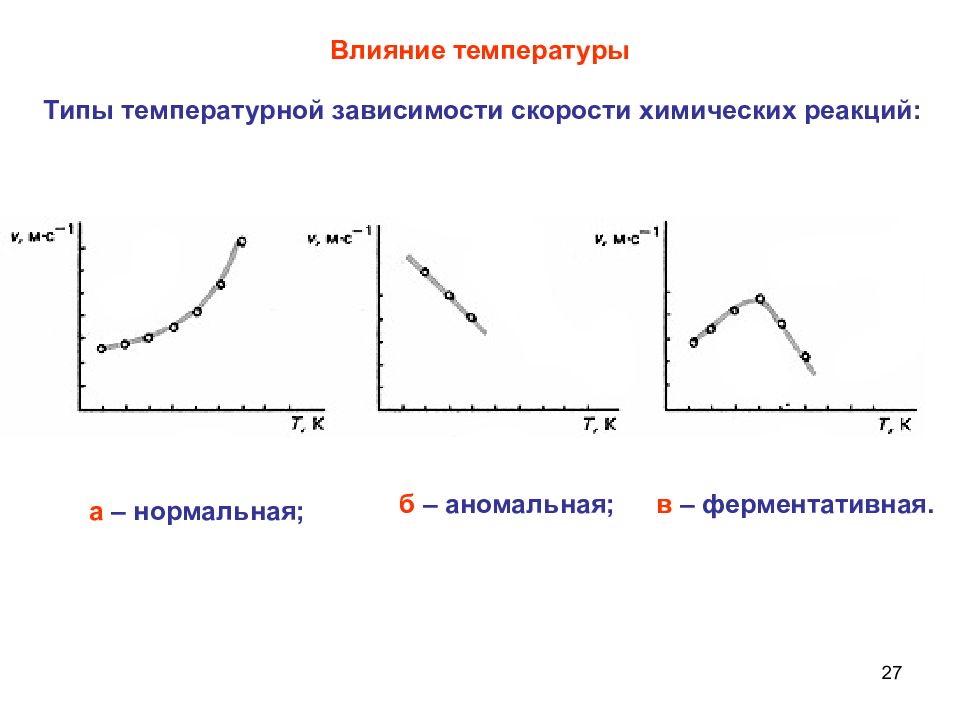
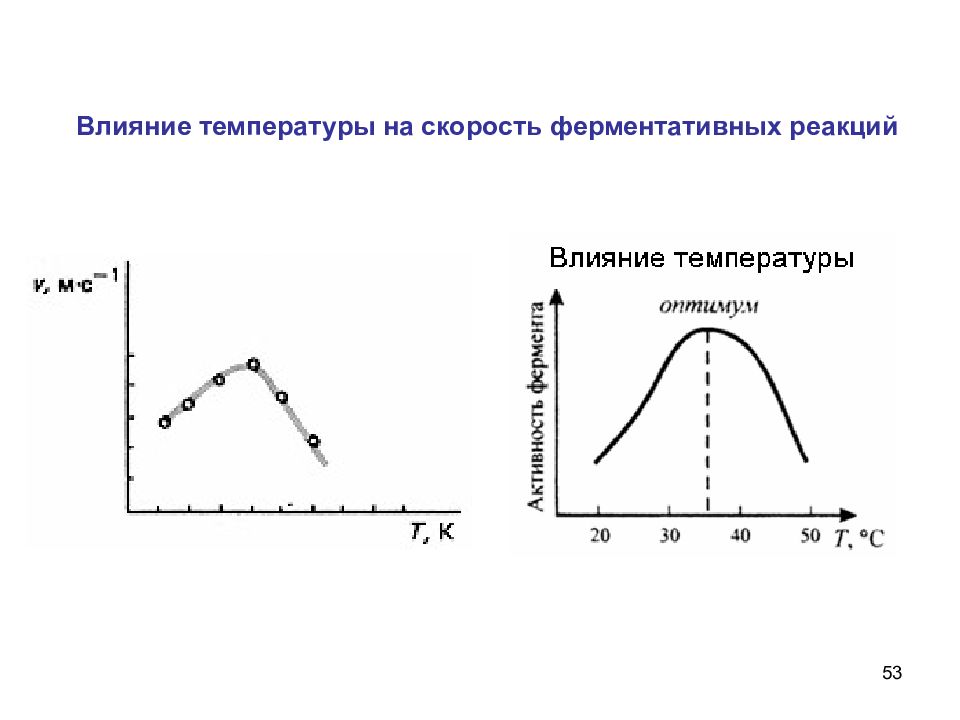
27 Влияние температуры в – ферментативная. 36 0 С Типы температурной зависимости скорости химических реакций: а – нормальная; б – аномальная;
Слайд 28
28 В отличие от большинства химиков своего времени, Вант-Гофф имел основательную математическую подготовку. Она пригодилась ученому, когда он взялся за сложную задачу изучения скорости реакций и условий, влияющих на химическое равновесие. В 1901 г. Вант-Гофф стал первым лауреатом Нобелевской премии по химии, которая была ему присуждена «в знак признания огромной важности открытия им законов химической динамики и осмотического давления в растворах». Якоб Вант-Гофф (30.08.1852 – 1.03.1911) Его теоретические работы внесли существенный вклад в развитие учения о химической кинетике, химическом равновесии, о свойствах растворов. Создал оригинальный метод вычисления химического сродства, разработал основы стереохимии. Закон Вант-Гоффа
Слайд 29
29 Невольно большую роль в популяризации новых взглядов Вант-Гоффа принадлежала профессору Г. Кольбе из Лейпцига. В резкой форме он высказал свои замечания по поводу статьи голландского ученого: "Какой-то доктор Я.Г. Вант-Гофф из Ветеринарного института в Утрехте, видимо, не имеет вкуса к точным химическим исследованиям. Ему значительно удобнее воссесть на Пегаса (вероятно, взятого напрокат в Ветеринарном институте) и провозгласить в своей "Химии в пространстве", что, как ему показалось во время смелого полета к химическому Парнасу, атомы расположены в межпланетном пространстве". Естественно, каждого, кто прочел эту резкую отповедь, заинтересовала теория Вант-Гоффа. Так началось ее быстрое распространение в научном мире. В 1845 году Георг Кольбе синтезировал уксусную кислоту
Слайд 30
30 Закон Вант-Гоффа При повышении температуры на 10° скорость химической реакции возрастает в два-четыре раза. Если повысить температуру на 100°, то скорость реакции увеличится в 1024 раза: Температурный коэффициент изменяется от 2 до 4. Для биохимических реакций = 7-9.
Слайд 31
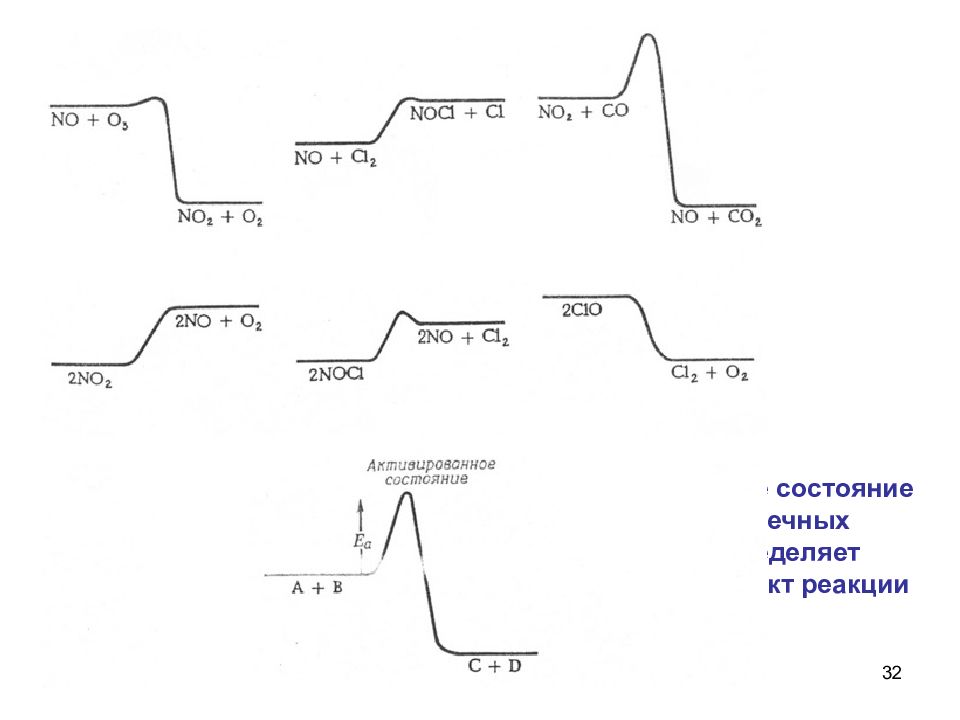
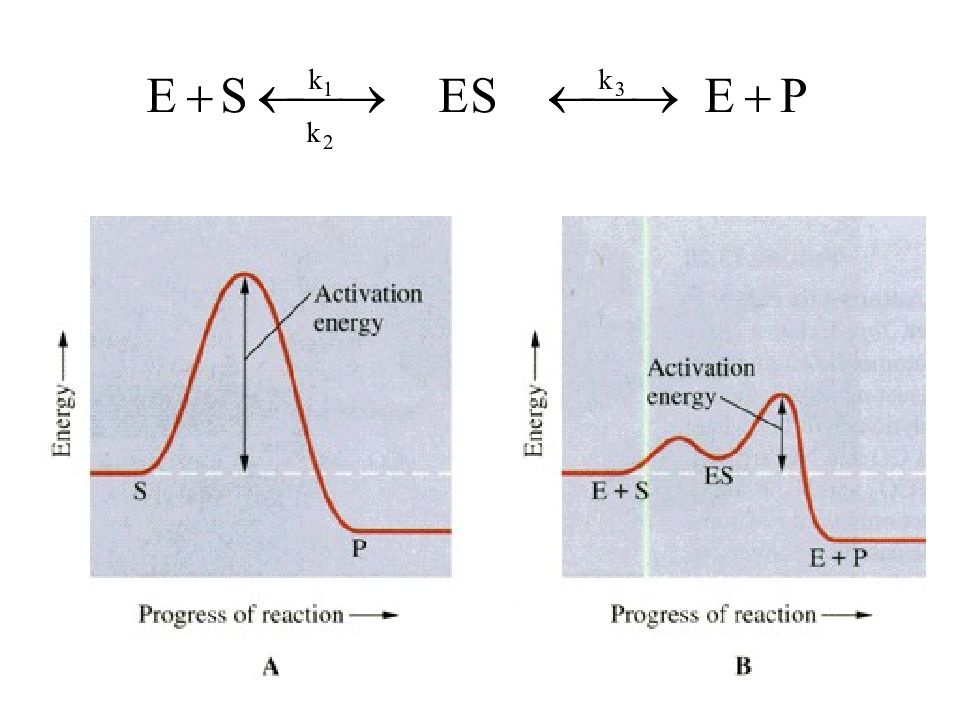
31 Рост скорости реакции с температурой объясняется тем, что не всякое столкновение приводит к химическому превращению. Для осуществления реакции необходимо, чтобы молекулы обладали запасом энергии, достаточным для расшатывания тех связей, которые перестраиваются в ходе реакции (энергией активации Е) Химическая реакция напоминает туристский поход, маршрут которого проложен чрез вершину горы. Только сильные могут преодолеть вершину.
Слайд 32
32 Энергетическое состояние исходных и конечных продуктов определяет тепловой эффект реакции + Q - Q - Q - Q + Q + Q + Q
Слайд 33
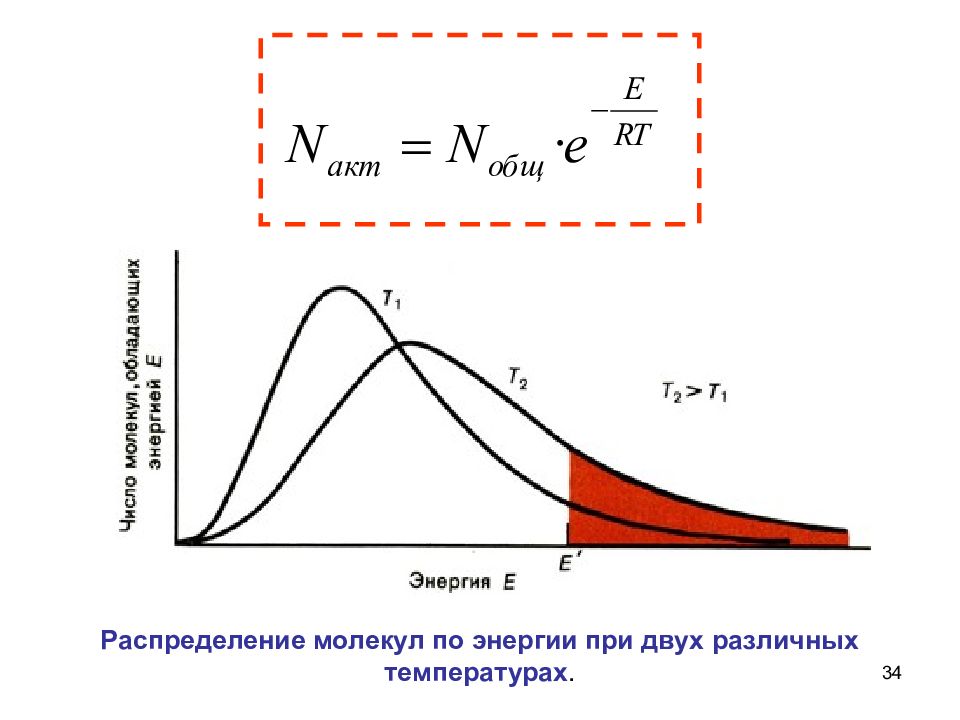
33 Зависимость числа активных молекул от температуры N a кт — число активных молекул N o 6щ — общее количество молекул, Е — энергия активации Уравнение Больцмана Людвиг Больцман (20.02.1844 – 05.09.1906)
Слайд 35
35 E — энергия активации К — константа скорости реакции при обычных условиях А о — число эффективных столкновений за 1 сек в единице объема Сванте Аррениус (19.02.1859-2.10.1927) В 1889 году впервые ввел понятие «энергия активации»; вывел уравнение зависимости скорости реакции от чистоты столкновения молекул, температуры и энергии активации; Нобелевская премия за 1903 г. Уравнение Аррениуса
Слайд 36
36 Графический способ нахождения E a и A o из уравнения Аррениуса Математический способ нахождения E a из уравнения Аррениуса
Слайд 37
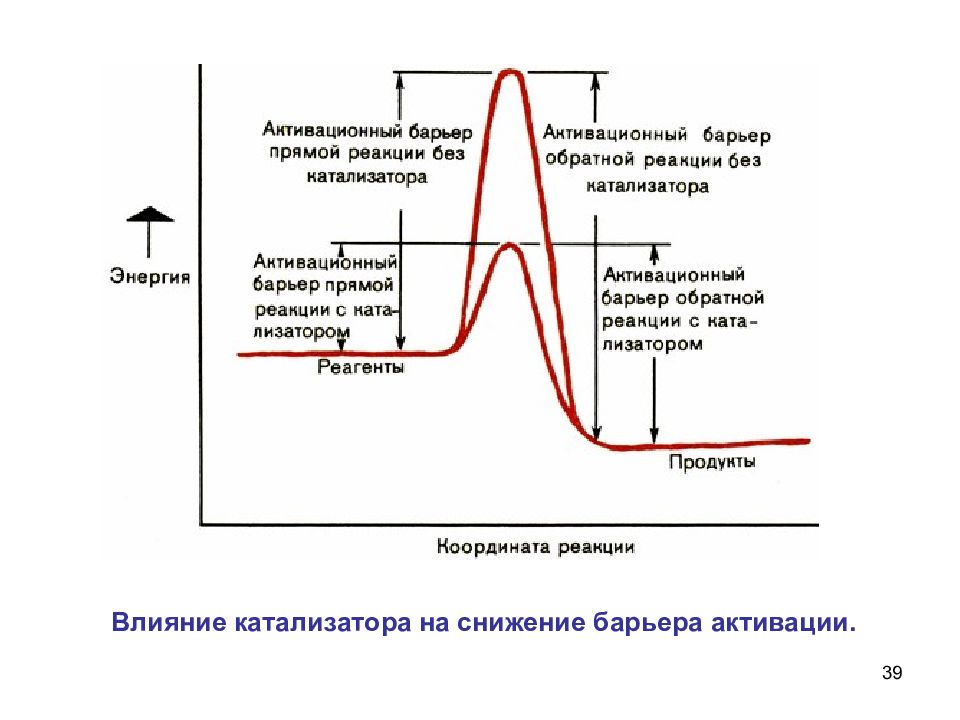
37 Катализаторы - вещества, увеличивающие скорость химических реакций Ингибиторы - вещества, замедляющие скорость химических реакций Влияние катализатора Положительный катализатор ускоряет реакцию, отрицательный замедляет ее.
Слайд 38
38 Катализатор понижает энергетический барьер, его могут преодолеть и молекулы, обладающие малой энергией Роль катализатора заключается в понижении энергии активации данной реакции за счет того, что он создает новый путь ее протекания.
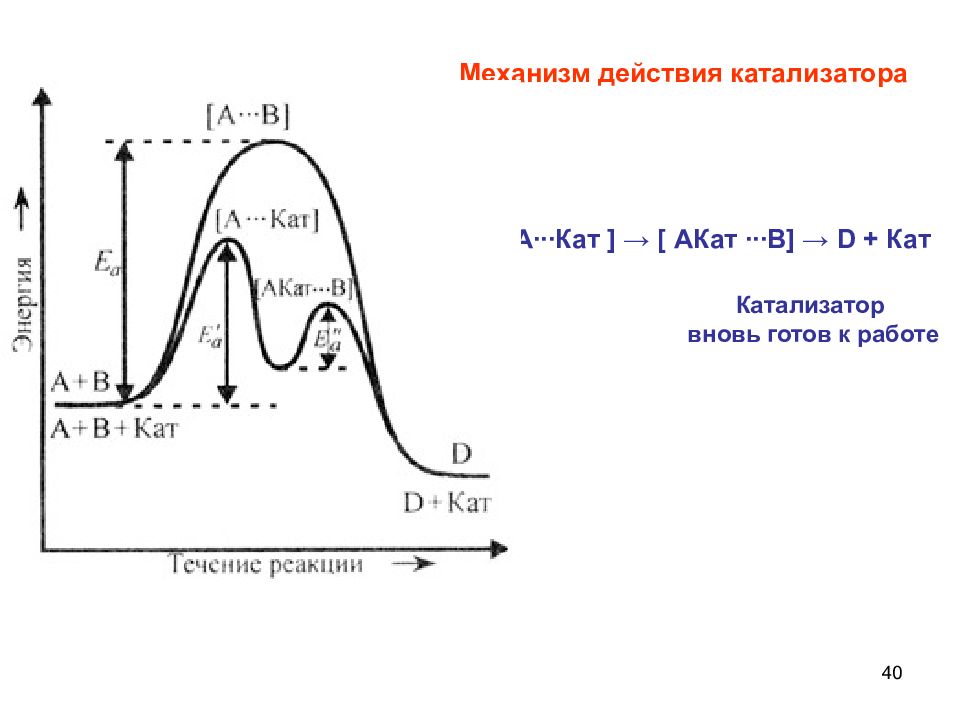
Слайд 40
40 Катализатор вновь готов к работе Механизм действия катализатора А + Кат → [ А∙∙∙Кат ] → [ АКат ∙∙∙В ] → D + Кат
Слайд 41
41 Из одного вещества можно получить различные продукты в зависимости от катализатора
Слайд 45
45 Ферменты (энзимы) – белковые молекулы, которые катализируют химические реакции в живых системах Отличия от химического катализа 1. Высокая каталитическая активность, в миллионы раз превосходящая активность химических катализаторов: 1 моль сахарозы способен расщепить за 1 сек 1000 моль свекловичного сахара 1 г пепсина расщепляет 50 кг яичного белка 1 г кристаллического ренина свертывает 72 т молока 1 г пероксидазы проявляет активность при разбавлении в 500 000 кг воды. Ферментативный катализ
Слайд 46
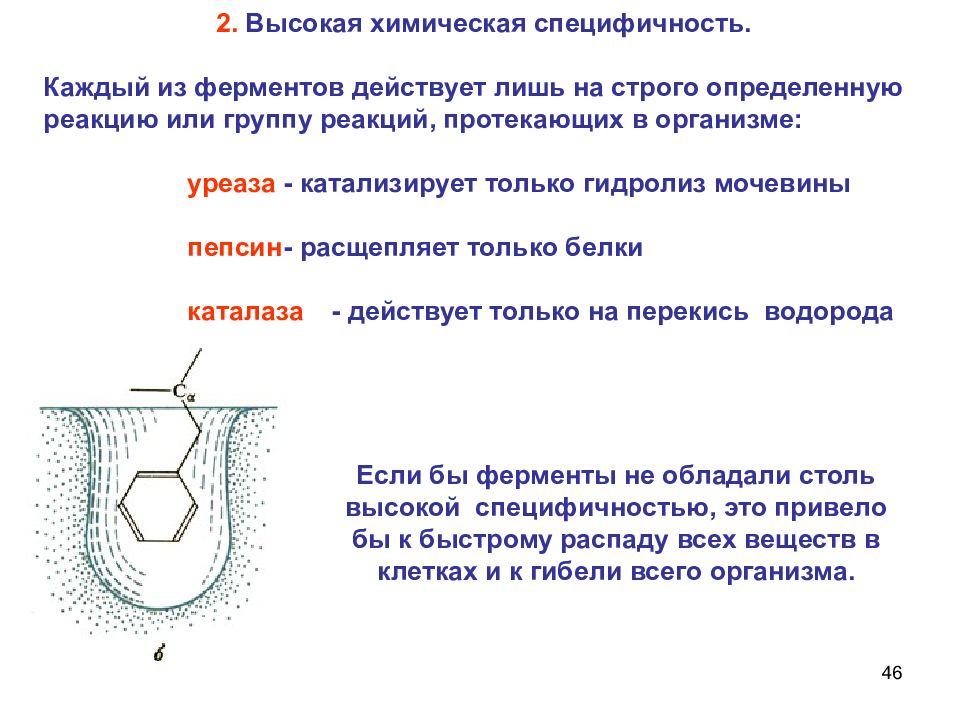
46 2. Высокая химическая специфичность. Каждый из ферментов действует лишь на строго определенную реакцию или группу реакций, протекающих в организме: уреаза - катализирует только гидролиз мочевины пепсин - расщепляет только белки каталаза - действует только на перекись водорода Если бы ферменты не обладали столь высокой специфичностью, это привело бы к быстрому распаду всех веществ в клетках и к гибели всего организма.
Слайд 47
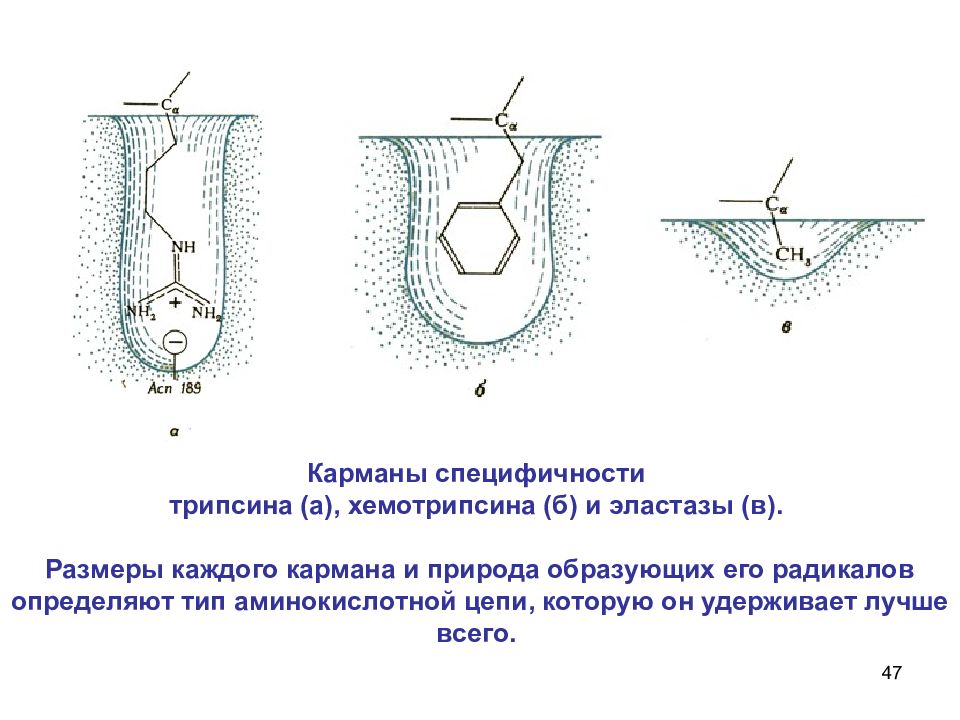
47 Карманы специфичности трипсина (а), хемотрипсина (б) и эластазы (в). Размеры каждого кармана и природа образующих его радикалов определяют тип аминокислотной цепи, которую он удерживает лучше всего.
Слайд 48
48 В организме человека одновременно функционирует около 1000 различных ферментов.
Слайд 49
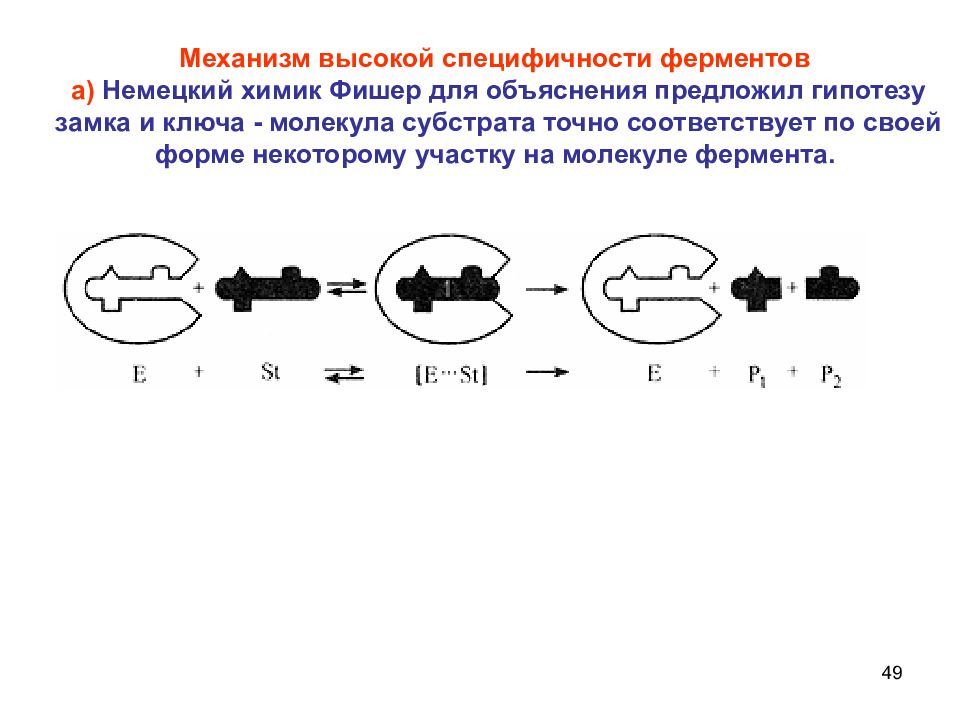
49 Механизм высокой специфичности ферментов а) Немецкий химик Фишер для объяснения предложил гипотезу замка и ключа - молекула субстрата точно соответствует по своей форме некоторому участку на молекуле фермента.
Слайд 50
50 б) Согласно гипотезе Кошланда, субстрат, присоединяясь к активному центру, изменяет его форму, обеспечивая таким образом идеальное их соответствие. Однако, в ряде случаев гипотеза Фишера не может объяснить некоторые факты.
Слайд 51
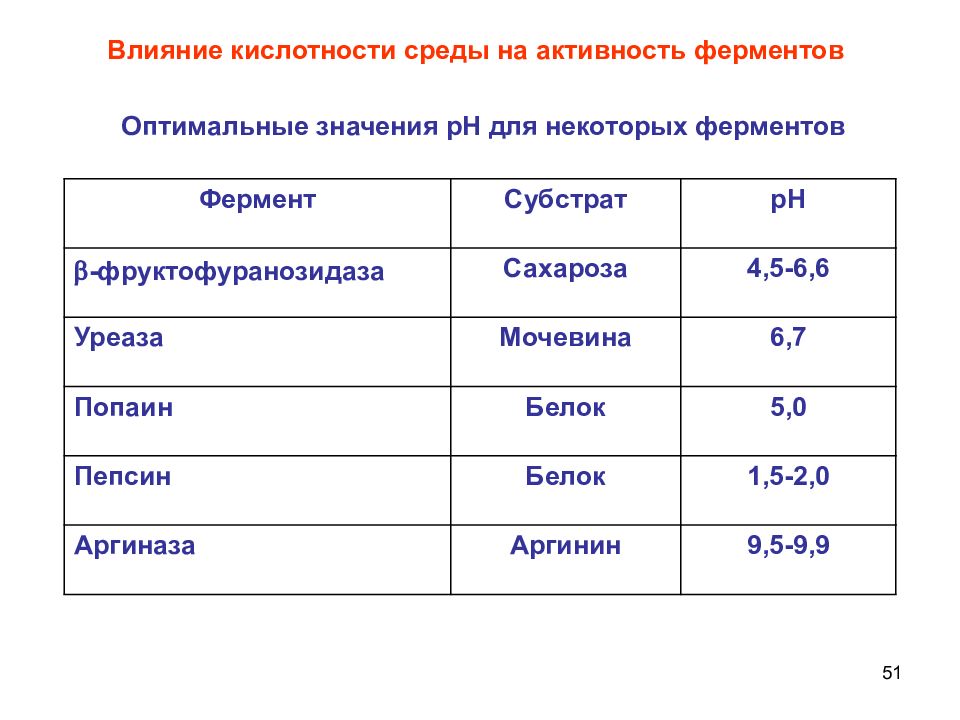
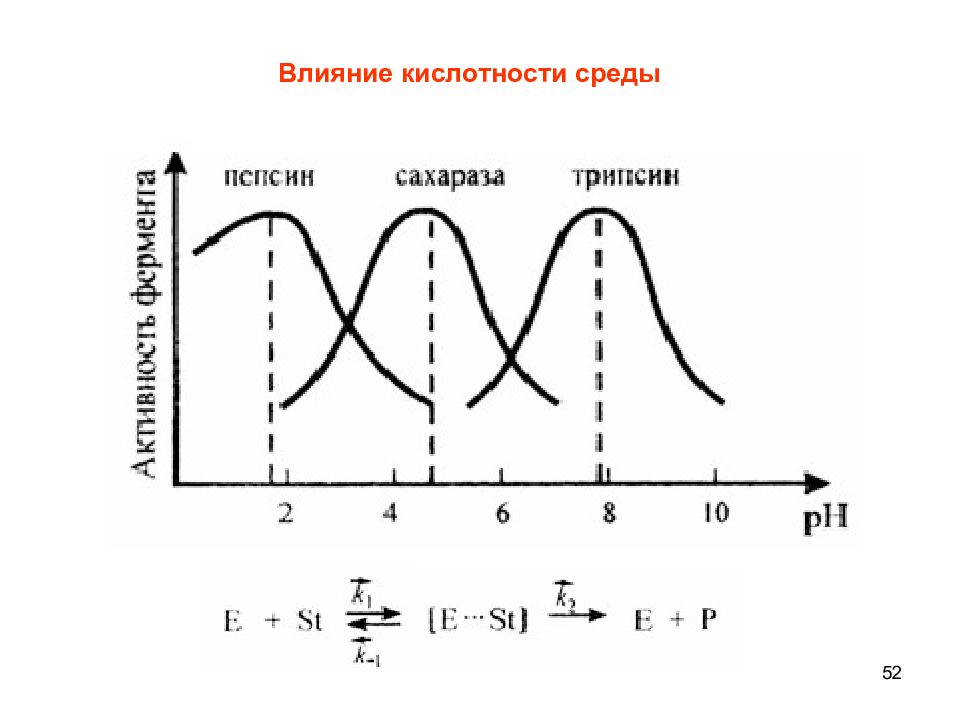
51 Влияние кислотности среды на активность ферментов Фермент Субстрат рН - фруктофуранозидаза Сахароза 4,5-6,6 Уреаза Мочевина 6,7 Попаин Белок 5,0 Пепсин Белок 1,5-2,0 Аргиназа Аргинин 9,5-9,9 Оптимальные значения рН для некоторых ферментов
Слайд 55
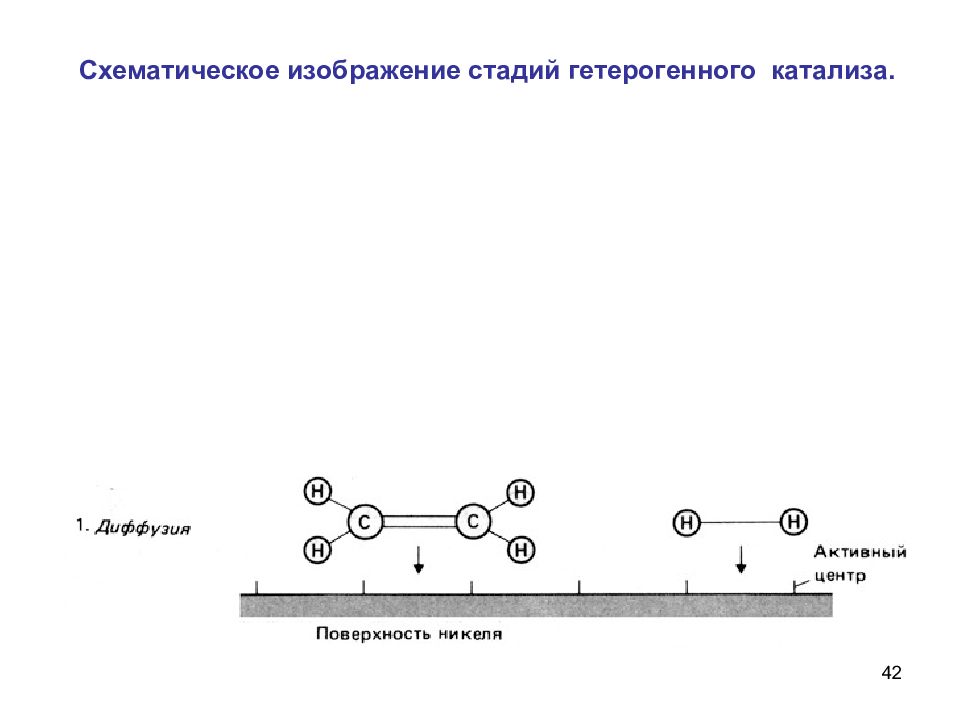
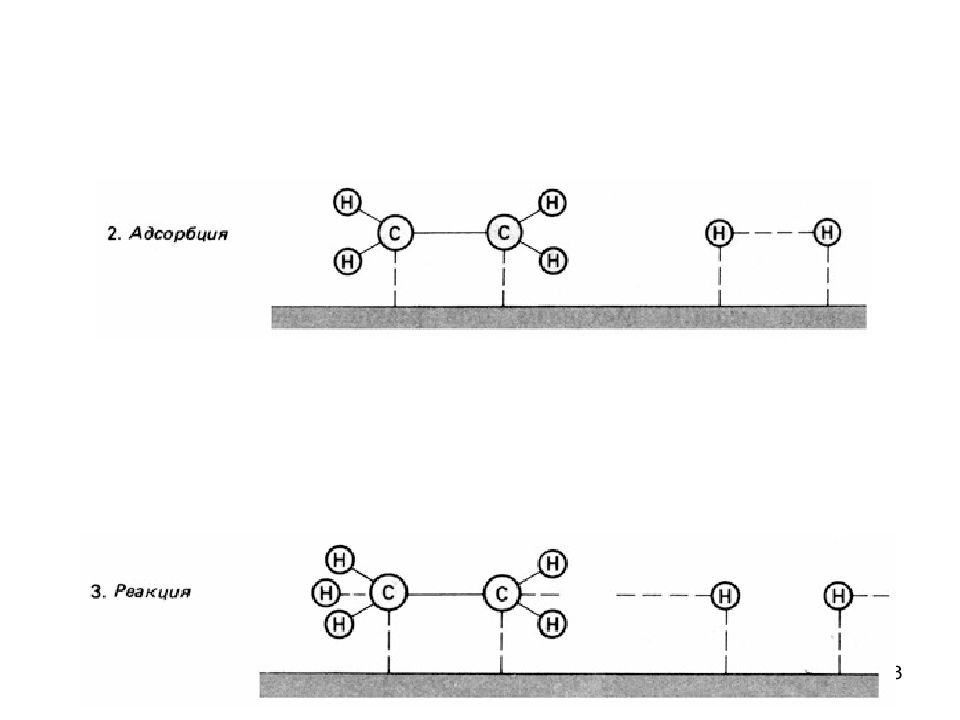
55 Влияние концентрации фермента на скорость реакций Схема ферментативного процесса Е – фермент (энзим) S – субстрат ES – фермент-субстратный комплекс P – продукт реакции k 1, k 2, k 3 – константы скоростей реакций
Слайд 57
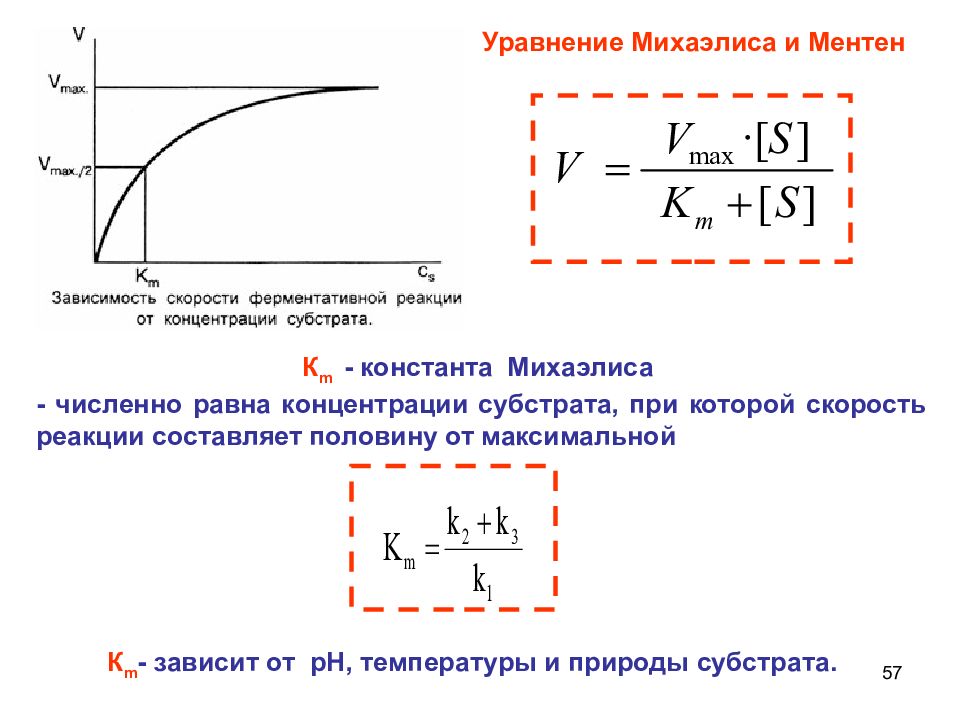
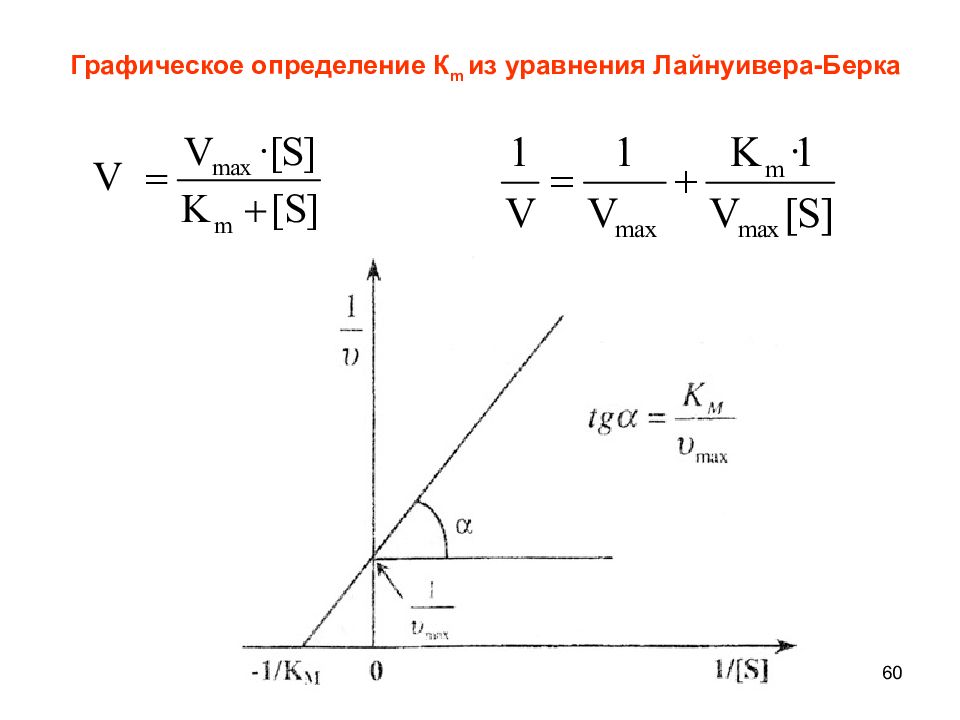
57 К m - константа Михаэлиса - численно равна концентрации субстрата, при которой скорость реакции составляет половину от максимальной Уравнение Михаэлиса и Ментен К m - зависит от рН, температуры и природы субстрата.
Слайд 58
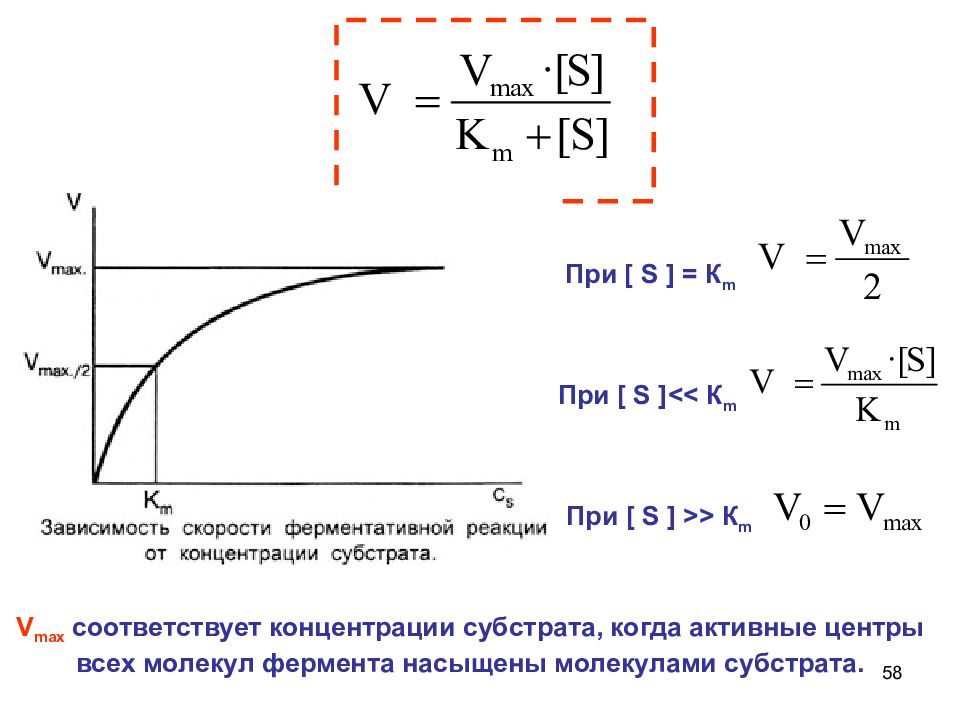
58 При [ S ]<< К m При [ S ] >> К m При [ S ] = К m V max соответствует концентрации субстрата, когда активные центры всех молекул фермента насыщены молекулами субстрата.
Слайд 59
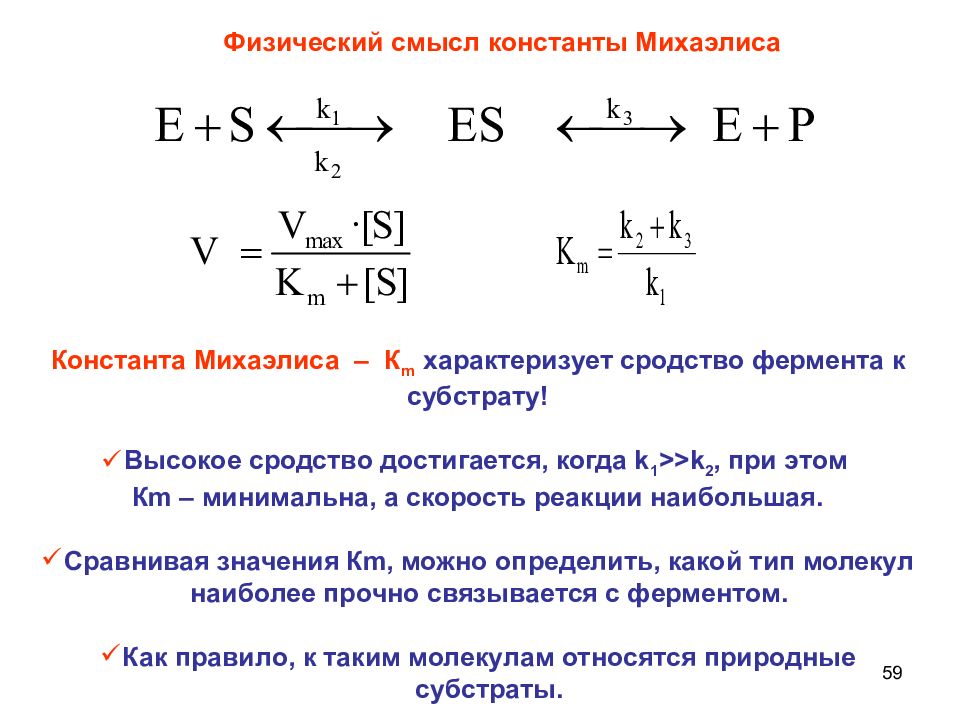
59 Физический смысл константы Михаэлиса Константа Михаэлиса – К m характеризует сродство фермента к субстрату! Высокое сродство достигается, когда k 1 >>k 2, при этом К m – минимальна, а скорость реакции наибольшая. Сравнивая значения К m, можно определить, какой тип молекул наиболее прочно связывается с ферментом. Как правило, к таким молекулам относятся природные субстраты.
Слайд 61
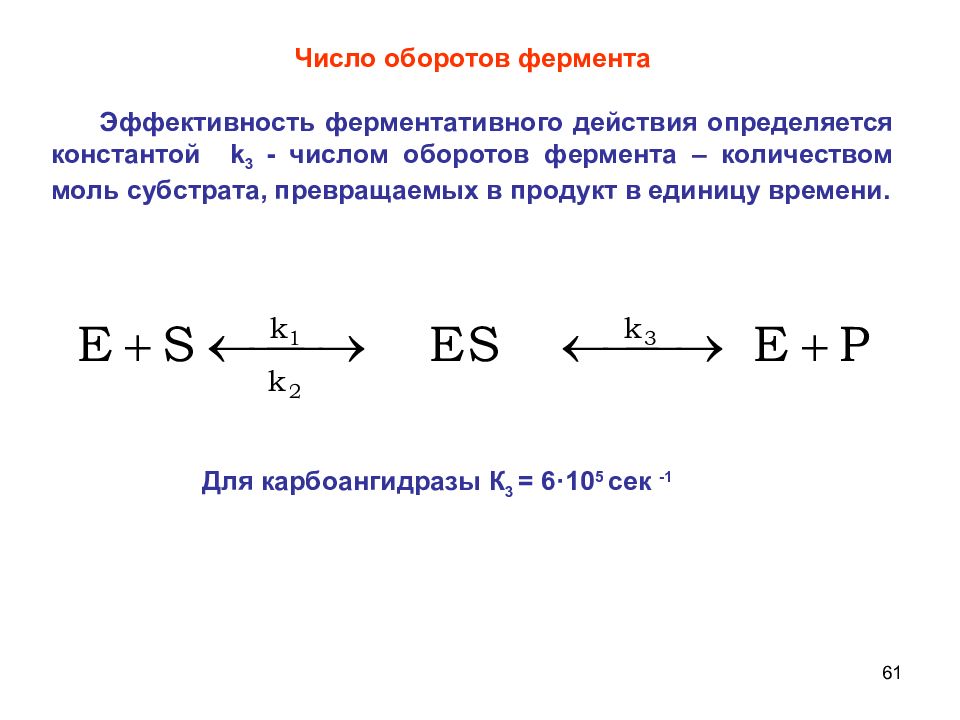
61 Для карбоангидразы К 3 = 6·10 5 сек -1 Число оборотов фермента Эффективность ферментативного действия определяется константой k 3 - числом оборотов фермента – количеством моль субстрата, превращаемых в продукт в единицу времени.
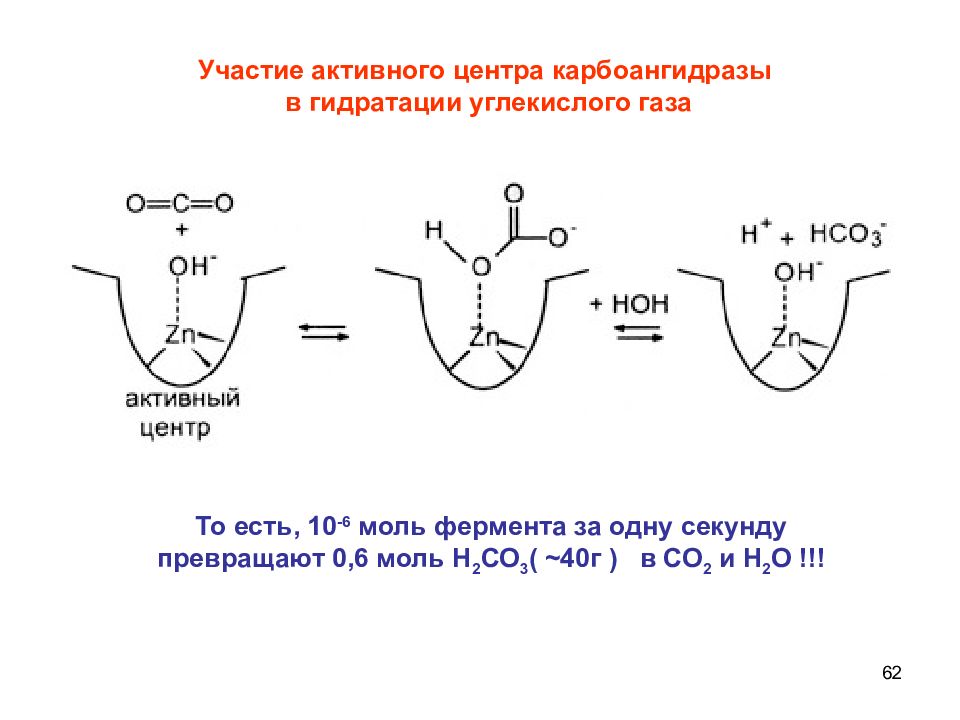
Слайд 62
62 Участие активного центра карбоангидразы в гидратации углекислого газа То есть, 10 -6 моль фермента за одну секунду превращают 0,6 моль Н 2 СО 3 ( ~ 40г ) в СО 2 и Н 2 О !!!
Слайд 63
63 Значение ферментативных реакций Применение ферментов в качестве лекарственных препаратов; Разработка методов диагностики с помощью ферментов; Производство антибиотиков; Синтез окси- и аминокислот, гидролиз крахмала; Изготовление кисломолочных продуктов, сыра, алкогольных напитков, обработка фруктов и овощей;
Слайд 64
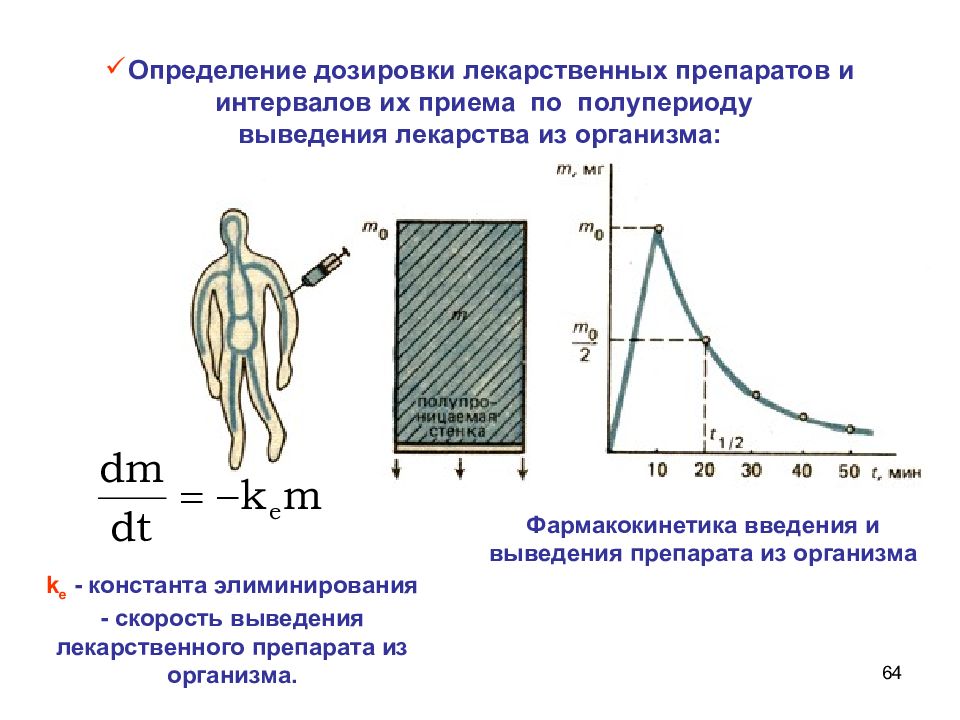
64 Определение дозировки лекарственных препаратов и интервалов их приема по полупериоду выведения лекарства из организма: Фармакокинетика введения и выведения препарата из организма k е - константа элиминирования - скорость выведения лекарственного препарата из организма.
Слайд 65
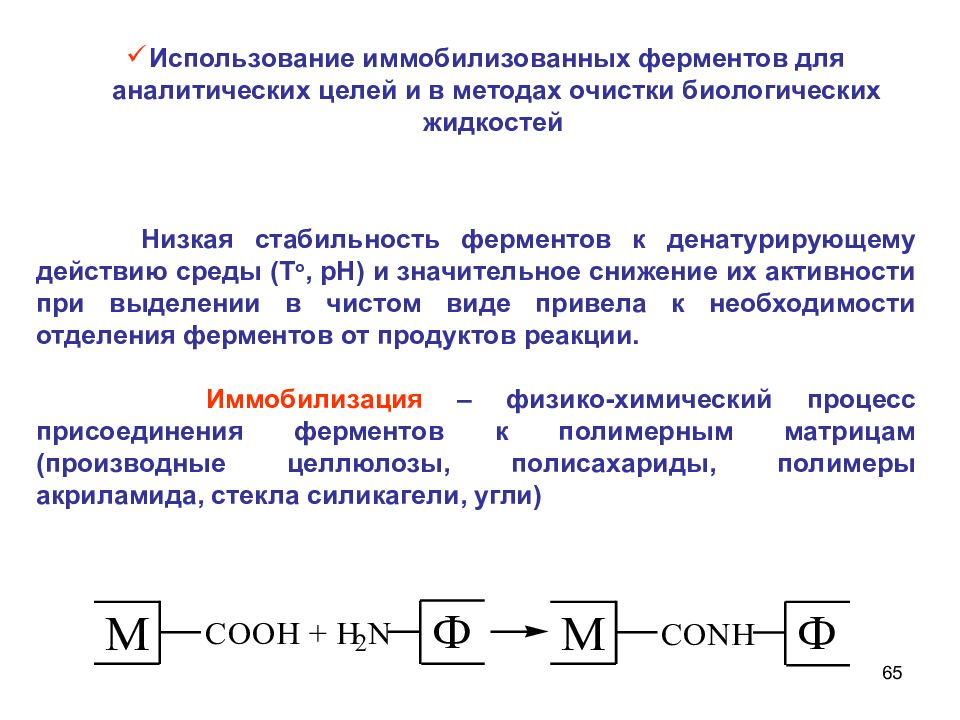
65 Низкая стабильность ферментов к денатурирующему действию среды (Т o, рН) и значительное снижение их активности при выделении в чистом виде привела к необходимости отделения ферментов от продуктов реакции. Иммобилизация – физико-химический процесс присоединения ферментов к полимерным матрицам (производные целлюлозы, полисахариды, полимеры акриламида, стекла силикагели, угли) Использование иммобилизованных ферментов для аналитических целей и в методах очистки биологических жидкостей
Слайд 66
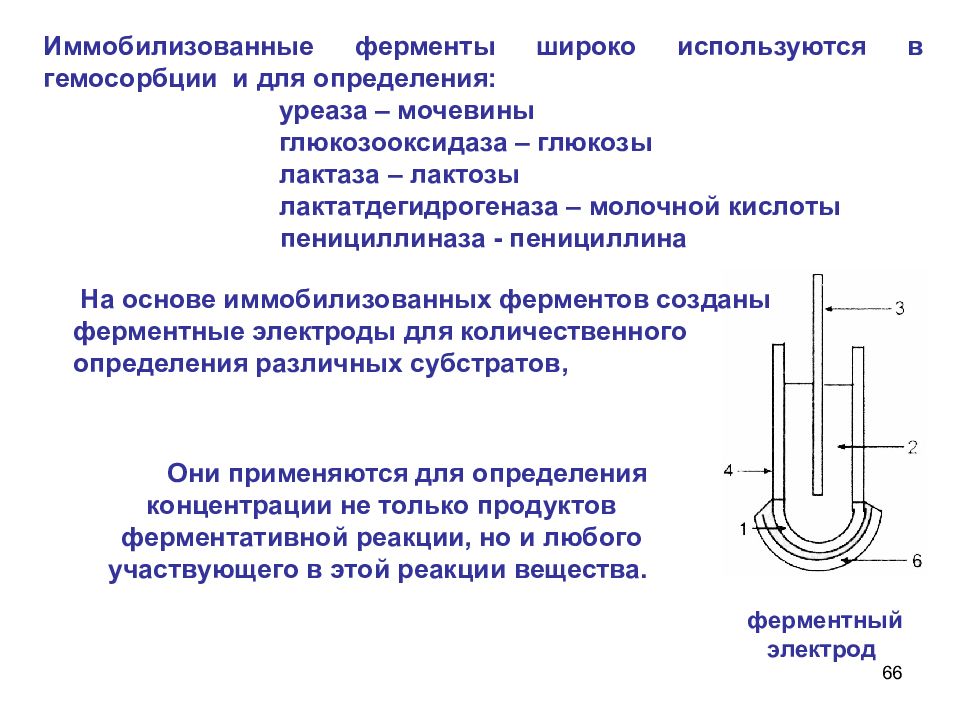
66 Иммобилизованные ферменты широко используются в гемосорбции и для определения: уреаза – мочевины глюкозооксидаза – глюкозы лактаза – лактозы лактатдегидрогеназа – молочной кислоты пенициллиназа - пенициллина Они применяются для определения концентрации не только продуктов ферментативной реакции, но и любого участвующего в этой реакции вещества. ферментный электрод На основе иммобилизованных ферментов созданы ферментные электроды для количественного определения различных субстратов,
Слайд 67
67 Катализаторы и ферменты изменяют скорости и прямой, и обратной реакций, но… не смещают равновесие!!! Достаточно легкого толчка, чтобы шарик покатился. Но от толчка не зависит ни направление движения, ни место, где он остановится. Катализатор изменяет только скорость реакции, не влияя на равновесие.
Слайд 68: Лекция «Химическое равновесие»
68 Лекция «Химическое равновесие» Кафедра общей и медицинской химии
Слайд 70
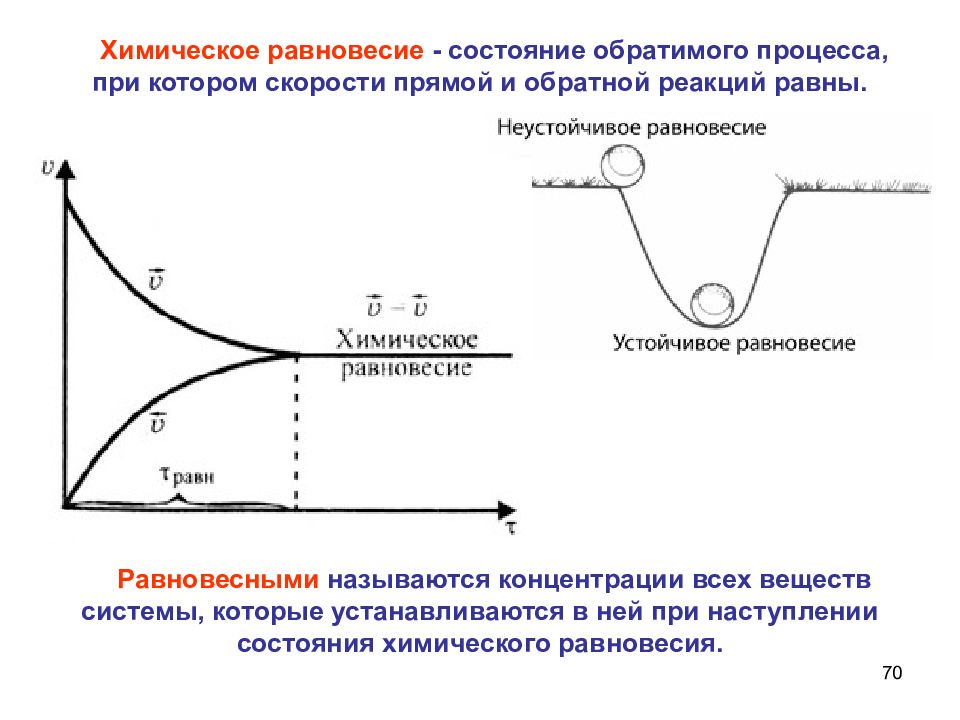
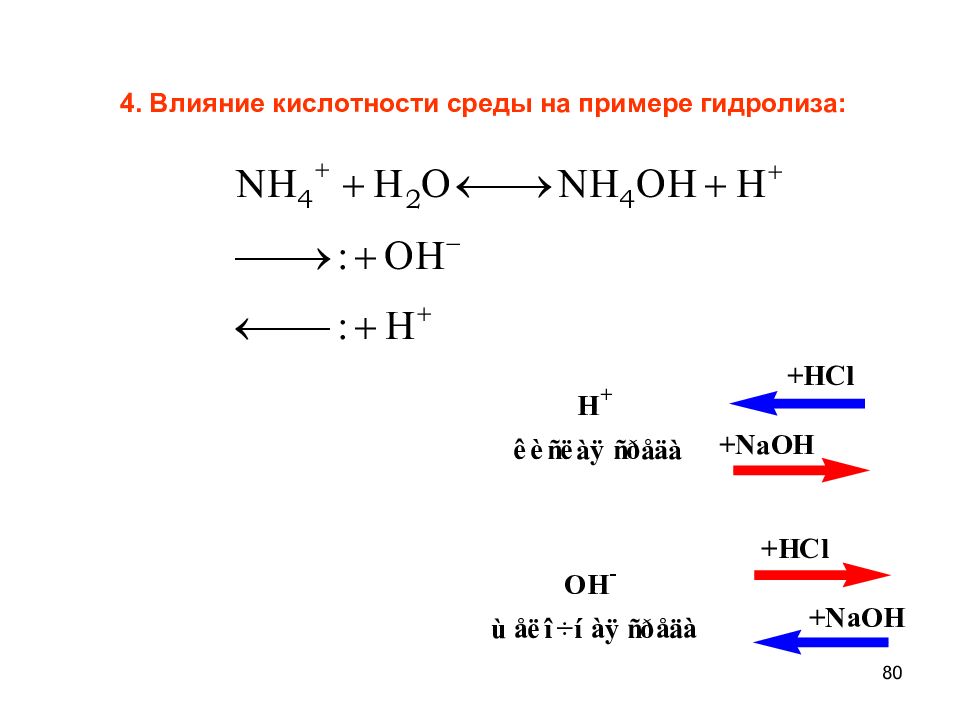
70 Химическое равновесие - состояние обратимого процесса, при котором скорости прямой и обратной реакций равны. Равновесными называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия. N 2 + 3 H 2 2 NH 3 + 92 кДж
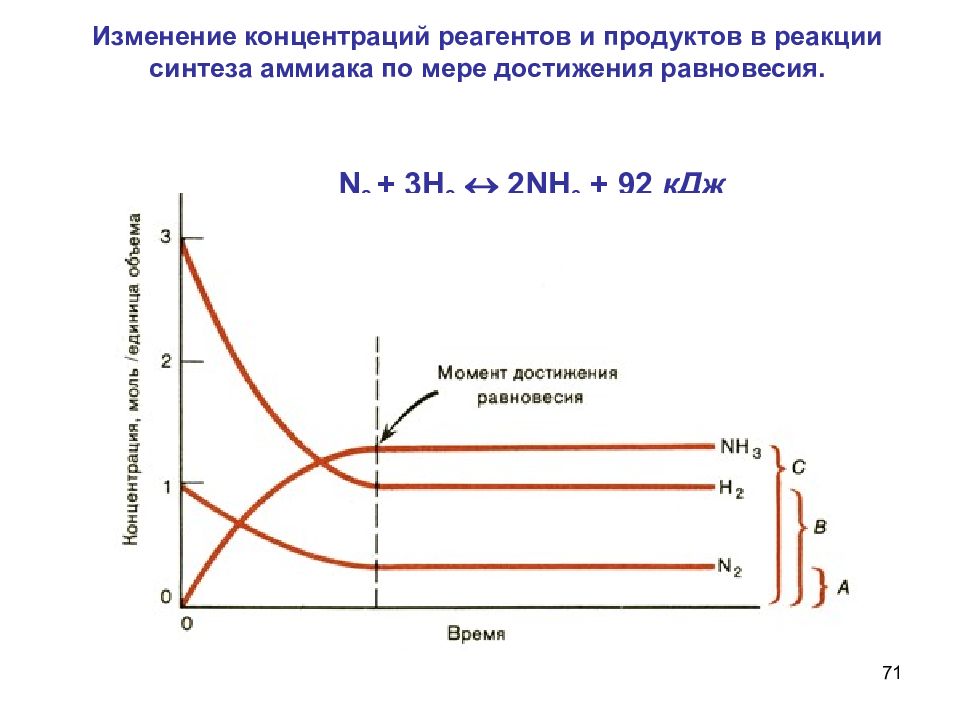
Слайд 71
71 Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по мере достижения равновесия. N 2 + 3 H 2 2 NH 3 + 92 кДж
Слайд 72
72 Вывод константы химического равновесия В состоянии химического равновесия: ГУЛЬДБЕРГ Като Максимилиан (2.08.1836-14.1.1902)
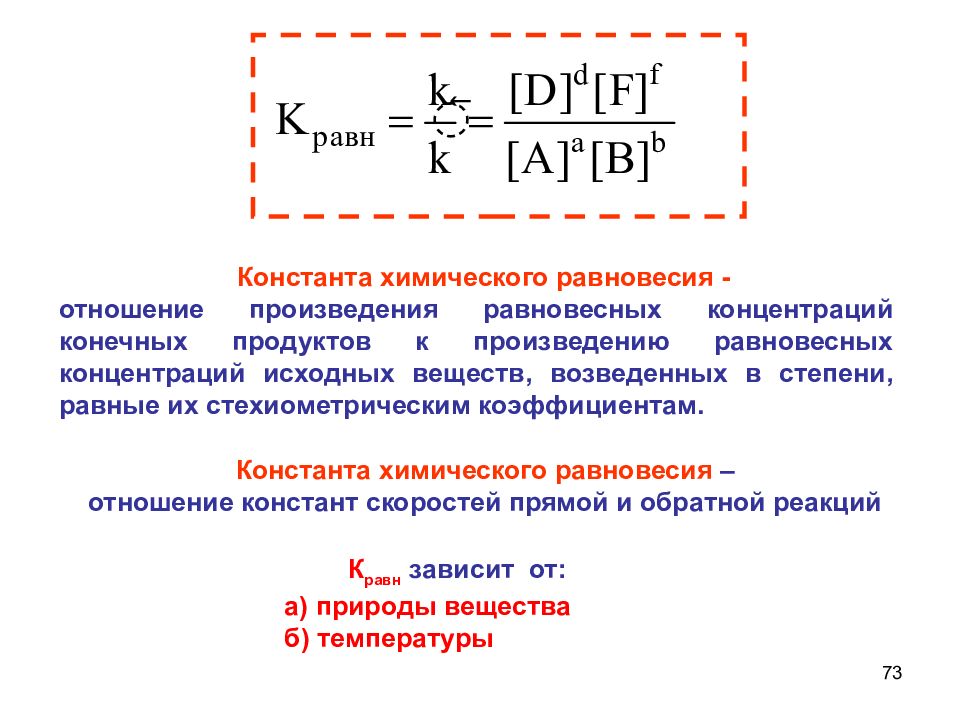
Слайд 73
73 Константа химического равновесия - отношение произведения равновесных концентраций конечных продуктов к произведению равновесных концентраций исходных веществ, возведенных в степени, равные их стехиометрическим коэффициентам. Константа химического равновесия – отношение констант скоростей прямой и обратной реакций К равн зависит от: а) природы вещества б) температуры
Слайд 74
74 Смещение химического равновесия. Анри Ле-Шателье (8.10.1850 – 17.09.1936 ) Принцип Ле Шателье Если на систему, находящуюся в состоянии равновесия оказывается внешнее воздействие, равновесие смещается в таком направлении, чтобы свести к минимуму влияние этого воздействия. Занимался исследованием процессов воспламенения, горения, взрывов и детонации. Нашел условия синтеза аммиака (1901), рудничного газа. В 1884 году сформулировал общий закон смещения химического равновесия. (Принцип Ле Шателье)
Слайд 75
75 Студенты Сорбонны, слушавшие лекции Ле-Шателье в 1907-1908 годах, так записывали в своих конспектах: " Изменение любого фактора, могущего влиять на состояние химического равновесия системы веществ, вызывает в ней реакцию, стремящуюся противодействовать производимому изменению. Повышение температуры вызывает реакцию, стремящуюся понизить температуру, то есть идущую с поглощением тепла. Увеличение давления вызывает реакцию, стремящуюся вызвать уменьшение давления, то есть сопровождающуюся уменьшением объема...". Будущий открыватель знаменитого принципа был широко образованным и эрудированным человеком. Много времени он посвятил изучению религии и древних языков. В возрасте 27 лет Ле-Шателье стал профессором. К сожалению, Ле-Шателье не был удостоен Нобелевской премии. Причина заключалась в том, что первоначально премия присуждалась только авторам работ, выполненных или получивших признание в год получения премии. Важнейшие работы Ле Шателье были выполнены задолго до 1901 года, когда состоялось первое присуждение Нобелевских премий.
Слайд 76
76 1. Влияние изменения температуры на смещение равновесия N 2 + 3 H 2 2 NH 3 + 92 кдж Экзотермическим реакциям благоприятствует понижение температуры
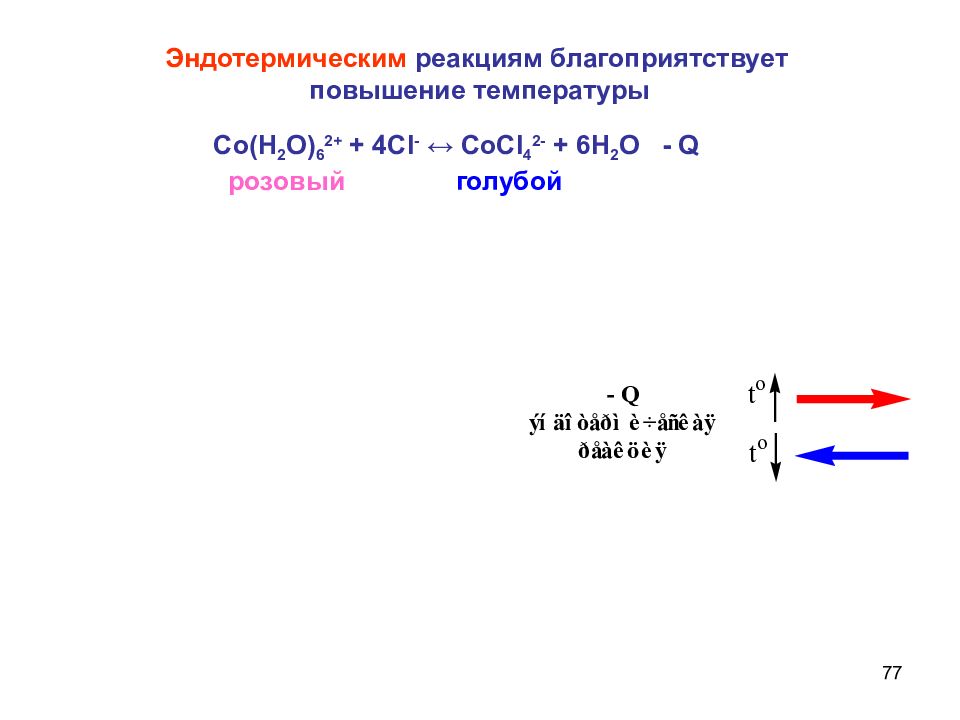
Слайд 77
77 Со(Н 2 О) 6 2+ + 4С I - ↔ СоС I 4 2- + 6Н 2 О - Q розовый голубой Эндотермическим реакциям благоприятствует повышение температуры
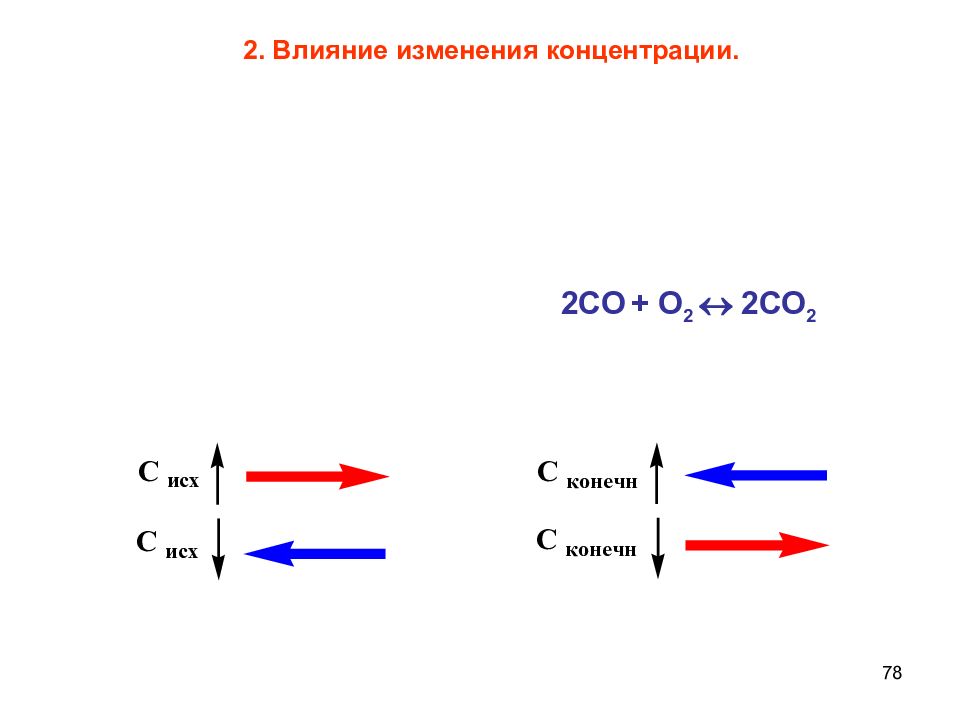
Слайд 79
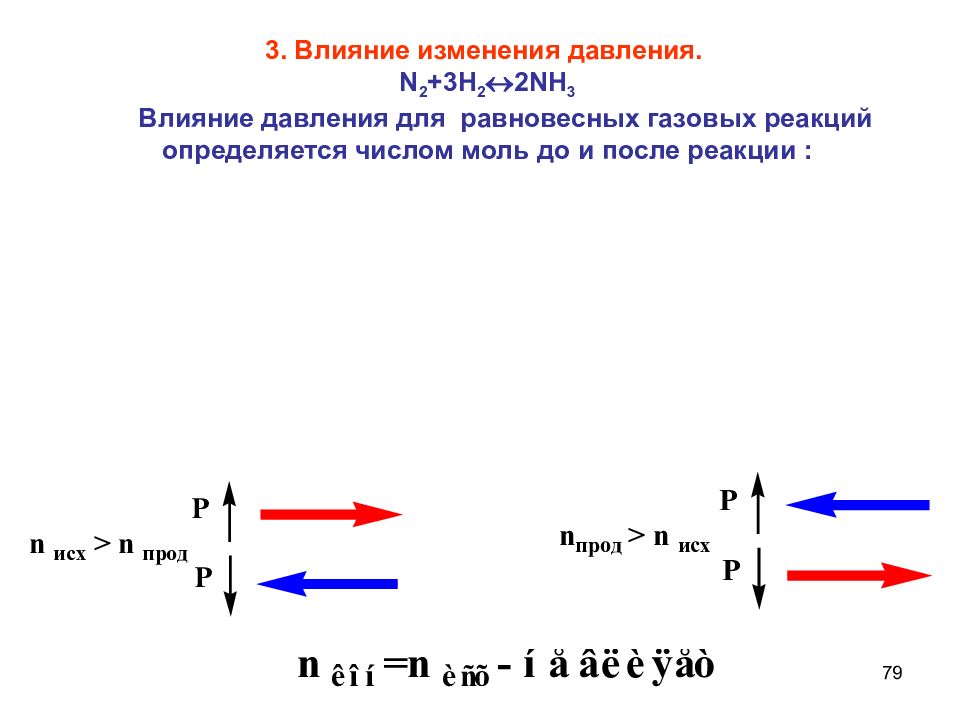
79 3. Влияние изменения давления. N 2 +3 H 2 2 NH 3 Влияние давления для равновесных газовых реакций определяется числом моль до и после реакции :