Первый слайд презентации
1 Лекция 5 "Химическая кинетика и катализ Смещение химического равновесия"
Слайд 2
2 ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ Химическая кинетика - учение о скорости химических реакций и зависимости ее от различных факторов - природы и концентрации реагирующих веществ, давления, температуры, катализаторов. Взрыв - тысячные доли секунды Управление химическим процессом является главной задачей химической кинетики. Ржавчина - несколько часов Антрацит - сотни, тысячи лет.
Слайд 3
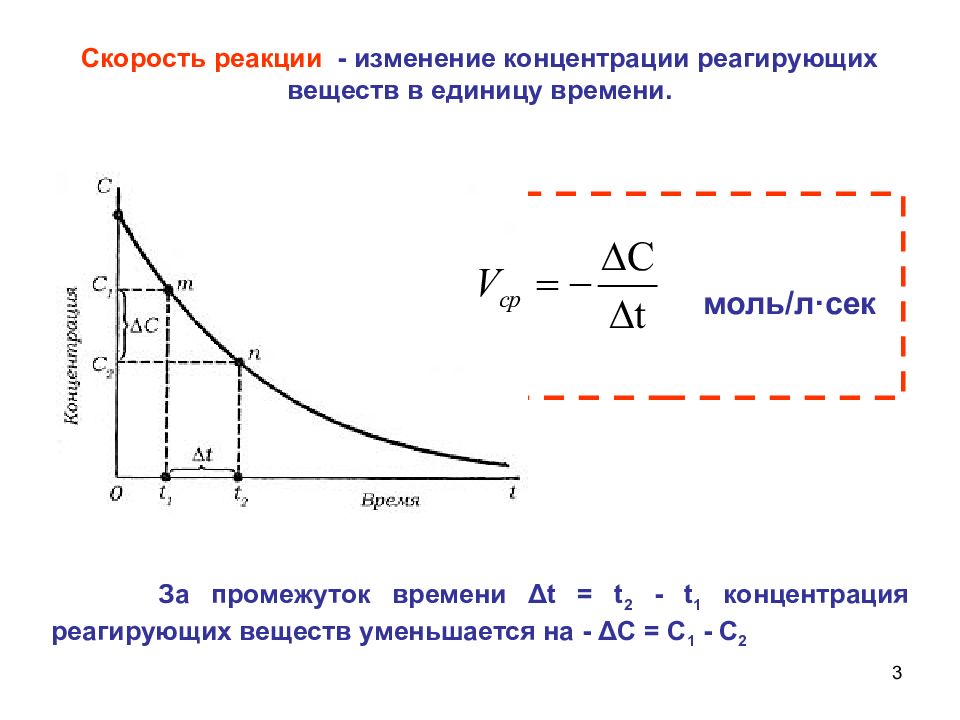
3 Скорость реакции - изменение концентрации реагирующих веществ в единицу времени. За промежуток времени Δ t = t 2 - t 1 концентрация реагирующих веществ уменьшается на - Δ С = С 1 - С 2 моль/л · сек
Слайд 4
4 ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОМОГЕННЫХ РЕАКЦИЙ концентрация реагентов природа реагирующих веществ температура катализатор
Слайд 5
5 Влияние концентрации реагентов Скорость химической реакции зависит от концентрации реагирующих веществ - чем выше концентрация, тем больше скорость реакции
Слайд 6
6 Закон действующих масс – ЗДМ (принцип Гульдберга - Вааге) Скорость гомогенной реакции при постоянной температуре пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам. k - константа скорости химической реакции
Слайд 7
7 k - константа скорости химической реакции ( удельная скорость реакции ) численно равна скорости химической реакции при концентрациях всех реагирующих веществ, равных 1 моль/л и зависит от: природы реагирующих веществ температуры катализатора k не зависит от концентрации реагирующих веществ! Задание1. Скорость синтеза аммиака при повышении концентраций азота и водорода в три раза увеличивается в _____ раз.
Слайд 8
8 Концентрации твердых веществ в гетерогенных системах не входят в выражение константы химического равновесия !!! Прямая реакция - реакция нулевого порядка Обратная реакция - реакция первого порядка
Слайд 9
9 Вместе с тем, чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
Слайд 10
10 Задание 2 Как изменится скорость реакции выделения водорода Mg + 2 HCl = MgCl 2 + H 2, если кусочек магния массой 1 г измельчить на 1000 одинаковых кубиков? 1) не изменится 2) возрастет примерно в 10 раз 3) возрастет примерно в 100 раз 4) возрастет примерно в 1000 раз
Слайд 11
11 Задание 3 Реакция, скорость которой зависит от площади поверхности соприкосновения реагирующих веществ, - это: 1) нейтрализация серной кислоты раствором гидроксида натрия 2) горение водорода в кислороде 3) взаимодействие растворов хлорида меди и гидроксида калия 4) горение алюминия в кислороде
Слайд 12
12 ВЛИЯНИЕ ПРИРОДЫ РЕАГИРУЮЩИХ ВЕЩЕСТВ Скорость химической реакции зависит от природы химических соединений, подобно тому, как скорость физических процессов определяется свойствами веществ. Например, скорость истечения жидкостей зависит от их вязкости.
Слайд 13
13 Реакции между молекулами протекают обычно медленно, между ионами и радикалами – быстро: Природу реагирующих веществ учитывает константа скорости реакции k
Слайд 14
14 Задание 5 С наибольшей скоростью при обычных условиях взаимодействуют 1) цинк и соляная кислота 2) натрий и вода 3) магний и вода 4) свинец и соляная кислота Задание 4 С наибольшей скоростью при обычных условиях взаимодействуют: 1) азот и водород 2) магний и вода 3) раствор гидроксида натрия и соляная кислота 4) сера и железо
Слайд 16
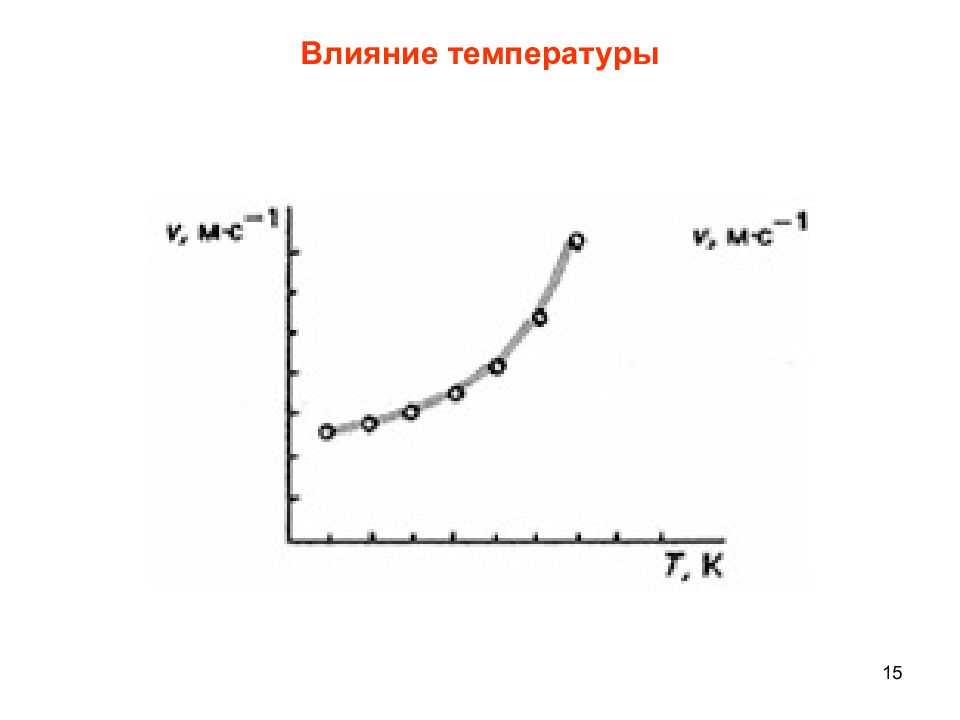
16 Закон Вант-Гоффа При повышении температуры на 10° скорость химической реакции возрастает в два-четыре раза. Если повысить температуру на 100°, то скорость реакции увеличится в 1024 раза: Температурный коэффициент изменяется от 2 до 4.
Слайд 17
17 Задание 6 При повышении температуры 30 о скорость реакции, температурный коэффициент которой равен 2, возрастает в …. раз. Задание 7 При повышении температуры на 60°С скорость химической реакции увеличилась в 64 раза. Следовательно, температурный коэффициент этой реакции равен _____
Слайд 18
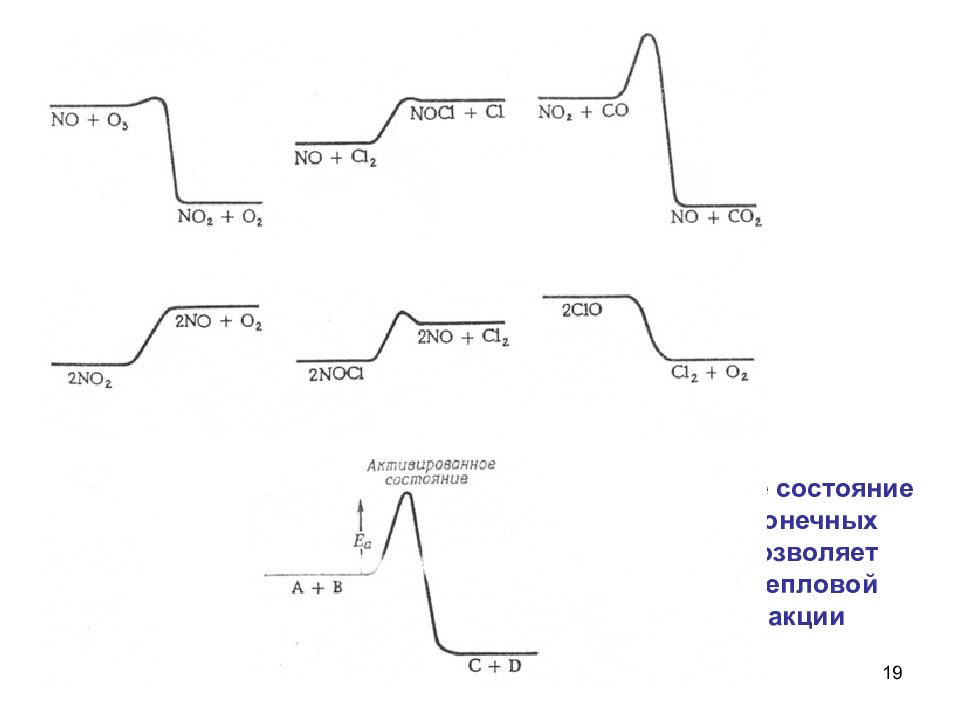
18 Рост скорости реакции с температурой объясняется тем, что не всякое столкновение приводит к химическому превращению. Для осуществления реакции необходимо, чтобы молекулы обладали запасом энергии, достаточным для расшатывания тех связей, которые перестраиваются в ходе реакции (энергией активации Е) Химическая реакция напоминает туристский поход, маршрут которого проложен чрез вершину горы. Только сильные могут преодолеть вершину.
Слайд 19
19 Энергетическое состояние исходных и конечных продуктов позволяет определить тепловой эффект реакции + Q - Q - Q - Q + Q + Q + Q
Слайд 20
20 Катализаторы - вещества, увеличивающие скорость химических реакций Ингибиторы - вещества, замедляющие скорость химических реакций Влияние катализатора Положительный катализатор ускоряет реакцию, отрицательный (ингибитор) замедляет ее.
Слайд 21
21 Гетерогенные катализаторы. Из одного вещества можно получить различные продукты в зависимости от катализатора
Слайд 22
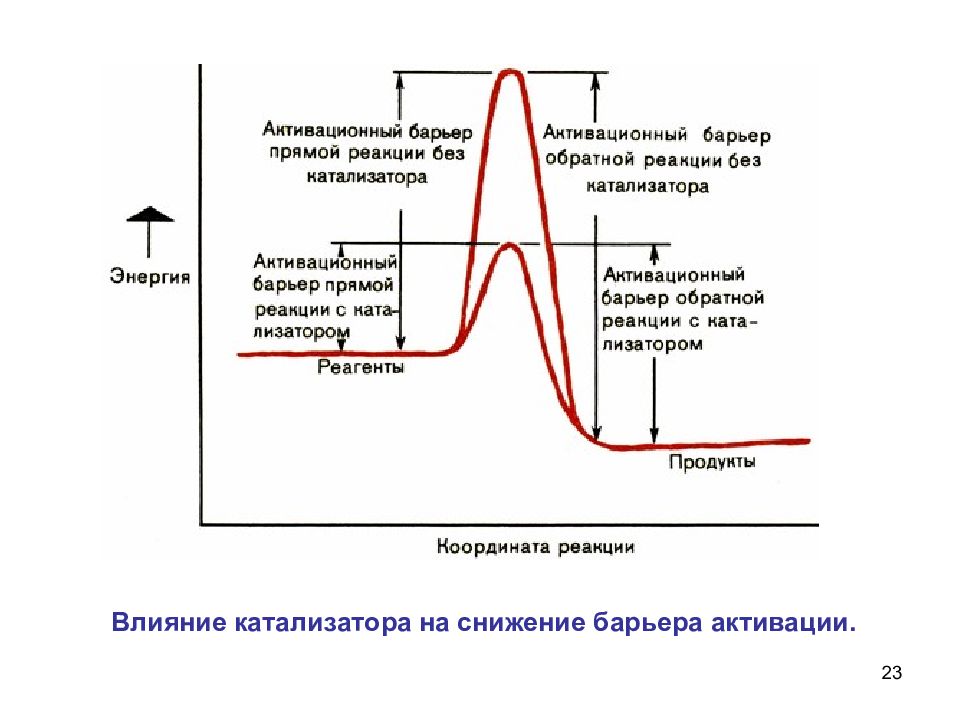
22 Катализатор понижает энергетический барьер, его могут преодолеть и молекулы, обладающие малой энергией Роль катализатора заключается в понижении энергии активации данной реакции за счет того, что он создает новый путь ее протекания.
Слайд 24
24 Катализаторы изменяют скорости и прямой, и обратной реакций, но… не смещают равновесие!!! Достаточно легкого толчка, чтобы шарик покатился. Но от толчка не зависит ни направление движения, ни место, где он остановится. Катализатор изменяет только скорость реакции, не влияя на равновесие.
Слайд 26
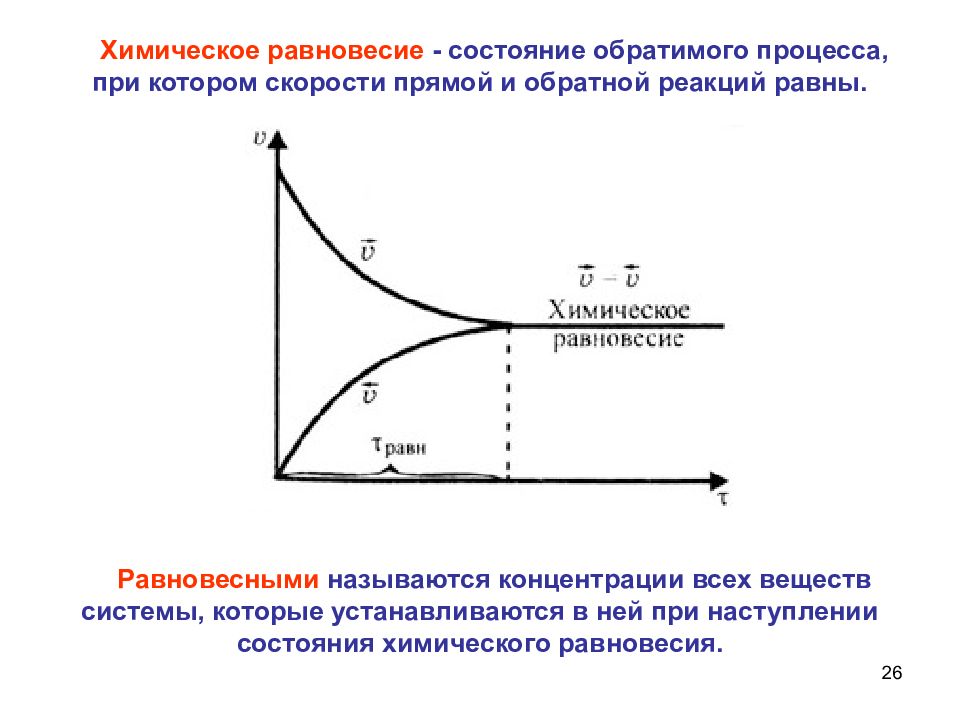
26 Химическое равновесие - состояние обратимого процесса, при котором скорости прямой и обратной реакций равны. Равновесными называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия.
Слайд 27
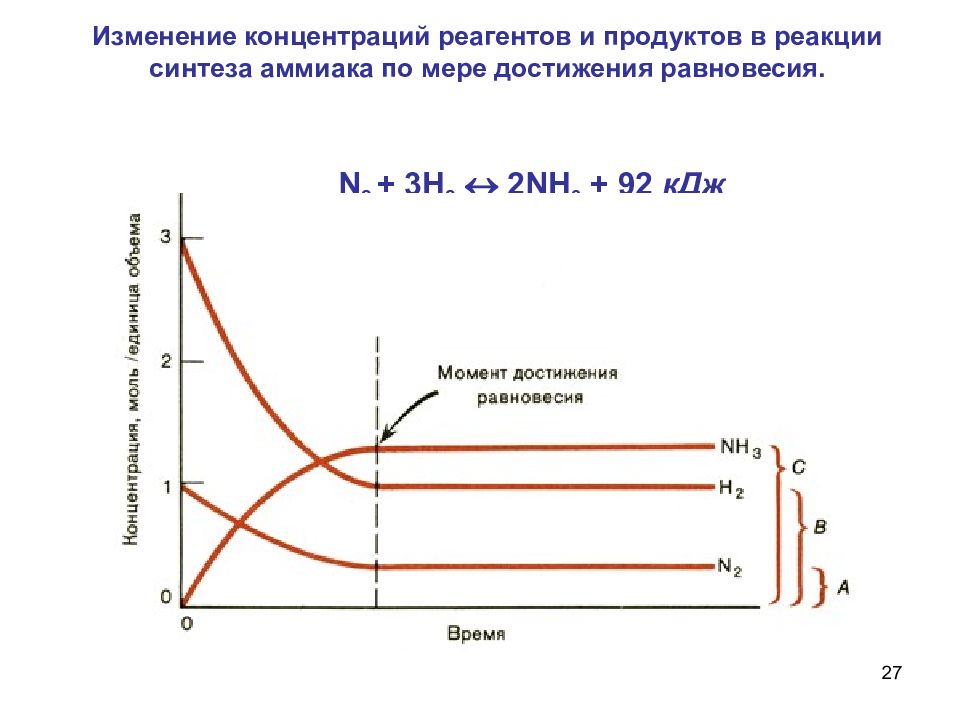
27 Изменение концентраций реагентов и продуктов в реакции синтеза аммиака по мере достижения равновесия. N 2 + 3 H 2 2 NH 3 + 92 кДж
Слайд 29
29 Смещение химического равновесия. Анри Ле-Шателье (8.10.1850 – 17.09.1936 ) Принцип Ле Шателье Если на систему, находящуюся в состоянии равновесия оказывается внешнее воздействие, равновесие смещается в таком направлении, чтобы свести к минимуму влияние этого воздействия. Занимался исследованием процессов воспламенения, горения, взрывов и детонации. Нашел условия синтеза аммиака (1901), рудничного газа. В 1884 году сформулировал общий закон смещения химического равновесия. (Принцип Ле Шателье)
Слайд 30
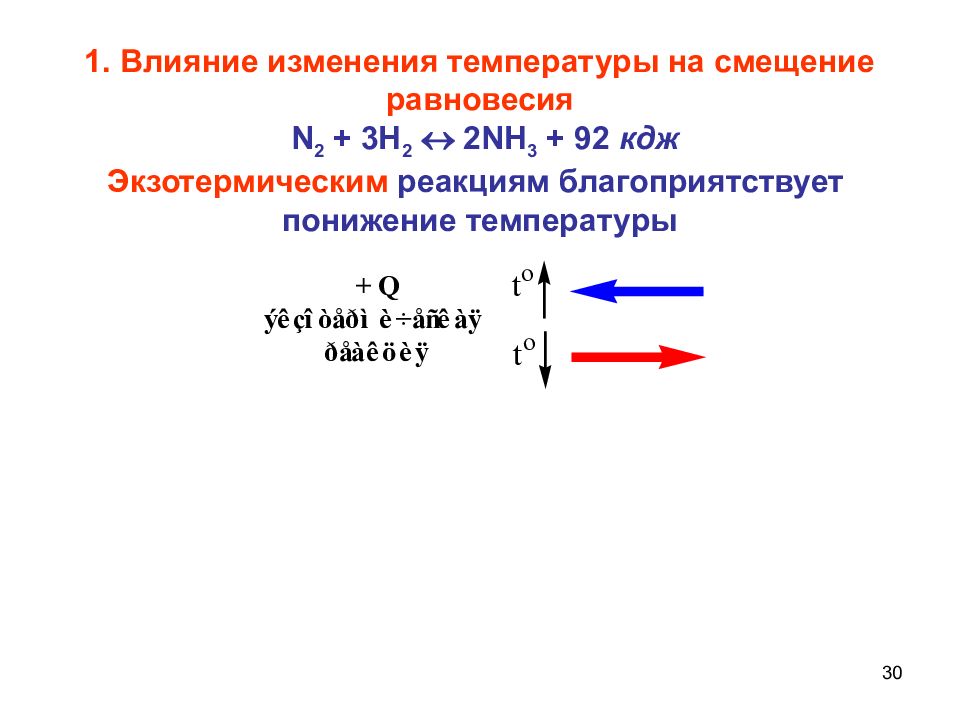
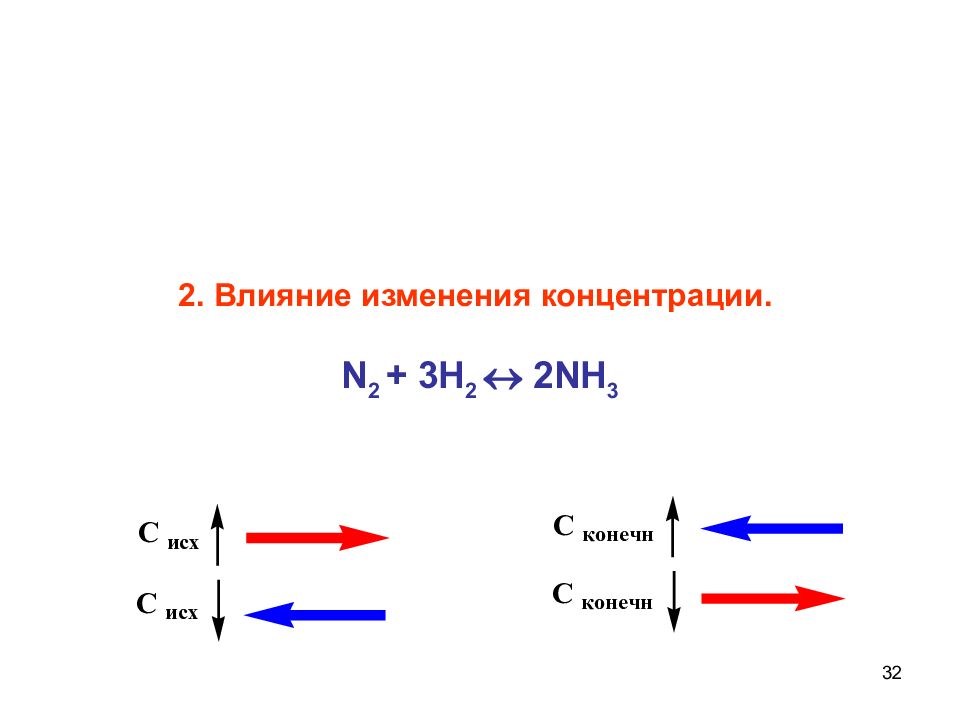
30 1. Влияние изменения температуры на смещение равновесия N 2 + 3 H 2 2 NH 3 + 92 кдж Экзотермическим реакциям благоприятствует понижение температуры
Слайд 31
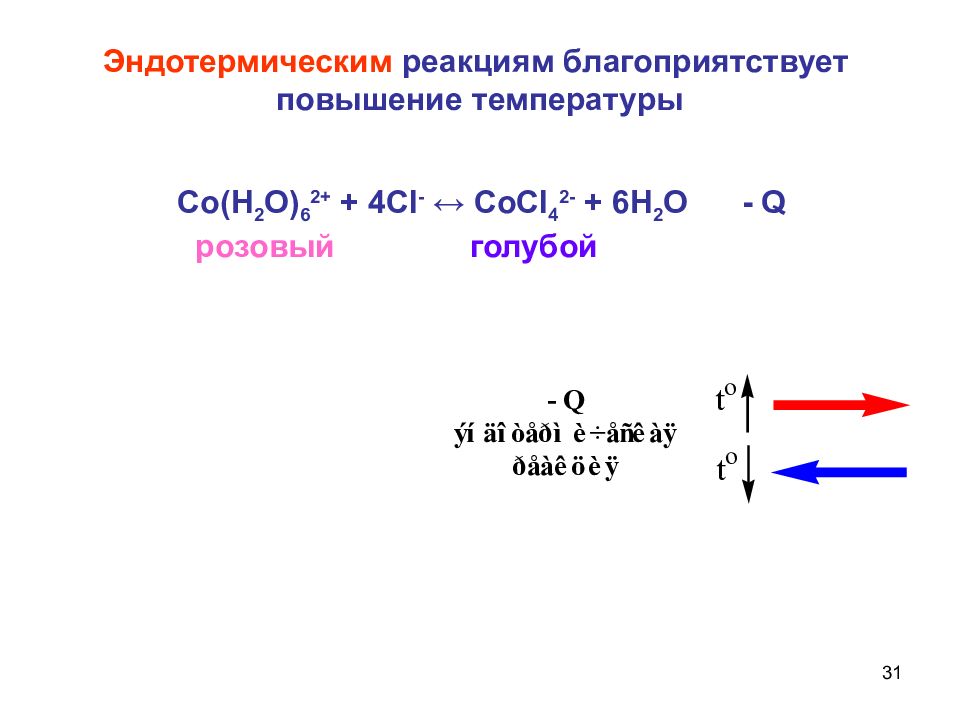
31 Со(Н 2 О) 6 2+ + 4С I - ↔ СоС I 4 2- + 6Н 2 О - Q розовый голубой Эндотермическим реакциям благоприятствует повышение температуры
Слайд 33
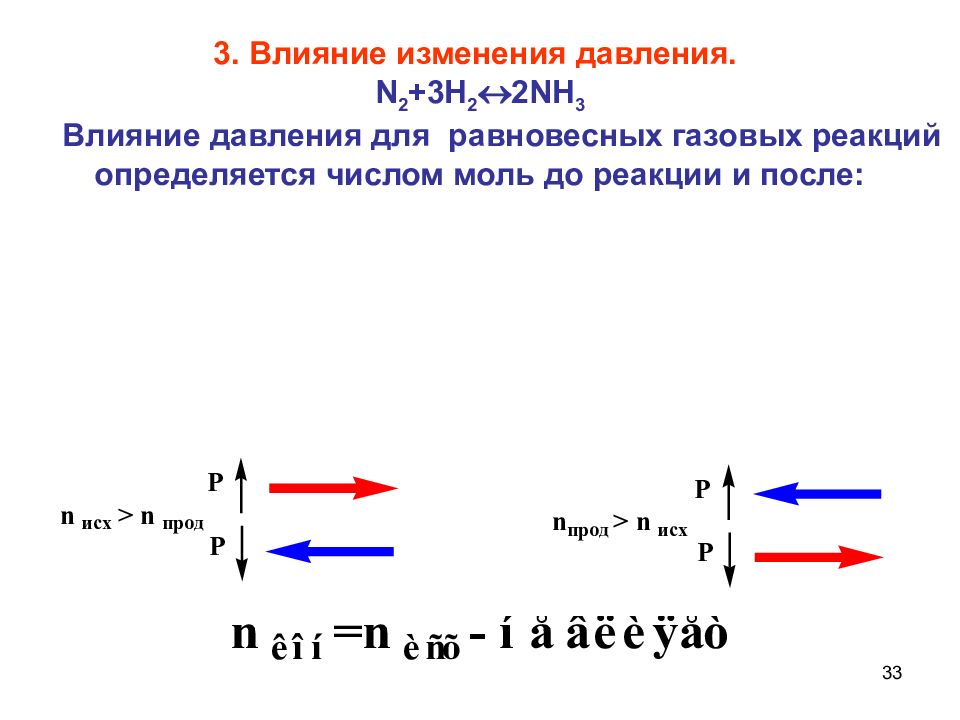
33 3. Влияние изменения давления. N 2 +3 H 2 2 NH 3 Влияние давления для равновесных газовых реакций определяется числом моль до реакции и после:
Слайд 34
34 Катализаторы изменяют скорости и прямой, и обратной реакций, но… не смещают равновесие!!! Задание 8 Реакцию, уравнение которой FeO + 2 H + = Fe 2+ + H 2 O + Q, можно ускорить, если: 1) повысить давление 2) понизить давление 3) повысить температуру 4) понизить температуру
35 Тест 18 Кинетика. Катализ, Химическое равновесие (один вариант ответа)
36 1. Единица измерения скорости гомогенной химической реакции: 1) моль/л ∙ с 2) кмоль ∙ м 3 /ч 3) моль ∙ с/мл 4) л ∙ с/моль
37 2. Скорость любой химической реакции зависит от: давления температуры площади соприкосновения реагирующих веществ всех вышеперечисленных факторов
Слайд 38: 3. Во сколько раз изменится скорость реакции 2 S О 2 + О 2 → 2 S О 3 при повышении давления в системе в 3 раза?
38 3. Во сколько раз изменится скорость реакции 2 S О 2 + О 2 → 2 S О 3 при повышении давления в системе в 3 раза? увеличится в 9 раз увеличится в 6 раз увеличится в 27 раз увеличится в 18 раз
39 4. Через определенный промежуток времени после начала реакции 2СО 2 + С → 2СО концентрация углекислого газа уменьшилась в 4 раза. Во сколько раз при этом уменьшится скорость реакции по сравнению с начальной? в 4 раза в 8 раз в 12 раз в 16 раз
Слайд 40: 5. В реакции, схема которой 2А(г) + В(г) → C + D, концентрацию вещества А увеличили в 2 раза, а вещества В - в 3 раза. Скорость реакции при этом возрастет:
40 5. В реакции, схема которой 2А(г) + В(г) → C + D, концентрацию вещества А увеличили в 2 раза, а вещества В - в 3 раза. Скорость реакции при этом возрастет: в 12 раз в 6 раз в 1,5 раза в 3 раза
Слайд 41: 6. Во сколько раз надо увеличить концентрацию кислорода в реакции, уравнение которой: 2 S О 2 + О 2 → 2 SO 3 чтобы при уменьшении концентрации сернистого газа в 5 раз скорость реакции не изменилась?
41 6. Во сколько раз надо увеличить концентрацию кислорода в реакции, уравнение которой: 2 S О 2 + О 2 → 2 SO 3 чтобы при уменьшении концентрации сернистого газа в 5 раз скорость реакции не изменилась? в 10 раз 2) в 2,5 раза 3) в 5 раз 4) в 25 раз
Слайд 42: 7. Константа скорости химической реакции не зависит:
42 7. Константа скорости химической реакции не зависит: от природы реагирующих веществ от концентрации реагирующих веществ от температуры от наличия катализатора
Слайд 43: 8. В присутствии катализатора протекает реакция, уравнение которой:
43 8. В присутствии катализатора протекает реакция, уравнение которой: S + О 2 → S О 2 2H 2 S + S О 2 → 3S + 2H 2 О 2S О 2 + О 2 → 2S О 3 2H 2 S + 3 О 2 → 2S О 2 + 2H 2 О
Слайд 44: 9. Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при повышении температуры на 20 °С?
44 9. Температурный коэффициент реакции равен 3. Во сколько раз увеличится скорость реакции при повышении температуры на 20 °С? 1) в 1,5 раза 2) в 3 раза 3) в 6 раз 4) в 9 раз
Слайд 45: 10. Температурный коэффициент реакции равен 2. На сколько градусов надо уменьшить температуру, чтобы скорость реакции уменьшилась в 16 раз?
45 10. Температурный коэффициент реакции равен 2. На сколько градусов надо уменьшить температуру, чтобы скорость реакции уменьшилась в 16 раз? на 20 0 С 2) на 30 0 С 3) на 40 0 С 4) на 50 0 С
Слайд 46: 11. При 30 °С химическая реакция протекает за 225 с. За какое время эта реакция завершится при 50 °С, если ее температурный коэффициент равен 3?
46 11. При 30 °С химическая реакция протекает за 225 с. За какое время эта реакция завершится при 50 °С, если ее температурный коэффициент равен 3? 1) 25 с 2) 50 с 3) 75 с 4) 125 с
Слайд 47: 12. При 10°С реакция протекает за 8 мин, а при 60 °С— за 15 с. Температурный коэффициент реакции равен:
47 12. При 10°С реакция протекает за 8 мин, а при 60 °С— за 15 с. Температурный коэффициент реакции равен: 1) 2 2) 3 3) 3,5 4) 4
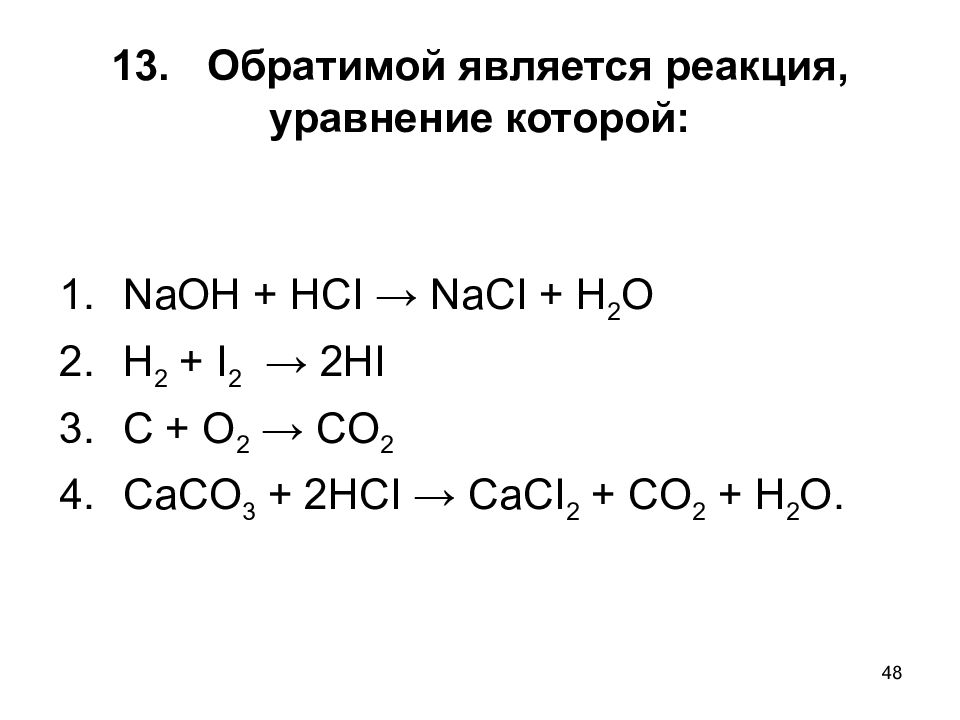
Слайд 48: 13. Обратимой является реакция, уравнение которой:
48 13. Обратимой является реакция, уравнение которой: NaOH + НС I → NaCI + Н 2 O Н 2 + I 2 → 2 HI С + O 2 → С O 2 СаС O 3 + 2 HCI → СаС I 2 + С O 2 + Н 2 O.
Слайд 49: 14. В реагирующей системе, уравнение которой 2 NO (г) + С I 2 (г) ↔ 2 NOCI (г) - Q, равновесие сместится вправо при:
49 14. В реагирующей системе, уравнение которой 2 NO (г) + С I 2 (г) ↔ 2 NOCI (г) - Q, равновесие сместится вправо при: повышении давления использовании катализатора понижении температуры повышении концентрации NOCI
Слайд 50: 15. Система, в которой повышение давления не вызовет смещения равновесия:
50 15. Система, в которой повышение давления не вызовет смещения равновесия: 2 NF 3(г) + 3 H 2(г) ↔ 6 HF (г) + N 2(г); С(т) + 2 N 2 O (г) ↔ CO 2(г) + 2 N 2(г); 3 Fe 2 O 3 ( T ) + Н 2(г ) ↔ 2 Fe 3 O 4(т ) + Н 2 O (г); 2ZnS( T ) + 3O 2 ( г ) ↔ 2ZnO( T )+ 2SO 2 ( г ).
Слайд 51: 16. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях:
51 16. Система, в которой повышение давления и повышение температуры приведут к смещению равновесия в противоположных направлениях: 1) C О 2 (г) + C (т) ↔ 2 CO (г) + Q ; 2) I 2 (г) + 5СО 2 (г) ↔ I 2 O 5 (т) + 5СО(г) - Q ; 3) N 2 (г)+О 2 (г) ↔ 2 NO (г) - Q ; 4) С 2 Н 2 (г) + 2Н 2 (г) ↔ СН 3 —СН 3 (г) + Q
Слайд 52: 17. В реагирующей системе 2А + В ↔ С + 2D исходная концентрация вещества А равна 4 моль/л; равновесная концентрация этого же вещества — 1,6 моль/л. Равновесные концентрации веществ С и D соответственно равны (моль/л):
52 17. В реагирующей системе 2А + В ↔ С + 2D исходная концентрация вещества А равна 4 моль/л; равновесная концентрация этого же вещества — 1,6 моль/л. Равновесные концентрации веществ С и D соответственно равны (моль/л): 1) 0,6 и 1,2 2) 1,2 и 2,4 3) 1,2 и 1,2 4) 1,2 и 0,6
Слайд 53: 18. В реагирующей системе ЗА + В ↔ 2С + D, равновесные концентрации веществ равны: А - 0,35 моль/л, В -1,1 моль/л С - 0,9 моль/л. Исходные концентрации веществ А и В соответственно равны (моль/л):
53 18. В реагирующей системе ЗА + В ↔ 2С + D, равновесные концентрации веществ равны: А - 0,35 моль/л, В -1,1 моль/л С - 0,9 моль/л. Исходные концентрации веществ А и В соответственно равны (моль/л): 1) 1,3 и 1,25 2) 1,3 и 1,55 3) 1,7 и 1,55 4) 1,5 и 1,45
Слайд 54: 19. В реагирующей системе A + 2 B ↔ C + 3 D исходные концентрации вещества А— 3 моль/л, В— 4моль/л, а равновесная концентрация вещества С — 1,5 моль/л. Константа равновесия в системе равна:
54 19. В реагирующей системе A + 2 B ↔ C + 3 D исходные концентрации вещества А— 3 моль/л, В— 4моль/л, а равновесная концентрация вещества С — 1,5 моль/л. Константа равновесия в системе равна: 1) 45,3 2) 48,7 3) 50,5 4) 91,1
Слайд 55
55 20. В системе Н 2 + В r 2 ↔ 2 НВ r установилось равновесие, при котором концентрация Н 2 равна 5 моль/л, В r 2 — 2 моль/л, НВ r — 3 моль/л. Концентрацию В r 2 в системе увеличили в 2 раза. Определите концентрации веществ после того, как система вновь придет в состояние равновесия.
Слайд 56
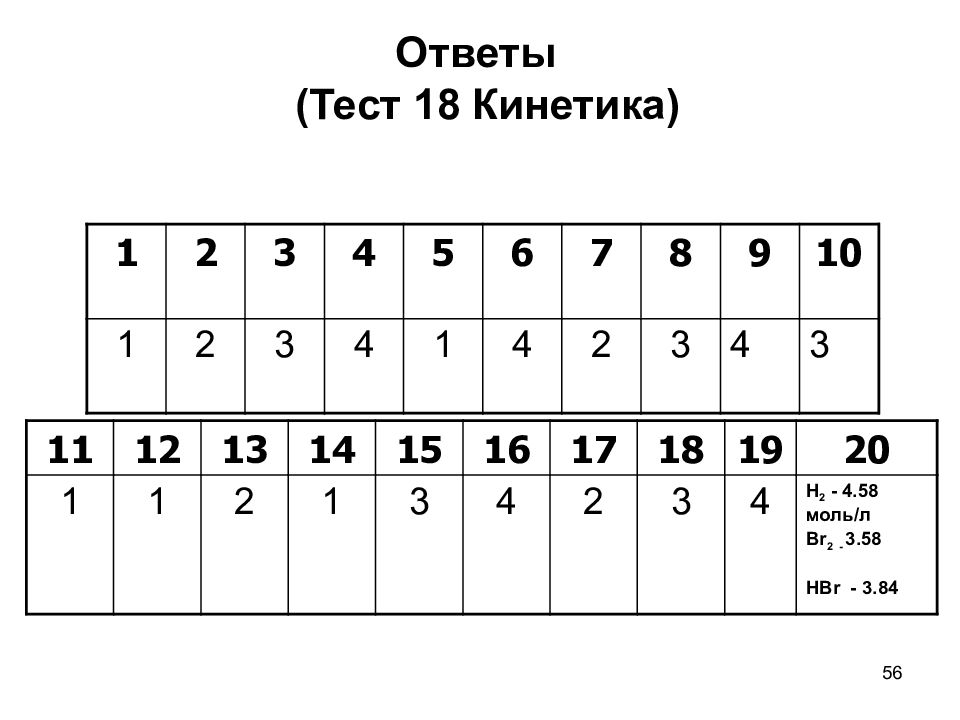
56 1 2 3 4 5 6 7 8 9 10 1 2 3 4 1 4 2 3 4 3 Ответы (Тест 18 Кинетика) 11 12 13 14 15 16 17 18 19 20 1 1 2 1 3 4 2 3 4 Н 2 - 4.58 моль/л В r 2 - 3.58 НВ r - 3.84