Слайд 2: Химическая кинетика
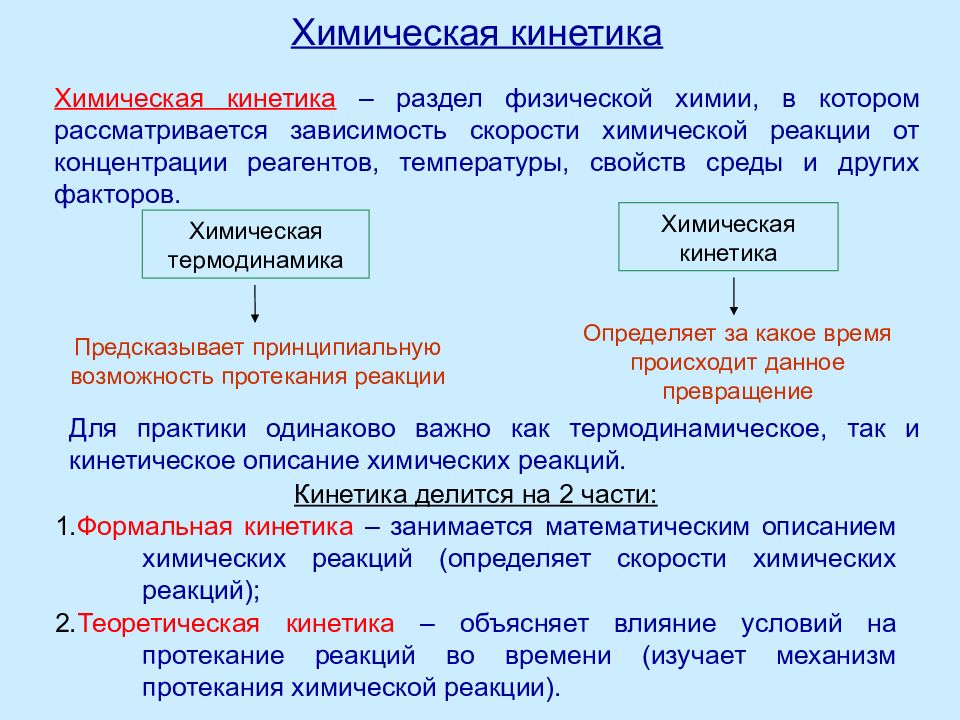
Предсказывает принципиальную возможность протекания реакции Химическая термодинамика Химическая кинетика Определяет за какое время происходит данное превращение Кинетика делится на 2 части : 1. Формальная кинетика – занимается математическим описанием химических реакций (определяет скорости химических реакций) ; 2. Теоретическая кинетика – объясняет влияние условий на протекание реакций во времени (изучает механизм протекания химической реакции). Химическая кинетика – раздел физической химии, в котором рассматривается зависимость скорости химической реакции от концентрации реагентов, температуры, свойств среды и других факторов. Для практики одинаково важно как термодинамическое, так и кинетическое описание химических реакций.
Слайд 3
В основе формальной кинетики лежит Закон Действующих Масс (основной постулат химической кинетики) k – константа скорости химической реакции По физическому смыслу k равна самой скорости, когда концентрация каждого из реагирующих веществ равна единице. Константа скорости зависит от всех факторов, которые влияют на скорость реакции, за исключением концентрации реагирующих веществ и времени. Численное значение k зависит также от выбора единиц измерения времени и концентрации. Размерность ее определяется тем кинетическим уравнением, по которому ведется ее расчет, то есть зависит от значений показателей степеней концентраций реагентов. Закон действующих масс и принцип независимости протекания реакций лежат в основе теории формальной кинетики химических реакий.
Слайд 4
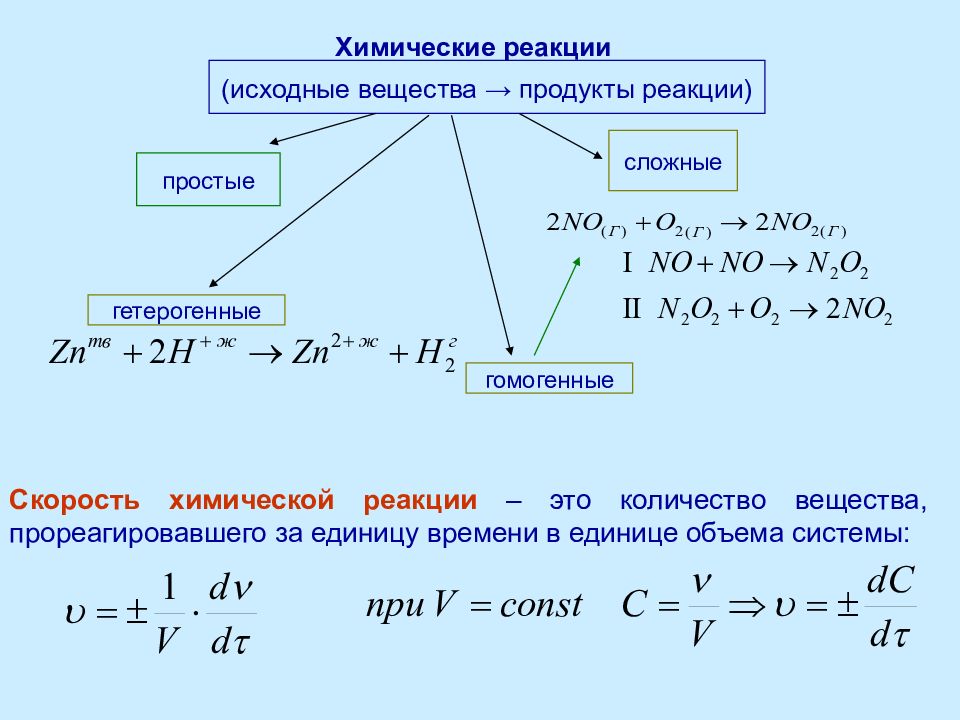
(исходные вещества → продукты реакции) простые Химические реакции сложные гомогенные гетерогенные Скорость химической реакции – это количество вещества, прореагировавшего за единицу времени в единице объема системы :
Слайд 5
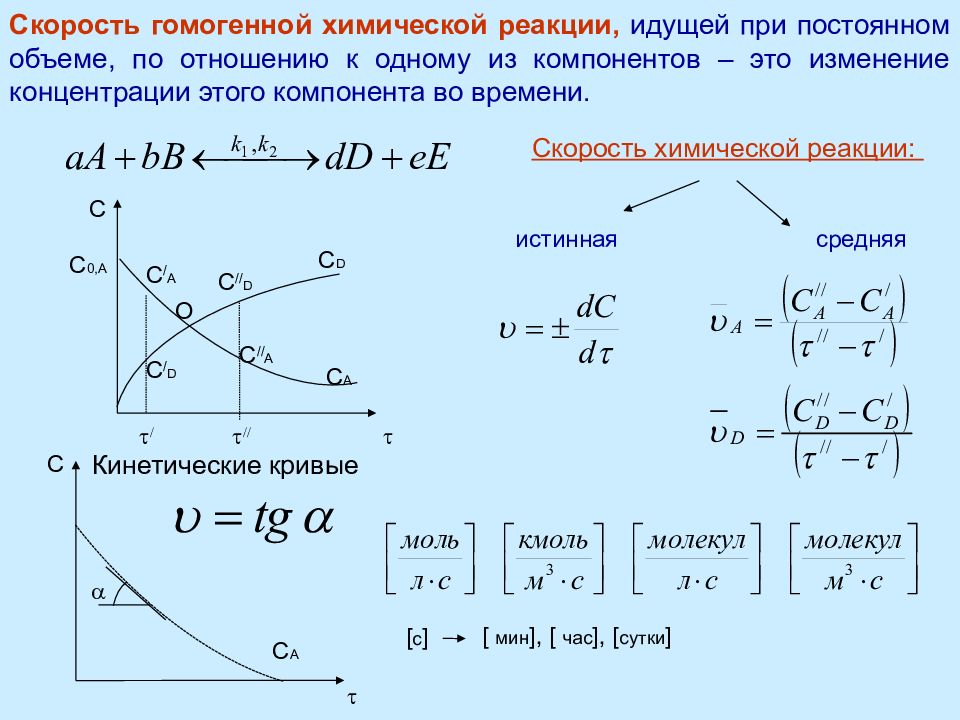
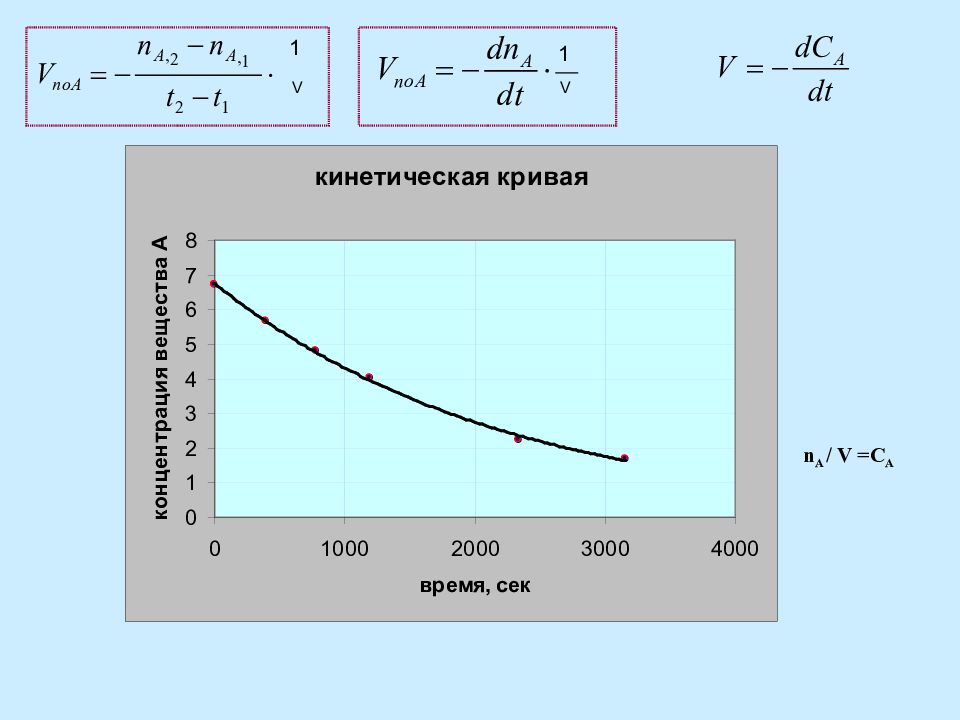
Скорость гомогенной химической реакции, идущей при постоянном объеме, по отношению к одному из компонентов – это изменение концентрации этого компонента во времени. С t С A С D O С / A С // A С / D С // D t / t // С 0,A Скорость химической реакции : истинная средняя Кинетические кривые a t С A С [ с ] [ мин ], [ час ], [ сутки ]
Слайд 6
Скорость реакции всегда положительна. Однако при протекании реакции во времени концентрации исходных веществ уменьшаются, а продуктов реакции – возрастают. В результате соотношение и производная могут быть положительными или отрицательными в зависимости от того, изучают скорость реакции по изменению концентрации одного из продуктов реакции (знак «+») или одного из исходных веществ (знак «-»). Для обратимой реакции: - скорость прямой реакции - скорость обратной реакции При равновесии: - связь кинетики с термодинамикой
Слайд 8: Основные факторы, влияющие на скорость реакции
A + 2B → C + D 1. Природа реагирующих веществ 2. Концентрация реагирующих веществ 3. Температура реакционной смеси 4. Присутствие катализатора или ингибитора реакции
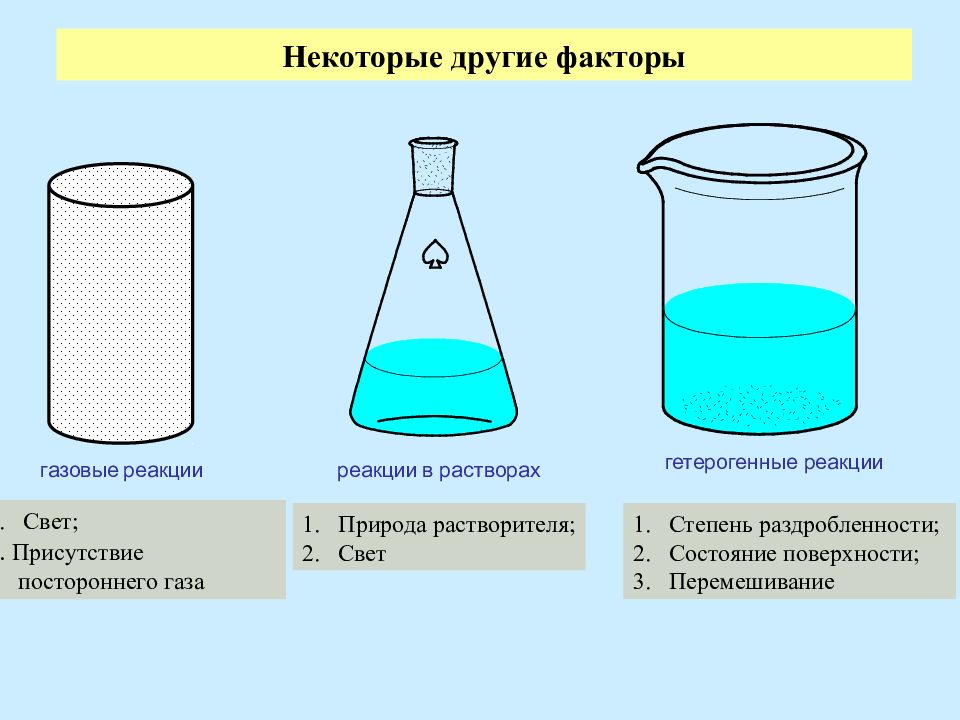
Слайд 9: Некоторые другие факторы
газовые реакции реакции в растворах гетерогенные реакции Свет; 2. Присутствие постороннего газа Природа растворителя; Свет Степень раздробленности; Состояние поверхности; Перемешивание
Слайд 10: Классификация химических реакций ( по молекулярности и порядку )
Возможность и скорость реакции определяется числом одновременных столкновений между частицами – молекулярностью - числом молекул, которые могут принимать участие в элементарном акте химического взаимодействия. Мономолекулярные реакции Бимолекулярные реакции Тримолекулярные реакции Реакции более высокой молекулярности не встречаются из-за очень малой вероятности одновременного столкновения четырех и более молекул. Молекулярность реакции – всегда целое положительное число: 1, 2, реже 3. Молекулярность реакции является теоретической характеристикой, практически реакция описывается порядком реакции, который определяется на основании экспериментальных данных. Порядок химической реакции определяется по устанавливаемому на основе экспериментальных данных виду кинетического уравнения, выражающего зависимость скорости реакции от концентрации реагирующих веществ.
Слайд 11
Порядок химической реакции – сумма показателей степеней концентраций в кинетических уравнениях реакций. Реакции могут быть I, II, III, а также 0-го и дробного порядков. Истинный и формальный порядок реакций. Истинный порядок реакции, как и моллекулярность относится к механизму реакции. Формальный порядок реакции получается из кинетического уравнения. В случае совпадения механизма реакции с кинетическим уравнением истинный и формальный порядок совпадают – это характерно для очень простых реакций. В большинстве случаев уравнение выражает суммарный результат многостадийного процесса. Порядок реакции может быть понижен, если какой-либо из реагентов берется в большом избытке. В этом случае его концентрация в соответствующей степени при прохождении химической реакции остается постоянной величиной и может быть включена в константу скорости химической реакции, которая в этом случае приобретает новое значение.
Слайд 12
Например, при избытке компонента В в реакции: кинетическое уравнение приобретает вид: ,где В этом случае общий порядок реакции становится равным n A и носит название псевдопорядка. Инверсия сахарозы с образованием фруктозы и глюкозы – реакция бимолекулярная, но n =1 Вводится представление о порядке реакции по каждому из реагирующих веществ
Слайд 13
Для характеристики скорости реакции, наряду с константой скорости, часто пользуются временем полупревращения или полураспада ( ), равным промежутку времени, в течение которого реагирует половина взятого количества вещества. Время полупревращения (полураспада) химической реакции – это время, за которое происходит уменьшение исходной концентрации в 2 раза. В основном постулате химической кинетики связывается скорость реакции с концентрацией (кинетические уравнения). Для практики важно иметь уравнения, связывающие концентрацию со временем. Для этого кинетические уравнения интегрируют.
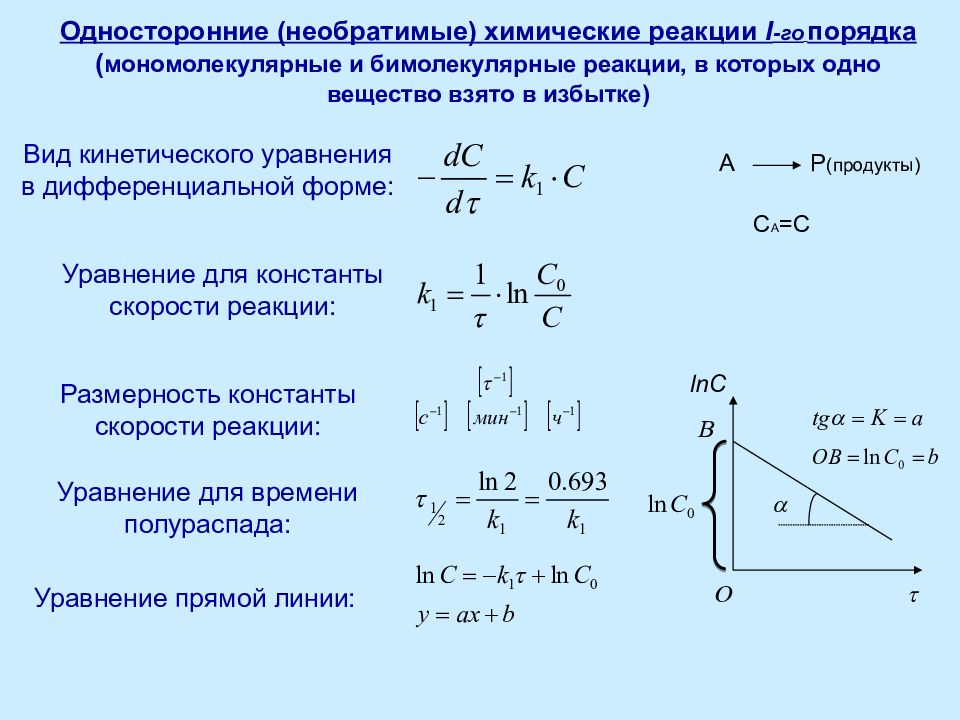
Слайд 14: Односторонние (необратимые) химические реакции I -го порядка ( мономолекулярные и бимолекулярные реакции, в которых одно вещество взято в избытке)
Вид кинетического уравнения в дифференциальной форме: Уравнение для константы скорости реакции: Размерность константы скорости реакции: Уравнение для времени полураспада: Уравнение прямой линии: lnC t a А P (продукты) С А =С O B
Слайд 15
При кинетическом изучении реакции первого порядка вместо концентраций можно использовать любые другие величины, которые меняются пропорционально концентрации, так как в уравнение для K входит отношение концентраций. Если в это уравнение подставить вместо концентрации пропорциональную ей величину, то коэффициент пропорциональности сократится и величина под логарифмом не изменится. Тогда: t / 1/2 t //1/2 t С X C 0 - вид кинетического уравнения в интегральной форме С
Слайд 16: Односторонние (необратимые) химические реакции II -го порядка
Размерность константы скорости реакции: Уравнение для времени полураспада: Уравнение прямой линии: Вид кинетического уравнения: A+B P (C a =C b =C) Уравнение для константы скорости реакции: где, х – количество прореагировавшего вещества, x=C 0 -C 1/C t O B t С X C 0 t / 1/2 t // 1/2
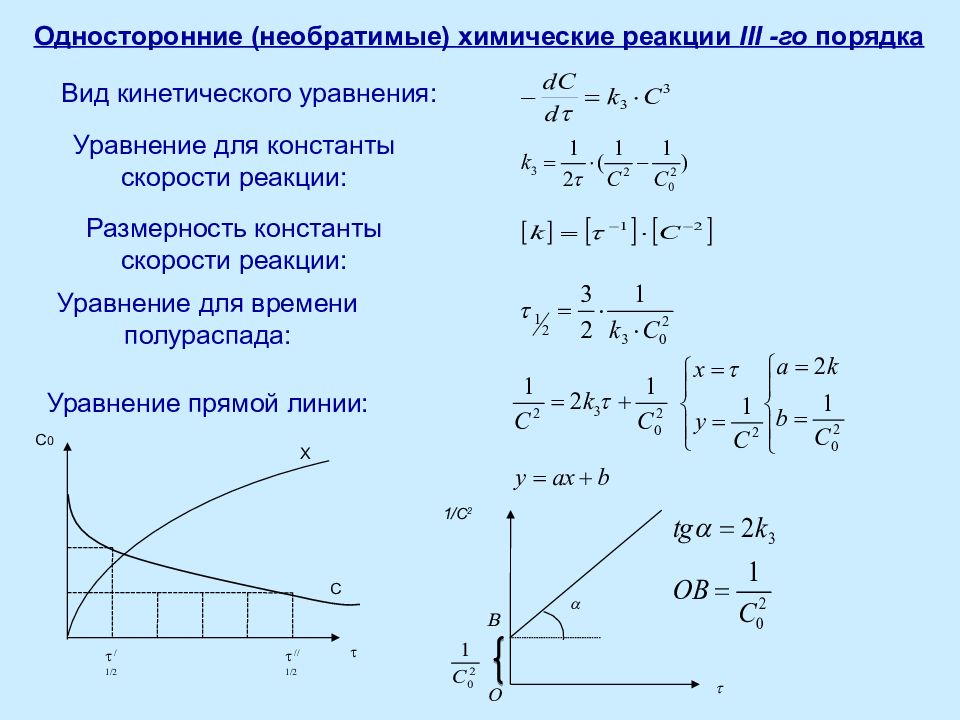
Слайд 17
Односторонние (необратимые) химические реакции III -го порядка Вид кинетического уравнения: Уравнение для константы скорости реакции: Размерность константы скорости реакции: Уравнение для времени полураспада: Уравнение прямой линии: 1/ C 2 t a t С X C 0 O B t / 1/2 t // 1/2
Слайд 18
Химические реакции 0 -го и дробного порядков Вид кинетического уравнения: Уравнение для константы скорости реакции: Нулевой порядок получается при постоянстве скорости реакции, то есть независимости ее от концентрации одного или нескольких реагирующих веществ. Реакции нулевого порядка встречаются, главным образом, среди гетерогенных реакций, протекающих на поверхности. Дробный порядок реакции указывает обычно на одновременное протекание нескольких стадий реакций, мало отличающихся друг от друга по скоростям, или на протекание обратимых реакций. Размерность константы скорости реакции: Уравнение для времени полураспада:
Слайд 19
Уравнение прямой линии: C t C 0 a Скорость реакции может определяться не только концентрацией, но и другими факторами, например, количеством катализатора в каталитических реакциях. Каталитические реакции могут иметь первый порядок по катализатору и нулевой - по реагирующему веществу. Реакции общего нулевого порядка встречаются крайне редко. Необходимо помнить, что константы скорости реакций разных порядков являются разными физическими величинами и сопоставление их абсолютных значений лишено смысла. Сопоставлять между собой можно только реакции одного порядка с учетом единых единиц измерения. t / 1/2 t // 1/2
Слайд 20
Величина Порядок химической реакции n n=1 n=2 n=3 n=0 Кинетическое уравнение Константа скорости k Размерность k Уравнение прямой Время полураспада Таблица уравнений для расчета кинетических характеристик химических реакций различного порядка
Слайд 21
1.Метод подстановки – экспериментальные данные подставляются в уравнение для К определённого порядка. Если К остаётся постоянной, то порядок реакции выбран правильно. 2.Метод измерения времени полураспада при изменении С 0 – для I -го порядка время полураспада не меняется, для II -го порядка изменяется обратно пропорционально С 0, для III -го порядка изменяется обратно пропорционально С 0 2, для 0 -го порядка прямо пропорционально С 0. Методы определения порядка реакции Метод подстановки Графический метод По зависимости Метод Вант-Гоффа Метод избытков то метод называется «Метод Освальда-Нойеса»
Слайд 22
3.Графический метод – состоит в представлении кинетических данных в виде линейной зависимости определённой функции концентрации от времени. Если функция ln C, то I - й порядок, если 1/С, то II -й, если 1/С 2, то III -й, если С, то 0 -й. 4.Метод Вант-Гоффа – состоит в определении скорости одной и той же реакции при различных концентрациях исходного вещества. 5. Метод избытков – заключается в том, что берут в избытке все вещества, кроме определенного и находят его порядок. Затем проводят реакцию при избытке других веществ, кроме заданного и находят порядок по этому веществу, затем складывая порядки по каждому веществу находят общий порядок.
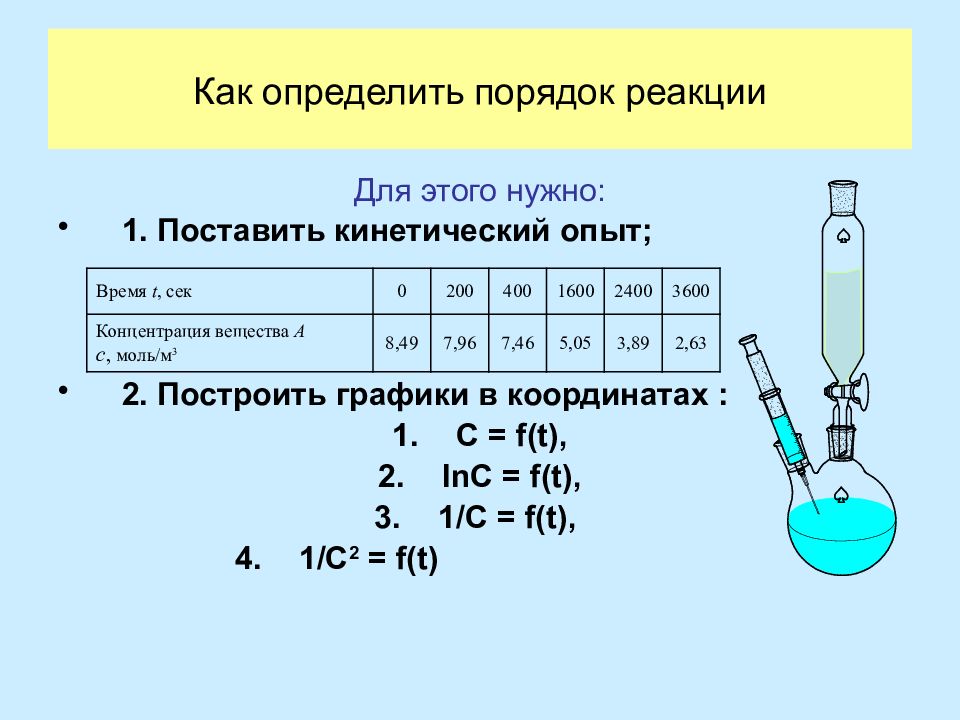
Слайд 23: Как определить порядок реакции
Для этого нужно: 1. Поставить кинетический опыт; 2. Построить графики в координатах : C = f(t), lnC = f(t), 1/C = f(t), 1/C 2 = f(t) Время t, сек 0 200 400 1600 2400 3600 Концентрация вещества А с, моль/м 3 8,49 7,96 7,46 5,05 3,89 2,63