Первый слайд презентации
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Лекция 3 ХИМИЧЕСКАЯ КИНЕТИКА
Слайд 2: Содержание
Общие понятия Скорость реакций в гомогенных и гетерогенных системах Энергия активации Влияние различных факторов на скорость химических реакций Влияние концентрации. Кинетические уравнения Влияние давления Влияние температуры Влияние катализаторов ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 3: Основные понятия химической кинетики
Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие на них Скорость реакции равна числу элементарных актов взаимодействия, происходящих за единицу времени в единице реакционного пространства Элементарный акт - каждое непосредственное взаимодействие частиц, приводящее к изменению их химического строения Элементарная стадия химического превращения - сумма всех однотипных элементарных актов Механизм химической реакции ‑ совокупность элементарных стадий, из которых складывается данная реакция ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 4: Молекулярность реакции
определяется числом молекул, одновременным взаимодействием между которыми осуществляется элементарный химический акт Мономолекулярная реакция: N 2 O 5 = NO + NO 2 + O 2 Бимолекулярная реакция: 2Н = Н 2, Тримолекулярная реакция: Cl 2 + 2 NO = 2 NOCl Реакции с молекулярностью выше трех неизвестны ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 5: Скорость реакции в гомогенных системах
– средняя скорость реакции в интервале времени, – изменение количества вещества, моль V – объем системы, л С – концентрация вещества, моль/л ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 6: C корость реакции по различным реагентам
Средняя скорость реакции 2 NO (г) + O 2 (г) = 2 NO 2 (г) по оксиду азота ( II ) по кислороду ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 7: Определение средней скорости реакции
0 ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА α ∆С С 0 С 1 С Модуль I. Лекция 3. Химическая кинетика
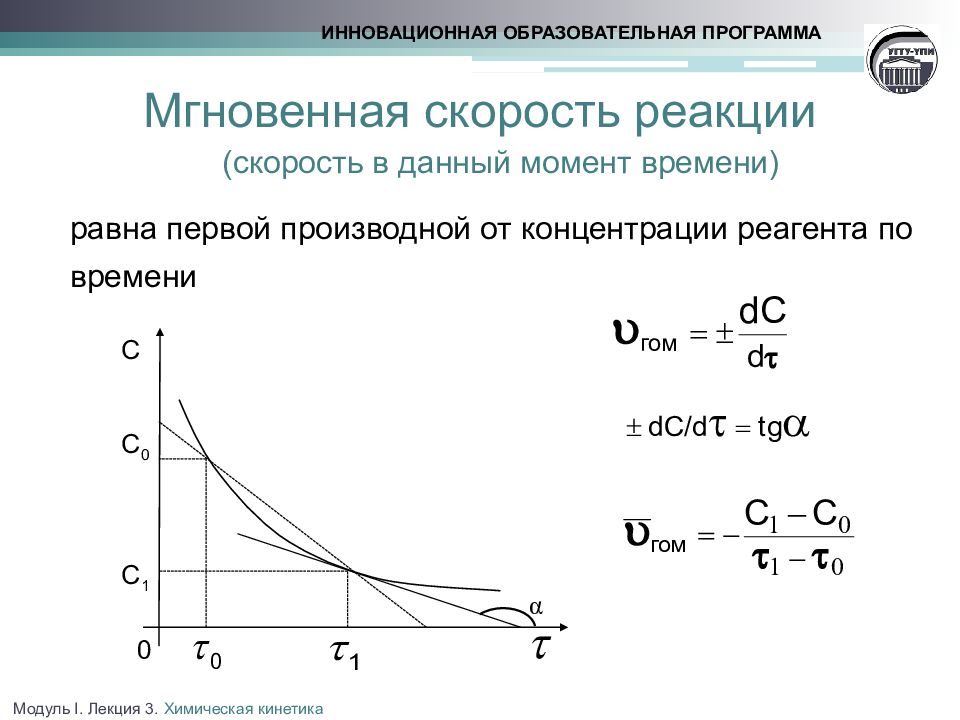
Слайд 8: Мгновенная скорость реакции
(скорость в данный момент времени) равна первой производной от концентрации реагента по времени ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА α С 0 С 1 0 С Модуль I. Лекция 3. Химическая кинетика
В гетерогенной системе взаимодействие компонентов происходит на поверхности раздела фаз S - площадь поверхности раздела фаз, м 2 Размерность скорости реакции в гетерогенных системах ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Скорость реакции в гетерогенных системах Модуль I. Лекция 3. Химическая кинетика
Слайд 10: Энергия активации
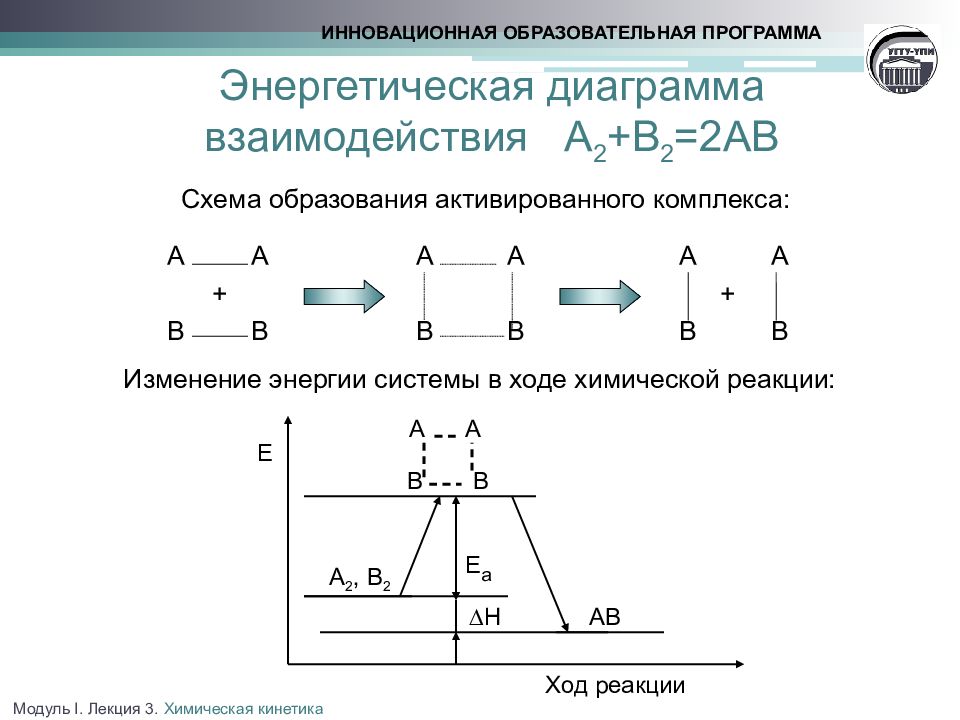
Химическое взаимодействие осуществляется при столкновении частиц, которые обладают избытком энергии, достаточным для преодоления сил взаимного отталкивания их электронных оболочек При эффективном соударении частицы переходят в неустойчивое промежуточное состояние -нестабильный активированный комплекс, с более высоким уровнем энергии, чем средний уровень энергии частиц системы Энергия активации (Е а ) - минимальная избыточная энергия частиц по сравнению со средним уровнем, необходимая для протекания реакции ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Схема образования активированного комплекса : А А А А А А + + В В В В В В Изменение энергии системы в ходе химической реакции: ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Ход реакции А А В Е а ∆Н АВ Е А 2, В 2 В Модуль I. Лекция 3. Химическая кинетика
Слайд 12: Влияние концентрации на скорость химической реакции
Закон действующих масс: скорость элементарной химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам Элементарные реакции - реакции, протекающие в одну стадию Кинетическое уравнение - математическая зависимость скорости реакции от концентрации Кинетические уравнения элементарных реакций: бимолекулярной A + B = C тримолекулярной 2 A + B = D k – константа скорости С А, С В – концентрации веществ, моль/л ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 13: Порядок химической реакции
Показатели степени концентрации реагентов в кинетическом уравнении называют порядком реакции по каждому из реагентов Реакции A + bB + cC + … = eE + fF + … соответствует кинетическое уравнение где , , - порядок реакции по веществам А, В и С Общий порядок реакции (или порядок реакции) определяется суммой показателей степени концентраций реагентов в кинетическом уравнении: + + 2 N 2 O = 2 N 2 + O 2 реакция нулевого порядка 2 N 2 O 5 = 4 NO 2 + O 2 реакция первого порядка H 2 + I 2 = 2 HI реакция второго порядка ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 14: Особенности гетерогенных реакций
Стадии гетерогенных реакций : подвод вещества к реакционной поверхности химическое взаимодействие отвод продукта реакции от поверхности Для реакции C + O 2 = CO 2 лимитирующая стадия - подвод вещества Скорость реакции CaCO 3 + 2 HCl = CaCl 2 + H 2 O + CO 2 определяется скоростью химического взаимодействия I стадия : CaCO 3 + H + = Ca 2+ + HCO 3 ‑ II стадия : HCO 3 ‑ + H + = H 2 O + CO 2 I стадия лимитирующая ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 15: Влияние давления на скорость химической реакции
Влияние давления существенно для реакций с участием газообразных веществ, так как концентрация реагентов меняется пропорционально давлению ( T = const) Пример. Реакции 2 NO (г) + 2 H 2(г) = N 2(г) + 2Н 2 О (г) соответствует кинетическое уравнение При увеличении давления в 3 раза константа скорости не изменяется, а концентрации реагирующих веществ увеличиваются в 3 раза скорость увеличивается в 27 раз ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 16: Правило Вант-Гоффа
При повышении температуры на каждые 10 0 скорость большинства реакций увеличивается в 2 4 раза: и ‑ скорость реакции при температурах Т 1 и Т 2 (Т 2 > Т 1 ) ‑ температурный коэффициент скорости, равный 2 4 Например, при повышении температуры с 20 до 40 0 С скорость реакции (γ = 2) увеличивается в 4 раза: ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
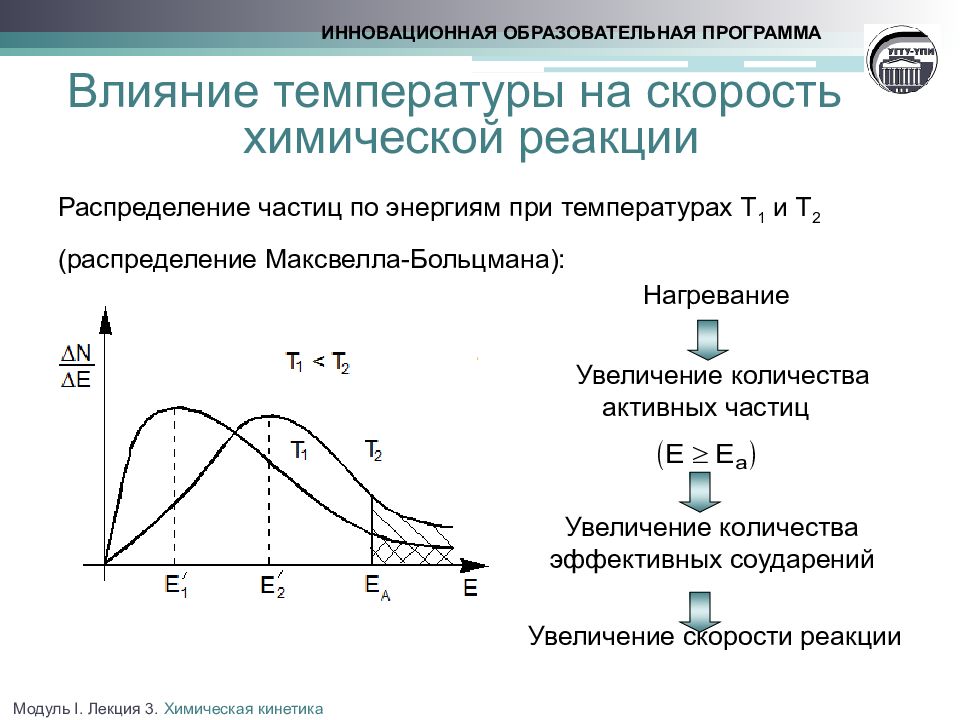
Слайд 17: Влияние температуры на скорость химической реакции Распределение частиц по энергиям при температурах Т 1 и Т 2 (распределение Максвелла-Больцмана):
Нагревание Увеличение количества активных частиц Увеличение количества эффективных соударений Увеличение скорости реакции ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 18: Зависимость константы скорости от температуры
Уравнение Аррениуса Е а ‑ энергия активации, кДж/моль R ‑ универсальная газовая постоянная, равная 8,31∙10 -3 Т ‑ абсолютная температура, К А - коэффициент пропорциональности, отражающий вероятность столкновения активных частиц; величина постоянная для данной реакции ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Слайд 19: Влияние катализаторов на скорость химической реакции
Катализаторы - вещества, увеличивающие скорость реакции и остающиеся в конце реакции химически неизменными Катализаторы применяют для изменения скорости термодинамически возможных процессов ( G <0) Ингибиторы - вещества, снижающие скорость реакции Промоторы – вещества, добавки которых к катализатору усиливают эффективность его действия Автокатализ – увеличение скорости реакции под действием одного из продуктов Выделяют гомогенный и гетерогенный катализ 2 SO 2(г) + О 2(г) = 2 SO 3(г) катализатор NO (г) - катализатор V 2 O 5(к) или Pt ( к ) - гомогенный катализ гетерогенный катализ ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
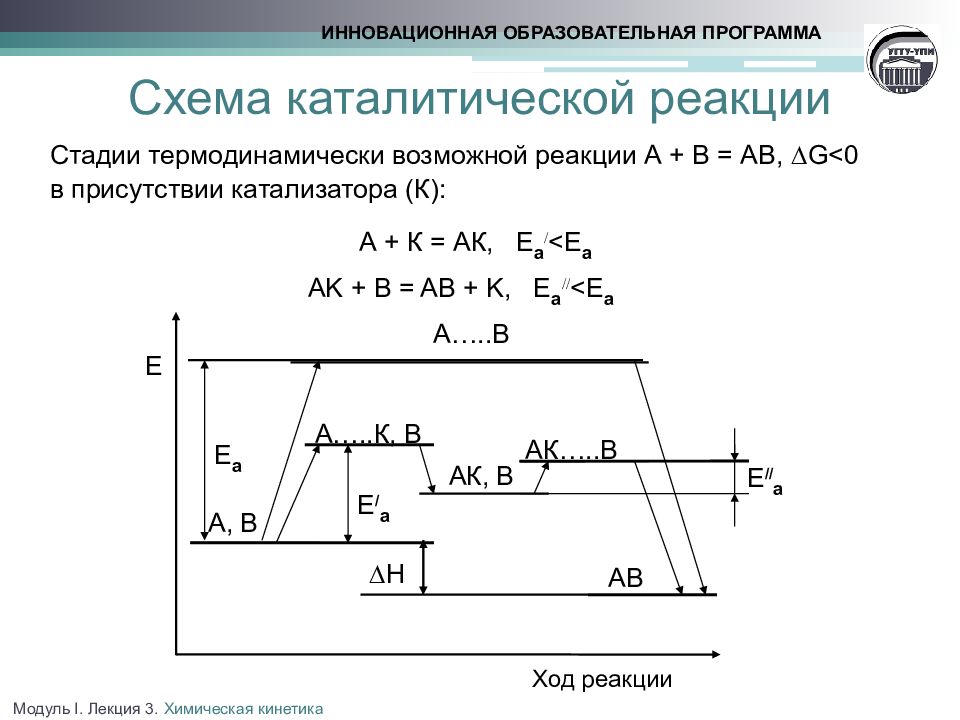
Слайд 20: Схема каталитической реакции
Стадии термодинамически возможной реакции А + В = АВ, G <0 в присутствии катализатора (К): А + К = АК, Е а < E а AK + B = AB + K, Е а < E а ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Е Ход реакции А…..В А, В Е / а ∆Н А…..К, В АК, В АК…..В Е а АВ Е // а Модуль I. Лекция 3. Химическая кинетика
Слайд 21: Заключение
Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие на них Скорость реакции ‑ изменение количества любого из реагирующих веществ или продуктов реакции за единицу времени в единице реакционного пространства Энергия активации ‑ минимальная избыточная энергия частиц по сравнению со средним уровнем, необходимая для протекания реакции Скорость реакции зависит от C, p, T и катализатора: зависимость скорости от концентраций реагирующих веществ выражается экспериментально получаемым кинетическим уравнением; изменение давления в системе приводит к пропорциональному изменению концентраций газообразных реагентов и соответствующему изменению скорости в соответствии с правилом Вант-Гоффа при повышении температуры на каждые 10 о скорость большинства реакций увеличивается в 2 4 раза катализаторы ‑ вещества, увеличивающие скорость реакции за счет снижения энергии активации ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика
Последний слайд презентации: ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Лекция 3 ХИМИЧЕСКАЯ КИНЕТИКА: Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001 Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Высш. шк., 1994 Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия, 2000 Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007 Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004 Стромберг А.Г., Семченко Д.П. Физическая химия. - М.: Высш. шк., 2003 Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000 ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА Модуль I. Лекция 3. Химическая кинетика