Первый слайд презентации
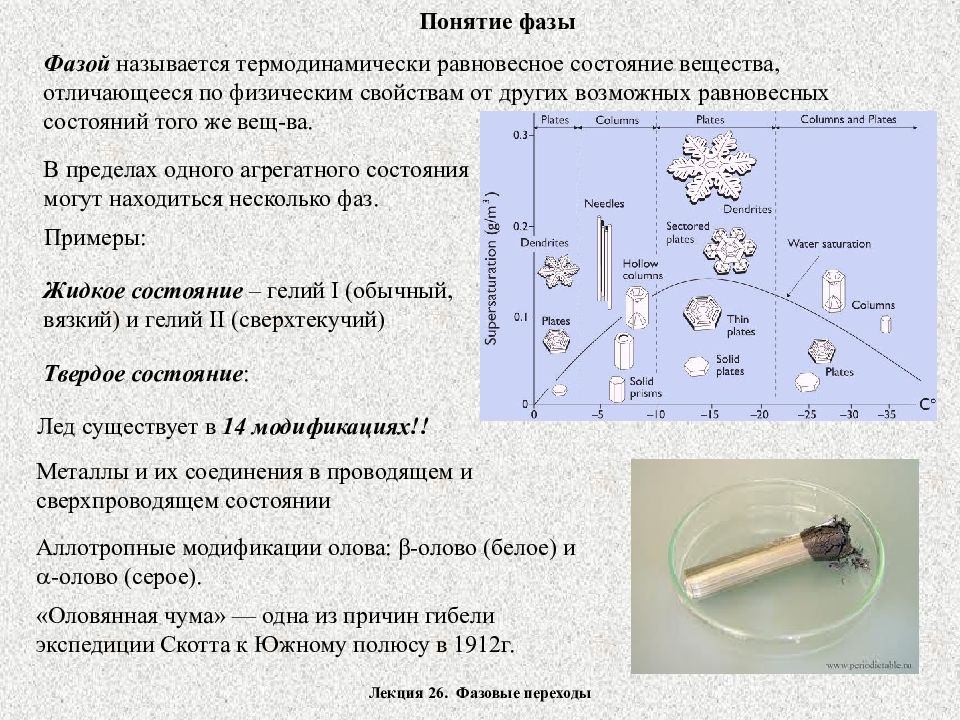
Лекция 26. Фазовые переходы Понятие фазы Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещ-ва. В пределах одного агрегатного состояния могут находиться несколько фаз. Примеры: Жидкое состояние – гелий I (обычный, вязкий) и гелий II (сверхтекучий) Твердое состояние : «Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912г. Аллотропные модификации олова: β -олово (белое) и -олово (серое). Металлы и их соединения в проводящем и сверхпроводящем состоянии Лед существует в 14 модификациях!!
Слайд 2
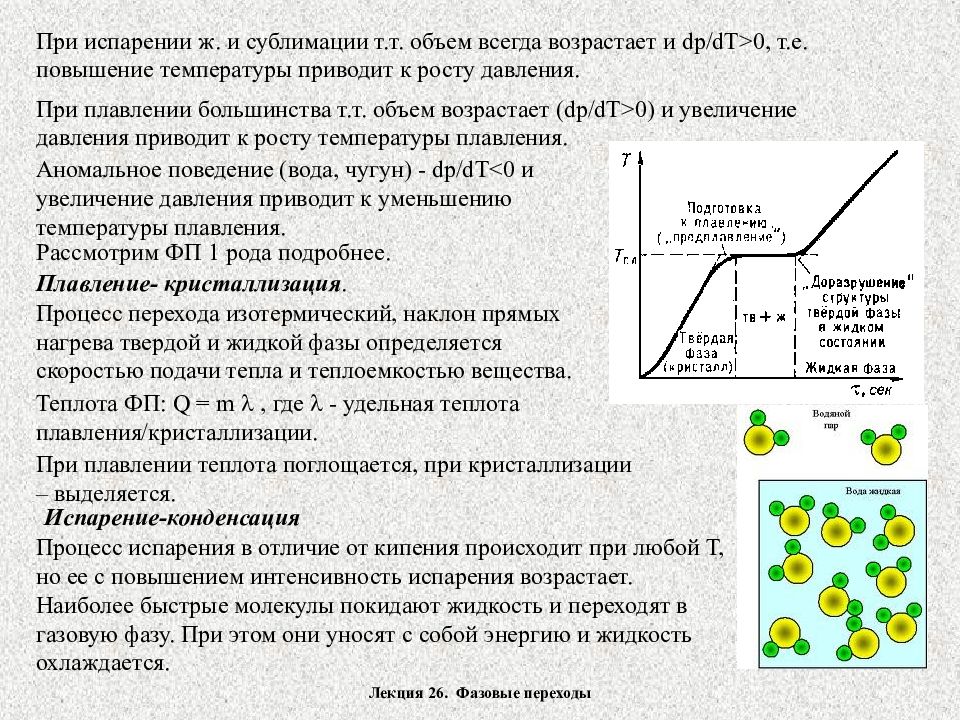
Лекция 26. Фазовые переходы Фазовые переходы первого рода Переход вещества из одной фазы в другую называется фазовым переходом. ФП 1-го рода сопровождается поглощением или выделением теплоты, называемой теплотой ФП. ФП 1 рода характеризуется постоянством температуры, изменением энтропии и объема. Примеры ФП 1 рода – переходы между агрегатными состояниями вещества – испарение/конденсация, плавление/кристаллизация, возгонка/конденсация. На диаграмме состояния в координатах РТ изображены кривые испарения, плавления и сублимации, разделяющие твердую, жидкую и газообразную фазы. Точка пересечения кривых – тройная точка. В ней одновременно устойчиво существуют три фазы. Каждое вещество имеет только одну тройную точку. Для воды тройная точка 273.16К. ТД расчет равновесия 2-х фаз проводится по уравнению Клайперона-Клаузиуса: L - скрытая теплота ФП, ( V2-V1) – изменение объема при переходе из 1-й фазы во 2-ю, Т- температура изотермического перехода.
Слайд 3
Лекция 26. Фазовые переходы При испарении ж. и сублимации т.т. объем всегда возрастает и dp/dT>0, т.е. повышение температуры приводит к росту давления. При плавлении большинства т.т. объем возрастает ( dp/dT>0 ) и увеличение давления приводит к росту температуры плавления. Аномальное поведение (вода, чугун) - dp/dT<0 и увеличение давления приводит к уменьшению температуры плавления. Рассмотрим ФП 1 рода подробнее. Плавление- кристаллизация. Процесс перехода изотермический, наклон прямых нагрева твердой и жидкой фазы определяется скоростью подачи тепла и теплоемкостью вещества. Теплота ФП: Q = m , где - удельная теплота плавления/кристаллизации. При плавлении теплота поглощается, при кристаллизации – выделяется. Испарение-конденсация Процесс испарения в отличие от кипения происходит при любой Т, но ее с повышением интенсивность испарения возрастает. Наиболее быстрые молекулы покидают жидкость и переходят в газовую фазу. При этом они уносят с собой энергию и жидкость охлаждается.
Слайд 4
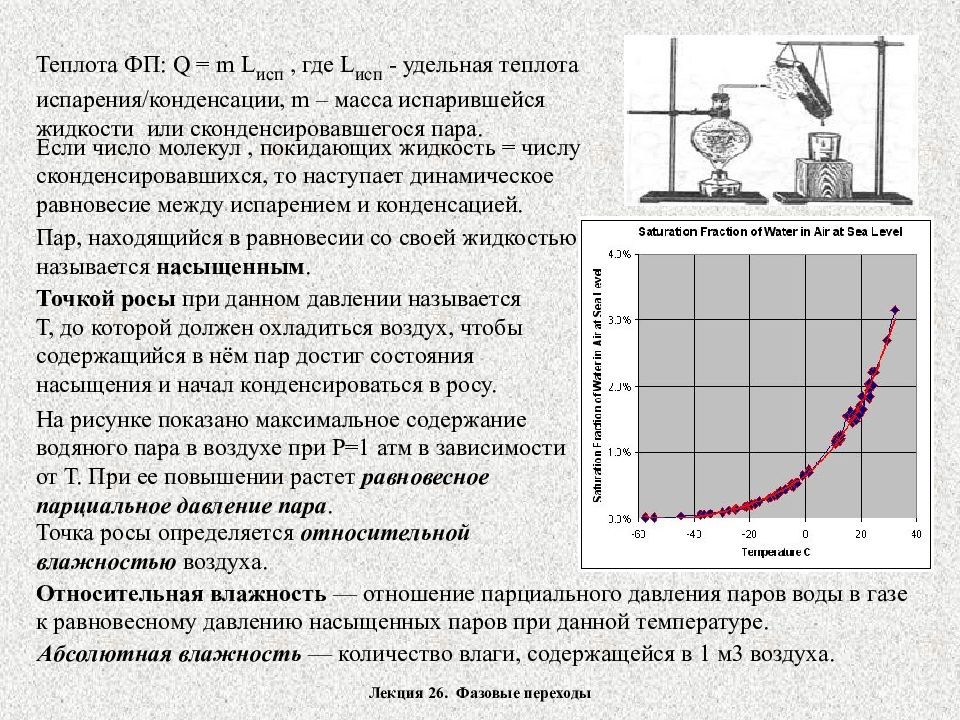
Лекция 26. Фазовые переходы Теплота ФП: Q = m L исп, где L исп - удельная теплота испарения/конденсации, m – масса испарившейся жидкости или сконденсировавшегося пара. Если число молекул, покидающих жидкость = числу сконденсировавшихся, то наступает динамическое равновесие между испарением и конденсацией. Пар, находящийся в равновесии со своей жидкостью называется насыщенным. Точкой росы при данном давлении называется Т, до которой должен охладиться воздух, чтобы содержащийся в нём пар достиг состояния насыщения и начал конденсироваться в росу. На рисунке показано максимальное содержание водяного пара в воздухе при Р=1 атм в зависимости от Т. При ее повышении растет равновесное парциальное давление пара. Точка росы определяется относительной влажностью воздуха. Относительная влажность — отношение парциального давления паров воды в газе к равновесному давлению насыщенных паров при данной температуре. Абсолютная влажность — количество влаги, содержащейся в 1 м3 воздуха.
Слайд 5
Лекция 26. Фазовые переходы Давление насыщенных паров воды сильно растёт при увеличении температуры. При изобарическом охлаждении воздуха с постоянной концентрацией пара наступает точка росы, когда пар насыщается и его избыток конденсируется в виде тумана или кристалликов льда. В физике атмосферы это процессы образования облаков и образование атмосферных фронтов; теплота конденсации атмосферного водяного пара обеспечивает энергией механизм возникновения и развития тропических циклонов (ураганов). Для определения влажности воздуха используются приборы, которые называются психрометрами и гигрометрами. волосяной гигрометр психрометр Психрометр Августа состоит из двух термометров — сухого и влажного. Влажный термометр показывает Т ниже, чем сухой, так как его резервуар обмотан тканью, смоченной в воде, которая, испаряясь, охлаждает его. Интенсивность испарения зависит от относительной влажности воздуха. По показаниям сухого и влажного термометров находят относительную влажность воздуха по психрометрическим таблицам. Волосяной гигрометр механического действия использует свойство волоса удлиняться во влажном воздухе.
Слайд 6
Лекция 26. Фазовые переходы сублимация йода Испарение т.т. непосредственно в газовую фазу минуя жидкое состояние – сублимация. Обратный процесс – десублимация. Пример сублимирующих веществ – йод, твердая углекислота, вода. Электронные влагомеры измеряют диэлектрическую проницаемость пористых гидрофильных диэлектриков, которая сильно зависит от влажности. Отн. влажность воздуха — важный экологический показатель среды. При отклонениях от нормы наблюдается быстрая утомляемость человека, ухудшение восприятия и памяти. Хранение продуктов и материалов, эксплуатация техники возможна в строго определённом диапазоне влажности воздуха (климатическое исполнение приборов). Пример высоких природных значений влажности: влажные тропические леса 80-95 %, тёплые субтропики — 75-80 %, холодные субтропики — 50-75 %. Применение сублимации: Очистка твердых веществ в сублиматоре. При определенной Т одно из веществ в смеси возгоняется с более высокой скоростью, чем другое. Пары очищаемого вещества конденсируют на охлаждаемой поверхности. Сублимационная сушка. Сублимированные продукты значительно превосходят сушеные по пищевой ценности, т.к. не происходит термического разрушения полезных вешеств.
Слайд 7
Лекция 26. Фазовые переходы Кипение – ФП 1 рода из жидкого в газообразное состояние, совершающийся по всему объему жидкости при определенной температуре. Рассмотрим процесс кипения. При нагреве ж. в сосуде начинает выделяться растворенный воздух в виде мелких пузырьков на стенках сосуда. Испарение ж. происходит на границах этих пузырьков и они увеличиваются, заполняясь паром. Когда сила Архимеда превысит силу поверхностного натяжения, пузырек отрывается от стенки и всплывает. Если ж. не прогрелась, то в ее верхних слоях пар в пузырьке конденсируется и пузырек исчезает (а). Возникающий при этом гидравлический удар (см. лекцию по гидродинамике) создает шум – чайник всегда шумит перед закипанием. После равномерного прогрева ж. пузырьки поднимаются на поверхность – идет кипение. Количественный критерий – давление насыщенного пара в пузырьке равно атмосферному. Для воды если Р <1 атм, то кипение при Т < 100 о С, если Р > 1 атм, то кипение Т > 100 о С
Слайд 8
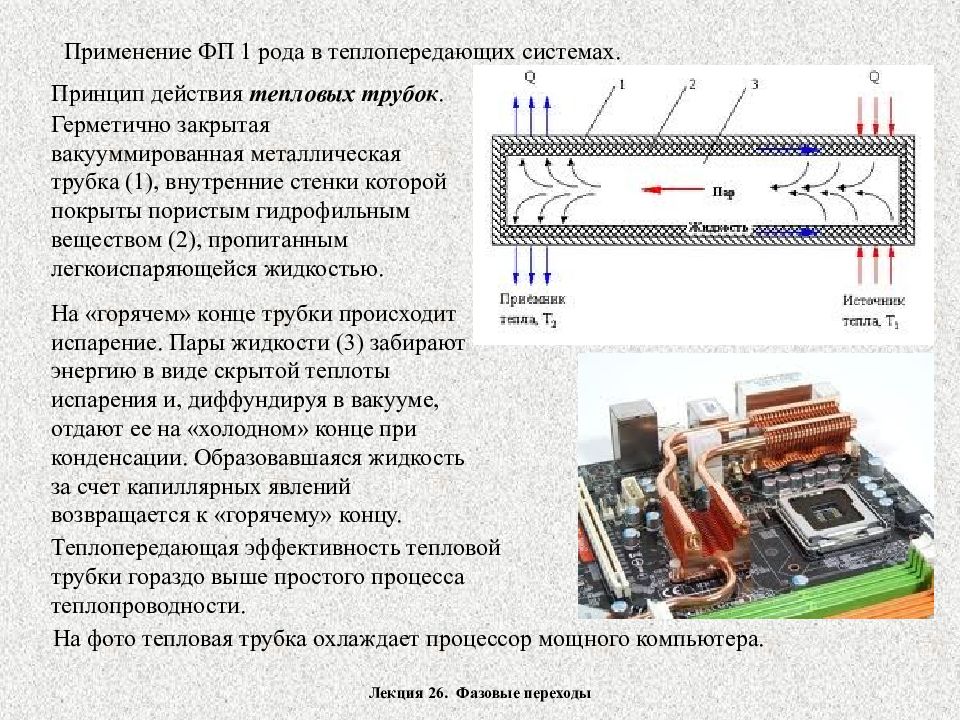
Лекция 26. Фазовые переходы Применение ФП 1 рода в теплопередающих системах. Принцип действия тепловых трубок. Герметично закрытая вакууммированная металлическая трубка (1), внутренние стенки которой покрыты пористым гидрофильным веществом (2), пропитанным легкоиспаряющейся жидкостью. На «горячем» конце трубки происходит испарение. Пары жидкости (3) забирают энергию в виде скрытой теплоты испарения и, диффундируя в вакууме, отдают ее на «холодном» конце при конденсации. Образовавшаяся жидкость за счет капиллярных явлений возвращается к «горячему» концу. Теплопередающая эффективность тепловой трубки гораздо выше простого процесса теплопроводности. На фото тепловая трубка охлаждает процессор мощного компьютера.
Последний слайд презентации: Лекция 26. Фазовые переходы Понятие фазы Фазой называется термодинамически
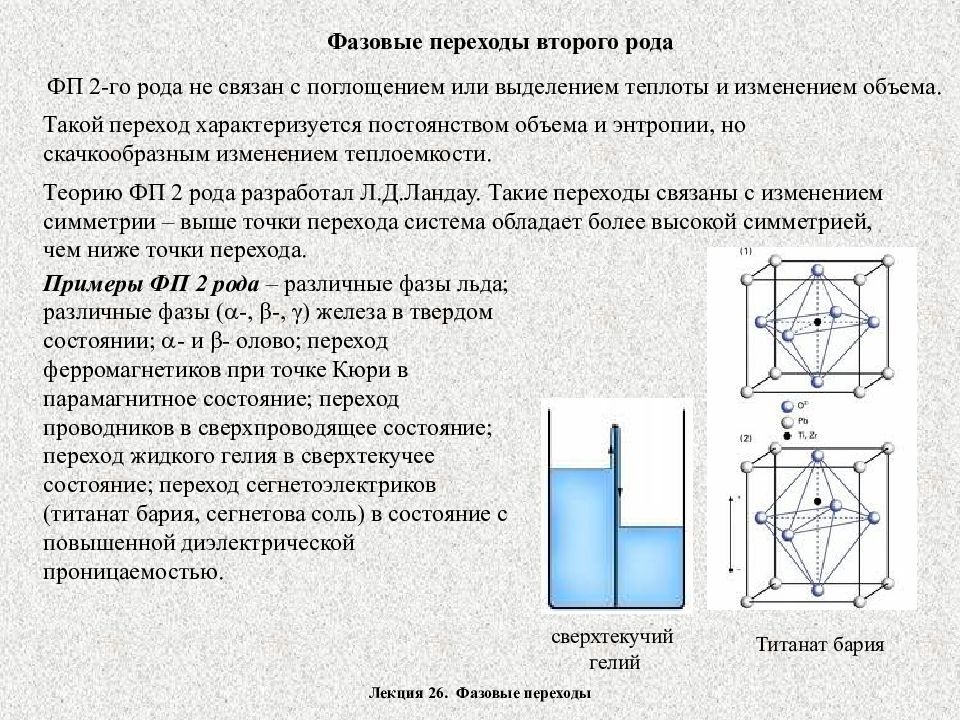
Лекция 26. Фазовые переходы Фазовые переходы второго рода ФП 2-го рода не связан с поглощением или выделением теплоты и изменением объема. Такой переход характеризуется постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Теорию ФП 2 рода разработал Л.Д.Ландау. Такие переходы связаны с изменением симметрии – выше точки перехода система обладает более высокой симметрией, чем ниже точки перехода. Титанат бария сверхтекучий гелий Примеры ФП 2 рода – различные фазы льда; различные фазы ( -, β -, γ ) железа в твердом состоянии; - и β - олово; переход ферромагнетиков при точке Кюри в парамагнитное состояние; переход проводников в сверхпроводящее состояние; переход жидкого гелия в сверхтекучее состояние; переход сегнетоэлектриков (титанат бария, сегнетова соль) в состояние с повышенной диэлектрической проницаемостью.