Первый слайд презентации
Национальный исследовательский Томский политехнический университет «Прикладная химическая термодинамика» Смороков Андрей Аркадьевич wolfraum@yandex.ru vk.com/wolfraum1993 1
Слайд 3
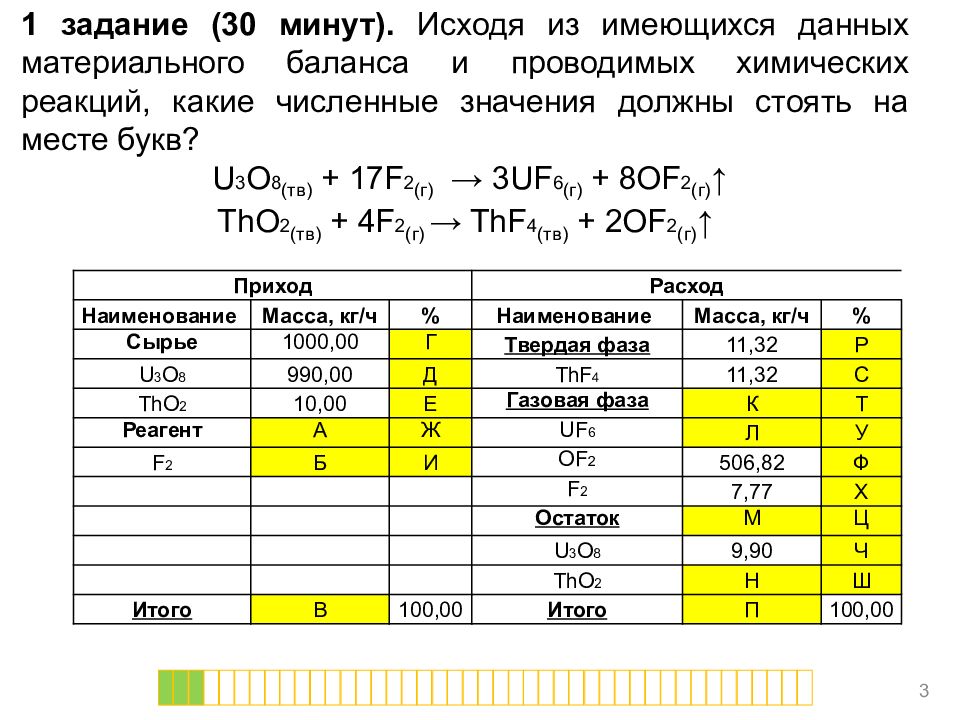
1 задание (30 минут). Исходя из имеющихся данных материального баланса и проводимых химических реакций, какие численные значения должны стоять на месте букв? U 3 O 8 (тв) + 17 F 2 (г) → 3UF 6 (г) + 8OF 2 (г) ↑ ThO 2 (тв) + 4F 2 (г) → ThF 4 (тв) + 2OF 2 (г) ↑ 3 Приход Расход Наименование Масса, кг/ч % Наименование Масса, кг/ч % Сырье 1000,00 Г Твердая фаза 11, 32 Р U 3 O 8 99 0,00 Д ThF 4 11, 32 С ThO 2 1 0,00 Е Газовая фаза К Т Реагент А Ж UF 6 Л У F 2 Б И OF 2 506,82 Ф F 2 7,77 Х Остаток М Ц U 3 O 8 9,90 Ч ThO 2 Н Ш Итого В 100,00 Итого П 100,00
Слайд 4
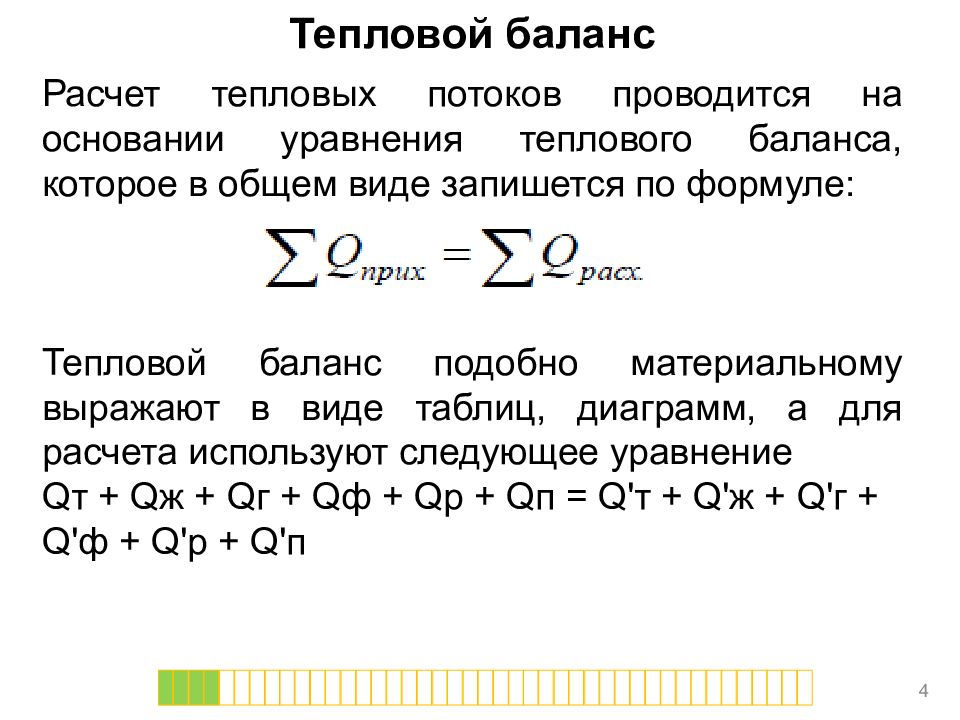
Расчет тепловых потоков проводится на основании уравнения теплового баланса, которое в общем виде запишется по формуле: Тепловой баланс подобно материальному выражают в виде таблиц, диаграмм, а для расчета используют следующее уравнение Q т + Q ж + Q г + Q ф + Q р + Q п = Q' т + Q' ж + Q' г + Q' ф + Q' р + Q' п 4 Тепловой баланс
Слайд 5
где Qт, Qж, Qг – количество теплоты, вносимое в аппарат твердыми, жидкими и газообразными веществами соответственно; Q'т, Q'ж, Q'г – количество теплоты, уносимое из аппарата выходящими продуктами и полупродуктами реакции и не прореагировавшими исходными веществами в твердом, жидком и газообразном виде; Qф и Q'ф – теплота физических процессов, происходящих с выделением и поглощением (Q'ф) теплоты; Qр и Q'р – количество теплоты, выделяющееся в результате экзо- и эндотермических реакций (Q'р); Qп – количество теплоты, подводимое в аппарат извне (в виде дымовых газов, нагретого воздуха, сжигания топлива, электроэнергии и т.п.); Q'п – потери тепла в окружающую среду, а также отвод тепла через холодильники, помещенные внутри аппарата. 5 Тепловой баланс
Слайд 6
Величины Qт,Qж,Qг, Q'т, Q'ж, Q'г рассчитывают для каждого вещества, поступающего в аппарат и выходящего из него по формуле 6
Слайд 7
Для расчета теплового баланса необходимы: Рассчитанный материальный баланс. Расчет теплового эффекта химической реакции. Определение тепловых эффектов фазовых переходов (при необходимости). Определение теплоемкостей веществ, принимающих участие в реакции. 7
Слайд 8
SiO 2 (тв) + 3NH 4 HF 2 (тв) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Материальный баланс переработки 1000 кг диоксида кремния. Степень протекания реакции составляет 90 % при 210 °С. 8 Приход Расход Наименование Масса, кг/ч % Наименование Масса, кг/ч % Сырье Твердый продукт SiO 2 (NH 4 ) 2 SiF 6 Реагент Отходящие газы NH 4 HF 2 NH 3 H 2 O Непрореагировавший остаток SiO 2 NH 4 HF 2 Итого 100,00 Итого 100,00
Слайд 9
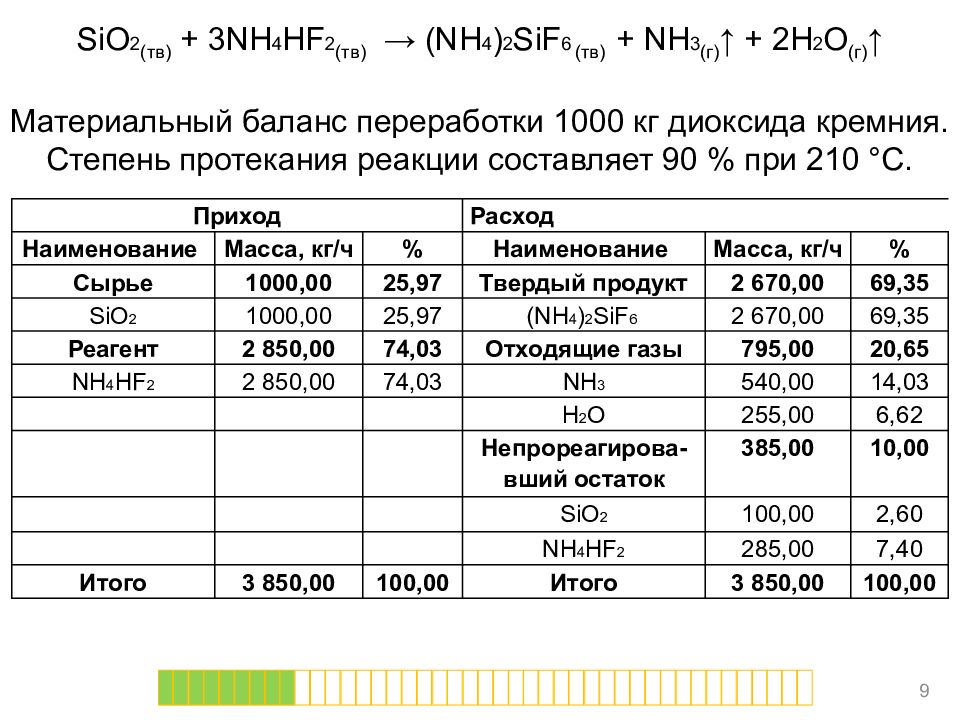
SiO 2 (тв) + 3NH 4 HF 2 (тв) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Материальный баланс переработки 1000 кг диоксида кремния. Степень протекания реакции составляет 90 % при 210 °С. 9 Приход Расход Наименование Масса, кг/ч % Наименование Масса, кг/ч % Сырье 1000,00 25,97 Твердый продукт 2 670,00 69,35 SiO 2 1000,00 25,97 (NH 4 ) 2 SiF 6 2 670,00 69,35 Реагент 2 850,00 74,03 Отходящие газы 795,00 20,65 NH 4 HF 2 2 850,00 74,03 NH 3 540,00 14,03 H 2 O 255,00 6,62 Непрореагирова-вший остаток 385,00 10,00 SiO 2 100,00 2,60 NH 4 HF 2 285,00 7,40 Итого 3 850,00 100,00 Итого 3 850,00 100,00
Слайд 10
Для расчета теплового баланса необходимы: Рассчитанный материальный баланс. ( + ) Определение теплоемкостей веществ, принимающих участие в реакции. Расчет теплового эффекта химической реакции. Определение тепловых эффектов фазовых переходов (при необходимости). 10
Слайд 11
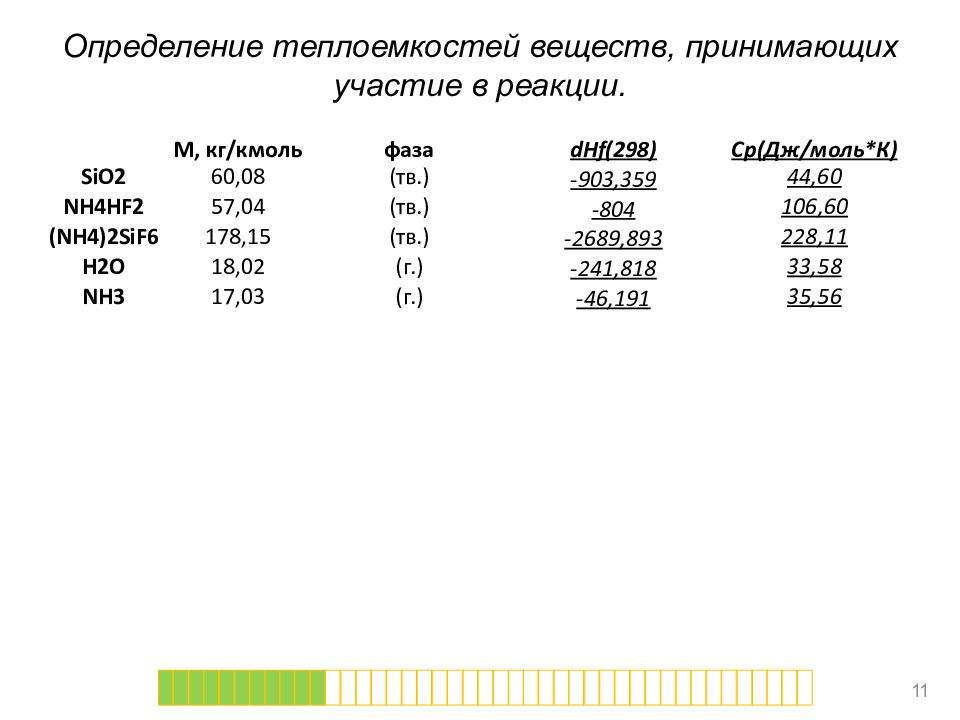
Определение теплоемкостей веществ, принимающих участие в реакции. 11 М, кг/ кмоль фаза dHf (298) Cp ( Дж/моль*К) SiO2 60,08 ( тв.) -903,359 44,60 NH4HF2 57,04 ( тв.) -804 106,60 (NH4)2SiF6 178,15 ( тв.) -2689,893 228,11 H2O 18,02 (г.) -241,818 33,58 NH3 17,03 (г.) -46,191 35,56
Слайд 12
Для расчета теплового баланса необходимы: Рассчитанный материальный баланс. ( + ) Определение теплоемкостей веществ, принимающих участие в реакции. ( + ) Расчет теплового эффекта химической реакции. Определение тепловых эффектов фазовых переходов (при необходимости). 12
Слайд 13
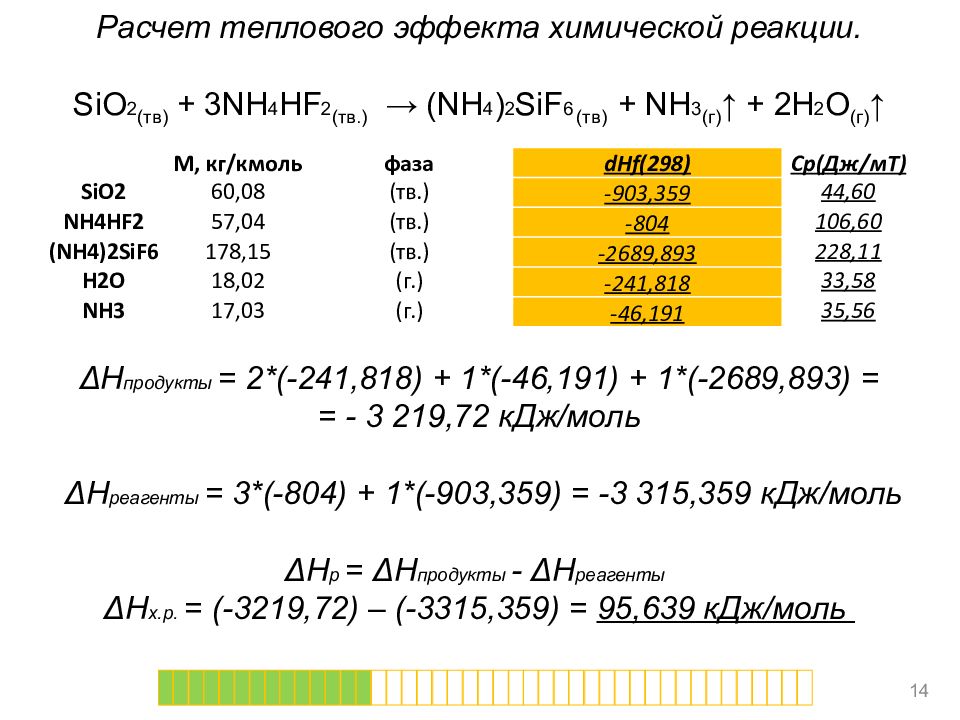
Расчет теплового эффекта химической реакции. SiO 2 (тв) + 3NH 4 HF 2 (тв.) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Как? 13 М, кг/ кмоль фаза dHf (298) Cp ( Дж/ мТ ) SiO2 60,08 ( тв.) -903,359 44,60 NH4HF2 57,04 ( тв.) -804 106,60 (NH4)2SiF6 178,15 ( тв.) -2689,893 228,11 H2O 18,02 (г.) -241,818 33,58 NH3 17,03 (г.) -46,191 35,56
Слайд 14
Расчет теплового эффекта химической реакции. SiO 2 (тв) + 3NH 4 HF 2 (тв.) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Δ H продукты = 2*(-241,818) + 1*(-46,191) + 1*(-2689,893) = = - 3 219,72 кДж/моль Δ H реагенты = 3*(-804) + 1*(-903,359) = -3 315,359 кДж/моль Δ H р = Δ H продукты - Δ H реагенты Δ H х.р. = (-3219,72) – (-3315,359) = 95,639 кДж/моль 14 М, кг/ кмоль фаза dHf (298) Cp ( Дж/ мТ ) SiO2 60,08 ( тв.) -903,359 44,60 NH4HF2 57,04 ( тв.) -804 106,60 (NH4)2SiF6 178,15 ( тв.) -2689,893 228,11 H2O 18,02 (г.) -241,818 33,58 NH3 17,03 (г.) -46,191 35,56
Слайд 15
Расчет теплового эффекта химической реакции. SiO 2 (тв) + 3NH 4 HF 2 (тв.) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Δ H х.р. = 95,639 кДж/моль Исходя из расчетов определяем, что реакция является эндотермической, поэтому тепловой поток от химической реакции, с учетом степени протекания реакции и используемых масс, размещаем в колонке «расход». Верно и обратное - в случае обратного знака теплового эффекта реакции, численное значение с учетом степени протекания реакции и используемых масс, размещается в колонке «приход». При наличии в системе как экзо-, так и эндотермических реакций, стоит провести результирующий расчет для определения итогового значения величины теплового эффекта химической реакции и внести в соответствующую колонку. 15
Слайд 16
Для расчета теплового баланса необходимы: Рассчитанный материальный баланс. ( + ) Определение теплоемкостей веществ, принимающих участие в реакции. ( + ) Расчет теплового эффекта химической реакции. ( + ) Определение тепловых эффектов фазовых переходов (при необходимости). 16
Слайд 17
Определение тепловых эффектов фазовых переходов (при необходимости). В ходе процесса (нагрев до 210 °С) из исходных компонентов фазовые изменения претерпевает только NH 4 HF 2 (плавление при 126 °С). Тепловой эффект фазового перехода ( Δ H пл. ) равен 19,1 кДж/моль. Так как фазовые переходы вещества (плавление, кипение, сублимация) происходят при внесении внешней энергии в систему, то значения данных величин вносим в колонку «расход», так как на осуществление данных процессов необходимо расходовать энергию. Логично, что обратные фазовые переходы (кристаллизация, конденсация, десублимация) происходят с выделением энергии и ее распределением внутри системы, поэтому данный поток вносится в колонку «приход». 17
Слайд 18
Для расчета теплового баланса необходимы: Рассчитанный материальный баланс. ( + ) Определение теплоемкостей веществ, принимающих участие в реакции. ( + ) Расчет теплового эффекта химической реакции. ( + ) Определение тепловых эффектов фазовых переходов (при необходимости). ( + ) 18
Слайд 19
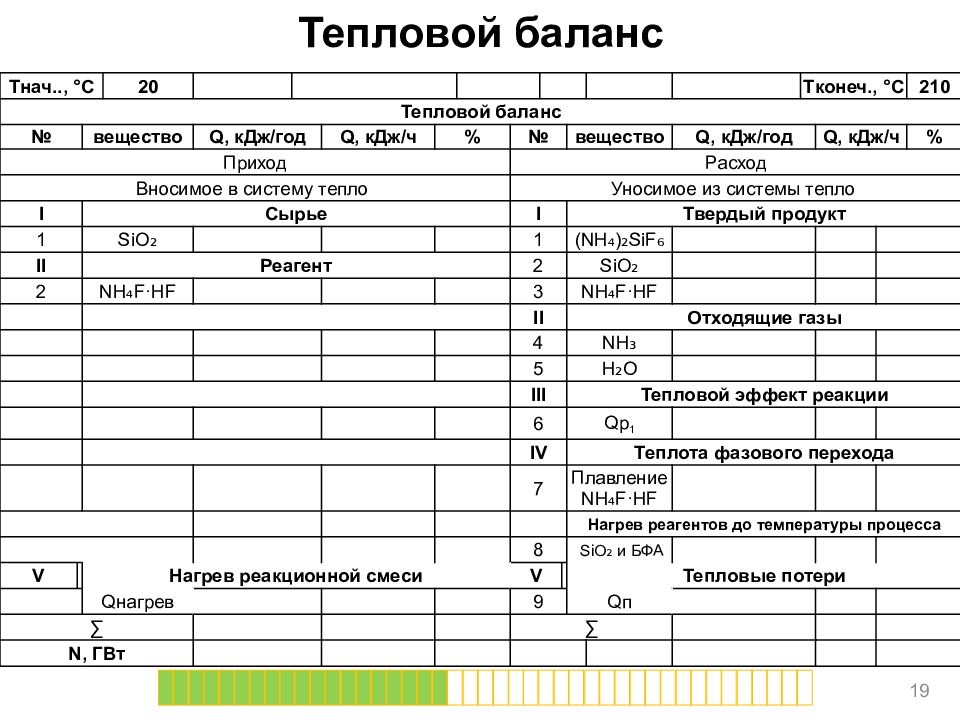
Тепловой баланс 19 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 1 (NH₄)₂ SiF ₆ II Реагент 2 SiO ₂ 2 NH₄F·HF 3 NH₄F·HF II Отходящие газы 4 NH₃ 5 H₂O III Тепловой эффект реакции 6 Qp 1 IV Теплота фазового перехода 7 Плавление NH₄F·HF Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА V Нагрев реакционной смеси V Тепловые потери Q нагрев 9 Q п ∑ ∑ N, ГВт
Слайд 20
Расчет тепла вносимого в систему реагентами и выносимого продуктами 1) Q внос. (SiO2) = 2)Q внос. (NH4HF2) = 3) Q вынос. (SiO2) = 4) Q вынос. (NH4HF2) = 5 ) Q вынос. ((NH4)2SiF 6 ) = 6) Q вынос. (NH3) = 7) Q вынос. (H2O) = 20
Слайд 21
Расчет тепла вносимого в систему реагентами и выносимого продуктами Q внос. (SiO2) = 1000*44,60*(273+20)/60,08 = 217 506,66 Q внос. (NH4HF2) = 2848,16*106,6*(273+20)/57,04 = 1 559 587,30 Q вынос. (SiO2) = 100*44,60*(273+210)/60,08 = 35 855,19 Q вынос. (NH4HF2) = 284,816*106,6*(273+210)/57,04 = 257 092,38 Q вынос. ((NH4)2SiF 6 ) = 2668,54*228,11*(273+210)/178,15 = 1 650 362,50 Q вынос. (NH3) = 255,10*35,56*(273+210)/17,03 = 257 279,21 Q вынос. (H2O) = 539,70*33,58*(273+210)/18,02 = 868 399,79 21
Слайд 22
Расчет тепла вносимого в систему реагентами и выносимого продуктами Q внос. (SiO2) = 217 495,97 кДж/год Q внос. (NH4HF2) = 1 559 498,90 кДж/год Q вынос. (SiO2) = 35 853,43 кДж/год Q вынос. (NH4HF2) = 257 077,81 кДж/год Q вынос. ((NH4)2SiF 6 ) = 1 650 345,46 кДж/год Q вынос. (NH3) = 257 299,67 кДж/год Q вынос. (H2O) = 485 833,64 кДж/год 22
Слайд 23
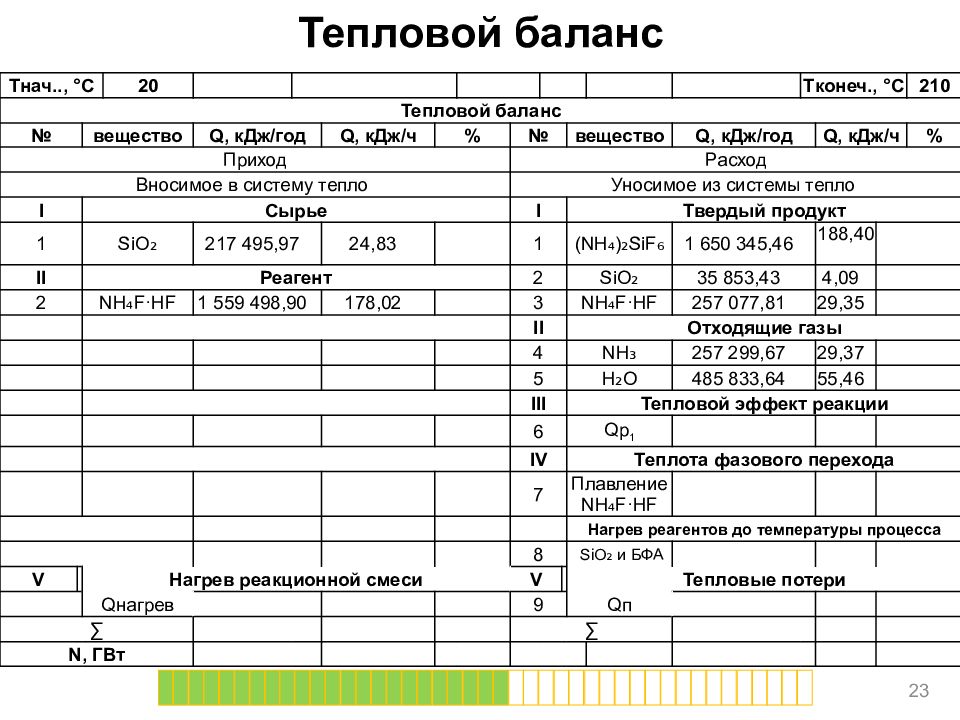
Тепловой баланс 23 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 IV Теплота фазового перехода 7 Плавление NH₄F·HF Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА V Нагрев реакционной смеси V Тепловые потери Q нагрев 9 Q п ∑ ∑ N, ГВт
Слайд 24
Расчет теплового эффекта реакции SiO 2 (тв) + 3NH 4 HF 2 (тв.) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Δ H р = (2*(-241,818) + 1*(-46,191) + 1*(-2689,893)) – (3*(-804) -1*(-903,359)) = 95,639 кДж/моль В пересчете на 2 668,54 кг (NH 4 ) 2 SiF 6 тепловой эффект составит: 24
Слайд 25
Расчет теплового эффекта реакции SiO 2 (тв) + 3NH 4 HF 2 (тв.) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Δ H р = (2*(-241,818) + 1*(-46,191) + 1*(-2689,893)) – (3*(-804) -1*(-903,359)) = 95,639 кДж/моль В пересчете на 2 668,54 кг (NH 4 ) 2 SiF 6 тепловой эффект составит: Δ H р = 95,639 * 1000 * m/M = 95,639 * 1000 * 2 668,54 / 178,15 = 25
Слайд 26
Расчет теплового эффекта реакции SiO 2 (тв) + 3NH 4 HF 2 (тв.) → (NH 4 ) 2 SiF 6 (тв) + NH 3 (г) ↑ + 2H 2 O (г) ↑ Δ H р = (2*(-241,818) + 1*(-46,191) + 1*(-2689,893)) – (3*(-804) -1*(-903,359)) = 95,639 кДж/моль В пересчете на 2 668,54 кг (NH 4 ) 2 SiF 6 тепловой эффект составит: Δ H р = 95,639 * 1000 * m/M = 95,639 * 1000 * 2 668,54 / 178,15 = 1 432 572,24 кДж 26
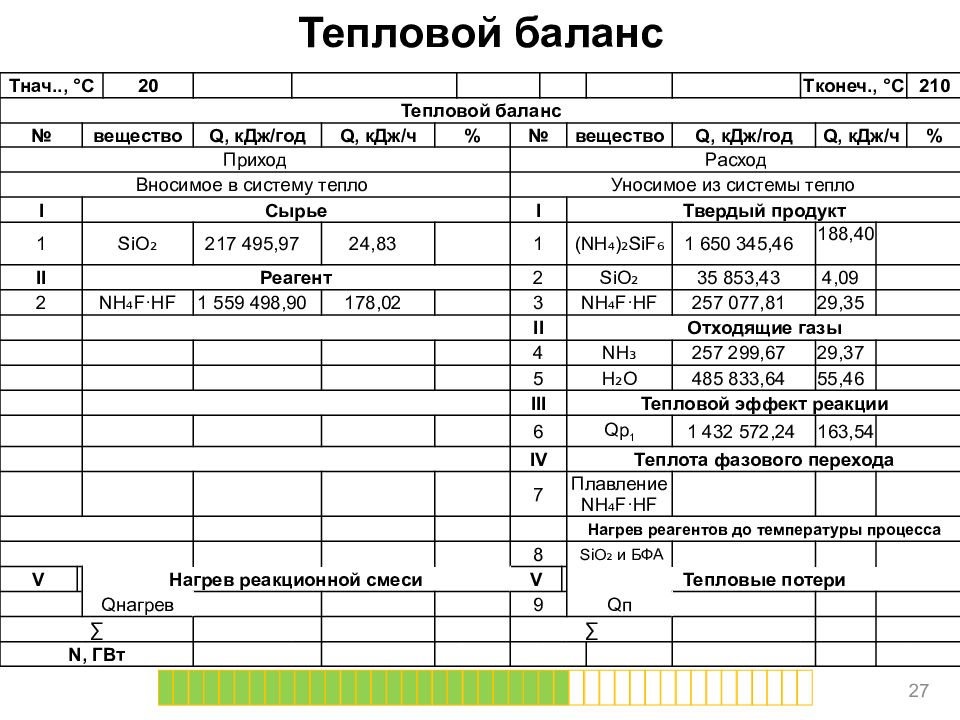
Слайд 27
Тепловой баланс 27 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 IV Теплота фазового перехода 7 Плавление NH₄F·HF Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА V Нагрев реакционной смеси V Тепловые потери Q нагрев 9 Q п ∑ ∑ N, ГВт
Слайд 28
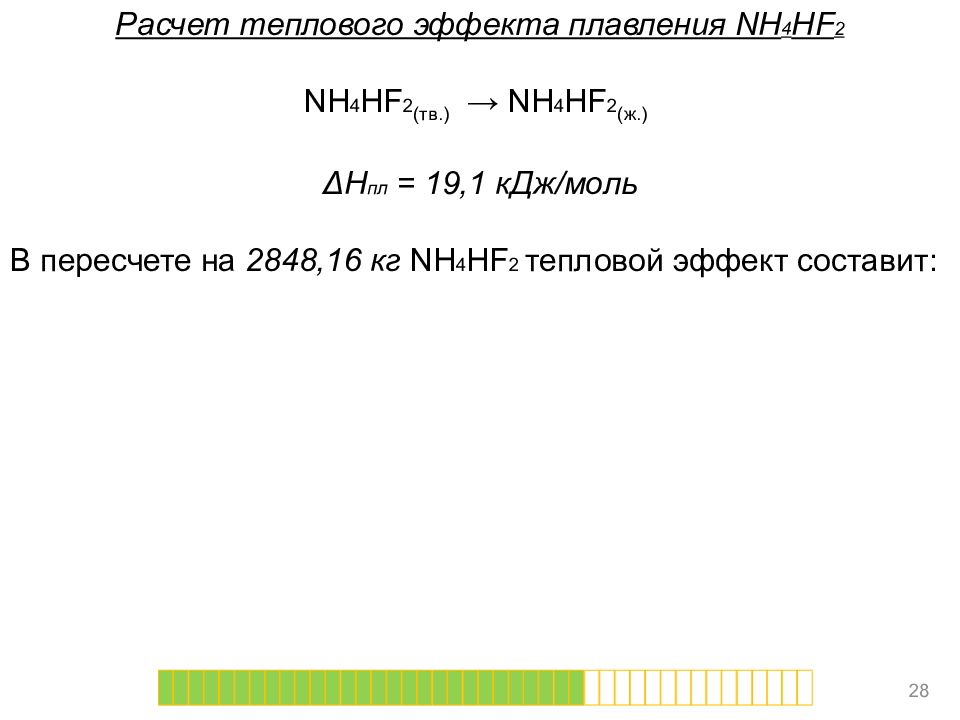
Расчет теплового эффекта плавления NH 4 HF 2 NH 4 HF 2 (тв.) → NH 4 HF 2 (ж.) Δ H пл = 19,1 кДж/моль В пересчете на 2848,16 кг NH 4 Н F 2 тепловой эффект составит: 28
Слайд 29
Расчет теплового эффекта плавления NH 4 HF 2 NH 4 HF 2 (тв.) → NH 4 HF 2 (ж.) Δ H пл = 19,1 кДж/моль В пересчете на 2848,16 кг NH 4 Н F 2 тепловой эффект составит: Δ H р = 19,1 * 1000 * 2848,16 / 57,04 = 29
Слайд 30
Расчет теплового эффекта плавления NH 4 HF 2 NH 4 HF 2 (тв.) → NH 4 HF 2 (ж.) Δ H пл = 19,1 кДж/моль В пересчете на 2848,16 кг NH 4 Н F 2 тепловой эффект составит: Δ H р = 19,1 * 1000 * 2848,16 / 57,04 = 953 660,11 кДж 30
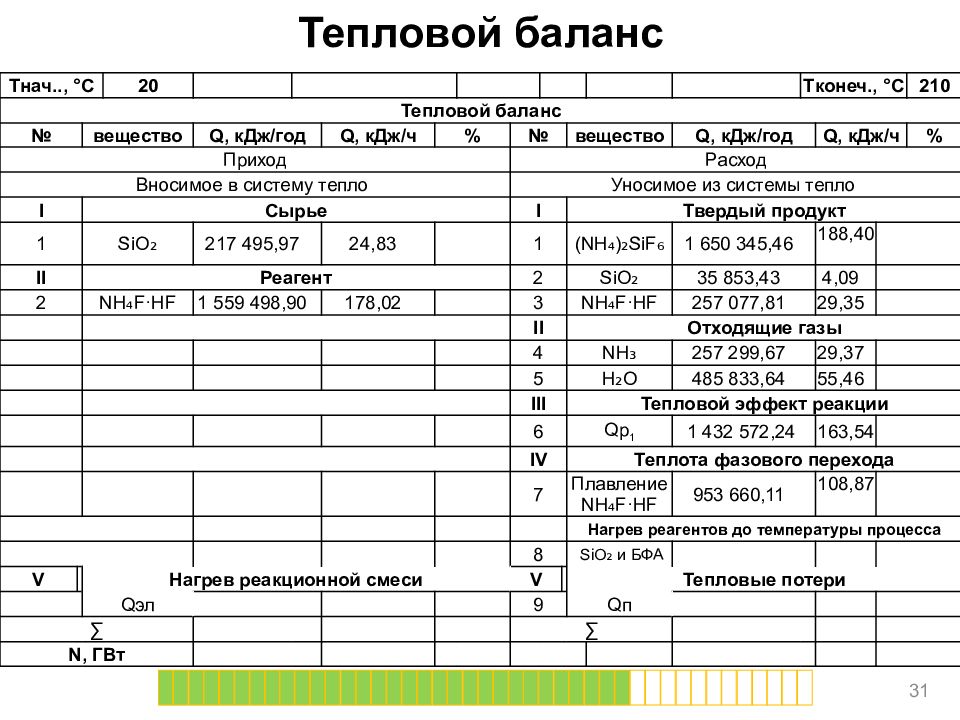
Слайд 31
Тепловой баланс 31 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 IV Теплота фазового перехода 7 Плавление NH₄F·HF 953 660,11 108,87 Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА V Нагрев реакционной смеси V Тепловые потери Q эл 9 Q п ∑ ∑ N, ГВт
Слайд 32
Расчет нагрева реагентов до температуры процесса Проводится аналогично вносимой теплоте реагента, только берется разность меджу исходной и конечной температурами. Фазовые переходы компонентов рассчитывают отдельно. Q нагрев (SiO2) = 1000*44,60*(210-20)/60,08 = Q нагрев (NH4HF2) = 2848,16*106,6*(210-20)/57,04 = 32
Слайд 33
Расчет нагрева реагентов до температуры процесса Проводится аналогично вносимой теплоте реагента, только берется разность меджу исходной и конечной температурами. Фазовые переходы компонентов рассчитывают отдельно. Q нагрев (SiO2) = 1000*44,60*(210-20)/60,08 = 444 346,60 кДж Q нагрев (NH4HF2) = 2848,16*106,6*(210-20)/57,04 = 1 011 279,15 кДж Сумма = 1 455 625,75 кДж 33
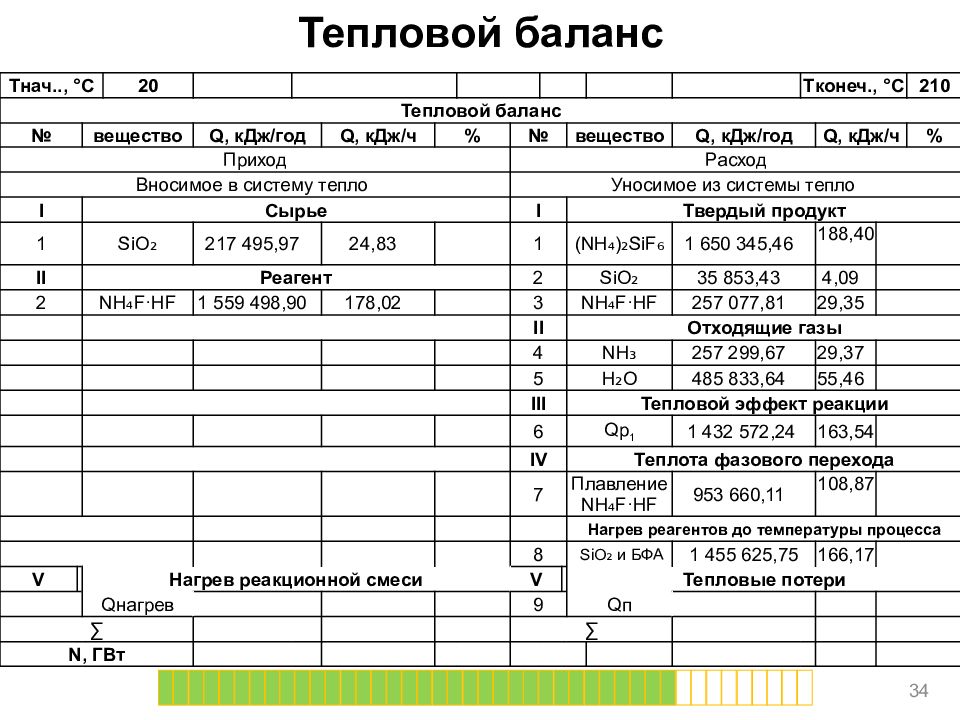
Слайд 34
Тепловой баланс 34 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 IV Теплота фазового перехода 7 Плавление NH₄F·HF 953 660,11 108,87 Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА 1 455 625,75 166,17 V Нагрев реакционной смеси V Тепловые потери Q нагрев 9 Q п ∑ ∑ N, ГВт
Слайд 35
Расчет нагрева реакционной смеси Если количество энергии в приходе существенно превышает количество энергии в расходе, то сумма энергии в расходе берется за итоговую сумму энергии, а в колонке расход проводится распределение энергетических потоков на «потери тепла в окружающую среду», а также на тепло, которое необходимо отводить от системы. Исходя из предварительной оценки внесенных данных по рассматриваемому примеру, становится понятно, что для осуществления процесса необходимо подводить энергию извне. 35
Слайд 36
Расчет нагрева реакционной смеси В рассматриваемом случае вносимый нагрев расходует на все рассчитанные ранее пункты, кроме тепла, вносимым исходными реагентами. Также стоит сразу заложить тепловые потери ( 10 % в данном случае). Q нагрев.= ( Q расход – Q приход)/(1- 10 /100) = (1 455 625,75 + 953 660,11 + 1 432 572,24 + 485 833,64 + 257 299,67 + 257 077,81 + 35 853,43 + 1 650 345,46 - 1 559 498,90 - 217 495,97)/0,9 = 36
Слайд 37
Расчет нагрева реакционной смеси В рассматриваемом случае вносимый нагрев расходует на все рассчитанные ранее пункты, кроме тепла, вносимым исходными реагентами. Также стоит сразу заложить тепловые потери ( 10 % в данном случае). Q нагрев.= ( Q расход – Q приход)/(1- 10 /100) = (1 455 625,75 + 953 660,11 + 1 432 572,24 + 485 833,64 + 257 299,67 + 257 077,81 + 35 853,43 + 1 650 345,46 - 1 559 498,90 - 217 495,97)/0,9 = 5 279 192,49 кДж 37
Слайд 38
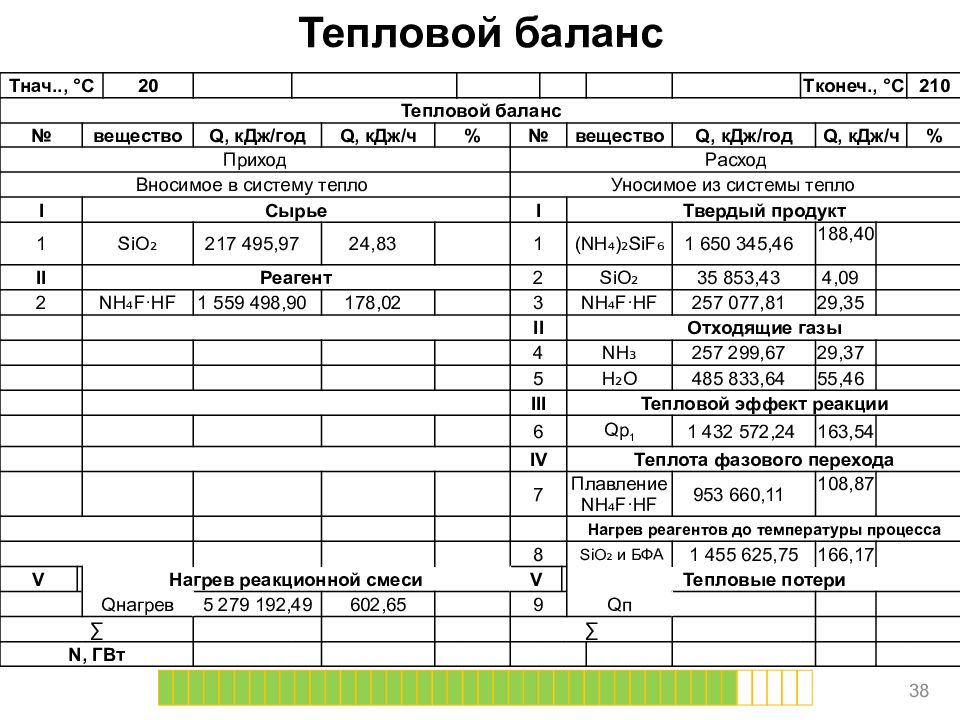
Тепловой баланс 38 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 IV Теплота фазового перехода 7 Плавление NH₄F·HF 953 660,11 108,87 Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА 1 455 625,75 166,17 V Нагрев реакционной смеси V Тепловые потери Q нагрев 5 279 192,49 602,65 9 Q п ∑ ∑ N, ГВт
Слайд 39
Расчет тепловых потерь Тепловые потери происходят за счет рассеивания энергии химической реакции в виде тепла, а также за счет рассеивания тепла, подводимого для осуществления реакции (в случае экзотермической реакции). Возможен вариант, когда тепло не подводится в систему, так как выделяющегося в ходе химической реакции энергии достаточно для поддержания температуры процесса. В таком случае потери рассчитываются только на основании теплоты экзотермической химической реакции. Если процесс носит эндотермический характер, то расчет тепловых потерь основывается только на подводимой к системе энергии. 39
Слайд 40
Расчет тепловых потерь В данном случае тепловые потери принимаем на уровне 10 % от нагрева. Q потер. = 5 279 192,49 * 0,1 = 5 279 19,25 кДж 40
Слайд 41
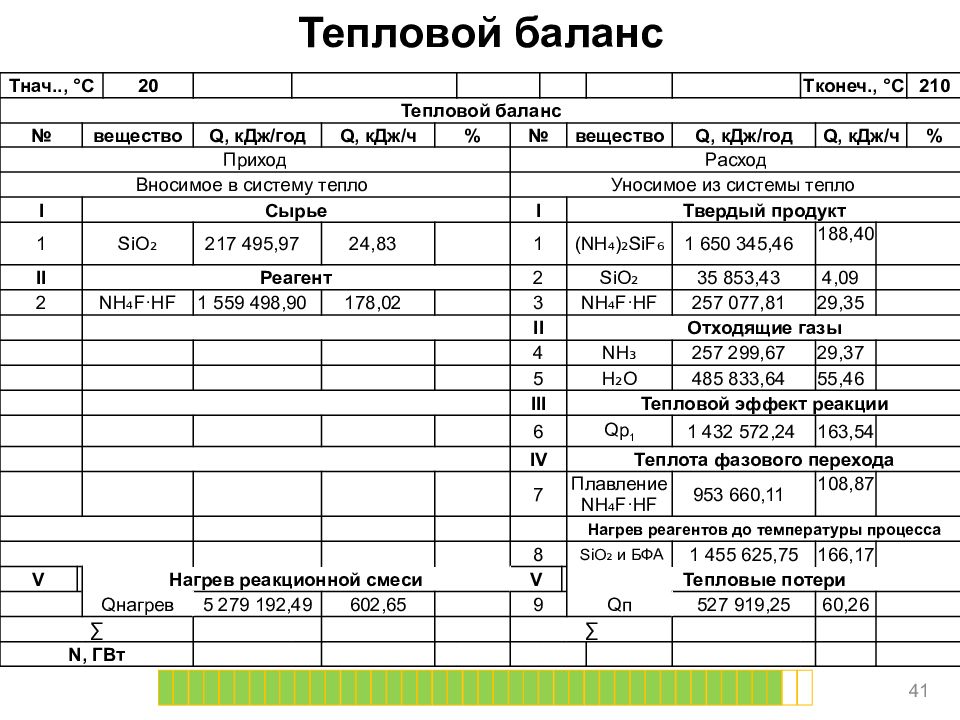
Тепловой баланс 41 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 IV Теплота фазового перехода 7 Плавление NH₄F·HF 953 660,11 108,87 Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА 1 455 625,75 166,17 V Нагрев реакционной смеси V Тепловые потери Q нагрев 5 279 192,49 602,65 9 Q п 527 919,25 60,26 ∑ ∑ N, ГВт
Слайд 42
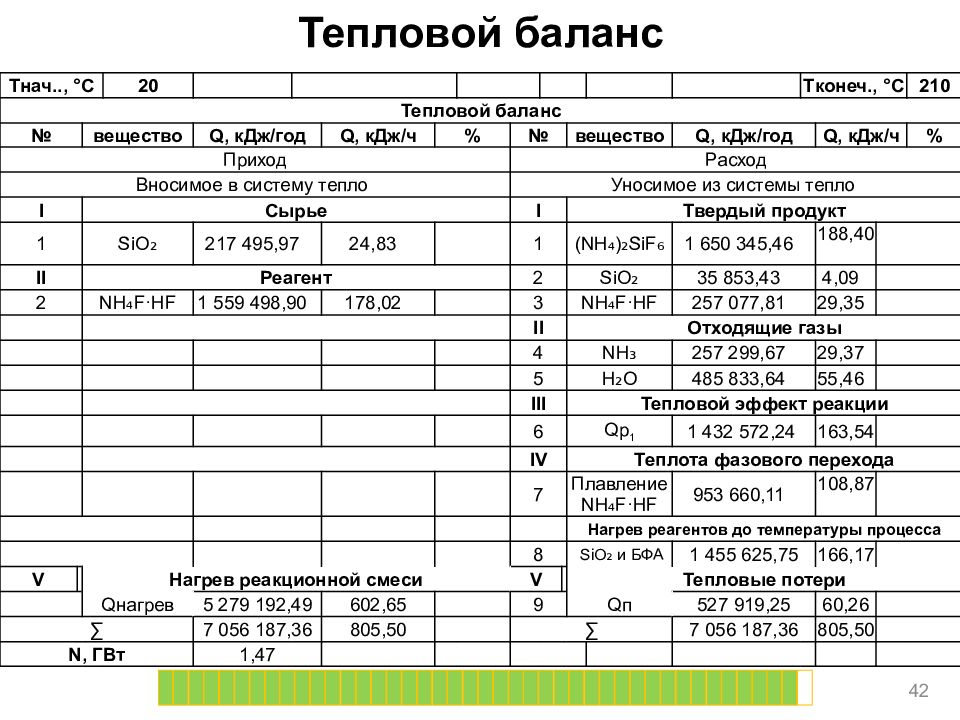
Тепловой баланс 42 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 II Реагент 2 SiO ₂ 35 853,43 4,09 2 NH₄F·HF 1 559 498,90 178,02 3 NH₄F·HF 257 077,81 29,35 II Отходящие газы 4 NH₃ 257 299,67 29,37 5 H₂O 485 833,64 55,46 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 IV Теплота фазового перехода 7 Плавление NH₄F·HF 953 660,11 108,87 Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА 1 455 625,75 166,17 V Нагрев реакционной смеси V Тепловые потери Q нагрев 5 279 192,49 602,65 9 Q п 527 919,25 60,26 ∑ 7 056 187,36 805,50 ∑ 7 056 187,36 805,50 N, ГВт 1,47
Последний слайд презентации: Национальный исследовательский Томский политехнический университет «Прикладная
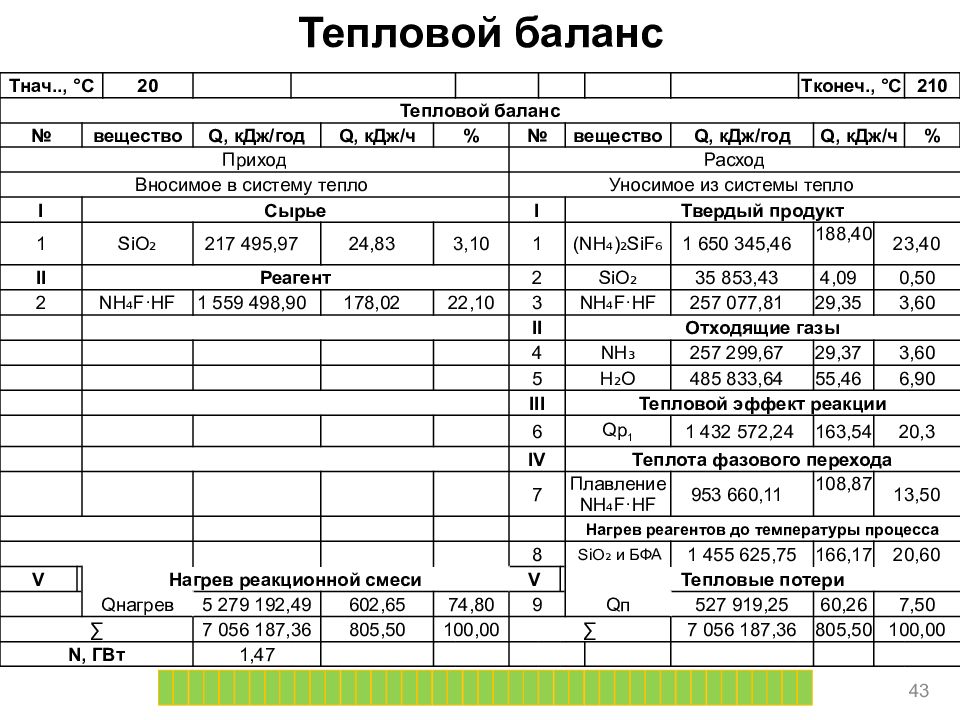
Тепловой баланс 43 T нач.., ° C 20 T конеч., ° C 210 Тепловой баланс № вещество Q, кДж/год Q, кДж/ч % № вещество Q, кДж/год Q, кДж/ч % Приход Расход Вносимое в систему тепло Уносимое из системы тепло I Сырье I Твердый продукт 1 SiO ₂ 217 495,97 24,83 3,10 1 (NH₄)₂ SiF ₆ 1 650 345,46 188,40 23,40 II Реагент 2 SiO ₂ 35 853,43 4,09 0,50 2 NH₄F·HF 1 559 498,90 178,02 22,10 3 NH₄F·HF 257 077,81 29,35 3,60 II Отходящие газы 4 NH₃ 257 299,67 29,37 3,60 5 H₂O 485 833,64 55,46 6,90 III Тепловой эффект реакции 6 Qp 1 1 432 572,24 163,54 20,3 IV Теплота фазового перехода 7 Плавление NH₄F·HF 953 660,11 108,87 13,50 Нагрев реагентов до температуры процесса 8 SiO ₂ и БФА 1 455 625,75 166,17 20,60 V Нагрев реакционной смеси V Тепловые потери Q нагрев 5 279 192,49 602,65 74,80 9 Q п 527 919,25 60,26 7,50 ∑ 7 056 187,36 805,50 100,00 ∑ 7 056 187,36 805,50 100,00 N, ГВт 1,47