Первый слайд презентации: Ионные равновесия в растворах электролитов
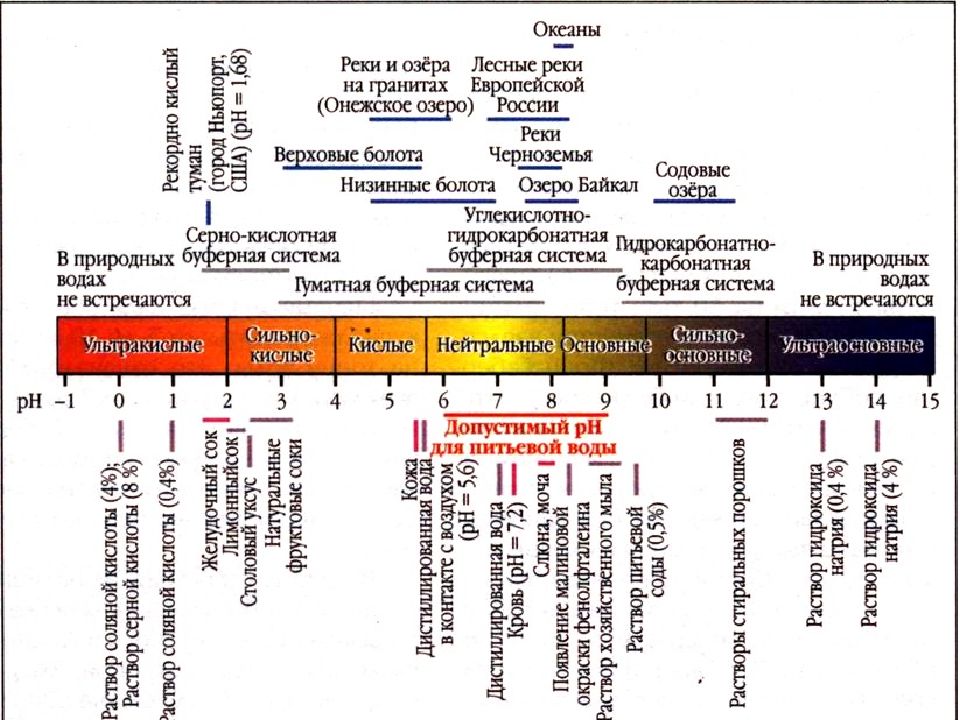
Водородный показатель среды (рН)
Слайд 2: Константа диссоциации воды
Вода слабый электролит: Н 2 0 Н + + ОН - ее константа диссоциации при 298 K равна : При столь малой константе диссоциации концентрация воды остается практически неизменной и равной :
Слайд 3: Ионное произведение воды
Отсюда произведение постоянных величин K д ∙ [H 2 O] = [H + ]∙[OH – ] = const. Произведение концентраций ионов, на которые диссоциирует вода, называется ионным произведением воды K в
Слайд 4: Реакция среды
В воде : Н 2 0 Н + + ОН - [H + ] = [OH – ] = = 1 ∙ 10 –7 равенство [H + ] и [OH – ] соответствует нейтральной среде в растворе кислоты : [H + ] > 1 ∙ 10 –7 кислая среда [OH – ] < 1 ∙ 10 –7 в растворе щелочи [OH – ] > 1 ∙ 10 –7 щелочная [H + ] < 1 ∙ 10 –7 среда
Слайд 5: Водородный показатель pH
Для определения кислотно-основных свойств растворов пользуются понятием водородный показатель среды pH Водородный показатель это десятичный логарифм концентрации водородных ионов с обратным знаком : pH = –lg [H + ]
Слайд 6: Гидроксильный показатель pОH
гидроксильный показатель среды pОH – это десятичный логарифм концентрации ионов гидроксила с обратным знаком : pОH = –lg [ОH - ]
Слайд 7: Водородный показатель pH
Очевидно, –lg ([H + ] ∙ [OH – ]) = – lg 1 ∙ 10 –14 pH + pOH = 14 При [H + ] > 1 ∙ 10 –7 pH < 7 кислая среда, При [H + ] < 1 ∙ 10 –7 pH > 7 щелочная среда, При [H + ] = 1 ∙ 10 –7 pH = 7 нейтральная среда
Индикаторы – вещества, меняющие свою окраску в зависимости от реакции среды.
Название Окраска индикаторов в среде среда кислая среда нейтральная среда щелочная фенолфталеин бесцветный бесцветный малиновый метилоранж красный оранжевый жёлтый лакмус красный фиолетовый синий
Слайд 13: 2. Определение рН среды потенциометрическим методом
Потенциометрия – это электрохимический метод анализа, основанный на зависимости величины электродного потенциала, а, следовательно, и ЭДС, составленного из соответствующих электродов гальванического элемента, от состава раствора. Для определения величины рН среды применяются рН-индикаторные электроды. Потенциал стеклянного электрода зависит от концентрации (активности) ионов водорода в растворе.
Слайд 14: Наиболее широко в лабораторной практике применяется стеклянный индикаторный электрод
Стеклянный индикаторный электрод Хлорсеребряный электрод сравнения
Слайд 15: Гидролиз
Гидролиз – процесс взаимодействия вещества с водой, в результате которого нарушается ионное равновесие воды и меняется рН среды. Гидролиз является частным случаем реакций сольволиза, т. е. реакций обмена между растворителем и растворенным веществом.
Слайд 16: Гидролизу подвергаются :
Соли Углеводы Белки Мыла Сложные эфиры Жиры Феноляты Алкоголяты Галогенангидриды и другие вещества.
Слайд 17: Соли могут быть образованы:
Сильным основанием + сильной кислотой например : Na 2 SO 4 Сильным основанием + слабой кислотой например : Na 2 CO 3 Слабым основанием + сильной кислотой например : (NH 4 ) 2 SO 4 Слабым основанием + слабой кислотой например : (NH 4 ) 2 CO 3
Слайд 18: При рассмотрении процессов гидролиза солей следует помнить :
Гидролизу подвергаются только те соли, в состав которых входит ион от слабого электролита. ИОН СЛАБОГО ЭЛЕКТРОЛИТА – ДВИГАТЕЛЬ ГИДРОЛИЗА Соли, образованные сильным основанием сильной кислотой гидролизу не подвергаются.
Слайд 19: При рассмотрении процессов гидролиза солей следует помнить :
Обычно гидролиз идет незначительно и преимущественно по первой ступени (один ион слабого электролита взаимодействует только с одной молекулой воды).
Слайд 20: При рассмотрении процессов гидролиза солей следует помнить :
Соли, образованные слабым основанием и слабой кислотой, гидролизуются практически полностью. Реакцию среды при гидролизе определяется по виду иона сильного электролита. соль сильного основания – среда щелочная соль сильной кислоты – среда кислая
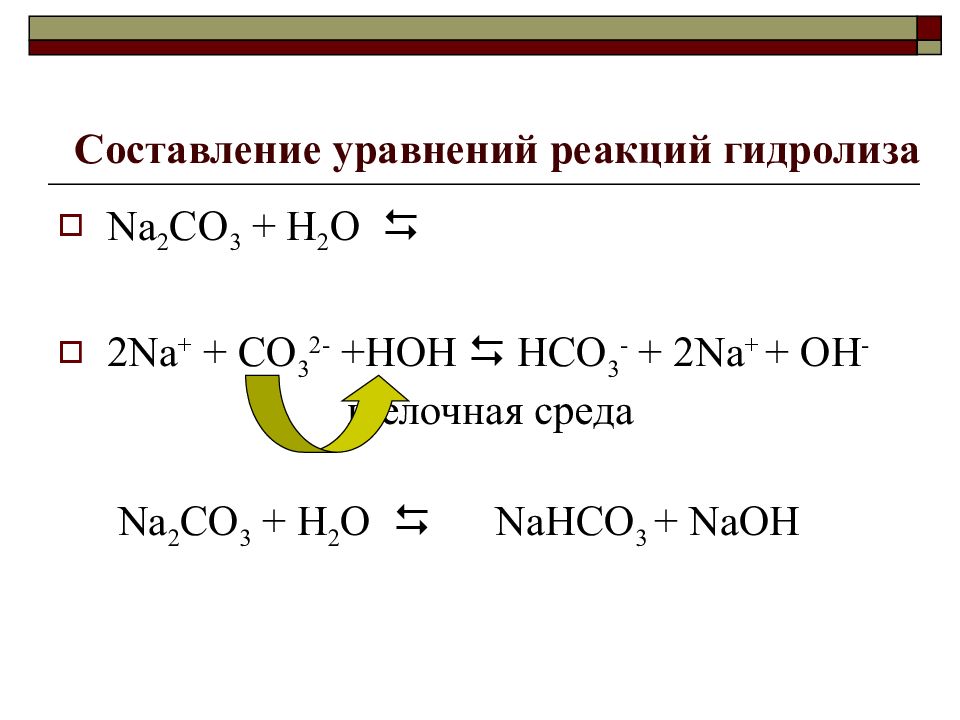
Слайд 21: Составление уравнений реакций гидролиза
Na 2 CO 3 + Н 2 О 2Na + + CO 3 2- +HOH HCO 3 - + 2Na + + OH - щелочная среда Na 2 CO 3 + Н 2 О Na НСО 3 + NaOH
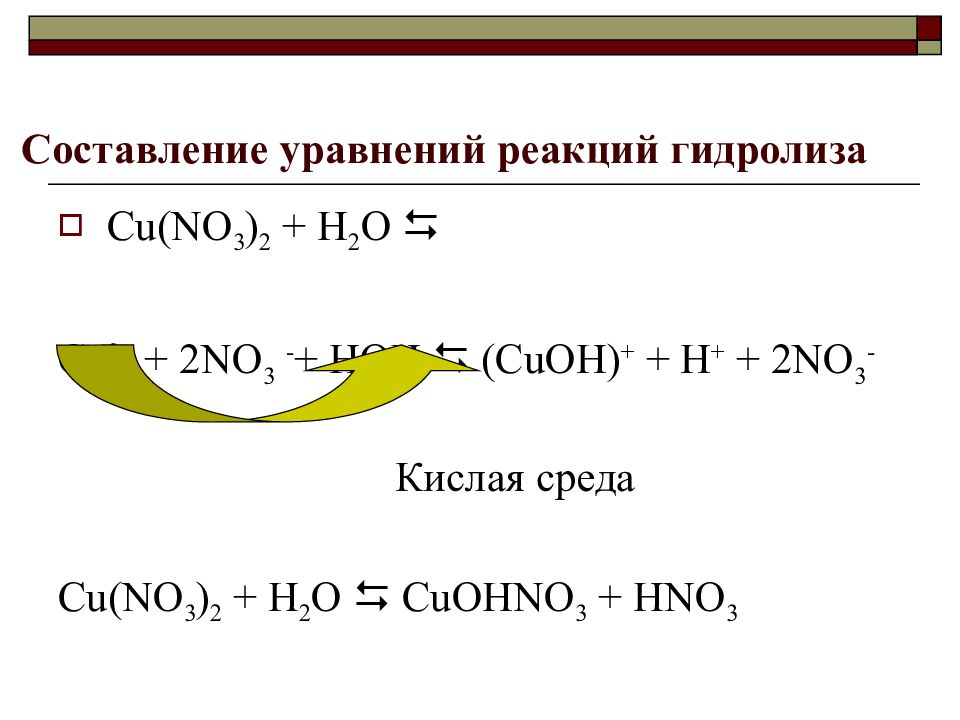
Слайд 22: Составление уравнений реакций гидролиза
С u(NO 3 ) 2 + Н 2 О Cu 2+ + 2NO 3 - + HOH (CuOH) + + H + + 2NO 3 - Кислая среда С u(NO 3 ) 2 + Н 2 О С uOHNO 3 + HNO 3
Слайд 23: Составление уравнений реакций гидролиза
Cr 2 S 3 + 6Н 2 О Cr 2 S 3 + 6Н 2 О 2 Cr ( OH ) 3 + 3 H 2 S Среда близка к нейтральной рН ≈ 7
Слайд 24: Ступенчатый гидролиз
I ступень : Na 2 CO 3 + Н 2 О Na НСО 3 + NaOH II ступень : Na НСО 3 + Н 2 О NaOH + H 2 CO 3 Гидролиз солей слабых многоосновных кислот и слабых многокислотных оснований по второй и третьей ступеням протекает незначительно.
Слайд 25: Факторы, влияющие на процесс гидролиза
Природа гидролизующегося вещества. Чем слабее электролит, образовавший соль, тем активнее происходит процесс гидролиза. Концентрация. Разбавление раствора способствует гидролизу.
Слайд 26: Факторы, влияющие на процесс гидролиза
Температура. Повышение температуры усиливает гидролиз. Пример : гидролиз раствора ацетата натрия CH 3 COONa
Слайд 27: При добавлении к раствору ацетата натрия индикатора фенолфталеин цвет раствора - бледно-малиновый
CH 3 COONa + HOH→ CH 3 COOH + NaOH CH 3 COO - + Na + + HOH→ CH 3 COOH + Na + + OH - CH 3 COO - + HOH→ CH 3 COOH + OH - (pH >7) Среда – слабощелочная. При нагревании раствора процесс гидролиза усиливается, среда становится более щелочной и, поэтому, раствор становится ярко малиновым.
Слайд 28: ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ГИДРОЛИЗ
Цвет индикатора фенолфталеин в растворе ацетата натрия До нагревания После нагревания
Слайд 29: Количественные характеристики процесса гидролиза
C тепень гидролиза ( β ) β = Так, в 0,1 н. растворе СН 3 СОО Na β = 0,01 %
Слайд 30: Количественные характеристики процесса гидролиза
Константа гидролиза ( К гидр.) Для соли слабого основания и слабой кислоты
Слайд 31: Равновесие в системе осадок раствор
BaSO 4 Ba 2+ + SO 4 2- Ва 2+ + SO 4 2- BaSO 4
Слайд 32: Произведение растворимости
В насыщенном растворе труднорастворимого сильного электролита произведение концентраций его ионов в степенях их стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Слайд 33
Произведение растворимости (ПР) характеризует растворимость ( S ) труднорастворимого электролита при данной температуре. s s s CaSO 4 Ca 2+ + SO 4 2- ПР( CaSO 4 ) = [Ca 2+ ] ∙ [ SO 4 2- ] = S 2 = 2,5∙10 –5 S = √ 2,5∙10 –5 = 5 ∙ 10 -3 [ моль / л ]
Слайд 34
Из двух однотипных солей, например, CaSO 4 и BaSO 4, большей растворимостью обладает та соль, у которой ПР больше. ПР( CaSO 4 ) = [Ca 2+ ] ∙ [ SO 4 2- ] = 2,5∙10 –5 ПР( BaSO 4 ) = [Ba 2+ ] ∙ [ SO 4 2- ] = 1,1∙10 –10 S ( BaSO 4 ) < S ( CaSO 4 )
Слайд 39: Условие образования и растворения осадков
ПК – произведение концентраций ионов в степенях, соответствующих стехиометрическим коэффициентам для системы в неравновесном состоянии. Зная величину ПК и сравнив ее с величиной ПР, можно установить, растворится или выпадет осадок при данной температуре:
Слайд 40: Условие образования и растворения осадков
Если ПК = ПР, Δ G = 0 – система находится в состоянии равновесия (раствор насыщенный). Если ПК < ПР, Δ G < 0 – самопроизвольно протекает процесс растворения осадка (раствор ненасыщенный). Если ПК > ПР, Δ G > 0 – возможен обратный процесс – выпадание осадка (раствор пересыщенный).
Слайд 41
S 2S S Ag 2 S O 4 2Ag + +SO 4 2- ПР ( Ag 2 S O 4 ) [Ag + ] 2 ∙ [SO 4 2- ] = 2S 2 ∙S = 4S 3 = 2 ∙ 10 -5 S = При добавлении Na 2 SO 4 равновесие смещается влево. Растворимость уменьшается.
Последний слайд презентации: Ионные равновесия в растворах электролитов
Если в насыщенный раствор электролита ввести некоторое количество одноименных ионов, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть от введения в раствор одноименных ионов растворимость электролита понижается.