Первый слайд презентации: Лекция №3 «Лекарственные средства производные р -элементов ПСЭ»
19.09.2012 Кафедра фармацевтической и токсикологической химии доц. Богословская О.А.
Галогены: Фтор, хлор, бром, йод и астат. Атомы галогенов имеют по семь электронов на внешнем уровне: два на s - и пять на p -орбиталях. Электронная формула валентной оболочки ns 2 np 5 (n -номер периода). До завершения оболочки инертных элементов – 1 e. Следовательно, галогены обладают большим сродством к электрону и являются сильными окислителями. Типичные неметаллы. От фтора к астату по мере увеличения радиусов атомов, окислительная активность нейтральных атомов ослабевает. Самый сильный окислитель – фтор, наиболее слабый – астат. У йода и астата появляются металлические признаки. 2
Слайд 3
В природе галогены вследствие своей высокой реакционной способности в свободном состоянии не встречаются, а существуют в виде различных соединений. Все р -элементы VII группы (галогены), за исключением искусственно полученного радиоактивного астата, физиологически активны. К лекарственным средствам p -элементов VII группы ПСЭ относятся: - препараты галогенов (I 2 ) - препараты галогенидов. (F -, Cl -, Br -, I - ) 3
Слайд 4: Йод и его препараты
Йод (от греч. «йодос»—фиолетовый) был впервые обнаружен в 1811 г. французским фармацевтом Куртуа в золе морских водорослей. Различают 4 группы препаратов йода 1. содержащие элементарный йод (р-р Люголя, р-р йода спиртовой) 2.неорганический йодиды ( KI, NaI) 3.органические вещества, отщепляющие элементарный йод (йодоформ, йодинол) 4.йодсодержащие органический вещества, в мол-ле которых йод прочно связан (рентгеноконтрастные вещества) 4
Слайд 5
Фармакопейными препаратами йода являются: йод, раствор йода спиртовой 5% раствор йода спиртовой 10% 5
Слайд 6
Источники промышленного получения йода: буровые воды при добыче газа и нефти (содержание 0,01-0,1кг/м 3 ) (0, 001-0,01%) отходы при получении чилийской селитры (содержит NaIO 3 ) зола морских водорослей. 6
Слайд 7
Название ЛС - русское и латинское Химическая формула (структурная и брутто) Описание (физические свойства, растворимость, рН водного раствора и др.) Подлинность ( уравнения реакций ) Чистота ЛС (допустимые и недопустимые примеси) Количественное определение Условия хранение Применение СХЕМА ОПИСАНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ. 7
Слайд 8: Йод Iodum М. r. 253,80
ОПИСАНИЕ. С еро-фиолетовые, хрупкие пластинки или мелкие кристаллы с металлическим блеском. При обычной температуре легко летуч. При возгонке образует пары фиолетового цвета с резким запахом. РАСТВОРИМОСТЬ. Йод плохо растворяется в воде (1:5000), растворим в этаноле (1:10), хлороформе и эфире. Легко растворяется в водном растворе йодидов, образуя растворимую комплексный ион [ I 3 ] -: Растворы йода в различных растворителях - в хлороформе и сероуглероде - фиолетовый - в спирте и эфире — бурый. 8
Слайд 9: ПОДЛИННОСТЬ (ЕР)
1. Р еакция с крахмалом I 2 + крахмал I 2 крахмал, H 0 адсорбционный комплекс синего цвета При нагревании синяя окраска исчезает (экзотермический процесс) При охлаждении окраска появляется вновь. 2. при нагревании кристаллов йода образуются фиолетовые пары. 9
Слайд 10: ЧИСТОТА
1. Примесь активированного угля, используемого для адсорбции йода в процессе его получения: Образование прозрачного раствора свидетельствует о чистоте лекарственного средства (отсутствие механических примесей). 10
Слайд 11
2. При получении йода из морских водорослей : опасной примесью может быть йодистый циан ICN, образующийся при неполном сжигании водорослей. : I 2 + 2C + N 2 2ICN Для обнаружения примеси йодистого циана йод обесцвечивают : ICN + 2NaOH NaCN + NaOI + H 2 O 6NaCN + FeSO 4 Na 4 [Fe(CN) 6 ] + Na 2 SO 4 Р-р подкисляют Н Cl и добавляют FeCl 3 : FeCl 3 + Na 4 [Fe(CN) 6 ] NaFe[Fe(CN) 6 ] (СИНИЙ) 11
Слайд 12
3. Определение примеси I Cl - обесцвечивают йод 2. - добавляют избыток раствора нитрата серебра. NaI + AgNO 3 Ag I + Na NO 3 Cl - + AgNO 3 Ag Cl + NO 3 - добавляют в избыточном количестве раствор аммиака : - в осадк е - Ag I, не растворимый в аммиаке : - в фильтрате – растворимый аммиачный комплекс серебра [ Ag ( NH 3 ) 2 ] Cl : Ag Cl + 2NH 3. H 2 O [Ag(NH 3 ) 2 ] Cl + 2H 2 O К бесцветному фильтрату добавляют избыток HNO 3 конц. При наличии Cl - образуется муть или белый осадок. 12
Слайд 13
ВР: Допустимые примеси ( 250 ррm) : Cl -, Br - Обесцвечивание: Zn + I 2 = ZnI 2 . К 10 мл раствора ЛС добавьте 3 мл раствора аммиака и 6 мл раствора серебра нитрата. Ag Cl + 2NH 3. H 2 O [Ag(NH 3 ) 2 ] Cl + 2H 2 O Ag Br + 2NH 3. H 2 O [Ag(NH 3 ) 2 ] Br + 2H 2 O Профильтровать, добавить 1,5 мл азотной кислоты. Сравните с эталоном на бромиды и хлориды. 13
Слайд 14
Количественное определение (ГФ,ВР). I 2 + KI тв K[I 3 ] K[I 3 ] + 2Na 2 S 2 O 3 KI + 2NaI + Na 2 S 4 O 6 Индикатор – крахмал. В субстанции должно быть не менее 99,5% и не более 100,5% иода. 14
Слайд 15
Применение 1. наружно используют как антисептические, раздражающие и отвлекающие средства при воспалительных и других заболеваниях кожи и слизистых оболочек 2. При увеличении щитовидной железы с явлениями гипертериоза: таб. «микройод», содержащие 0,5 мг I 2 5,0 мг KI 15
Слайд 16
Хранение. Летучесть и окислительно-восстановительные свойства йода определяют условия его хранения — в банках с притертыми пробками (корковые пробки йод разъедает) в холодном защищенном от света месте. 16
Слайд 17: Раствор йода спиртовой 10% (Solutio iodi spirituosa 10%)
СИНОНИМЫ: настойка йода 10% Раствор йода спиртовой 10% готовят путем растворения йода в 95° спирте: Йода – 100г Спирта 95% - до 1 л Жидкость красно-бурого цвета с характерным запахом. От прибавления воды, выпадает мелкокристаллический осадок. 17
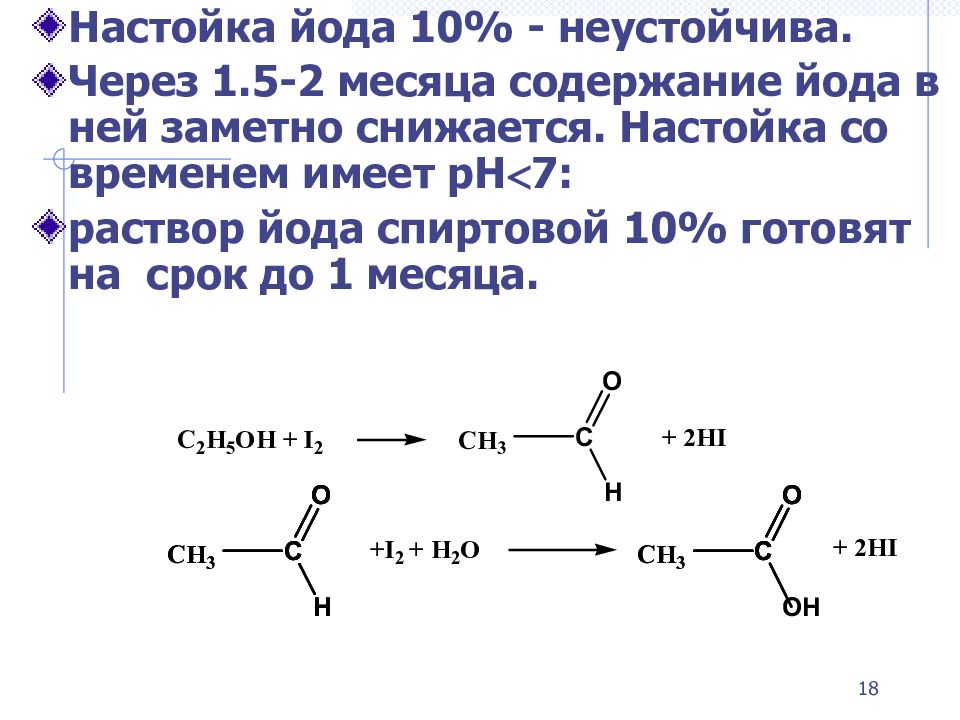
Слайд 18
Настойка йода 10% - неустойчива. Через 1.5-2 месяца содержание йода в ней заметно снижается. Н астойка со временем имеет рН 7: раствор йода спиртовой 10% готовят на срок до 1 месяца. 18
Слайд 19
Количественное определение ( Прибавляют KI, и титруют до обесцвечивания без индикатора ). I 2 + KI тв K[I 3 ] K[I 3 ] + 2Na 2 S 2 O 3 KI + 2NaI + Na 2 S 4 O 6 ГФ: рекомендует определять количество йодоводородной к-ты - HI. Для этого обесцвеченный после титрования тиосульфатом раствор титруют раствором щелочи (индикатор - фенолфталеин) до розового окр. : HI + NaOH NaI + H 2 O 19
Слайд 20
Раствор йода спиртовой 5% (Solutio iodi spirituosa 5%) Синонимы: настойка йода 5 % -йода 5 г -калия иодида 2 г -вода и спирт поровну до 100 мл. Прозрачная жидкость красно-бурого цвета с характерным запахом. 20
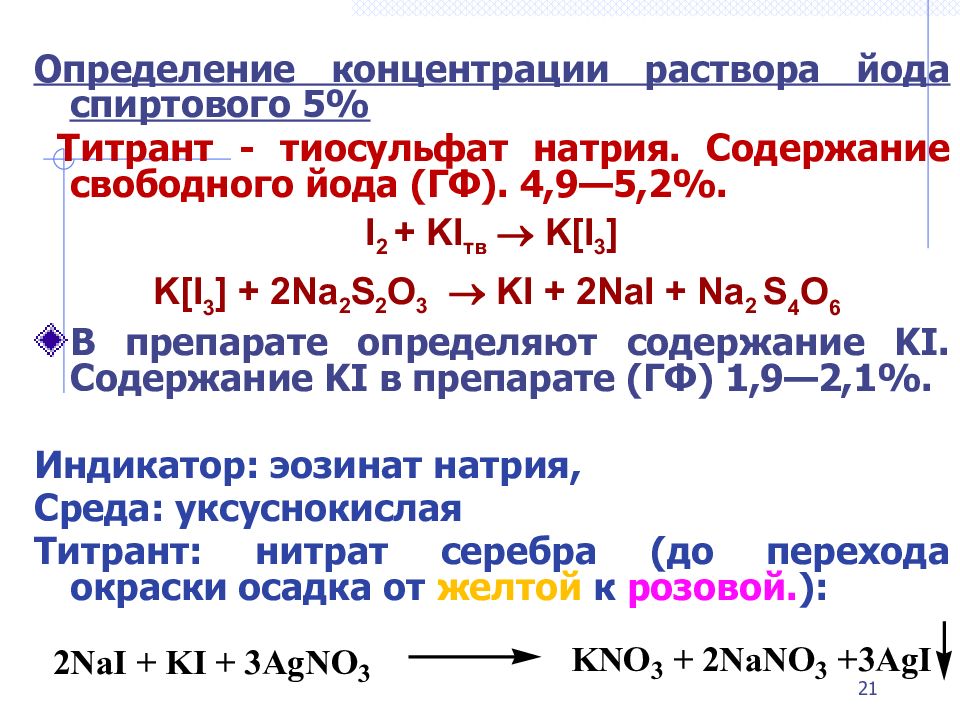
Слайд 21
Опр еделени е концентрации раствора йода спиртового 5% Титрант - тиосульфат натрия. Содержание свободного йода (ГФ). 4,9—5,2%. I 2 + KI тв K[I 3 ] K[I 3 ] + 2Na 2 S 2 O 3 KI + 2NaI + Na 2 S 4 O 6 В препарате определяют содержание KI. C одержание KI в препарате ( ГФ) 1,9—2,1%. Индикатор: эозинат натрия, Среда: уксуснокислая Титрант: нитрат серебра (до перехода окраски осадка от желтой к розовой. ): 21
Слайд 22
Применяют наружно как антисептическое, раздражающее и отвлекающее средство (например, при миозите, невралгиях). для профилактики атеросклероза от 1 до 10 капель 1 - 2 раза в день курсами до 30 дней 2 - 3 раза в год; для лечения атеросклероза - по 10 - 12 капель 3 раза в день; при лечении сифилиса - от 5 до 50 капель 2 - 3 раза в день. Принимают в молоке после еды. 22
Слайд 23
Форма выпуска: в банках оранжевого стекла по 10; 15 и 25 мл; в ампулах по 1 мл в упаковке по 10 ампул. Хранение: список Б. В защищенном от света месте. 23
Слайд 24
Раствор йода в водном растворе калия йодида применяется в медицине под названием раствор Люголя ( Solutio Lugoli ): йода 1 часть, калия иодида 2 части, воды 17 частей. Применяют наружно - для смазывания слизистой оболочки глотки, гортани, а также внутрь по 5-10 капель 2 раза в день. Раствор Люголя с глицерином: йода 1 часть, калия иодида 2 части, воды 3 части, глицерина 94 части Применяют наружно - для смазывания слизистой оболочки глотки, гортани. 24
Слайд 25: ГАЛОГЕНИДЫ
К препаратам галогенидов относятся кислота хлористоводородная (соляная ), натрия хлорид, калия хлорид, натрия бромид, калия бромид, натрия йодид, калия йодид натрия фторид. 25
Слайд 26: ХЛОР И ЕГО СОЕДИНЕНИЯ
В организме человека содержится примерно 100 г хлора (мас. доля 0,15%). Хлорид-ионы: создают благоприятную среду для действия протолитических ферментов желудочного сока; Желудочный сок (рН=1-3) содержит катион Н + и анионы Cl -, H 2 PO 4 -, HSO 4 -. HCl переводит в активную форму фермент пепсин, который обеспечивает переваривание, белков путем гидролитического расщепления пептидных связей: R-CO-NH-R 1 + H 2 O пепсин, HCl RCOOH + R 1 NH 2 HCl уничтожает различные болезнетворные патогенные и гнилостные бактерии (холеры, тифа). 26
Слайд 27: Кислота хлороводородная Acidum hydrochloricum НСl М. r. 36,46
Синонимы: Кислота соляная ГФ приводит два препарата : 1. - Acidum hydrochloricum (кислота хлороводород н ая, содержание HCl 24.8 % до 25.2%). Плотность 1,12 2 -1,12 4. 2. - Acidum hydrochloricum dilutum (кислота хлороводородная разведенная, содержание HCl 8,2-8,4%). Плотность 1,0 38 -1,0 39 : - Кислота хлористоводородная –1 часть - Вода - 2 части 27
Слайд 28
Для медицинских целей применяют разведенную хлороводородную кислоту. Если кислота прописана без обозначения концентрации, всегда отпускают кислоту хлороводородную разведенную ; 28
Слайд 29
ОПИСАНИЕ. Б есцветн ая прозрачн ая летуч ая жидкость. С мешивается с водой и спиртом в любых соотношениях, образуя растворы сил ь но кислой реакции. Окрашивает лакмус в красный цвет. Для 0.1 М раствора HCl рН = 1. 29
Слайд 30: П одлинность
1. Белый осадок AgCl нерастворим в азотной кислоте, но растворим в растворе аммиака: 2. С окислителями ( KMnO 4, MnO 2 ) 4HCl+MnO 2 Cl 2 +MnCl 2 +2H 2 O Хлор обнаруживают по посинению влажной йодид-крахмальной бумаги, вследствие образования молекулярного йода: Cl 2 + 2KI I 2 + 2KCl HNO 3 30
Слайд 31: П одлинность (ЕР):
31 П одлинность (ЕР): А. It is strongly acid. B. It gives the reactions of chlorides. C. It complies with the limits of the assay.
Слайд 32: ЧИСТОТА
Недопустимые примеси (ГФ) : -Свободный хлор, -Тяжелые металлы, -Сернистая кислота, -Сульфаты -Мышьяк 32
Слайд 33: ЧИСТОТА
1а. Если хлороводород получают: Cl 2 + H 2 2 HCl в качестве примеси может быть обнаружен хлор : ЕР: Free chlorine - Maximum 1 ppm. После проведения реакции, раствор оставляют на 2 мин., любое появившиеся синее окрашивание должно исчезнуть при добавлении натрия тиосульфата 33
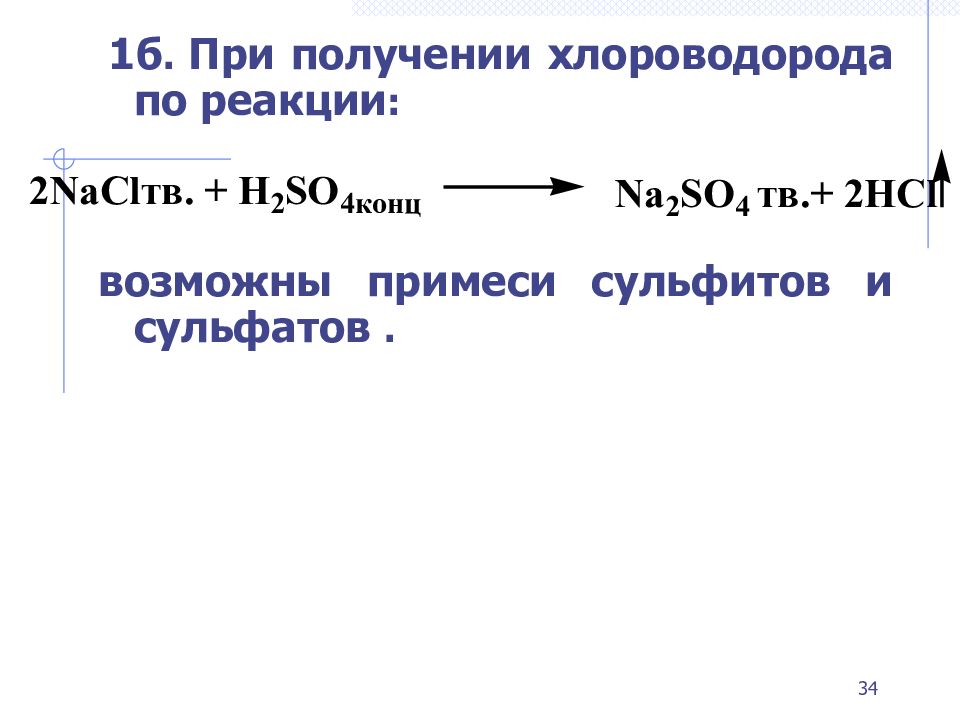
Слайд 34
1б. При получении хлороводорода по реакции : возможны примеси сульфитов и сульфатов. 34
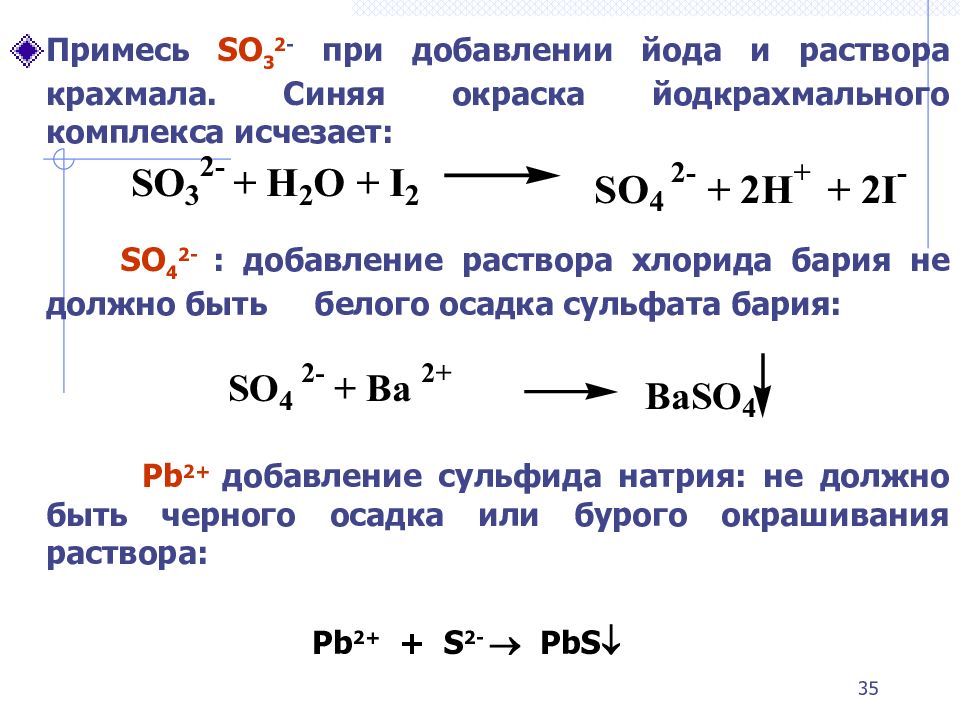
Слайд 35
Примесь SO 3 2 - при добавлении йода и раствора крахмала. Синяя окраска йодкрахмального комплекса исчезает: SO 4 2- : добавление раствора хлорида бария не должно быть белого осадка сульфата бария: Pb 2+ добавление сульфида натрия: не должно быть черного осадка или бурого окрашивания раствора: Pb 2+ + S 2- PbS 35
Слайд 37: Количественное определение
1 ).(ГФ, ЕР): М етод нейтрализации титрант - NaOH индикатор - метиловый оранжевый: HCl + NaOH NaCl + H 2 O Титрование проводят до перехода розовой окраски в оражево-желтую. 2). По плотности (не фармакопейная) 37
Слайд 38
ХРАНЕНИЕ. В склянках с притертыми пробками при комнатной температуре. Не хранить препарат в теплых помещениях: выделяется газ (НС l ), который нарушает укупорку склянки. Относится к списку Б. 38
Слайд 39
ПРИМЕНЕНИЕ. При заболеваниях желудка, сопровождающихся пониженной кислотностью. При гипохромных анемиях (снижении содержания гемоглобина в крови) вместе с продуктами железа обычно назначают хлористоводородную кислоту. Фармакологическое действие : Повышение кислотности желудочного сока способствует улучшению всасывания и усвоения железа. Способ применения и дозы : внутрь по 10-15 капель в ]/2 стакана воды 2-4 раза каждый день во время еды. При гипохромных анемиях применяют в комплексе с продуктами железа. 39
Слайд 40: Соединения галогенов со щелочными металлами (галогениды)
Ф армацевтическими препаратами являются: натрия и калия : - хлориды, - бромиды, - иодиды натрия фторид. Кристаллические порошки белого цвета. Однако йодиды могут иметь желтый цвет, что связано с разложением препарата на свету с выделением йода. Все галогениды хорошо растворяются в воде (растворимость NaCl 26,4% при 2 0 0 С); растворимость их в спирте различна. 40
Слайд 41: НАТРИЯ ХЛОРИД ( NATRII CHLORIDUM ) М.58,44 КАЛИЯ ХЛОРИД ( KALII CHLORIDUM ) М.74,55)
NaCl содержится в крови и в тканевых жидкостях организма ( концентрация в крови составляет около 0,5%) и обеспечивает постоянство осматического давления крови. В медицине применяют : 1. гипертонические растворы натрия хлорида (2, 5 % -10%-ные). Внутривенно и наружно. При наружной аппликации они способствуют выделению гноя, проявляют антимикробную активность, при внутривенном введении усиливают диурез и восполняют дефицит ионов натрия и хлора. 2. изотонический (0,9 %-ный) раствор натрия хлорида (внутривенно, подкожно). [ физиологический раствор ]. 41
Слайд 42
Дефицит NaCl может возникать при различных патологических состояниях, сопровождающихся повышенным выделением NaCl, при отсутствии компенсирующего поступления с пищей (холероподобном понос, неукротимой рвоте, обширных ожогах). При снижении концентрации NaCl в плазме крови, вода переходит из сосудистого русла в межтканевую жидкость и развивается сгущение крови, спазмируются гладкие мышцы и появляются судорожные сокращения скелетной мускулатуры, нарушаются функции нервной и сердечно-сосудистой систем. 42
Слайд 43
Калий является основным внутриклеточным ионом. Калия хлорид является антиаритмическим средством и источником ионов калия (при гипокалиемии). 43
Слайд 44: Получение
Натрия хлорид — единственный галогенид, который широко распространен в природе в виде массивных отложений каменной соли, которая является основным источником для получения препарата. Источники получения калия хлорида – минералы : сильвинит KCl. NaCl карналлит KCl. MgCl 2. 6 H 2 O. 44
Слайд 45: Определение подлинности
Подлинность препаратов NaCl и KCl определяется реакциями на катионы Na + и К + и анионы Сl -. Качественные реакции на ион Nа + (Фармакопейная). Окрашивание пламени. в желтый цвет. ЕФ: Реакция с цинк уранилацетатом ( в разбавленной уксусной кислоте ) : выпадает кристаллический осадок натрия цинк уранилацетата желтого цвета: 45
Слайд 46
3. ЕФ:с гексагидроксистибатом калия - образуется белый осадок гексагидроксистибата натрия: Na + + [Sb(OH) 6 ] - Na[Sb(OH) 6 ] Условия: Нейтральная среда Н + : аморфный осадок метасурьмяной кислоты Н SbO 3 ОН - : не происходит гидролиз К [Sb(OH) 6 ] Высокая концентрация Na + При низких концентрациях потереть палочкой и оставить на ночь 46
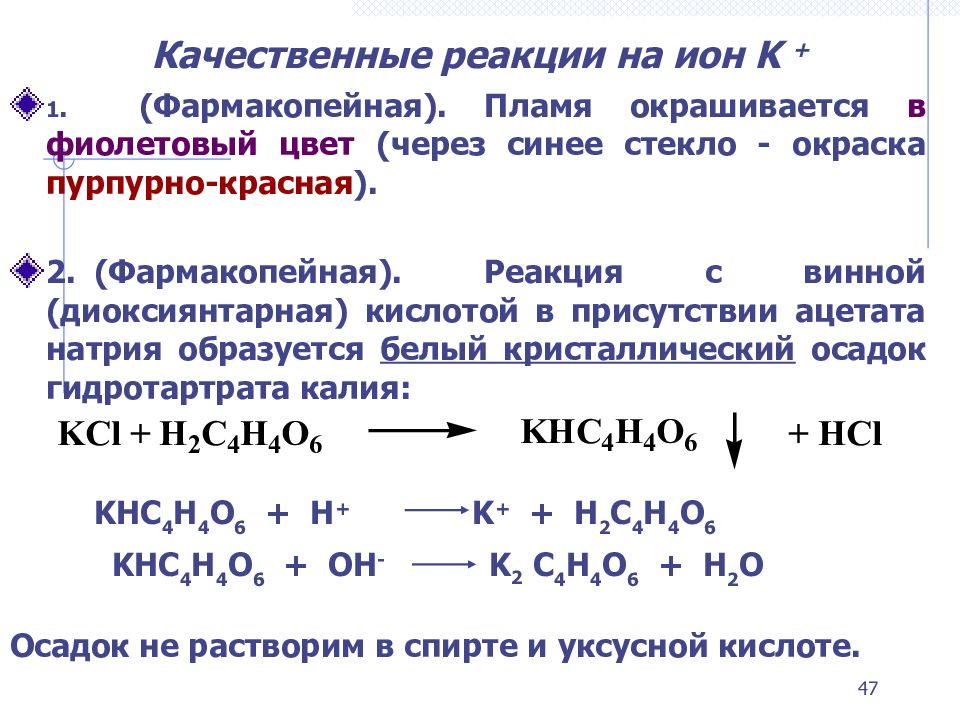
Слайд 47: Качественные реакции на ион K +
1. (Фармакопейная). П ламя окрашивается в фиолетовый цвет (через синее стекло - окраска пурпурно-красная ). 2. ( Фармакопейная). Реакция с винной (диоксиянтарная) кислотой в присутствии ацетата натрия образуется белый кристаллический осадок гидротартрата калия: KHC 4 H 4 O 6 + H + K + + H 2 C 4 H 4 O 6 KHC 4 H 4 O 6 + OH - K 2 C 4 H 4 O 6 + H 2 O Осадок не растворим в спирте и уксусной кислоте. 47
Слайд 48
3. ( Ф армакопейная). С гексанитрокобальтат ом натрия - желтый кристаллический осадок гексанитрокобальтата калия-натрия: Осадок нерастворим в кислоте уксусной, но растворяется в минеральных к-тах с образованием нестойкой кислоты H 3 [ Co ( NO 2 ) 6 ]. В щелочной среде выпадает бурый осадок гидроксида кобальта (Ш) Со(ОН) 3. Недопустимо присутствие спирта, т.к. Na 3 [ Co ( NO 2 ) 6 ] в спирте плохо растворим, и поэтому в растворе может появиться муть или даже осадок в отсутствие калия. 48
Слайд 49: ЧИСТОТА KCl, NaCl (ЕР)
не допускаются примеси: I- 2I - + 2NO 2 - + 4H + I 2 + 2NO + 2H 2 O Крахмал не должен окрашиваться в синий цвет Бария Ва 2+ + SO 4 - Ва SO 4 ЧИСТОТА NaCl (ЕР) не допускаются примеси: Ферроцианиды [Fe(CN) 6 ] 4- : Fe 3+ + [Fe(CN) 6 ] 4- Н+ NaFe[Fe(CN) 6 ] 49
Слайд 50
ГФ : Поскольку калий и натрий являются антагонистами по действию, не допускаются примеси калия в препаратах натрия и примеси натрия в препаратах калия. ЕФ: примеси калия в препаратах натрия и примеси натрия в препаратах калия определяют методом атомно-эмиссионной спектрометрией 0,1% натрия в препаратах калия для гемодиализа 500 ppm калия (мкг/г)(0,05%) 50
Слайд 51: БРОМ И ЕГО СОЕДИНЕНИЯ
Масса брома в организме составляет около 7 мг. Л окализуется преимущественно в железах внутренней секреции, в первую очередь в гипофизе. Бромид-ионы равномерно накапливаются в различных отделах мозга и действуют успокаивающе при повышенной возбудимости, т.е. способствуют восстановлению нарушенного равновесия между процессами возбуждения и торможения. 51
Слайд 52
НАТРИЯ БРОМИД ( Natrii bromidum ) NaBr М. 102,89 КАЛИЯ БРОМИД ( Kalii bromidum ) KBr М. 119,00 П рименяют в качестве седативных (успокаивающих) средств внутрь и внутривенно. Выпускают их в виде таблеток по 0,5 г, порошков, 3%-ных растворов. 52
Слайд 53
НАТРИЯ ЙОДИД ( Natrii iodidum ) NaI м. м. 149,89 КАЛИЯ ЙОДИД ( Kalii iodidum ) KI м. м. 166,00 Йодиды применяют при недостатке йода в организме (эндемическом зобе) и некоторых воспалительных заболеваниях. Изотопы 127 I, получены искусственные изотопы - 125 I ( T 1/2 = 60.2 сут), 131 I ( T 1/2 = 8.05 сут), 136 I ( T 1/2 = 2.26 час), используемые для диагностики и лечения рака щитовидной железы. Подлинность препаратов натрия и калия хлоридов, бромидов, йодидов определяется реакциями : на катионы Na + и К + и анионы: Сl -, Вг -, I -. 53
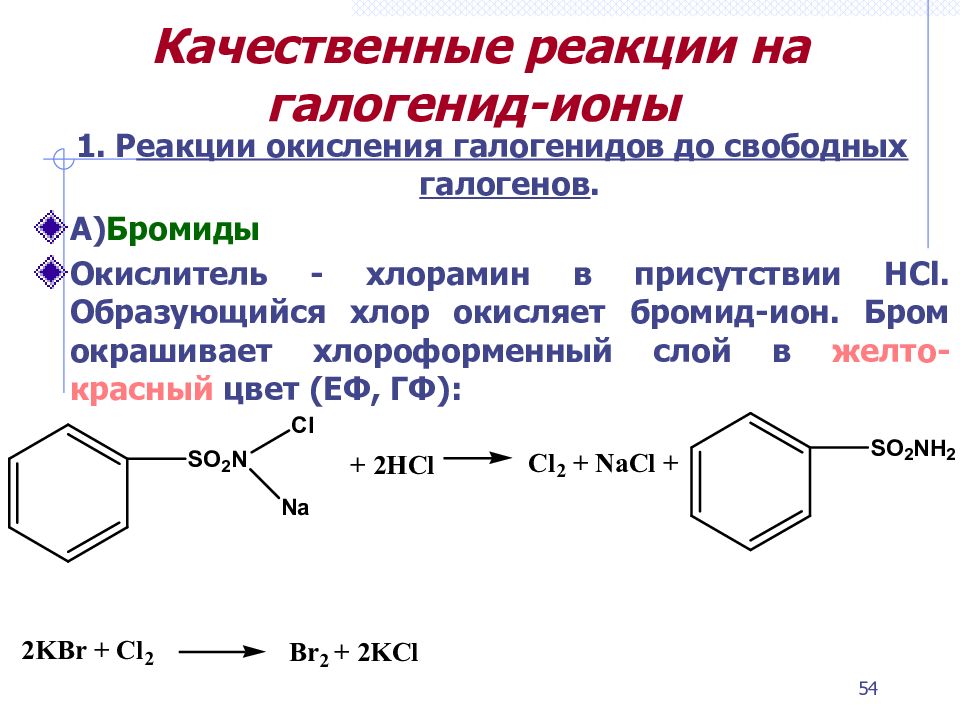
Слайд 54: Качественные реакции на галогенид-ионы
1. Р еакции окисления галогенидов до свободных галогенов. А) Бромиды Окислитель - хлорамин в присутствии HCl. Образующийся хлор окисляет бромид-ион. Бром окрашивает хлороформенный слой в желто-красный цвет (ЕФ, ГФ): 54
Слайд 55
Б). Йодиды 1. ГФ : для открытия йодидов использ уют р - р нитрита натрия или железа ( III ) хлорида, которые окисляют иодид-ионы I - до иода I 2. Выделяющийся йод окрашивает раствор хлороформа в фиолетовый цвет, а водный – в светло-коричневый. 2I - + 2Fe 3+ I 2 + 2Fe 2+ 2I - + 2NO 2 - + 4H + I 2 + 2NO + 2H 2 O 2. ГФ : При нагревании препаратов иодидов с концентрированной серной кислотой выделяются фиолетовые пары йода : 2KI + 2H 2 SO 4 I 2 + SO 2 + K 2 SO 4 + 2H 2 O 55
Слайд 56
Б). Йодиды 3. ЕФ : После добавления к раствору, содержащему йодид-ионы калия бихромата хлороформенный слой окрашивается в фиолетово-красный цвет 56
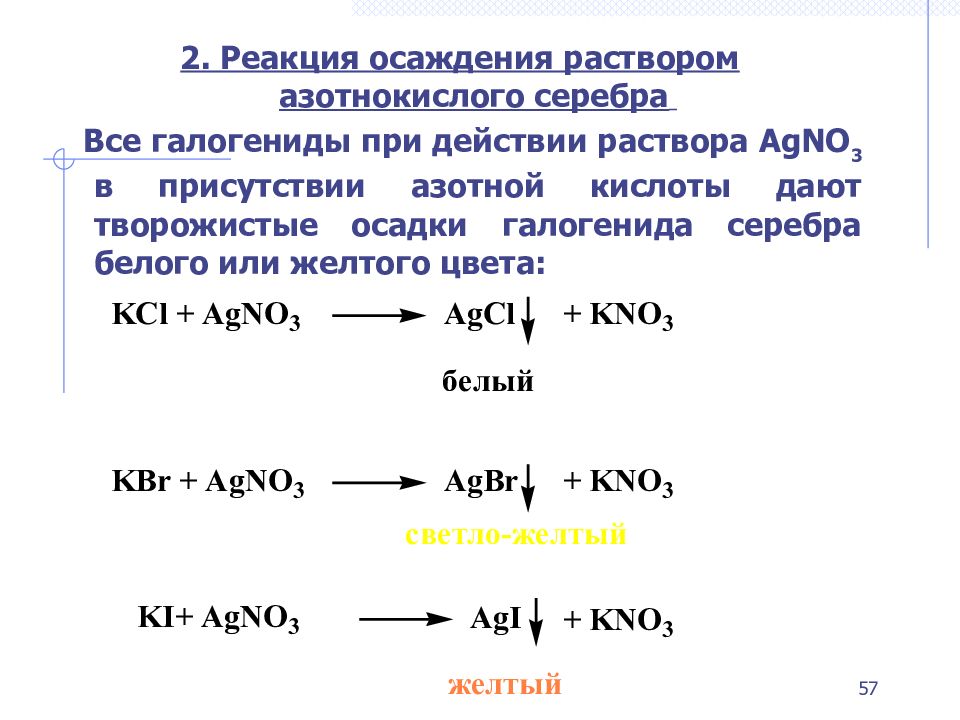
Слайд 57
2. Реакция осаждения раствором азотнокислого серебра Все галогениды при действии раствора AgNO 3 в присутствии азотной кислоты дают творожистые осадки галогенида серебра белого или желтого цвета: 57
Слайд 58
Все галогениды серебра ( AgCl, AgBr, AgI) нерастворимы в HNO 3, но растворимы в растворах Na 2 S 2 O 3 (с образованием тиосульфатного комплекса серебра): 58
Слайд 60
В препаратах бромидов определяют примесь йодидов (ЕР): Не должно появиться фиолетовой окраски хлороформенного слоя ( йод ). примесь солей бария и броматов реактив – конц. серная кислота. Соли бария образуют BaSO 4. Броматы в присутствии бромидов в кислой среде выделяют бром, придающий раствору желтый цвет: BrO 3 - + 5Br - + 6H + 3Br 2 + 3H 2 O ЕР: BrO 3 - + 6 I - + 6H + 3I 2 + 3H 2 O + Br - (в присутствии крахмала не должно появиться синей окраски) 60
Слайд 61
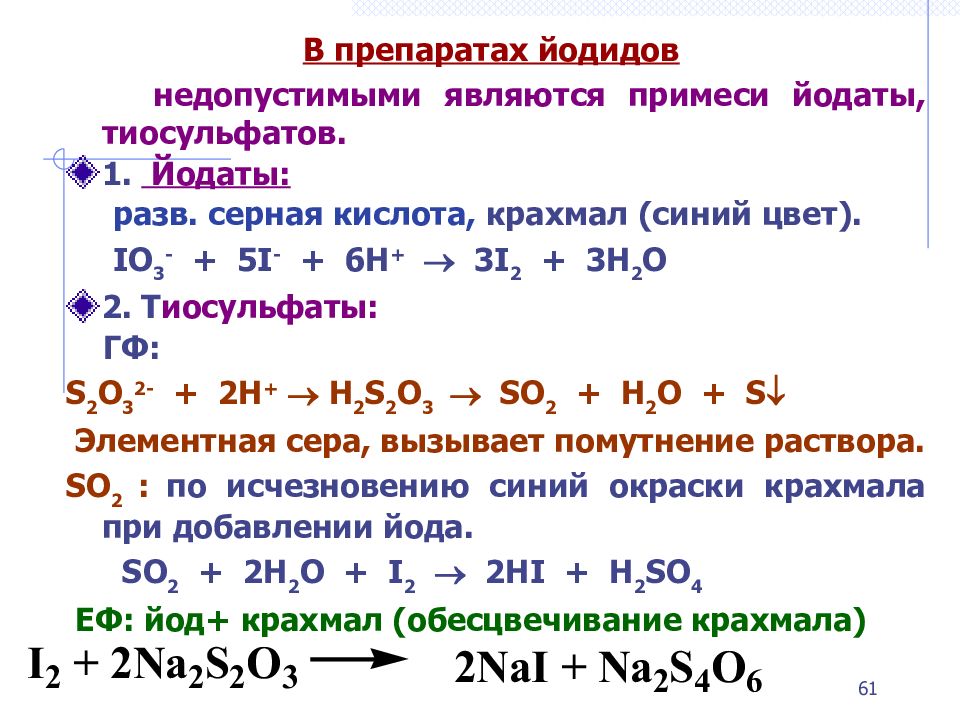
В препаратах йодидов недопустимыми являются примеси йодаты, тиосульфатов. 1. Йодаты: разв. серная кислота, крахмал (синий цвет). IO 3 - + 5I - + 6H + 3I 2 + 3H 2 O 2. Т иосульфаты: ГФ: S 2 O 3 2- + 2H + H 2 S 2 O 3 SO 2 + H 2 O + S Элементная сера, вызывает помутнение раствора. SO 2 : по исчезновению синий окраски крахмала при добавлении йода. SO 2 + 2H 2 O + I 2 2HI + H 2 SO 4 ЕФ: йод+ крахмал (обесцвечивание крахмала) 61
Слайд 62: Количественное определение
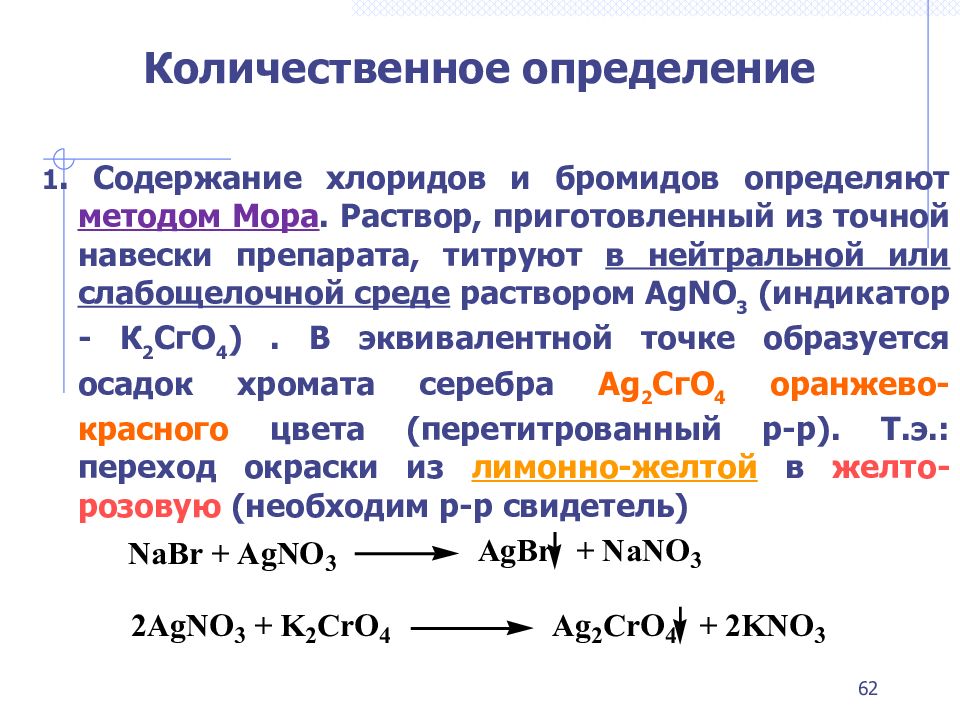
1. C одержание хлоридов и бромидов определяют методом Мора. Раствор, приготовленный из точной навески препарата, титруют в нейтральной или слабощелочной среде раствором AgNO 3 (индикатор - К 2 СгO 4 ). В эквивалентной точке образуется осадок хромата серебра Аg 2 СгO 4 оранжево-красного цвета ( перетитрованный р-р ). Т.э.: переход окраски из лимонно-желтой в желто-розовую (необходим р-р свидетель) 62
Слайд 63
Йодиды методом Мора определить невозможно, т.к. осадок AgI адсорбирует К 2 СгO 4, поэтому т.э. определить невозможно. Растворимость AgCl, AgBr ниже, чем Аg 2 СгO 4, поэтому только после полного осаждения Cl - и Br - выпадает Аg 2 СгO 4 Недостатки 1. Среда –нейтральная: в кислой растворяется Аg 2 СгO 4, а в щелочной – осадок Аg 2 O рН <6: Cr 2 O 4 2– + 2 H + → С r 2 O 7 2– + H 2 O, рН >8: 2 Ag + + 2 OH – → Ag 2 O + H 2 O. 2. Титрование нельзя проводить в присутствии ионов, образующих осадок с СгO 4 2- ( Ba 2+, Bi 3+, Pb 2+ и т.д.) 3. Нельзя титровать галогенами AgNO 3 63
Слайд 64
2. ЕР: метод обратного аргентометрического титрования по Фольгарду ( KBr, KCl, NaBr, NaCl). Остаток серебра нитрата оттитровывают стандартным раствором аммония тиоцианата: Изб. AgNO 3 + NaCl AgCl + NaNO 3 AgNO 3 + NH 4 SCN Ag SCN + NH 4 NO 3 В качестве индикатора - соли трехвалентного железа - квасцы железоаммониевые – NH 4 Fe ( SO 4 ) 2. 12 H 2 O, которые с избыточной каплей аммония тиоцианата образуют комплексные соли красного цвета: Fe 3+ + nSCN - [Fe(SCN) n ] 3-n 64
Слайд 65
1. Среда –кислая: кислота подавляет гидролиз соли железа и уничтожает желтую окраску железо-аммонийных квасцов, связанную с гидролизом. 2. Ионы, Ba 2+, Bi 3+, Pb 2+ не мешают титрованию. Недостатки: меньшая точность 65
Слайд 66
3. По ГФ иодиды определяют методом Фаянса. П рименяются адсорбционные индикаторы —динатриевые соли флуоресцеина или эозина. По мере титрования йодида раствором AgNO 3 образуется коллоидный осадок I - + AgNO 3 AgI . Коллоидные частицы AgI обладают большой адсорбционной способностью и образуют отрицательно заряженные частицы: [ AgI. I - ] В точке эвивалентности их заряд меняется на положительный: [AgI. I - ] + Ag + [AgI. Ag + ] и они адсорбируют на своей поверхности отрицательно заряженные анионы индикаторов. При этом в эквивалентной точке происходит изменение цвета поверхности осадка (AgI) от желтого до розового. 66
Слайд 67
Адсорбционные индикаторы представляют собой слабые органические кислоты, диссоциирующие на ионы: HInd → Н + + Ind - Анионы вблизи точки эквивалентности адсорбируются поверхностью образующихся осадков, что приводит к изменению окраски осадка и позволяет фиксировать конечную точку титрования. В качестве адсорбционных индикаторов применяют: 1. Бромфеноловый синий, бромкрезеловый синий – в уксуснокислой среде; 2. Эозинат натрия – в уксуснокислой среде; 3. Флуоресцеин – в нейтральной и слабо щелочной среде 67
Слайд 68: 4.Определение йодидов по ЕР ( йодатометрия)
Титрант: калия йодата IO 3 - + 5I - + 6H + 3I 2 + 3H 2 O 2 I 2 + IO 3 - + 10Cl- + 6H+ 5ICl 2 - + 3H 2 O 1. При титровании изменение окраски от красной к желтой 2.Добавляем хлороформ: I 2 окрашивает хлороформенный слой в фиолетовый цвет, 3. по мере прибавления титранта происходит обесцвечивание органического слоя Т.Э.: обесцвечивание органического слоя 68
Слайд 69: ФТОР И ЕГО СОЕДИНЕНИЯ
Масса фтора в организме составляет около 7 мг. Соединения фтора концентрируются : в костной ткани, ногтях, Зубах ( 0,01% ). Недостаток фтора в организме приводит к кариесу зубов. Минеральную основу зубных тканей – дентина составляет гидроксилапатит Ca 5 ( PO 4 ) 3 (ОН) Кариес зубов. Под действием кислот, вырабатываемых бактериями происходит растворение гидроксилапатитной компоненты эмали: Ca 5 ( PO 4 ) 3 (ОН) + Н - 5 Ca 2+ + 3Н 2 PO 4 - + H 2 О. 69
Слайд 70
Введение фторид-иона (обычно, в виде фторида натрия в зубной пасте) способствует образованию фторапатита: Ca 5 (PO 4 ) 3 ( ОН ) + NaF Ca 5 (PO 4 ) 3 F + NaOH. Из быток фтора. При содержании фтора в питьевой воде выше предельно допустимой нормы (1,2 мг/л) появляются симптомы хронического отравления фтором: зубная эмаль становится хрупкой, повышается хрупкость костей, наблюдаются костные деформации и т.д. 70
Слайд 71: Натрия фторид Natrii fluoridum NaF М 41.99
Лекарственные формы : Жидкость для полоскания рта, капли для приёма внутрь, таблетки. Белый порошок или бесцветные кристаллы. Растворим в воде, практически не растворим в этаноле. Определение подлинности А. Даёт реакции на натрий. Б. Даёт реакции на фториды: 1. ЕФ: C кальцием хлорида образуется белый желатиновый осадок, малорастворимый в кислотах. NaF + CaCl 2 CaF 2 + 2NaCl 71
Слайд 72
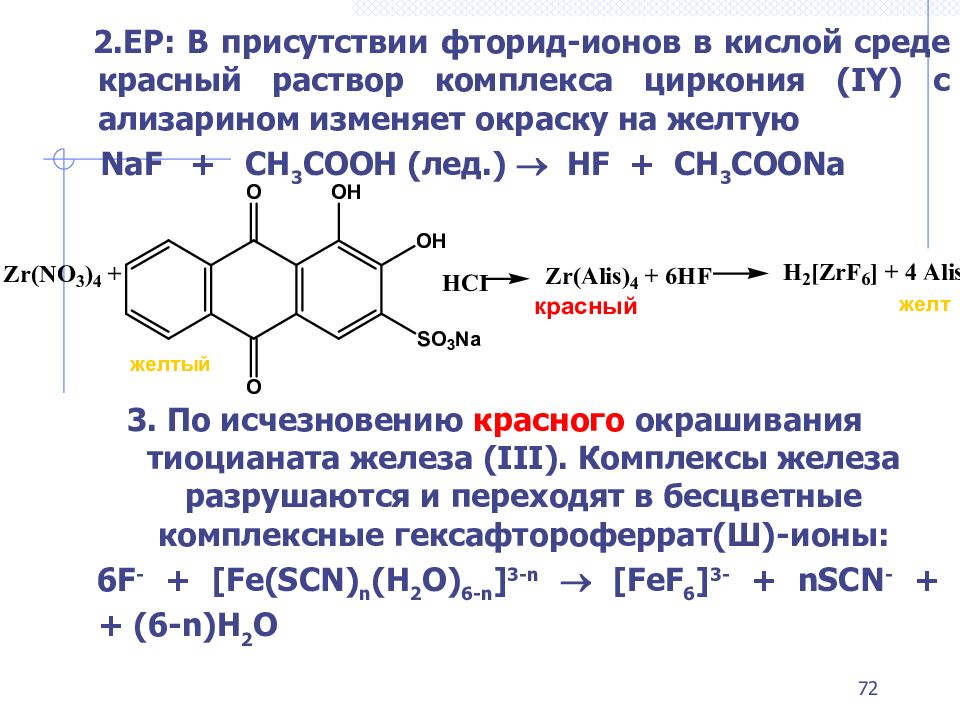
2.ЕР: В присутствии фторид-ионов в кислой среде красный раствор комплекса циркония ( IY ) с ализарином изменяет окраску на желтую NaF + CH 3 COOH ( лед.) HF + CH 3 COONa 3. П о исчезновению красного окрашивания тиоцианата железа ( III ). Комплексы железа разрушаются и переходят в бесцветные комплексные гексафтороферрат(Ш)-ионы: 6F - + [Fe(SCN) n (H 2 O) 6-n ] 3-n [FeF 6 ] 3- + nSCN - + + (6-n)H 2 O желт желтый красный 72
Слайд 73
Испытание на чистоту. В ЛП “Натрия фторид» допускаются примеси хлоридов, сульфатов. Недопустимой примесью являются фторосиликаты ( SiF 6 2- или SiF 5 - ) которые при нагревании может разлагаться с выделением HF и SiF 4. Не более чем 0,75 мл 0,1М натрия гидроксида требуется для изменения цвета (индикатор фенолфталеин) на красный. 73
Слайд 74
Количественное определение. 1. Г равиметрическим методом после осаждения фторид-ионов хлоридом свинца: NaF + PbCl 2 PbFCl + 2NaCl 2. Методом неводного титрования. Титрант – хлорная кислота, индикатор кристаллический фиолетовый до зеленого окрашивания NaF + CH 3 COOH (CH 3 COONaH) + F - CH 3 COOH + HClO 4 (CH 3 COOH 2 ) + ClO 4 - (CH 3 COONaH) + F - + CH 3 COOH 2 ) + ClO 4 - 2CH 3 COOH + NaClO 4 + HF 74
Слайд 75
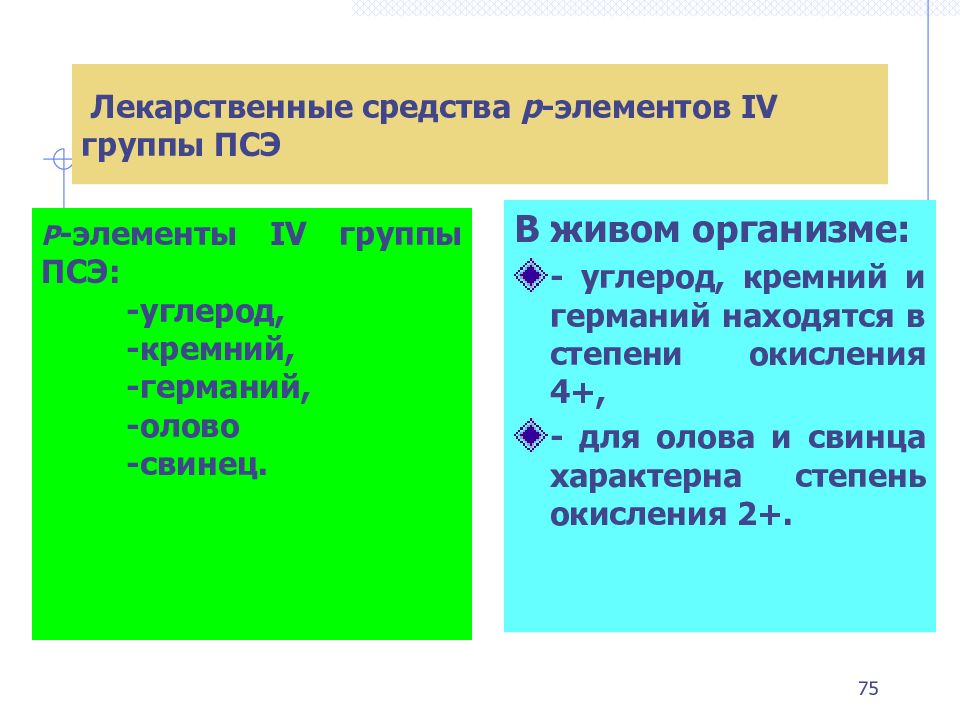
В живом организме: - углерод, кремний и германий находятся в степени окисления 4+, - для олова и свинца характерна степень окисления 2+. Лекарственные средства p -элементов IV группы ПСЭ Р -элементы IV группы ПСЭ: -углерод, -кремний, -германий, -олово -свинец. 75
Слайд 76: Углерод
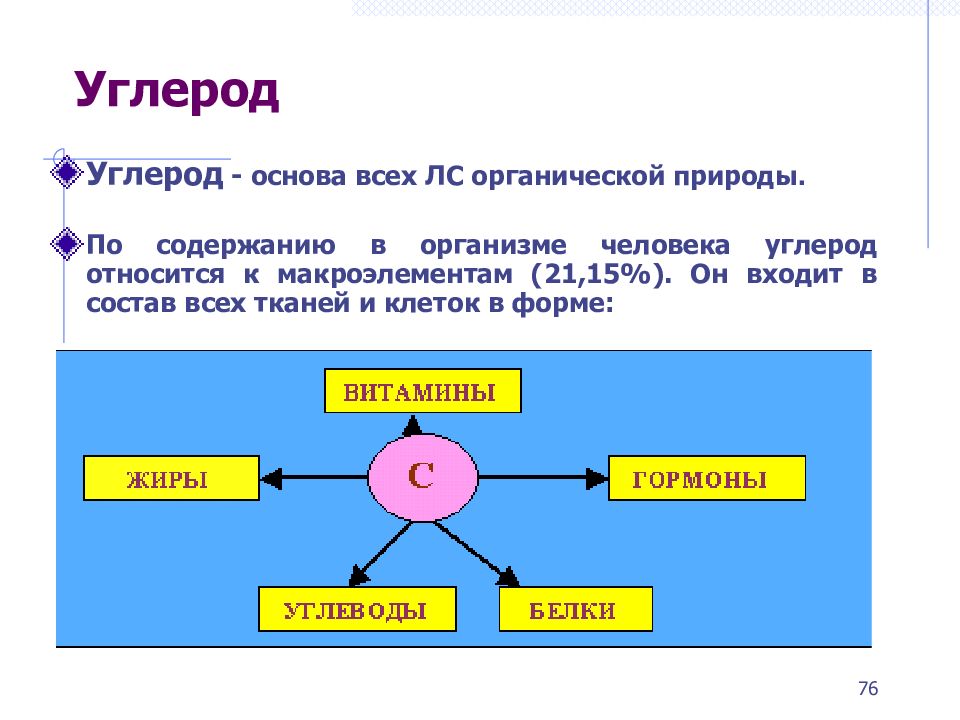
Углерод - основа всех ЛС органической природы. По содержанию в организме человека углерод относится к макроэлементам (21,15%). Он входит в состав всех тканей и клеток в форме: 76
Слайд 77: РАСПРОСТРАНЕНИЕ УГЛЕРОДА В ПРИРОДЕ
В земной коре углерод находится: - в свободном состоянии: -антрацит, -бурый уголь, -каменный уголь, -алмазы, -графит - в виде соединений (карбонатов): Известняка, Мрамора Мела СаСО 3, , Магнезита MgCO 3 Доломита MgCO 3. СаСО 3. - в виде оксида углерода (IV) CO 2 в атмосферном воздухе (в среднем 0,03%), в природных водах ( CO 3 2-, HCO 3 - ). 77
Слайд 78
УГОЛЬНАЯ КИСЛОТА ОБРАЗУЕТ ДВА РЯДА СОЛЕЙ: кислые (гидрокарбонаты НСО 3 - ) средние (карбонаты СО 3 2- ) Растворимость солей угольной кислоты: 1.Гидрокарбонаты щелочных и щелочно-земельных металлов хорошо растворимы в воде. 2.Карбонаты щелочно-земельных металлов в воде мало растворимы 3. Карбонаты щелочных металлов растворимы. 78
Слайд 79
Соли угольной кислоты - соединения устойчивые, хотя сама кислота неустойчива. Соли в водных растворах вследствие гидролиза имеют щелочную реакцию: СО 3 2- + НOН ОН - + НСО 3 - НСО 3 - + НОН ОН - + Н 2 О + CO 2 79
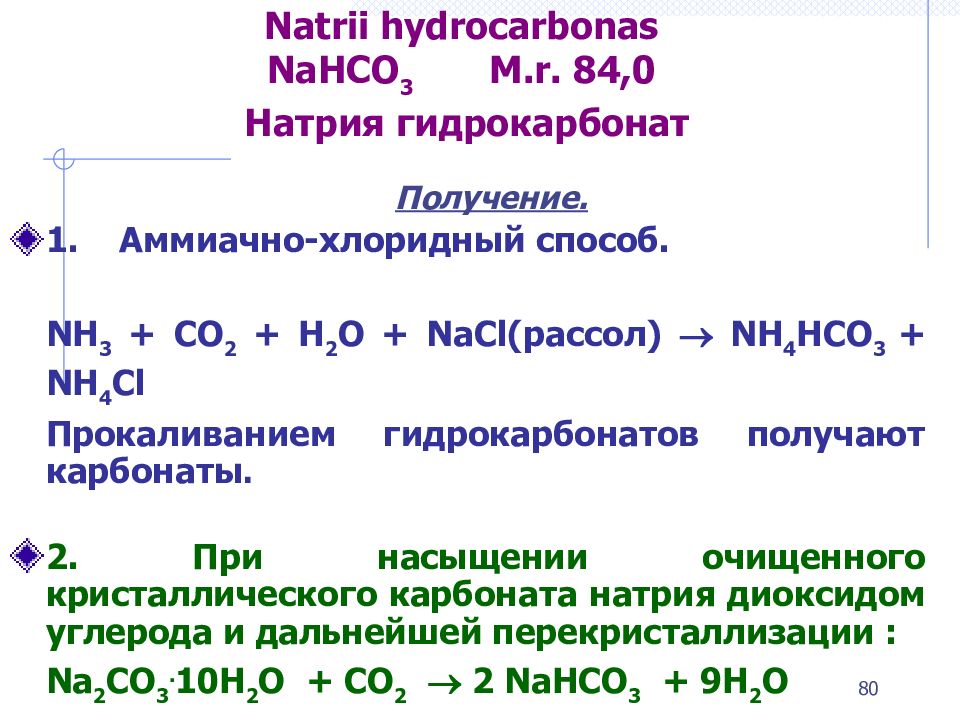
Слайд 80: Natrii hydrocarbonas NaHCO 3 М.r. 84,0 Натрия гидрокарбонат
Получение. 1. Аммиачно-хлоридный способ. NH 3 + СО 2 + Н 2 О + NaCl (рассол) NН 4 НСО 3 + NH 4 Cl Прокаливанием гидрокарбонатов получают карбонаты. 2. П ри насыщении очищенного кристаллического карбоната натрия диоксидом углерода и дальнейшей перекристаллизации : Na 2 CO 3. 10Н 2 О + СО 2 2 NaHCO 3 + 9Н 2 О 80
Слайд 81
ОПИСАНИЕ. Белый кристаллический порошок, без запаха, солено щ елочного вкуса, устойчив в сухом воздухе, медленно разлагается во влажном воздухе. НСО 3 - + НОН ОН - + Н 2 О + CO 2 При нагревании в растворе или в сухом состоянии постепенно переходит в натрия карбонат. NaHCO 3 100oC Na 2 CO 3 + H 2 O + CO 2 Растворим в воде: р астворяется в 11 частях воды, практически не растворим в этаноле. Водные растворы имеют рН 8,37. 81
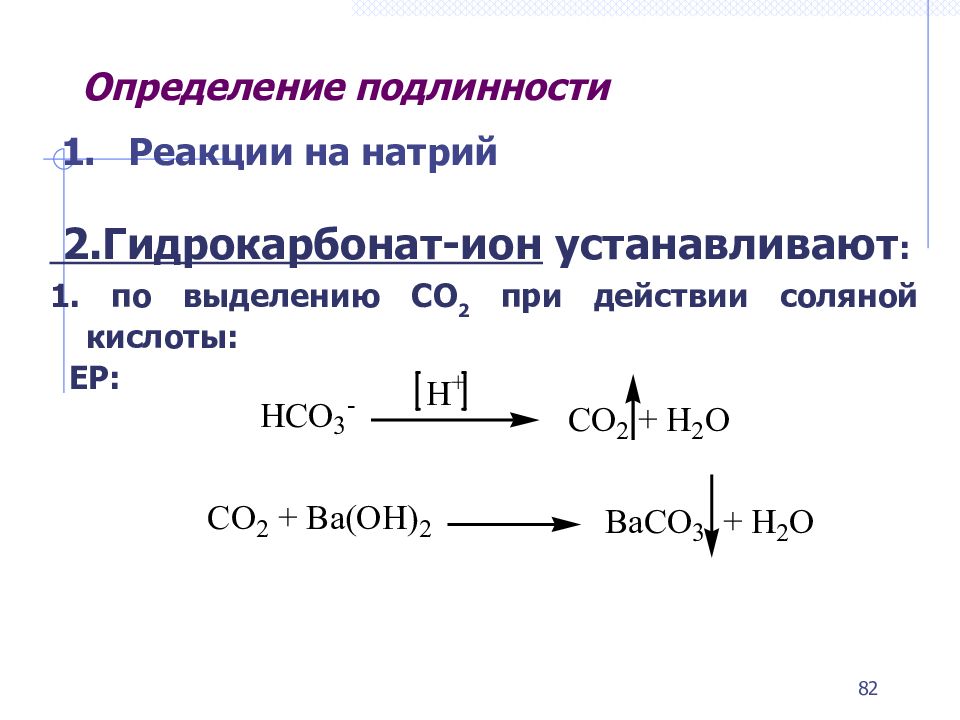
Слайд 82: Определение подлинности
1. Реакции на натрий 2.Г идрокарбонат-ион устанавливают : 1. по выделению CO 2 при действии соляной кислоты: ЕР: 82
Слайд 83
2. Согласно ЕФ: 5.0% раствор препарата в воде, свободной от углекислого газа, + 0.1 мл фенолфталеина = бледно-розовая окраска. При нагревании: выделяется газ и раствор становится красным (увеличивается значение рН раствора): НСО 3 - + НОН СО 2 + ОН - + Н 2 О 83
Слайд 84: Как отличи ть гидрокарбонат-ион от карбонат-иона ?
С насыщенным раствором сульфата магния. Б ел ый осад о к магния карбоната основного. Растворы карбонатов дают эту реакцию при обычной температуре : 4MgSO 4 + 4Na 2 CO 3 + 4H 2 O 3MgCO 3. Mg(OH) 2. 3H 2 O + 4Na 2 SO 4 + CO 2 Гидрокарбонат-ион образует осадок только после кипячения (превращения в карбонат-ион): NaHCO 3 100oC Na 2 CO 3 + H 2 O + CO 2 84
Слайд 85
Д обавление индикатора фенолфталеина к раствору испытуемой соли : растворы карбонатов окрашиваются в малиновый цвет, раствор натрия гидрокарбоната остается бесцветным или становится слабо-розовым (рН перехода окраски индикатора: 8.2(бесцветный) -10.0 ( малиновый ).
Слайд 86
ЧИСТОТА 1.Согласно ВР примесь карбонатов оценивают по значению рН – не более 8.6. При высокой концентрации карбонатов, рН будет выше. Согласно ГФ примесь карбонатов оценивают по потере в весе при прокаливании при температуре 280-300 о С. Потеря массы при этом должна быть не менее 36,6%. При высокой концентрации карбонатов, потеря массы при прокаливании будет меньше. NaHCO 3 100oC Na 2 CO 3 + H 2 O + CO 2 86
Слайд 87: Испытания на чистоту
ГФ, ЕР : допускает наличие примесей: солей аммония (ГФ – недопустимая примесь: нагревание с NaOH) тяжелых металлов (ГФ – недопустимая примесь ) хлорид ов сульфат ов желез а кальци я мышьяк а. 2. Если натрия гидрокарбонат используют для инъекций, его 5% раствор должен быть прозрачным. 87
Слайд 88: Количественное содержание
О пределяется ацидиметрически. NaHCO 3 + HCl NaCl + H 2 O + CO 2 Лекарственного вещества в субстанции не менее 99,0% и не более 101,0%, в пересчёте на сухое вещество. 88
Слайд 89
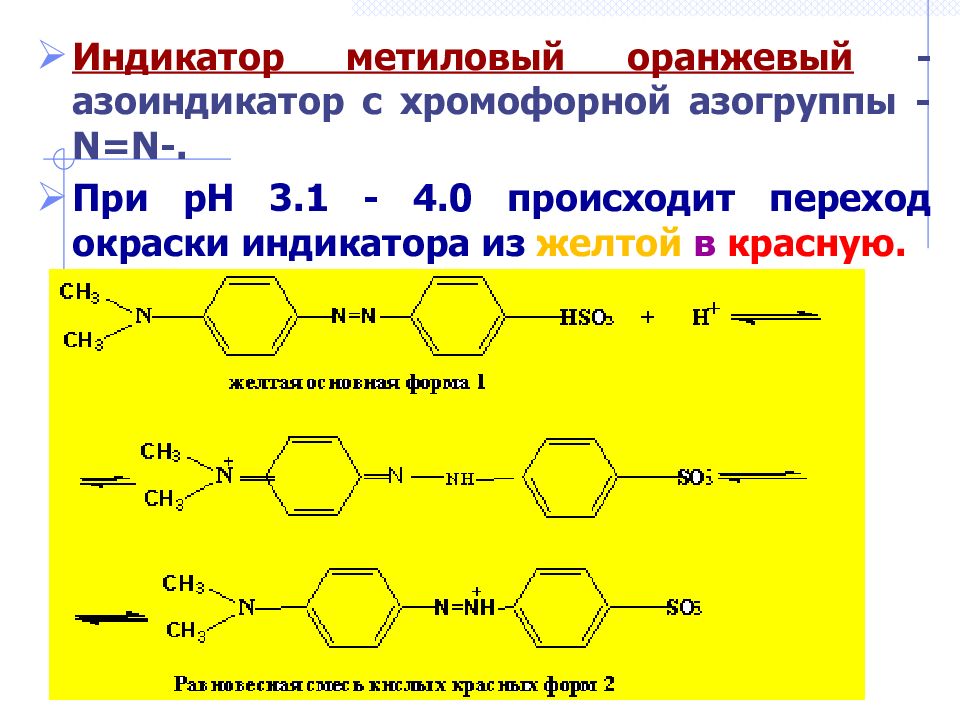
Индикатор метиловый оранжевый - азоиндикатор c хромофорной азогруппы - N = N -. При рН 3.1 - 4.0 происходит переход окраски индикатора из желтой в красную.
Слайд 90
ПРИМЕНЕНИЕ 1.Антацидное средство. При приеме внутрь взаимодействует с HCl желудочного сока, нейтрализуя ее. NaHCO 3 + HCl NaCl + H 2 O + CO 2 Н атрия гидрокарбонат часто назначают с обволакивающими, адсорбирующими веществами, Устраняет болевой синдром. Антацидный эффект - быстрый, но CO 2 раздражает рецепторы слизистой оболочки желудка, что приводит к неприятным ощущениям в желудке (вследствие его растяжения) и отрыжку. ПРИМЕНЯЮТ при Гиперацидности желудочного сока, метаболическом ацидозе (в т.ч. при инфекциях, интоксикациях, сахарном диабете, в послеоперационном периоде), при язвенной болезни желудка и 12-перстной кишки
Слайд 91
2. Увеличивает выведение Na+ и Cl-, осмотический диурез; при артериальной гипертензии 3. сдвигает в щелочную сторону реакцию бронхиальной слизи, повышает бронхиальную секрецию, снижает вязкость мокроты и улучшает ее отхаркивание; при бронхитах и воспалительных заболеваниях верхних дыхательных путей 4. Всасываясь, приводит к развитию алкалоза. Ощелачивание мочи предупреждает осаждение мочевой кислоты в мочевыводящих путях. 5. Облегчает симптомы морской и воздушной болезни.
Слайд 92
Натрия гидрокарбонат выпускается в виде следующих лекарственных форм: порошка, таблеток, 4% растворов в ампулах, (БФ: ушные капли). ХРАНЕНИЕ. В сухом, прохладном месте в хорошо закупоренных банках.
Слайд 93: Лития карбонат Lithii Carbonas Li 2 CO 3 М.r. 73,89
ПОЛУЧЕНИЕ. 1. 2LiOH + CO 2 Li 2 CO 3 + H 2 O 2. Действием карбонатов ( Na 2 CO 3 ; K 2 CO 3 ) на соли лития ( LiCl ; LiNO 3 ; Li 2 SO 4 ) при нагревании: 2LiCl + Na 2 CO 3 Li 2 CO 3 + 2NaCl 93
Слайд 94
ОПИСАНИЕ. Белый легкий щелочной порошок без запаха. Мал о растворим в воде (1:100), не растворим в спирте.
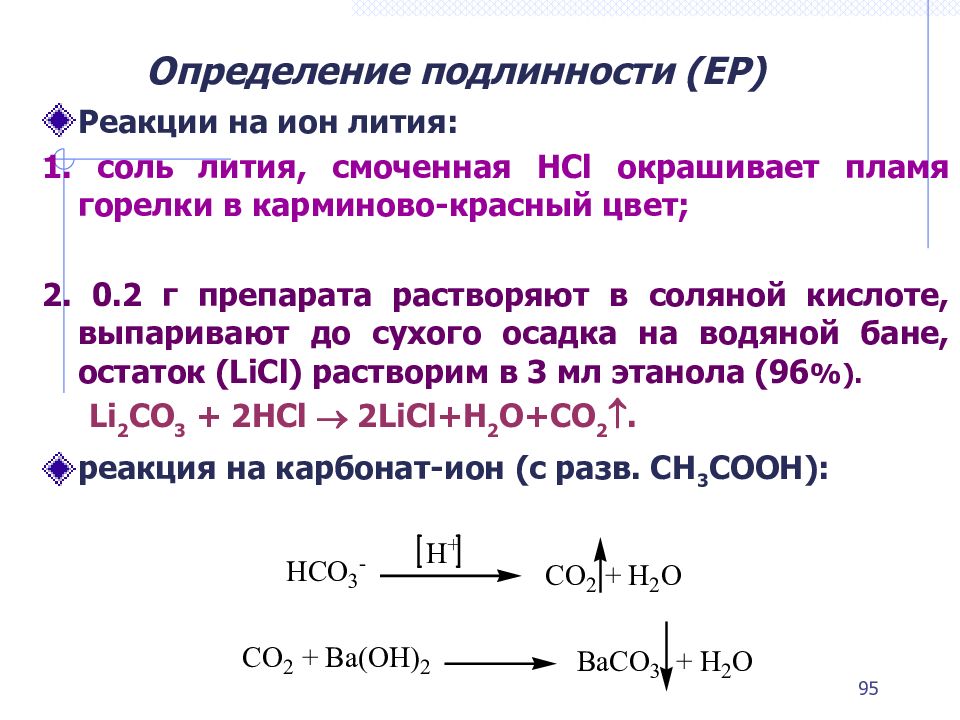
Слайд 95: Определение подлинности (ЕР)
Реакции на ион лития: 1. соль лития, смоченная НСl окрашивает пламя горелки в карминово-красный цвет; 2. 0.2 г препарата растворяют в соляной кислоте, выпаривают до сухого осадка на водяной бане, остаток ( LiCl ) растворим в 3 мл этанола (96 %). Li 2 CO 3 + 2HCl 2LiCl+H 2 O+CO 2 . реакция на карбонат-ион (c разв. CH 3 COOH) : 95
Слайд 96
Нефармакопейные реакции определения присутствия иона лития 1. соль лития растворяют в HCl, +р-р натрия гидрофосфата, белый осадок лития фосфата: Li 2 CO 3 + 2HCl 2LiCl+H 2 O+CO 2 3Li + + HPO 4 2- Li 3 PO 4 + Н + Для увеличения полноты осаждения добавляют этанол. Li 3 PO 4 растворим в растворах кислот. 96
Слайд 97
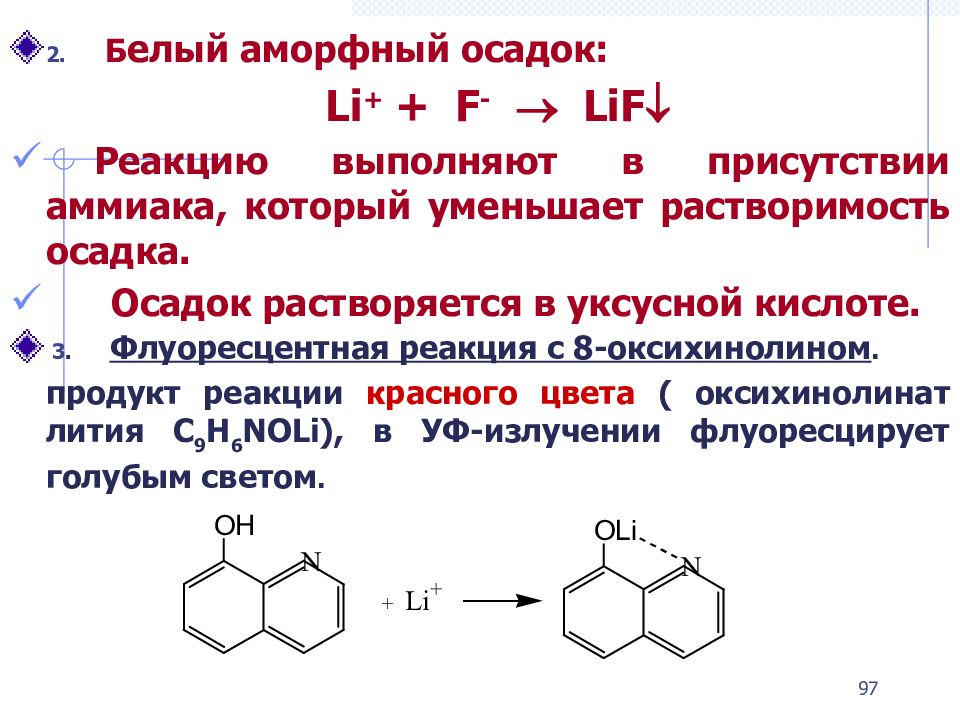
2. Б елый аморфный осадок: Li + + F - LiF Реакцию выполняют в присутствии аммиака, который уменьшает растворимость осадка. Осадок растворяется в уксусной кислоте. 3. Флуоресцентная реакция с 8-оксихинолином. продукт реакции красного цвета ( оксихинолинат лития C 9 H 6 NOLi ), в УФ-излучении флуоресцирует голубым светом. 97
Слайд 98: Испытания на чистоту ЛП «ЛИТИЯ КАРБОНАТ»
Примесь мышьяка не должна превышать 2 мкг/г. Примеси хлоридов, сульфатов и кальция не должны превышать 200 мкг/г (каждого). Тяжелые металлы –не более 2 мкг/г свинца. Железо – не более 20 мкг/г. Магний –не более 150 мкг. Определение примеси калия и натрия осуществляют методом атомно-эмиссионной спектрофотометрии. Содержание каждого из них не должно превышать 300 мкг/мл. 1. Раствор должен быть прозрачным и бесцветны м при действ ии азотной кислоты на суспензию, приготовленную смешиванием препарата с вод ой 98
Слайд 99: Количественное определение. М етод обратного ацидиметрического титрования, индикатор – метиловый оранжевый: Li 2 CO 3 + 2HCl 2LiCl + H 2 O + CO 2 HCl + NaOH NaCl+H 2 O
99
Слайд 100
ПРИМЕНЕНИЕ Нормотимическое средство (нормализует психическое состояние, не вызывая общей заторможенности), оказывает антидепрессивное действие, седативное действие антиманиакальное действие. Эффект обусловлен ионами Li+, которые, являясь антагонистами Na+, вытесняют их из клеток и тем самым снижают биоэлектрическую активность нейронов мозга. Благоприятное действие препаратов Li+ при мигрени может быть связано с изменением концентраций серотонина.
Слайд 101
алкоголизм (аффективные расстройства); мигрень, сексуальные расстройства, лекарственная зависимость (некоторые формы). Форма выпуска. Таблетки. Х ранение. В сухом месте
Слайд 102
ЛС р-элементов IY группы Олово -радиофармацевтического препарата «Микросферы альбумина, MCA(Sn) 99м-Тс ». -пленочное силиконовое пенопокрытие. Свинец в виде растворов уксуснокислой соли при воспалительных заболеваниях кожи и слизистых оболочек («свинцовая примочка»). 102
Последний слайд презентации: Лекция №3 «Лекарственные средства производные р -элементов ПСЭ»
Производные кремниевой кислоты Тальк ( Talcum ). Природное вещество - силикат магния, содержащий около 64% окиси магния и 36% кремниевой кислоты: 3MgO. 4SiO 2. H 2 O или 3MgSiO 3. H 2 SiO 3 ПРИМЕНЕНИЕ. Используется как адсорбент. Для обволакивания пилюль и как присыпку. При массаже вместо жира для создания скользящей поверхности. БФ: Коллоидный оксид кремния (Силикагель Colloidal Anhydrous Silica ) Si0 2 ; (содержит 99.0-100.5 % основного вещества). Применяется в хроматографии для разделения и анализа лекарственных веществ 103