Первый слайд презентации: ГИДРОЛИЗ СОЛЕЙ
Термин «гидролиз» буквально означает разложение водой. Гидролизу подвержены соединения различных классов. Гидролиз солей – это реакция обменного взаимодействия между солями (ионами солей) и водой (ионами воды).
Слайд 2
Причиной гидролиза является образование слабых электролитов. При этом происходит связывание ионов воды ионами растворённого вещества с обр-нием мало-диссоциированного или труднорастворимого продукта. Это приводит к нарушению равновесия диссоциации воды: H 2 О OH‾ + Н +, МА + Н 2 О НА + МOH; Δ Н > 0. в рез-те может изменяться кислотность среды ( рН р-ра ). В зависимости от силы к и слоты и основания, из к-рых образована соль, выделяют четыре случая гидролиза. Гидролиз солей обратим. Обратная реакция – это нейтрализация кислот и оснований. Пусть НА – кислота, МOH – основание, МА – их соль. Тогда уравнение гидролиза будет иметь вид:
Слайд 3
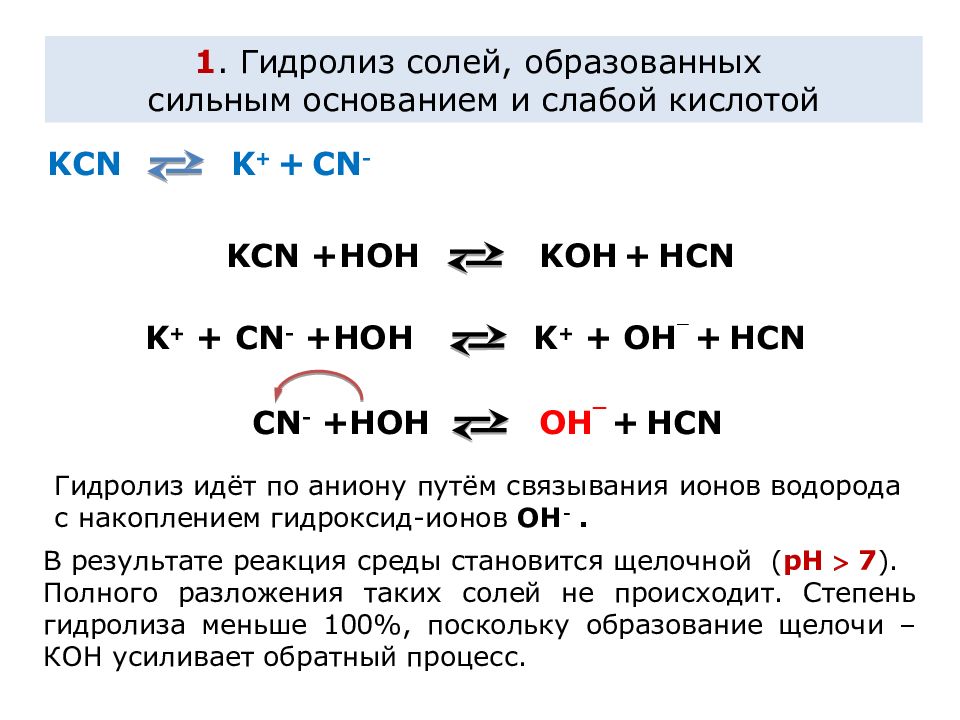
K CN K + + CN - K CN +HOH KOH + H CN K + + CN - +HOH K + + OH ¯ + H CN CN - +HOH OH ¯ + H CN 1. Гидролиз солей, образованных сильным основанием и слабой кислотой В результате реакция среды становится щелочной ( рН 7 ). Полного разложения таких солей не происходит. Степень гидролиза меньше 100%, поскольку образование щелочи – КОН усиливает обратный процесс. Гидролиз идёт по аниону путём связывания ионов водорода с накоплением гидроксид-ионов OH -.
Слайд 4
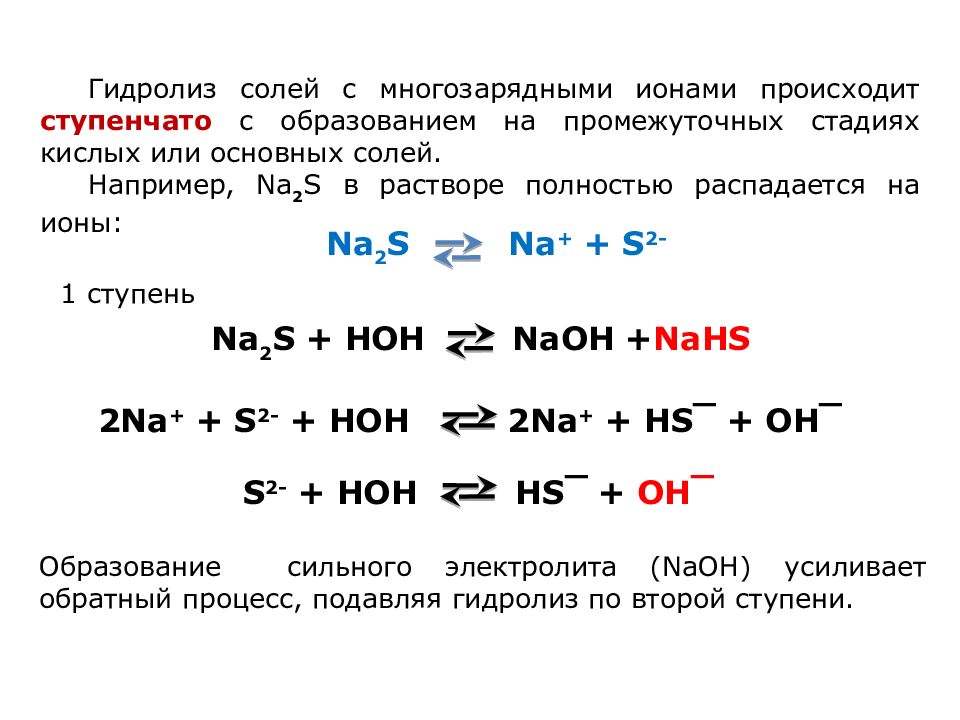
Гидролиз солей с многозарядными ионами происходит ступенчато с образованием на промежуточных стадиях кислых или основных солей. Например, Na 2 S в растворе полностью распадается на ионы: Na 2 S Na + + S 2- 2Na + + S 2- + HOH 2Na + + HS‾ + OH‾ Na 2 S + HOH Na OH + NaH S S 2- + HOH HS‾ + OH‾ 1 ступень Образование сильного электролита ( Na ОН ) усиливает обратный процесс, подавляя гидролиз по второй ступени.
Слайд 5
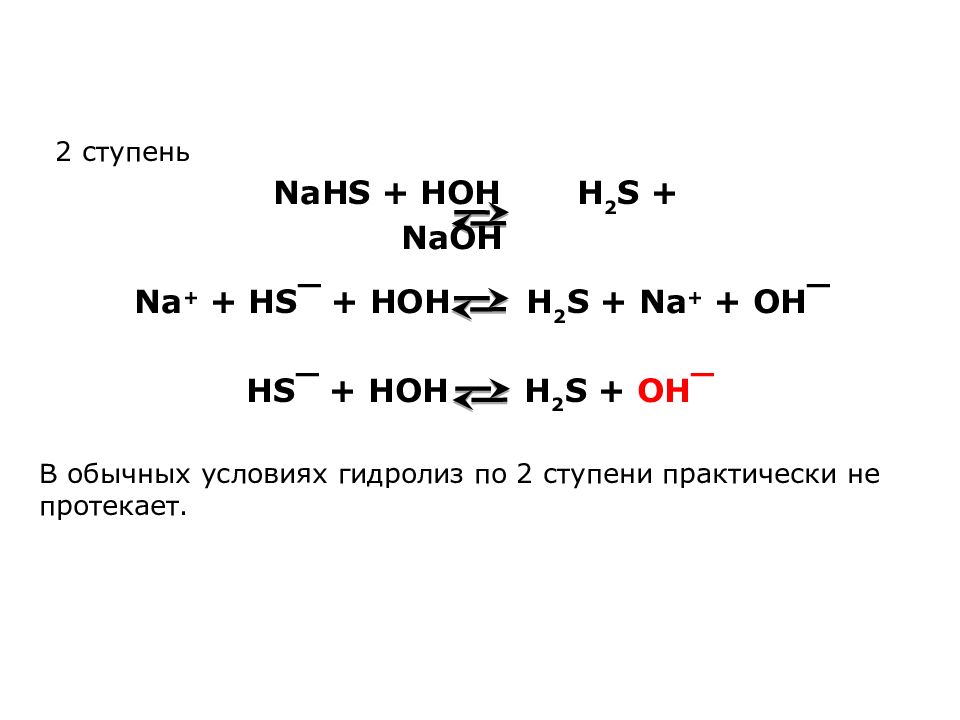
HS‾ + HOH H 2 S + OH‾ NaHS + HOH H 2 S + NaOH Na + + HS‾ + HOH H 2 S + Na + + OH‾ 2 ступень В обычных условиях гидролиз по 2 ступени практически не протекает.
Слайд 6
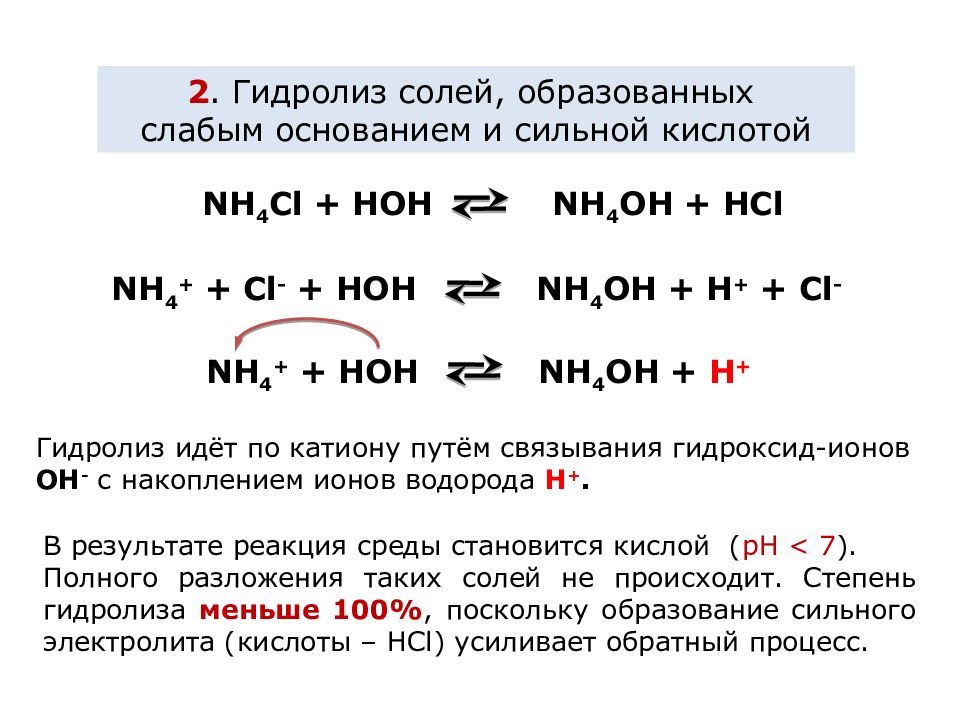
2. Гидролиз солей, образованных слабым основанием и сильной кислотой NH 4 C l + HOH NH 4 OH + HCl NH 4 + + C l - + HOH NH 4 OH + H + + Cl - NH 4 + + HOH NH 4 OH + H + В результате реакция среды становится кислой ( рН < 7 ). Полного разложения таких солей не происходит. Степень гидролиза меньше 100%, поскольку образование сильного электролита (кислоты – НС l) усиливает обратный процесс. Гидролиз идёт по катиону путём связывания гидроксид-ионов OH - с накоплением ионов водорода H +.
Слайд 7
Гидролиз солей с многозарядными ионами происходит ступенчато с образованием на промежуточных стадиях кислых или основных солей. FeCl 3 + HOH FeOHCl 2 + HCl Fe 3+ + 3 Cl - + HOH FeOH 2+ + 2Cl - + H + + Cl - Fe 3+ + HOH FeOH 2+ + H + Образование сильного электролита (кислоты – НС l) усиливает обратный процесс, подавляя гидролиз по второй и третьей ступеням.
Слайд 8
3. Гидролиз солей, образованных слабым основанием и слабой кислотой NH 4 CN + HOH NH 4 OH + HCN NH 4 + + CN - + HOH NH 4 OH + HCN Гидролиз идёт и по катиону и по аниону путём связывания обоих ионов воды, в результате среда остаётся практически нейтральной ( рН ≈ 7 ). Степень гидролиза → 100 %.
Слайд 9
4. Гидролиз солей, образованных сильным основанием и сильной кислотой Na + + Cl ‾ + НОН Na + + ОН‾ + Н + + Cl ‾ N a C l + HOH N aOH + HCl После сокращения одинаковых ионов в обеих частях уравнения остаётся уравнение реакции диссоциации воды: H 2 О OH‾ + Н + Вывод: соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Реакция раствора остается нейтральной ( рН=7,0 ).
Слайд 10
Совместный гидролиз Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы и разлагаются с образованием летучих продуктов, то гидролиз соли часто протекает необратимо, т. е. сопровождается полным разложением соли. 2AlCl 3 + 3Na 2 CO 3 + 3 Н 2 О = 2 Al(OH) 3 ↓ + 3 СО 2 ↑ + 6NaCl или сокращённо 2 Al 3+ + 3СО + 3Н 2 O = 2 Al (OH) 3 ↓ + 3СO 2 ↓ 2Al 3+ +3 Cl ¯+ 6 Na + + CO +3 Н 2 О =2Al(OH) 3 ↓+3 СО 2 ↑+6Na + + Cl ¯
Слайд 11
Влияние на равновесие при гидролизе соле й. Гидролиз солей - процесс обратимый и протекает с поглощением тепла ( эндотермически ). При постоянных условиях наступает состояние равновесия, влияние на него подчиняется принципу Ле Шателье : Если на систему, находящуюся в состоянии равновесия, оказано внешнее воздействие, то равновесие сместится таким образом, чтобы уменьшить оказанное воздействие. Влияние температуры на степень гидролиза. Все реакции нейтрализации протекают с выделением теплоты, а гидролиз - с поглощением теплоты. Выход эндотермических реакций с ростом температуры увеличивается, поэтому степень гидролиза растет с повышением температуры. К с = ехр [-∆H°(Т)/(RT) + ∆S/R]. Из данного выражения видно, что влияние температуры на равновесие определяется как абсолютным значением, так и знаком ∆H°(Т).
Последний слайд презентации: ГИДРОЛИЗ СОЛЕЙ
Изменение концентрации веществ. Для ослабления гидролиза растворы следует хранить концентрированными и при низких температурах. Кроме того, подавлению гидролиза способствует подкисление (в случае солей, образованных сильной кислотой и слабым основанием) или подщелачивание (для солей, образованных сильным основанием и слабой кислотой) раствора. Для ослабления гидролиза всё наоборот.