Первый слайд презентации: КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ
Слайд 2: Постановка проблемы
CoCl 3 •6NH 3 Проявляет свойства Cl – ( осадок с нитратом серебра ) Но Не проявляет свойства Co 3+ Не проявляет свойства NH 3
Слайд 3: Координационная теория Вернера (1893 г.)
Альфред Вернер (1866 – 1919 гг.) – швейцарский химик, лауреат Нобелевской премии по химии 1913 г. Координационная теория Вернера – основа современной теории строения комплексных соединений Видно строение вещества
Слайд 4: Основные понятия
Комплексообразователь (центральный катион) - катион металла, который обладает вакантными орбиталями d- элементы : С u +2, Co +3, Fe +3, Hg +2 и др. реже р-элементы: Al +3 иногда неметаллы: В +3, Si +4 Вокруг комплексообразователя расположены лиганды – частицы, обладающие неподеленными электронными парами Координационными называют соединения, содержащие в одном из агрегатных состояний группу атомов или молекул ( лигандов ), в определенном порядке присоединенных к атому-комплексообразователю Молекулы: H 2 O, NH 3 Анионы: CN -, OH -, Cl -, Br -, NO 2 -
Слайд 5: Основные понятия
Внутренняя сфера комплексного соединения - центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица Связь между центральным атомом и лигандами ковалентная Внешняя сфера комплексного соединения - остальные частицы, связанные с комплексной частицей ионной связью Комплексообразователь Лиганды
Слайд 6: Координационное число
Координационное число (КЧ) - число связей, образуемых центральным атомом с лигандами КЧ зависит: от размеров центрального атома и лигандов от степени окисления центрального атома концентрации исходных компонентов Al(OH) 3 + NaOH= Na[Al(OH) 4 ] Al(OH) 3 +3NaOH= Na 3 [Al(OH) 6 ] КЧ может принимать значения от 2 до 12 Чаще всего оно равно 6, несколько реже 4
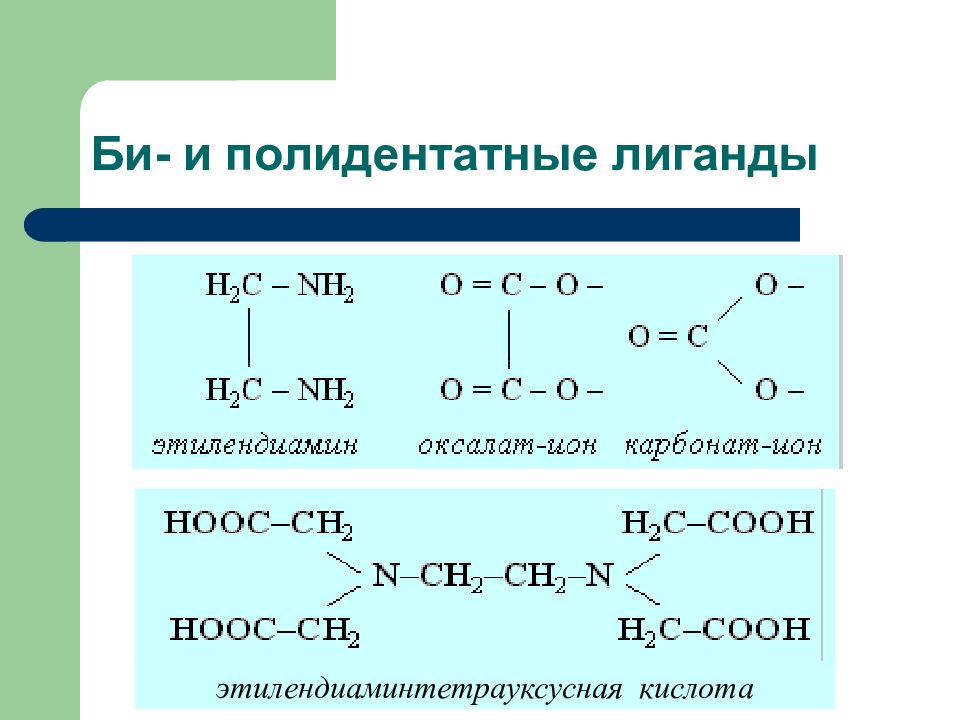
Слайд 7: Дентатность лигандов
Монодентатные лиганды. Такие лиганды бывают нейтральными (молекулы Н 2 О, NH 3, CO, NO и др.) и заряженными (ионы CN −, F −, Cl −, OH −, SCN −, S 2 O 3 2− и др.) Бидентатные лиганды. Примерами служат лиганды: ион аминоуксусной кислоты H 2 N – CH 2 –COO −, оксалатный ион − O–CO–CO–O −, карбонат-ион СО 3 2−, сульфат-ион SO 4 2− Полидентатные лиганды. Например, комплексоны - органические лиганды, содержащие в своём составе несколько групп −С≡N или −COOH (этилендиаминтетрауксусная кислота - ЭДТА) Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя
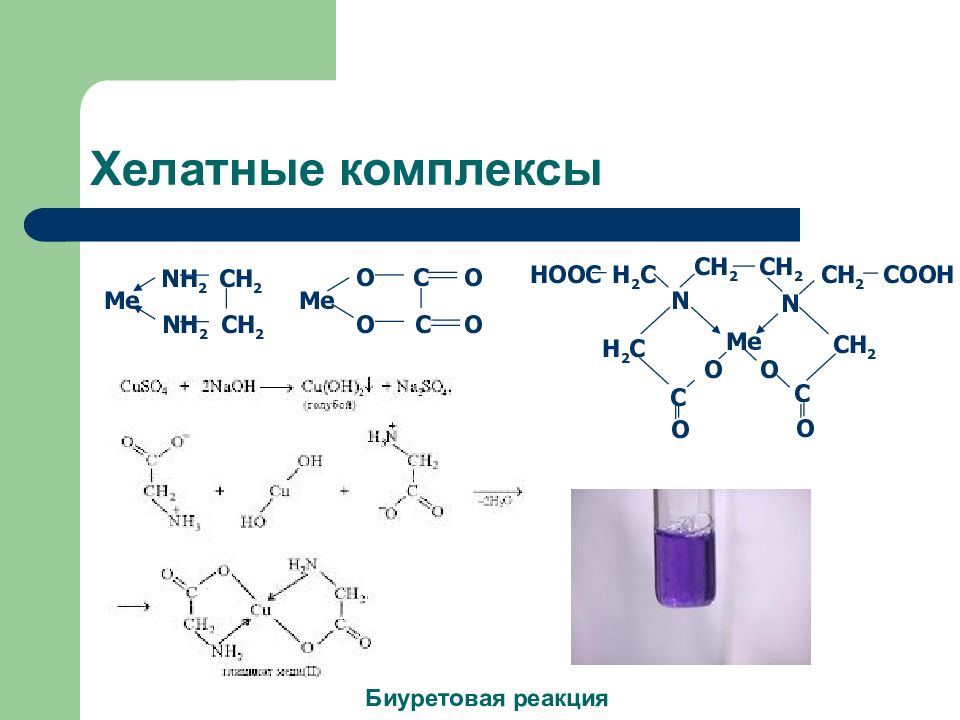
Слайд 9: Хелатные комплексы
Me O O O O C C Me NH 2 NH 2 CH 2 CH 2 C O CH 2 CH 2 N N H 2 C HOOC COOH CH 2 Me H 2 C CH 2 C O O O Биуретовая реакция
Слайд 10: Классификация комплексных соединений
Слайд 11: Номенклатура комплексных соединений
В названии комплексного соединения первым указывают отрицательно заряженную часть – анион, затем положительную часть – катион Название комплексной части начинают с указания состава внутренней сферы. Во внутренней сфере прежде всего называют лиганды – анионы, прибавляя к их латинскому названию окончание «о». Например: Cl − – хлоро, CN − – циано, SCN − – тиоцианато, NO 3 − – нитрато, SO 3 2− – сульфито, OH − – гидроксо и т. д. При этом пользуются терминами: для координированного аммиака – аммин, для воды – аква, для оксида углерода(II) – карбонил Число монодентатных лигандов указывают греческими числительными: 1 – моно (часто не приводится), 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Для полидентатных лигандов (например, этилендиамин, оксалат) используют бис-, трис-, тетракис- и т. д. Затем называют комплексообразователь, используя корень его латинского названия и окончание -ат, после чего римскими цифрами указывают (в скобках) степень окисления комплексообразователя После обозначения состава внутренней сферы называют внешнюю сферу В названии нейтральных комплексных частиц комплексообразователь указывается в именительном падеже, а степень его не указывается, так как она однозначно определяется, исходя из электронейтральности комплекса
Слайд 12: Номенклатура комплексных соединений: примеры
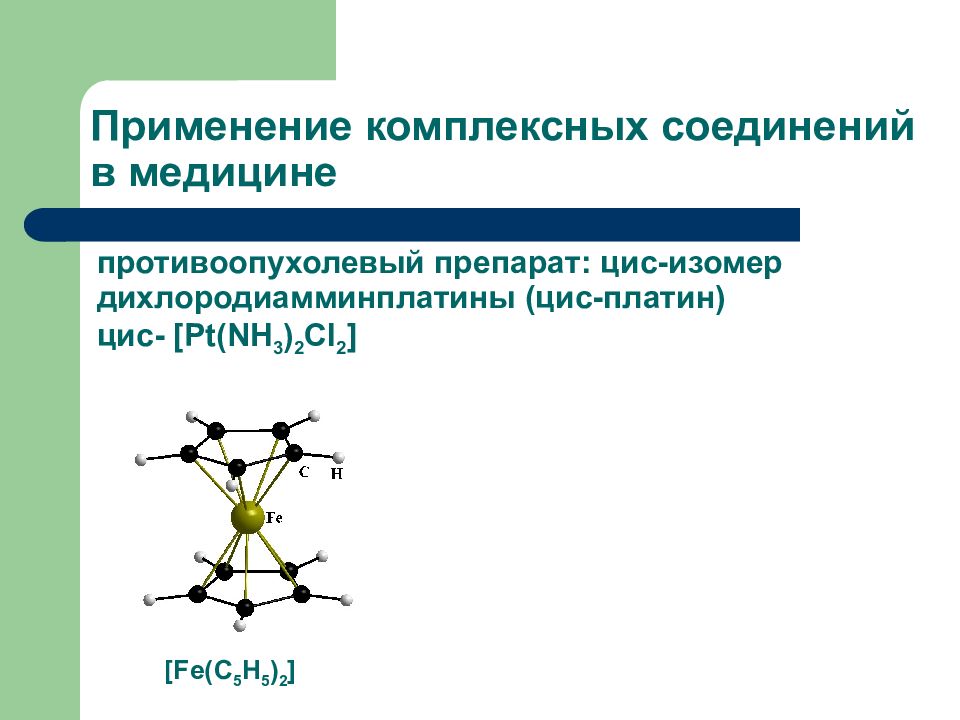
Номенклатура комплексных соединений [ Cu(NH 3 ) 4 ] SO 4 Сульфат тетраамминмеди ( II) Na 3 [ Co(NO 2 ) 6 ] Гексанитрокобальтат ( III) натрия [ Pt(NH 3 ) 2 Cl 2 ] Дихлородиамминплатина [Cr(H 2 O) 2 (NH 3 ) 3 Cl ] Br 2 Бромид хлородиакватриамминхрома ( III)
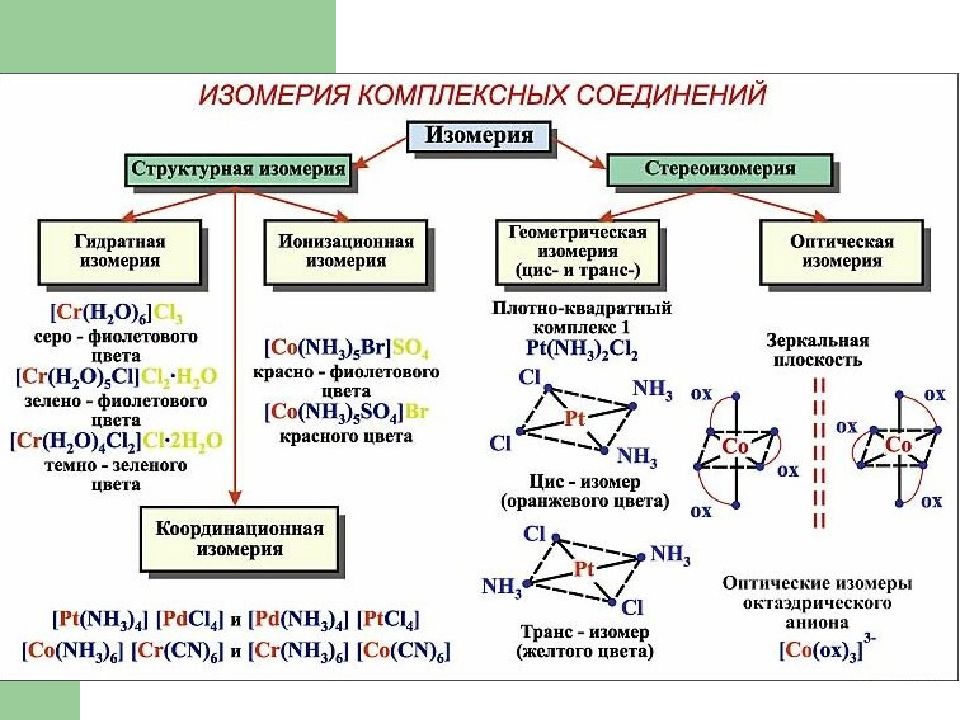
Слайд 13: Изомерия комплексных соединений
Изомерия – явление существования соединений, одинаковых по составу и мол. массе, но различающихся по строению и свойствам ( изомеров ) В случае компл ексных соед инений изомери я обусловлен а : различ ием в строении и координации лигандов различ ием в строении внутр енней коорд инационной сферы раз личным распред елением частиц между внутр енней и внеш ней сферой
Слайд 15: K 4 [Fe(CN) 6 ]
Ионная связь (диссоциация по типу сильного электролита ) Ковалентная (диссоциация по типу слабого электролита ) Диссоциация комплексных соединений K 4 [Fe(CN) 6 ] 4 K + + [Fe(CN) 6 ]³ – обусловлена разрывом ионной связи между внутренней и внешней сферами, практически необратима разрушаются ковалентные связи комплексообразователя с лигандами, процесс сложный и обратимый [Fe(CN) 6 ]³ – ↔ Fe 3+ + 6 CN – Вторичная диссоциация характеризуется константой равновесия, причем для каждой из стадий можно вычислить свою константу. Для количественной оценки устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию. Эту константу называют константой нестойкости комплекса β -1
Слайд 16: Константы устойчивости и нестойкости
M n+ +mL ↔ [ML m ] n+ Константа устойчивости Константа нестойкости Константы устойчивости и нестойкости относятся только к комплексному иону !
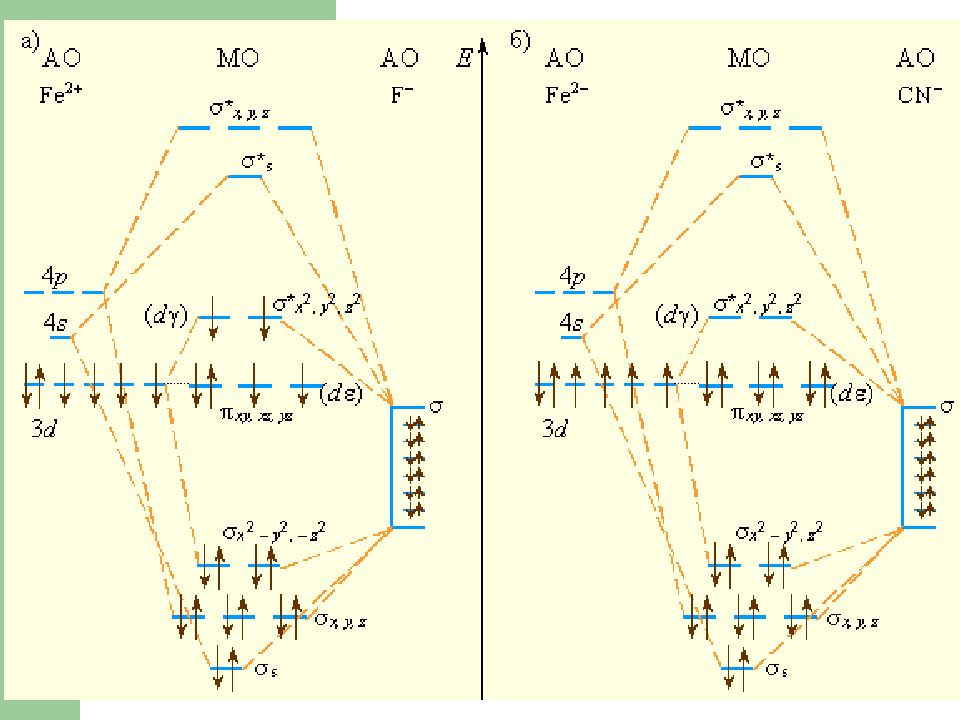
Слайд 17: Химическая связь в комплексных соединениях
Для объяснения строения комплексных соединений наиболее широко применяются теория валентных связей (метод валентных связей) теория кристаллического поля метод молекулярных орбиталей
Слайд 18: Основные положения метода валентных связей
Связь между комплексообразователем и лигандами донорно-акцепторная. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали. Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов. Дополнительное упрочение комплекса обусловлено тем, что наряду с σ -связями могут возникать и π -связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда. Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
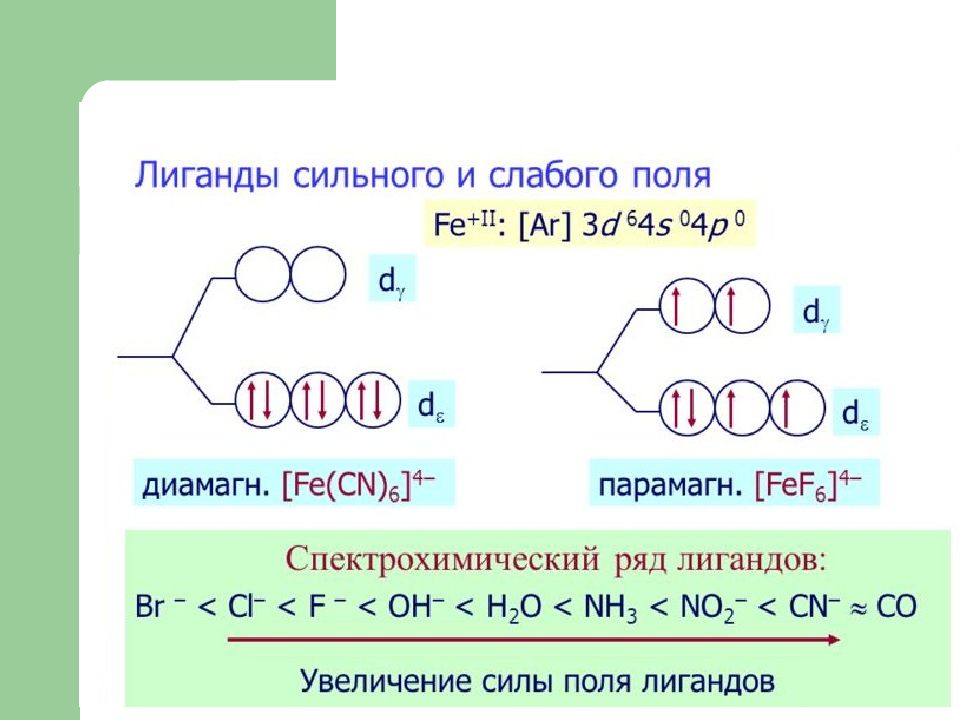
Слайд 19: Пример: [FeF 6 ] 4-
Fe 3d 6 4s 2 4s 4p Fe 2+ 3d 6 4s 0 3d 4d [FeF 6 ] 4- ●● ●● ●● ●● ●● ●● sp 3 d 2 - гибридизация Высокоспиновый комплекс
Слайд 20: Пример: [Fe(CN) 6 ] 4-
[Fe(CN) 6 ] 4- Fe 3d 6 4s 2 Fe 2+ 3d 6 4s 0 Fe 3d 6 4s 2 4s 4p 3d 4d ●● ●● ●● ●● ●● ●● d 2 sp 3 - гибридизация Низкоспиновый комплекс
Слайд 21: Теория кристаллического поля
Связь комплексообразователя (центр. атома) M с лигандами L считается чисто ионной Лиганды L – точечные заряды в вершинах правильных полиэдров, т.е. на максимальном расстоянии друг от друга Взаимодействие L между собой не рассматривается Детально рассматривается влияние электростатического пол я лигандов на M, а именно, на энергетические п одуровни центрального атома.
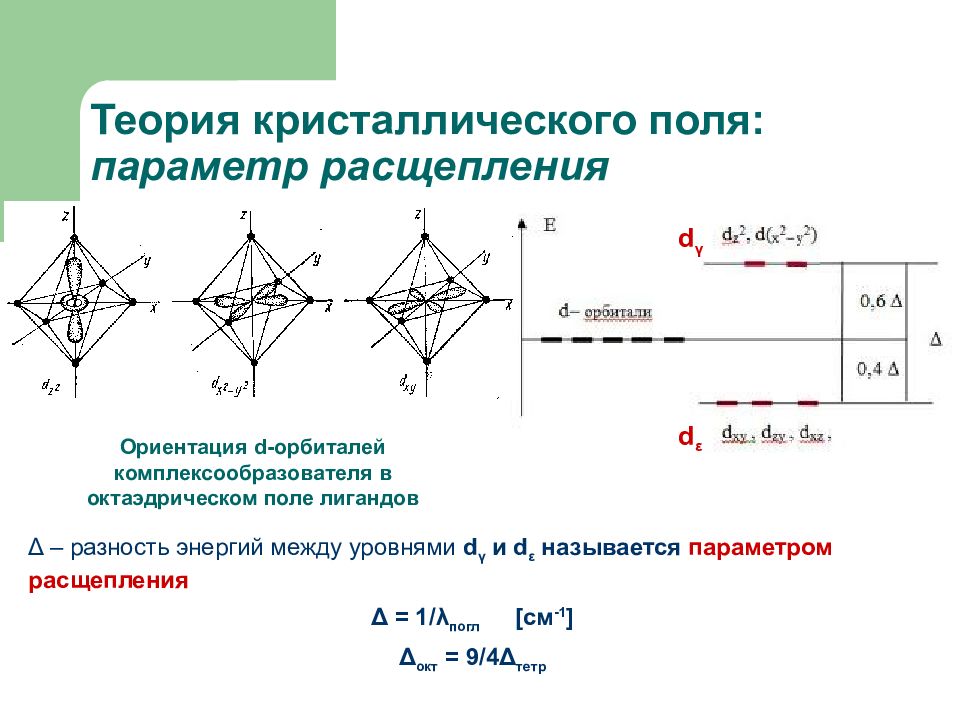
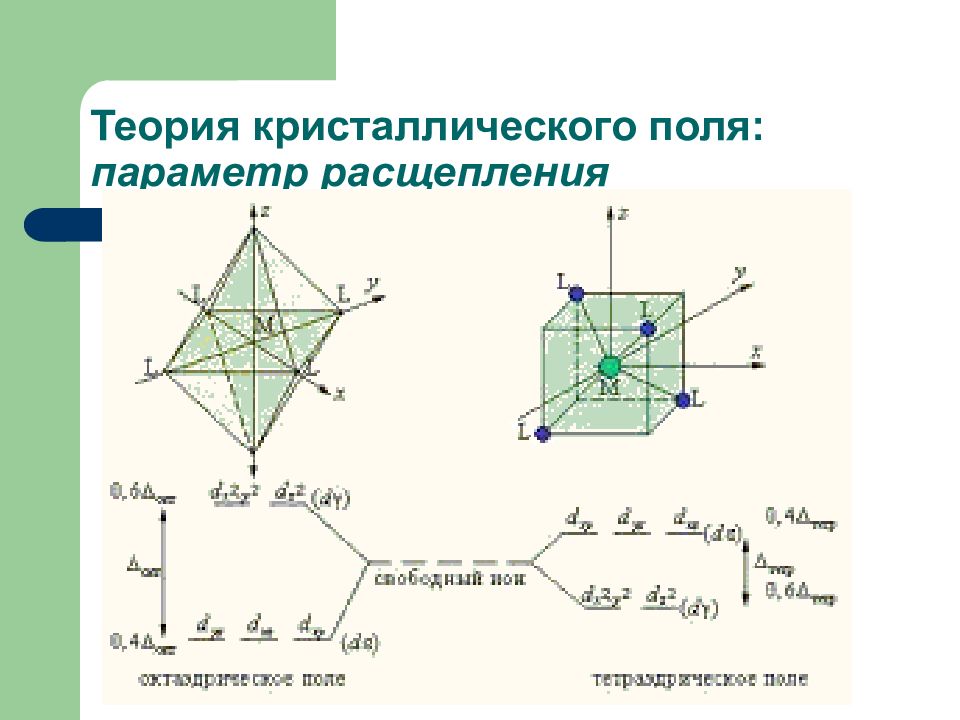
Слайд 22: Теория кристаллического поля: параметр расщепления
Ориентация d-орбиталей комплексообразователя в октаэдрическом поле лигандов d γ d ε Δ – разность энергий между уровнями d γ и d ε называется параметром расщепления Δ = 1/ λ погл [ см -1 ] Δ окт = 9/4 Δ тетр
Слайд 24
Δ зависит: Геометрии КС: Δ окт = 9/4 Δ тетр Размеров центрального атома Заряда центрального атома Природы лигандов
Слайд 25: Теория кристаллического поля: ЭСКП
Величина понижения энергии комплексного соединения в результате перераспределения d- электронов по d γ и d ε -орбиталям называется энергией стабилизации кристаллическим полем ( ЭСКП ) ЭСКП окт = (0,4 n – 0,6m) Δ окт ЭСКП тетр = (0,6 n – 0,4 m) Δ тетр n – число электронов на нижнем подуровне m – число электронов на верхнем подуровне
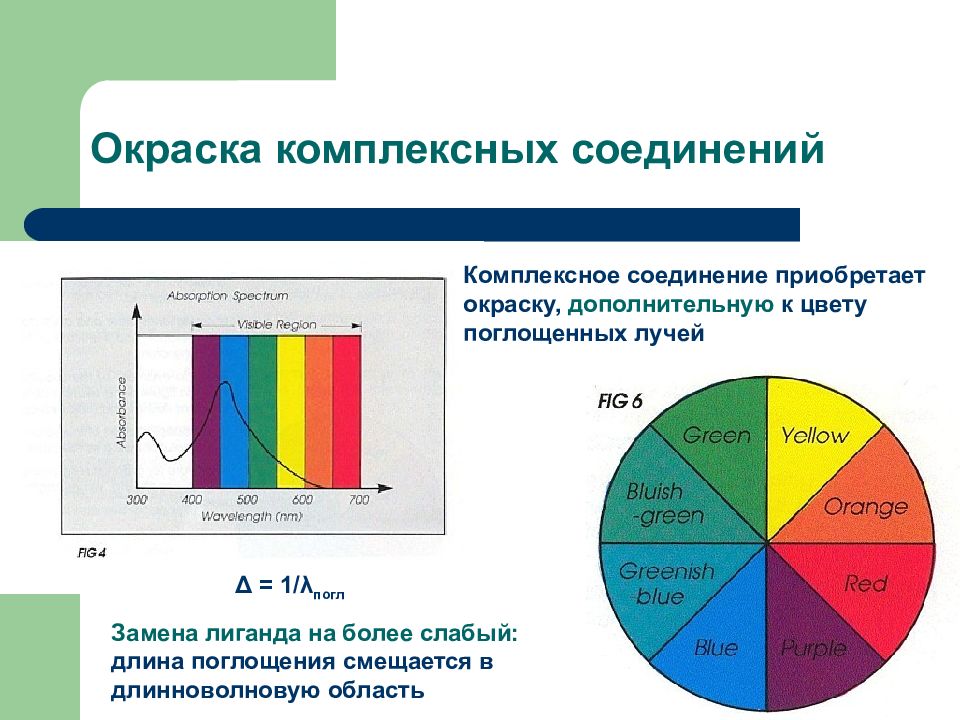
Слайд 27: Окраска комплексных соединений
Замена лиганда на более слабый: длина поглощения смещается в длинноволновую область Δ = 1/ λ погл Комплексное соединение приобретает окраску, дополнительную к цвету поглощенных лучей
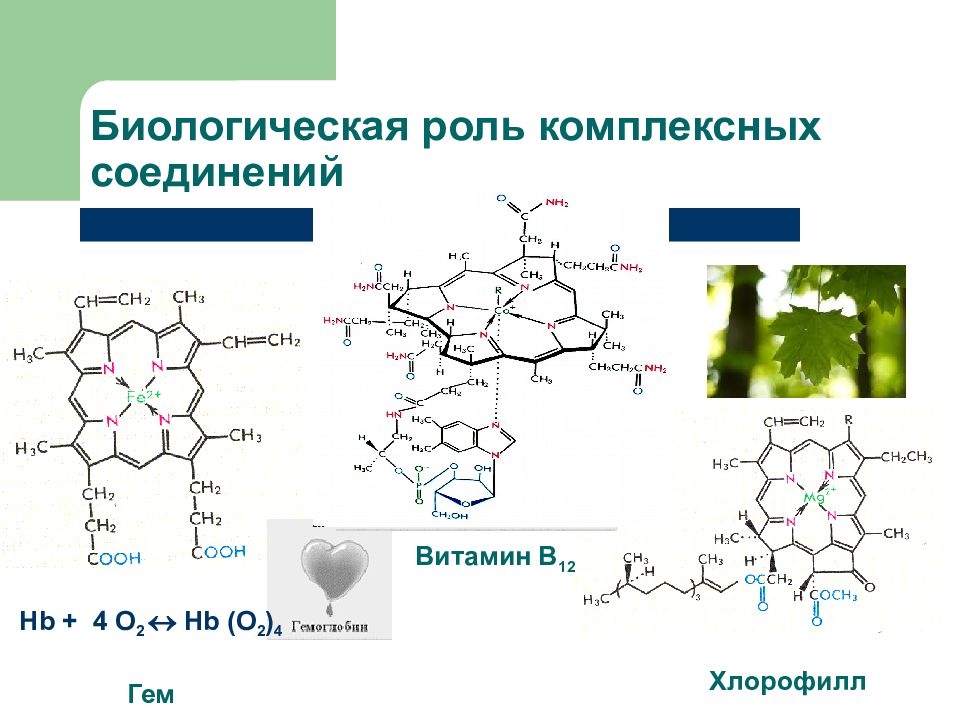
Слайд 29: Значение комплексных соединений
Гемоглобин, хлорофил, витамин В 12 Катализаторы (получение полимеров, переработка нефти) Устранение жесткости воды Производство кислот Аналитическая химия Получение Ме высокой степени очистки Медицина
Слайд 30: Биологическая роль комплексных соединений
Hb + 4 O 2 Hb (O 2 ) 4 Гем Витамин В 12 Хлорофилл










![КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ K 4 [Fe(CN) 6 ]](https://s1.showslide.ru/s_slide/fc4763584a635d67a4b8198ec1b7eca8/548c3984-a46a-49a8-8941-d8904e363b89.jpeg)



![КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ Пример: [FeF 6 ] 4-](https://s1.showslide.ru/s_slide/09c6013d2564837712ea7e4adbe10f67/35c96655-3cff-40f2-b583-b77b9d9a8e66.jpeg)
![КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ Пример: [Fe(CN) 6 ] 4-](https://s1.showslide.ru/s_slide/41000bb3eed889066cee7f57ae0a826e/f8e8ef74-41a5-4592-9d6c-856b42567e53.jpeg)