Слайд 2
Электролитическая диссоциация – процесс распада электролита на ионы при взаимодействии с водой. Вещества могут быть Электролитами Неэлектролитами Слабыми электролитами Екатерина Вайс
Слайд 3: Давайт е посмотрим эксперимент
Екатерина Вайс Давайт е посмотрим эксперимент
Слайд 4
Прибор для определения электропроводности растворов Неэлектролит Не проводит эл.ток Слабый электролит Слабо проводит эл.ток Сильный электролит Проводит эл.ток Угольные электроды, к клеммам которых присоединены провода, опускают в раствор вещества. Включают прибор в электрическую сеть. Два раствора: раствор сахара и раствор поваренной соли Екатерина Вайс
Слайд 5
Сванте Август Аррениус создал теорию электролитической диссоциации (ТЭД) Иван Алексеевич Каблуков дополнил ТЭД Владимир Александрович Кистяковский дополнил ТЭД Екатерина Вайс
Слайд 6
Электролиты – это вещество, раствор и расплав, проводящие электрический ток. Полностью распадаются на ионы. Растворимые соли, щелочи, кислоты Примеры: растворы NaOH, NaCl, MgCl Неэлектролиты – это вещество, раствор и расплав, не проводящие электрический ток. Не распадаются на ионы. Воздух, дистиллированная вода, спирт, глюкоза, сахароза и другие органические соединения. Слабые электролиты – это вещество, раствор и расплав, частично проводящие электрический ток. Слабые неорганические кислоты, гидрат аммония, органические кислоты Примеры: H N O 2, H 2 S, H 2 CO 3, NH 3 *H 2 O, CH 3 COOH в водных растворах Екатерина Вайс
Слайд 7
Электролитами могут быть только вещества с ионной и ковалентной полярной связью (соли, основания, кислоты) Причина диссоциации электролита в растворе – это его способность взаимодействовать с молекулами воды. Екатерина Вайс
Слайд 10: Механизм электролитической диссоциации
Екатерина Вайс Диполь – это два противоположно заряженных полюса. Гидратная оболочка иона – перешедшие в раствор ионы, связанные с молекулами воды. Гидратированные ионы – ионы, образующие гидратную оболочку.
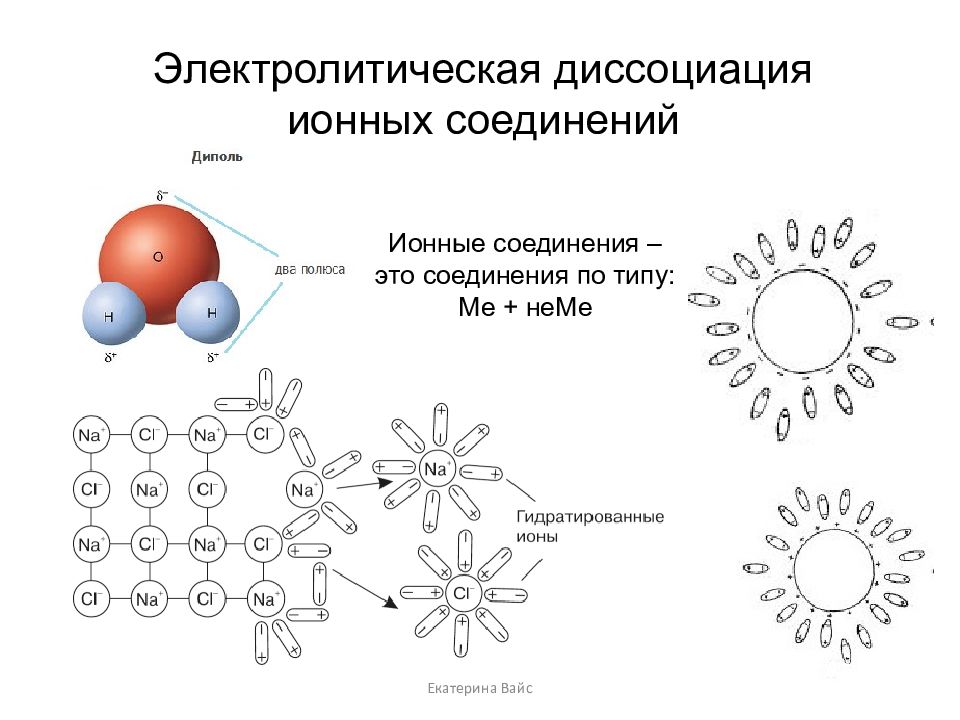
Слайд 11: Электролитическая диссоциация ионных соединений
Екатерина Вайс Электролитическая диссоциация ионных соединений Ионные соединения – это соединения по типу: Ме + неМе
Слайд 12: Механизм электролитической диссоциации ионных соединений
Екатерина Вайс
Слайд 13
Диссоциация электролитов с ионной кристаллической решеткой происходит в 3 стадии: Ориентация - молекулы ориентируются вокруг ионов кристалла, противоположными к ним полюсами. Гидратация (взаимодействие) - диполи воды взаимодействуют с ионами поверхностного слоя кристалла. Диссоциация (распад) – молекулы воды перемещаются в раствор вместе с гидратированными ионами. Екатерина Вайс
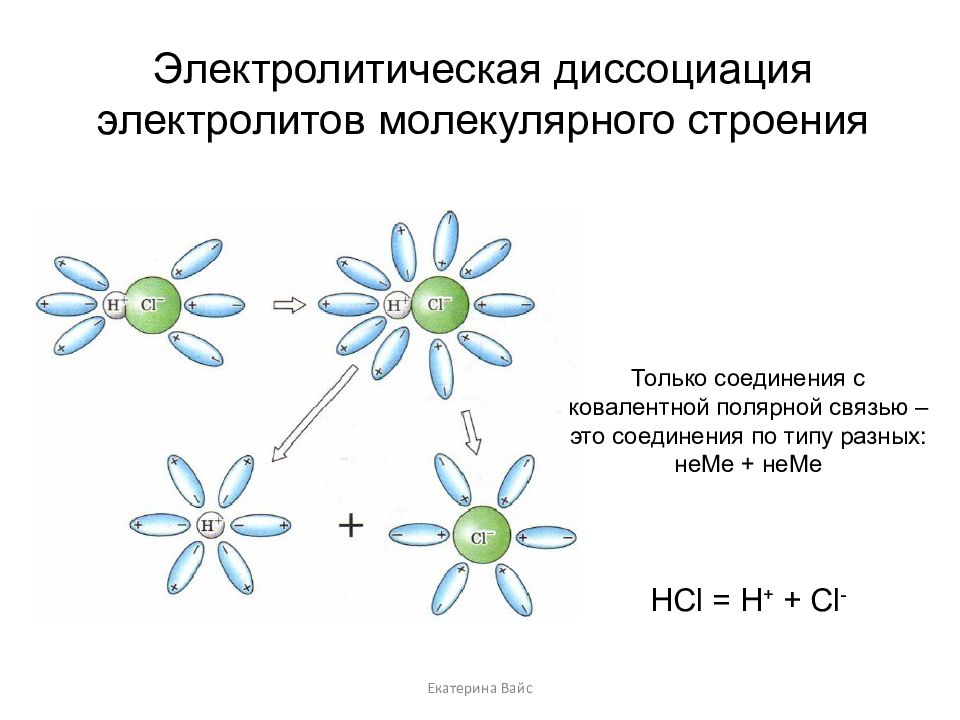
Слайд 14: Электролитическая диссоциация электролитов молекулярного строения
Екатерина Вайс Электролитическая диссоциация электролитов молекулярного строения Только соединения с ковалентной полярной связью – это соединения по типу разных: неМе + неМе HCl = H + + Cl -
Слайд 15: Механизм диссоциации электролитов молекулярного строения
Екатерина Вайс
Слайд 16
Диссоциация электролитов молекулярного строения происходит в 4 стадии: Ориентация - молекулы ориентируются вокруг ионов кристалла, противоположными к ним полюсами. Гидратация (взаимодействие) - диполи воды взаимодействуют с ионами поверхностного слоя кристалла. Ионизация – превращение ковалентной полярной связи в ионную. Диссоциация (распад) – молекулы воды перемещаются в раствор вместе с гидратированными ионами. Екатерина Вайс
Слайд 17: Давайт е посмотрим видео про механизмы ЭД по типу строения соединений
Екатерина Вайс Давайт е посмотрим видео про механизмы ЭД по типу строения соединений
Слайд 18
Степень электролитической диссоциации В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации ( α ). α = N д /N р N д – количество распавшегося вещества электролита N р – общее количество растворенного вещества Обозначение α [%] или единицы Сильные электролиты ( α → 1) необратимая реакция Слабые электролиты ( α → 0) обратимая реакция Екатерина Вайс
Слайд 19
Темы докладов Подготовьте доклад о жизни и творчестве С.Аррениуса Подготовьте доклад на тему “ Вклад русских химиков в теорию электролитической диссоциации ” Время доклада: не более 5 минут Екатерина Вайс