Первый слайд презентации: Воронежская государственная медицинская академия им. Н.Н.Бурденко кафедра Химии Зав. кафедрой д.х.н., профессор Пономарева Наталия Ивановна
Дисциплина: Химия Лектор: к.х.н., доцент Рябинина Елена Ивановна
Слайд 2: Простые правила
Слайд 3: Лекция 1. РАСТВОРЫ
Якоб Хендрик Вант-Гофф 1852-1911 Сванте Август Аррениус 1859-1927 Фридрих Вильгельм Оствальд 1853-1932 Рихард Адольф Зигмонди 1865-1929
Слайд 4
Раствор - гомогенная (однородная) система переменного состава, состоящая из двух и более компонентов. Компоненты раствора Растворитель Растворенное вещество Компонент, агрегатное состояние которого не изменяется при образовании раствора, а при одинаковом агрегатном состоянии компонентов находится в избытке. вещество, равномерно распределенное в растворителе в виде молекул или ионов
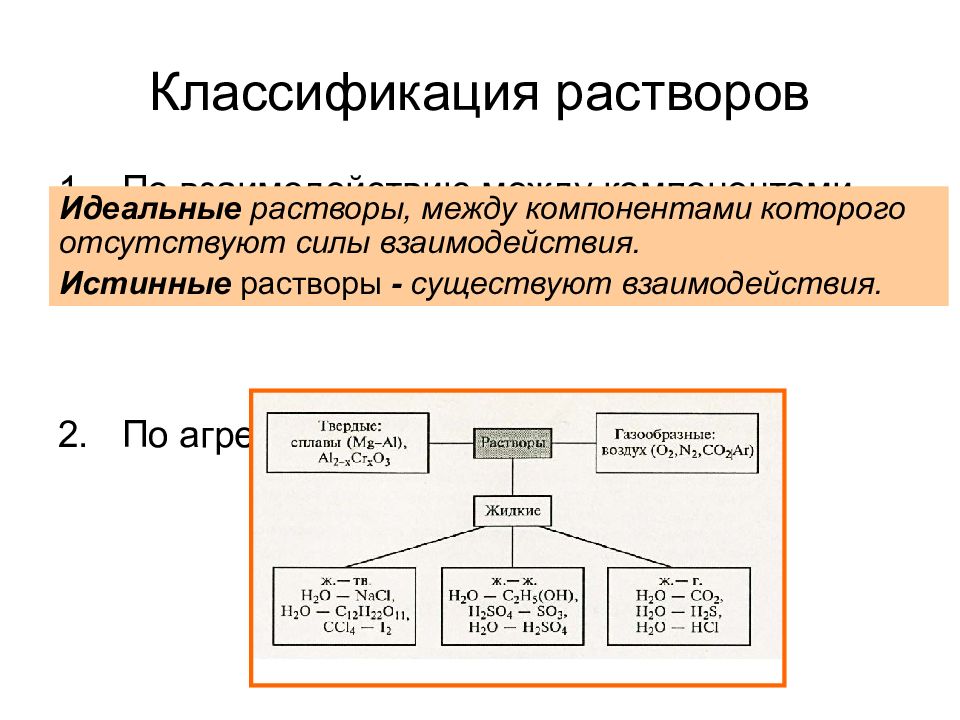
Слайд 5: Классификация растворов
По взаимодействию между компонентами раствора (идеальные и истинные (реальные)) По агрегатному состоянию Идеальные растворы, между компонентами которого отсутствуют силы взаимодействия. Истинные растворы - существуют взаимодействия.
Слайд 6
3. По размеру частиц растворенного вещества : истинные растворы – однородные (гомогенные) системы с размером частиц 10 -10 – 10 -9 м растворы электролитов (ионные) растворы неэлектролитов (молекулярные) коллоидные растворы – неоднородные (гетерогенные) системы с размером частиц 10 -9 – 10 -6 м (мицеллярные). 4. По типу растворителя: водные растворы (растворитель – вода) и неводные растворы (растворители – спирт, эфир, бензол, толуол и т.д.).
Слайд 7
концентрированные (с большим содержанием растворенного вещества) и разбавленные (с небольшим содержанием). 5. По количеству растворенного вещества: насыщенные (в которых данное вещество при данной температуре больше не растворяется, т.е. такой раствор находится в равновесии с растворяемым веществом), ненасыщенные и пересыщенные. 6. По состоянию равновесия:
Слайд 8: Подробнее о способах выражения состава растворов и связи между ними вы познакомитесь на лабораторных занятиях
Способы выражения состава растворов
Слайд 9
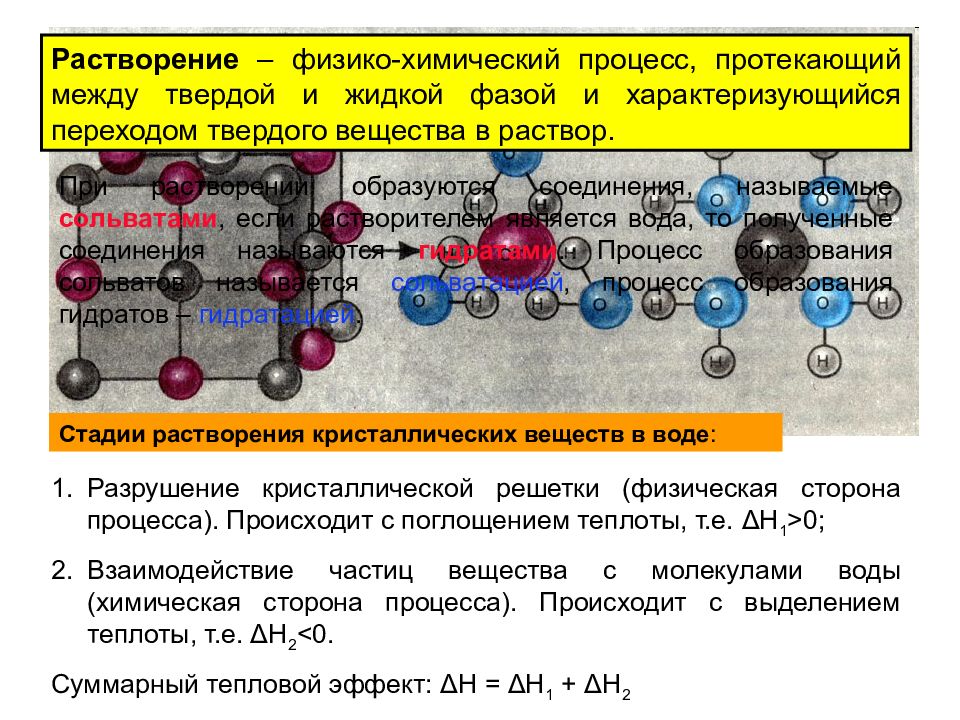
Растворение – физико-химический процесс, протекающий между твердой и жидкой фазой и характеризующийся переходом твердого вещества в раствор. При растворении образуются соединения, называемые сольватами, если растворителем является вода, то полученные соединения называются гидратами. Процесс образования сольватов называется сольватацией, процесс образования гидратов – гидратацией. Стадии растворения кристаллических веществ в воде : Разрушение кристаллической решетки (физическая сторона процесса). Происходит с поглощением теплоты, т.е. Δ Н 1 > 0; Взаимодействие частиц вещества с молекулами воды (химическая сторона процесса). Происходит с выделением теплоты, т.е. Δ Н 2 < 0. Суммарный тепловой эффект: Δ Н = Δ Н 1 + Δ Н 2
Слайд 10
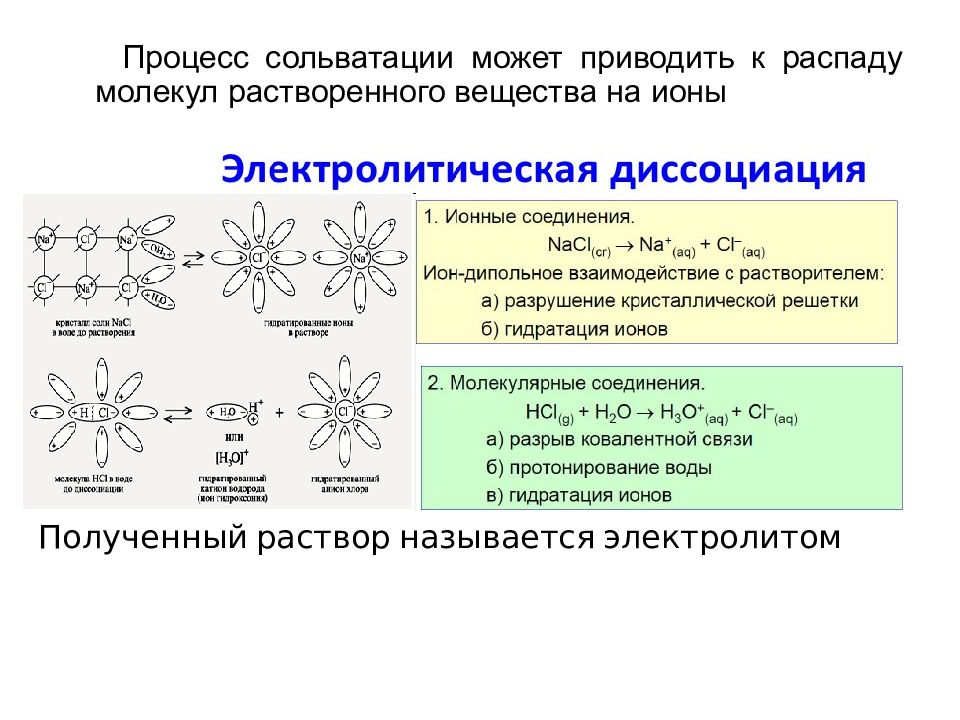
Процесс сольватации может приводить к распаду молекул растворенного вещества на ионы Полученный раствор называется электролитом
Слайд 12: Основные характеристики электролитов
Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации. Степень диссоциации (α – греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N): Основные характеристики электролитов
Слайд 13
Степень диссоциации зависит от: - природы электролита и растворителя : чем полярнее химическая связь в молекуле электролита и растворителя, тем выше значение α. - концентрации электролита : с уменьшением концентрации электролита (разбавление), α увеличивается. - температуры : α возрастает при повышении температуры
Слайд 14: Константа диссоциации
Электролитическая диссоциация слабых электролитов, согласно теории Аррениуса, является обратимой реакцией, например: KA ↔ K + + A − Константу равновесия такой реакции можно выразить уравнением: Константу равновесия применительно к реакции диссоциации называют константой диссоциации (К д ). . На практике для характеристики слабого электролита часто используют показатель константы диссоциации (рК): рК = - lg К д. Чем больше рК, тем слабее электролит.
Слайд 15: Связь константы диссоциации и степени диссоциации (закон разведения Оствальда)
Для очень слабых электролитов при α << 1 это уравнение упрощается :
Слайд 16: Особенности растворов сильных электролитов
Вследствие полной диссоциации число ионов в растворе сильных электролитов больше, чем в растворе слабых той же концентрации. При увеличении концентрации число ионов в растворе увеличивается, сила взаимодействия их между собой и с растворителем возрастает, что приводит к снижению подвижности ионов и создает эффект уменьшения их концентрации. Количественно влияние межионного взаимодействия характеризуют: Активность иона (а) – эффективная концентрация иона; Коэффициент активности ( γ ) мера отклонения активности иона от его истинной концентрации.
Слайд 17
В разбавленных растворах γ = 1, тогда а = С. Коэффициент активности иона ( γ ) зависит от температуры; общей концентрации всех ионов в растворе (Г.Льюис ввел понятие ионной силы раствора)
Слайд 18
Ионная сила раствора ( I) - величина, характеризующая силу электростатического взаимодействия ионов в растворе, которая равна полусумме произведений молярных концентраций всех ионов на квадрат их заряда: I = ½ C i z i 2 Ионная сила плазмы равна 0,167; все кровезаменители готовят с I равной плазме.
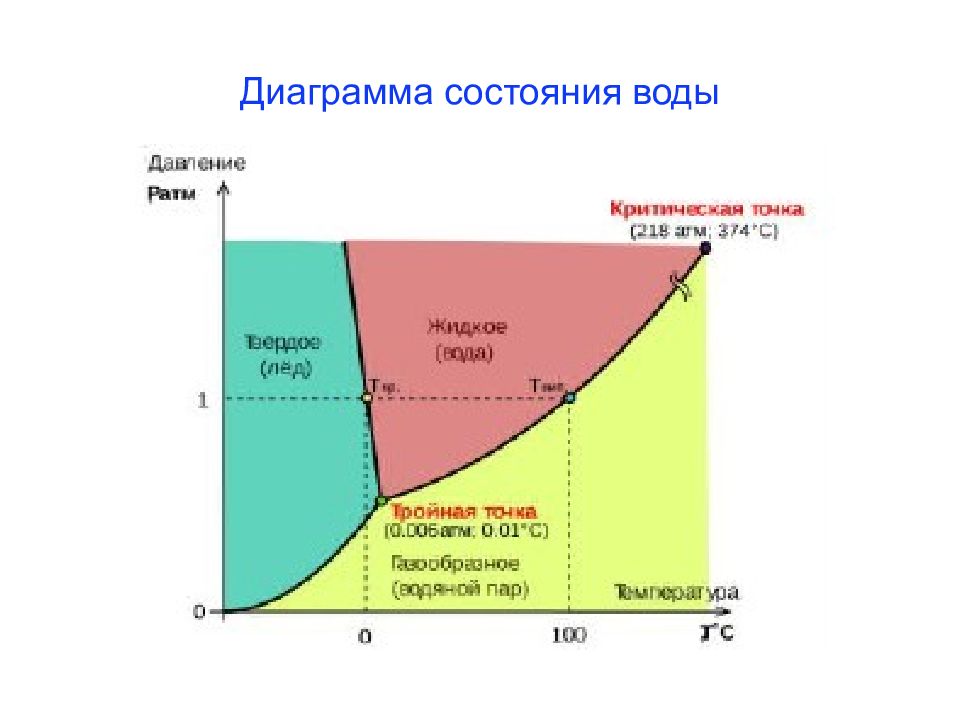
Слайд 20: Давление насыщенного пара (ДНП) над раствором
Франсуа Мари Рауль Н 2 О раствор p 0 > p Х(Н 2 О) = 1 Х(Н 2 О) + Х(в-ва) = 1 Закон Рауля: давление пара растворителя над раствором (р) прямо пропорционально давлению пара над чистым растворителем ( p 0 ) и его мольную долю : р = р 0 · Х(Н 2 О)
Слайд 21
Вторая формулировка закона Рауля : относительное понижение давления насыщенного пара растворителя ( p 0 ) над раствором ( p ) нелетучего неэлектролита пропорционально мольной доле (Х) растворенного вещества :
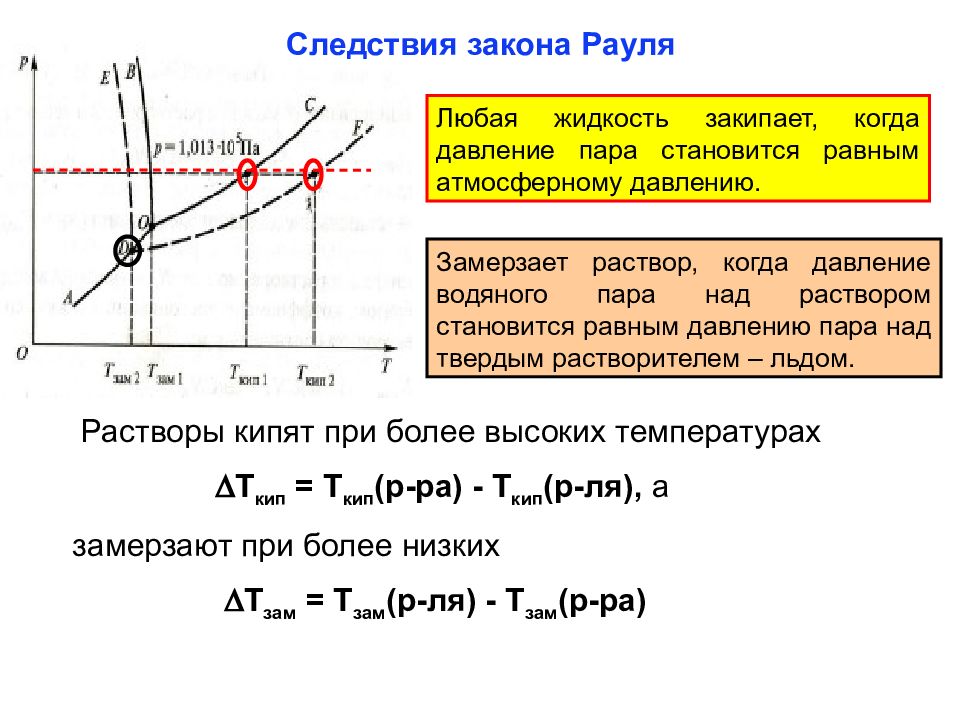
Слайд 23: Следствия закона Рауля
Любая жидкость закипает, когда давление пара становится равным атмосферному давлению. Замерзает раствор, когда давление водяного пара над раствором становится равным давлению пара над твердым растворителем – льдом. Растворы кипят при более высоких температурах Т кип = Т кип (р-ра) - Т кип (р-ля), а замерзают при более низких Т зам = Т зам (р-ля) - Т зам (р-ра)
Слайд 24
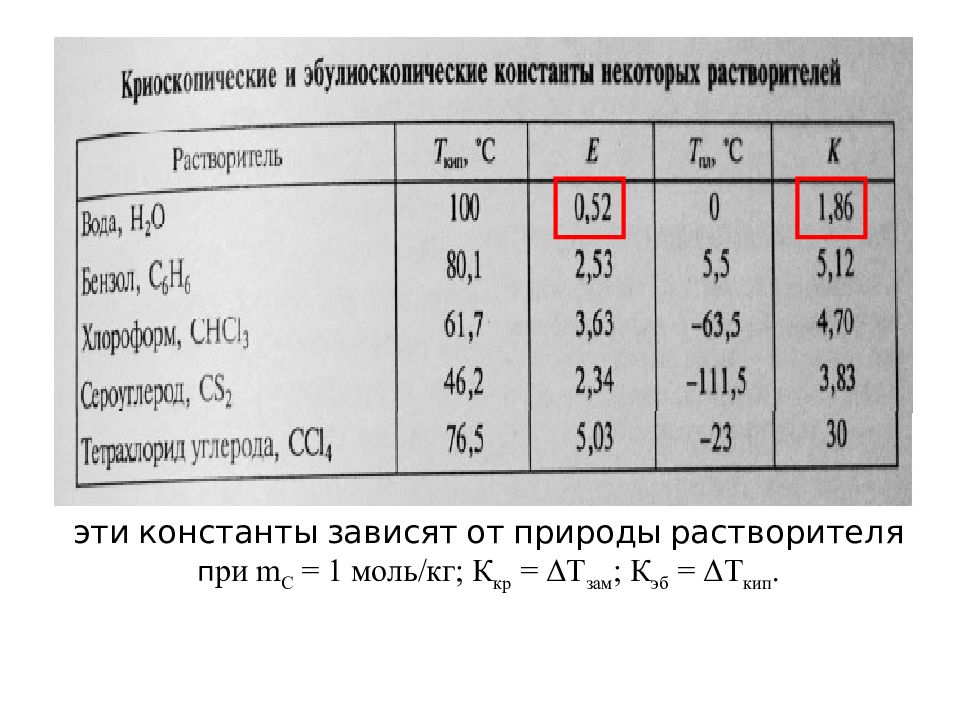
Понижение температуры замерзания и повышение температуры кипения прямопропорционально моляльной концентрации раствора: Т = К • m с, где Δ Т – понижение температуры замерзания и повышения температуры кипения раствора; К – криоскопическая или эбулиоскопическая константа растворителя, m с - моляльная концентрация раствора (моль/кг).
Слайд 25: эти константы зависят от природы растворителя п ри m C = 1 моль/кг; К кр = ΔТ зам ; К эб = ΔТ кип
Слайд 26
В растворах электролитов число частиц больше из-за диссоциации. Вант-Гофф дал поправочный изотонический коэффициент i, который учитывает диссоциацию электролитов. i = 1+ α (n – 1) / \ степень число частиц диссоциации из 1 молекулы Изменение температуры кипения и замерзания для растворов электролитов рассчитывается с учетом изотонического коэффициента ( i ) по уравнениям: Т кип = i · К эб · m с Т зам = i · К кр · m с
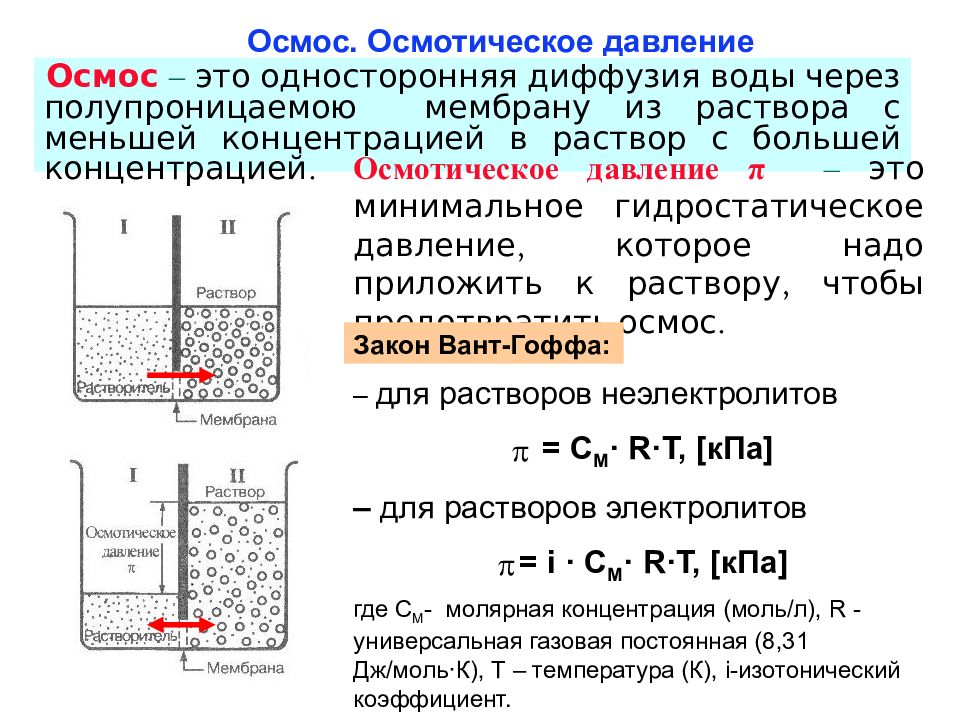
Слайд 27: Осмос. Осмотическое давление
Осмос – это односторонняя диффузия воды через полупроницаемою мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией. Осмотическое давление π – это минимальное гидростатическое давление, которое надо приложить к раствору, чтобы предотвратить осмос. – для растворов неэлектролитов = С М · R · T, [ кПа ] – для растворов электролитов = i · С М · R · T, [ кПа ] где С М - молярная концентрация (моль/л), R - универсальная газовая постоянная (8,31 Дж/моль · К), T – температура (К), i -изотонический коэффициент. Закон Вант-Гоффа:
Слайд 28
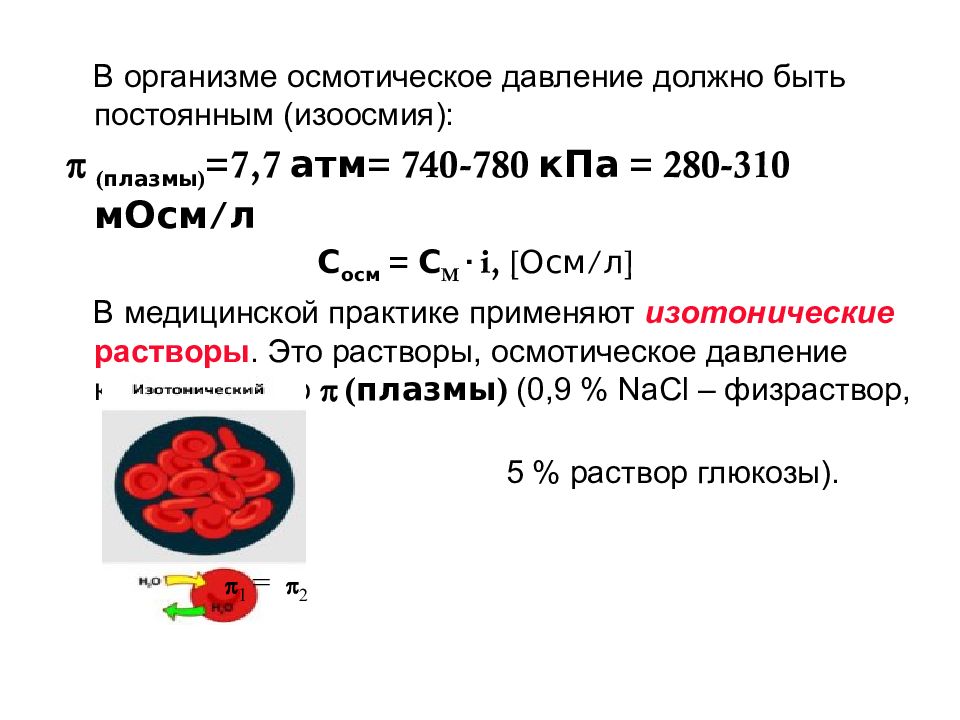
В организме осмотическое давление должно быть постоянным (изоосмия): (плазмы) =7,7 атм= 740-780 кПа = 280-310 мОсм/л С осм = С M · i, [ Осм/л ] В медицинской практике применяют изотонические растворы. Это растворы, осмотическое давление которых равно (плазмы) (0,9 % NaCl – физраствор, 5 % раствор глюкозы). 1 = 2
Слайд 29
Растворы, у которых больше, чем у (плазмы), называются гипертоническими. В медицине они применяются для очистки ран от гноя (10 % NaCl ), для удаления аллергических оттенков (10 % CaCl 2, 20 % – глюкоза), в качестве слабительных лекарств ( Na 2 SO 4 ∙10H 2 O, MgSO 4 ∙7H 2 O ). Экзоосмос (движение воды из клетки в плазму) приводит к сморщиванию оболочки клетки вызывая плазмолиз 1 < 2
Слайд 30
Растворы, у которых меньше, чем у (плазмы), называются гипотоническими. В медицине они практически не применяются. Эндоосмос (движение воды в клетку из плазмы) приводит к набуханию оболочки клетки с появлением напряженного состояния – тургора. Однако при большой разнице концентраций происходит разрушение клеточной мембраны и лизис клетки, что является причиной гемолиза. 1 < 2
Слайд 31: Значение осмоса
упругость, тургор клеток эластичность тканей, форма органов усвоение пищи, образование лимфы, мочи, кала действие лекарств За счет осмоса вода в организме распределяется между кровью, тканями, клетками.
Слайд 32: Методы, основанные на изучении коллигативных свойств растворов
осмометрия – измерение π, криоскопия – измерение Δ Т зам (р-ра), эбулиоскопия – измерение Δ Т кип (р-ра).
Слайд 33
Применяются для определения : молекулярных масс различных веществ, чаще всего биополимеров (белков); суммарной концентрации всех растворенных частиц; изотонического коэффициента, степени и константы диссоциации.
Слайд 34
Криоскопическому методу исследования отдается предпочтение, поскольку температуру замерзания можно измерить с большой точностью и при низких температурах не происходит изменений в структуре растворенных веществ и растворителя. При выборе растворителя предпочтение следует отдавать растворителю с большей криоскопической константой.