Первый слайд презентации: Лекция №7
Теория электролитической диссоциации. Свойства разбавленных растворов электролитов Лекция №7
Слайд 2
↑ План лекции. Отклонение поведения растворов электролитов от неэлектролитов. Теория электролитической диссоциации (ТЭД) Аррениуса. 3. Кислоты, основания, щелочи с точки зрения ТЭД Степень диссоциации электролитов 5. Способы выражения концентраций растворов. 6. Ионные реакции.
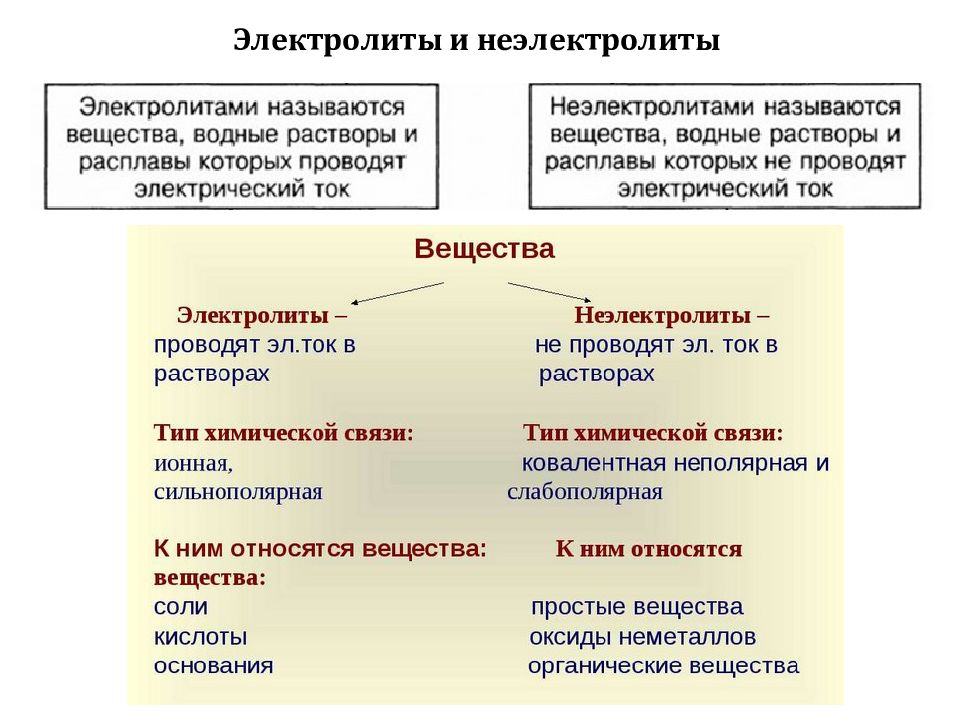
Слайд 3: Электролиты и неэлектролиты
i - изотонический коэффициент показывает меру отклонения поведения растворов электролитов от неэлектролитов. ( i эл. >1). Закон Вант-Гоффа для растворов электролитов: Росм. эл. = i См RT i - изотонический коэффициент См – молярная концентрация, моль / л, R - универсальная газовая постоянная 8,31 Дж / моль · К, Т – температура, К.
Слайд 5
Законы Рауля для растворов электролитов: Δ t кип. эл. = i ЕС m Δ t зам. эл. = i КС m С m - моляльная концентрация, моль / кг р-ля Е - эбуллиоскопическая постоянная, К - криоскопическая постоянная i - изотонический коэффициент
Слайд 6
2. Теория электролитической диссоциации Аррениуса (ТЭД) 1. Молекулы электролитов при растворении или плавлении распадаются на ионы. 2. При пропускании электрического тока через раствор или расплав электролита положительные ионы движутся к катоду (это катионы), а отрицательные – к аноду (это анионы). 3. Диссоциация – процесс обратимый.
Слайд 7: 3. Кислоты, основания, щелочи с точки зрения ТЭД
Кислоты - это электролиты, которые при диссоциации в качестве катионов образуют только ионы : Основания - это электролиты, которые при диссоциации в качестве анионов, образуют гидроксид-ионы : Соли – это электролиты, которые при диссоциации образуют катионы метало и анионы кислотных остатков:
Слайд 8: 4. Степень диссоциации электролитов
Степень диссоциации ( α ) равна отношению продиссоциированных молекул вещества n к общему числу его молекул N. Выражается в долях или процентах.
При растворении электролита он диссоциирует на ионы и число частиц в растворе электролита больше, чем в растворе неэлектролита. Степень диссоциации электролита зависит от числа ионов, образующихся при диссоциации 1 молекулы его и от изотонического коэффициента:
Слайд 10: Факторы, влияющие на степень диссоциации электролита
1. Природа растворителя 2. Природа растворенного вещества 3. Температура ( t) 4. Концентрация раствора (С) 5. Наличие одноименных ионов
Слайд 11: 5. Способы выражения концентрации растворов
1. Массовая доля, С, % - показывает сколько граммов растворенного вещества содержится в 100 г раствора 2. Молярная концентрация,,М, моль / л – показывает сколько моль растворенного в-ва содержится в 1 л раствора
Слайд 12
3. Моляльная концентрация,, моль / кг растворителя. - показывает сколько моль растворенного вещества содержится в 1 кг растворителя 4. Нормальная концентрация,, экв / л – показывает сколько эквивалентов растворенного вещества содержится в 1 литре раствора
Слайд 13
5. Титр, Т, г / мл – показывает сколько граммов растворенного вещества содержится в 1 мл раствора 6. Мольная доля, N, показывает отношение количества растворенного вещества к количеству всех компонентов раствора