Слайд 2: Санитарная микробиология
Санитарная микробиология Эта отрасль медицинской науки сформировалась на стыке микробиологии, гигиены и эпидемиологии в ответ на потребность в точных данных для научного обоснования санитарно-гигиенических и противоэпидемических мероприятий. Санитарная микробиология - наука, которая изучает микрофлору (микробиоту) окружающей среды и её вредное влияние на организм человека.
Слайд 3: Санитарная микробиология
Задачи санитарной микробиологии 1. Гигиеническая и эпидемиологическая оценка объектов внешней среды по микробиологическим показателям. 2. Разработка нормативов, определяющих соответствие микрофлоры исследуемых объектов гигиеническим требованиям.
Слайд 4: Задачи санитарной микробиологии
3. Разработка и экспертиза методов микробиологических и вирусологических исследований разнообразных объектов внешней среды с целью оценки их санитарно-гигиенического состояния. 4. Разработка рекомендаций по оздоровлению объектов внешней среды путём воздействия на их микрофлору и оценка эффективности проводимых мероприятий. 5. Изучение закономерностей жизнедеятельности микрофлоры окружающей среды как в самой экосистеме, так и во взаимоотношениях с человеком.
Слайд 5: Объекты санитарно-микробиологического исследования
Объектами санитарно-микробиологического исследования служат: вода, воздух, почва, объекты окружающей среды, пищевые продукты, лекарственные средства оборудование и др.
Слайд 6: Объекты санитарно-микробиологического исследования
Биологические загрязнения : загрязнения патогенными и условно-патогенными микроорганизмами, цианобактериями, микроорганизмами, предназначенными для борьбы с насекомыми, микроорганизмами-продуцентами токсических веществ; загрязнения различными веществами — антибиотиками, белками, ферментами, витаминами.
Слайд 7: Объекты санитарно-микробиологического исследования
По размеру наносимого ущерба к наиболее значимым биологическим загрязнителям относят: хозяйственно-бытовые и сточные воды; отходы животноводческих комплексов; отходы промышленных предприятий по производству антибиотиков, вакцин, сывороток, белков, витаминов, ферментов и т.п.; сине-зёленые водоросли, массово развивающиеся в открытых водоёмах.
Слайд 8: Объекты санитарно-микробиологического исследования
Для каждого вида загрязнения должны быть определены предельные допустимые концентрации ( ПДК ), которые: не влияют отрицательно на процессы самоочищения внешней среды; не подавляют развитие санитарно-показательных микроорганизмов (СПМО) и не усиливают их патогенных свойств; не удлиняют сроков выживания микроорганизмов; не способствуют ухудшению здоровья людей.
Слайд 9: Методы санитарно-микробиологического исследования
Санитарная микробиология располагает двумя методами, с помощью которых можно определить санитарно-эпидемиологическое состояние внешней среды. 1. Прямое обнаружение патогенных микроорганизмов во внешней среде. 2. Косвенная индикация возможного их присутствия во внешней среде.
Слайд 10: Методы санитарно-микробиологического исследования
Прямой метод более надёжный, но трудоёмкий и недостаточно чувствительный. Трудности выделения патогенных микроорганизмов из внешней среды обусловлены их незначительной концентрацией, неравномерностью распределения, конкуренцией между патогенными микроорганизмами и сапрофитной микрофлорой. Огромное значение имеет изменчивость возбудителя во внешней среде. Необходимо вести исследования в широком диапазоне, в том числе и по обнаружению условно-патогенных микроорганизмов, так как выделение одного вида возбудителя не свидетельствует об отсутствии других. Прямое выделение патогенных микроорганизмов проводят только по эпидемиологическим показаниям. Косвенный метод более прост и доступен. Этот метод располагает двумя показателями-критериями, которые позволяют определить санитарно-эпидемиологическую ситуацию. К ним относят общее микробное число и концентрацию СПМО.
Слайд 11: Критерий общего микробного числа
Общее микробное число ( ОМЧ ) — число всех микроорганизмов в 1 мл или в 1 г субстрата. При этом исходят из предположения, что чем больше микроорганизмов обнаружено во внешней среде, тем вероятнее загрязнение патогенными микроорганизмами. В связи с этим ОМЧ даёт представление об эпидемиологической обстановке.
Слайд 12: Методы определения ОМЧ
Существуют три метода определения ОМЧ. 1. Оптический метод прямого подсчёта бактерий под микроскопом в камере Горяева. 2. Бактериологический метод (менее точный). 3. Измерение биомассы.
Слайд 13: Критерий ОМЧ
Критерий ОМЧ имеет большое значение при проведении сравнительных исследований. В этих случаях внезапное повышение ОМЧ указывает на микробную обсеменённость объекта (кухонного инвентаря в столовой). ОМЧ определяют в следующих случаях : контроль качества очистки воды (в том числе колодезной); проверка эффективности мойки посуды; контроль чистоты воздуха в закрытых помещениях; определение свежести скоропортящихся продуктов; выбор места для строительства жилых объектов (исследование почвы); определение характера микрофлоры.
Слайд 14: Санитарно-показательные микроорганизмы
СПМО - микроорганизмы, которые постоянно обитают в естественных полостях тела человека (животных) и постоянно выделяются во внешнюю среду. Требования к СПМО 1. Постоянное обитание в естественных полостях человека и животных и постоянное выделение во внешнюю среду. 2. Отсутствие размножения во внешней среде. 3. длительность выживания и устойчивость во внешней среде не меньше или даже выше, чем у патогенных микроорганизмов. 4. Отсутствие «двойников», с которыми СПМО можно перепутать. 5. Относительно низкая изменчивость во внешней среде. 6. Наличие простых в исполнении и вместе с тем надёжных методов индикации.
Слайд 15: Санитарно-показательные микроорганизмы
Чем выше концентрация СПМО, тем больше вероятность присутствия патогенных микроорганизмов. Их количество выражают в титрах и индексах. Титр - минимальное количество субстрата (в кубических санти метрах или граммах), в котором ещё обнаруживают СПМО. Индекс - количество СПМО, которое содержится в 1 л воды или в 1 см другого субстрата. Наиболее вероятное число ( НВЧ ) - количество СПМО в 1 л воды или в 1 г (см 3 ) другого субстрата. Это более точный показатель, так как он имеет доверительные границы, в пределах которых может колебаться с вероятностью 95%.
Слайд 16: Характеристика СПМО
Группировка санитарно-показательных микроорганизмов 1-я группа (индикаторы фекального загрязнения — представители микрофлоры кишечника человека и животных): бактерии группы кишечных палочек (БГКП); энтерококки; протей; сульфитредуцирующие клостридии; термофилы, кишечные бактериофаги, сальмонеллы; бактероиды, бифидо- и лактобактерии; - синегнойная палочка; грибы рода Candida ; ацинетобактер.
Слайд 17: Характеристика СПМО
2-я группа (индикаторы воздушно-капельного загрязнения - комменсалы верхних дыхательных путей): стрептококки; стафилококки.
Слайд 18: Характеристика СПМО
3-я группа (индикаторы процессов самоочищения - обитатели внешней среды): протеолиты; аммонификаторы и нитрификаторы; аэромоносы и бделловибрионы; споровые микроорганизмы; грибы и актиномицеты; целлюлозобактерии.
Слайд 19: Санитарно-микробиологическое исследование почвы
Почва дает приют разнообразным микроорганизмам. Количество только бактерий в почве достигает 10 млрд. клеток в 1 г. Микроорганизмы участвуют в почвообразовании и самоочищении почвы, в кругооборота в природе азота, углерода, и других элементов. В почве обитают грибы, простейшие и лишайники представляющие собой симбиоз грибов с цианобактериями. На поверхности почвы микроорганизмов относительно мало из-за губительного действия УФ-лучей, высушивания и других факторов. Пахотный слой почвы толщиной 10–15 см содержит наибольшее число микроорганизмов. По мере углубления количество микроорганизмов уменьшается вплоть до их исчезновения на глубине 3-4 м. Состав микрофлоры почвы зависит от ее типа и состояния, состава растительности, температуры, влажности и т.д. Большинство почвенных микроорганизмов способны развиваться при нейтральном рН, высокой относительной влажности, температуре от 25 до 45 °С.
Слайд 20: Санитарно-микробиологическое исследование почвы
В лаборатории из 5 точечных проб почвы, взятых с одного участка, готовят усредненную пробу, тщательно перемешивая и растирая в стерильной фарфоровой чашке резиновым пестиком в течение 5 мин. Посторонние примеси (корни растений, камни, щепки) удаляют путем просеивания почвы через сито, которое предварительно протирают ватным тампоном, смоченным 96% этиловым спиртом. Из усредненной пробы отбирают навески (от 1 до 50–55 г в зависимости от перечня определяемых показателей) и готовят суспензию 1:10 на стерильной водопроводной воде (10 г почвы на 90 см 3 воды). Для десорбции микроорганизмов с поверхности почвенных частиц приготовленную почвенную суспензию встряхивают в течение 3 мин на мешалке механического диспергатора. После отстаивания суспензии в течение 30 с, готовят последовательные 10-кратные разведения почвы до концентрации 10 -4 –10 -5 г/см 3.
Слайд 21: Санитарно-микробиологическое исследование почвы
В МУ 2.1.7.730–99 «Гигиеническая оценка качества почвы населенных мест» представлена схема оценки эпидемической опасности почв населенных мест. В данном документе для оценки интенсивности биологической нагрузки на почву используются показатели: БГКП и индекс энтерококков, для оценки эпидемической опасности почвы - патогенные энтеробактерии и энтеровирусы.
Слайд 22: Исследование воды
Вода относительно благоприятная среда для жизни, роста и размножения микроорганизмов, так как в ней находится достаточное количество питательных веществ (источников азота, углерода, кислорода, водорода), что позволяет микроорганизмам не только сохраняться, но и размножаться (т.е. накапливаться) в водной среде.
Слайд 23: Микрофлора воды
Микрофлора воды подразделяется на резидентную и транзиторную. Резидентная микрофлора состоит, преимущественно, из сапрофитов. Это, так называемая, аутохтонная микрофлора водоемов. Транзиторная (аллохтонная) микрофлора поступает из почвы, воздуха, живых организмов. Она может содержать и патогенную для человека микрофлору (как результат попадания фекальных хозяйственно-бытовых стоков в водоёмы): возбудителей дизентерии, брюшного тифа и паратифов, сальмонеллезов, холеры, энтеропатогенные кишечные палочки, энтеровирусы, вирусы гепатита А и др. Наличие в воде большого количества органических веществ значительно увеличивает степень микробной обсемененности. Основным источником фекального загрязнения водопроводной воды является подсос из окружающей среды при нарушении герметичности водопроводных труб; открытых водоёмов – городские хозяйственно-бытовые стоки, не очищенные предварительно, стоки с ферм и личных хозяйств в сельской местности.
Слайд 24: Водопроводная вода проходит несколько этапов очистки:
а) очистка от взвешенных примесей, б) очистка от превалирующей массы микроорганизмов, в) дезинфекция воды (устранение патогенных бактерий): проводится обработкой воды газообразным хлором, озоном, ультрафиолетовыми лучами и т.д., после чего ее микробная обсемененность доходит до нормативной – не более 50 сапрофитных микробов в 1 мл (Общее микробное число – ОМЧ).
Слайд 25: Вода очищенная». «Вода для инъекций»
В технологии изготовления многих лекарственных форм используются растворители, одним из основных среди них является вода. Качество воды, используемой для аптечной и промышленной технологии, регламентируется ФС 42-2619-97 «Вода очищенная» и ФС 42-2620-97 «Вода для инъекций». Воду очищенную и воду для инъекций в настоящее время получают чаще всего из воды водопроводной. От её качества будет зависеть качество воды очищенной и воды для инъекций. Санитарно-микробиологические показатели водопроводной воды регламентируются СанПиНом 2.1.4.1070-01 : Общее микробное число (ОМЧ) воды – количество микроорганизмов в 1 мл воды – 50 КОЕ/мл, не должны обнаруживаться возбудители инфекционных заболеваний, кишечная палочка не должна обнаруживаться в 100 мл.
Слайд 26: Примеси воды
Вода из любого источника очищается от примесей, которые подразделяются на 4 группы: а) механические, б) растворимые органические вещества, в) растворимые неорганические вещества, г) бактерии и пирогены.
Слайд 27: воды очищенная
Методы получения воды очищенной 1.Ионный обмен. Используются колонки с ионно-обменными смолами / Недостатки : используемые для деминерализации воды, ионно-обменные смолы являются прекрасным субстратом для размножения бактерий, поэтому данным методом нельзя пользоваться для получения воды для инъекций 2.Принцип обратного осмоса. Основан на использовании полупроницаемых мембран. Эти мембраны удерживают до 100% взвешенных коллоидных и растворенных веществ с молекулярной массой 200, и 95% веществ с более низкой молекулярной массой (в том числе бактерии, молекулы пирогенов). Суть обратного осмоса: под давлением, превышающим осмотическое, высокоминерализованная вода диффундирует через полупроницаемую мембрану в отсек чистой воды. Недостатки: нельзя контролировать наличие микроскопических дефектов (уже имеющихся или возникающих под давлением фильтруемой воды), что ведет к попаданию микроорганизмов в чистую воду. 3.Дистилляция. Самый широко применяемый и эффективный метод получения воды для любого назначения: как очищенной, так и для инъекций. Недостатки: теоретически, дистиллят, полученный с соблюдением всех технологических правил перегонки воды, не должен содержать химических примесей выше допустимых пределов, должен быть стерильным и апирогенным.
Слайд 28: вода очищенная
Нормативы санитарно-микробиологического состояния воды очищенной регламентируются ФС 42-2619-97: ОМЧ 100 микроорганизмов суммарно (бактерии и грибы) в 1 мл, отсутствие энтеробактерий, синегнойной палочки и золотистого стафилококка; срок хранения не более 3 суток. Вода для инъекций используется для изготовления инъекционных и инфузионных растворов, которые вводятся парентерально (минуя защитные кожно-слизистые барьеры). Поэтому к ней предъявляются более строгие санитарно-микробиологические требования. Согласно ФС 42-2620-97, вода для инъекций должна соответствовать требованиям, предъявляемым к воде очищенной и должна быть апирогенной. Срок хранения не более 24 часов, в асептических условиях при температурном режиме 5-100С (холодовой) или 85-950С (тепловой).
Слайд 29: БАКТЕРИАЛЬНЫЕ ПИРОГЕНЫ
Бактериальные пирогены – продукты жизнедеятельности и распада бактерий. По химической природе бактериальные пирогены – полисахариды и полипептиды с молекулярной массой 8х106, размером от 50 нм до 1 мкм. Пирогенными свойствами обладают практически все бактерии: патогенные и сапрофитные, грамотрицательные и грамположительные. Но пирогенность грамотрицательных бактерий почти в 100 раз выше за счет липидных компонентов клеточной стенки (ЛПС и ЛПП). У грамположительных бактерий пирогенность обусловлена преимущественно пептидогликаном.
Слайд 30: Свойства пирогенов
1) проходят через фарфоровые фильтры, 2) адсорбируются углём и на асбестовых фильтрах, 3) сохраняют активность при длительном хранении (до 6-8 месяцев), в высушенном виде – до 5 лет, 4) адсорбируются из раствора на стенках стеклянных емкостей при хранении. 5) не летучи 6) термостабильны – выдерживают обычные режимы автоклавирования (до 5 часов) и воздействия сухим горячим воздухом (сухожаровой шкаф 1800С – до 4 часов) Загрязнение пирогенами дистиллята может происходит за счет перебрасывания мельчайших капелек воды или переноса их сильной струей пара в холодильник. В лекарственный раствор пирогены могут быть внесены с водой или лекарственным веществом (субстанцией), но, в основном, они высвобождаются в процессе термической стерилизации растворов, так как при этом происходит гибель и разрушение микроорганизмов, находящихся в растворе. Есть определенная зависимость между количеством микробов в 1 мл до стерилизации и пирогенностью простерилизованной воды. Эта цифра колеблется в пределах 103-104 микробных клеток в 1 мл.
Слайд 31: Методы предотвращения пирогенности инъекционных препаратов и воды для инъекций:
1.Температурное воздействие, при котором разрушаются все органические вещества (нагревание Т 2000С – 60 мин, Т2500С – 30 мин) 2.Фильтрация растворов для инфузий через асбестовые фильтры «Микропор». 3.Интенсивное воздействие ультразвуком. 4.Сорбция активированным углем ( но многие лекарственные субстанции также будут адсорбироваться: алкалоиды и пр. ) 5.Обработка ферментами (энзиматический метод). 6.Химический метод (использование горячего подкисленного 1% раствора перманганата калия для обработки стеклянных трубок дистилляторов, сосудов для сбора дистиллята с последующим отмыванием от раствора). 7.Соблюдение правил по получению, хранению и транспортировке воды для инъекций (Приказ №309 от 21 октября 1997 г.) 8.Использование специальных аквадистилляторов с брызгоулавливающими экранами и каплеотделителями при получении воды для инъекций. 9.Соблюдение правил работы в асептическом боксе. 10.Соблюдение технологии производства инъекционных растворов. 11.Использование субстанций, соответствующих нормативам по микробиологической чистоте.
Слайд 32: Пирогены
Освободить растворы от пирогенов технологически очень сложно и в условиях аптеки – практически невозможно. Поэтому все усилия должны быть направлены на получение растворов, максимально свободных от сопутствующей микрофлоры. С целью уменьшения риска накопления пирогенов в результате размножения бактерий регламентированы нормативными документами (ФС. 42-2620-97), а так же парентеральных растворов до стерилизации (не более 3 часов по Приказу №309 от 21 октября 1997 г.). Вода очищенная проверяется на микробиологическую чистоту. Вода для инъекций и инъекционные растворы проверяются: до стерилизации: на микробиологическую чистоту после стерилизации: а) на стерильность; б) на пирогенность и содержание бактериальных эндотоксинов.
Слайд 33: Санитарно-микробиологический контроль воды
Для фармацевтического производства Вода забирается для исследования на разных этапах её получения, хранения, использования с соблюдением правил асептики: конец бюретки предварительно обжигают ватой, смоченной спиртом, дают стечь первой порции, затем забирают воду в стерильные флаконы, закрывая их стерильными ватными пробками. Аналогично производят отбор проб из дистиллятора, из тройников с внешним выводом и краном при значительной длине трубопровода. С момента забора воды до её микробиологического исследования должно проходить не более 3 часов (риск накопления микроорганизмов). Определение ОМЧ воды. По 1 мл. исследуемой воды вносят 2 чашки Петри с расплавленным и остуженным до 40-450С МПА, тщательно перемешивают и выдерживают 3-5 суток в термостате при 37 0С. После инкубации ведётся подсчет выросших колоний на 2-х чашках и определяется среднеарифметическое число. Для выявления плесневых и дрожжевых грибов по 1 мл исследуемой воды засевают в чашки Петри на среду Сабуро и инкубируют при температуре 20-220С в течение 5 суток. После инкубации подсчитывают число колоний грибов на обеих чашках, находят среднее арифметическое, и путем суммирования определяют число микроорганизмов, отражающее ОМЧ исследуемой дистиллированной воды. Определение энтеробактерий, синегнойной палочки, золотистого стафилококка проводится также, как и при исследовании на микробиологическую чистоту нестерильных лекарственных средств
Слайд 34: Воздух
Воздушная среда является неблагоприятной для длительного пребывания в ней микроорганизмов, особенно патогенных. Отсутствие влаги, питательных веществ, действие ультрафиолетовых лучей и т.д. ведут к гибели большинства микроорганизмов.
Слайд 35: Микрофлора воздуха
Нормальная микрофлора воздуха складывается из резидентной и транзиторной. Резидентная микрофлора представлена, в основном, сапрофитами: бактерии с липохромным пигментом (сарцины, микрококки. сапрофитный стафилококк и др.), спорообразующие (бациллы), плесневые и дрожжеподобные грибы. Транзиторная представлена, преимущественно, патогенными и условно-патогенными бактериями, вирусами: золотистый и эпидермальный стафилококк, дифтерийная, туберкулёзная, синегнойная палочки, энтеробактерии (клебсиелла, протей, серрация и др.); вирусы кори, гриппа и т.д.
Слайд 36: Микрофлора воздуха
В неочищенном воздухе во взвешенном состоянии находятся инородные включения различных размеров: 0,03-0,30 мкм – вирусы, бактерии; 10,0-100,0 мкм – частицы пыли; 30,0-200 мкм – волокна, волосы. Бактерии находятся в воздухе в виде аэрозоля, который по размерам частиц делятся на фазы: а) крупнокапельная или быстро оседающая фаза – капли с диаметром более 100 мкм; б) мелкоядерная фаза – капли и частицы с диаметром менее 10мкм. Они длительно находятся во взвешенном состоянии, и часть из них высыхает раньше, чем оседает (“бактериальная пыль”)
Слайд 37: Воздух производственных помещений
аптек – один из немаловажных источников микробного обсеменения лекарственных препаратов. Одновременно воздух является каналом переноса микрофлоры из одного помещения в другое. Поэтому, для промышленного производства лекарственных препаратов разработаны нормативы по допустимым уровням микробной загрязнённости воздуха в помещениях для производства стерильных лекарственных форм в асептических условиях. В зоне устанавливается 4 класса чистоты воздушной среды по уровню загрязненности механическими частицами и микроорганизмами.
Слайд 38: 4 класса чистоты воздушной среды
Чистые зоны классифицируются по соответствующему стандарту с целью сведения к минимуму риска загрязнения продукции или материалов пылевыми частицами и микроорганизмами. Чистые зоны подразделяются на 4 типа СанПиН 2.1.3.1375 – 03 «Допустимые уровни бактериальной обсемененности воздушной среды помещений лечебных учреждений в зависимости от их функционального назначения и класса чистоты»: А – локальная зона для проведения операций, представляющий высокий риск для качества продукции, в асептических условиях ( вскрытие ампул и флаконов, укупорка, наполнение и т.д.); в таких зонах используется однонаправленный (ламинарный) поток воздуха, обеспечивающий однородную скорость 0,36-0,54 м/с; В – зона, непосредственно окружающая зону А, и предназначенная для асептического приготовления и наполнения; С, D – чистые зоны для выполнения менее ответственных стадий производства СЛС.
Слайд 39: Исследование микробиологическое воздуха
Для контроля степени микробной обсемененности воздуха в аптеках и на предприятиях фармацевтической промышленности проводят определение следующих показателей: а) общее микробное число воздуха (ОМЧ) – количество микроорганизмов в 1 м3 воздуха, б) наличие в воздухе золотистого стафилококка и грибов (плесневых, дрожжеподобных) Методы изучения микрофлоры воздуха Используется 2 метода: седиментационный и аспирационный.
Слайд 40: объекты окружающей среды
Микробиологическая контаминация объектов окружающей среды происходит постоянно. Главным источником микробного загрязнения является человек: выделения верхних дыхательных путей, фекалии, слущенный эпидермис, волосы с колоссальным количеством микроорганизмов.
Слайд 41: объекты окружающей среды
Среди персонала могут быть носители патогенных микроорганизмов и больные с лёгкими формами заболевания, которые они переносят на ногах (дизентерия, брюшной тиф, паратифы А и Б, сальмонеллёзы и т.д.). Попавшие на объекты внешней среды микроорганизмы, в том числе и патогенные, как правило, не размножаются на них. Но такие объекты служат пассивными посредниками при передаче возбудителя. Возможность заражения и заболевания в таких случаях зависит от концентрации микроба, его вирулентности, сроков выживания во внешней среде. Так, патогенные энтеробактерии (сальмонеллы) могут выживать во внешней среде до 60-80 дней. Если микроорганизмы контаминируют субстанции, содержащие органические вещества, то может идти процесс размножения и накопления попавших микробов (органические масла, жировые вещества, глюкоза, кремы, мази и т.д.)
Слайд 42: Объекты окружающей среды
Показания для санитарно-микробиологического обследования предприятий фармацевтической промышленности и аптек: а) текущий санитарный контроль; б) микробиологический контроль санитарно-гигиенического режима, в) обследование по показаниям – при выявлении патогенных и санитарно-показательных микробов во внешней среде или лекарственных формах.
Слайд 43: Объекты окружающей среды
Объекты микробиологического контроля в аптеках Объектами микробиологического контроля в аптеках являются исходные, промежуточные и готовые продукты, вспомогательные вещества и материалы, руки и санитарная одежда персонала, воздушная среда и поверхности помещений и оборудования. Принципы отбора проб. Отбор проб для санитарно-микробиологического исследования предметов, аппаратуры, рабочих поверхностей проводятся с помощью следующих методов: смыв с использованием стерильного тампона или салфетки; или ополаскивания мелких предметов и внутренней поверхности флаконов; контактный метод – метод “отпечатков”;
Слайд 44: МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ НЕСТЕРИЛЬНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Размножение микробов в лекарственном препарате приводят к следующим результатам: Разрушение активного начала – потеря лечебных свойств; Появление токсических свойств, связанных с продукцией метаболитов и микробных токсинов ( экзо- и эндотоксинов ); Появление инфекционных свойств в результате накопления микробов до концентраций, соответствующих инфицирующей дозе; Пирогенность инъекционных препаратов, так как происходит накопление продуктов метаболизма и распада микробных клеток, особенно ГОБ; Сокращение сроков хранения; Потеря товарного вида.
Слайд 45: Нестерильные ЛС
При формировании категорий ЛС, сырья и субстанций и нормативов к их микробиологической чистоте учитываются следующие параметры : *возрастные категории лиц, для которых готовится ЛС (для новорожденных, для детей до 1 года); *характер применения препарата (пероральный, парентеральный, трансдермальный и т.д.); *происхождение компонентов ЛС (синтетическое, животное, растительное и т.д.); *технология приготовления (например, с использованием кипящей воды); *для какой категории ЛС используются субстанции и вспомогательные материалы (подлежащие стерилизации или изготовляемые в асептических условиях) и т.д.
Слайд 46: Нестерильные ЛС
Микробиологическая чистота лекарственных препаратов основных групп лекарственных средств, субстанций и вспомогательных материалов регламентируется в Государственной Фармакопии XII. (4 категории)
Слайд 47: Нестерильные ЛС
Кроме исходной контаминации субстанций и сырья, на микробиологическую чистоту лекарственного препарата влияют микроорганизмы, находящиеся на различном оборудовании, с помощью которого готовится препарат ( весы, дозирующее устройство, устройство для закупорки флаконов и т.д.). А также вспомогательные материалы и инструменты (фильтры, шпатели, прокладки и т.д.), посуда, воздух производственных помещений, вода очищенная, одежда и руки персонала и т.д.
Слайд 48: Нестерильные ЛС
Процессы, происходящие в системе “ микроорганизм – лекарственный препарат ” могут быть видимыми и невидимыми. Если система “ микроорганизм – лекарственный препарат ” находится в стационарной или размножения стадии, то в зависимости от состава ингредиентов и попавшей в неё микрофлоры могут наблюдаться изменения вкуса, цвета или запаха, выделение газов, появление осадка, хлопьев, плесени или изменение консистенции. В этом случае выбраковка лекарственного средства не представляет затруднений и производится по органолептическим свойствам. Наиболее часто подобные изменения отмечается в водных настоях, отварах. При добавлении консервантов этот процесс может удлиниться во времени в несколько раз. Если происходит микробная контаминация вязких субстанций и лекарственных форм ( мазей, мазевых основ и др.), то микробная диффузия затрудняется, и формируются локальные ( гнёздные) очаги: изменение цвета, консистенции, появление плесени и т.д.
Слайд 49: Нестерильные ЛС
Сложнее с выбраковкой лекарственного средства, находящегося на стадии покоя развития находящихся в нём микробов, так как они не успевают за короткое время значительно изменить органолептические характеристики препарата. Все процессы, происходящие на всех стадиях развития микроорганизмов в субстрате могут ускоряться на фоне нарушения санитарных нормативов, микроклимата помещений (температура, влажность, содержание пылевых частиц и т.д.). Например, повышение влажности и температуры воздуха способствуют отсыреванию порошков, таблеток с последующей активацией в них жизнедеятельности микроорганизмов; в мазевых основах при микрофлора может сохраняться длительное время
Слайд 50: Для предотвращения микробной загрязнённости НЛС необходимо соблюдать:
*технологию производства, *правила эксплуатации оборудования, *правила получения, хранения и транспортировки воды очищенной, *правила обработки рук провизора, *режим хранения субстанций, сырья, промежуточных продуктов *обеспечивать соответствующее санитарное состояние оборудования и помещений, *использовать сырьё и субстанции, соответствующие нормативам по микробиологической чистоте Для предотвращения микробной загрязнённости НЛС необходимо соблюдать: *технологию производства, *правила эксплуатации оборудования, *правила получения, хранения и транспортировки воды очищенной, *правила обработки рук провизора, *режим хранения субстанций, сырья, промежуточных продуктов *обеспечивать соответствующее санитарное состояние оборудования и помещений, *использовать сырьё и субстанции, соответствующие нормативам по микробиологической чистоте
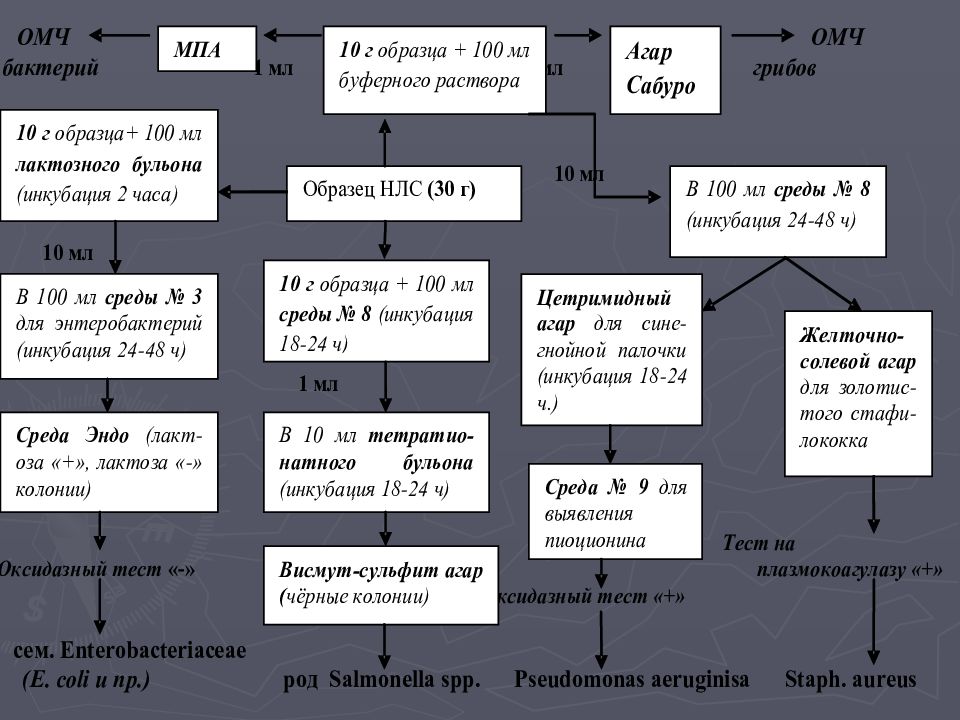
Слайд 51: Исследование микробной обсемененности НЛС
Методы: 1.Чашечный агаровый метод 2.Метод мембранной фильтрации 3.Метод наиболее вероятностных чисел (НВЧ) Для определения ОМЧ (общего микробного числа) бактерий: МПА ( мясо-пептонный агар); ОМЧ грибов – плотная среда Сабуро Среды накопления (обогащения ) Т-гликолевая для выявления кишечной палочки, сальмонелл, синегнойной палочки и золотистого стафилококка.
Слайд 53: МИКРОБИОЛОГИЧЕСКИЙ КОНТРОЛЬ СТЕРИЛЬНЫХ И ИНЪЕКЦИОННЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Лекарственные средства, к которым предъявляется требования стерильности (СЛС): а) инъекционные и инфузионные растворы и другие виды препаратов для парентерального введения (вводимые в полость суставов, в плевральную полость и т.д.); б) глазные капли (после стерилизации и изготовленные в асептических условиях); в) глазные препараты (мази, пленки, офтальмологические растворы для орошения и др.); г) препараты для нанесения на открытые раны и ожоги; д) жидкие лекарственные средства для новорожденных; е) медицинские иммунобиологические препараты (МИБП).
Слайд 54: Требование стерильности предполагает отсутствие в препарате микроорганизмов
должно обеспечиваться следующими приёмами: а) соблюдение правил асептики при изготовлении лекарственного средства б) выбор правильного метода и режима стерилизации СЛС аптечного изготовления делятся на 2 группы: Лекарственные средства, стерилизуемые в конечной упаковке Лекарственные средства, не подлежащие стерилизации и готовящиеся в асептических условиях (с использованием стерильных растворителей, посуды, вспомогательных материалов, мембранной фильтрации и т.д. на основе стерильной воды) Стерильные и инъекционные лекарственные средства готовятся в асептическом боксе аптеки. В условиях заводского производства асептические условия создаются путём организации чистых зон A, B, C, D
Слайд 55: Основными нормативными документами при изготовлении стерильных лекарственных средств в аптеках и на фармацевтическом производстве являются :
Государственная Фармакопея XI и Х II издания Правила производства и контроля качества лекарственных средств ( GMP ) (от 10 марта 2004 г. № 160-ст) Методические указания по изготовлению стерильных растворов в аптеках, ФС (фармакопейные статьи), Федеральный закон Российской Федерации от 12 апреля 2010 г. N 61-ФЗ "Об обращении лекарственных средств" СП 3.3.2.015-94 «Медицинские иммунологические препараты: производство и контроль качества». Приказ № 214 от 16 июля 1997г. “О контроле качества лекарственных средств, изготовляемых в аптеках”, Приказ № 1026 от 19 октября 1982г. “Об усилении контроля за санитарным состоянием родильных домов, детских лечебно-профилактических учреждений и аптек Приказ №309 от 21 октября 1997 г. Об утверждении инструкции по санитарному режиму аптечных организаций (аптек) Документ с изменениями, внесенными приказом Минздрава России от 24 апреля 2003 года № 172.
Слайд 56: стерильные ЛС
Многие основы и растворители могут являться питательной средой для микроорганизмов. Наличие или отсутствие микроорганизмов ( стерильность ) в основах, растворителях и субстанциях регламентируется нормативными документами. Выбор способа термической обработки лекарственного препарата определяется степенью устойчивости компонентов в растворах при нагревании. Некоторые инъекционные растворы не выдерживают термической стерилизации ( барбамил, мединал, адреналина гидрохлорид и др.). При заводском производстве стерильных лекарственных форм используют стерилизацию фильтрованием или гамма-лучами.
Слайд 57: стерильные ЛС
Некоторые из субстанций в инъекционных растворах оказывают бактерицидное действие ( аминазин, дипразин, гексаметилентетрамин и др.). Лекарственные формы, не переносящие термической обработки, готовят в асептических условиях.
Слайд 58: стерильные ЛС
Асептические условия – единственный путь получения лекарственных препаратов, отвечающих требованию стерильности. Это достигается тем, что растворитель или основу, инструменты, посуду стерилизуют отдельно. Термолабильные лекарственные вещества асептически взвешивают и растворяют в стерильном растворителе (иногда с добавлением консерванта) или смешивают со стерильной основой стерильными инструментами, и помещают в стерильные отпускные склянки. Термостабильные компоненты лекарственных препаратов стерилизуются.
Слайд 59: стерильные ЛС
К инъекционным растворам, кроме стерильности, предъявляется требование апирогенности. Пирогенность данной группы лекарственных средств зависит от: 1. Исходной (до стерилизации) микробной контаминации раствора (особенно грамотрицательными бактериями), степень которой обусловлена: *качеством используемых субстанций и вспомогательных веществ (микробиологическая чистота), *качеством воды для инъекций (микробиологическая чистота) *интервалом времени от начала производства препарата до стерилизации (т.к. микробы могут использовать компоненты препарата в качестве питательных веществ и размножаться в нём) – не должен превышать 3 часов (Приказ №309 от 21 октября 1997 г.), * внешней средой асептического бокса (чистой зоны на фармацевтических заводах) – оборудование, воздух (микробная контаминация), *качеством обработки рук провизора, *соблюдением правил работы в асептическом боксе (чистой зоне на фармацевтических заводах) и технологии производства лекарственного препарат;
Слайд 60: стерильные ЛС
2. Внесения пирогенных веществ (липополисахаридов, липополипротеидов бактерий) с водой, субстанциями, растворителями, со стенок флаконов – возвратной аптечной посуды, что обусловлено: *накоплением продуктов жизнедеятельности и распада (после тепловой стерилизации!) микроорганизмов в субстанциях, растворителях, *накоплением продуктов жизнедеятельности и распада микроорганизмов в воде для инъекций (при нарушении правил подготовки дистиллятора к работе, обработки баллонов для сбора воды, сроков и условий хранения воды для инъекций), *накоплением продуктов жизнедеятельности и распада микроорганизмов на стенках возвратной аптечной посуды – флаконов (при нарушении правил её дезинфекции, мытья и стерилизации)
Слайд 61: стерильные ЛС
С целью контроля качества производственного процесса изготовляемые в аптеках растворы для инъекций и промежуточные продукты подвергаются микробиологическому контролю ( микробиологическая чистота и стерильность) выборочно, не реже 2 раз в квартал, а также на содержание пирогенных веществ ежеквартально
Слайд 62: стерильные ЛС
I.Исследование на микробиологическую чистоту ( раздел «Микробиологический контроль нестерильных лекарственных средств»). II. Исследование на пирогенность Требования к микробиологической чистоте инъекционных лекарственных препаратов и субстанций для их производства: ОМЧ инъекционных растворов до стерилизации не более 30 сапрофитов в 1 мл (Приложение №1 к методическим указаниям по микробиологическому контролю в аптеках, №3182-84). Микробиологическая чистота субстанций и вспомогательных веществ, используемых при производстве лекарственных препаратов. (ГФ XII издание)
Слайд 63: стерильные ЛС
Категория-1.2.а- Стерильных лекарственных препаратов, которые в процессе производства не подвергаются стерилизации-Субстанции должны быть стерильными Категория-1.2.б- Стерильных лекарственных препаратов, которые в процессе производства подвергаются стерилизации- Не более 1000 аэробных бактерий и грибов суммарно в 1 г или в 1 мл; - при отсутствии Enterobacteriaceae, Pseudomonas aeruginosa, Staphylococcus aureus в 1 г или в 1 мл
Слайд 64: стерильные ЛС
III. Исследование на стерильность ( ОФС 42-0066-07 ) Лекарственные средства для инъекций и инфузий, глазные капли, мази, плёнки и другие препараты и субстанции, в отношении которых имеются соответствующие указания в документации, должны быть стерильными. Методы контроля стерильности : метод прямого посева и метод мембранной фильтрации. Методы контроля стерильности применяют для испытания всех лекарственных средств независимо от их природы и лекарственной формы.
Слайд 65: Работа микробиологических лабораторий
Микробиологические лаборатории фармацевтических предприятий и контрольных служб проводят контроль качества заведомо стерильной или незначительно контаминированной продукции при четком соблюдении правил GMP и GLP. В используемых в настоящее время нормативных документах приводятся только обобщенные положения работы любых лабораторий подобной направленности. Микробиологический анализ на фармацевтическом производстве строго ограничен по времени в связи с экономическим аспектом.
Слайд 66: Система микробиологического контроля качества лекарственных средств (СМКК ЛС)
Система микробиологического контроля качества лекарственных средств (СМКК ЛС) - направление фармацевтической микробиологии, - комплекс элементов, технических средств и организационных мероприятий, обеспечивающих качество и безопасность ЛС по микробиологическим показателям. СМКК ЛС в составе: контроля качества ( QC ), обеспечения качества ( QA ), надлежащей производственной ( GMP ) и лабораторной ( GLP ) практик является частью Государственной системы контроля качества, эффективности и безопасности ЛС, утвержденной Федеральным законом «О лекарственных средствах»(№86-ФЗ от 22.06.1998)
Слайд 67: Структура СМКК представлена следующими элементами:
1.Требования к качеству в виде допустимых пределов количественного содержания бактерий и грибов, а также ограничения по наличию или количественному содержанию определенных бактерий в лекарственных препаратах, субстанциях и вспомогательных веществах. 2.Методы микробиологического контроля качества ЛС. 3.Методы микробиологического мониторинга производственных и лабораторных помещений. 4.Питательные среды с гарантированными ростовыми и селективными свойствами и методами их определения.
Слайд 68: Структура СМКК представлена следующими элементами:
5. Персонал, аттестованный на работу в контрольной службе. 6.Микробиологическая лаборатория (специализированный набор помещений) со специфическим оборудованием и методами его валидации и аттестации. 7.Документация (ОФС, ФСП, НД, СОП и др.) Все элементы СМКК ЛС участвуют в оценке достоверности полученных результатов, подтверждая надежность указанной системы.
Слайд 69: Концепция рационального построения и функционирования СМКК ЛС:
Наличие современных нормативных документов, определяющих правовые нормы работы СМКК ЛС. Взаимосвязь всех элементов СМКК, образующих 3 главных направления - регистрацию, производство и контроль качества ЛС. Систематическое обучение персонала. Регулярное проведение внутренних лабораторных проверок и периодическое выполнение заданий внешних аудитов.
Слайд 70: Микрофлора растительного лекарственного сырья, фитопатогенные микроорганизмы
В процессе получения растительного лекарст - венного сырья возможно его инфицирование: через воду, не стерильную аптечную посуду, воздух производственных помещений и руки персонала. Обсеменение происходит также за счет нормальной микрофлоры растений и фито-патогенных микроорганизмов - возбудителей заболеваний растений. Микроорганизмы находятся на поверхности (на листьях, стеблях, семенах) и на корнях растений.
Слайд 71: Микрофлора растительного лекарственного сырья
Микроорганизмы поверхности растений, относятся к эпифитам (греч. epi - над, phyton - растение). Они не наносят вреда, являются антагонистами некоторых фитопатогенных микроорганизмов, растут за счет обычных выделений растений и органических загрязнений поверхности растений. Эпифитная микрофлора усиливает иммунитет растений, защищая их от фитопатогенных микроорганизмов. Наибольшее количество эпифитной микрофлоры составляют грамотрицательные палочковидные бактерии Erwinia herbicola (новое название Pantoea agglomerans ), являющиеся антагонистами возбудителя мягкой гнили овощей. Обнаруживают в норме и другие бактерии - Pseudomonas fluorescens, реже Bacillus mesentericus и небольшое количество грибов.
Слайд 72: Микрофлора растительного лекарственного сырья
Состав микрофлоры растений зависит от вида, возраста растений, типа почвы и температуры окружающей среды. Нарушение поверхности растений и их семян способствует накоплению на них большого количества пыли и микроорганизмов. При повышении влажности численность эпифитных микроорганизмов возрастает, при понижении влажности - уменьшается.
Слайд 73: Микрофлора растительного лекарственного сырья
Около корней растений в почве находится значительное количество микроорганизмов. Эта зона называется р изосферой ( от греч. rhiza - корень, sphaira - шар). В ризосфере часто присутствуют псевдомонады и микобактерии, встречаются также актиномицеты, спорообразующие бактерии и грибы. Микроорганизмы ризосферы переводят различные субстраты в соединения, доступные для растений, синтезируют биологически активные соединения (витамины, антибиотики и др.), вступают в симбиотические взаимоотношения с растениями, обладают антагонистическими свойствами против фитопатогенных бактерий.
Слайд 74: Микрофлора растительного лекарственного сырья
Микроорганизмы поверхности корня растений ( микрофлора ризопланы ) в большей степени, чем ризосфера, представлены псевдомонадами. Симбиоз мицелия грибов с корнями высших растений называют микоризой,т.е. грибокорнем (от греч. mykes - гриб, rhiza - корень). Микориза улучшает рост растений. Более загрязнены микроорганизмами растения окультуренных почв, чем растения лесов и лугов. Их много появляется на растениях, растущих на полях орошения, свалках, вблизи складирования навоза, в местах выпаса скота. При этом растения могут загрязняться патогенными микроорганизмами и при неправильной заготовке сырья являются хорошей питательной средой для размножения микроорганизмов. Высушивание растений препятствует росту в них микроорганизмов.
Слайд 75: Фитопатогенные микроорганизмы
К фитопатогенным микроорганизмам относят бактерии, вирусы и грибы. Болезни, вызываемые бактериями, называют бактериозами. К бактериозам относятся различные виды гнилей, некрозы тканей, увядание растений, развитие опухолей и др. Среди возбудителей бактериозов встречаются псевдомонады, микобактерии, эрвинии, коринебактерии, агробактерии и др.
Слайд 76: Фитопатогенные микроорганизмы
Возбудители бактериозов передаются через зараженные семена, остатки больных растений, почву, воду, воздух путем переноса насекомыми, моллюсками, нематодами. Бактерии проникают в растения через устьица, нектарники и другие части растений, а также через небольшие повреждения. Представители рода Erwinia вызывают болезни типа ожога, увядания, мокрой или водянистой гнили, E. amylovora - возбудитель ожога яблонь и груш, Е. carotovora (новое название Pectobacterium carotovorum ) - возбудитель мокрой бактериальной гнили.
Слайд 77: Фитопатогенные микроорганизмы
Псевдомонады (род Pseudomonas ) вызывают бактериальную пятнистость ( Р. syringae и др.), при этом на листьях образуются разнообразные пятна. Поражают листья и бактерии рода Xanthomonas, которые, проникая в сосудистую систему растения и закупоривая ее элемент, вызывают пятнистость и гибель растения. Некоторые представители рода Corynebacterium и виды Сurtobacterium flaccumfaciens, Сlavibacter michihanensis вызывают сосудистые и паренхиматозные заболевания растений. Гликопептиды этих бактерий повреждают клеточные мембраны сосудов, в результате чего происходит закупорка сосудов и гибель растения. Агробактерии рода Agrobacterium способствуют развитию различных опухолей у растений (корончатый галл, корень волосяной, рак стеблей), что обусловлено онкогенной плазмидой, передающейся агробактериями в растительные клетки.
Слайд 78: Фитопатогенные микроорганизмы
Вирусы вызывают болезни растений в виде мозаики и желтухи. При мозаичной болезни растений появляется мозаичная (пятнистая) расцветка пораженных листьев и плодов, растения отстают в росте. Желтуха проявляется карликовостью растений, измененными многочисленными боковыми побегами, цветками и т.д.
Слайд 79: Фитопатогенные микроорганизмы
При использовании ЛС из пораженного грибами РЛС могут возникать микотоксикозы. В условиях повышенной влажности, низкой температуры на вегетирующих или скошенных растениях могут развиваться грибы родов Fusarium, Penicillium, Aspeigillus и др.
Последний слайд презентации: Санитарная микробиология: Фитопатогенные микроорганизмы
Для борьбы с фитопатогенными микроорганизмами выращивание выносливых растений, очистка и обработка семян, обеззараживание почвы, удаление пораженных растений, уничтожение переносчиков возбудителей болезней, обитающих на растениях.