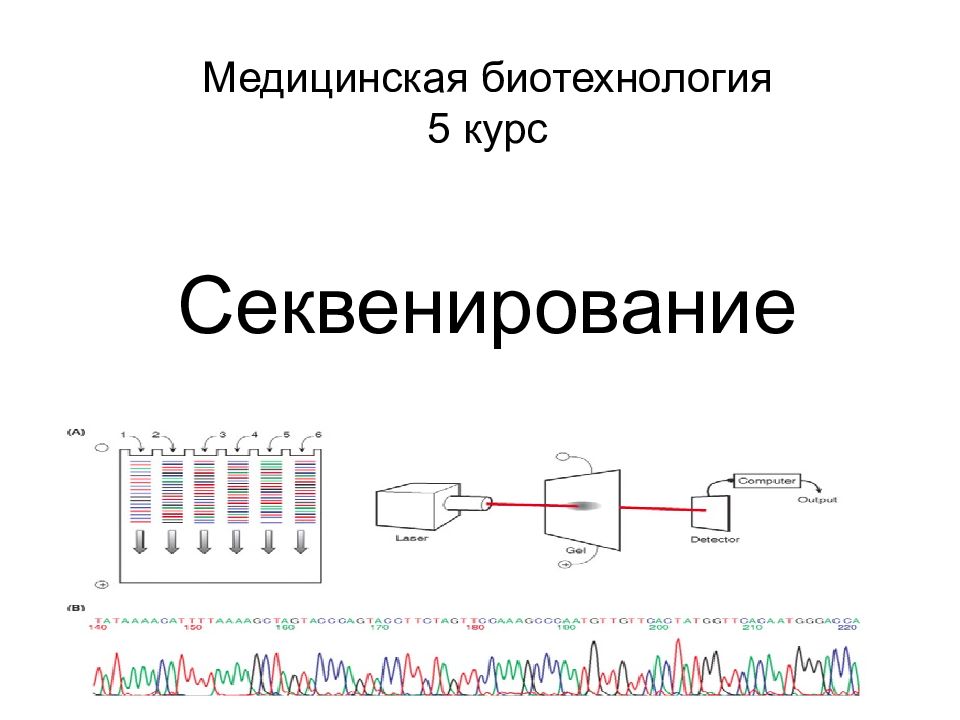
Слайд 2
Под секвенированием ДНК понимают определение её нуклеотидной последовательности последовательности (от лат. sequentum — последовательность) Расшифровка генома человека - картирование генов -выявление регуляторных элементов -идентификация новых генетических маркеров -эволюция человека и млекопитающих -популяционные исследования -дизайн праймеров для ДНК-диагностики В повседневной практике научных и диагностических лабораторий - идентификация патологических мутаций -определение полиморфных вариантов -построение карт метилирования генов- супрессоров -проверка на различных этапах создания генно-инженерных конструкций, при разработке контролей для тест-систем 2
Слайд 3
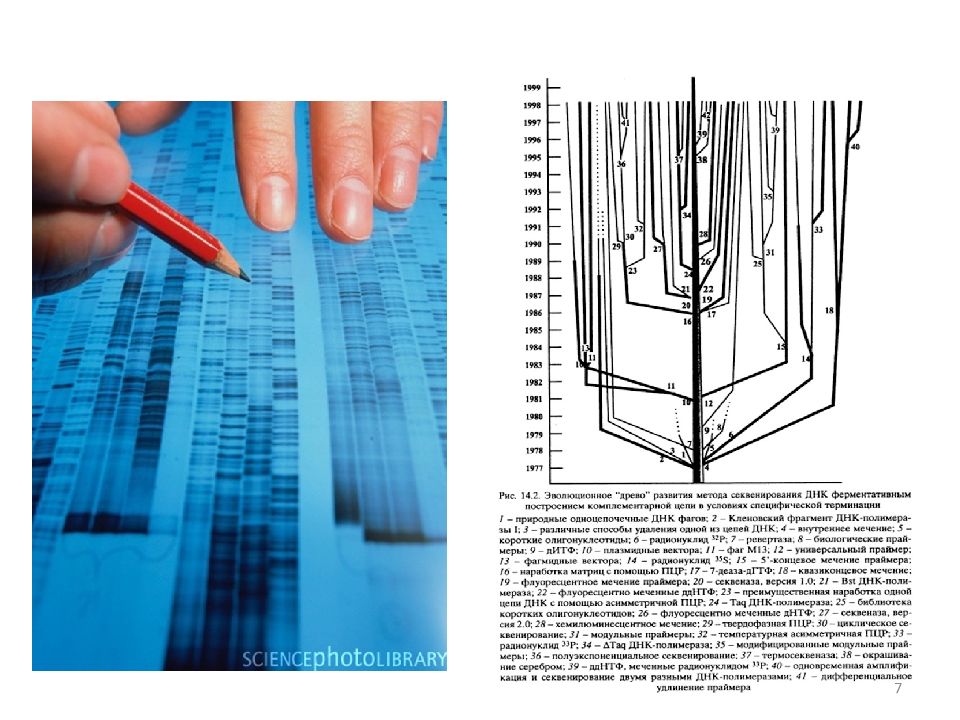
1953 г. – двойная спираль ДНК Д. Уотсона и Ф. Крика (нобелевская премия в 1962 г.) 1959 г. – нобелевская премия А. Корнбергу и С. Очоа за открытие механизма биосинтеза нуклеиновых кислот 1977 г. – У. Гилберт и Ф. Сэнгер опубликовали разработанные ими методы секвенирования (нобелевская премия в 1980 г.) 1978 г. – нобелевская премия В. Арберу, Г. Смиту и Д. Натансону за открытие эндонуклеаз рестрикции 1993 г. – нобелевская премия К. Мюллису за ПЦР и М. Смиту за направленный мутагенез 3
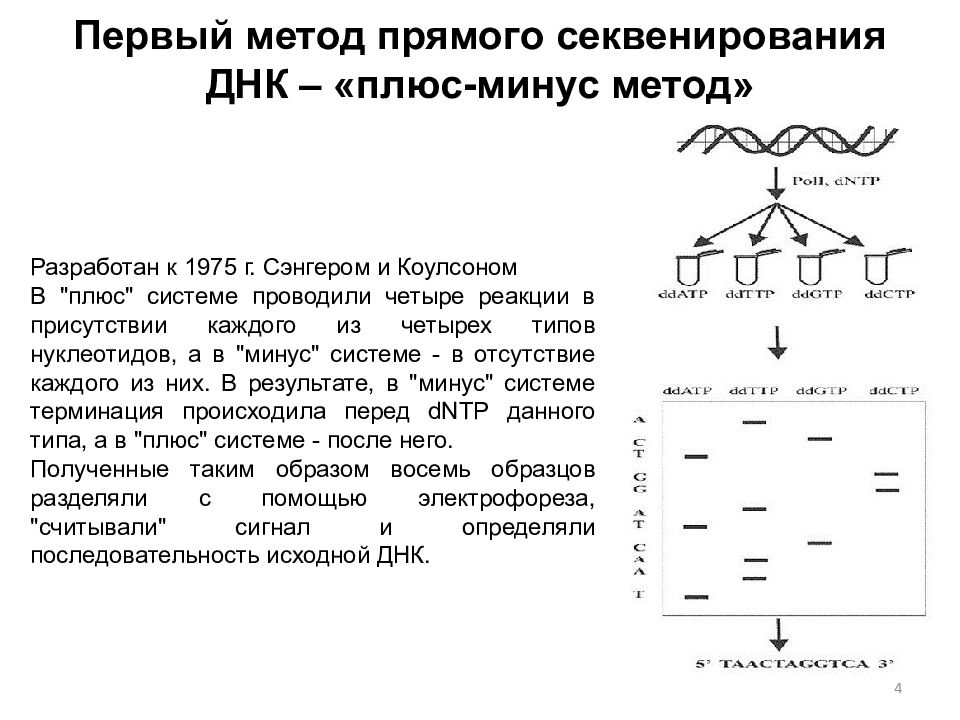
4 Разработан к 1975 г. Сэнгером и Коулсоном В "плюс" системе проводили четыре реакции в присутствии каждого из четырех типов нуклеотидов, а в "минус" системе - в отсутствие каждого из них. В результате, в "минус" системе терминация происходила перед dNTP данного типа, а в "плюс" системе - после него. Полученные таким образом восемь образцов разделяли с помощью электрофореза, "считывали" сигнал и определяли последовательность исходной ДНК.
Слайд 5
5 Метод Максама -Гилберта Пуриновые основания обрабатывают диметилсульфатом. При этом происходит метилирование адениновых остатков по азоту в положении 3, а гуаниновых - по азоту в положении 7. Обработка образца ДНК соляной кислотой при 0°С приводит к выщеплению метиладенина. Последующая инкубация при температуре 90°С в щелочной среде вызывает разрыв сахарно-фосфатной цепи ДНК в местах выщепления оснований. Обработка пиперидином приводит к гидролизу образца по остаткам метилгуанина. Пиримидиновые основания модифицируют гидразином. Если реакцию вести в бессолевой среде, то модифицируются как цитозин, так и тимидин ; если обработку вести в присутствии 2М NaCl, то модифицируется лишь цитозин. Расщепление цепи ДНК на фрагменты и в этом случае осуществляется пиперидином. Условия реакций авторы подбирали таким образом, чтобы в итоге получить полный набор субфрагментов разной длины. Последующий электрофорез в полиакриламидном геле позволяет восстановить полную структуру исследуемого фрагмента.
Слайд 6
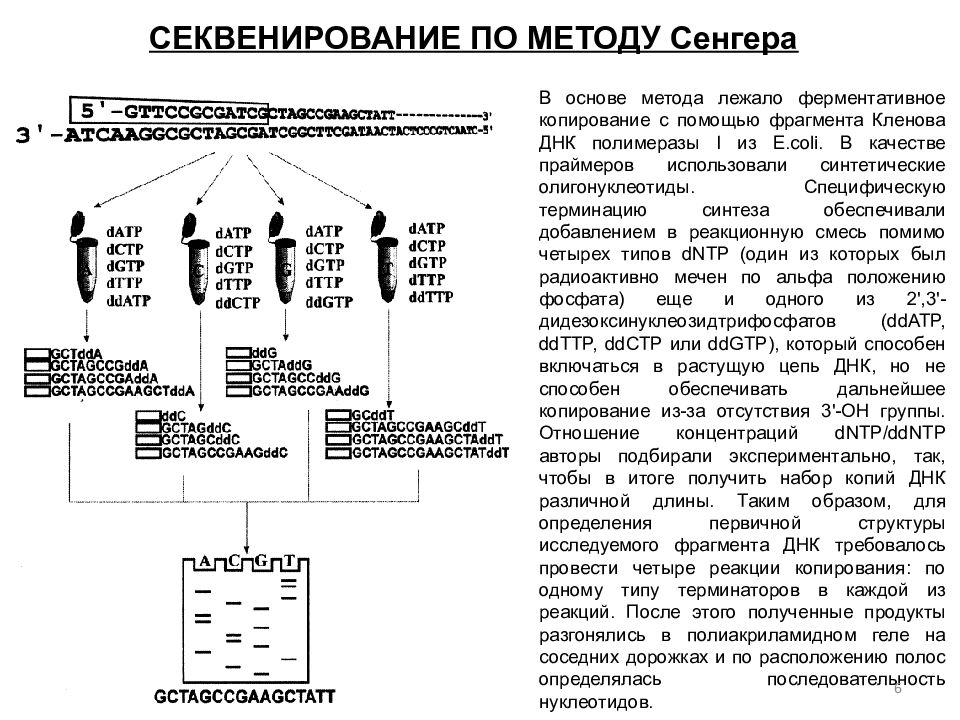
СЕКВЕНИРОВАНИЕ ПО МЕТОДУ Сенгера ие ДНК по Сэнгеру В основе метода лежало ферментативное копирование с помощью фрагмента Кленова ДНК полимеразы I из E.coli. В качестве праймеров использовали синтетические олигонуклеотиды. Специфическую терминацию синтеза обеспечивали добавлением в реакционную смесь помимо четырех типов dNTP (один из которых был радиоактивно мечен по альфа положению фосфата) еще и одного из 2',3'-дидезоксинуклеозидтрифосфатов ( ddATP, ddTTP, ddCTP или ddGTP ), который способен включаться в растущую цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за отсутствия 3'-ОН группы. Отношение концентраций dNTP / ddNTP авторы подбирали экспериментально, так, чтобы в итоге получить набор копий ДНК различной длины. Таким образом, для определения первичной структуры исследуемого фрагмента ДНК требовалось провести четыре реакции копирования: по одному типу терминаторов в каждой из реакций. После этого полученные продукты разгонялись в полиакриламидном геле на соседних дорожках и по расположению полос определялась последовательность нуклеотидов. В основе метода лежало ферментативное копирование с помощью фрагмента Кленова ДНК полимеразы I из E.coli. В качестве праймеров использовали синтетические олигонуклеотиды. Специфическую терминацию синтеза обеспечивали добавлением в реакционную смесь помимо четырех типов dNTP (один из которых был радиоактивно мечен по альфа положению фосфата) еще и одного из 2',3'-дидезоксинуклеозидтрифосфатов ( ddATP, ddTTP, ddCTP или ddGTP ), который способен включаться в растущую цепь ДНК, но не способен обеспечивать дальнейшее копирование из-за отсутствия 3'-ОН группы. Отношение концентраций dNTP / ddNTP авторы подбирали экспериментально, так, чтобы в итоге получить набор копий ДНК различной длины. Таким образом, для определения первичной структуры исследуемого фрагмента ДНК требовалось провести четыре реакции копирования: по одному типу терминаторов в каждой из реакций. После этого полученные продукты разгонялись в полиакриламидном геле на соседних дорожках и по расположению полос определялась последовательность нуклеотидов. 6
Слайд 8
Флуоресцентные красители Флуоресцентные красители Флуоресценция – излучение, возникающее при переходе электрона из возбужденного состояния в основное. спектр эмиссии не зависит от длины волны возбуждения (он зависит от строения молекулы флуорофора и условий, в которых он находится – рН и т.п.) длина волны испускания больше длины волны возбуждения из-за энергетических потерь (в секвенаторах Applied Biosystems возбуждающий и испускаемый свет находится в видимой части спектра 450-650 нм ) квантовый выход флуоресценции – важен для секвенирования (отношение числа испускаемых фотонов к числу поглощенных) Первыми флуорофорами, адаптированными к нуждам секвенирования, стали соединения из семейства флуоресцеиновых (FAM, JOE) и родаминовых (TAMRA, ROX, R110, R6G) красителей. Следующее поколение флуорофоров этого семейства - dTAMRA, dROX, dR110, dR6G - получило довесок из двух остатков хлора. Это позволило несколько снизить перекрывание спектров испускания и значительно повысить интенсивность флуоресценции, а значит и чувствительность. Еще более высоким выходом флуоресценции характеризуются "трехкомпонентные" красители класса BigDye ™ ( Applied Biosystems ), при конструировании которых был использован принцип переноса энергии. Под переносом энергии понимают явление безизлучательного переноса энергии возбужденного состояния от донора к акцептору. Донором в BigDye ™ является 4'-аминометил-5(или 6)- карбоксифлуоресцеин, который связан с акцептором (представителем семейства d-родаминов) через остаток 4-аминометилбензойной кислоты. 8
Слайд 9
Полимеразы для автоматического секвенирования ДНК Гель для автоматического секвенирования и условия электрофореза Полимеразы для автоматического секвенирования ДНК В оригинальной работе Ф. Сэнгера для проведения сиквенсовых реакций был использован Кленовский фрагмент ДНК-полимеразы I из E.Coli. В настоящее время для секвенирования используют рекомбинантные ДНК-полимеразы, отвечающие следующим требованиям: - отсутствие 3'- и 5'-экзонуклеазной активности, отсутствие дискриминации по включению в растущую цепь как обычных, так и модифицированных (меченных) ddNTP. Всего существует два разных подхода. В первом случае (сейчас практически не используется) копирование осуществляется при 37°С высокопроцессивными термолабильными полимеразами (например, T7 DNA polymerase ). Однако наиболее распространен второй способ - циклический процесс, который включает денатурацию, Biosystems. Полученные в реакции секвенирования флуоресцентно меченные одноцепочные фрагменты ДНК разделяют с помощью электрофореза в полиакриламидном геле. Гели, используемые в секвенировании должны позволять разделять фрагменты, отличающиеся друг от друга на один нуклеотид в широком диапазоне длин. Разделение должно проходить в денатурирующих условиях, препятствующих ренатурации и возникновению вторичных структур у разделяемых фрагментов. В общем случае этим требованиям удовлетворяют 5-8% полиакриламидные гели, содержащие 7М мочевину. В автоматическом секвенировании используют капиллярный электрофорез в линейном полиакриламиде. Капилляры представляют собой стеклянную трубку длинной 30-100 см, закатанную в полимерный пластификатор. Небольшой диаметр капилляра (50-100 мкм) позволяет проводить разделение значительно быстрее, чем в обычных гелях. Кроме того, капиллярные секвенаторы позволяют обеспечивать гораздо более высокую чувствительность за счет отсутствия горизонтальной диффузии. 9
Слайд 10
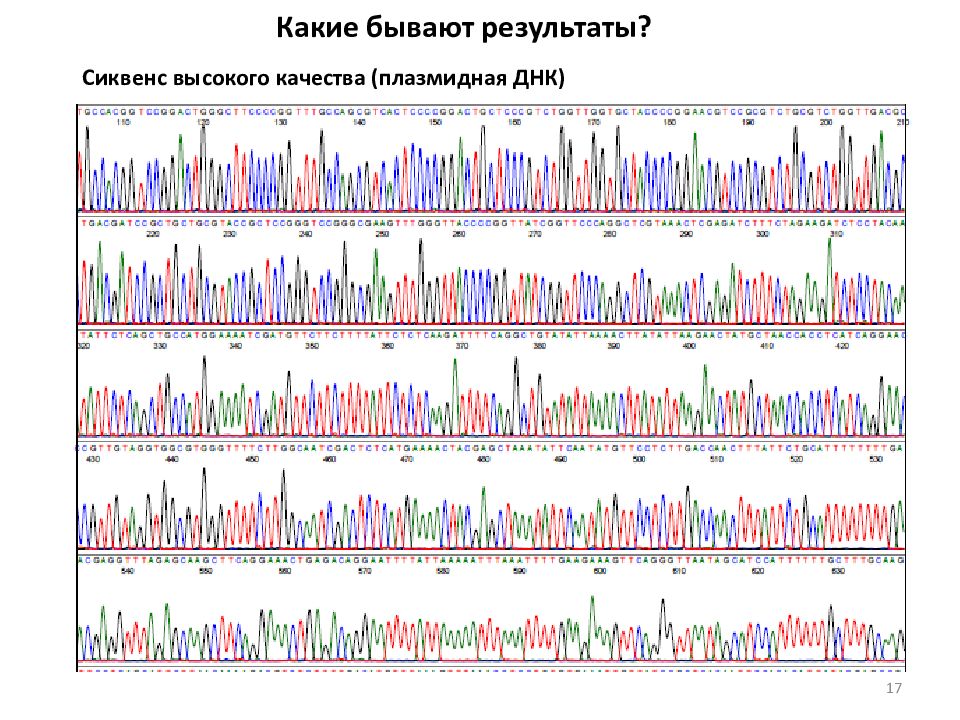
Последовательность действий при секвенировании ДНК Получение матрицы для секвенирования (ПЦР-продукт, плазмида ) Очистка матрицы от невключившихся праймеров, dNTPs и других примесей. Проведение реакции секвенирования (наработка пула фрагментов различной длины, комплементарных матричной молекуле и заканчивающихся меченым ddNTP.) Очистка продуктов реакции от невключившихся меченых ddNTPs и других примесей, которые могут влиять на подвижность и / или флуоресценцию полученных продуктов. Электрофорез меченых фрагментов в денатурирующих условиях при высоком разрешении в капиллярных генетических анализаторах и автоматическая детекция флуоресцентных сигналов. Анализ первичных данных и построение хроматограммы, идентификация мутаций или полиморфизмов. 10
Слайд 11
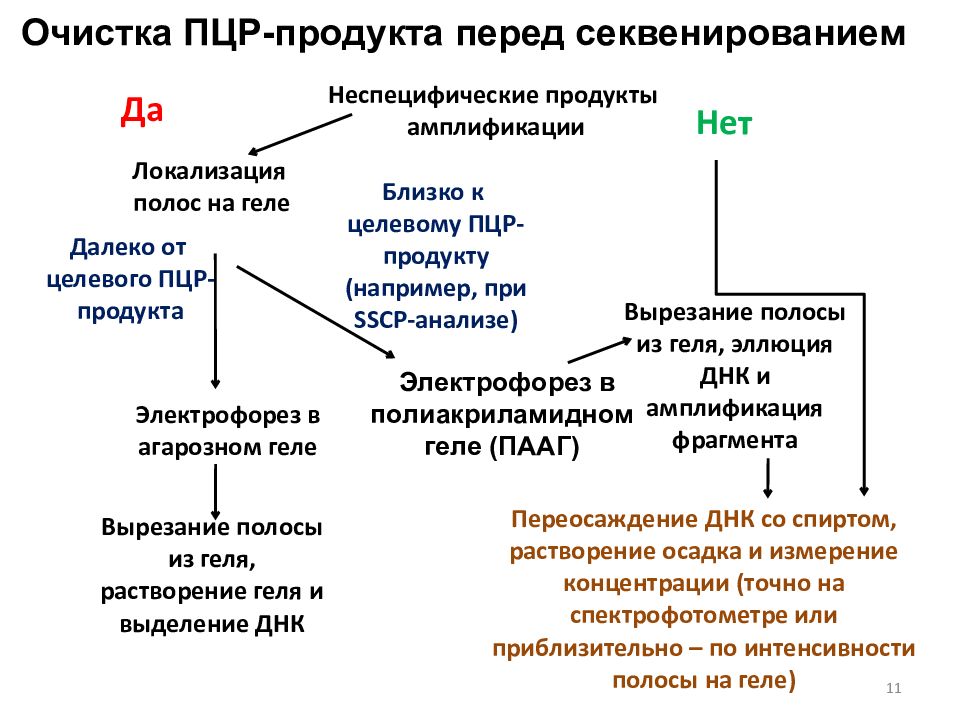
Неспецифические продукты амплификации Да Нет Далеко от целевого ПЦР-продукта Близко к целевому ПЦР-продукту (например, при SSCP -анализе) Электрофорез в агарозном геле Электрофорез в полиакриламидном геле (ПААГ) Переосаждение ДНК со спиртом, растворение осадка и измерение концентрации (точно на спектрофотометре или приблизительно – по интенсивности полосы на геле) Очистка ПЦР-продукта перед секвенированием Неспецифические продукты амплификации Локализация полос на геле Электрофорез в полиакриламидном геле (ПААГ) Электрофорез в агарозном геле Вырезание полосы из геля, растворение геля и выделение ДНК Вырезание полосы из геля, эллюция ДНК и амплификация фрагмента 11
Слайд 12
12 Очистка целевого ПЦР-продукта от неспецифических фрагментов с помощью электрофореза Агарозный гель-электрофорез (1,5% агарозы, 0,5х-буфер ТВЕ, 150-200 В) 1. После электрофореза вырезать в проходящем УФ полосу геля с целевым ПЦР-продуктом, затем добавить связывающий буфер в соотношении 1 мкл буфера на 1 мг геля. 2. Инкубировать пробирку при 55°С в течение, примерно, 10 мин до полного растворения геля. Если длина фрагмента < 500 п.н., то добавить изопропанол в соотношении 1 /3 от исходной массы полосы геля и перемешать. 3. Нанести полученную смесь (до 800 мкл) на колонку для сорбции и центрифугировать 1 мин при 12 тыс. об. / мин. Еще раз нанести 100 мкл буфера и центрифугировать. Поместить колонку в новую пробирку. 4. Добавить 700 мкл отмывочного буфера и центрифугировать 1 мин при 12 тыс. об. / мин. 5. Нанести в центр колонки 50 мкл отмывочного буфера, подождать 1-2 мин и центрифугировать1 мин при 12 тыс. об. / мин. Отфильтрованный раствор ДНК можно использовать для секвенирования. ПААГ-электрофорез (8% ПААГ – АА:бис-АА как 19:1, 1х-буфер ТВЕ, 300-400 В) 1. После завершения электрофореза и окраски геля вырезать скальпелем или иглой от шприца полосу с целевым ПЦР-продуктом. 2. Измельчить вырезанную полосу геля на дне пробирки 1,5 мл, затем добавить 0,5 мл буфера ТЕ (10 мМ Трис - HCl, 10 мМ ЭДТА, рН 8,0), перемешать на вортексе. 3. Инкубировать при 37°С в течение ночи ( overnight), затем центрифугировать 5 мин при 12 тыс. об. / мин. Перенести супернатант в новую пробирку, добавить 1 / 10 объема 3М ацетата натрия и 2 объема 96%- го этанола или 1,5 объема изопропанола, перемешать на вортексе и инкубировать 20 мин при -20°С. 4. Центрифугировать полученную смесь 15 мин при 12 тыс. об. / мин. Удалить супернатант, не задевая осадка. 4. Высушить осадок, затем растворить его в 20-25 мкл деионизованной воды или ТЕ.
Слайд 13
13 Методы эллюции и очистки ПЦР-продукта (продолжение) График эффективности очистки на silica spin -колонках 1. Растворение LMP- агарозы 1. Вырезать полосу геля, содержащую анализируемый ПЦР-продукт, взвесить. Затем добавить буфер ТЕ, чтобы итоговая концентрация агарозы стала < 0,5%. 2. Довести полученную смесь сухим NaCl до концентрации соли 0,1М. Далее инкубировать при 65°С в течение 10 мин, несколько раз перемешивая (пока гель полностью растворится). 3. Охладить до комнатной температуры и экстрагировать фенол-хлороформным методом. 4. Добавить 10М ацетат аммония в количестве ¼ объема исходной смеси и 2-кратный объем 96%-ого этанола или 1,5-кратный объем изопропанола. Перемешать на вортексе, затем инкубировать 20 мин при -20°С. 5. Центрифугировать полученную смесь 15 мин при 12 тыс. об. / мин. Удалить супернатант, не задевая осадка. Осадок сполоснуть 70%-ым этанолом, высушить. 6. Растворить осадок в деионизованной воде или буфере ТЕ. 2. Выделение ПЦР-продукта из лунки с помощью полиэтиленгликоля. 3. Эллюция ПЦР-продукта из полосы геля с помощью диализного мешка.
Слайд 14
14 Проведение реакции секвенирования Требования некоторых лабораторий к образцам для секвенирования « Синтол »: не менее 10 нг матрицы (очищенный ПЦР-продукт до 500 п.н.), 10 мкл праймера в концентрации 3,2 пмоль / мкл, один анализ – 350 руб. Центр коллективного пользования в ИМБ: очищенный ПЦР-продукт, праймер в количестве 3,2 пмоль на реакцию, цена одного образца – 260 руб. « СибЭнзим »: не менее 2 мкг очищенного ПЦР-продукта, 20 пмоль праймера (для растворов определены минимальные концентрации), один анализ – 900 руб. Постановка реакции: К 3 мкл очищенного ПЦР-продукта добавить 3 мкл деионизованной воды, 2 мкл праймера для секвенирования (концентрация 5 пмоль / мкл) и 3 мкл BigDye ™ Terminator v. 3.1 Kit. Поместить образцы в термоциклер и запустить программу: 96°С – 1 мин 96°С – 10 с 55°С – 5 с 60°С – 4 мин 25 циклов Охлаждение до 4°С Праймера – 3,2 пмоль на реакцию, матрицы – в соответствии с таблицей
Слайд 15
15 Очистка образцов после реакции секвенирования Необходимо избавиться от: невключившихся меченых ddNTPs ионов, которые могут влиять на подвижность меченных фрагментов в капилляре 1. BigDye Xterminator ® Purification Kit Добавить к 10 мкл реакционной смеси 45 мкл реактива SAM, а затем 10 мкл реактива BigDye, перемешивать 30 мин при комнатной температуре. Центрифугировать плашку 1 мин при 3 тыс. об. мин. Образцы готовы для постановки в генетический анализатор. 2. Centri -Sep™ Columns Добавить в колонку 800 мкл деионизованной воды и оставить при комнатной температуре на 30 мин. Центрифугировать колонку 2 мин со скоростью 3 тыс. об. мин., затем поместить колонку в новую пробирку на 1,5 мл. Нанести на сефадекс сверху 10 мкл реакционной смеси, центрифугировать 2 мин со скоростью 3 тыс. об. мин. Отфильтрованный раствор ДНК смешать с 20 мкл HiDi - формамида ( деионизованного ). 3. Осаждение со спиртом Добавить по 2 мкл 125мМ раствора ЭДТА в лунки с реакционной смесью, после того, как раствор ЭДТА достигнет дна лунок, добавить по 2 мкл 3М раствора ацетата натрия, который тоже должен достигнуть дна лунок. Нанести в лунки по 50 мкл 100%- го этанола, перемешать, затем инкубировать при комнатной температуре 15 мин. Центрифугировать при 4°С со скоростью 13 тыс. об. мин. в течение 30 мин. Промыть осадок 70%- ым спиртом, подсушить. Растворить осадок в 10 мкл деионизованной воды.
Слайд 16
16 Автоматические секвенаторы Applied Biosystems 310 Genetic Analyzer – 1 капилляр 3100 Avant Genetic Analyzer и 3130 Genetic analyzer – 4 капилляра 3500 и 3500 Dx Genetic Analyzers – 8 капилляров 3100 и 31 3 0xl Genetic Analyzers – 16 капилляров 3500 xl и 3500xl Dx Genetic Analyzers – 24 капилляра 3730 Genetic Analyzer – 48 капилляров 3730 xl Genetic Analyzer – 96 капилляров Beckman Coulter Seq8000 Genetic Analysis System Amersham
Слайд 18
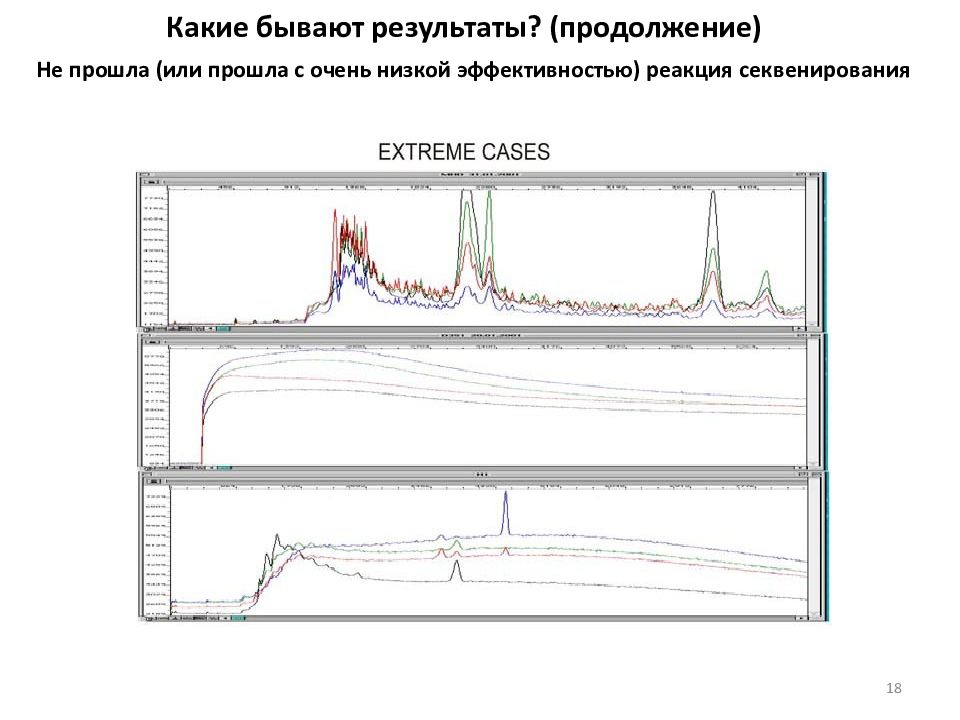
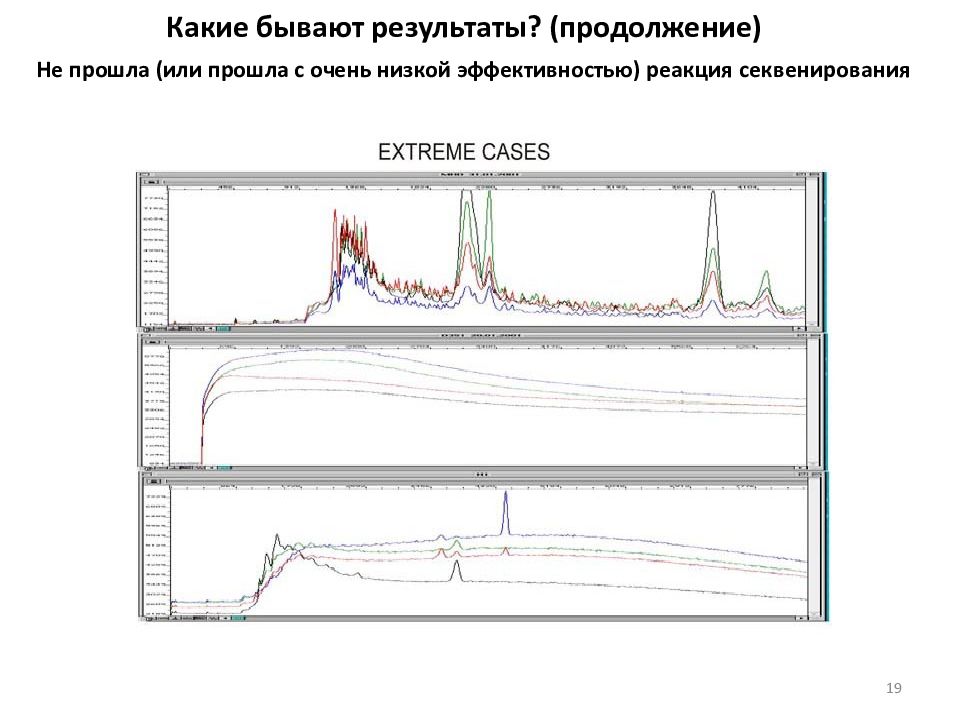
Какие бывают результаты? (продолжение) Не прошла (или прошла с очень низкой эффективностью) реакция секвенирования 18
Слайд 19
Какие бывают результаты? (продолжение) Не прошла (или прошла с очень низкой эффективностью) реакция секвенирования 19
Слайд 20
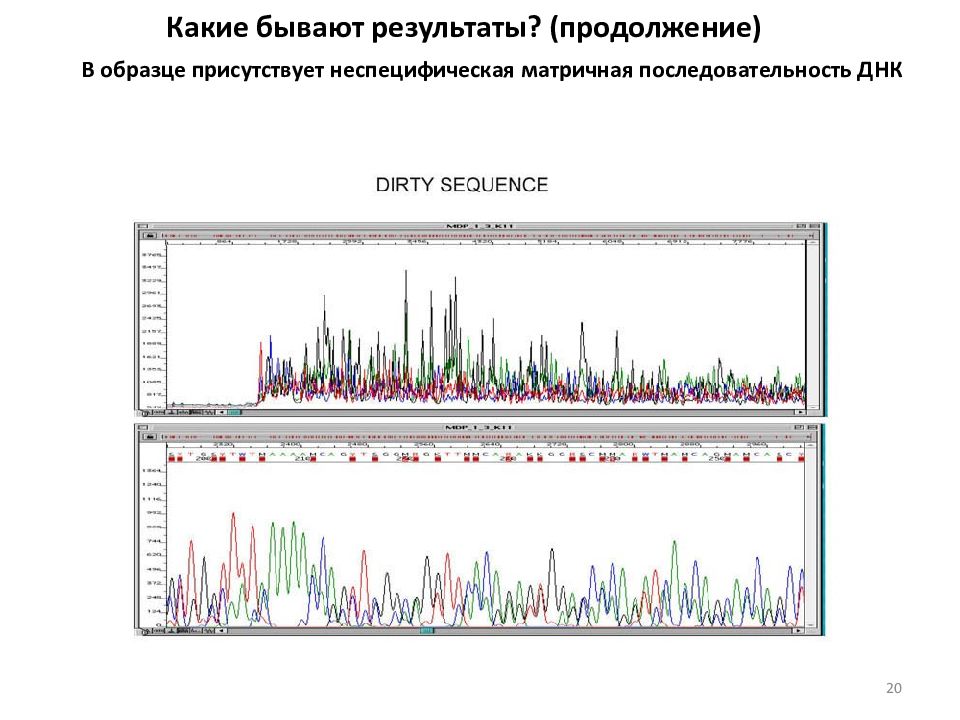
Какие бывают результаты? (продолжение) В образце присутствует неспецифическая матричная последовательность ДНК 20
Слайд 21
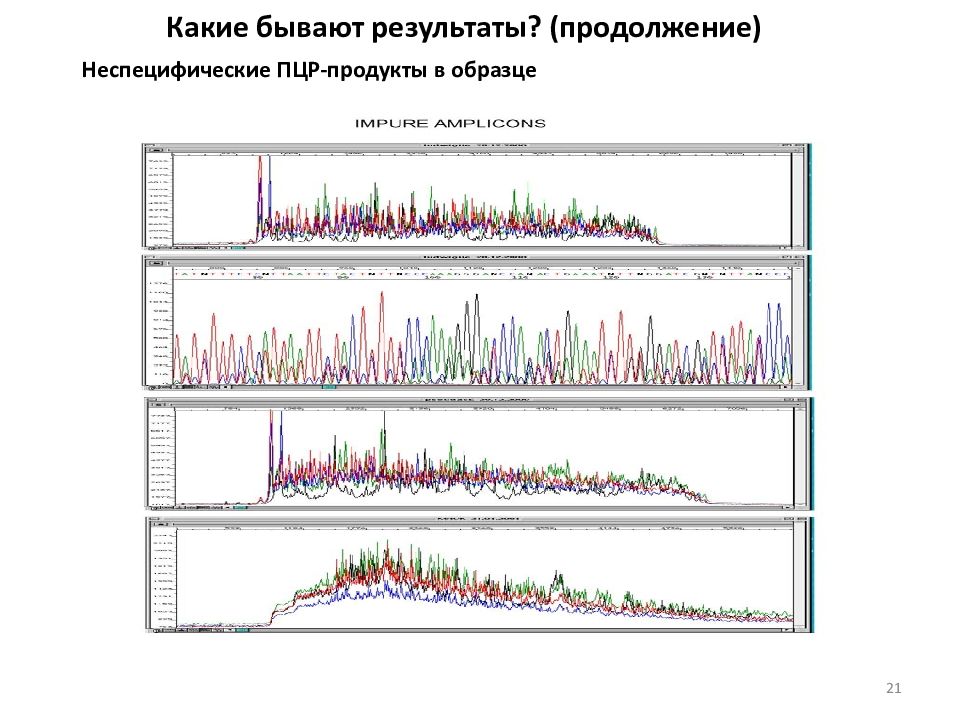
Какие бывают результаты? (продолжение) Неспецифические ПЦР-продукты в образце 21
Слайд 22
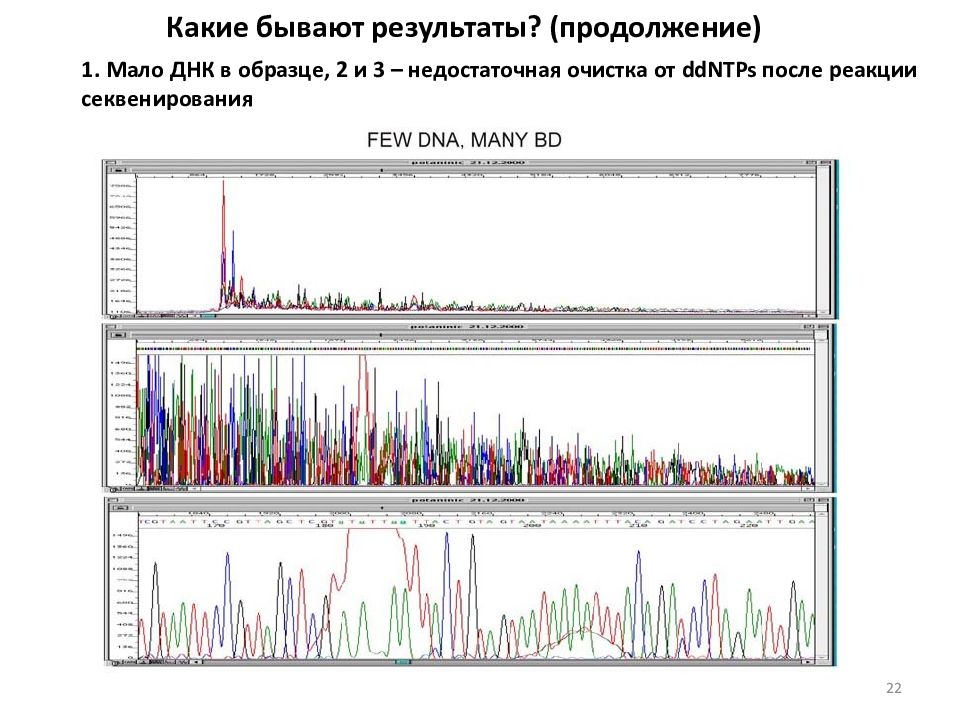
Какие бывают результаты? (продолжение) 1. Мало ДНК в образце, 2 и 3 – недостаточная очистка от ddNTPs после реакции секвенирования 22
Слайд 23
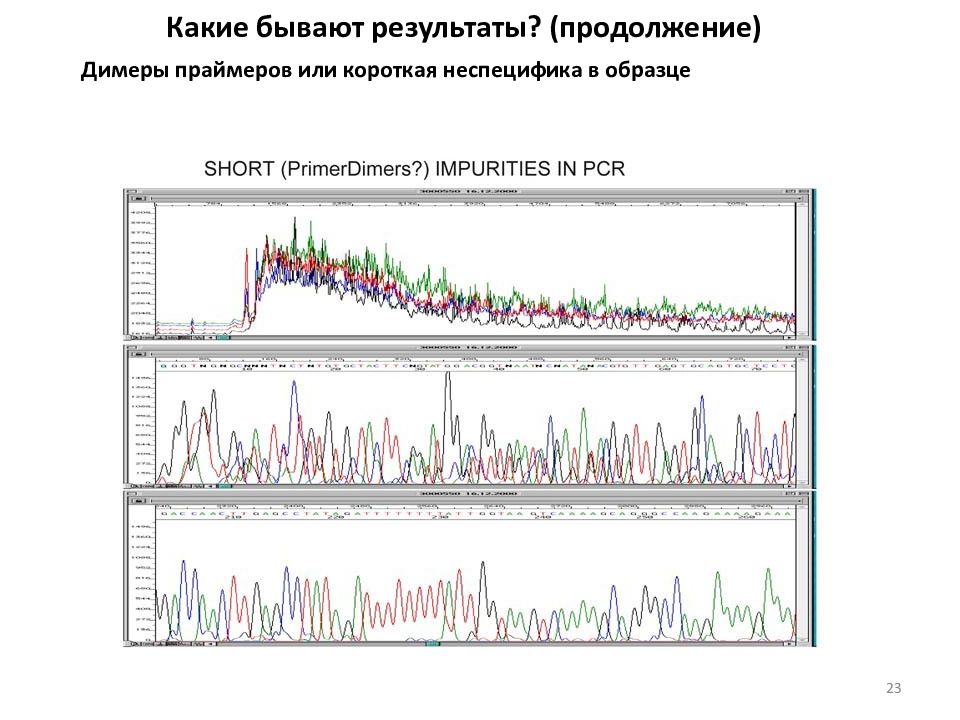
Какие бывают результаты? (продолжение) Димеры праймеров или короткая неспецифика в образце 23
Слайд 24
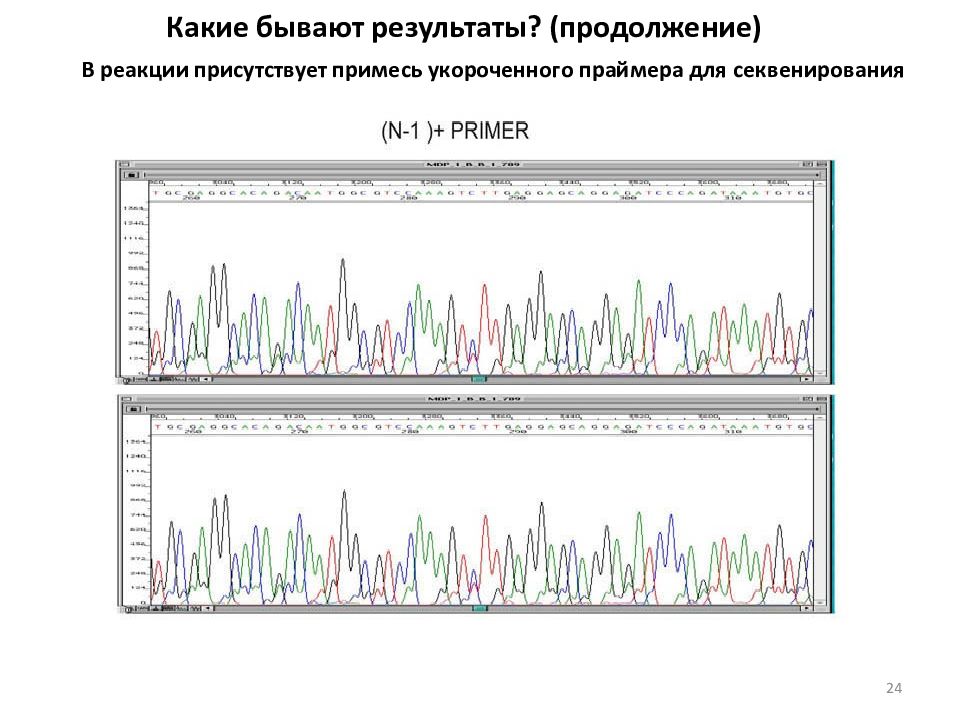
Какие бывают результаты? (продолжение) В реакции присутствует примесь укороченного праймера для секвенирования 24
Слайд 25
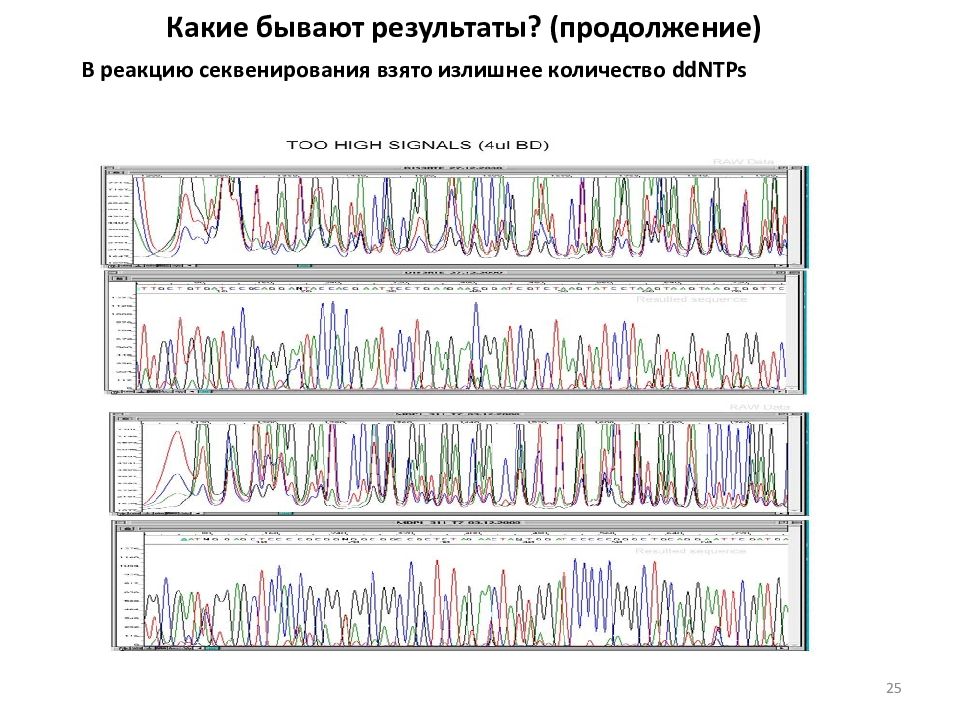
Какие бывают результаты? (продолжение) В реакцию секвенирования взято излишнее количество ddNTPs 25
Слайд 27
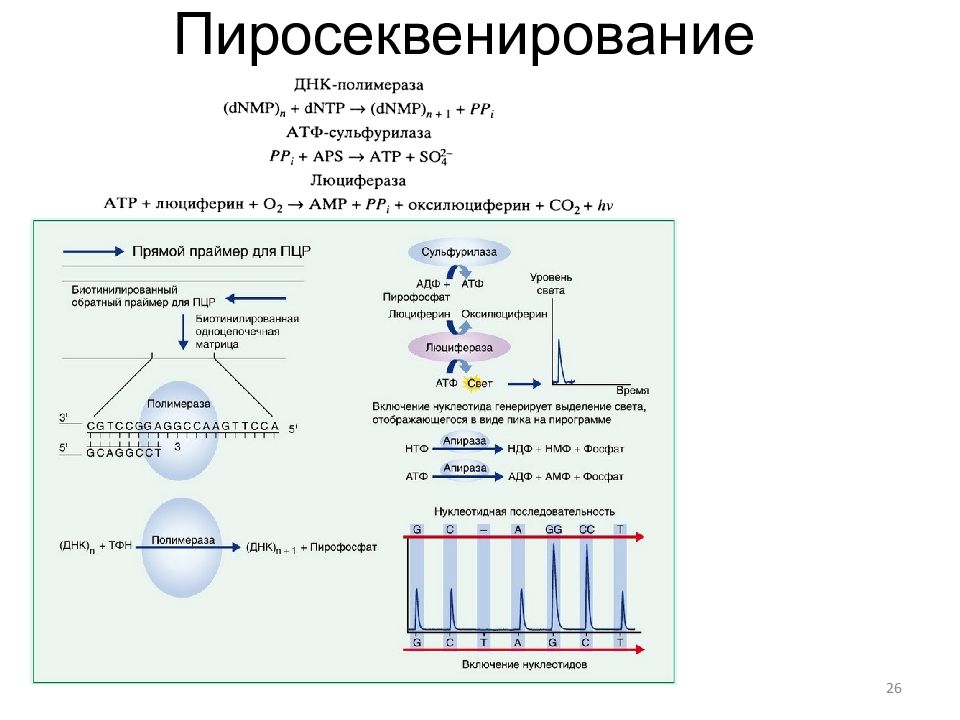
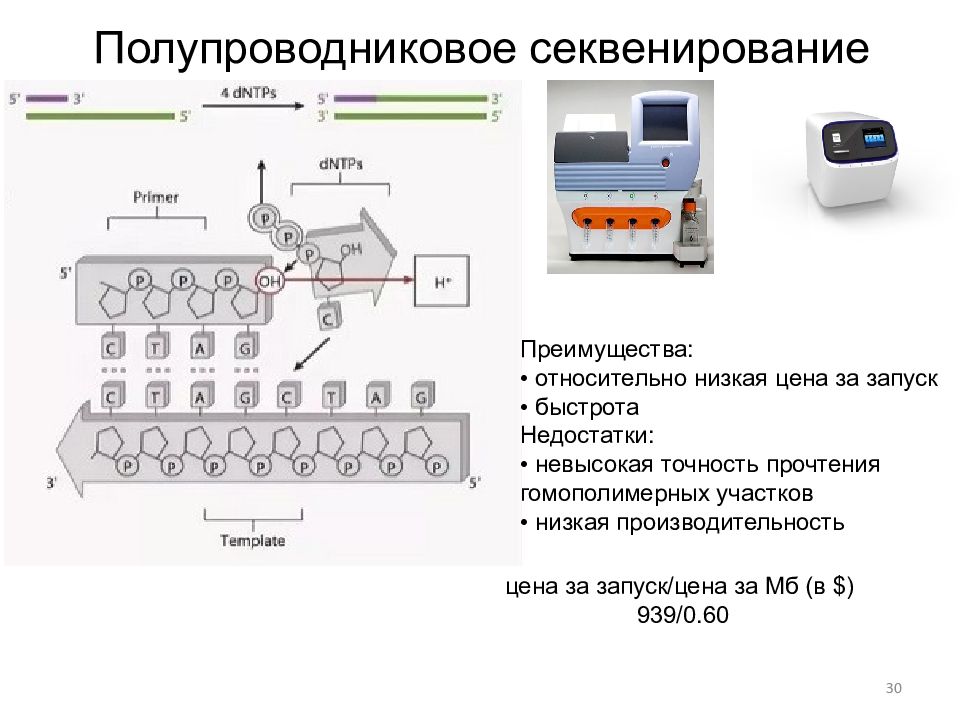
27 Современное пиросеквенирование ( Roche) Существенной особенностью более сложной технологии, разработанной компанией "454 Life Sciences ", является использование эмульсионной ПЦР для одновременной параллельной подготовки сотен тысяч препаратов ДНК к секвенированию. Такая пробоподготовка состоит из следующих этапов: ультразвуковая фрагментация ( небулизация ) анализируемой ДНК; пришивка адапторов и денатурация ДНК; получение эмульсии, содержащей в микрокаплях единичные фрагменты ДНК и полистирольные шарики с пришитым праймером ; проведение эмульсионной ПЦР ( emPCR ); отмывка микрошариков от реагентов и удаление несвязянных с шариками нитей ДНК; загрузка шариков в лунки проточной камеры; загрузка лунок микрошариками с иммобилизованными ферментами При пропускании реагентов через проточную ячейку регистрируются люминесцентные сигналы, излучаемые сотнями тысяч микролунок. На димерных, тримерных и тетрамерных нуклеотидных повторах интенсивность сигналов пропорционально увеличивается. Протяжённость секвенируемых участков ДНК может превышать 100 оснований
Слайд 28
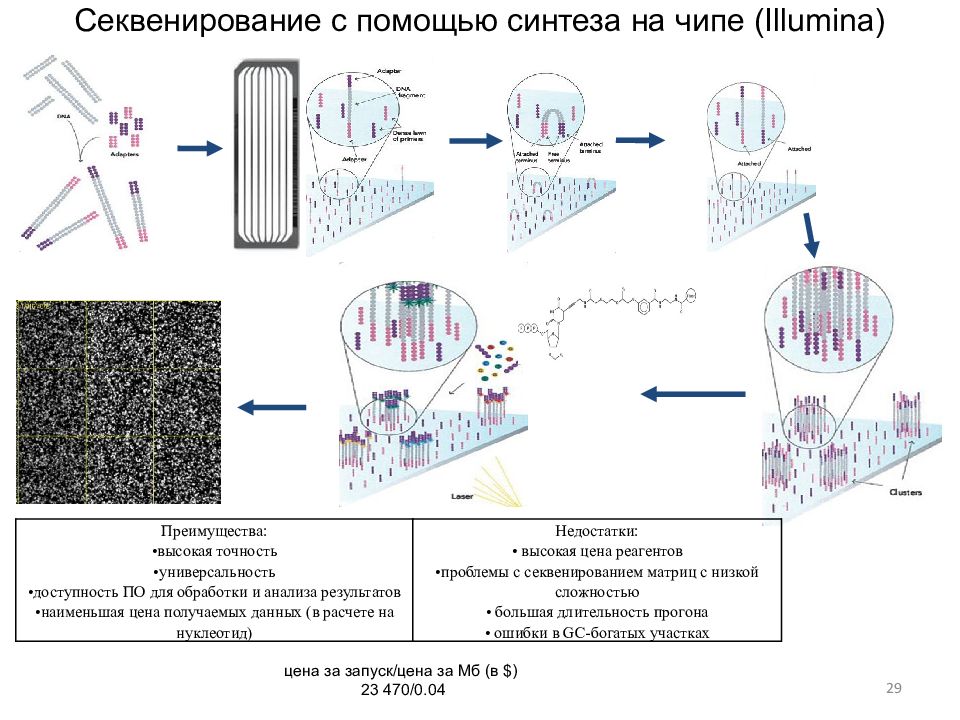
28 Секвенирование SOLID с помощью лигирования Преимущества: • высокая точность •возможность использовать часть дорожек на ячейке Недостатки : •очень короткие чтения •длительность работы •относительно малая доступность свободного ПО
29 Преимущества: •высокая точность •универсальность •доступность ПО для обработки и анализа результатов •наименьшая цена получаемых данных (в расчете на нуклеотид) Недостатки : • высокая цена реагентов •проблемы с секвенированием матриц с низкой сложностью • большая длительность прогона • ошибки в GC -богатых участках цена за запуск/цена за Мб (в $) 23 470/0.04