Первый слайд презентации: Молекулярно-генетические методы диагностики наследственных заболеваний
Слайд 2: Прямая ДНК - диагностика
В ыявляются нарушения в первичной нуклеотидной последовательности ДНК (мутации и их типы). Прямые методы отличаются точностью, достигающей почти 100 %. Должна быть известна цитогенетическая локализация гена, ответственного за развитие наследственного заболевания. Д олжна быть известна его нуклеотидная последовательность.
Слайд 3: Косвенная ДНК - диагностика
О снованы на анализе сцепления с исследуемым геном определенного полиморфного локуса (маркера), с помощью которого можно производить маркировку как мутантных, так и нормальных аллелей и проанализировать их передачу в поколениях. Используется при заболеваниях, ген которых достаточно точно картирован, т.е. локализован в конкретном узком участке определенной хромосомы.
Слайд 4: Выделение ДНК
Лизис клеток Удаление фрагментов клеточных органелл и мембран Ферментативное разрушение и экстрагирование белков Осаждение молекул ДНК Растворение ДНК в буферном растворе
Слайд 6
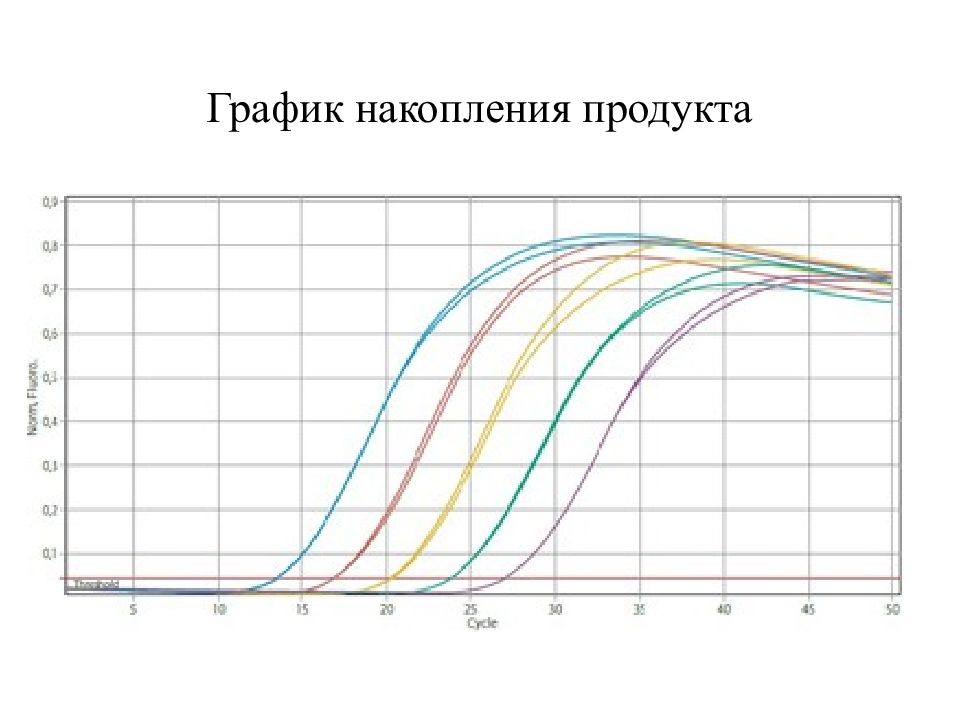
Полимеразная цепная реакция (ПЦР) – молекулярно-биологический метод, позволяющий нарабатывать « in vitro » определенный участок молекулы ДНК практически в неограниченных количествах.
Слайд 7: Основа метода:
Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях ( in vitro ). При этом происходит копирование только того участка, который удовлетворяет заданным условиям. С помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований.
Слайд 8: Применение метода:
Создание рекомбинантных ДНК Исследование мутагенеза Диагностика заболеваний (наследственных, инфекционных) HLA -типирование Установление отцовства Клонирование генов Выделение новых генов Как этап других методов
Слайд 9: Преимущества метода ПЦР
Универсальность метода Высокая специфичность Высокая чувствительность Маленький объём биоматериала Высокая скорость получения результата
Слайд 10: Материал, используемый для ПЦР:
кровь соскобы эпителиальных клеток плевральная и спинномозговая жидкости моча, кал мокрота, слизь другие биологические выделения, биоптаты
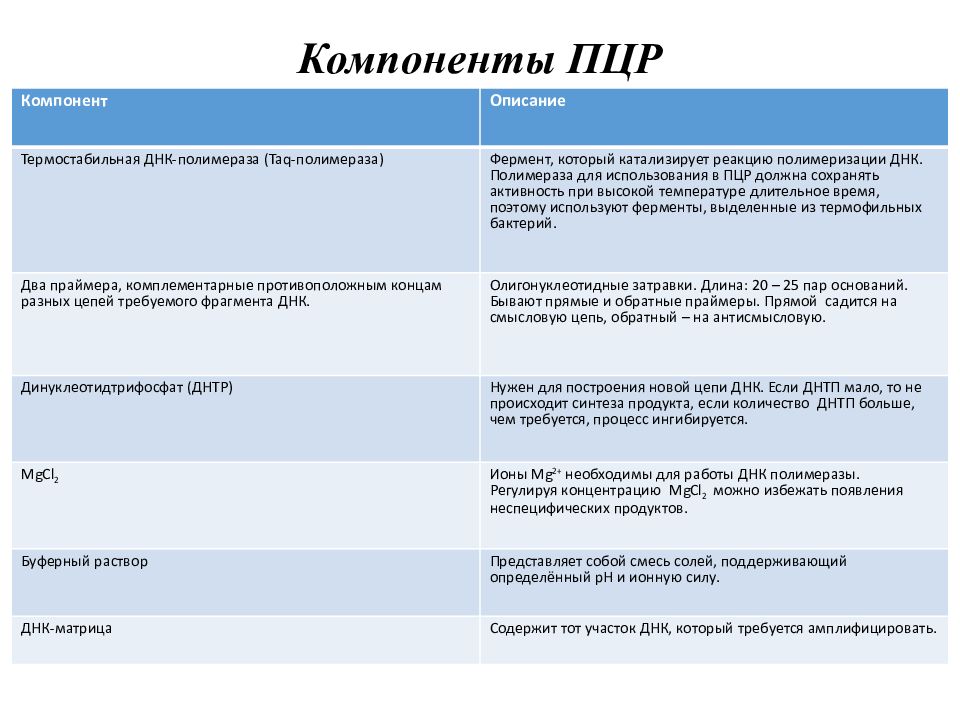
Слайд 11: К омпоненты ПЦР
Компонент Описание Термостабильная ДНК-полимераза ( Taq - полимераза) Фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофильных бактерий. Два праймера, комплементарные противоположным концам разных цепей требуемого фрагмента ДНК. Олигонуклеотидные затравки. Длина: 20 – 25 пар оснований. Бывают прямые и обратные праймеры. Прямой садится на смысловую цепь, обратный – на антисмысловую. Динуклеотидтрифосфат (ДНТР) Нужен для построения новой цепи ДНК. Если ДНТП мало, то не происходит синтеза продукта, если количество ДНТП больше, чем требуется, процесс ингибируется. MgCl 2 Ионы Mg 2+ необходимы для работы ДНК полимеразы. Регулируя концентрацию MgCl 2 можно избежать появления неспецифических продуктов. Буферный раствор Представляет собой смесь солей, поддерживающий определённый рН и ионную силу. ДНК-матрица Содержит тот участок ДНК, который требуется амплифицировать.
Слайд 12: Подбор праймеров
Размер праймера должен быть 16-25 нуклеотидов. Разница в температуре плавления праймеров - не более 6 градусов Ц+Г должно быть 50-60 % Для улучшения качества отжига рекомендуется подбирать праймеры так, чтобы последние несколько нуклеотидов 3' - конца праймера содержали GC-основания Отсутствие внутренней вторичной структуры ( праймеры не должны быть само- и взаимнокомплиментарными ) Отсутствие комплементарности между 3'-концами (чтобы не образовывалось праймер-димеров ) Область отжига праймеров должна находиться вне зон мутаций, делеций или инсерций в пределах видовой или иной, взятой в качестве критерия при выборе праймеров, специфичности.
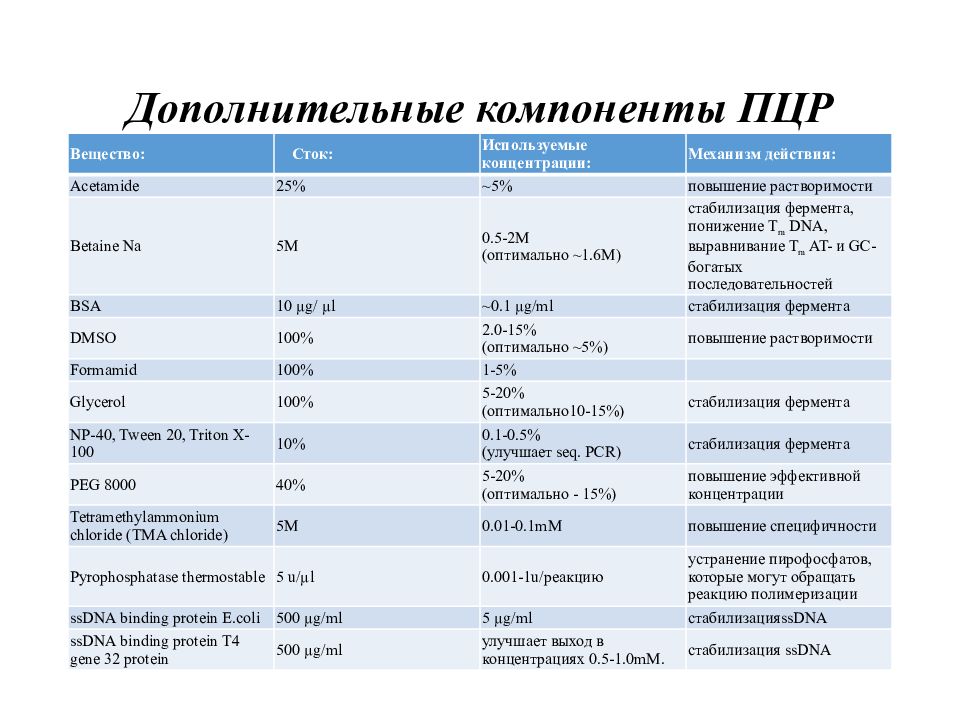
Слайд 14: Дополнительные компоненты ПЦР
Вещество: Сток: Используемые концентрации: Механизм действия: Acetamide 25% ~5% повышение растворимости Betaine Na 5M 0.5-2M ( оптимально ~1.6 M) стабилизация фермента, понижение T m DNA, выравнивание T m AT- и GC-богатых последовательностей BSA 10 µg/ µl ~0.1 µg/ml стабилизация фермента DMSO 100% 2.0-15% (оптимально ~5%) повышение растворимости Formamid 100% 1-5% Glycerol 100% 5-20% (оптимально10-15%) стабилизация фермента NP-40, Tween 20, Triton X-100 10% 0.1-0.5% (улучшает seq. PCR) стабилизация фермента PEG 8000 40% 5-20% (оптимально - 15%) повышение эффективной концентрации Tetramethylammonium chloride (TMA chloride) 5M 0.01-0.1mM повышение специфичности Pyrophosphatase thermostable 5 u/µl 0.001-1u/ реакцию устранение пирофосфатов, которые могут обращать реакцию полимеризации ssDNA binding protein E.coli 500 µg/ml 5 µg/ml стабилизация ssDNA ssDNA binding protein T4 gene 32 protein 500 µg/ml улучшает выход в концентрациях 0.5-1.0mM. стабилизация ssDNA
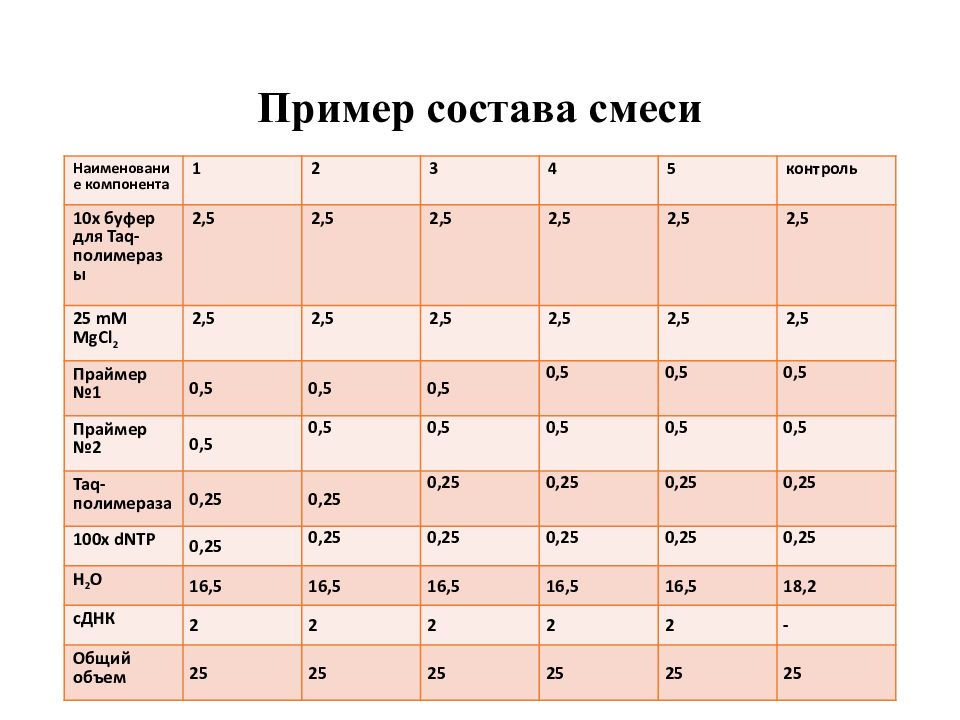
Слайд 15: Пример состава смеси
Наименование компонента 1 2 3 4 5 контроль 10x буфер для Taq-полимеразы 2,5 2,5 2,5 2,5 2,5 2,5 25 mM MgCl 2 2,5 2,5 2,5 2,5 2,5 2,5 Праймер №1 0,5 0,5 0,5 0,5 0,5 0,5 Праймер №2 0,5 0,5 0,5 0,5 0,5 0,5 Taq-полимераза 0,25 0,25 0,25 0,25 0,25 0,25 100х dNTP 0,25 0,25 0,25 0,25 0,25 0,25 Н 2 О 16,5 16,5 16,5 16,5 16,5 18,2 сДНК 2 2 2 2 2 - Общий объем 25 25 25 25 25 25
Слайд 16: Оборудование для ПЦР
Слайд 17: Приборы для пцр
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», и последующего хранения амплифицированных молекул при 4 °C.
Слайд 19: 1. Денатурация
Двухцепочечную ДНК-матрицу нагревают до 94—96 °C (или до 98 °C, если используется особенно термостабильная полимераза) на 0,5—2 мин., чтобы цепи ДНК разошлись. На этой стадии разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2—5 мин. для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции.
Слайд 20: 2. Отжиг
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Температура отжига зависит от состава праймеров. Время стадии — 0,5—2 мин. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре).
Слайд 21: 3. Элонгация
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы в направлении от 3' к 5'. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7-10 мин.
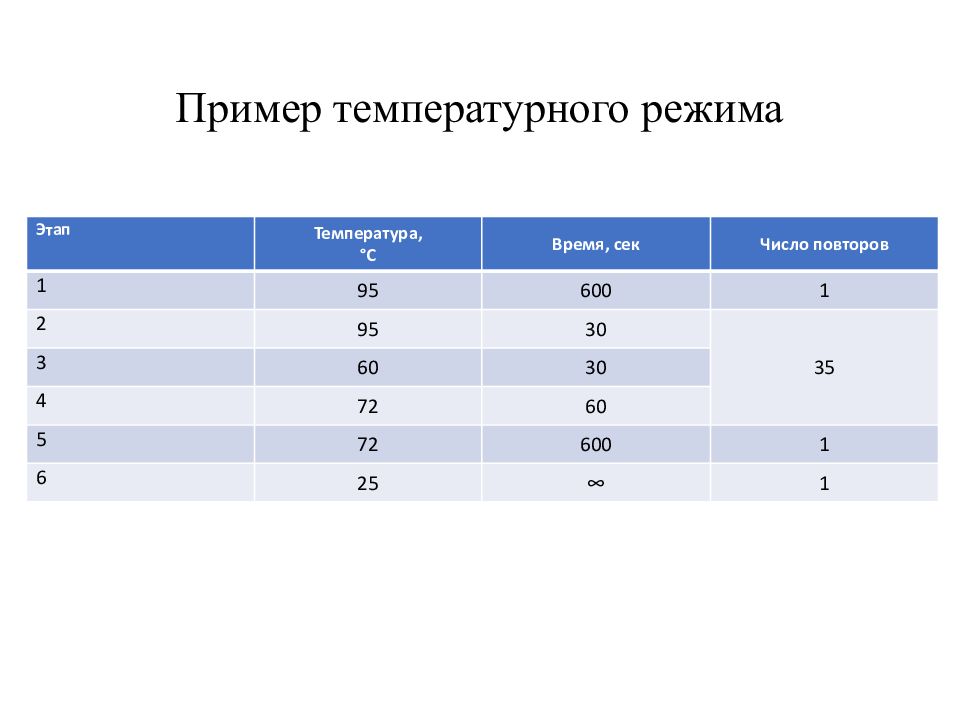
Слайд 22: Пример температурного режима
Этап Температура, °С Время, сек Число повторов 1 95 600 1 2 95 30 35 3 60 30 4 72 60 5 72 600 1 6 25 ∞ 1
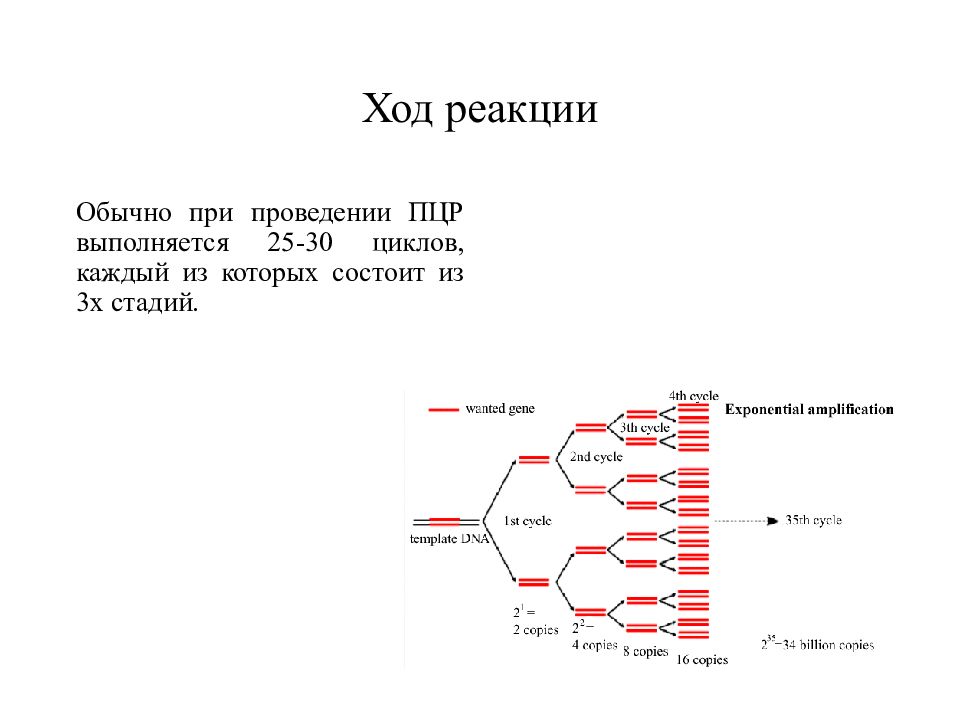
Слайд 23: Ход реакции
Обычно при проведении ПЦР выполняется 25-30 циклов, каждый из которых состоит из 3х стадий.
Слайд 25: Виды ПЦР
Вложенная ПЦР Инвертированная ПЦР ПЦР с обратной транскрипцией Асимметричная ПЦР Количественная ПЦР в реальном времени Метод молекулярных колоний Геликазно-зависимая амплификация ПЦР длинных фрагментов Случайная амплификация полиморфной ДНК Мультиплексная ПЦР
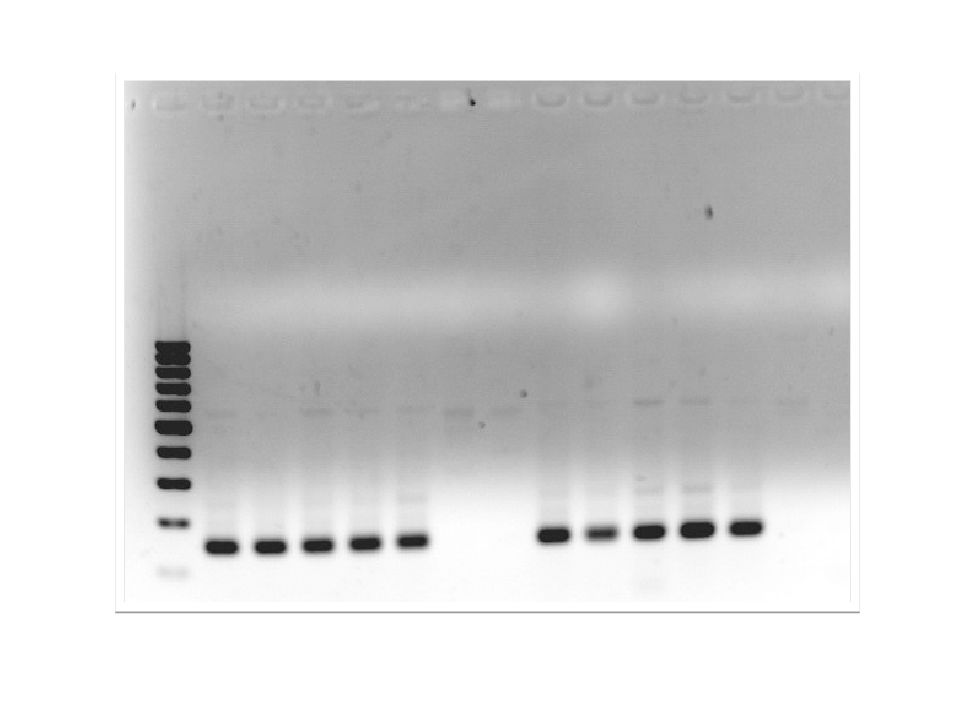
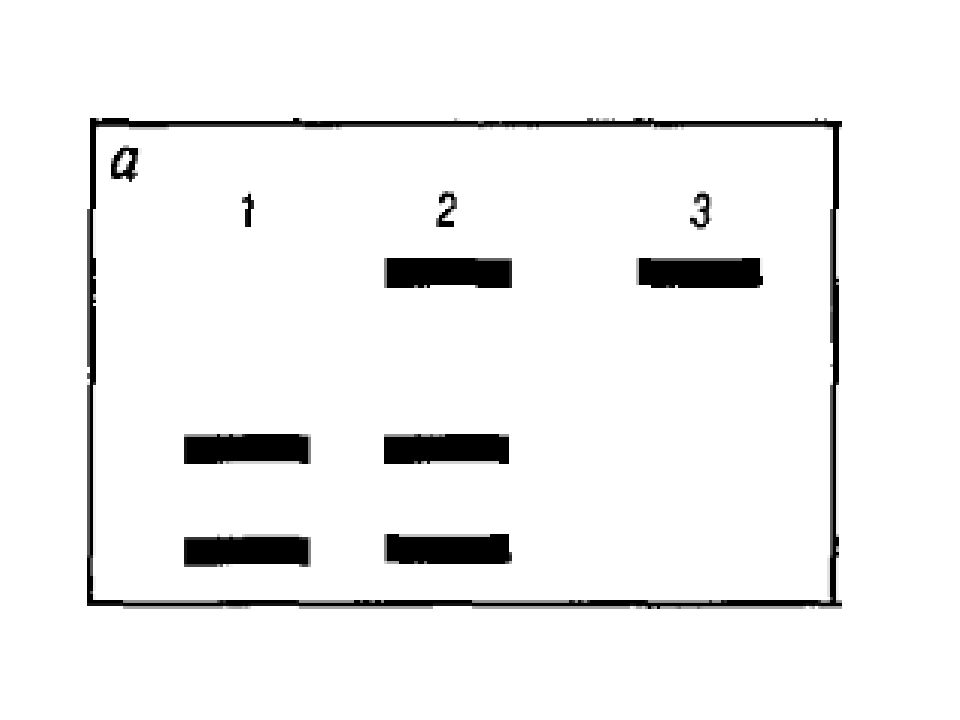
Слайд 26: Электрофорез
Электрофорез – метод разделения макромолекул, различающихся по таким параметрам, как размеры (или молекулярная масса), пространственная конфигурация, вторичная структура и электрический заряд. Агарозный гель Полиакриламидный гель
Слайд 30: Методы выявления мутаций
ПЦР SSCP (анализ полиморфизма одноцепочечной ДНК) Гетеродуплексный анализ Денатурирующий градиентный гель - электрофорез
Слайд 31: Анализ одноцепочечного конформационного полиморфизма (SSCP)
Амплификация фрагментов гена Денатурация Электрофорез SSCP-анализ применяется для выявления таких мутаций, как замена оснований, малые инсерции и делеции, различные перестройки и наиболее пригоден для анализа относительно коротких (200-300 п.н.) фрагментов ДНК.
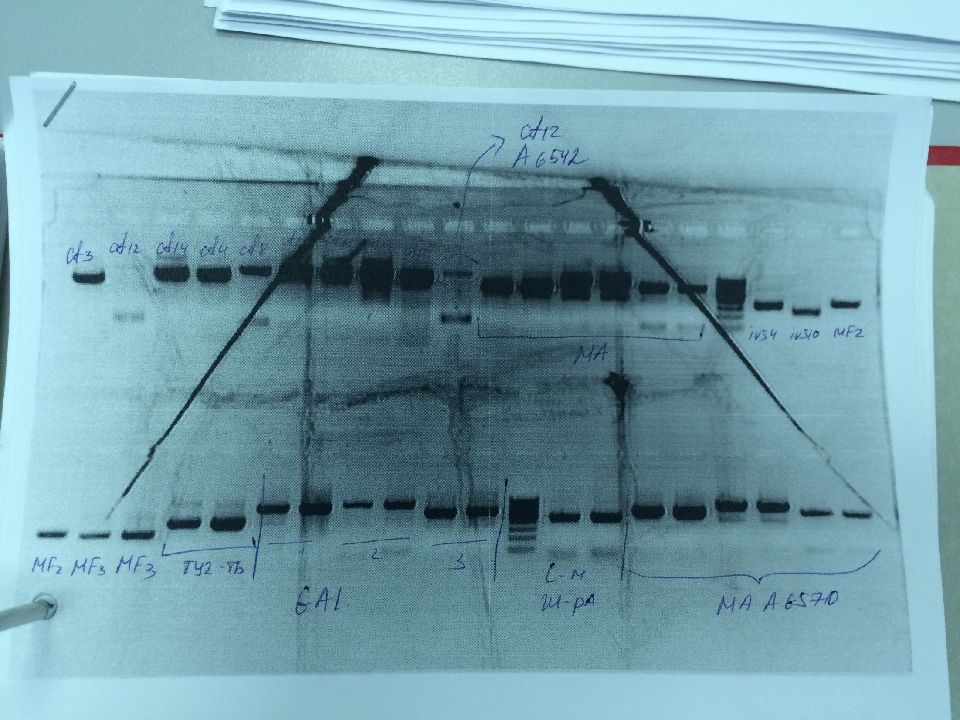
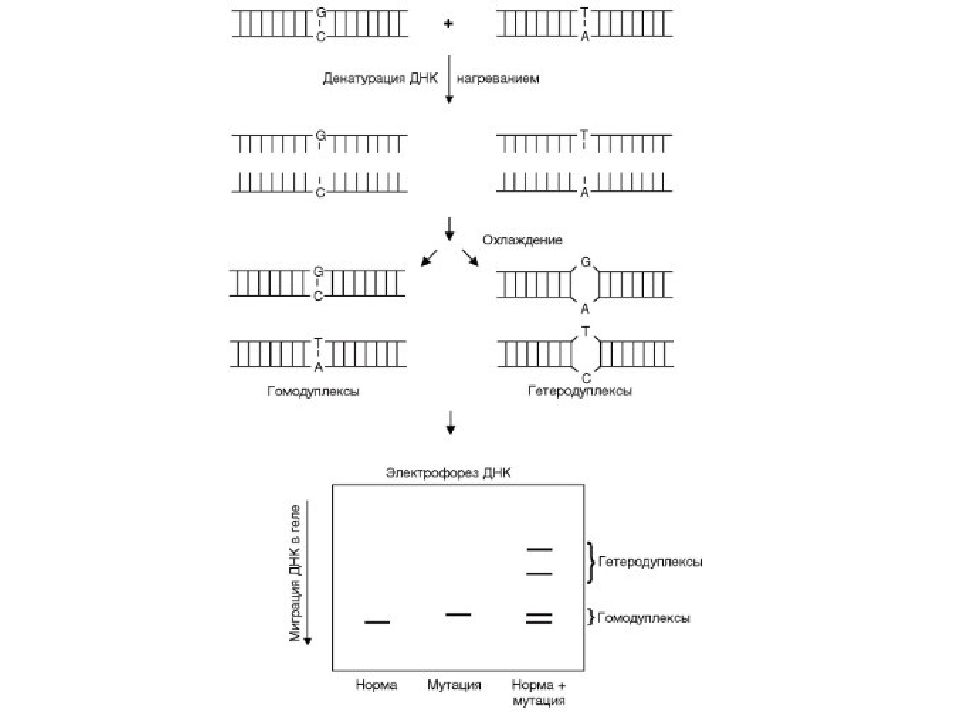
Слайд 32: Гетеродуплексный анализ
П озволяет выявлять мутации, находящиеся в гетерозиготном состоянии, а также инсерции и делеции. Амплификация фрагментов Денатурация Ренатурация
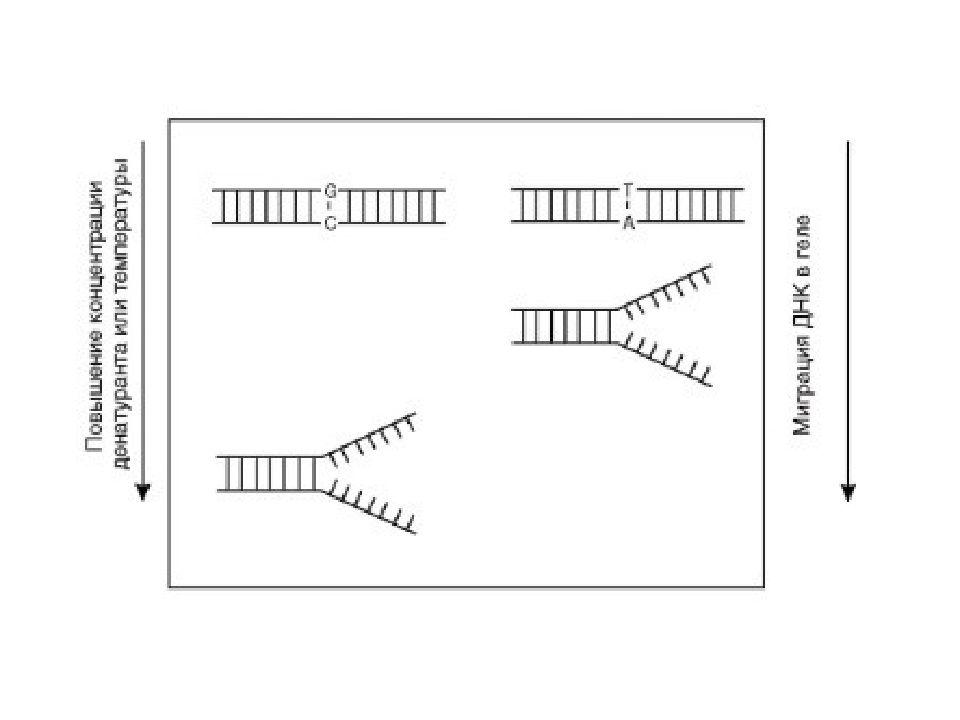
Слайд 34: Д енатурирующий градиентный гель-электрофорез
ДНК-дуплексы подвергаются миграции в геле с градиентом денатурирующих. Миграция продолжается до тех пор, пока ДНК-дуплексы не достигают в геле точки плавления и не разделяются, после чего миграция фрагментов останавливается. Однонуклеотидные различия в нормальной и тестируемой ДНК выявляются по различной электрофоретической подвижности в геле.
Слайд 36: Рестрикционный анализ
Рестриктазы, или рестрикционные эндонуклеазы, - ферменты, обладающие эндонуклеазной активностью и участвующие в системе распознавания и защиты «своих» и уничтожения чужеродных ДНК in vivo. Длина распознаваемого участка варьирует от 4 до 12 нуклеотидов. Р естриктаза разрезает молекулу ДНК на фрагменты в сайтах рестрикции. Чем больше сайтов рестрикции, тем больше образуется рестрикционных фрагментов. Образующиеся в результате рестрикции фрагменты ДНК могут быть упорядочены по длине путем электрофореза в агарозном или полиакриламидном геле в зависимости от их молекулярной массы. Зная молекулярную массу фрагментов, можно определить физическое расстояние между сайтом рестрикции и концами исходного фрагмента ДНК, что является основой метода, получившего название физического картирования.
Слайд 37: ПДРФ - анализ
Мутации, возникающие в участках узнавания определённых рестриктаз, делают эти участки ДНК нечувствительными к действию ферментов. Это может быть легко обнаружено по изменению длины рестрикционных фрагментов ДНК. Этапы: В ыделение ДНК Амплификация Р естрикцию специфической эндонуклеазой Э лектрофоретическое разделение образующихся фрагментов ДНК И дентификацию этих фрагментов путём блот -гибридизации по Саузерну
Слайд 39: Секвенирование
Секвенирование - это общее название методов, которые позволяют установить последовательность нуклеотидов в молекуле ДНК. В результате секвенирования получают формальное описание первичной структуры линейной макромолекулы в виде последовательности мономеров в текстовом виде. Размеры секвенируемых участков ДНК обычно не превышают 100 - 1000 пар нуклеотидов.
Слайд 40: Метод Сэнгера основан на синтезе изучаемой цепи ДНК in vitro с остановкой синтеза на заданном основании путем присоединения дидезоксинуклеотида. Дидезоксинуклеотид лишен гидроксильных групп при атомах сахарного кольца не только в 2'-, но и в 3'-положении, что делает его неспособным формировать фосфодиэфирную связь со следующим нуклеотидом
Для проведения секвенирования необходимы: 1 ) секвенирующий праймер (искусственно синтезированная олигонуклеотидная последовательность, комплементарная определенному участку исходной молекулы ДНК ) 2) набором из четырех дезоксинуклеотидов dATP, dCTP, dGTP и dTTP, один из которых изотопно меченный 3) один из четырех дидезоксинуклеотидов ( ddATP, ddCTP, ddGTP и ddTTP ) 4) ДНК-полимераза
Слайд 41: Этапы
1) гибридизация изучаемого фрагмента ДНК с праймером 2) ферментативный синтез ДНК 3) денатурация полученных продуктов формамидом (в результате образуются уникальные различающиеся по длине олигонуклеотидные последовательности, содержащие праймер ) 4) электрофорез в полиакриламидном геле на четырех дорожках (по числу типов нуклеотидов) 5) анализ результатов на радиоавтографе. На большинстве радиоавтографов можно четко различить 250—350 полос, т.е. прочитать последовательность в 250-350 п.н.
Слайд 42: Секвенирование нового поколения (NGS)
Исследуемый образец ДНК разрезают на кусочки подходящего размера ( ок. 800 пар оснований), используя пневматическое устройство под названием небулайзер. Концы ДНК зачищаются и два уникальных адаптера присоединяются к фрагментам. Амплификация фрагментов С интез новых фрагментов ДНК на одноцепочечных ДНК-библиотеках, которые выполняют роль матрицы. Нуклеотиды встраиваются в новую цепь в определенном порядке, соответствующем матричной цепи, который записывается в цифровом виде. После включения в цепь каждого последующего нуклеотида прибор регистрирует сигнал. Анализ полученных данных
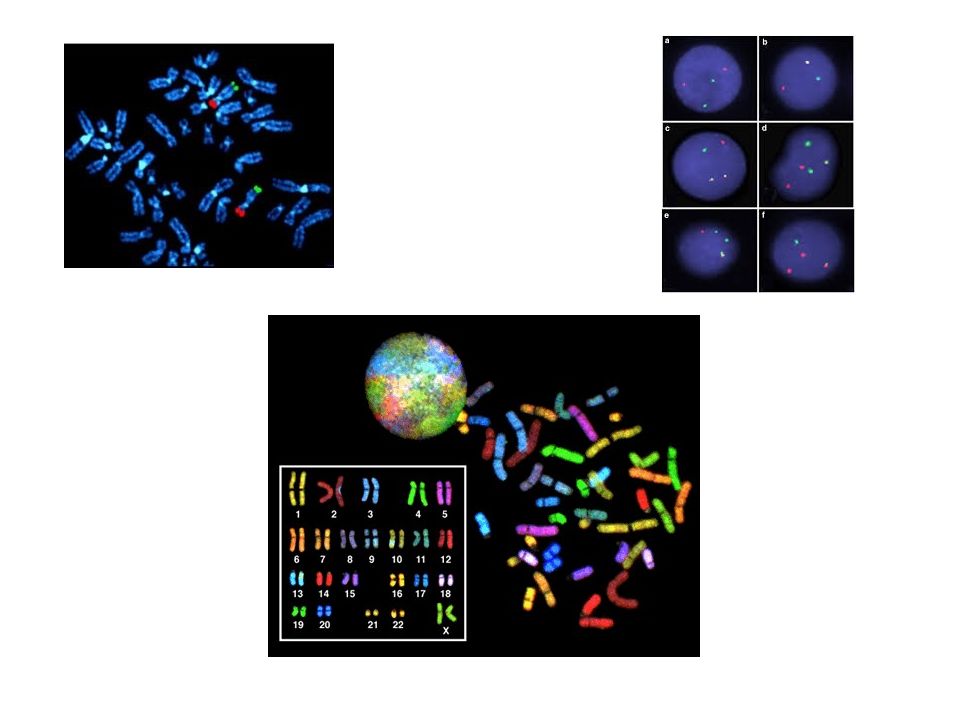
Слайд 43: Флуоресцентная гибридизация in situ (FISH)
В основе FISH-метода лежит реакция гибридизации между искусственно созданным ДНК-зондом и комплементраной ему нуклеотидной последовательностью ядерной ДНК. Объектом исследования являются уникальные нуклеотидные последовательности конкретной хромосомы или ее отдельного участка. FISH метод позволяет оценить генетический статус отдельной клетки и выявить, к примеру, несколько этиопатогенетически значимых аномальных клеток среди тысяч других с нормальным генотипом.
Слайд 44: Виды зондов
локус-специфичные зонды, связывающиеся с определенными участками хромосом. Данные зонды используются для идентификации имеющейся короткой последовательности выделенной ДНК, которая используется для приготовления меченого зонда и его последующей гибридизации с набором хромосом, альфоидные или центромерные зонды-повторы представляют собой повторяющиеся последовательности центромерных областей хромосом. С их помощью каждая хромосома может быть окрашена в различный цвет, что позволяет быстро определить число хромосом и отклонения от нормального их числа, зонды на всю хромосому являются набором небольших зондов, комплементарных к отдельным участкам хромосомы, но в целом покрывающими всю ее длину. Используя библиотеку таких зондов можно "раскрасить" всю хромосому и получить дифференциальный спектральный кариотип индивида. Данный тип анализа применяется для анализа хромосомных аберраций, например транслокаций, когда кусочек одной хромосомы переносится на плечо другой.
Слайд 45: Этапы метода
1. Подготовка гистологического или цитологического препарата. 2. Предварительная обработка Препарат обрабатывается протеазами, чтобы исключить присутствие белков, которые затрудняют гибридизацию. 3. Нанесение ДНК-зонда на препарат и последующая денатурация. Для того, чтобы денатурировать зонд и ДНК образца, их обрабатывают формамидом и нагревают до температуры около 85-90°С. 4. Гибридизация. После денатурации препарат охлаждают до определенной температуры (37°С в случае клинических исследований) и инкубируют во влажной камере в течение нескольких часов. 5. Промывка. После того, как гибридизация завершена, необходимо отмыть несвязавшиеся зонды, которые, в противном случае, создадут фон, затрудняющий оценку результатов FISH-анализа. Для промывки обычно используют раствор, содержащий цитрат и хлорид натрия (SSC). 6. Контр-окрашивание. При помощи флуоресцентных красителей (DAPI - 4,6-диамидин-2-фенилиндол; йодид пропидия ) проводится окраска всей ядерной ДНК. 7. Анализ результатов при помощи флуоресцентного микроскопа.
Последний слайд презентации: Молекулярно-генетические методы диагностики наследственных заболеваний: Картирование генов
Картирование генов - определение положения данного гена на какой-либо хромосоме относительно других генов. Виды картирования: Физическое Цитогенетическое Генетическое