Первый слайд презентации: ПРИНЦИПЫ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ
Слайд 2: Лабораторная диагностика инфекционных заболеваний основана на обнаружении в организме больного:
микроорганизма, вызвавшего болезнь, микробных компонентов (антигенов, генетического материала), продуктов жизнедеятельности (токсинов и др.), изменений в показателях гомеостаза под действием этого микроба (например, формулы крови, биохимического состава крови и др.).
идентифицировать микроорганизмы в исследуемом материале, определить их видовую принадлежность, морфологические, биохимические, токсигенные и антигенные свойства, установить чувствительность выделенных микроорганизмов к антимикробным препаратам.
Слайд 4: Основная цель МД:
Установить факт наличия (отсутствия) возбудителя в организме больного или объекте окружающей среды
Слайд 5: Показатели присутствия возбудителя:
Обнаружение микроба, вызвавшего болезнь микробных компонентов (антигенов и генетической информации) продуктов их жизнедеятельности (токсинов) специфических защитных факторов макроорганизма (антител)
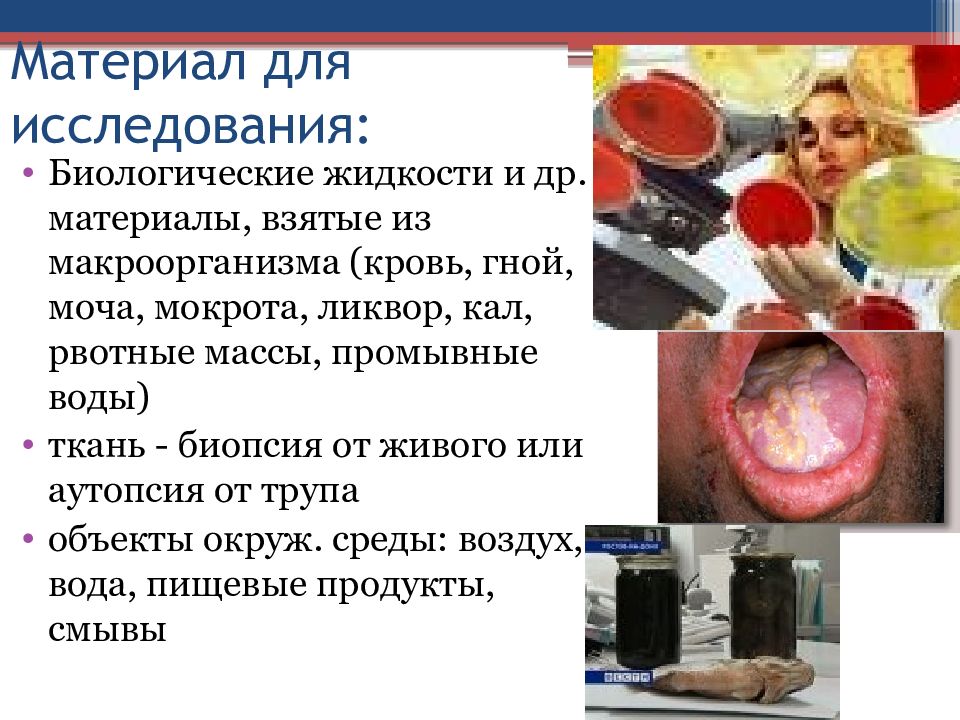
Слайд 6: Материал для исследования:
Биологические жидкости и др. материалы, взятые из макроорганизма (кровь, гной, моча, мокрота, ликвор, кал, рвотные массы, промывные воды) ткань - биопсия от живого или аутопсия от трупа объекты окруж. среды: воздух, вода, пищевые продукты, смывы
Слайд 7: Правила забора материала
Вид материала определяется клинической картиной болезни, т.е. он должен соответствовать предполагаемой локализации возбудителя на данном этапе патогенеза Количество материала должно быть достаточным для проведения исследований и их повторения по возможности материал берут в начальном периоде болезни (типичная локализация) забор материала проводят до антимикробной химиотерапии или после выделения препарата Материал берут непосредственно из очага инфекции в момент наибольшего содержания в нем возбудителя Забор проводят в асептических условиях для предупреждения контаминации
Слайд 8: Любой клинический материал потенциально опасен
Правила биологической безопасности: максимально короткие сроки передачи материала для исследований специальные транспортные среды обязательные сопроводительные документы предупреждение попадания в материал антимикробных факторов - дезинфектантов, антибиотиков, антисептиков
Слайд 9: В процессе транспортировки
Оберегать от действия света, тепла, холода, механических повреждений в специальных изотермических контейнерах с их последующим обезззараживанием
Слайд 10: Методы микробиологической диагностики
Бактериоскопический (микроскопический) Бактериологический (культуральный) Биологический Серологический Аллергический Молекулярно-генетический (гено-индикаторный)
Слайд 12: Используется для предварительного диагноза:
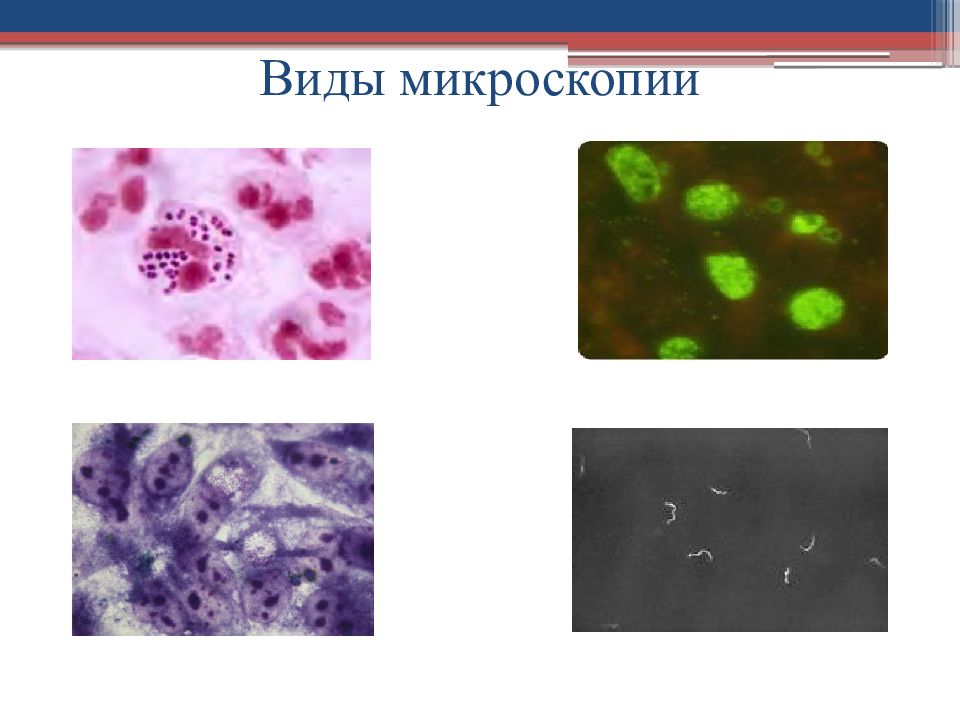
На основании морфологических особенностей : формы, наличия капсул, спор, жгутиков, особенностей строения клеточной стенки, особенностей химического состава, локализации в тканях и т.п. Используют : разные виды микроскопии различные виды микроскопических препаратов : «раздавленная капля» и «висячая капля» мазок, окрашенный простыми и сложными методами
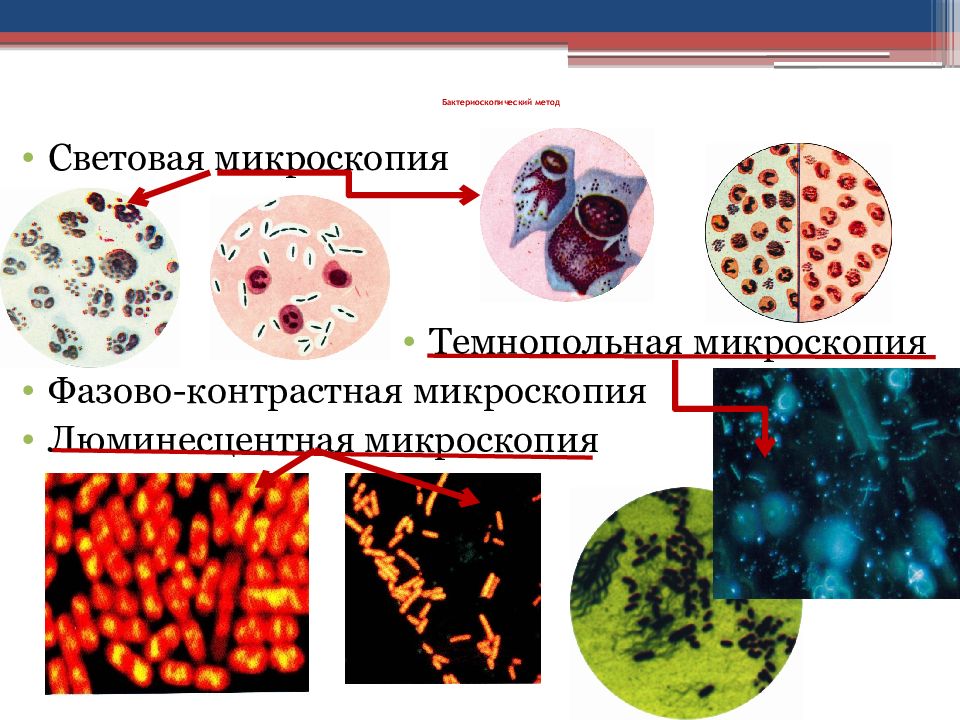
Слайд 13: Бактериоскопический метод
Световая микроскопия Темнопольная микроскопия Фазово-контрастная микроскопия Люминесцентная микроскопия
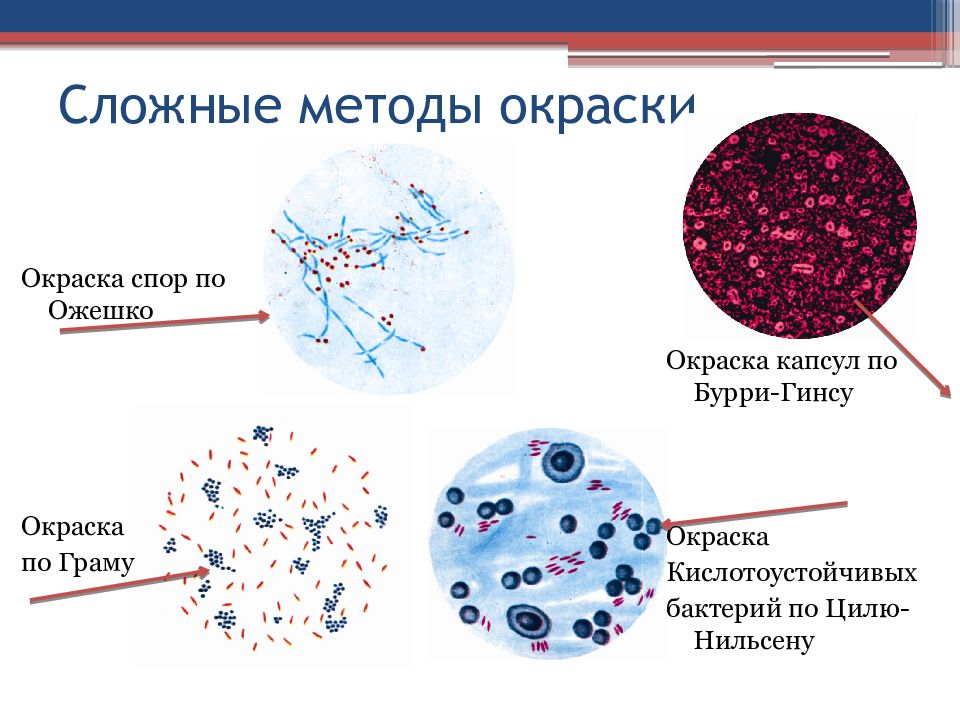
Слайд 14: Сложные методы окраски
Окраска спор по Ожешко Окраска по Граму Окраска капсул по Бурри-Гинсу Окраска Кислотоустойчивых бактерий по Цилю-Нильсену
Слайд 18: Бактериологический метод
«Золотой стандарт прикладной микробиологии» Заключается в выделении чистой культуры возбудителя из клинического материала и его идентификации. Используют стерильные питательные среды (по консистенции -жидкие, плотные, по назначению – универсальные, специальные, элективные, дифференциально-диагностические)
Слайд 19: Этапы выделения и идентификации чистых культур бактерий
1-й день. Микроскопия исследуемого материала. Посев исследуемого материала на питательные среды (плотную, жидкую).
Слайд 20: 2-й день
Изучение культуральных свойств. Пересев колоний на плотные питательные среды для накопления чистой культуры.
Слайд 21: 3-й день
Идентификация выделенной культуры: Проверка чистоты выделенной культуры. Изучение биохимических свойств: сахаролитических, протеолитических. Изучение фагочувствительности, колициночувствительности, чувствительности к антибиотикам и др. свойств
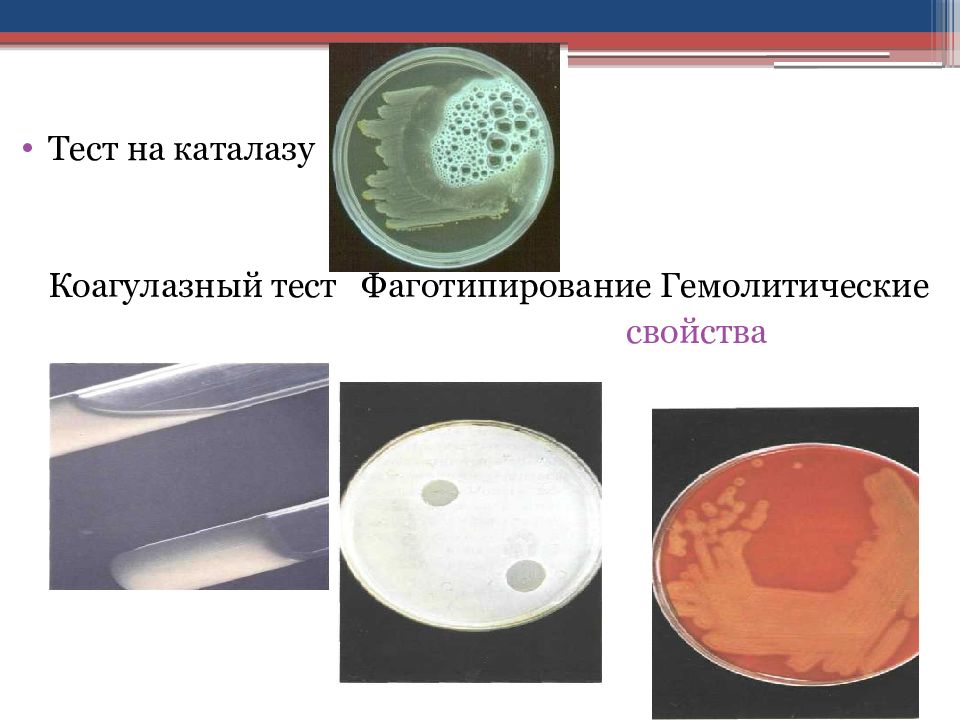
Слайд 22
Тест на каталазу Коагулазный тест Фаготипирование Гемолитические свойства
Слайд 23: Биологический метод
Заражение исследуемым материалом восприимчивых лабораторных животных в целях лабораторной диагностики с последующей идентификацией по клиническим симптомам и результатам патолого-анатомического вскрытия: для выделения чистой культуры возбудителя при невозможности использовать искусственные питательные среды (микобактерии лепры – армадиллы, возбудители туляремии – белые мыши) для ускорения выделения чистой культуры возбудителя по морфологическим признакам (пневмококк образует капсулы в тканях при заражении белых мышей) Для проведения реакции биологической нейтрализации токсина антитоксической сывороткой при диагностике клостридиозов для определения типа и вида микробного токсина Для определения активности in vivo антимикробных химиотерапевтических препаратов и т.д.
Слайд 24: Выбор экспериментальных животных
определяется целью работы. Наиболее часто используют для заражения: кроликов, морских свинок, белых мышей белых крыс.
Слайд 25: Методы заражения
Инфекционный материал вводят: внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно, подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга).
Слайд 26: СЕРОЛОГИЧЕСКИЙ МЕТОД
Определение специфических антител (иммуноглобулинов) в сыворотке крови больного, обнаружение микробного антигена в исследуемом материале. Используют реакции иммунитета.
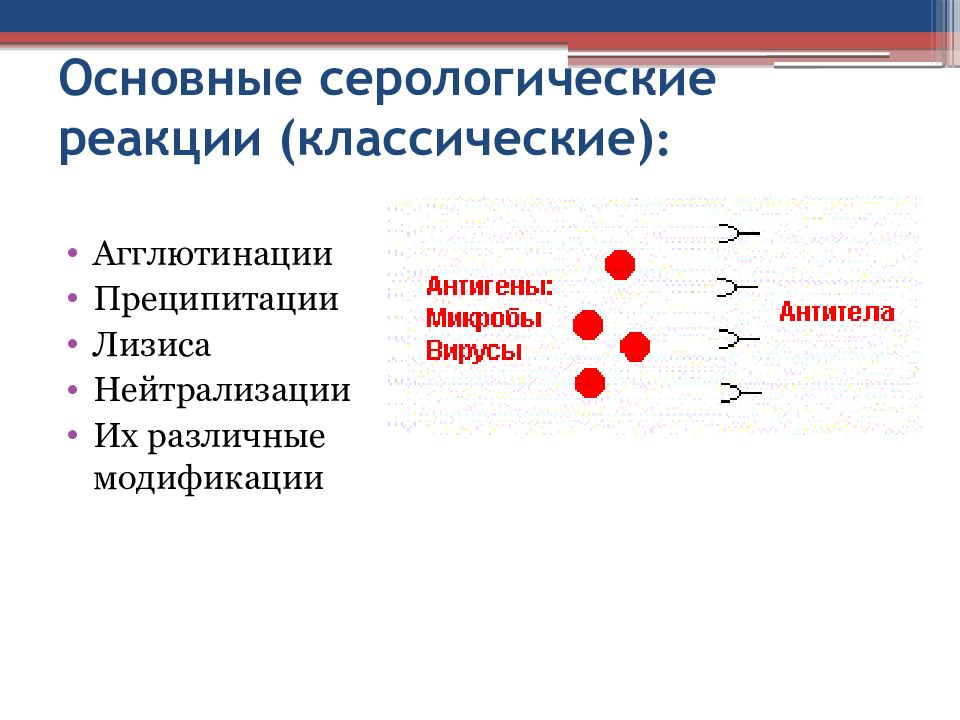
Слайд 27: Основные серологические реакции (классические) :
Агглютинации Преципитации Лизиса Нейтрализации Их различные модификации
Слайд 28: Серологические методы современные
Позволяют поставить микробиологический диагноз в течение короткого промежутка времени (от неск. минут до неск. часов) с момента доставки исследуемого материала в лабораторию. выявление антигенов возбудителя радиоиммунным (РИА), иммуноферментным (ИФА), иммунофлюоресцентным (РИФ) методами, выявление антител к взбудителю - РИА, ИФА.
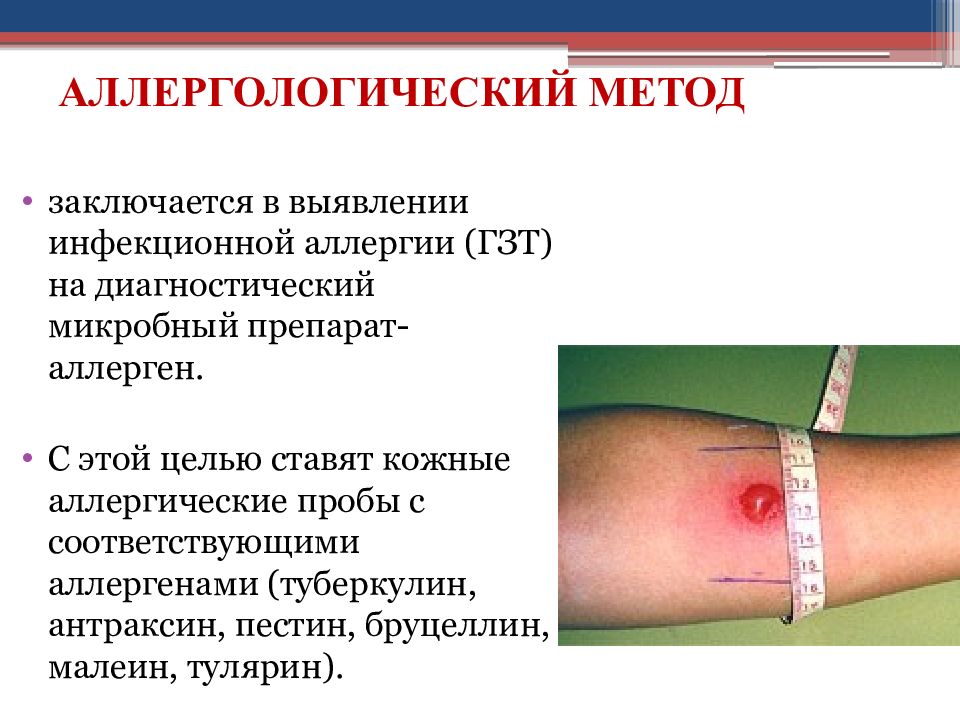
Слайд 29: АЛЛЕРГОЛОГИЧЕСКИЙ МЕТОД
заключается в выявлении инфекционной аллергии (ГЗТ) на диагностический микробный препарат-аллерген. С этой целью ставят кожные аллергические пробы с соответствующими аллергенами (туберкулин, антраксин, пестин, бруцеллин, малеин, тулярин).
Слайд 30: Аллергические пробы
1 группа ( in vivo ): кожные пробы, осуществляемые непосредственно на больном и выявляющие аллергию немедленного (через 20 мин) и замедленного (через 24-48 час) типов. 2 группа (in vitro): аллергические пробы, основанные на изучении процессов сенсибилизации не в организме больного, а в пробирке.
Слайд 31: Молекулярно-генетический метод
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР) Метод основан на выявлении в исследуемом материале ДНК возбудителя Идея ПЦР основана на том, что ген можно размножить в пробирке, увеличивая количество его копий в миллионы раз. Механизм ПЦР заключается в синтезе in vitro коротких нуклеотидных последовательностей для последующего анализа.
Слайд 32: Для проведения ПЦР
нужны пара олигонуклеотидов (праймеров), комплементарных исследуемому фрагменту, и фермент ДНК-полимераза. Праймеры способны распознавать гомологичные последовательности в денатурированной ДНК, связываться с ними и служить затравкой для ферментативного синтеза копий участка изучаемого гена. Каждый цикл синтеза удваивает число копий фрагмента-мишени, т.е. количество продукта (амплификата) в процессе ПЦР нарастает в геометрической прогрессии. 25-35 циклов реакции дают достаточно амплификата для дальнейшего изучения даже из единичного фрагмента ДНК.
Слайд 33: Метод ПЦР (метод полимеразной цепной реакции, PCR, polymerase chain reaction)
является прямым и самым современным методом анализа ДНК. позволяет специфично увеличивать (копировать - амплифицировать) количество исследуемого образца ДНК в десятки и сотни раз. В течение нескольких часов с помощью ПЦР из одного фрагмента молекулы ДНК можно получить 50 млрд. идентичных молекул. Такое количество копий фрагмента ДНК становится видимым в ультрафиолете после проведения электрофореза в агарозном геле.
Слайд 34
Метод ПЦР теоретически позволяет обнаружить даже 1 копию ДНК в образце, не имея, таким образом, предела чувствительности. Еще одно преимущество ПЦР заключается в том, что для нее характерна не только абсолютная чувствительность, но и абсолютная специфичность. ПЦР не дает ложноположительных результатов, при условии, что метод выполняется правильно.
Слайд 35
Метод ПЦР открыл американский химик Кэрри Б. Мюллисом в 1983 году, за что он был удостоен Нобелевской премии. В настоящее время метод получает все большую популярность для диагностики пациентов и имеет ряд преимуществ:
Слайд 36: Преимущества метода:
Метод ПЦР направлен на поиск самого возбудителя, а не антител к нему Метод ПЦР обладает высокой специфичностью – в исследуемом материале выявляется уникальный, характерный только для данного возбудителя фрагмент ДНК Метод ПЦР обладает наиболее высокой чувствительностью среды известных методов диагностики Метод ПЦР автоматизирован и позволяет получить результаты анализа в течение одного рабочего дня Метод ПЦР универсален – одна порция биологического материала позволяет провести исследования на наличие возбудителей целого ряда заболеваний
Слайд 37: Оборудование для ПЦР в классическом формате
амплификаторы (термоциклеры), оборудование для гель-электрофореза, системы документации гелей, Электрофорез Термоциклеры Гель-документация
Слайд 38: Модификации ПЦР
ЦР в режиме реального времени (real-time PCR) – мониторинг амплификации в процессе исследования дополнительная амплификация с внутренними праймерами (nested-PCR) – высокая чувствительность при нетипичной локализации возбудителя ПЦР c обратной транскрипцией (reverse transcriptase PCR, RT-PCR) множественная ПЦР (multiplex PCR) –одновременное выявление нескольких патогенов.
Слайд 39: ПЦР в реальном времени (Real-Time PCR)
Ее принципиальной особенностью является мониторинг и количественный анализ накопления продуктов ПЦР и автоматическая регистрация и интерпретация полученных результатов. ПЦР в реальном времени не требует стадии электрофореза, что позволяет снизить требования, предъявляемые к ПЦР лаборатории.
Последний слайд презентации: ПРИНЦИПЫ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ: Место ПЦР в современной лабораторной диагностике инфекций
ПЦР-метод является не заменой традиционных морфологических, биохимических или иммунологических методик, но их существенным и необходимым дополнением.