Первый слайд презентации
SiO 2 Массовая доля химического элемента Закон сохранения массы веществ — Вев Na С l
Слайд 2
Массовая доля химического элемента ω (Э) Массовая доля химического элемента рассчитывается как частное от деления суммарной относительной массы атомов этого элемента A r (Э), умноженное на х – число атомов в соединении, на относительную молекулярную массу вещества M r в долях единицы или в процентах.
Слайд 3
Рассчитаем в процентах долю азота и водорода в аммиаке (NH 3 ) : NH 3 ω ( N ) 82% ω ( H ) 18%
Слайд 4
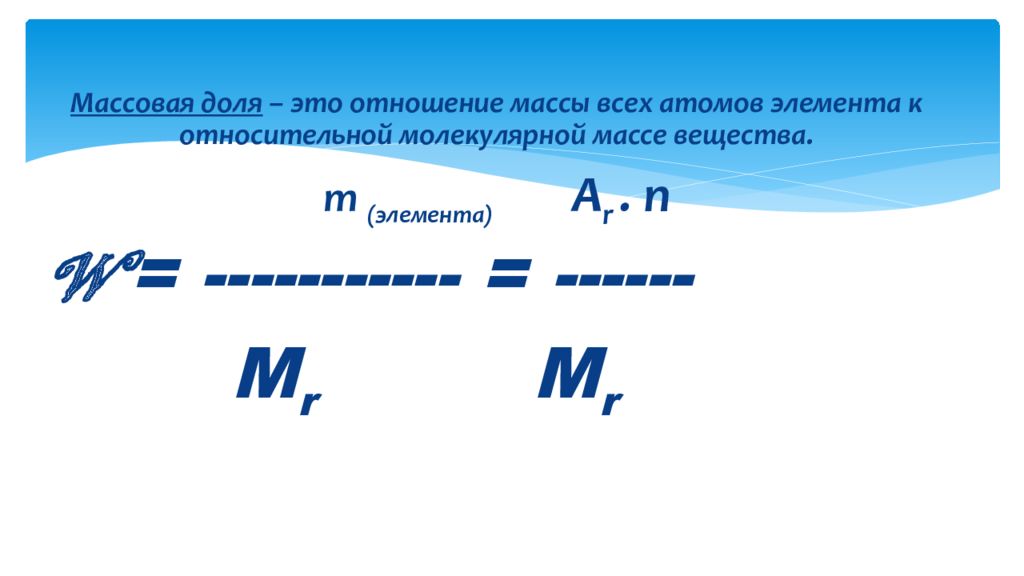
Массовая доля – это отношение массы всех атомов элемента к относительной молекулярной массе вещества. m ( элемента) A r. n W = ----------- = ------ М r М r
Слайд 5: Массовая доля выражается в % или долях единицы
Перевод долей в проценты осуществляется путем умножения на 100% ПРИМЕР: 0,03 = 0,03 * 100=3 %
Слайд 6: Значение знаний о массовой доле
Можно определить содержание элемента в любом количестве вещества Можно определить химическую формулу вещества; В народном хозяйстве определить содержание питательного элемента в определённом веществе Значение знаний о массовой доле
Слайд 7
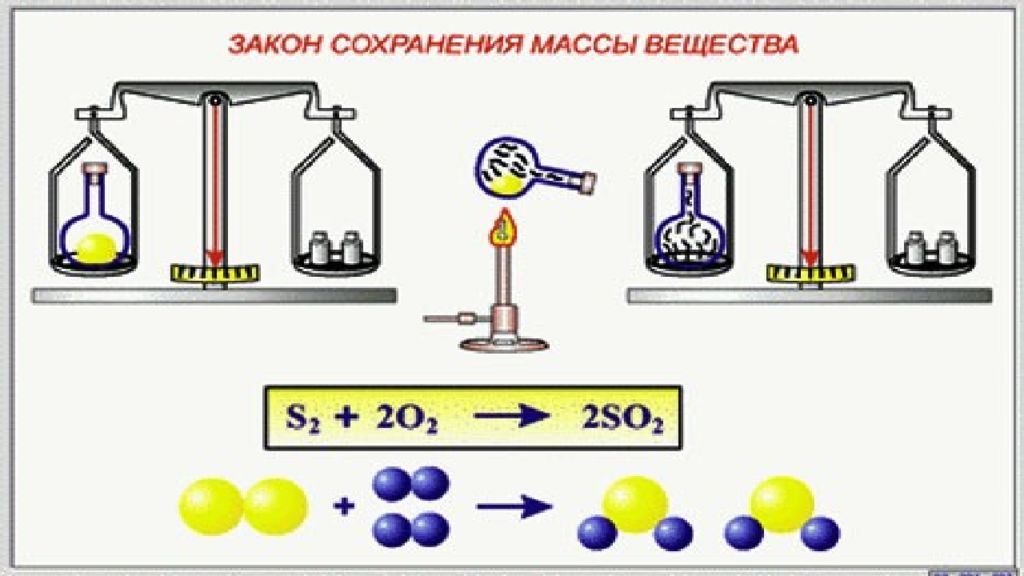
М.В.Ломоносов в 1748 г. впервые сформулировал, а в 1756 г. экспериментально доказал закон сохранения массы веществ А.Лавуазье в 1789 г независимо от Ломоносова к пришел тем же выводам
Слайд 9: Формулировка закона
Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ
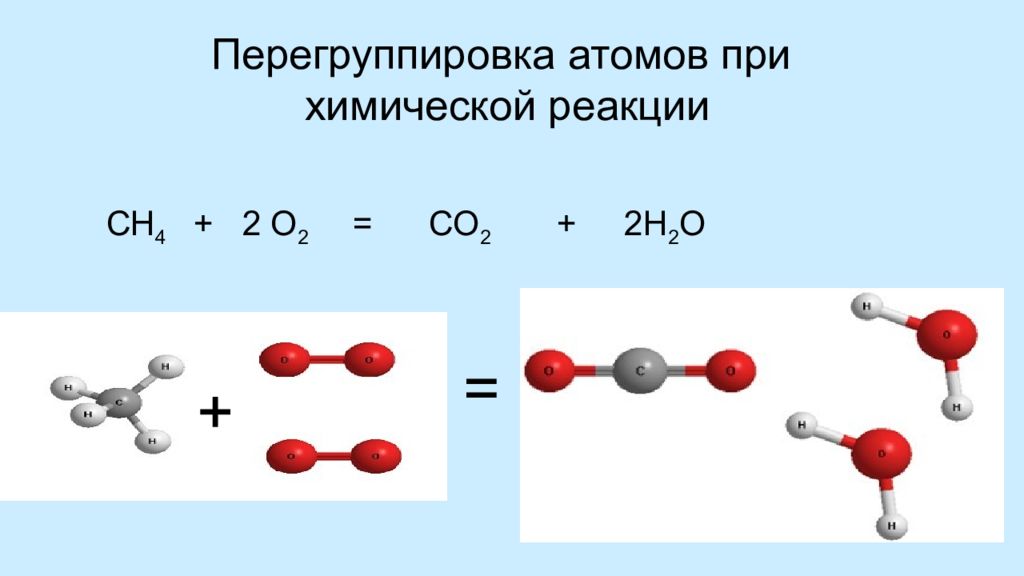
Слайд 13: Перегруппировка атомов при химической реакции
СН 4 + 2 О 2 = СО 2 + 2Н 2 О + =
Слайд 14: Решение задач
Определите массовую долю алюминия в его соединении с кислородом Al 2 O 3 Дано: Решение: Al 2 O 3 W Al = 2 A r (Al) / M r (Al 2 O 3 ) M r (Al 2 O 3 )= 2 х 27 + 3 х 16=102 W Al = 2х27 / 102 = 0,53, или 53% Ответ: массовая доля А l 53% Решение задач W (А l) = ?
Слайд 15: Самостоятельно:
Вычислите массовую долю кислорода в этом же соединении. Проверка W О = 16х3 / 102 = 0,47, или 47% ОТВЕТ : массовая доля О=47% Самостоятельно:
Слайд 16: Задача:
Вычислите массовую долю натрия и хлора в поваренной соли, формула которой NaCl Дано: Решение: NaCl w Na = A r (Na) / M r ( NaCl ) W Cl = A r ( Cl ) / M r ( NaCl ) M r ( NaCl )= 23 + 3 5.5 = 58.5 W(Na) - ? W ( Cl ) - ? W Na = 2 3 / 58.5 = 0,39, или 39% W С l = 3 5,5 / 58.5 = 0,61, или 61% Ответ: массовая доля Na – 39%; Cl - 61% Задача:
Слайд 17: Вычислите массовые доли углерода и кислорода в углекислом газе
Дано: СО 2 W (С ) =- ? W (О) -? Решение: w С = A r ( С ) / M r (C О 2 ) W О = 2 A r ( О ) / M r (C О 2 ) M r (C О 2 )= 1 2 + 2х16 =44 Ответ: 27% углерода и 73 % кислорода w С = 12/44 = 0,27, или 27% W О = 2 х 16/44 = 0,73, или 73%