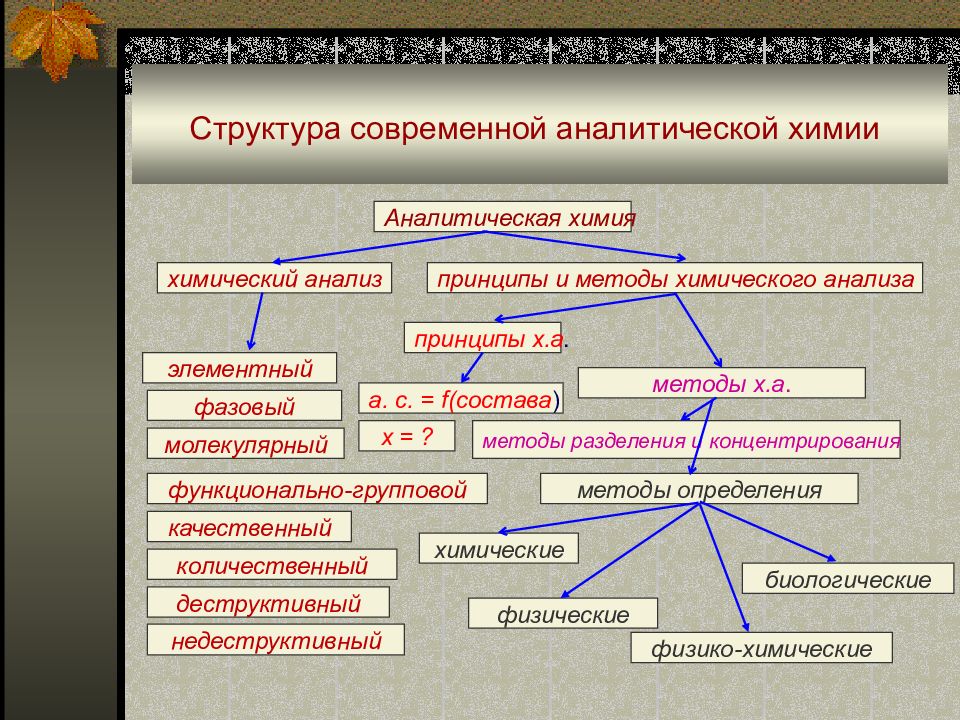
Первый слайд презентации: Структура современной аналитической химии
Аналитическая химия химический анализ элементный фазовый молекулярный функционально-групповой качественный количественный деструктивный недеструктивный принципы и методы химического анализа принципы х.а. а. с. = f( состава ) x = ? методы х.а. методы разделения и концентрирования методы определения химические физико-химические физические биологические
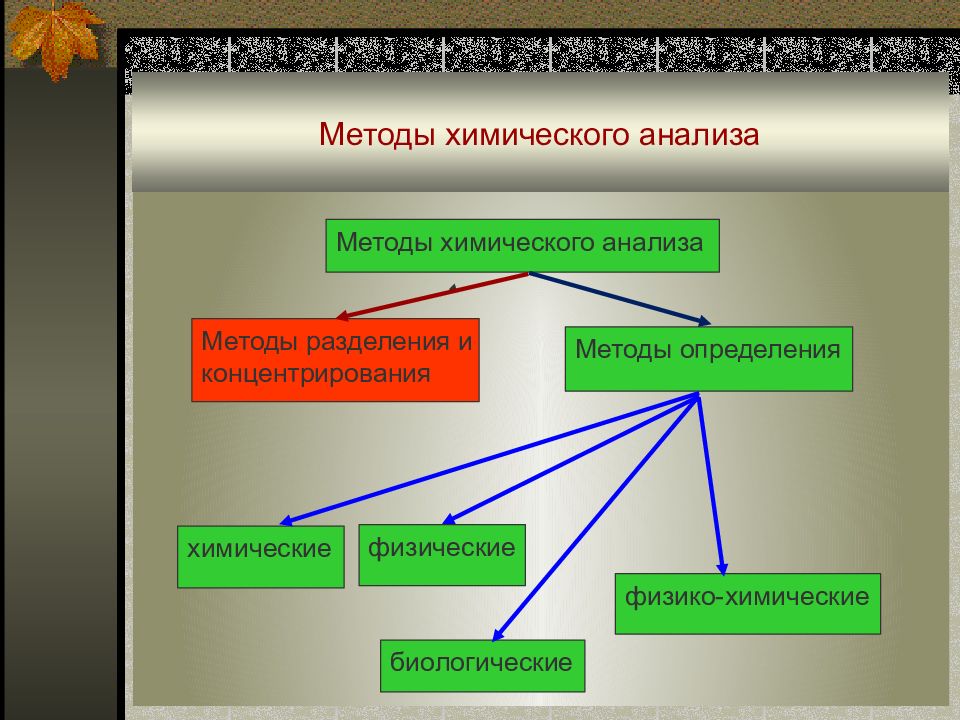
Слайд 2: Методы химического анализа
Методы химического анализа Методы разделения и концентрирования Методы определения химические физические физико-химические биологические
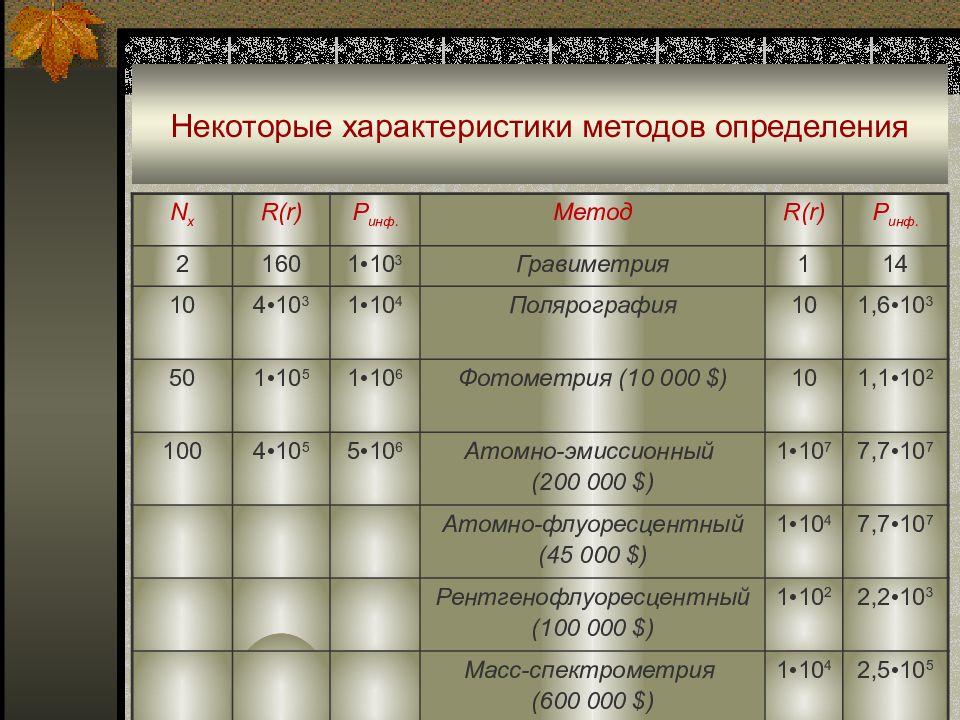
Нередко в практике химического анализа применяемый метод обнаружения или определения не обеспечивает надежных результатов из-за сложности пробы. Уравнение Гиршфельда : где N x – число случайно взятых соединений в пробе ; R – разрешающая способность метода, прибора или аналитической системы ; - вероятность раздельного определения каждого из N x соединений пробы ; R(r) = r/ dr (r- измеряемый переменный параметр ; dr – наименьшая различимая разность двух близких значений ). N x = √0,5• R•In/
N x R(r) P инф. Метод R(r) P инф. 2 160 1 •10 3 Гравиметрия 1 14 10 4•10 3 1 •10 4 Полярография 10 1,6 •10 3 50 1 •10 5 1 •10 6 Фотометрия ( 10 000 $) 10 1,1 •10 2 100 4•10 5 5•10 6 Атомно-эмиссионный (200 000 $) 1 •10 7 7,7 •10 7 Атомно-флуоресцентный (45 000 $) 1 •10 4 7,7 •10 7 Рентгенофлуоресцентный (100 000 $) 1 •10 2 2,2 •10 3 Масс-спектрометрия (600 000 $) 1 •10 4 2,5 •10 5
Слайд 5: Методы маскирования
Маскирование – это торможение или полное подавление прямой химической реакции с участием мешающего компонента. При термодинамическом ( равновесном ) маскировании концентрация м ешающе го компонента понижается до такой степени, что реакция с его участием незначительна ( используют протолитические реакции, комплексообразования, окисления-восстановления ) : Fe 3+ + nSCN - ↔ [Fe(SCN) n ] (3-n) ; Igβ 6 = 3,23; Co 2+ + mSCN - ↔ [Co(SCN) m ] (2-m) ; Igβ 4 = 2,20; Fe 3+ + nF - ↔ [ FeF n ] (3-n) ; Igβ 3 = 11,86.
Слайд 8: Методы маскирования
■ Кинетическое маскирование основано на увеличении разности между скоростями определяемого вещества и мешающего компонента с одним и тем же реагентом
Слайд 9: Методы разделения и концентрирования
Привходящие факторы для использования методов разделения и концентрирования : - проба содержит компоненты, мешающие определению ; - концентрация определяемого компонента ниже предела обнаружения метода ; - определяемые компоненты неравномерно распределены в пробе ; - отсутствуют стандартные образцы для градуировки приборов ; - проба высокотоксична, радиоактивна или дорога.
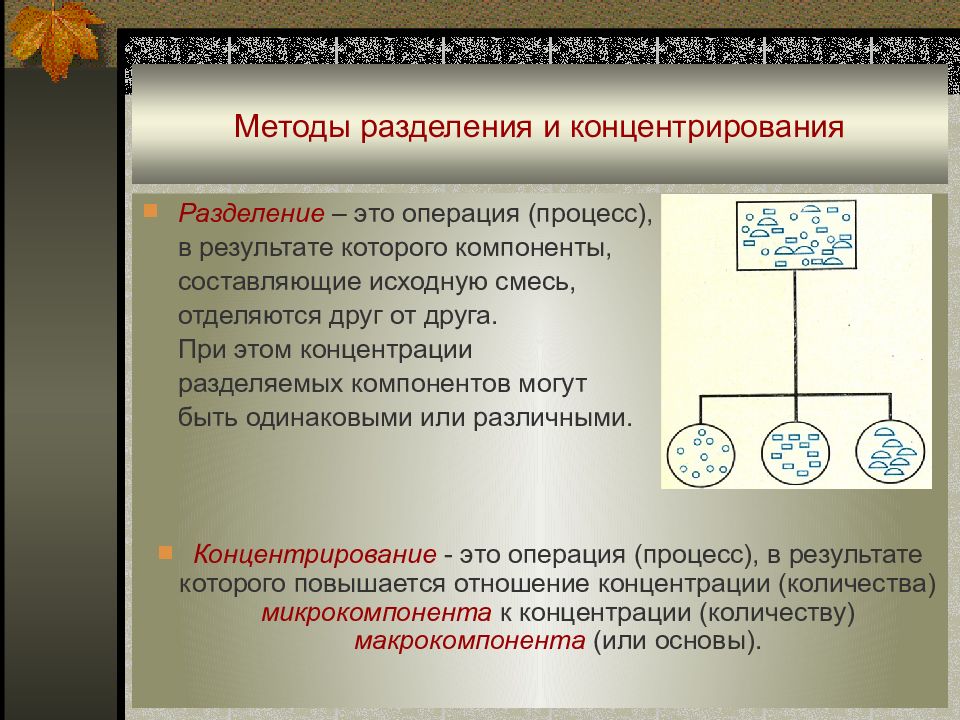
Слайд 10: Методы разделения и концентрирования
Разделение – это операция (процесс), в результате которого компоненты, составляющие исходную смесь, отделяются друг от друга. При этом концентрации разделяемых компонентов могут быть одинаковыми или различными. Концентрирование - это операция (процесс), в результате которого повышается отношение концентрации (количества) микрокомпонента к концентрации (количеству) макрокомпонента (или основы).
Слайд 11: Методы разделения и концентрирования
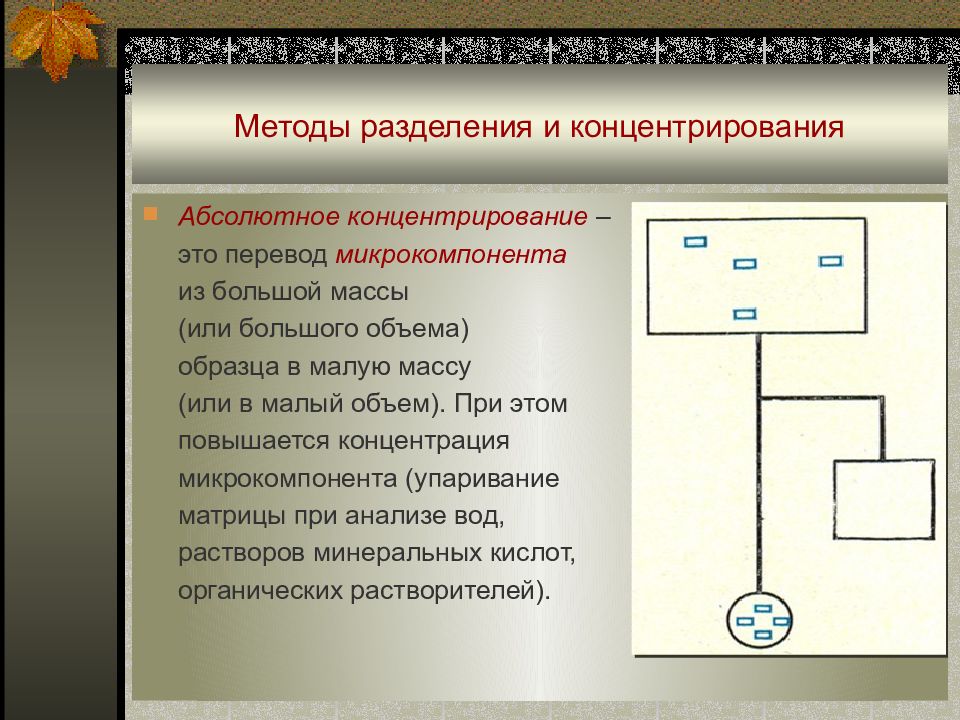
Абсолютное концентрирование – это перевод микрокомпонента из большой массы (или большого объема) образца в малую массу (или в малый объем). При этом повышается концентрация микрокомпонента ( упаривание матрицы при анализе вод, растворов минеральных кислот, органических растворителей).
Слайд 12: Методы разделения и концентрирования
Относительное концентрирование (обогащение) – это увеличение отношения между количествами микрокомпонента и макрокомпонента
Слайд 13: Методы разделения и концентрирования
Групповое и индивидуальное разделение и концентрирование : - при групповом – за один прием отделяется несколько компонентов ; - при индивидуальном – из образца выделяют один компонент или последовательно несколько компонентов. Методы разделения и концентрирования основаны на использовании различий в свойствах компонентов анализируемой системы : растворимость, температура кипения, скорость движения частиц во внешнем электрическом поле, сорбция и др.
Слайд 14: Классификация методов разделения и концентрирования
Фаза с микрокомпонентом Фаза с матрицей Метод Жидкость Жидкость Экстракция микрокомпонентов и матрицы, распределительная хроматография Твердое тело Жидкость Сорбция, соосаждение, электролиз, цементация микрокомпонентов Жидкость Твердое тело Сорбция, осаждение, электролиз, кристаллизация, зонная плавка матрицы Газ Жидкость Испарение микрокомпонентов Жидкость Газ Испарение матрицы и мокрое озоление Газ Твердое тело Испарение микрокомпонентов Твердое тело Газ Сублимация, направленное испарение матрицы
Слайд 17: Количественные характеристики методов разделения и концентрирования
Большинство методов разделения и концентрирования основано на распределении вещества между двумя фазами ( I и II): А I А II C A,I D = - коэффициент распределения. C A,II Q A,II R = - степень извлечения. Q A,II + Q A,I
Слайд 18: Количественные характеристики методов разделения и концентрирования
А I А II D A A/B = - коэффициент разделения. D B Коэффициент концентрирования ( S к ) q к Q проба 1 S к = ——— × ——— = R микр × —— q проба Q к R макр
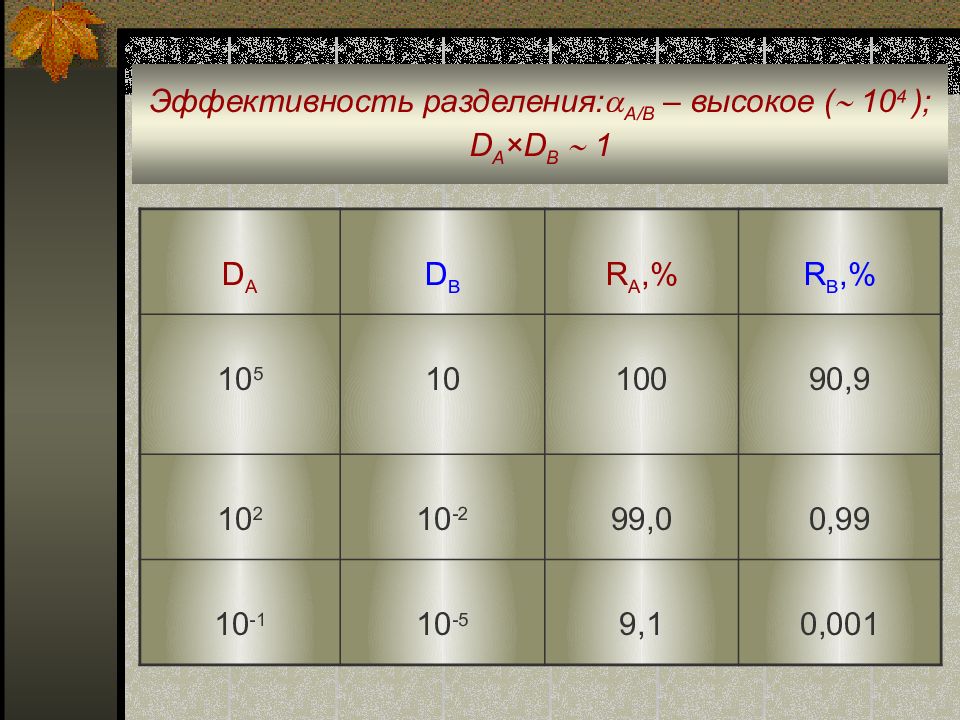
Слайд 19: Эффективность разделения : A/B – высокое ( 10 4 ) ; D A × D B 1
D A D B R A,% R B,% 10 5 10 100 90,9 10 2 10 -2 99,0 0,99 10 -1 10 -5 9,1 0,001
Слайд 20: Сравнительные характеристики методов разделения и концентрирования
Метод концентрирования Коэффициент концентрирования 10 0 10 1 10 2 10 3 10 4 Экстракция Экстракционная хроматография Ионный обмен Соосаждение Направленная кристаллизация Частичное растворение матрицы Пробирная плавка
Слайд 21: Осаждение
Метод осаждения основан на различной растворимости соединений, преимущественно в водных растворах. Метод имеет два явных недостатка : - потеря определяемого компонента вследствие частичной растворимости осадков ; - cоосаждение мешающих компонентов.
Слайд 22: Произведения растворимости
■ Соответствующие константы равновесия ( произведения растворимости ): K т s = a A m • a B n ; K c s = [A] m • [B] n ; K у s = С A m • С B n ; термодинамическое реальное условное ; ( концентрационное )
Слайд 23: Осаждение
Характеристики метода : где C A - исходная концентрация А до осаждения ; [A] – равновесная концентрация А в растворе после осаждения. при I =1, [A] = K s /[B]; [B] – равновесная концентрация осадителя. C A - [A] D = ————— [A]
Слайд 24: Осаждение
П о д ставляем выражение для K S С учетом протекания конкурирующих реакций ( R - осадитель) C A •[B] - K S D = ————— K S C A •C в – K у S K у S(BR) D = ————— A/B = ———— K у S K у S(AR)
Слайд 25: Осаждение
Концентрирование микрокомпонентов осаждением используют редко ( трудно достичь значения K у S ); обычно выделяют матрицу. Весьма эффективно разделение ионов металлов. ■ Соосаждение – распределение микрокомпонента ( адсорбция, ионный обмен, окклюзия, изоморфное осаждение, образование химических соединений ) между раствором ( жидкая фаза ) и осадком - коллектором ( твердая фаза ), причем микрокомпонент не образует собственной твердой фазы.
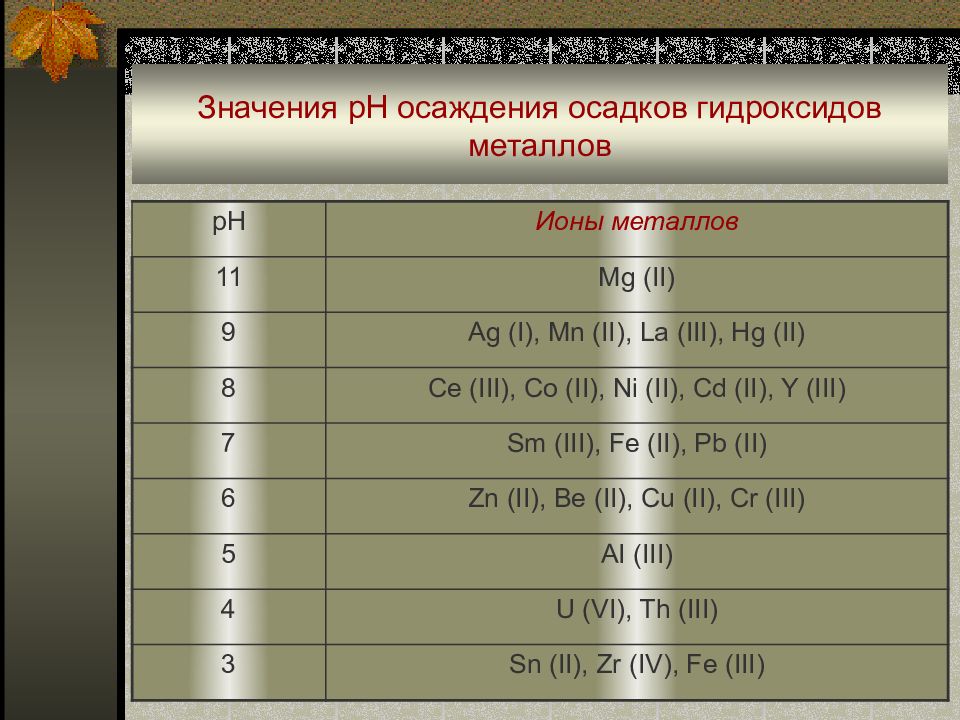
Слайд 26: Значения рН осаждения осадков гидроксидов металлов
pH Ионы металлов 11 Mg (II) 9 Ag (I), Mn (II), La (III), Hg (II) 8 Ce (III), Co (II), Ni (II), Cd (II), Y (III) 7 Sm (III), Fe (II), Pb (II) 6 Zn (II), Be (II), Cu (II), Cr (III) 5 AI (III) 4 U (VI), Th (III) 3 Sn (II), Zr (IV), Fe (III)
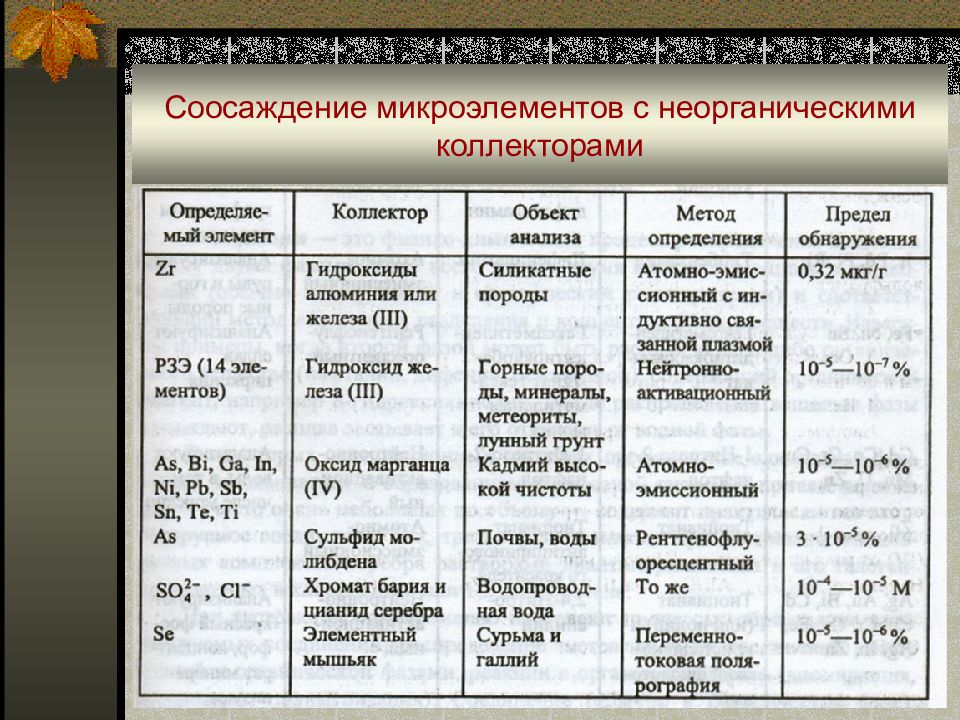
Слайд 27: Соосаждение
Коллекторы – это малорастворимые неорганические или органические соединения с хорошо развитой поверхностью. По степени абсолютного концентрирования, простоте и аппаратурному оформлению, соосаждение является одним из лучших методов. Так, коэффициент концентрирования тяжелых металлов при их содержании в пробе 10 -9 -10 -6 г/л достигает 10 3, степень извлечения превышает 90%. Недостаток метода соосаждения – его длительность.
Слайд 30: Экстракция
Экстракция – метод выделения, разделения и концентрирования веществ, основанный на распределении растворенного вещества между двумя несмешивающимися жидкими фазами. Экстракционный реагент – реагент, образующий экстрагируемое соединение (например, 8-оксихинолин). Экстрагент - вся система в целом (например, раствор 8-оксихинолина в СНС I 3 ). Разбавитель – инертный органический растворитель, применяемый для улучшения физических и экстракционных свойств экстрагента.
Слайд 31: Экстракция
Экстракт – органическая фаза с экстрагированным соединением, отделенная от водной фазы. Реэкстракция – перевод вещества из органической фазы в водную. Реэкстрагент – раствор, используемый для реэкстракции.
Слайд 32: Основные законы и количественные характеристики экстракции
Закон распределения Нернста : при постоянных температуре и давлении отношение активностей растворенного вещества между двумя несмешивающимися фазами есть величина постоянная. В гетерогенной системе A в ↔ A о изменение энергии Гиббса ( ΔG ) запишется так : (a A ) o ΔG = ΔG 0 + RTIn —— (a A ) в
Слайд 33: Основные законы и количественные характеристики экстракции
■ П оскольку в условиях равновесия ΔG = 0, получаем В реальных условиях, как правило, используют K С D = [A] o / [A] в, поскольку f i в органической фазе редко известны. (a A ) o —— = e - ΔG 0 /RT = K т D (a A ) в
Слайд 34: Основные законы и количественные характеристики экстракции
Если экстрагируемое вещество существует в единственной форме, то константа равновесия может быть записана в виде : где S i – растворимости вещества K D = S о /S в
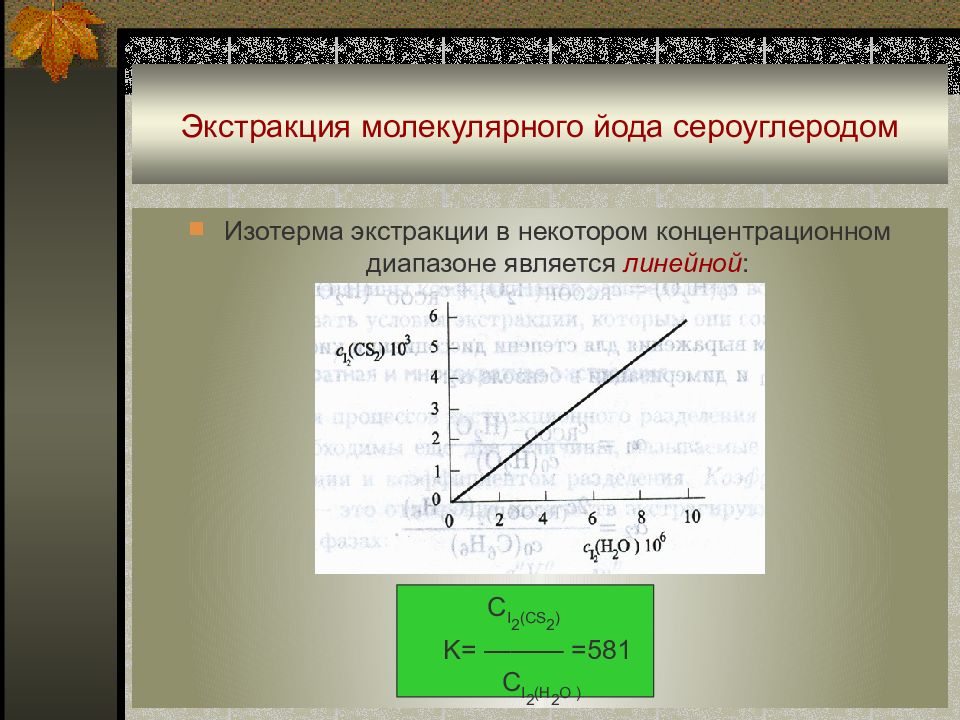
Слайд 35: Экстракция молекулярного йода сероуглеродом
И зотерма экстракции в некотором концентрационном диапазоне является линейной : C I 2 (CS 2 ) K= ——— =581 C I 2 (H 2 O )
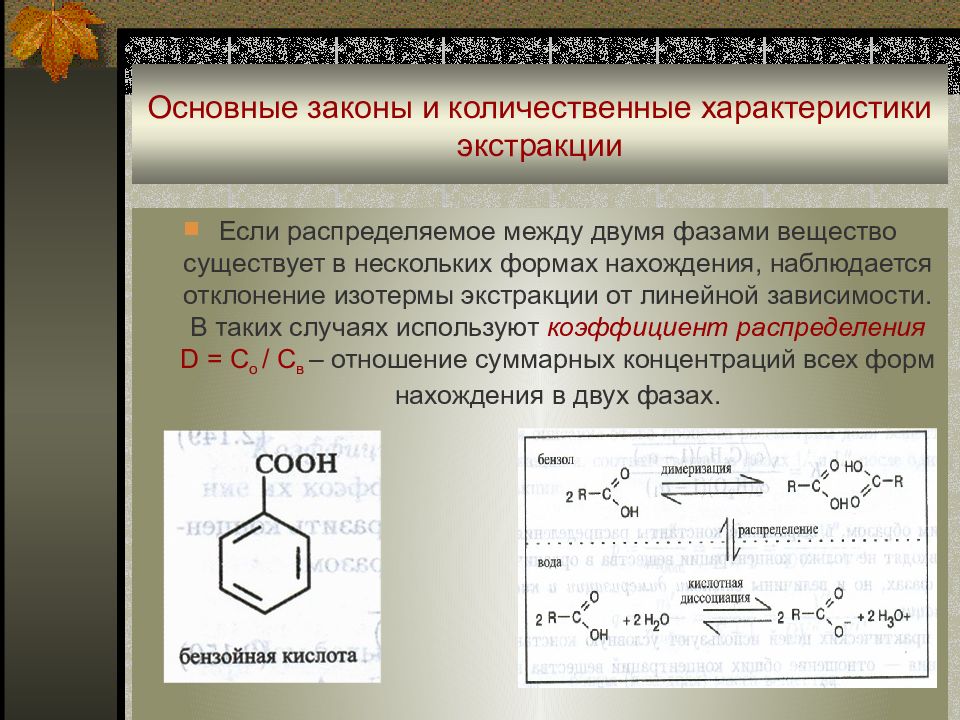
Слайд 36: Основные законы и количественные характеристики экстракции
Если распределяемое между двумя фазами вещество существует в нескольких формах нахождения, наблюдается отклонение изотермы экстракции от линейной зависимости. В таких случаях используют коэффициент распределения D = C o / C в – отношение суммарных концентраций всех форм нахождения в двух фазах.
Слайд 37: Основные количественные характеристики экстракции
Степень извлечения ( R,% ): В отличии от D, степень извлечения R зависит от соотношения объемов фаз C o •V o D R = —————— 100% = —————— 100% C в •V в + C o •V o D + V в / V o
Слайд 38: Основные количественные характеристики экстракции
■ Пример: распределение 8-гидроксихинолина в системе H 2 O–CHCI 3
Слайд 39: Основные количественные характеристики экстракции
Пример : распределение 8-гидроксихинолина в системе H 2 O–CHCI 3 продолжение)
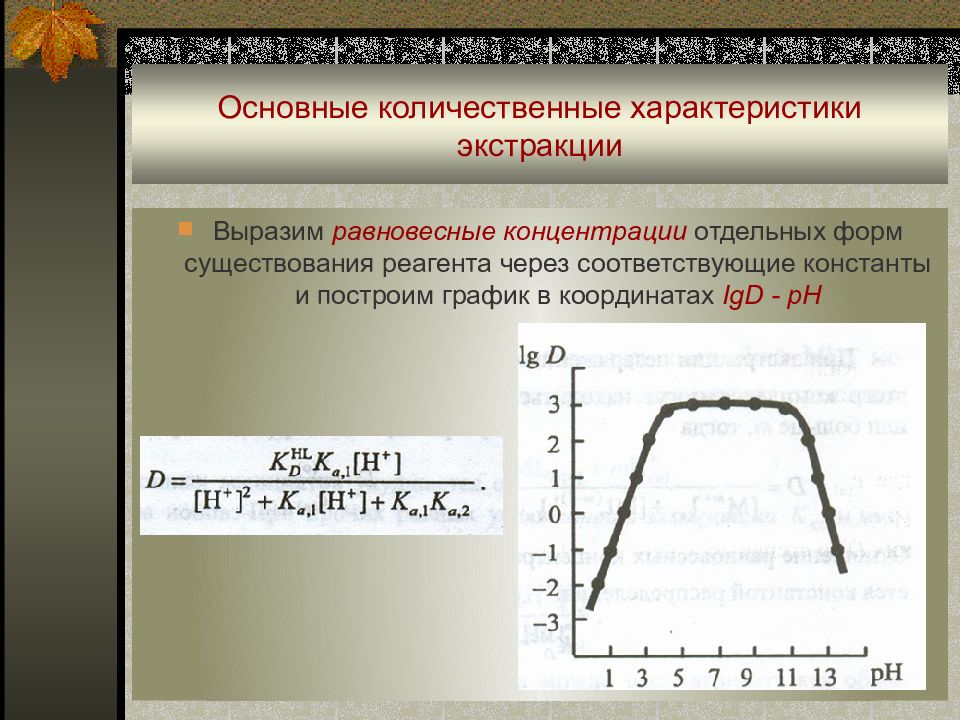
Слайд 40: Основные количественные характеристики экстракции
В ыразим равновесные концентрации отдельных форм существования реагента через соответствующие константы и построим график в координатах IgD - pH
Слайд 41: Основные количественные характеристики экстракции
Если имеют место процессы агрегации или ассоциации :
Слайд 42: Основные количественные характеристики экстракции
■ П осле преобразования получаем : здесь кривая 1 – D – const ; кривая 2 – образование ассоциата в органической фазе ; C 1, C 2 – концентрации вещества в органической и водной фазах соответственно ; D зависит от [HL] в водной фазе.
Слайд 43: Основные количественные характеристики экстракции
При экстракции комплексов с различным числом лигандов можно использовать следующие уравнения и расчеты:
Слайд 45: Классификация экстракционных процессов (экстрагенты)
Реакции основных типов экстрагентов : - кислотные : - основные : - нейтральные :
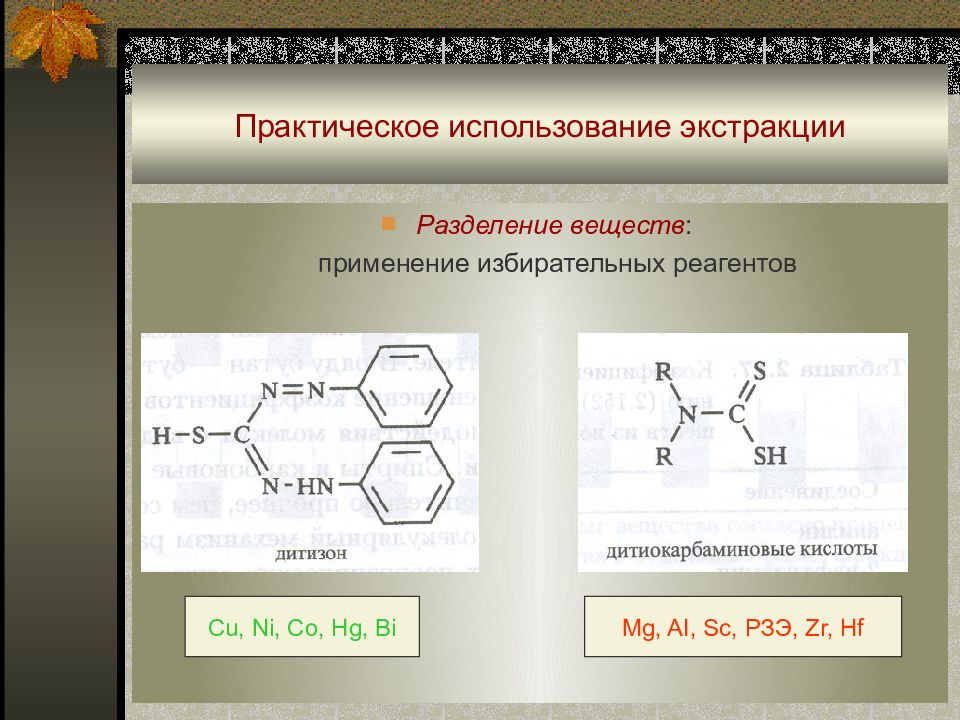
Слайд 47: Практическое использование экстракции
Разделение веществ : применение избирательных ре а гентов Cu, Ni, Co, Hg, Bi Mg, AI, Sc, РЗЭ, Zr, Hf
Слайд 48: Практическое использование экстракции
Концентрирование элементов : О-изопропил- N- этилдитиокарбаминат извлекает за одну экстракцию 99,9 % Ag + в присутствии ионов AI, As, Ba, Be, Bi, Zn, Cd, Ni, Co, Cr, Cu, Fe, Ga, In, Mn, Pb, Sn, Te, TI, V, Zr
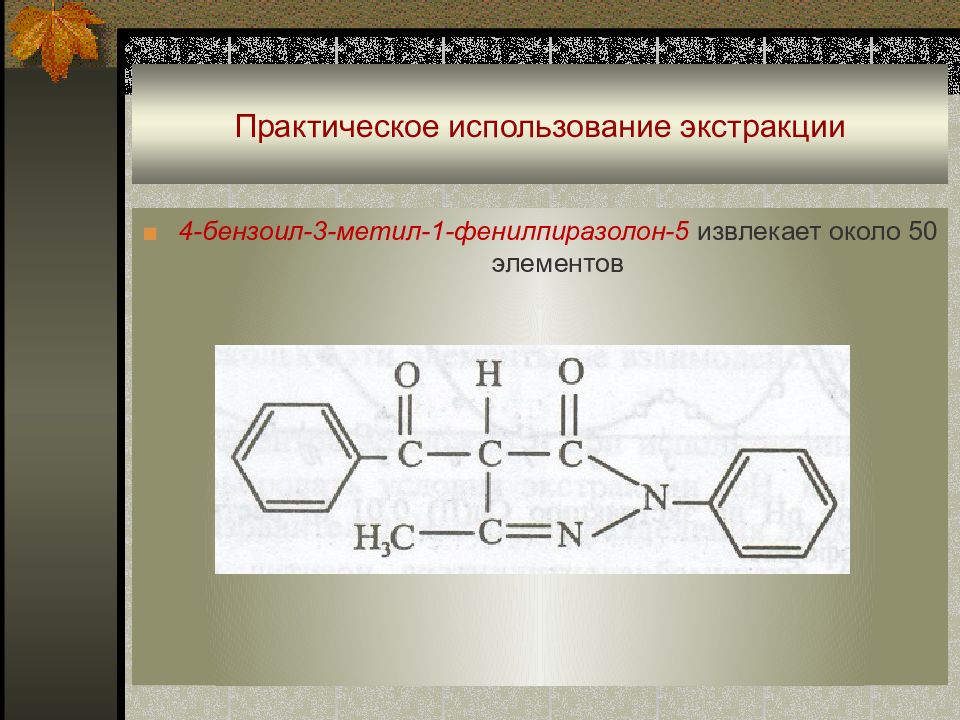
Слайд 49: Практическое использование экстракции
■ 4-бензоил-3-метил-1-фенилпиразолон-5 извлекает около 50 элементов
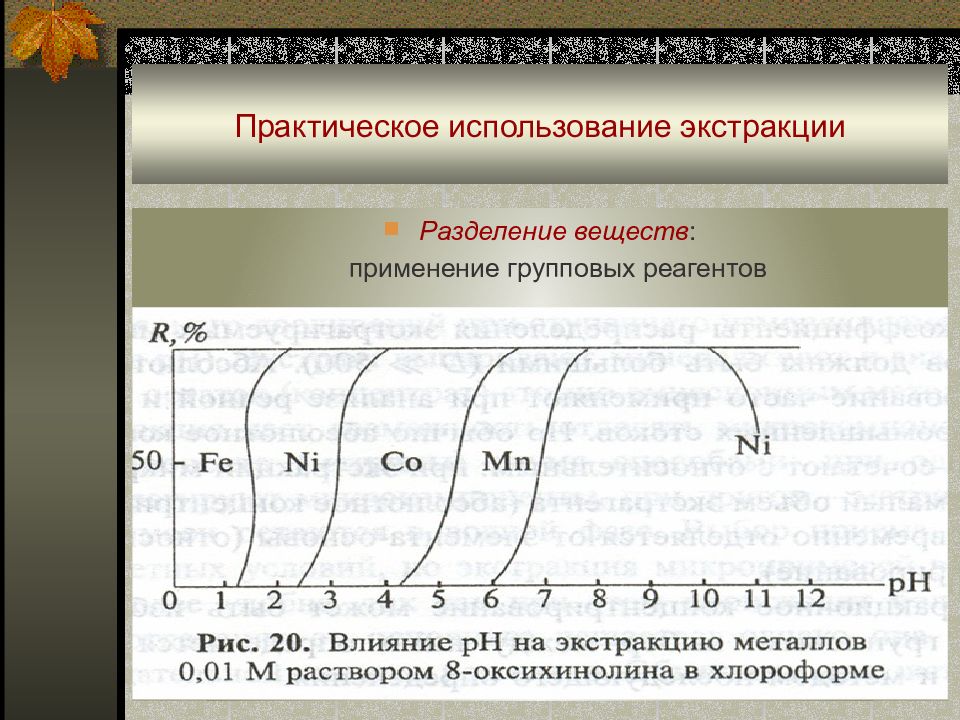
Слайд 50: Практическое использование экстракции
Разделение веществ : применение групповых ре а гентов
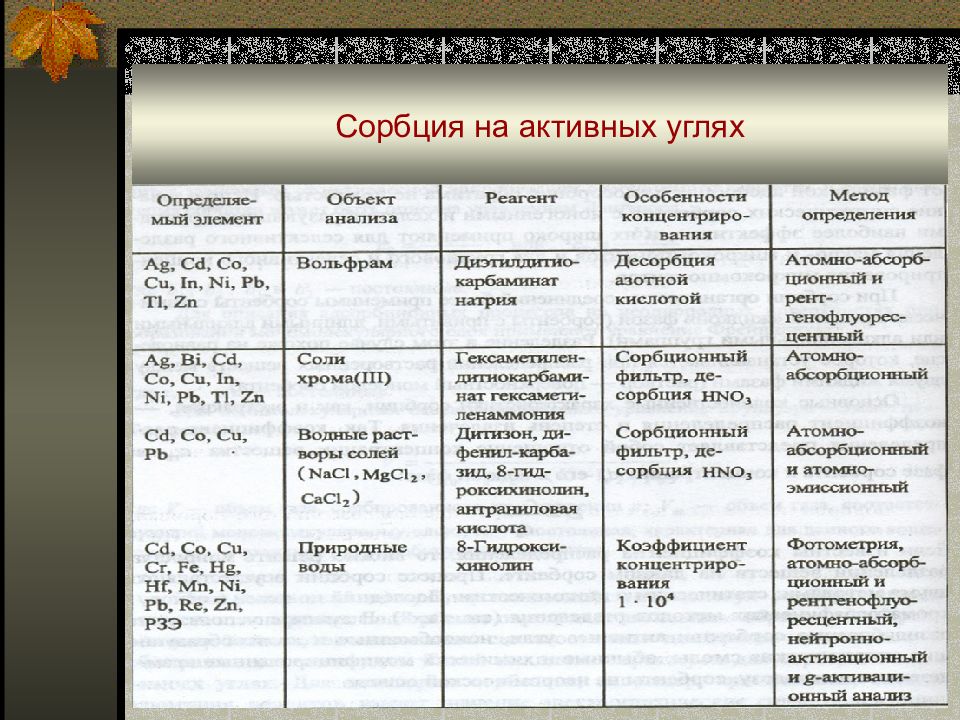
Слайд 51: Сорбция
Сорбционные методы разделения и концентрирования основаны на различном поглощении растворенных веществ, газов и паров твердыми или жидкими поглотителями ( сорбентами ). Виды сорбции : 1. адсорбция – поглощение вещества поверхностью сорбента 1.1. физическая ( молекулярная) адсорбция - взаимодействие между сорбентом и сорбируемым веществом ( сорбатом ) обусловлено межмолекулярными силами ; 1.2. хемосорбция – поглощение основано на протекании химических реакций сорбент- сорбат с образованием химических соединений.
Слайд 52: Сорбция
■ Виды сорбции (продолжение) : 2. абсорбция – поглощение вещества всей массой сорбента. 3. распределение вещества между двумя несмешивающимися фазами ( растворитель и жидкая фаза на сорбенте ). 4. капиллярная конденсация – образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров вещества. 5. смешанные механизмы (обычно реализуются на практике).
Слайд 53: Сорбция
Сорбционный процесс в статических условиях описывается функциональными зависимостями типа С S = f(C i, P), где С S – количество сорбированного вещества ; C i – его концентрация в жидкой ( газообразной ) или Р – давление в газообразной фазе. Графические зависимости С S = f(C i, P) называются изотермами сорбции.
Слайд 54: Сорбция
■ Основные виды сорбентов : активные угли, синтетические органические ионообменники и хелатообразующее сорбенты, кремнеземы, неорганические сорбенты. Процесс сорбции осуществляют двумя способами : статическим и динамическим. Сорбция в динамическом режиме :
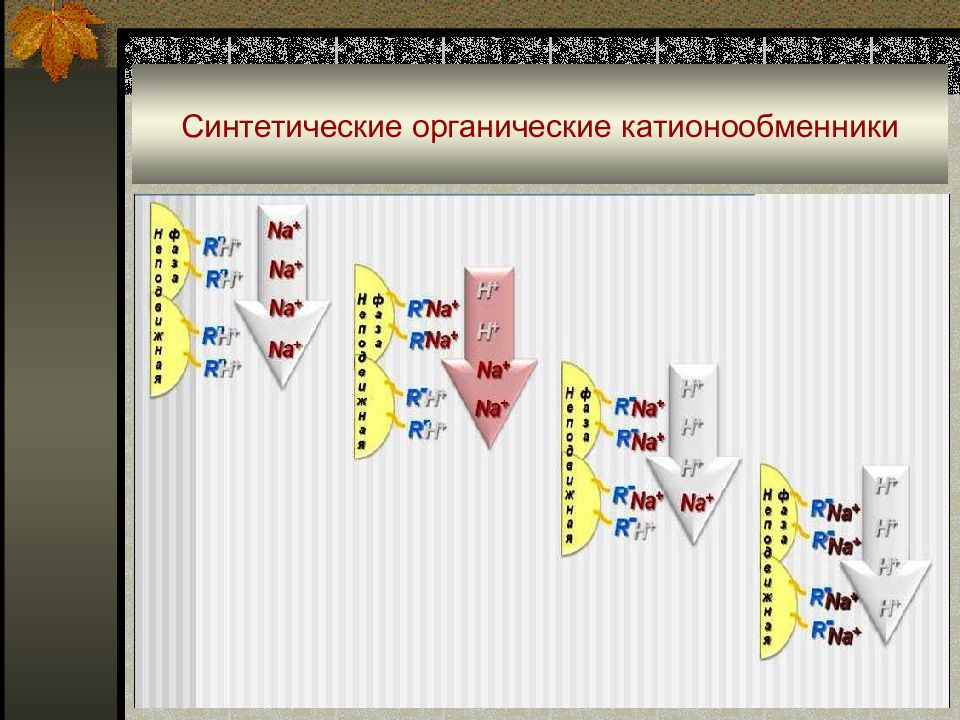
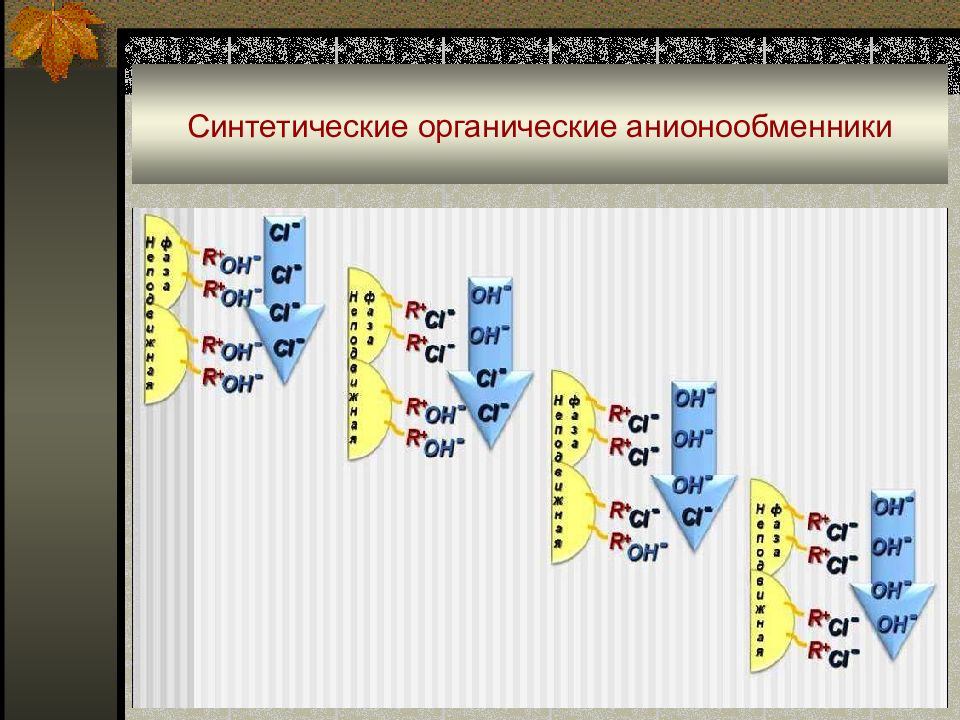
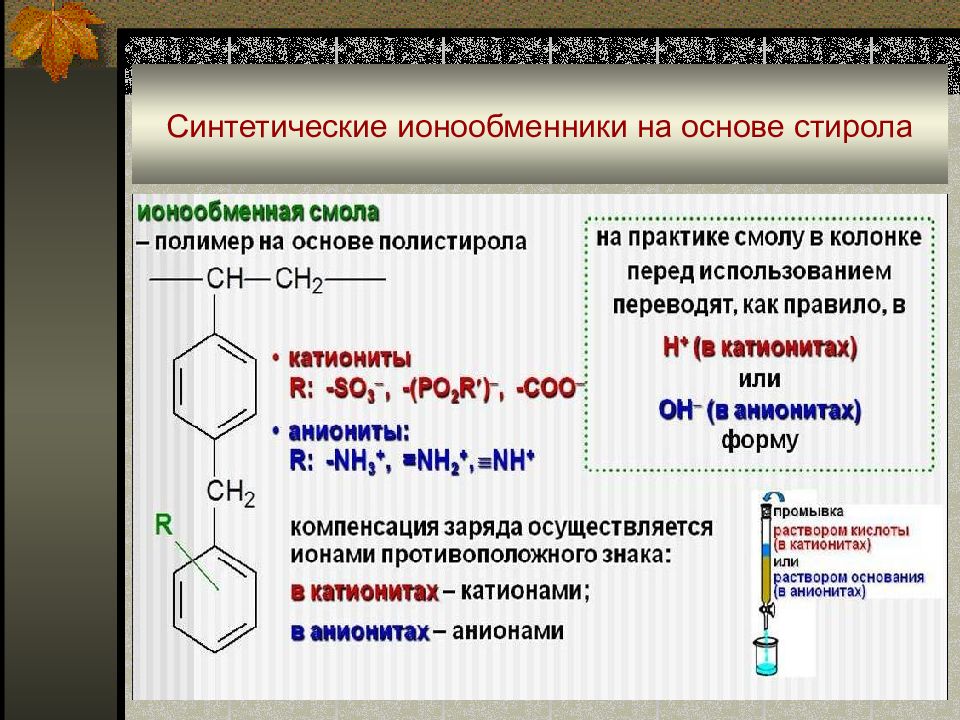
Слайд 56: Синтетические органические ионообменники
Продукты полимеризации и поликонденсации непредельных органических соединений, содержащих кислотные (-SO 3 H, -COOH, -OH, -PO 3 H 2, …) или основные (-N(CH 3 ) 3 +, -NH 3 +, =NH 2 +, …) группы. Ионообменный процесс можно представить уравнениями:
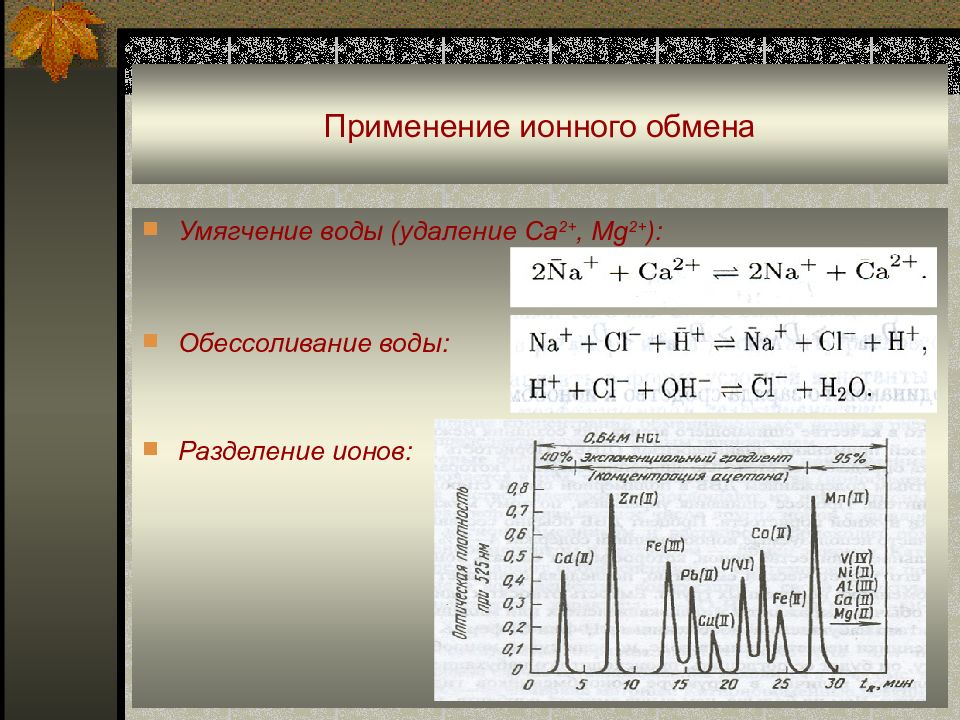
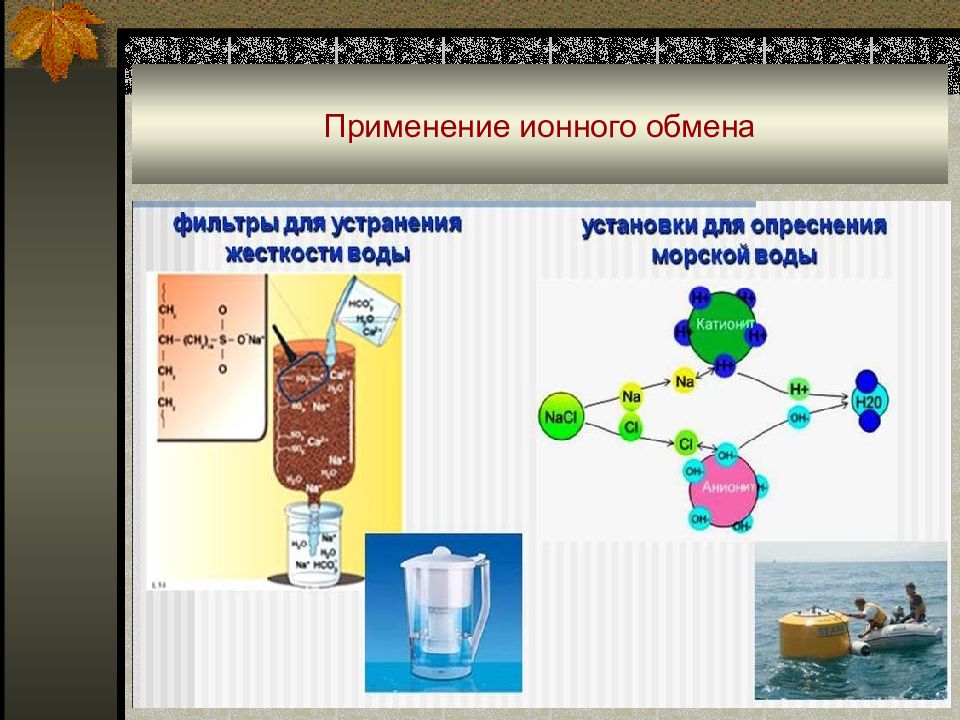
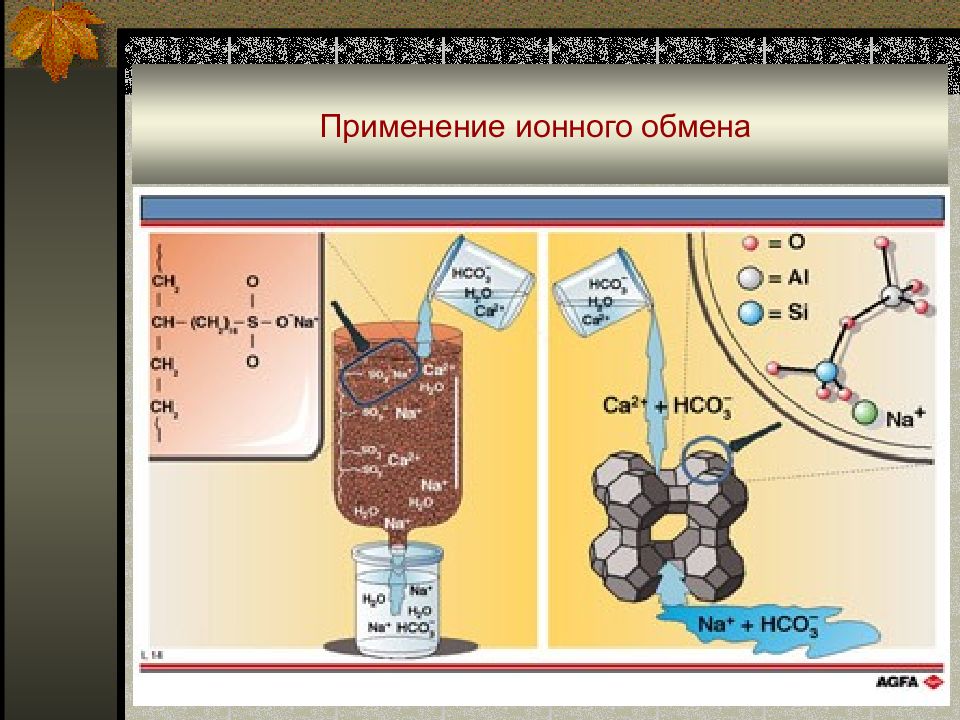
Слайд 61: Применение ионного обмена
Умягчение воды ( удаление Ca 2+, Mg 2+ ): Обессоливание воды : Разделение ионов :
Слайд 68: Кремнеземы
Кремнезем – диоксид кремния ( кристаллический, аморфный или гидратированный ) с поверхностными группами ≡ Si-OH. Аморфный кремнезем : - аэросилы – безводные аморфные частицы, получаемые при высокой температуре ; - аэросиликагели ( силохромы ) – однородная форма с удельной поверхностью 70-150 м 2 /г; - силикагели – сухие гели поликремниевой кислоты ; - пористые стекла – особая форма аморфного кремнезема.
Слайд 69: Кремнеземы
Химически модифицированные кремнеземы (ХМК) – с химически привитыми молекулами органических соединений :
Слайд 71: Электрохимические методы разделения
Электролитическое выделение – осаждение вещества электрическим током при контролируемом потенциале : - катодное осаждение (Hg – катод ) Fe, Cr, Zn, Ni, Pb, Co, Sn, Mo, Cu, Ag, Cd восстанавливаются до металлического состояния ( образуются амальгамы, легко разлагающиеся водой с образованием гидроксидов ); AI, Ti, U, Mg, Be, V, Zr, As, P остаются в растворе ; - анодное осаждение, например, в форме оксидов PbO 2 используют редко.
Слайд 72: Электрохимические методы разделения
Цементация ( внутренний электролиз ) – восстановление компонентов на электроотрицательных металлах или их амальгамах ; при работе анод окисляется, а высвобождающиеся электроны восстанавливают ионы металла ; пример – выделение микроэлементов из воды на металлах - цементаторах AI, Mg, Zn
Слайд 74: Электрофорез
Метод основан на различиях в скоростях движения частиц разного заряда, формы и размера в электрическом поле : где z – заряд частицы ; - ее скорость ; H – напряженность электрического поля ; r – радиус частицы ; - вязкость среды. ■ Обычно используют эффективный радиус частицы r + l ( I – толщина гидратной оболочки) и эффективный заряд z* с учетом ионной атмосферы. = zH/6 r
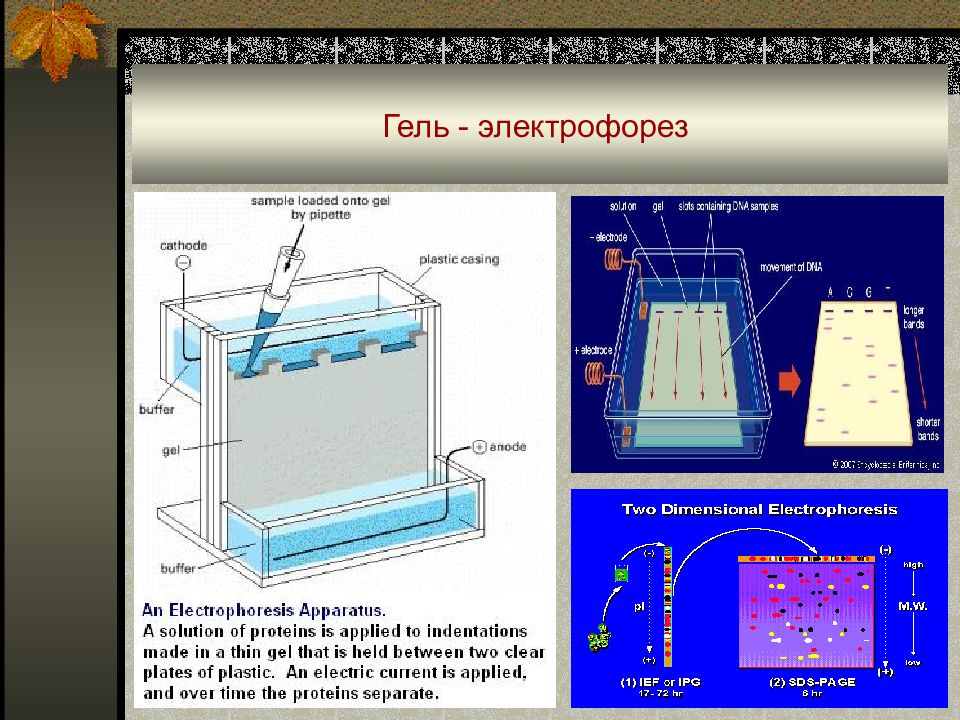
Слайд 75: Классический электрофорез
В основе методов электрофореза лежит явление миграции ионов, т.е. их движение в электрическом поле. Классический электрофорез (с носителем и без него) используют в исследованиях по биохимии и молекулярной биологии для разделения, выделения и определения белков, полинуклеотидов и других биополимеров ; электрофорез без носителя предложен А. Тизелиусом (Нобелевская премия, 1948 г.).
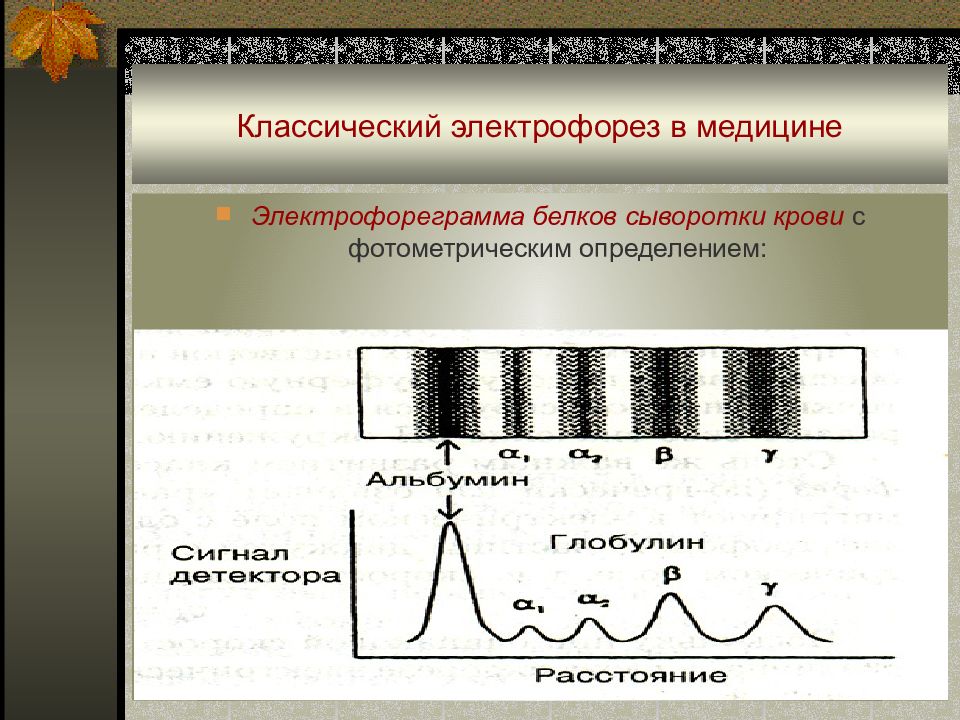
Слайд 76: Классический электрофорез в медицине
Электрофореграмма белков сыворотки крови с фотометрическим определением :
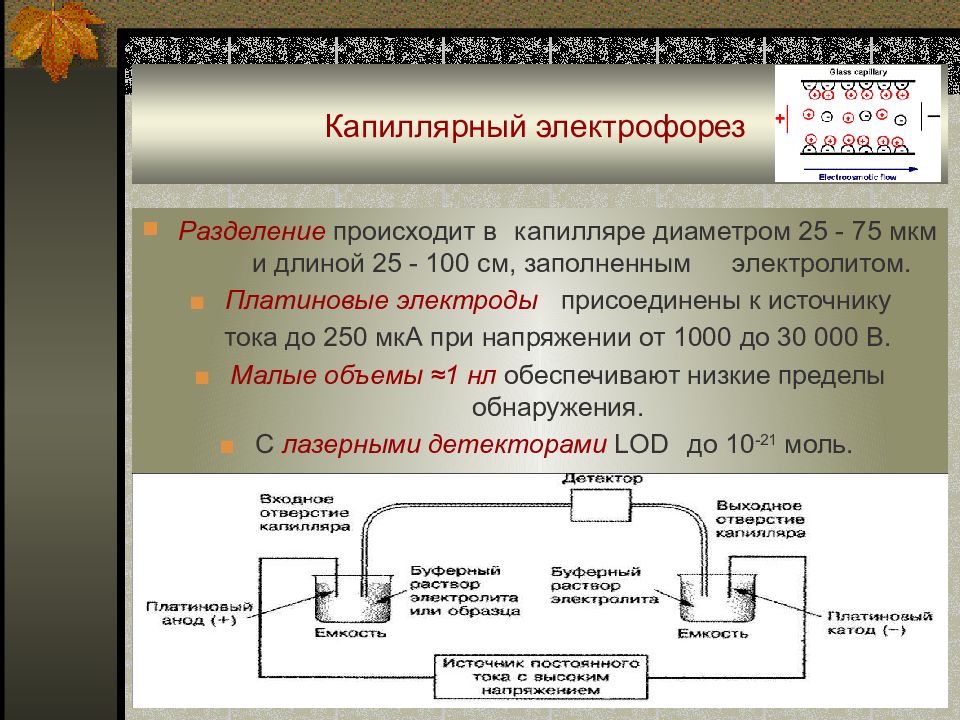
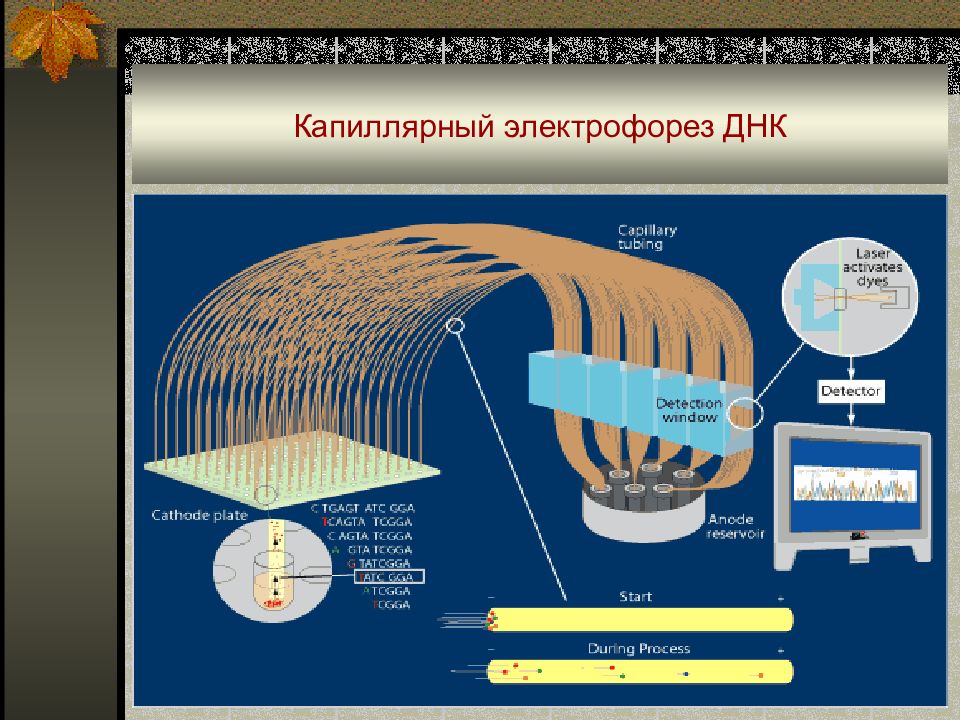
Слайд 77: Капиллярный электрофорез
Разделение происходит в капилляре диаметром 25 - 75 мкм и длиной 25 - 100 см, заполненным электролитом. ■ Платиновые электроды присоединены к источнику тока до 250 мкА при напряжении от 1000 до 30 000 В. ■ Малые объемы ≈1 нл обеспечивают низкие пределы обнаружения. ■ С лазерными детекторами LOD до 10 -21 моль.
Слайд 80: Диализ
Метод разделения и концентрирования растворенных веществ ( значительно различающихся по молекулярным массам, например, биологически активные вещества ); основан на различиях в скоростях диффузии веществ через полупроницаемую мембрану ( целлюлоза, иониты ) между концентрированным и разбавленным растворами ; различают электродиализ :
Слайд 82: Методы испарения
Дистилляция – разная летучесть веществ ; вещество переходит из жидкого состояния в газообразное, а затем при конденсации снова образует жидкую (твердую) фазу. Простой дистилляцией успешно отделяют AsCI 3, AsBr 3, OsO 4, RuO 4 от многих ионов. Для разделения многокомпонентных систем используют принцип фракционной дистилляции в ректификационной колонке ( противоточное прохождение части конденсата и поднимающихся вверх паров, между которыми происходит интенсивный обмен ).
Слайд 83: Отгонка
Простая отгонка – выпаривание, как правило, используют при отделении матрицы : - нагревание с помощью водяной бани ; - выпаривание ИК - лампой ; - сушка под вакуумом в замороженном состоянии ( лиофильная сушка ); - сухая и мокрая минерализация (в частности, сжигание органических и биологических проб ); используют автоклавы при повышенных температурах и давлении.
Слайд 84: Отгонка
■ Для перевода компонентов в летучие соединения применяют различные газообразные, жидкие и твердые вещества : F 2, CI 2, Br 2, HCI, HF, CCI 4, BBr 3, AICI 3 ; используют специальные камеры, в частности, графитовые.
Слайд 85: Возгонка (сублимация), химические транспортные реакции
Возгонка (сублимация) - процесс испарения вещества путем непосредственного перехода его из твердого состояния в газообразное (возможна, когда вещество, будучи нагрето до температуры ниже точки его плавления, характеризуется достаточно высоким давлением паров) : - пример : атомно-эмиссионное определение 16 микрокомпонентов ( Ag, AI, Au, Ca, Cr, Cu, Fe, Mg, Mg, Ni, Pb, Sb, Sn, Ni, V, Zn) в йоде после сублимации матрицы при 60-65 0 С.
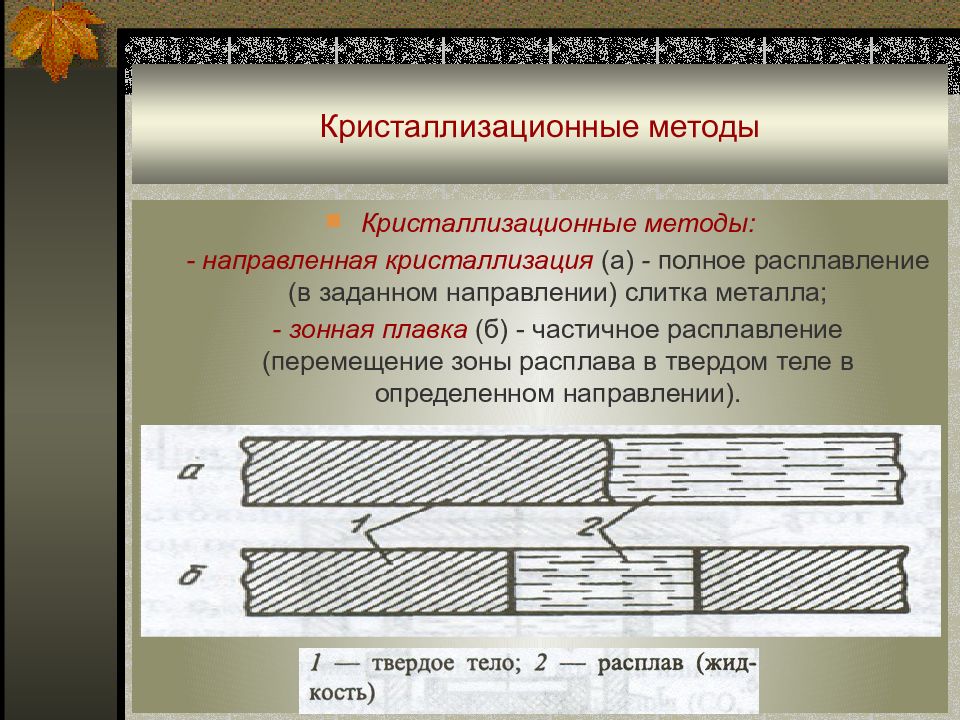
Слайд 86: Кристаллизационные методы
Кристаллизационные методы : - направленная кристаллизация (а) - полное расплавление (в заданном направлении) слитка металла ; - зонная плавка (б) - частичное расплавление (перемещение зоны расплава в твердом теле в определенном направлении).
Слайд 87: Другие методы разделения и концентрирования
Фильтрация – процесс движения жидкости или газа через пористую среду, сопровождающийся отделением взвешенных частиц ; например, примеси (10 -6 - 10 -7 %) As, Co, Cr, Mn, Mo, Ni, Pb, Sb, Sn, Sr, Ti, V, Zn, Zr в атмосферной пыли определяют АЭС путем пропускания пробы через фильтр, который анализируют после его озоления. Диффузия и термодиффузия – для разделения и очистки газообразных веществ используют различия в скоростях диффузии через пористые перегородки : для двух газов 1 / 2 = √M 2 / √M 1. Разделение и очистка в гравитационном поле – центрифугирование ( кристаллизация в центробежном поле ).