Первый слайд презентации
16.02.2019 Кафедра фундаментальной и клинической биохимии Тема лекции: Введение. Современные направления развития медицины. Методы исследования в медицине. Профессор Литвинова Т.Н.
Слайд 3
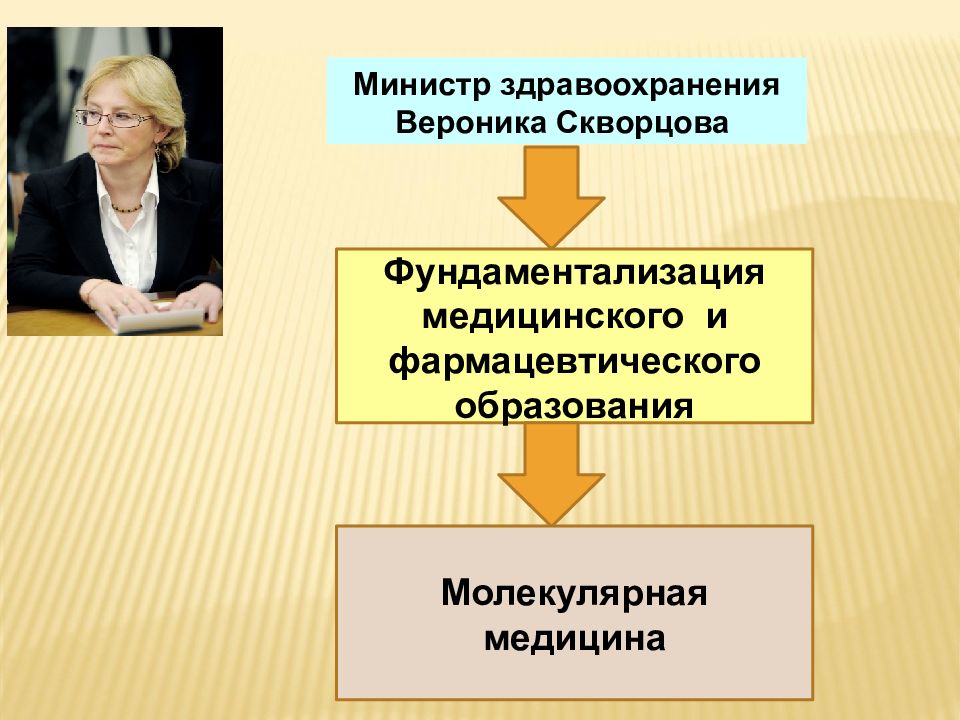
Министр здравоохранения Вероника Скворцова Фундаментализация медицинского и фармацевтического образования Молекулярная медицина
Слайд 4: Молекулярная медицина
16.02.2019 Молекулярная медицина Молекулярно-генетическая диагностика инфекционных и наследственных заболеваний Рекомбинантные белки Терапевтические антитела Генная терапия Клеточная терапия Клонирование и регенерация тканей Наномедицина
Слайд 5: Молекулярно-генетическая диагностика
16.02.2019 Молекулярно-генетическая диагностика Определение структуры генов человека для выявления мутаций и полиморфизмов. Определение структуры генов вирусов или бактерий для идентификации возбудителя инфекционной болезни. Определение активности генов человека для диагностики и подбора лекарств. Количественное определение возбудителя инфекционной болезни в жидкостях и тканях.
Слайд 6
16.02.2019 Сферы применения генодиагностики : Трансфузиология и трансплантация Антигенные характеристики для переливания совместимой донорской крови Подбор доноров для пересадки органов
Слайд 7
16.02.2019 Сферы применения генодиагностики • ПЦР-диагностика инфекционных заболе- ваний ( Полимеразная цепная реакция (ПЦР) – высокоточный метод молекулярно-генетической диагностики, который позволяет выявить у человека различные инфекционные и наследственные заболевания, как в острой и хронической стадии, так и задолго до того, как заболевание может себя проявить (Кэри Мюллис (США),1993 год Нобелевская премия по химии) • Идентификация личности • Судебно-медицинская экспертиза • Установление родственных связей • Разработка генетических препаратов
Слайд 8
16.02.2019 Сферы применения генодиагностики Пренатальная диагностика Диагностика заболеваний человека
Слайд 9: Рекомбинантные белки
16.02.2019 Рекомбинантные белки Урокиназа человека, экспрессированная в клетках кишечной палочки - выделенный и очищенный препарат используется для разрушения тромбов при инфаркте миокарда Рекомбинантные белки - результат новых комбинаций генов, которые формируют ДНК. Рекомбинантные технологии ДНК позволяют получать модифициро-ванные белки человека и млекопитающих в больших количествах.
Слайд 10: Терапевтические антитела
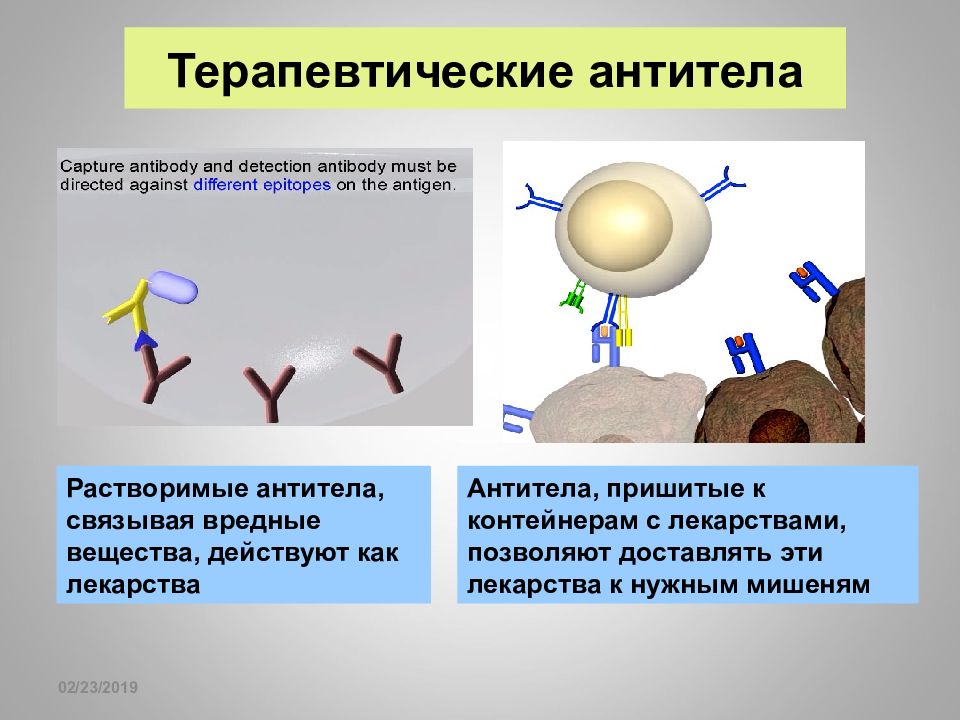
16.02.2019 Терапевтические антитела Растворимые антитела, связывая вредные вещества, действуют как лекарства Антитела, пришитые к контейнерам с лекарствами, позволяют доставлять эти лекарства к нужным мишеням
Слайд 11: Генная терапия
16.02.2019 Генная терапия Разрешено к применению (муковисцедоз, гемофилия В и др.) Клинические испытания (гемофилилия А и др.) Экспериментальные разработки (иммунодифицит и др.) Г.т. - внесение изменений в генети-ческий аппарат соматических клеток человека в целях лечения заболеваний.
Слайд 12
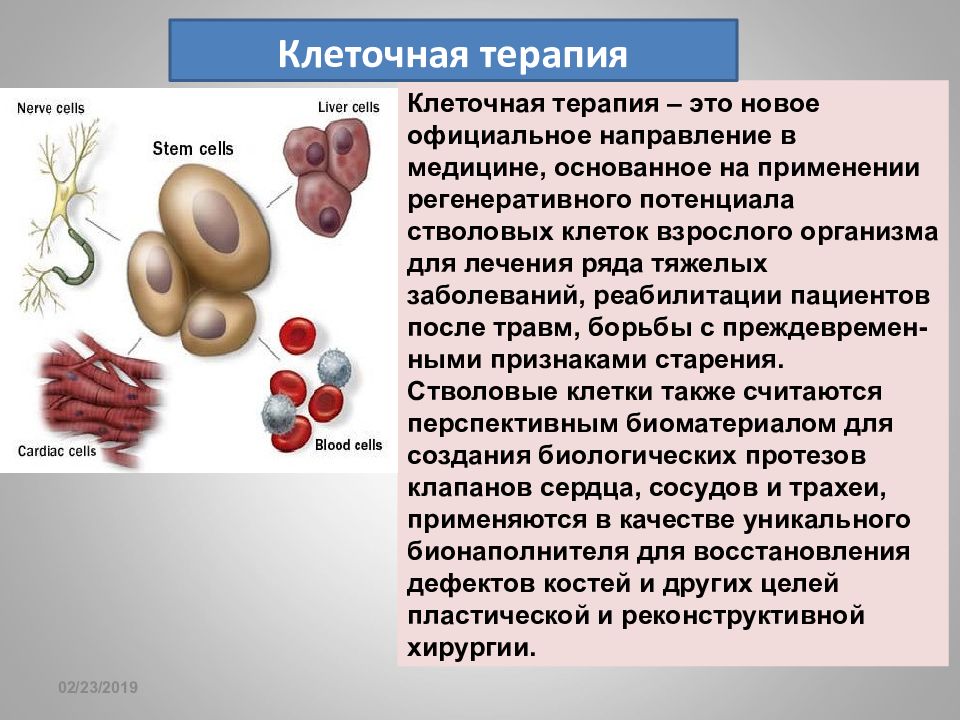
16.02.2019 Клеточная терапия – это новое официальное направление в медицине, основанное на применении регенеративного потенциала стволовых клеток взрослого организма для лечения ряда тяжелых заболеваний, реабилитации пациентов после травм, борьбы с преждевремен-ными признаками старения. Стволовые клетки также считаются перспективным биоматериалом для создания биологических протезов клапанов сердца, сосудов и трахеи, применяются в качестве уникального бионаполнителя для восстановления дефектов костей и других целей пластической и реконструктивной хирургии. Клеточная терапия
16.02.2019 Стволовые клетки – это клетки, способные как к самообновлению, так и к дифференцировке в специализированные клетки
Слайд 14: Клеточная терапия
16.02.2019 Клеточная терапия Основные итоги: Разработаны технологии культивирования стволовых клеток пациентов для лечения инфаркта миокарда, ожогов, пародонтоза и предотвращения ампутации конечностей при диабете Проблема: у нас недостаточно знаний о том, на что способны те же стволовые клетки в биологическом плане. Нам обязательно нужно расширить понимание этих важнейших вопросов, если мы хотим быть уверенными в том, что произойдет в случае их пересадки пациенту. Жером Гише - директор Франц. института здравоохранения и медицинских исследований. До операции После операции
Слайд 15
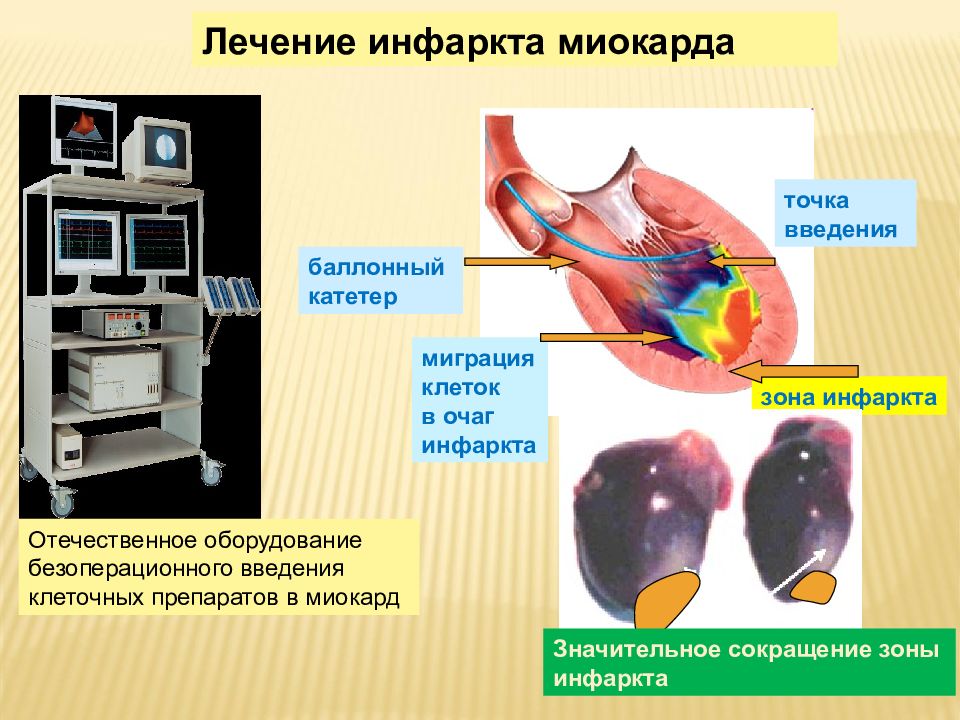
зона инфаркта точка введения баллонный катетер Отечественное оборудование безоперационного введения клеточных препаратов в миокард миграция клеток в очаг инфаркта Значительное сокращение зоны инфаркта Лечение инфаркта миокарда
Слайд 16: Клеточная терапия
16.02.2019 Клеточная терапия Американские ученые впервые научно подтвердили, что маломощное световое излучение способствует регенерации тканей за счет активации стволовых клеток. Результаты их исследования закладывают основу для разработки новых подходов в реставрационной стоматологии и регенеративной медицине, например, в области заживления ран и восстановлении костной ткани.
Слайд 17
16.02.2019 Регенеративная медицина - генная терапия; - клеточная терапия; - тканевая инженерия; - регуляция эндогенных регенеративных процессов Заболевания, которые можно вылечить только методами генной и клеточной терапии • Ишемия сердца после инфаркта • Сердечная недостаточность • Некоторые виды раковых опухолей • Цирроз печени • Диабет I типа • Паркинсонизм • Болезнь Альцгеймера • Дегенеративные заболевания сетчатки • Деструктивные заболевания суставов • Травматическое повреждение спинного мозга
Слайд 18
16.02.2019 Наномедицина: Применение нанотехнологии в здравоохранении Создается европейская технологическая платформа в области наномедицины и сформулированы стратегические направления исследований: 1. Нанодиагностика, включая визуализацию 2. Направленная доставка и контролируемое высвобождение лекарственных веществ 3. Регенеративная медицина Наномедицина США: применение нанотехнологии для диагностики, лечения и контроля состояния пациента В США в 2005-2006 гг. создано 8 центров развития наномедицины
Слайд 19: Нанотехнологии в медицине
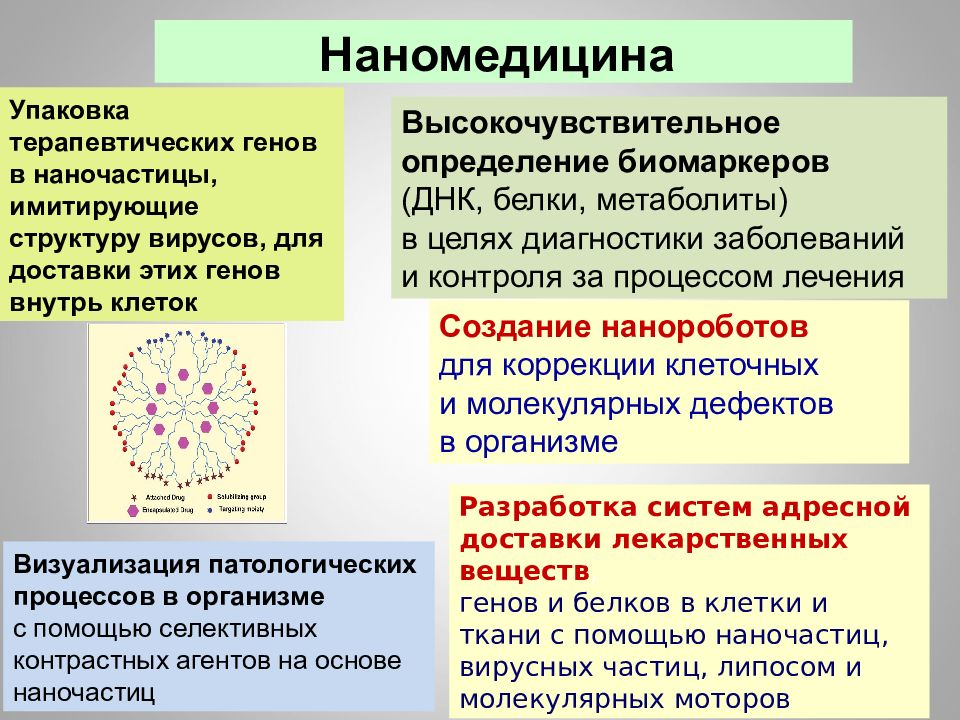
16.02.2019 Создание нанороботов для коррекции клеточных и молекулярных дефектов в организме Нанотехнологии в медицине Разработка систем адресной доставки лекарственных веществ, генов и белков в клетки и ткани с помощью наночастиц, вирусных частиц, липосом и молекулярных моторов Высокочувствительное определение биомарке-ров (ДНК, белки, метаболиты) в целях диагностики заболеваний и контроля за процессом лечения Визуализация патологических процессов в организме с помощью селективных контрастных агентов на основе наночастиц
Слайд 20: Наномедицина
16.02.2019 Наномедицина Упаковка терапевтических генов в наночастицы, имитирующие структуру вирусов, для доставки этих генов внутрь клеток Высокочувствительное определение биомаркеров (ДНК, белки, метаболиты) в целях диагностики заболеваний и контроля за процессом лечения Создание нанороботов для коррекции клеточных и молекулярных дефектов в организме Разработка систем адресной доставки лекарственных веществ, генов и белков в клетки и ткани с помощью наночастиц, вирусных частиц, липосом и молекулярных моторов Визуализация патологических процессов в организме с помощью селективных контрастных агентов на основе наночастиц
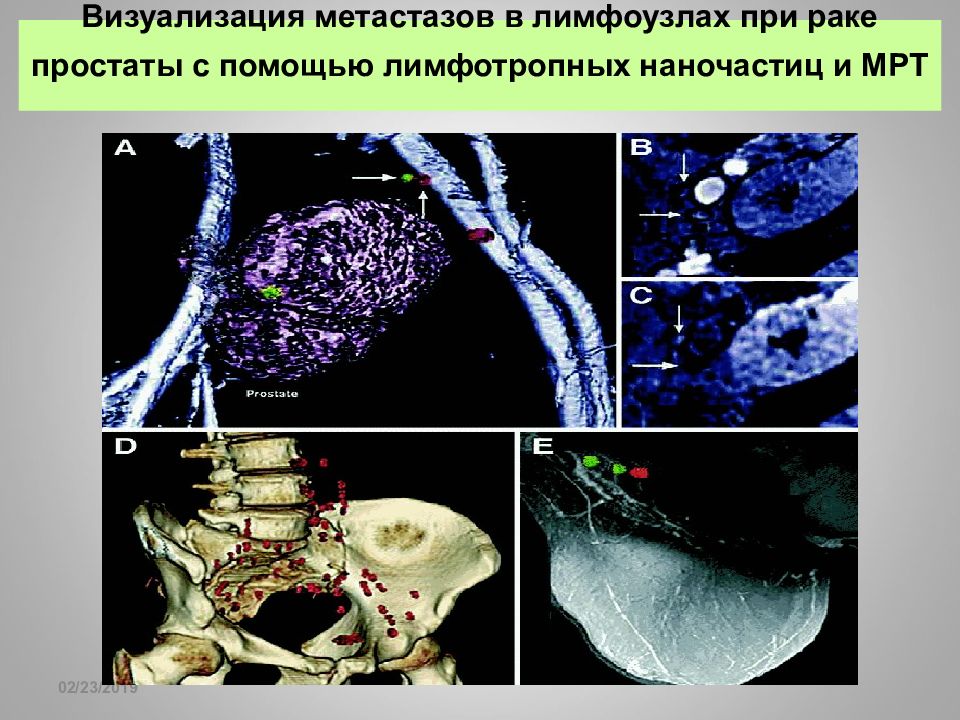
Слайд 21: Визуализация метастазов в лимфоузлах при раке простаты с помощью лимфотропных наночастиц и МРТ
16.02.2019 Визуализация метастазов в лимфоузлах при раке простаты с помощью лимфотропных наночастиц и МРТ
Слайд 22
16.02.2019 Возможное участие наночастиц в развитии патологии Наночастица ↓ Проникновение наночастиц в клетки различных тканей ↓ Накопление наночастиц в ядре и цитоплазме клеток ↓ Инициация агрегации белков, нарушение защитных систем клетки ↓ Накопление в клетке нерастворимых агрегатов белков ↓ Смерть клеток, развитие патологий, связанных с накоплением агрегатов белков (болезни Паркинсона, Альцгеймера, трансмиссивные нейропатии и др.) «Все в мире есть яд, и лишь только доза делает вещество безопасным» Парацельс
Слайд 23
16.02.2019 Персонифицированная медицина Многофакторные заболевания (оценка индивидуального риска предрасположенности) Заболевания ССС, онкологические заболевания, болезнь Альцгеймера, сахарный диабет, стеопороз, тромбофилии, осложнения беременности, бесплодие, алкоголизм, наркомания • Подготовка супружеской пары к беременности и родам • Генетический паспорт • Оценка физических возможностей (для спортсменов) • Подготовка к операции • Обследование при назначении гормональной терапии
Слайд 24: Перспективы молекулярной медицины
16.02.2019 Перспективы молекулярной медицины Молекулярная медицина Генетика Физиология Химия Биохимия Персонифицированная медицина : Генодиагностика Протеомика (инвентаризация белков в клетке) Компьютерная диагностика Регенеративная медицина : Генная терапия Клеточная терапия Тканевая инженерия Регуляция регенеративных процессов в организме ФГОС
Слайд 25: Лабораторная диагностика
16.02.2019 Лабораторная диагностика Л.Д. - совокупность физико-химических, биохимических и биологических методов диагностики, исследующих отклонения в составе и изменения свойств тканей и биологических жидкостей больного, а также выявляющих возбудителей болезней. Среди диагностических исследований в мировой практике суммарная стоимость лабораторных исследований занимает первое место. Л.Д – самостоятельный раздел клинической медицины.
Слайд 26: Лабораторная диагностика
16.02.2019 Лабораторная диагностика Задачи лабораторной диагностики : разработка методов лабораторных исследований; разработка требований к качеству выполнения аналитических методов и средств обеспечения этих требований, установление пределов нормальных индивидуальных колебаний каждого исследуемого параметра состава и свойств биологических жидкостей и тканей; 4) изучение закономерных связей лабораторно выявляемых патологических отклонений с сущностью патологического процесса при конкретных заболеваниях; 5) установление диагностической, дифференциально-диагностической и прогностической ценности отдельных лабораторных тестов и их комбинаций; 6) создание диагностических лабораторных программ для оптимизации диагностики.
Слайд 27: Лабораторная диагностика
16.02.2019 Лабораторная диагностика Теоретической основой Л.Д. являются как медицинские, так и фундаментальные науки, прежде всего химия, биохимия, физика, биофизика, молекулярная биология, микробиология, математика, развитие которых определяет прогресс возможностей и качества Л.Д. В соответствии с объектами и методами исследования формируются : клиническая биохимия, токсикология, клиническая микробиология, клиническая иммунология, клиническая паразитология, клиническая цитология; клиническая иммунология и др.
Слайд 28: Лабораторная диагностика
16.02.2019 На современном этапе развития Л.Д. наиболее совершенными являются методы, имитирующие эндогенные обменные процессы, т. е. методы, основанные на образовании антител, рецепторном взаимодействии, различные виды белок-связывающего анализа для определения гормонов, методы с применением пептидных субстратов с хромогенной или люминесцентной меткой для оценки активности различных ферментов. Лабораторная диагностика
Слайд 29: Лабораторная диагностика
16.02.2019 Правильную диагностическую информацию с помощью лабораторных исследований можно получить, зная нормальные величины данного лабораторного теста, пределы внутри- и межиндивидуальных колебаний и влияние на них различных факторов. Источниками вариабельности показателей Л.д. являются такие биологические факторы, как возраст, пол, масса и поверхность тела (особенно важны при обследовании детей); околосуточные месячные и сезонные ритмы; этническое происхождение; условия, в которых производится забор материала для анализа (положение тела, физическое напряжение, прием жидкости, курение, прием лекарств, стресс и др.), а также климатогеографические условия и экологическая обстановка в районе проживания больного. Лабораторная диагностика
Слайд 30: Лабораторная диагностика
16.02.2019 Истинно нормальными (референтными) считают величины лабораторных показателей, установленные в группах тщательно обследованных здоровых лиц в возрасте 20 - 30 лет, а нормальными для контингента, отличающегося по каким-либо признакам (по полу, возрасту, профессии, месту обитания и т.д.), — величины этих показателей у здоровых лиц данного контингента. При этом в оценке отклонений величины какого-либо показателя учитывают и так называемую индивидуальную норму — величину показателя у данного пациента, установленную ранее при профилактических и диспансерных обследованиях. Надежность результатов зависит от качества применяемых лабораторией методов, приборов, реактивов, калибровочных материалов, от тщательности работы персонала. Лабораторная диагностика
Слайд 31: Лаборатории
16.02.2019 Лаборатории Научно-исследовательские лаборатории: Физические Химико-биологические Бактериологические 2. Клинико-диагностические лаборатории : лаборатории общего типа производят общеклинические, гематологические, биохимические, иммунологические, цитологические, серологические, микробиологические и другие виды исследований. специализированные лаборатории создаются в составе диспансеров, госпиталей, женских консультаций, роддомов, санаториев и т. д., они выполняют общие и специальные лабораторные исследования в соответствии с профилем учреждения.
Слайд 32: Классификация методов анализа
16.02.2019 Классификация методов анализа 1. По объектам анализа : неорганический и органический. 2. По цели : качественный и количественный. Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа количественный анализ дает возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом объекте. Методы качественного и количественного анализа, позволяющие определить в анализируемом веществе содержание отдельных элементов, называют элементным анализом ; функциональных групп – функциональным анализом ; индивидуальных химических соединений, характеризующихся определенной молекулярной массой, – молекулярным анализом.
Слайд 33: Классификация методов анализа
16.02.2019 Совокупность разнообразных химических, физических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом. 3. По способу выполнения: химические, физические, физико-химические (инструментальные) методы. 4. По массе пробы : Макро – (>> 0,10г), Полумикро – (0,10 – 0,01г), Микро – (0,01 – 10 −6 г), Ультрамикроанализ (< 10 −6 г ). Классификация методов анализа
Слайд 34: Физические методы анализа
16.02.2019 Физические методы анализа Эти методы основаны на использовании зависимости физических свойств вещества от их химического состава. Спектральный анализ основан на исследовании спектров поглощения и испускания исследуемого вещества. По интенсивности характеристических спектральных линий судят о количественном составе вещества. Изобретение спектрального анализа принадлежит немецким ученым - физику Г. Кирхгофу и химику Р. Бунзену (1859 г.) Спектроскоп Бунзена – Кирхгофа
Слайд 35: Физические методы анализа
16.02.2019 2. Люминесцентный анализ основан на зависимости интенсивности люминесценции (свечения) от концентрации вещества. Эту зависимость впервые установил русский ученый С. И. Вавилов (1891-1951). молекула + h ν →молекула* (возбужденное состояние) Эту реакцию можно осуществить за счет: света – фотолюминесценция; рентгеновских лучей – рентгенолюминесценция ; радиоактивного излучения – радиолюминесценция ; химических реакций – хемилюминесценция. Эти методы, обладая очень низким пределом обнаружения (10 −6 – 10 −8 %, иногда до 10 −9 %) оказались весьма эффективными при анализе редких и рассеянных элементов, высокочистых веществ. Физические методы анализа
Слайд 36: Физические методы анализа
16.02.2019 Физические методы анализа 3. Рефрактометрия – зависимость показателя преломления от концентрации. Преломление ( рефракция ) – изменение направления прямолинейного распространения при переходе из одной среды в другую, при этом происходит взаимодействие света со средой. Рефрактометрия – измерение преломления света, которое оценивается величиной показателя преломления. Метод отличается простотой выполнения и обеспечивает точность до 10 −3 %, поэтому находит широкое применение. В фармацевтическом анализе этот метод применяется для идентификации лекарственных веществ, установления их чистоты и количественного анализа. Универсальный лабораторный рефрактометр ИРФ 454-Б2М - высокоточный оптический прибор, предназначенный для определения коэффициента рефракции, величины дисперсии жидкостей, твердых тел, а также для определения содержания сахара в водных растворах.
Слайд 37: Физические методы анализа
16.02.2019 4. Денсиметрия – зависимость плотности от концентрации вещества Царь Гиерон поручил физику Архимеду определить состав золотой короны. Архимед по плотности определил, что она состоит не из чистого золота, а из сплава золота и серебра. Определение проводят с помощью денсиметра (ареометра). Имеются таблицы зависимости концен- трации от плотности растворов различных кислот, оснований и солей. Метод находит широкое приме- нение в аналитической химии, так как от концентрации реагентов зависят многие параметры протекания химических реакций. По изменению плотности костей судят об их состоянии при лечении остеопороза. Физические методы анализа
Слайд 38: Физические методы анализа
16.02.2019 5. Рентгеноструктурный анализ – для исследования веществ используют рентгеновские лучи (анализ сплавов, металлов, материалов и др). 6. Магнитная спектроскопия. В последнее время метод ядерного магнитного резонанса ( ЯМР ) и электронного парамагнитного резонанса ( ЭПР ) нашли широкое применение в аналитической химии, медицине ЯМР основан на использовании обусловленного ядерным магнетизмом резонансного поглощения электромагнитных волн исследуемым веществом. ЭПР – использование явления резонансного поглощения электромагнитных волн парамагнитными частицами в постоянном магнитном поле. Физические методы анализа
Слайд 39: Физические методы анализа
16.02.2019 Явление ядерного магнитного резонанса ( ЯМР ), открытое в 1945 г. Ф. Блохом и Э. Перселлом, лауреатами Нобелевской премии, легло в основу создания нового вида спектроскопии, который в очень короткий срок превратился в один из самых информативных методов исследования молекулярной структуры и динамики молекул, межмолекулярных взаимодействий, механизмов химических реакций и количественного анализа веществ в различных агрегатных состояниях. Начиная с 1953 г., когда были выпущены первые спектрометры ЯМР, техника ЯМР непрерывно совершенствуется, лавинообразно нарастает поток исследований, возникают новые и расширяются традиционные области применения в химии, физике, биологии и медицине. Физические методы анализа
Слайд 40: Физические методы анализа
16.02.2019 7. Атомно-абсорбционный метод основан на способности атомов металлов в газах пламени по- глощать световую энергию при определенном значении длины волны. Атомно-абсорбционный метод позволяет определять примеси до 10 −12 %. Около 70 % элементов периодической системы Д.И. Менделеева определены этим методом. В Японии изготавливают приборы, позволяющие одновременно определять более 70 элементов. Физические методы анализа
Слайд 41
16.02.2019 Физико-химические методы анализа и исследования – это условное название большого числа способов количественного и качественного определения веществ, которые предполагают, как правило, применение различных, часто довольно сложных, измерительных приборов. За рубежом распространен термин “инструментальные методы анализа” или “приборные методы”. В основе физико-химических методов лежат законы физики и физической химии, а аппаратурное оформление основано на применении современных достижений оптики и электроники.
Слайд 42
16.02.2019 Наибольшее практическое значение среди ФХМА имеют следующие: 1) оптические методы; 2) электрохимические методы; 3) хроматографические методы анализа Оптические методы исследования веществ основаны на способности этих веществ порождать оптическое излучение или взаимодействовать с ним. Колориметрия широко применяется в санитарно-гигиенических лабораториях и при клинических исследованиях, в частности, крови.
Слайд 43
16.02.2019 Измерения с помощью колориметра отличаются простотой и быстротой проведения. Точность их во многих случаях не уступает точности других, более сложных методов химического анализа. Нижние границы определяемых концентраций в зависимости от метода составляют от 10 −3 до 10 −8 моль/л.
Слайд 44
16.02.2019 Микропланшетный ридер Anthos 2020 предназначен для использования в in vitro диагностике. Фотометр имеет встроенный компьютер и экран, отображающий каждый этап работы и облегчающий конструирование тестов и их проведение. Микропланшетные фотометры фирмы Anthos серии Зенит (Zenyth 340) – это универсальные ридеры для всех типов колориметрических измерений.
Слайд 45
16.02.2019 Мощность светового потока, прошедшего через исследуемый раствор определяется с помощью фотодетекторов – приемников светового излучения. В современной аппаратуре это, в основном, фотоэлементы и фотодиоды. Спектрофотометры, приборы, в которых монохроматическое излучение создается при помощи монохроматора.
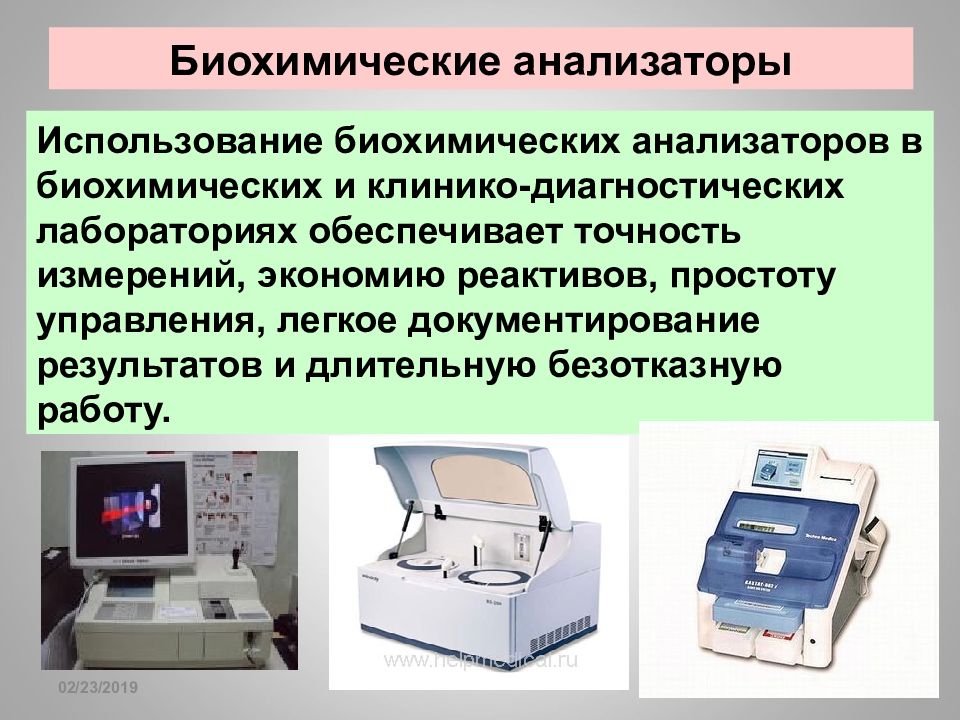
Слайд 46: Биохимические анализаторы
16.02.2019 Биохимические анализаторы — приборы, использующие для клинических и химических исследований различные механические и компьютерные технологии. С их помощью возможно определение наличия и концентрации электролитов, субстратов, ферментов, липидов, специфических белков, гормонов, лекарственных препаратов и наркотических веществ в практически любых видах биологического материала: сыворотка, плазма, спинномозговая жидкость, моча. Биохимические анализаторы
Слайд 47: Биохимические анализаторы
16.02.2019 Различают полностью автоматические и полуавтоматические биохимические анализаторы. Первые выполняют большинство операций: отбор материала и необходимых реагентов, их смешивание и нагрев, анализ и обработка полученных данных, их распечатка и промывание оборудования после завершение всех процедур с исследуемыми образцами автоматически. Полуавтоматические биохимические анализаторы требуют подготовки анализируемых реакционных смесей вручную и их использование больше подходит для небольших лабораторий с малым количеством исследуемых материалов. Биохимические анализаторы
Слайд 48: Биохимические анализаторы
16.02.2019 Биохимические анализаторы для автоматизации процесса подготовки и проведения анализов могут быть укомплектованы: — роботами-манипуляторами (со встроенными термоэлементами); — лабораторными центрифугами под картриджи с реагентами и для пробирок с пробами; — различными системами обработки информации для формирования рабочих листов, регистрации пациентов и формирования базы данных по ним, контроля для ходом реакций, расчетом концентрации и необходимых материалов и распечатки результатов. Биохимические анализаторы
Слайд 49: Биохимические анализаторы
16.02.2019 Использование биохимических анализаторов в биохимических и клинико-диагностических лабораториях обеспечивает точность измерений, экономию реактивов, простоту управления, легкое документирование результатов и длительную безотказную работу. Биохимические анализаторы
Слайд 50
16.02.2019 Бионеорганическая химия возникла на основе биологии, биохимии и неоргани- ческой химии, изучает химические реакции, протекающие в живой клетке с участием неорганических ионов. Бионеорганическая химия – это химия ионов биометаллов и их биокомплексов
Слайд 51: БОХ – фундаментальная наука на стыке химии и биологии
16.02.2019 БОХ – фундаментальная наука на стыке химии и биологии Биоорганическая химия — наука, которая изучает связь между строением органических веществ и их биологическими функциями. Объектами изучения являются биологически важные природные и синтетические соединения, такие как биополимеры, витамины, гормоны, антибиотики, лекарственные препараты и т.д. В задачи биоорганической химии входит изучение строения и синтез природных и синтетических биологически активных соединений, выяснение зависимости между их строением и биологическим действием, изучение их химических превращений внутри и вне организмов.
Слайд 53
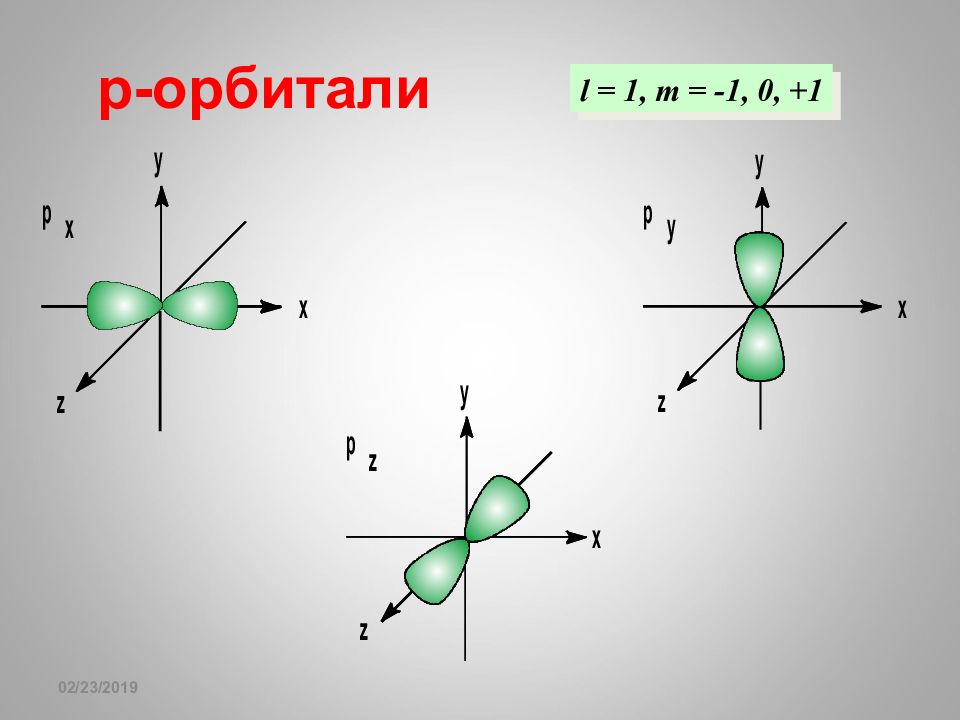
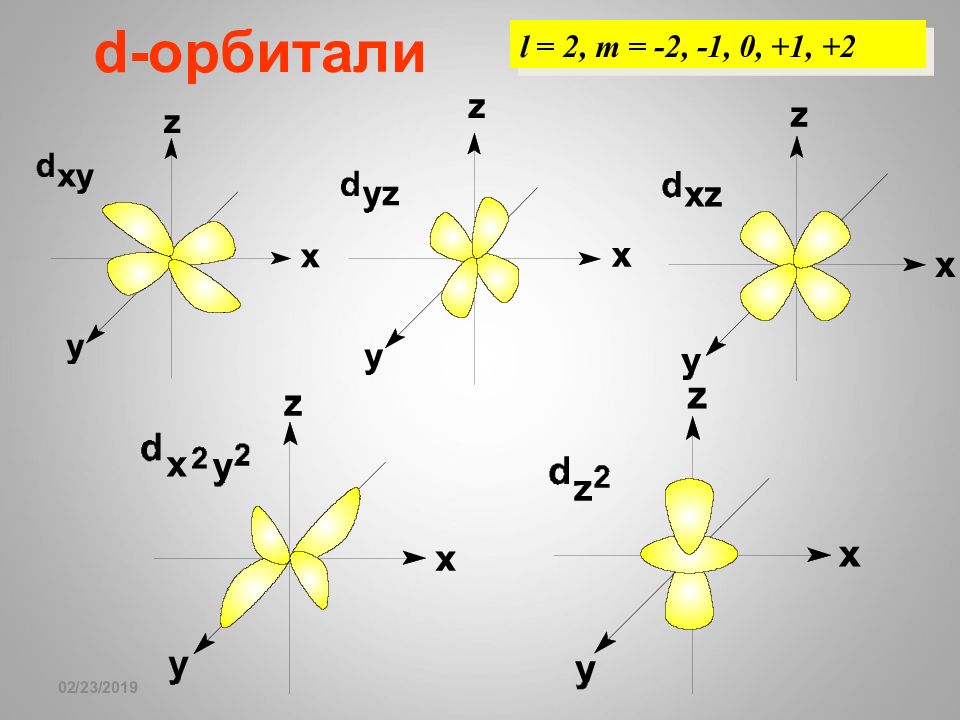
16.02.2019 КВАНТОВЫЙ «ПАСПОРТ» ЭЛЕКТРОНА n = 3 l = 0 l = 1 l = 2 Значения числа m l 0 -1 0 +1 -2 -1 0 +1 +2 s p d КВАНТОВАЯ «СЕТКА» АТОМА 1 2 3 s p d n
Слайд 59: Многоэлектронный атом
16.02.2019 Многоэлектронный атом Фундаментальные закономерности Принцип минимума энергии Первое правило Клечковского Из двух конкурентных орбиталей первой заполняется та, для которой меньше сумма значений главного и орбитального квантового числа ( n + l ) Второе правило Клечковского Если сумма значений главного и орбитального квантового числа у двух орбиталей одинакова, первой заполняется орбиталь с меньшим значением главного квантового числа
Слайд 60
16.02.2019 4 s < 3 d < 4 p 5 s < 4 d < 5 p 1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f < 5 d < 6 p < 7 s … Принцип исключения Паули – в одном атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел
Слайд 61
16.02.2019 Правило Хунда (Гунда) требует, чтобы заполнение электронами орбиталей происходило так, чтобы суммарный спин системы был максимальным.
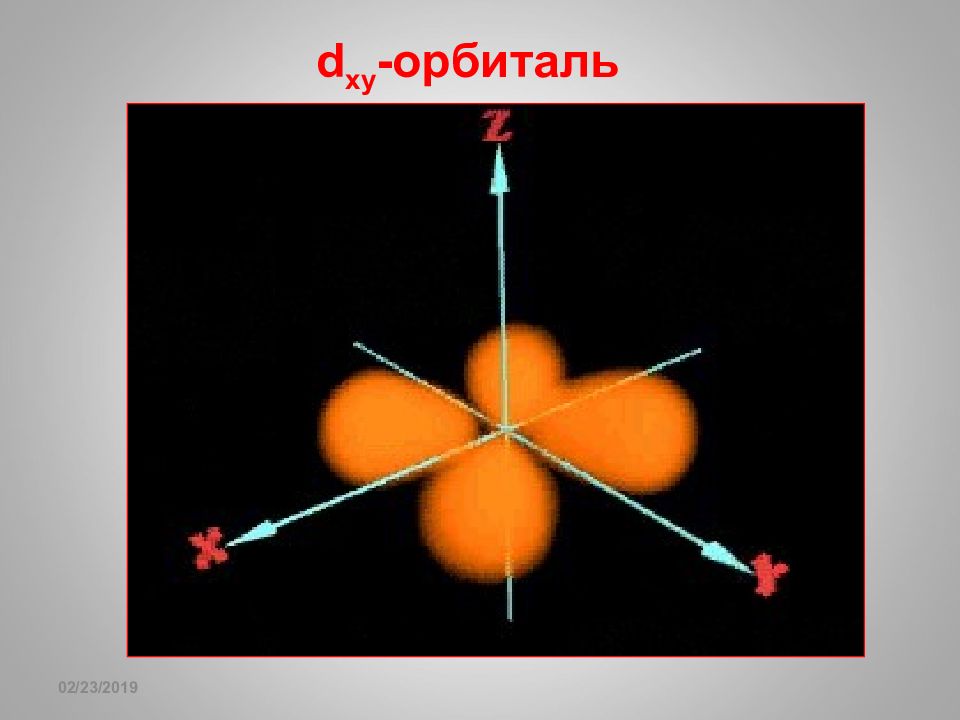
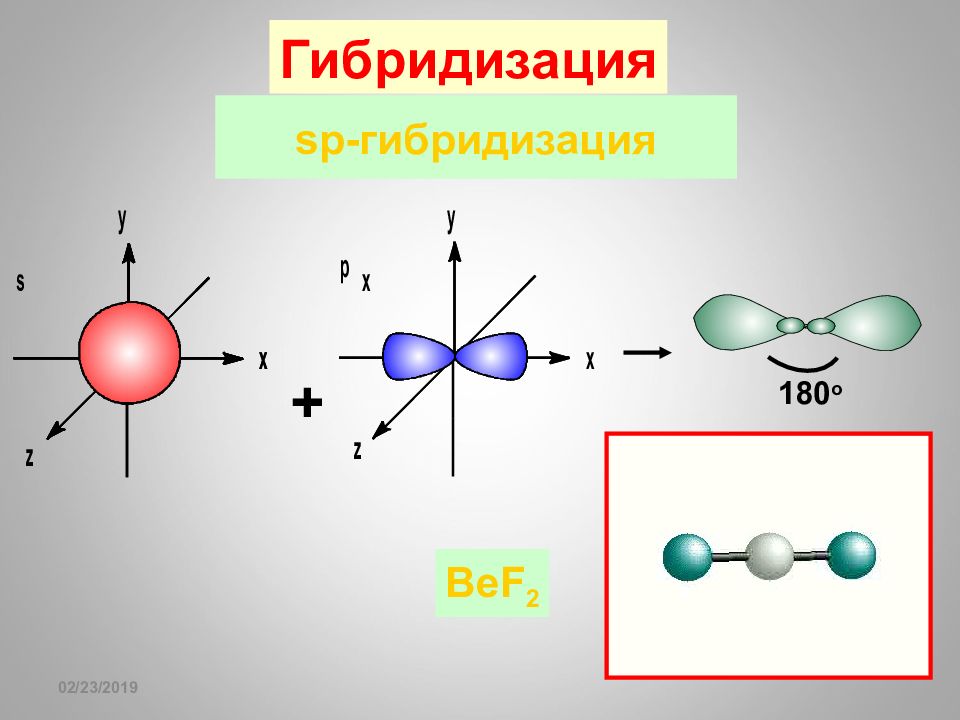
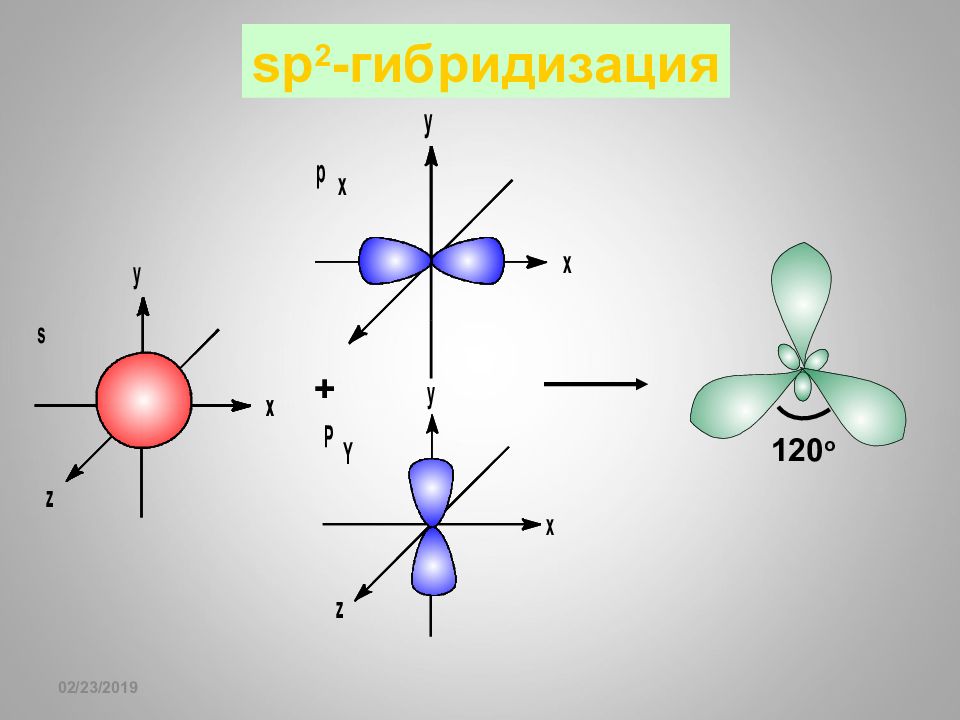
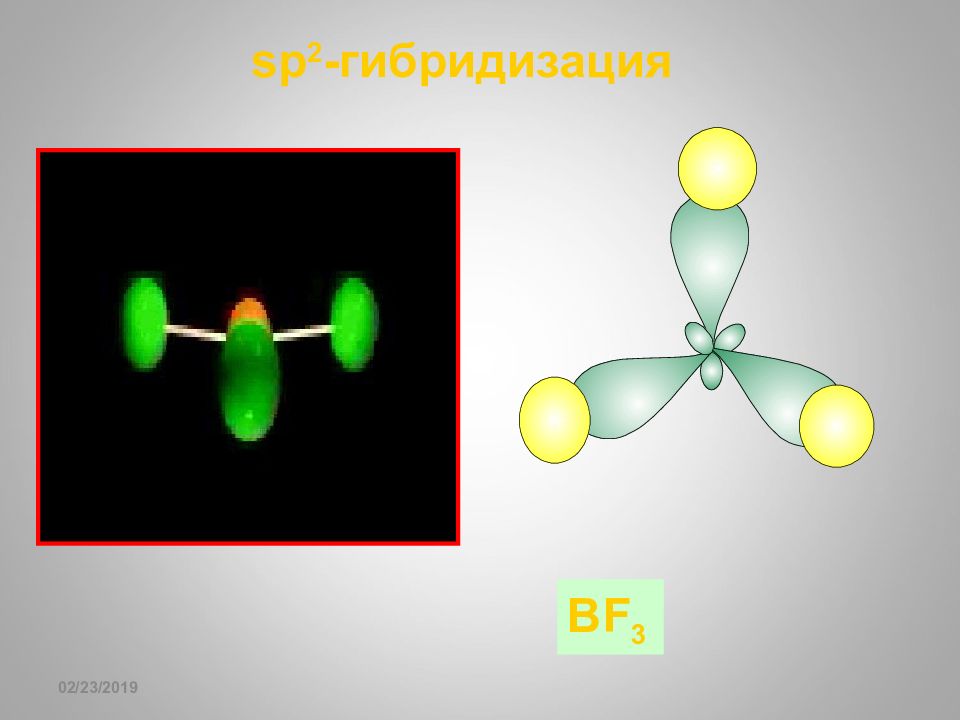
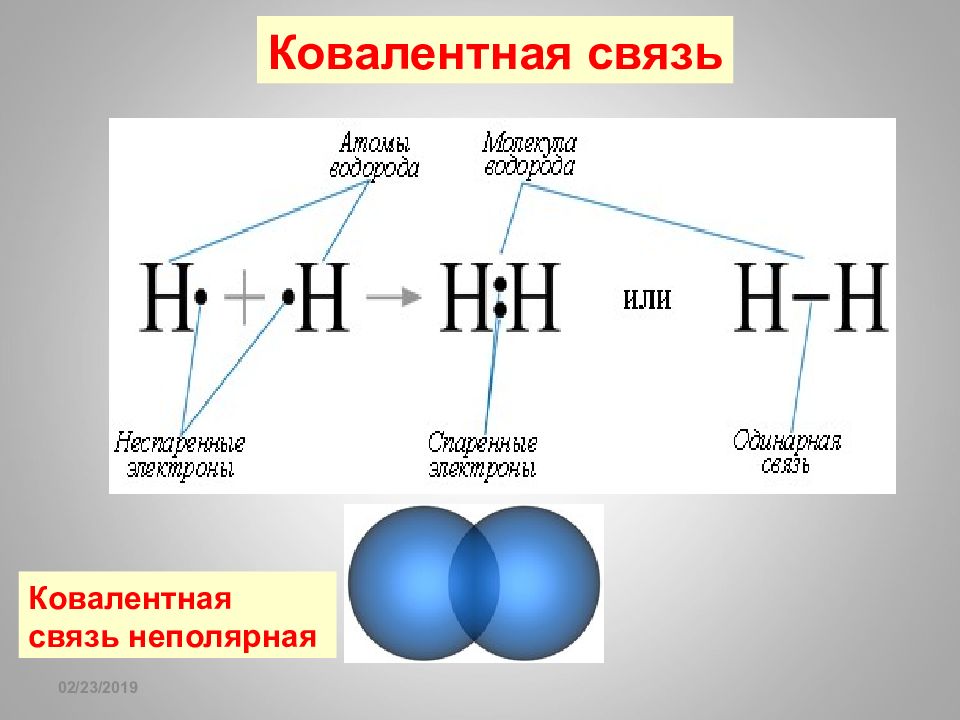
Слайд 62: sp- гибридизация
16.02.2019 sp- гибридизация + 1 8 0 o Гибридизация BeF 2
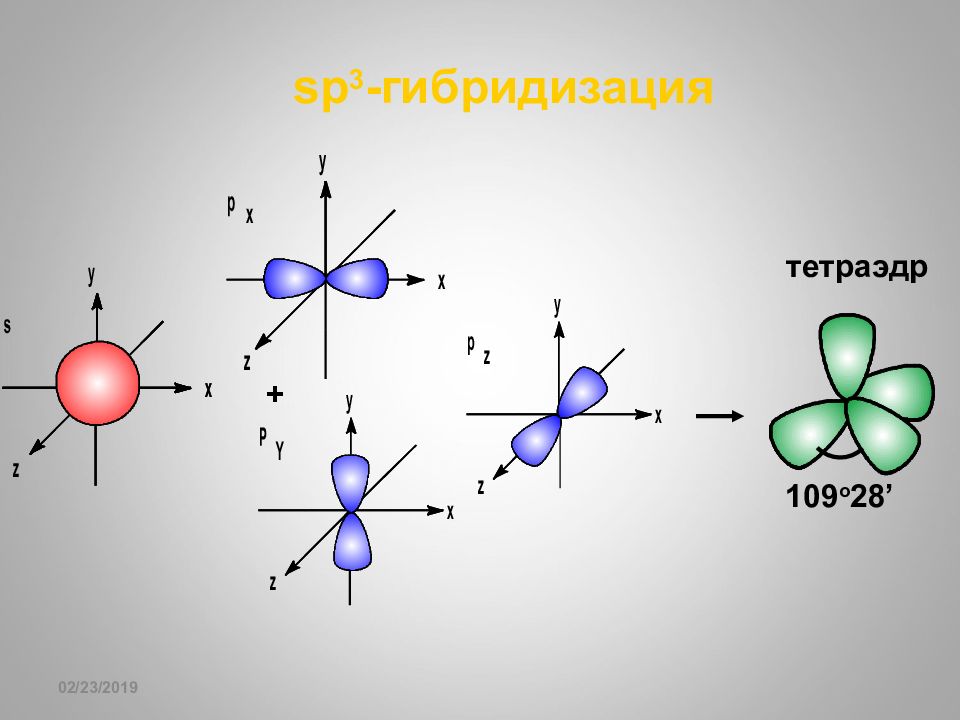
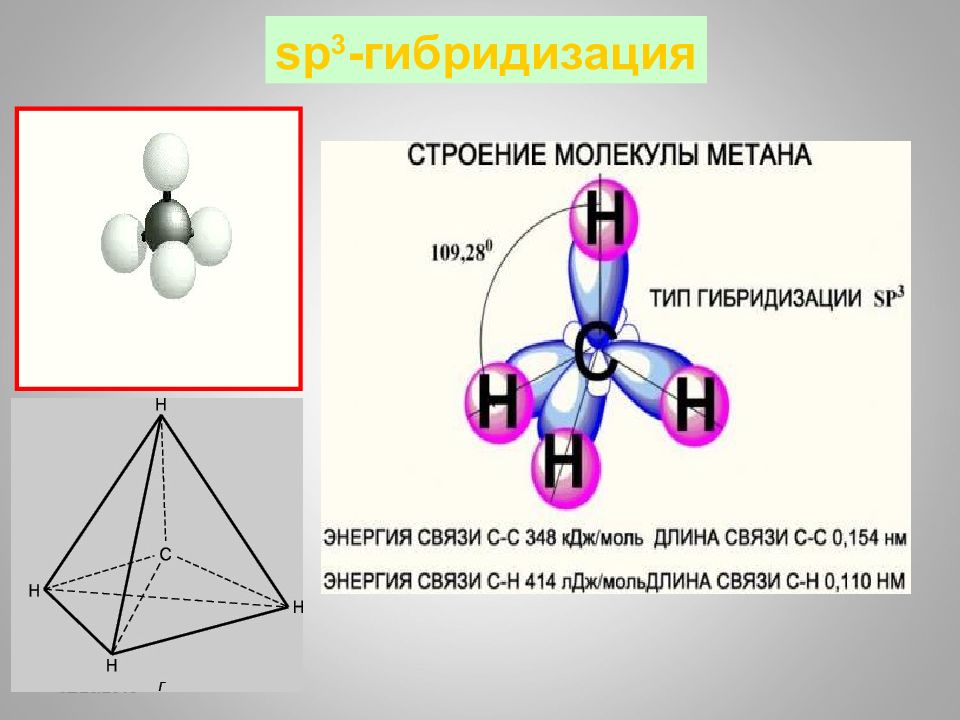
Слайд 65: sp 3 - гибридизация
16.02.2019 sp 3 - гибридизация 10 9 o 28’ + тетраэдр
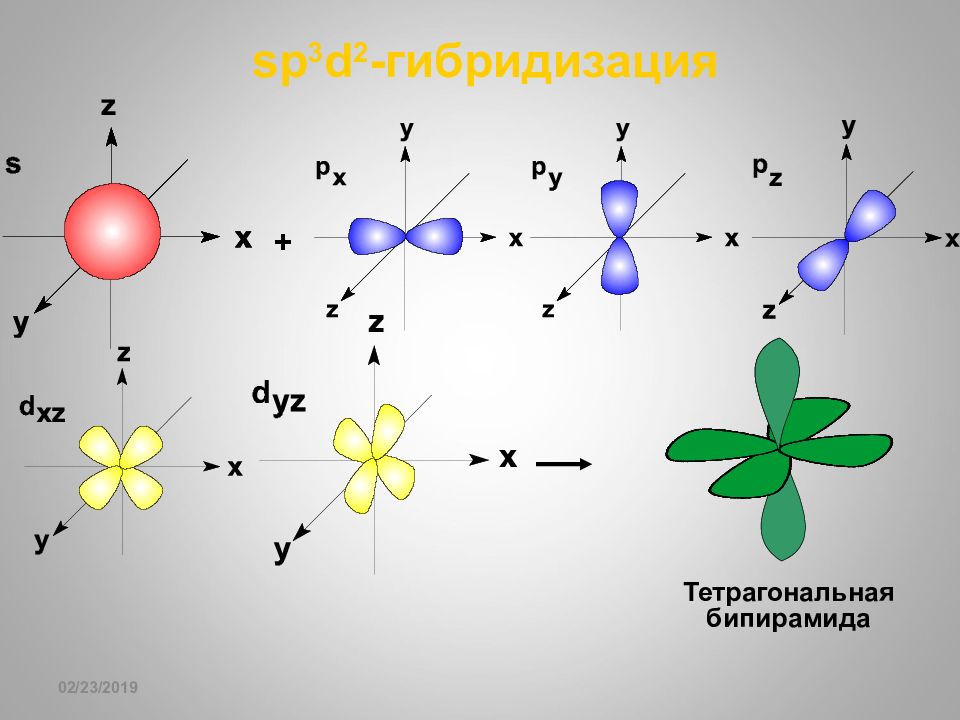
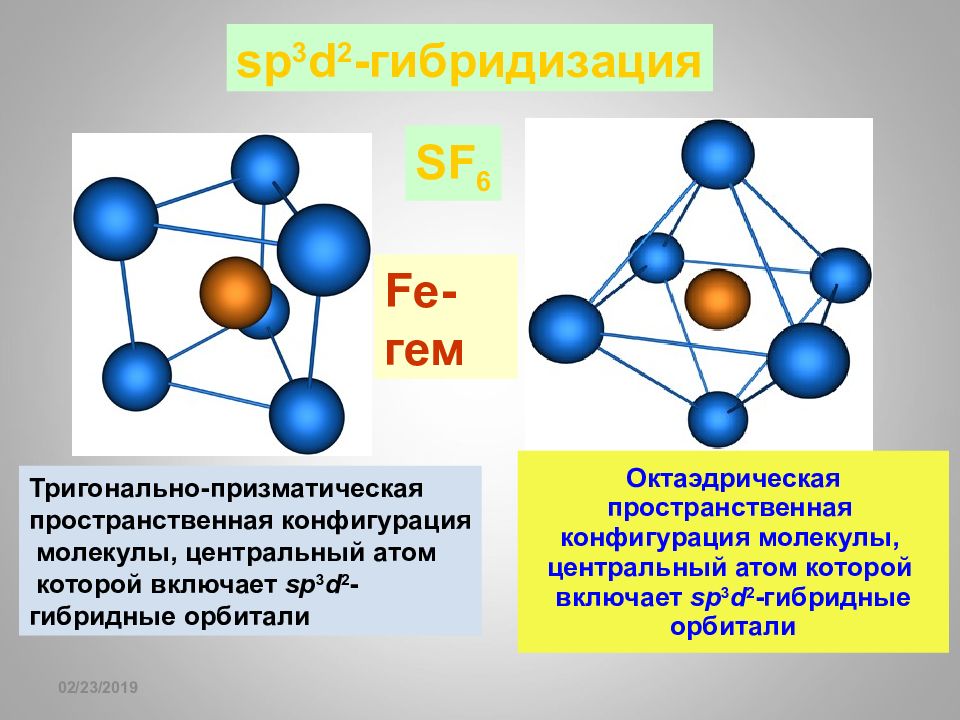
Слайд 69
16.02.2019 sp 3 d 2 - гибридизация SF 6 Октаэдрическая пространственная конфигурация молекулы, центральный атом которой включает sp 3 d 2 -гибридные орбитали Тригонально-призматическая пространственная конфигурация молекулы, центральный атом которой включает sp 3 d 2 - гибридные орбитали Fe- гем
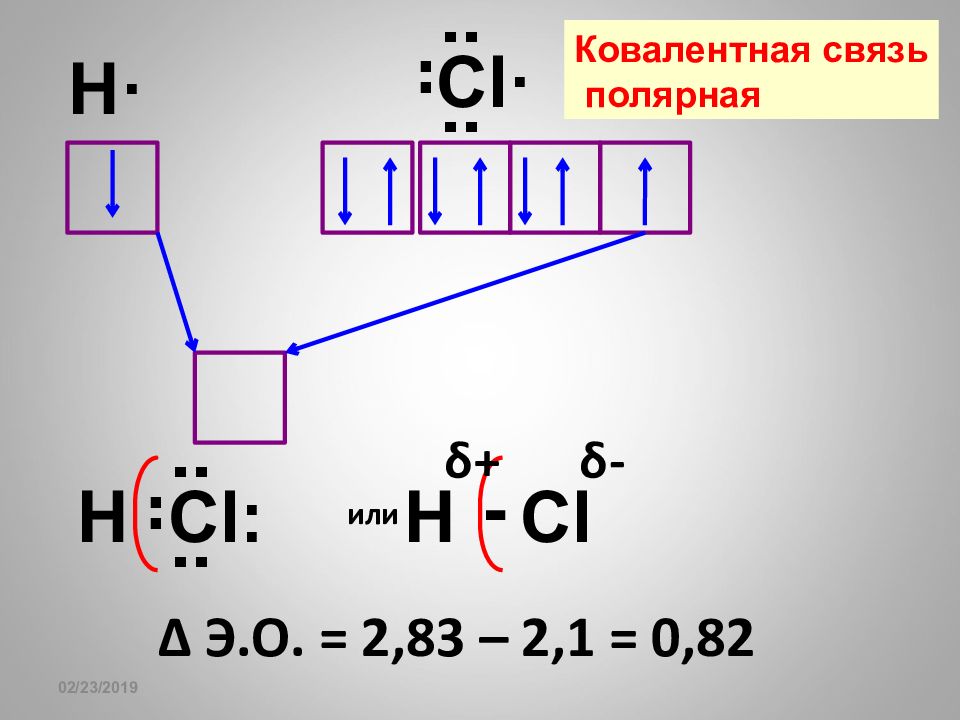
Слайд 72
16.02.2019 H· Cl · : : : H Cl : : : : или H Cl - Δ Э.О. = 2,83 – 2,1 = 0,82 δ + δ - Ковалентная связь полярная
Слайд 73
16.02.2019 Связь Связь кДж / моль кДж / моль C-O 360 C-H 415 C-C 348 620 С=С C = N 615 O-H 460 N-H 393 S-S 225 N N 947 P-O 502 Ковалентная связь
Слайд 74
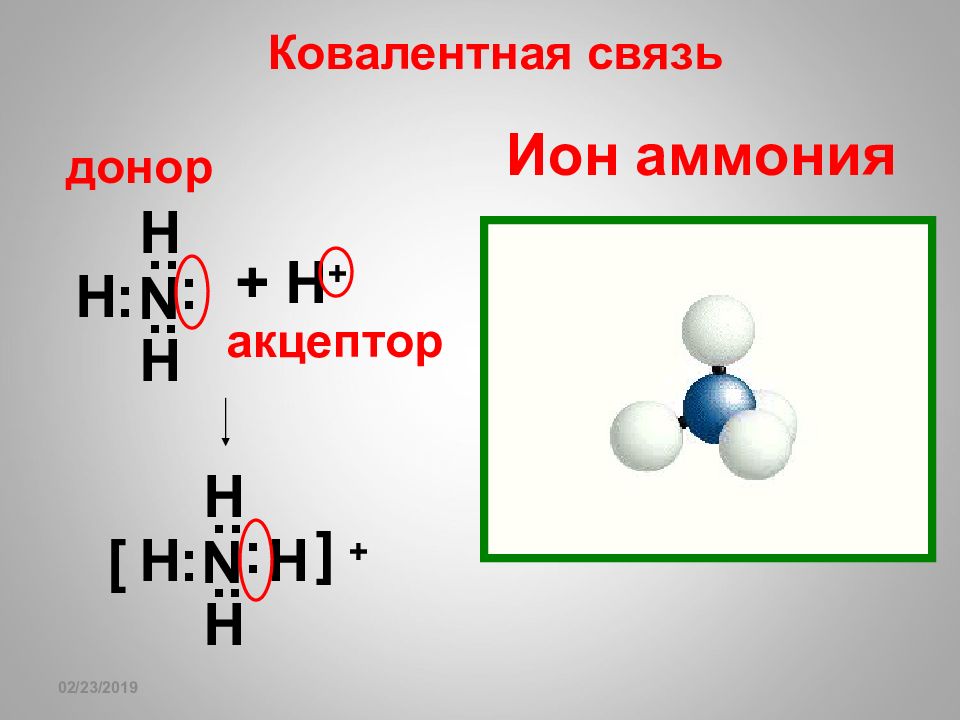
16.02.2019 Ион аммония N .. .. : : H H H + H + N .. .. : : H H H H [ ] + донор акцептор Ковалентная связь
Слайд 75
16.02.2019 Теория кислот и оснований Льюиса Кислоты – вещества, имеющие атом со свободной валентной орбиталью. Основания – вещества, имеющие атом с неподеленной электронной парой. Кислоты – акцепторы электронных пар. Основания – доноры электронных пар (акцепторы протона). Кислоты по Льюису могут не содержать протонов (например, Cr +3 )! Основания по Льюису могут не содержать гидроксильных групп (например, NH 3 )! Обратите внимание: H + + O-H - .. .. . . H-O-H .. ..
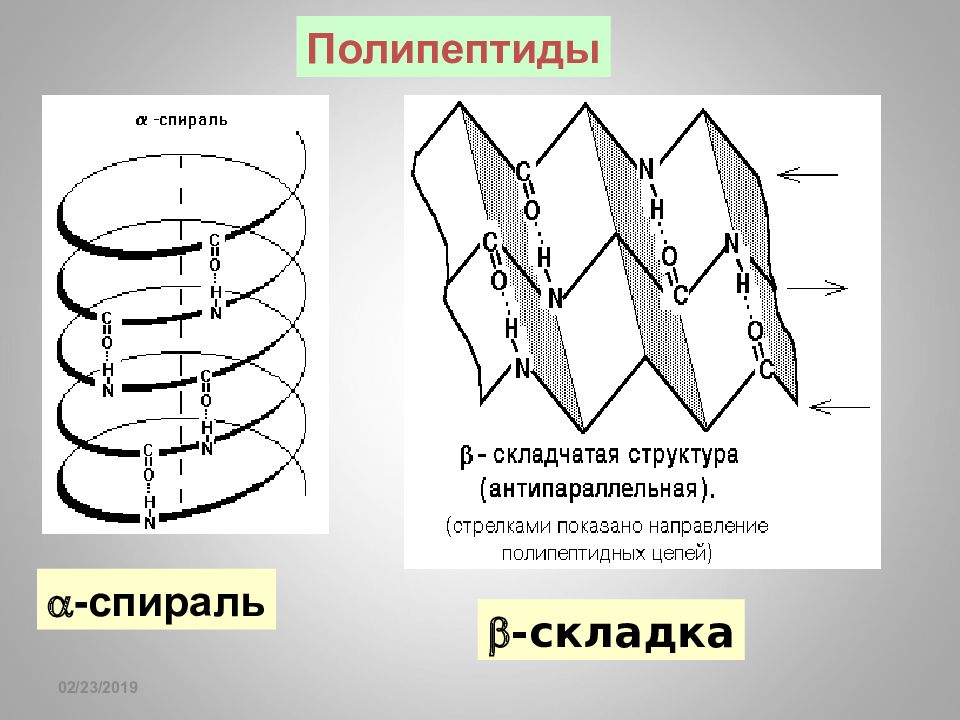
Слайд 76: Ион-ионное взаимодействие, 40-400 кДж / моль
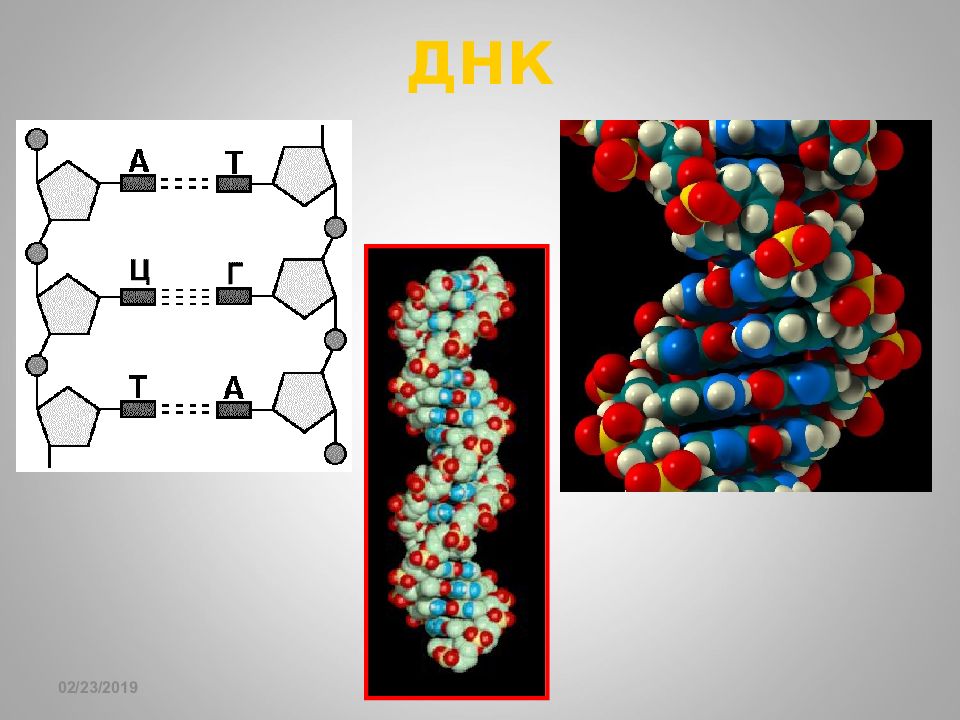
16.02.2019 Ион-ионное взаимодействие, 40-400 кДж / моль Ca 5 2+ (OH - )(PO 4 3- ) 3 Гидроксиапатит костной ткани - NH 3 - OOC - - NH 3 - O-P(=O)< Полипептиды Молекула ДНК - гистоны
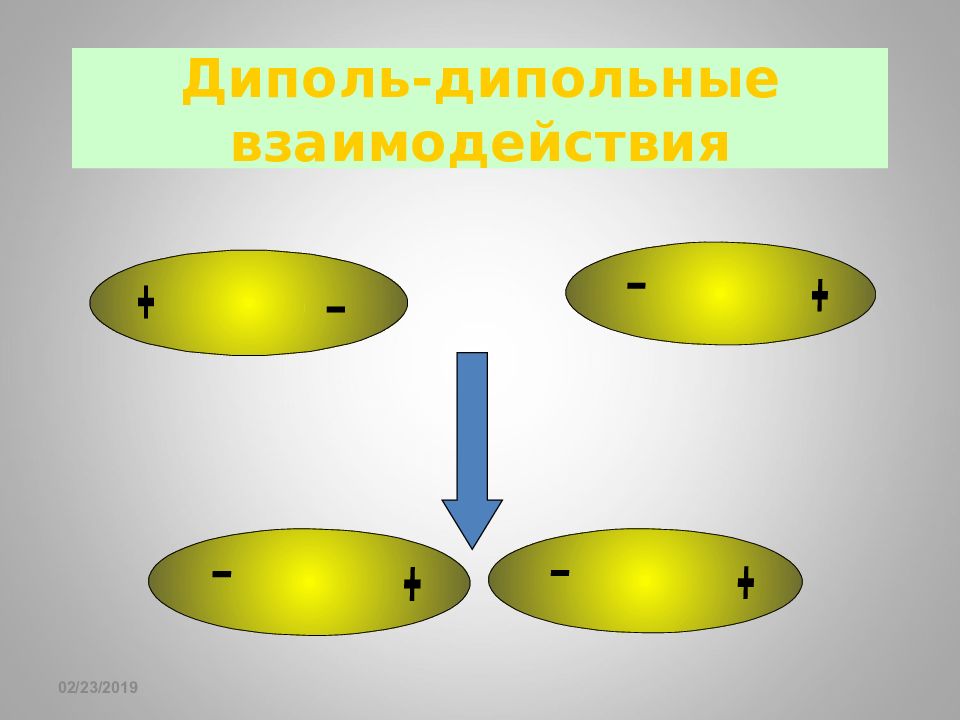
Слайд 78: Диполь-дипольные взаимодействия
16.02.2019 Диполь-дипольные взаимодействия
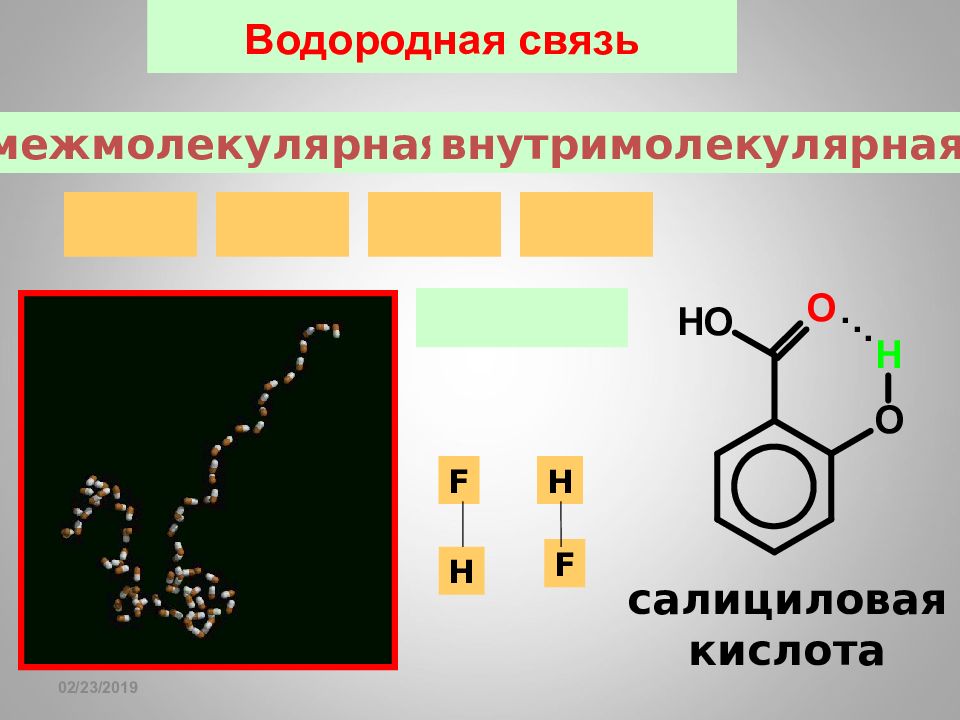
Слайд 79: Водородная связь
16.02.2019 Водородная связь салициловая кислота H F H F межмолекулярная внутримолекулярная
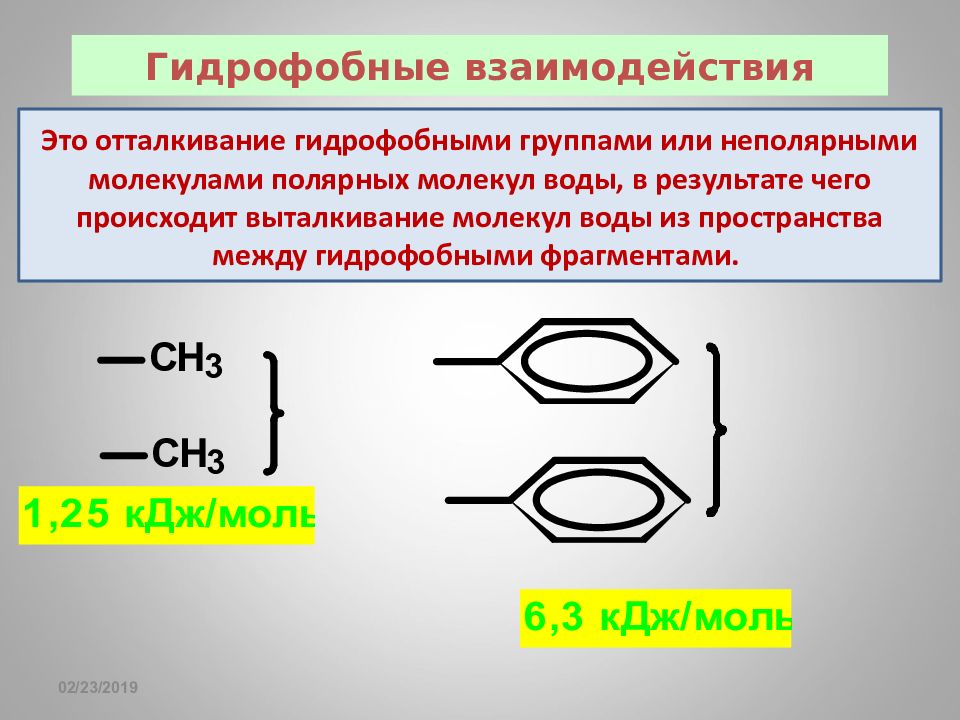
Слайд 83: Гидрофобные взаимодействия
16.02.2019 Гидрофобные взаимодействия Это отталкивание гидрофобными группами или неполярными молекулами полярных молекул воды, в результате чего происходит выталкивание молекул воды из пространства между гидрофобными фрагментами.
Слайд 84
16.02.2019 Тип кДж / моль Пример Роль Ион-диполь Диполь-диполь Диполь- индуцированный диполь Водородная связь Гидрофобное взаимодействие 4 - 40 1 - 20 0.4 - 4 0.4 - 4 Na + (H 2 O) 4 >O S< -OH - C 6 H 5 H 2 O … H 2 O Пептид … пептид Пептид … H 2 O -R R- -R - C 6 H 5 -C 6 H 5 - C 6 H 5 гидратирован- ные ионы между поляр- ными группами между поляр- ными и непо- лярными группами между непо- лярными группами вода в биосре- дах, строение полипептидов, строение ДНК Сравнительный анализ слабых взаимодействий 4 - 40
Слайд 85: Ионная связь
16.02.2019 Ионная связь ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K 2 O, LiF)
Слайд 86: Ионная химическая связь
16.02.2019 Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов и анионов
Слайд 87: Металлическая связь
16.02.2019 Металлическая связь Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке о п + М — п е М Схема образования металлической связи:
Слайд 88: Металлическая связь
16.02.2019 Металлическая связь Металлическую связь образуют элементы, атомы которых на внешнем слое имеют мало валентных электронов по сравнению с большим числом внешних энергетически близких орбиталей. Их валентные электроны слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены и перемещаются по всей кристаллической решетке в целом нейтрального металла.
Слайд 89
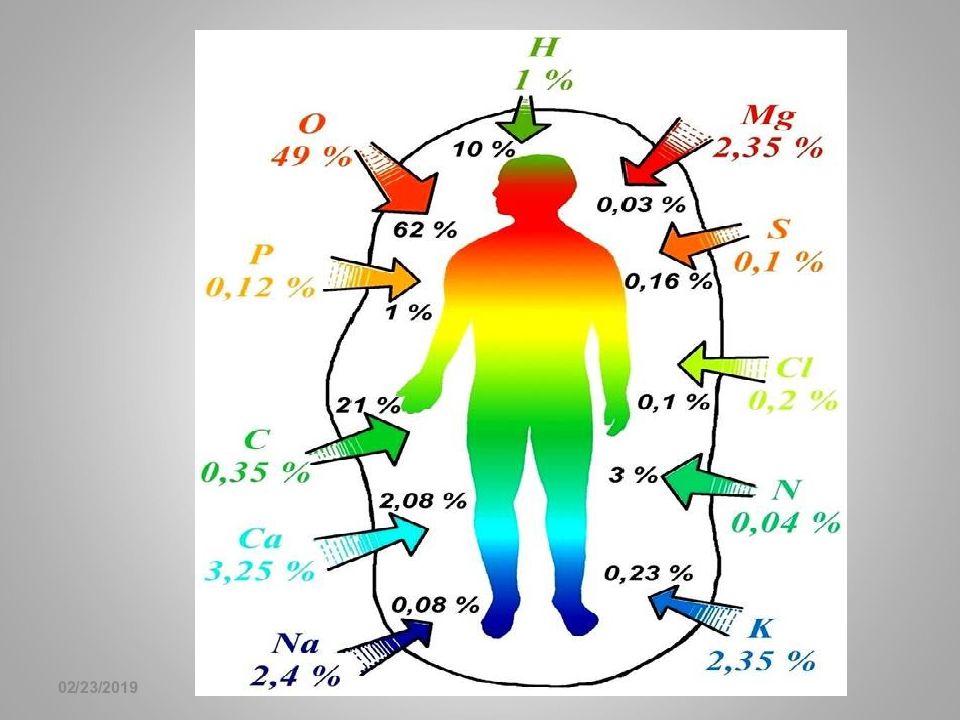
16.02.2019 Биогенные элементы Макроэлементы Ультрамикро -элементы Микроэлементы Элементы, необходимые для построения и жизнедеятельности клеток и организмов, называются биогенными элементами. Макроэлементы– массовая доля 10 –2 % и больше (H, C, N, O, P, S, Cl, Na, K, Mg, Ca). Na + aq, K + aq, Mg 2+ aq, Ca 2+ aq В организме: 60 г 180 г 140 г 1000 г Особенности: - широко распространены в природе; - высокая концентрация в организме; - постоянная степень окисления.
Слайд 91
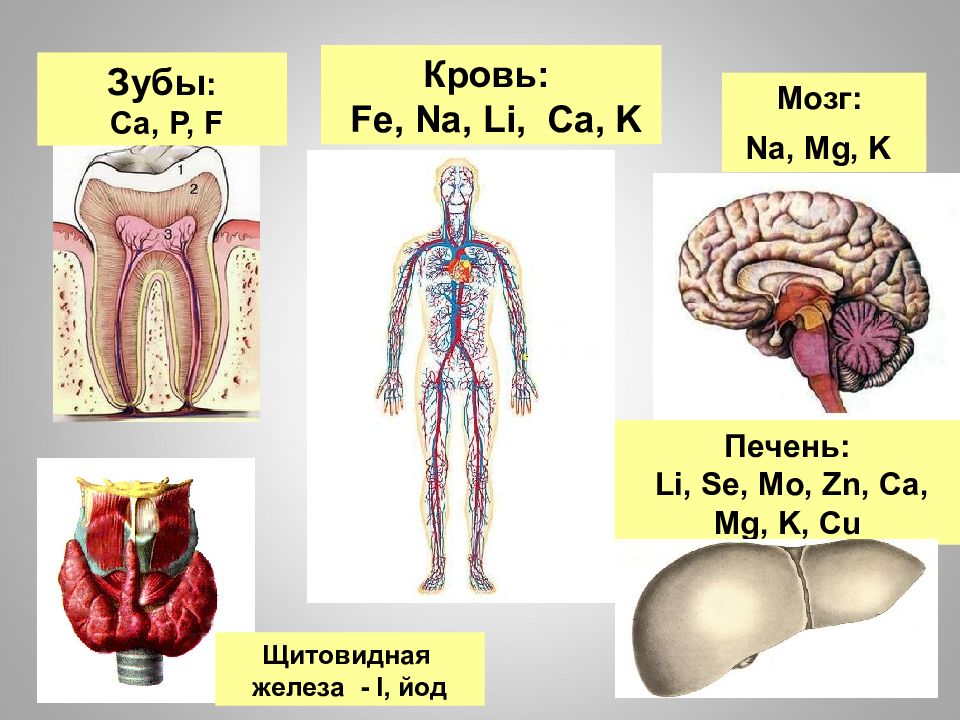
16.02.2019 Зубы : Ca, P, F Мозг : Na, Mg, K Кровь : Fe, Na, Li, Ca, K Печень : Li, Se, Mo, Zn, Ca, Mg, K, Cu Щитовидная железа - I, йод
Слайд 92
16.02.2019 Водород образует только ковалентные связи: Н-С, Н- S, H-N, H-O Типы кислот НХ: ОН- карбоновые кислоты, фенолы, спирты SH- тиолы NH- амиды, имиды, амины СН- УВ и их производные Н + - сильный окислитель, но в живых системах окислит. способность в нейтральной среде понижается, окислит. свойств не проявляет, участвует в ОВР, способствуя превращениям: СН 3 СОСООН + 2 ē + 2Н + СН 3 СНОНСООН В организме нет Н 2, Н -
Слайд 93
16.02.2019 Hb билирубин + CO (в организме) Hb O 2 + CO Hb CO + O 2 оксигемоглобин карбоксигемоглобин Углерод образует ковалентные связи с лабильной общей электронной парой: С-С, С-О, С-Н, С- N, C-S, C=S Гидрокарбонатная буферная система СО 2 +Н 2 О Н 2 СО 3 Н + + НСО 3 – Открытая система быстрого реагирования CaCO 3, MgCO 3, CO, CO 2, HCN, KCN 2 мг / л СО 60 мин 5 мг / л СО 5 мин
Слайд 94
16.02.2019 СО 2 – бесцветный, негорючий газ, с чуть кисловатым запахом и вкусом, в 1,5 раза тяжелее воздуха, мало растворим в воде, не поддерживает дыхание и горение (содержание в воздухе СО 2 более 10% смертельно опасно). Молекула СО 2 линейна (атом углерода находится в sp -гибридизации), неполярна О=С=О. В оксиде углерода(IV) валентность атома углерода равна IV, что существенно меняет свойства углекислого газа. Он не горит, не поддерживает дыхания и горения, не ядовит, но большие концентрации СО 2 (свыше 10%) вызывают сильный ацидоз, бурную одышку и паралич дыхательного центра. Оксид углерода ( IV).
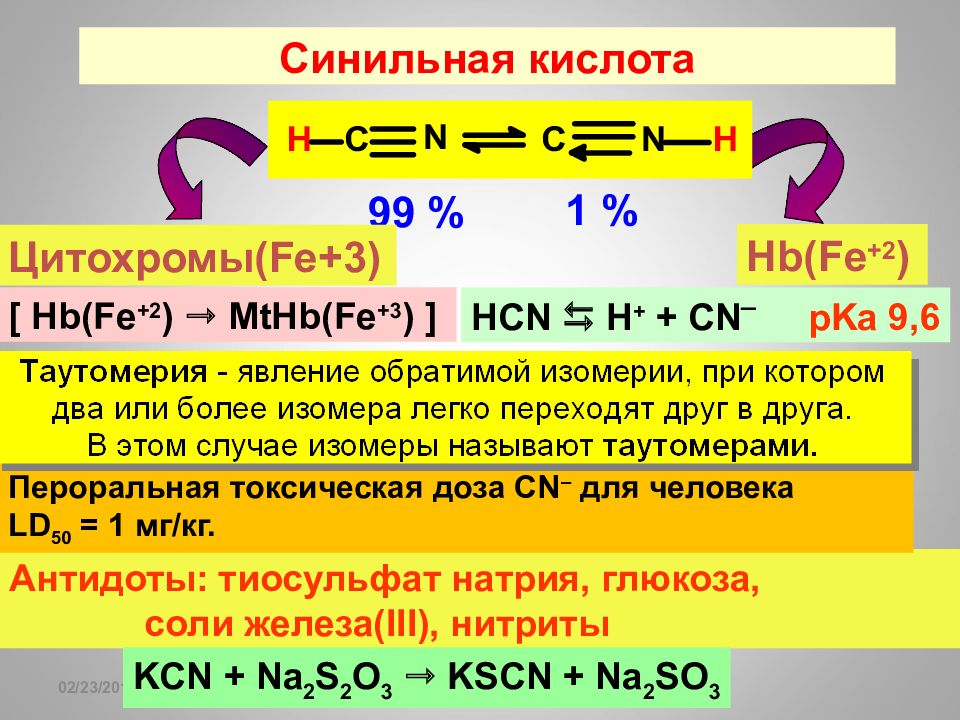
Слайд 95: Синильная кислота
16.02.2019 Синильная кислота 99 % 1 % HCN H + + CN ¯ pKa 9,6 Антидоты: тиосульфат натрия, глюкоза, соли железа( III), нитриты KCN + Na 2 S 2 O 3 KSCN + Na 2 SO 3 Hb(Fe +2 ) Цитохромы( Fe+3) [ Hb(Fe +2 ) MtHb(Fe +3 ) ] Пероральная токсическая доза CN – для человека LD 50 = 1 мг/кг.
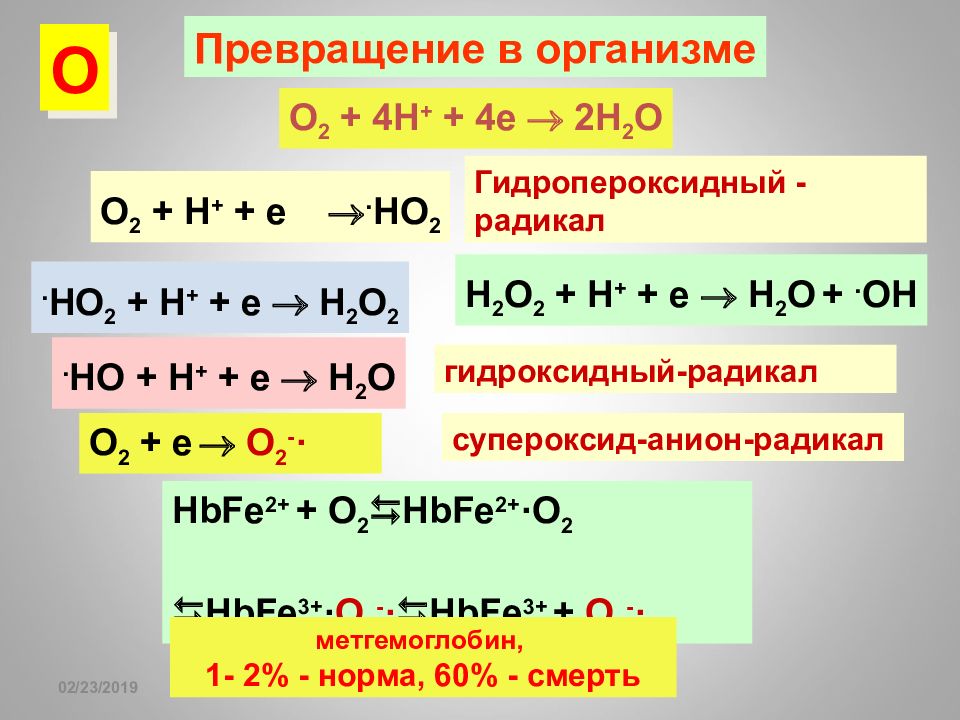
Слайд 96
16.02.2019 супероксид-анион-радикал O 2 + e O 2 - · HbFe 2+ + O 2 HbFe 2+ · O 2 HbFe 3+ · O 2 - · HbFe 3+ + O 2 - · метгемоглобин, 1- 2% - норма, 60% - смерть Превращение в организме O 2 + 4H + + 4e 2H 2 O O 2 + H + + e . HO 2 . HO 2 + H + + e H 2 O 2 H 2 O 2 + H + + e H 2 O +. OH . HO + H + + e H 2 O О Гидропероксидный -радикал гидроксидный-радикал
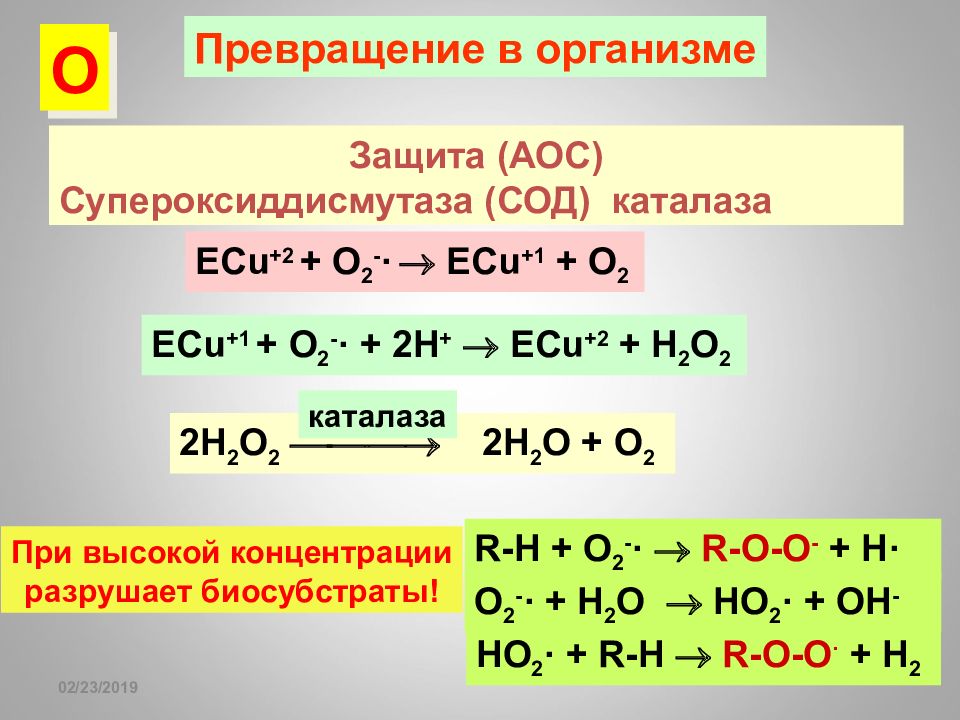
Слайд 97
16.02.2019 Превращение в организме Защита (АОС) Супероксиддисмутаза (СОД) каталаза ECu +2 + O 2 - · ECu +1 + O 2 ECu +1 + O 2 - · + 2H + ECu +2 + H 2 O 2 R-H + O 2 - · R-O-O - + H· O 2 - · + H 2 O HO 2 · + OH - HO 2 · + R-H R-O-O · + H 2 При высокой концентрации разрушает биосубстраты! О 2H 2 O 2 2H 2 O + O 2 каталаза
Слайд 98
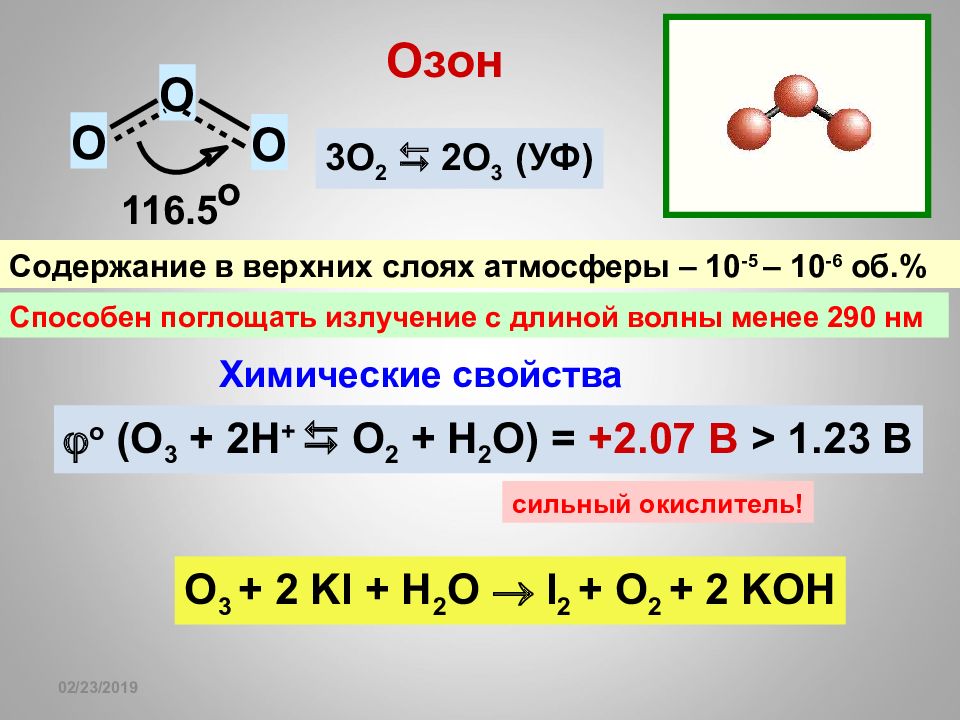
16.02.2019 Озон O O O 116.5 о 3О 2 2О 3 (УФ) Содержание в верхних слоях атмосферы – 10 -5 – 10 -6 об.% Способен поглощать излучение с длиной волны менее 290 нм о ( O 3 + 2H + O 2 + H 2 O) = +2.07 B > 1.23 В Химические свойства O 3 + 2 KI + H 2 O I 2 + O 2 + 2 KOH сильный окислитель!
Слайд 99
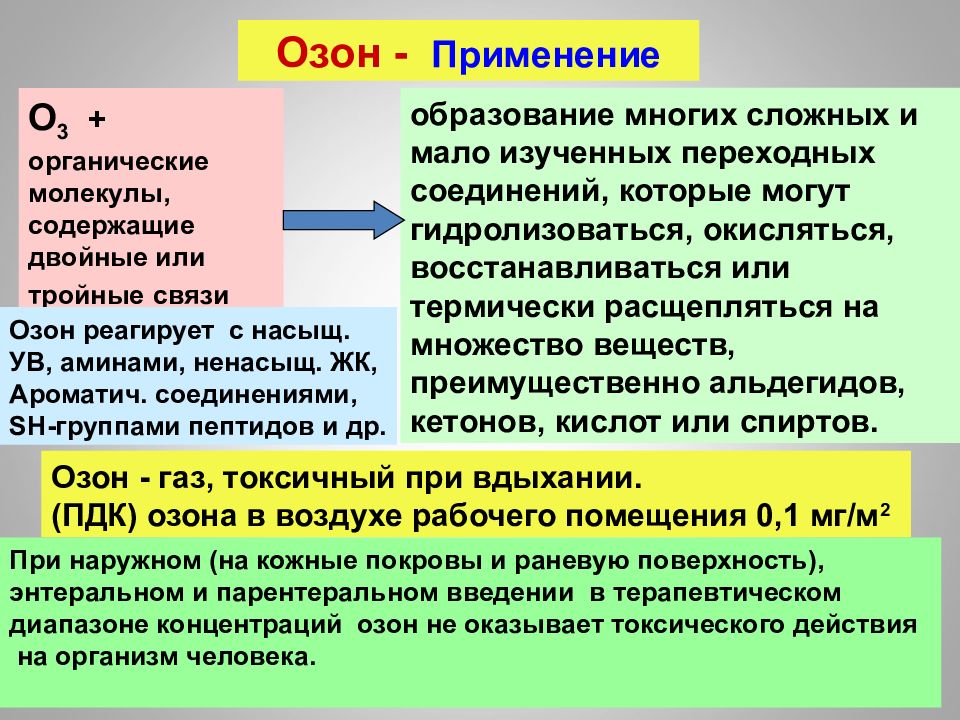
16.02.2019 Озон - Применение образование многих сложных и мало изученных переходных соединений, которые могут гидролизоваться, окисляться, восстанавливаться или термически расщепляться на множество веществ, преимущественно альдегидов, кетонов, кислот или спиртов. О 3 + органические молекулы, содержащие двойные или тройные связи Озон - газ, токсичный при вдыхании. (ПДК) озона в воздухе рабочего помещения 0,1 мг/м 2 Озон реагирует с насыщ. УВ, аминами, ненасыщ. ЖК, Ароматич. соединениями, SH- группами пептидов и др. При наружном (на кожные покровы и раневую поверхность), энтеральном и парентеральном введении в терапевтическом диапазоне концентраций озон не оказывает токсического действия на организм человека.
Слайд 100
16.02.2019 Бактерицидное, вирицидное и фунгицидное действие. Оптимизация про- и антиоксидантных систем. Активизация иммунной системы, липидного обмена Озон - Применение внутривенно внутримышечно внутрисуставно наружно, ректально
Слайд 101
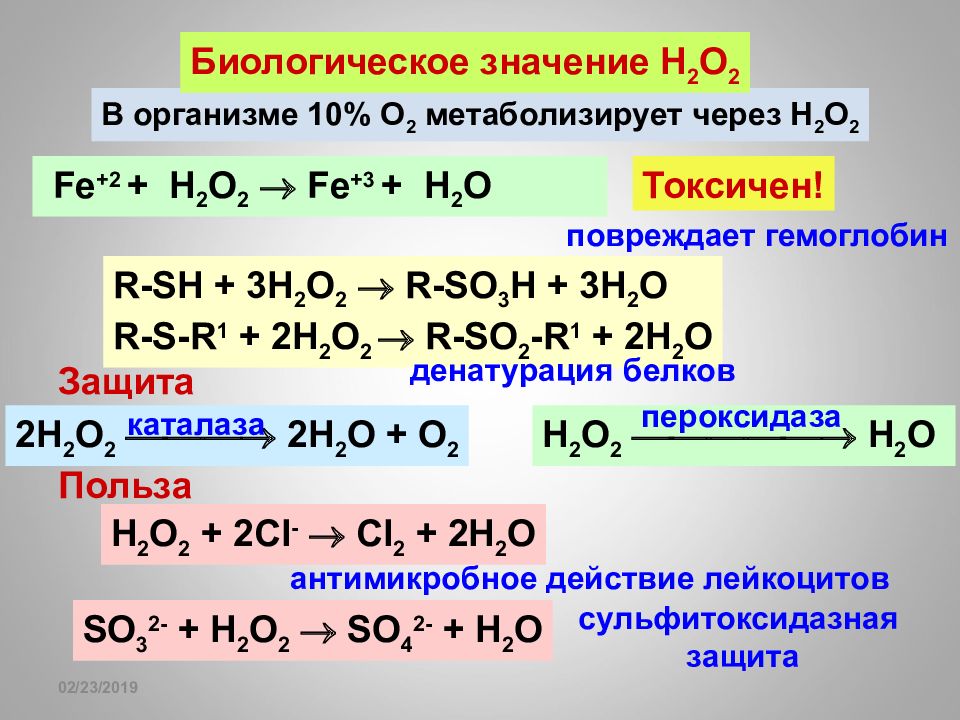
16.02.2019 В организме 10% О 2 метаболизирует через Н 2 О 2 Токсичен! Fe +2 + H 2 O 2 Fe +3 + H 2 O R-SH + 3H 2 O 2 R-SO 3 H + 3H 2 O R-S-R 1 + 2H 2 O 2 R-SO 2 -R 1 + 2H 2 O Защита 2H 2 O 2 2H 2 O + O 2 каталаза H 2 O 2 H 2 O пероксидаза Биологическое значение H 2 O 2 повреждает гемоглобин денатурация белков H 2 O 2 + 2Cl - Cl 2 + 2H 2 O SO 3 2- + H 2 O 2 SO 4 2- + H 2 O антимикробное действие лейкоцитов сульфитоксидазная защита Польза
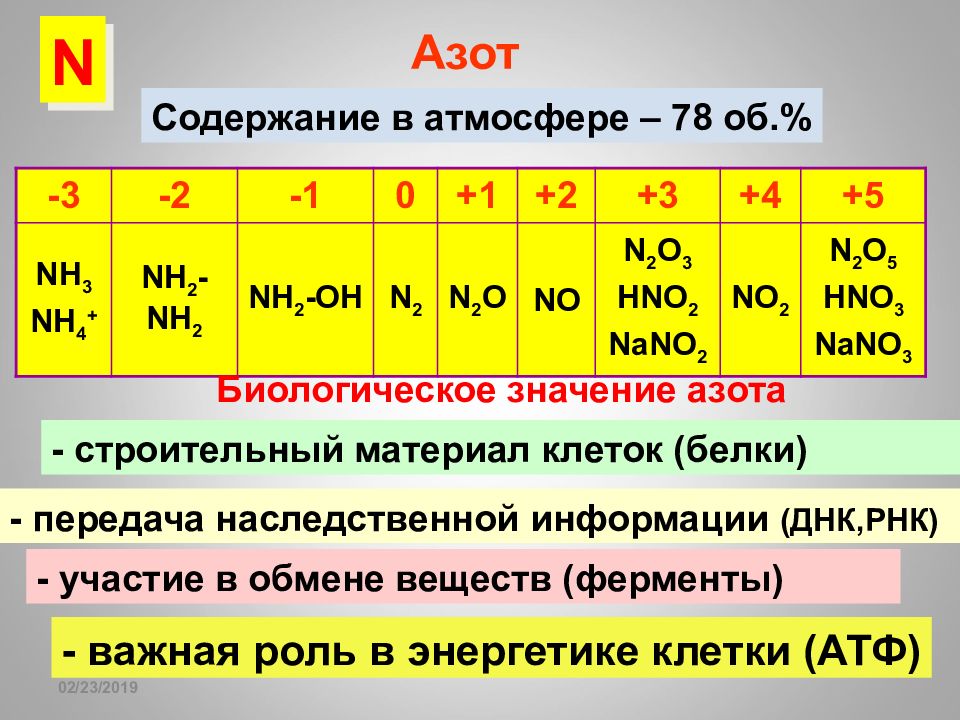
Слайд 102
16.02.2019 Азот -3 -2 -1 0 +1 +2 +3 +4 +5 NH 3 NH 4 + NH 2 -NH 2 NH 2 -OH N 2 N 2 O NO N 2 O 3 HNO 2 NaNO 2 NO 2 N 2 O 5 HNO 3 NaNO 3 Содержание в атмосфере – 78 об.% Биологическое значение азота - строительный материал клеток (белки) - участие в обмене веществ (ферменты) - передача наследственной информации (ДНК,РНК) - важная роль в энергетике клетки (АТФ) N
Слайд 103
16.02.2019 Джозеф Пристли (1733-1804) NO 1774 Сальвадор Монкада 1986 Универсальный биорегулятор Ф. Мурад Л. Игнарро Р. Фурчготт Нобелевская премия по физиологии, 1998
Слайд 104
16.02.2019 NO Широкий спектр биологического действия: регуляторное, защитное и вредное. участвует в регуляции систем внутри- и межклеточной сигнализации отвечает за эндотелиальную релаксацию гладких мышц обладает цитотоксическими и цитостатичес-кими свойствами Клетки-киллеры иммунной системы используют NO для уничтожения бактерий и клеток злокачественных опухолей.
Слайд 105
16.02.2019 С нарушением биосинтеза и метаболизма NO связаны такие заболевания как: артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезни Альцгеймера, Паркинсона), сахарный диабет, импотенция и др. NO
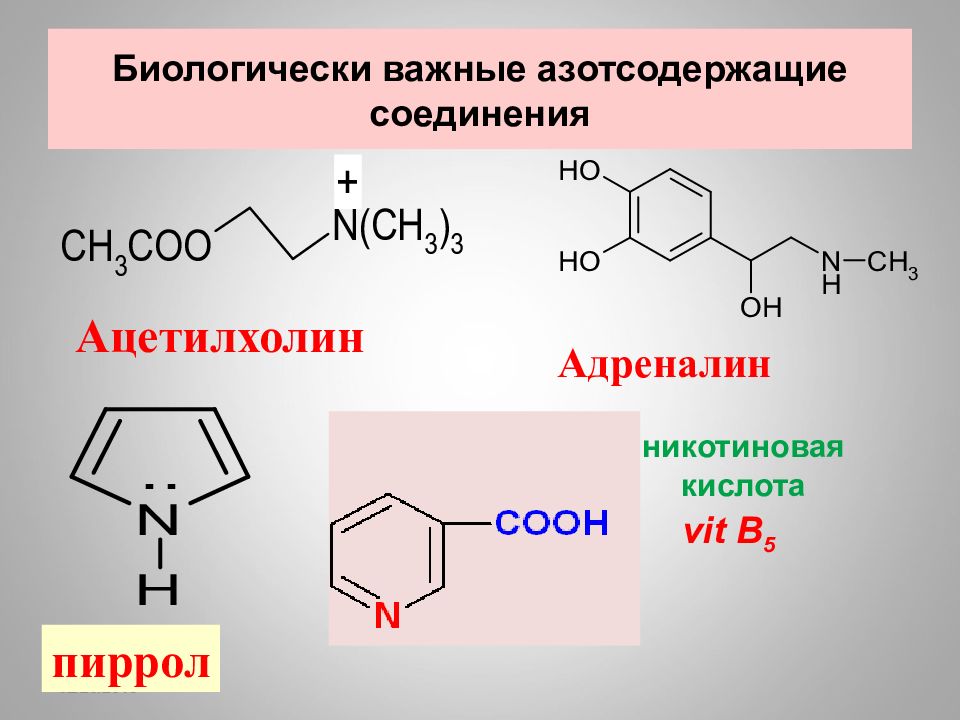
Слайд 106: Биологически важные азотсодержащие соединения
16.02.2019 Биологически важные азотсодержащие соединения Ацетилхолин Адреналин пиррол никотиновая кислота vit B 5
Слайд 107
16.02.2019 Fe 2+ R 1 R 2 R 3 R 4 R 5 R 7 R 6 R 8 Белок глобин Н 2 О (или О 2, СО, …) Г Е М Тетрапиррольные макроциклы
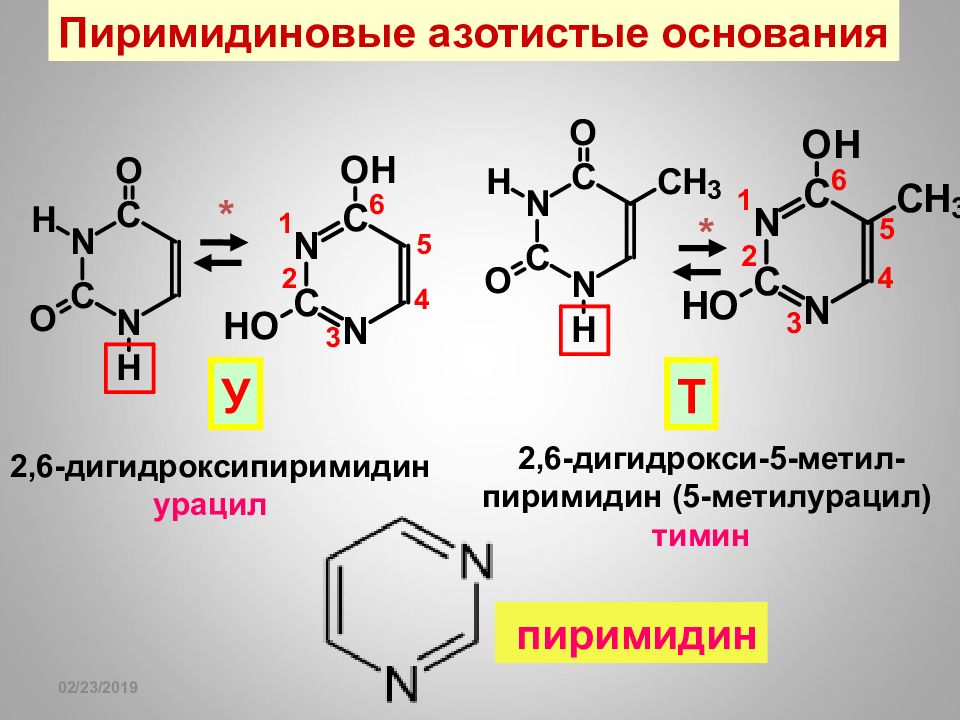
Слайд 108
16.02.2019 Пиримидиновые азотистые основания 2,6-дигидроксипиримидин урацил У 2,6-дигидрокси-5-метил- пиримидин (5-метилурацил) тимин Т * * пиримидин
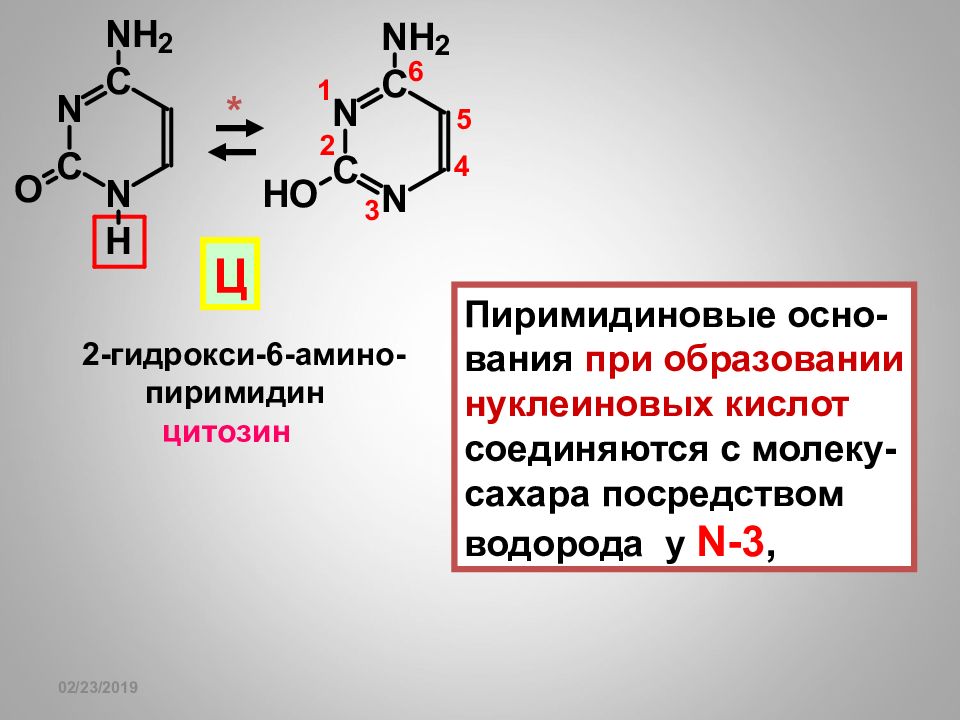
Слайд 109
16.02.2019 2-гидрокси-6-амино- пиримидин цитозин Ц Пиримидиновые осно- вания при образовании нуклеиновых кислот соединяются с молеку- сахара посредством водорода у N-3, *
Слайд 110
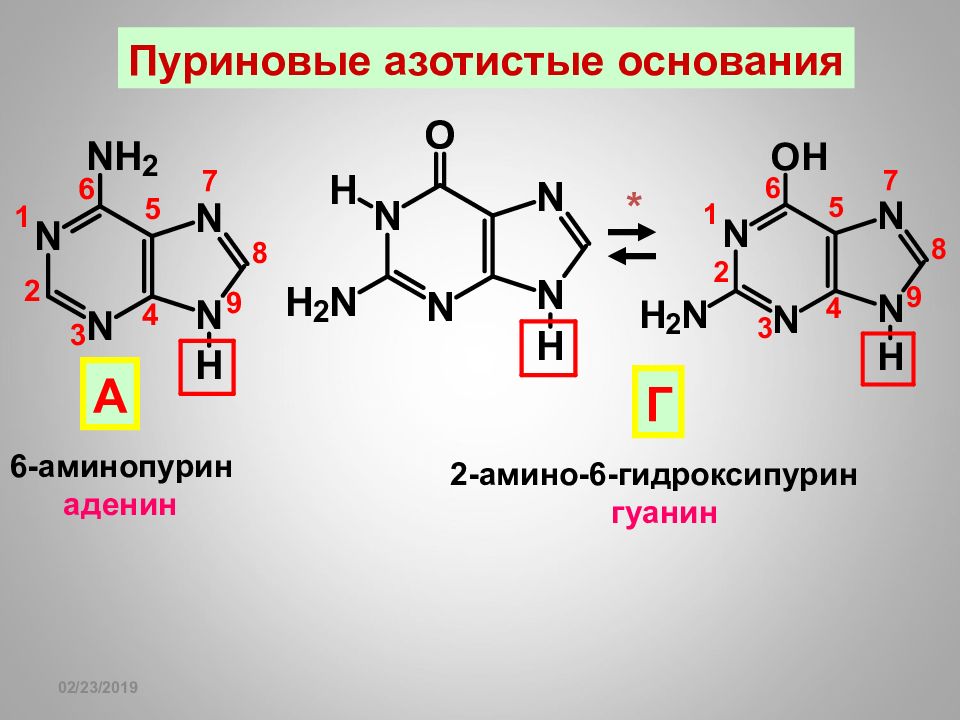
16.02.2019 Пуриновые азотистые основания 6-аминопурин аденин А 2-амино-6-гидроксипурин гуанин Г *
Слайд 112
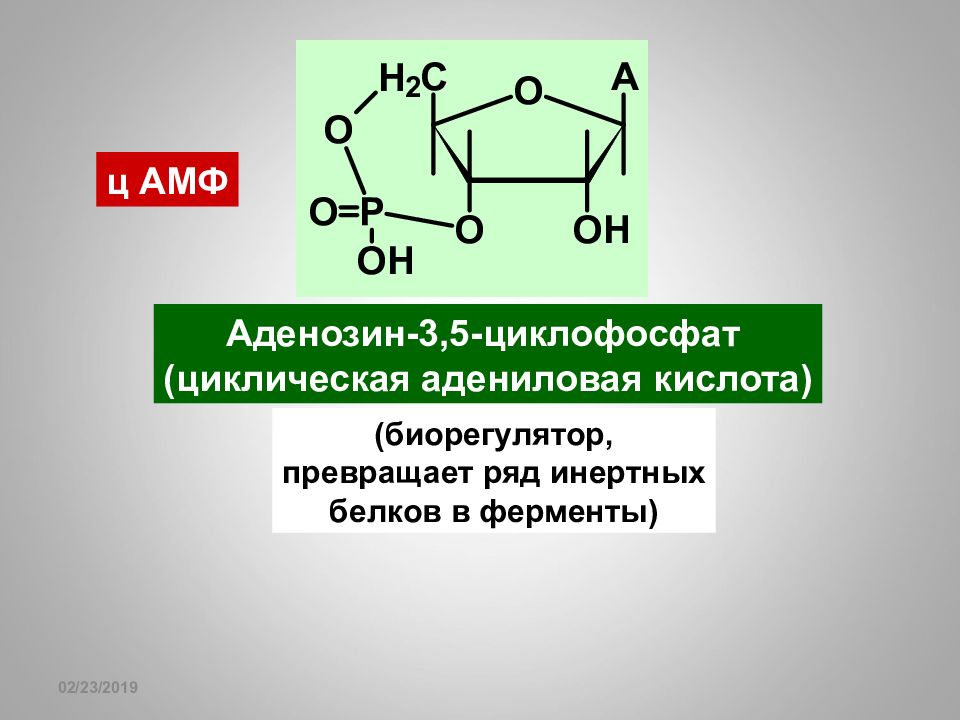
16.02.2019 ц АМФ Аденозин-3,5-циклофосфат (циклическая адениловая кислота) (биорегулятор, превращает ряд инертных белков в ферменты)
Слайд 113
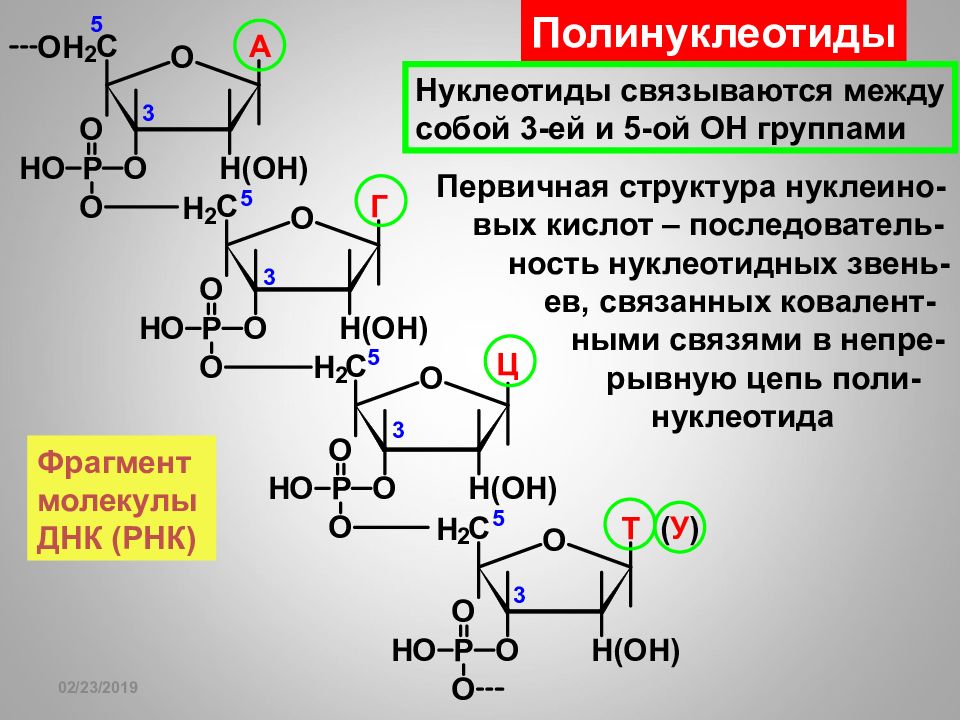
16.02.2019 Полинуклеотиды Нуклеотиды связываются между собой 3-ей и 5-ой ОН группами Фрагмент молекулы ДНК (РНК) Первичная структура нуклеино- вых кислот – последователь- ность нуклеотидных звень- ев, связанных ковалент- ными связями в непре- рывную цепь поли- нуклеотида
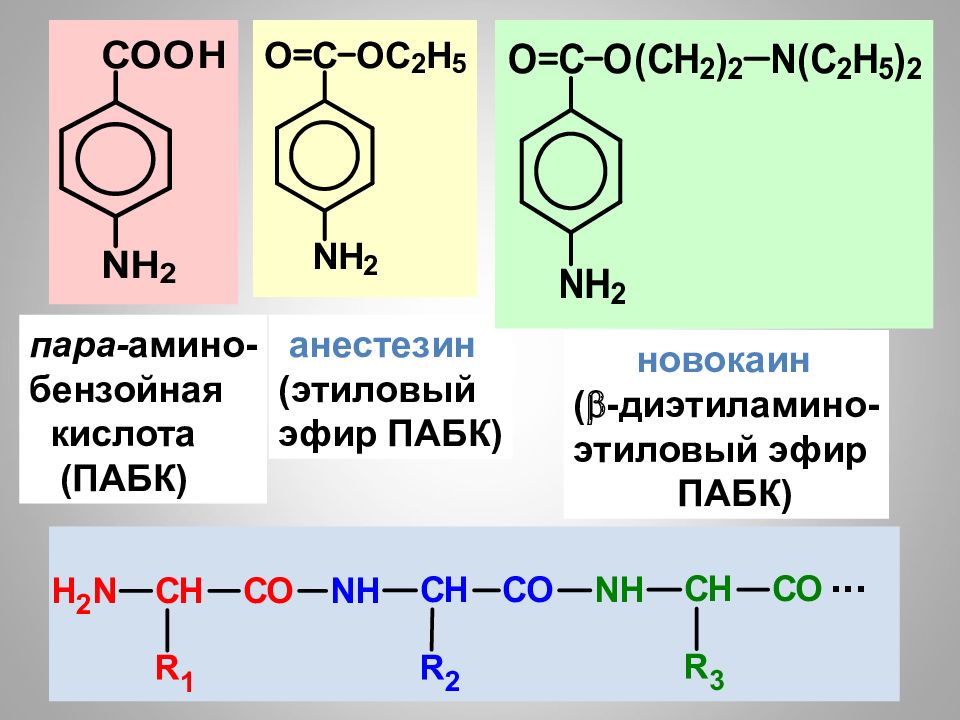
Слайд 114
16.02.2019 пара- амино- бензойная кислота (ПАБК) анестезин (этиловый эфир ПАБК) новокаин (-диэтиламино- этиловый эфир ПАБК)
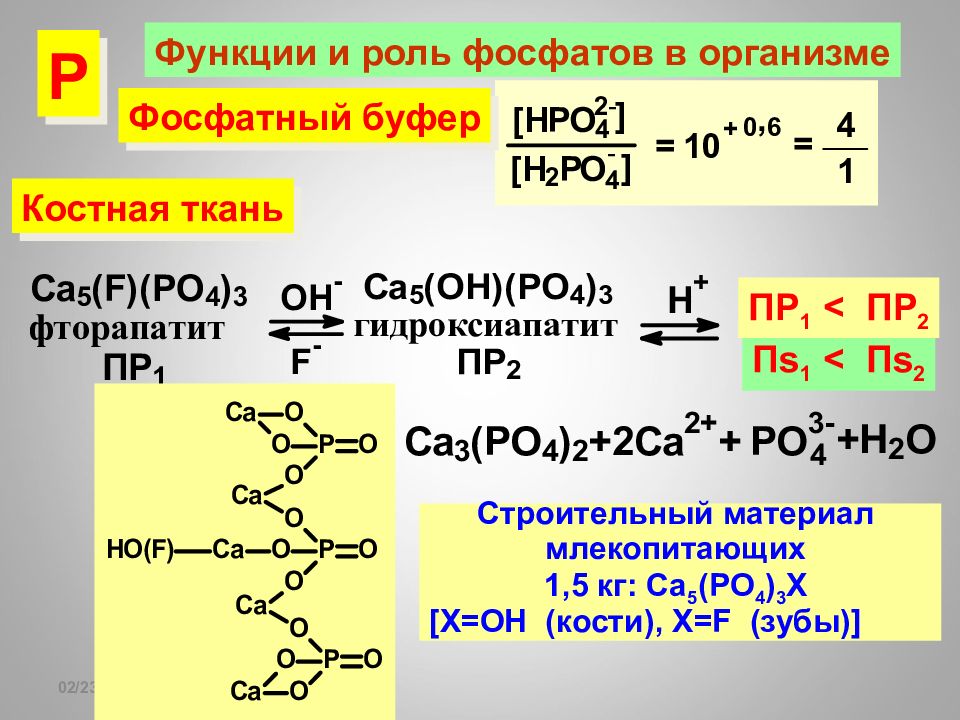
Слайд 115
16.02.2019 Функции и роль фосфатов в организме Костная ткань П s 1 < П s 2 Строительный материал млекопитающих 1,5 кг: С a 5 (PO 4 ) 3 X [X=OH ( кости), Х= F ( зубы) ] Фосфатный буфер ПР 1 < ПР 2 Р
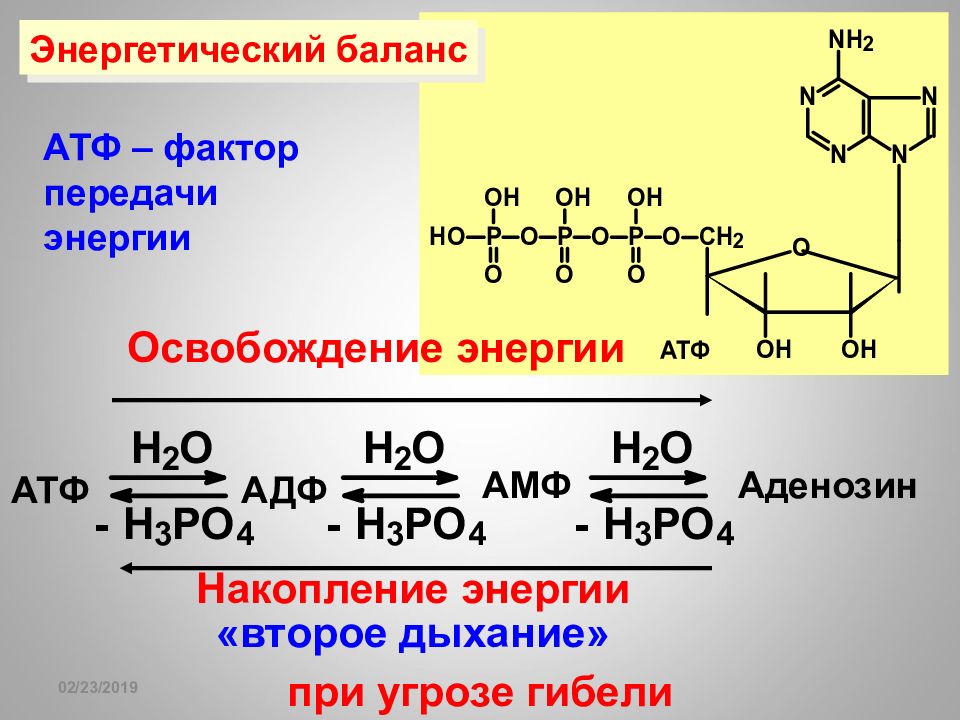
Слайд 116
16.02.2019 АТФ АДФ АМФ Аденозин Накопление энергии «второе дыхание» при угрозе гибели АТФ – фактор передачи энергии Энергетический баланс Освобождение энергии
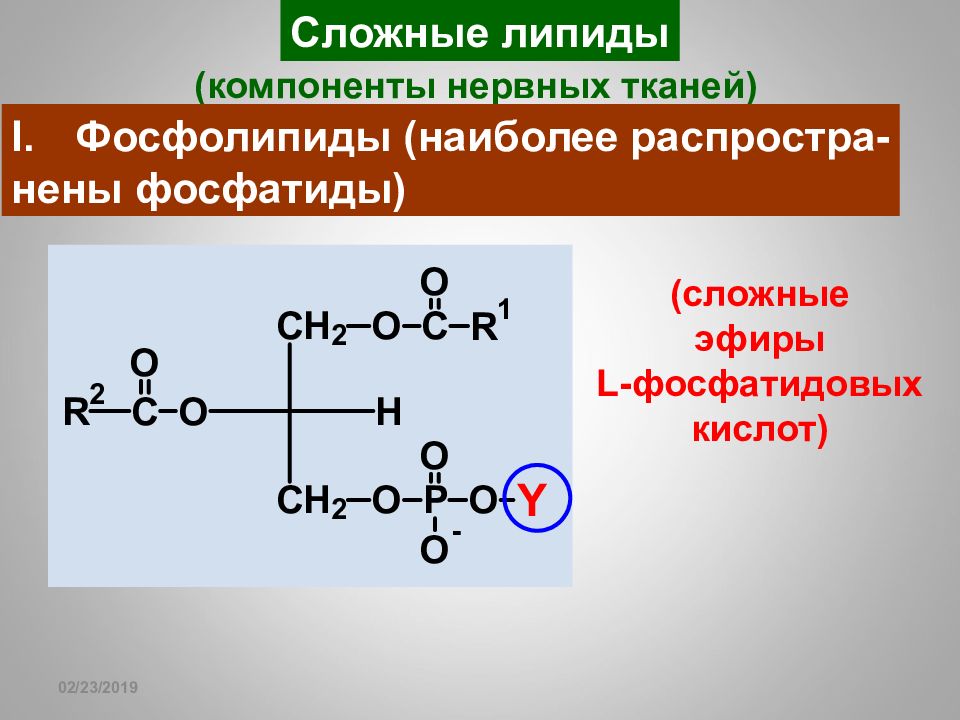
Слайд 117
16.02.2019 Сложные липиды (компоненты нервных тканей) Фосфолипиды (наиболее распростра- нены фосфатиды) (сложные эфиры L- фосфатидовых кислот)
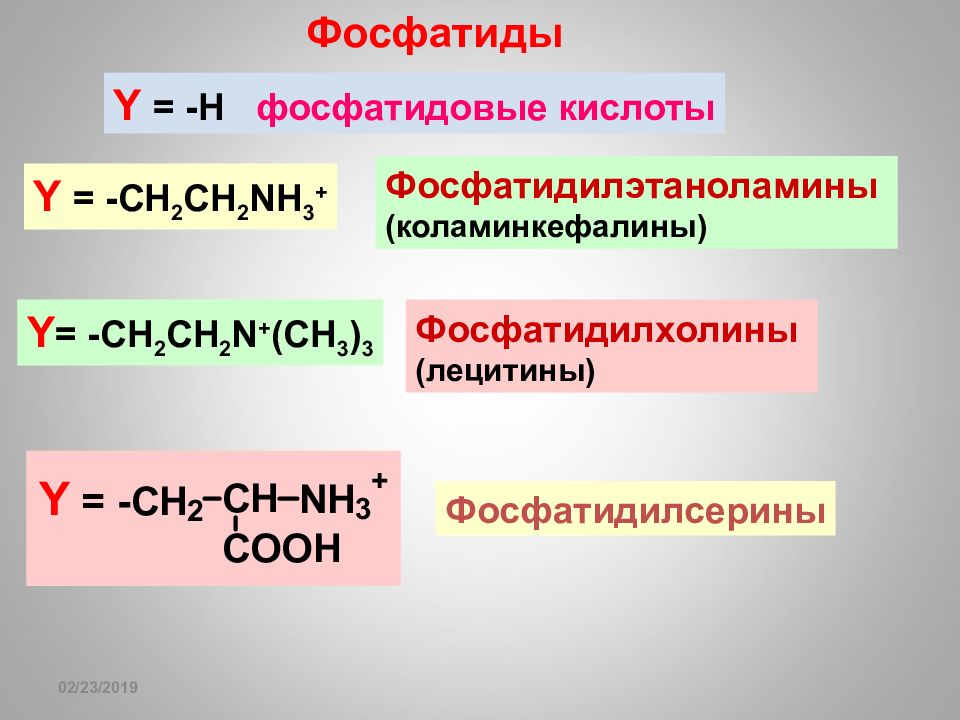
Слайд 118
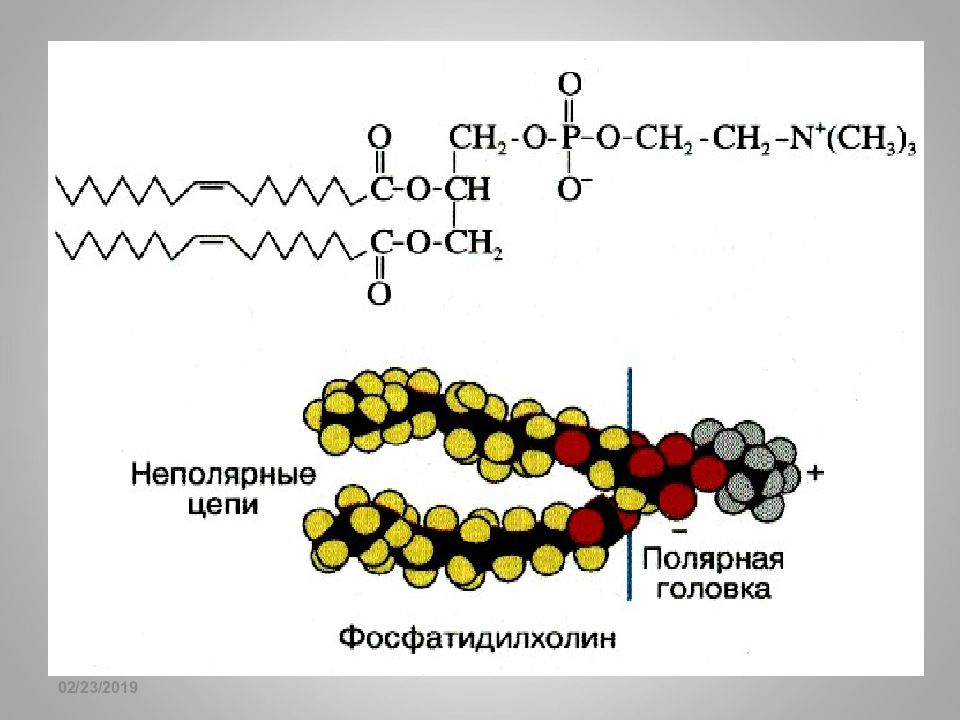
16.02.2019 Фосфатиды Y = -CH 2 CH 2 NH 3 + Фосфатидилэтаноламины (коламинкефалины) Y = -CH 2 CH 2 N + (С H 3 ) 3 Фосфатидилхолины (лецитины) Фосфатидилсерины Y = -H фосфатидовые кислоты
Слайд 120
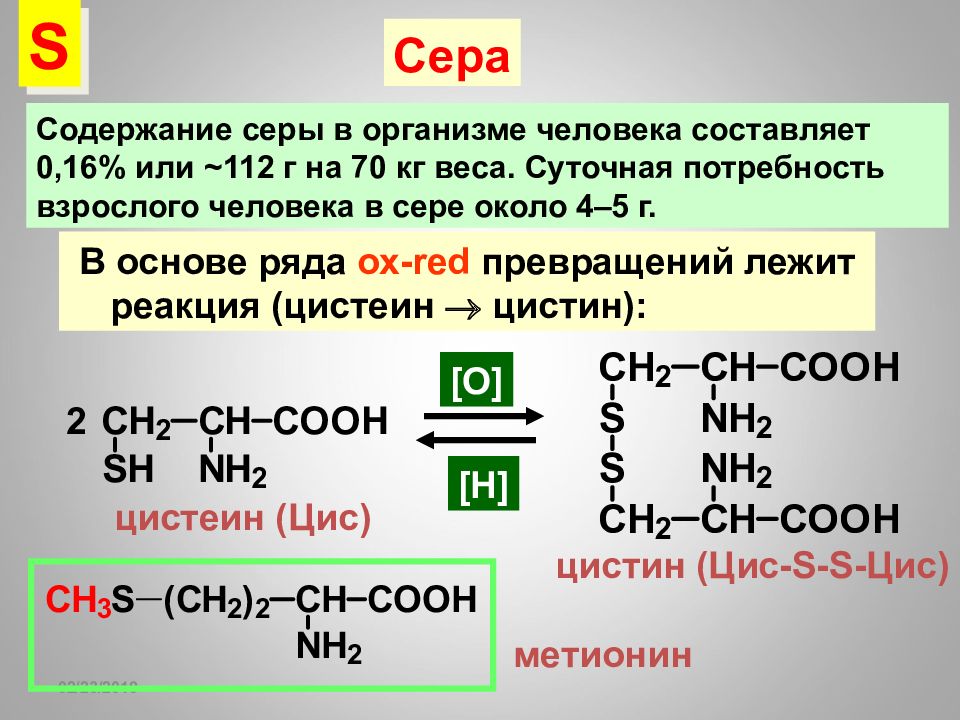
16.02.2019 В основе ряда ох- red превращений лежит реакция (цистеин цистин): 2 цистеин (Цис) [O] цистин (Цис- S-S -Цис) [H] S Сера Содержание серы в организме человека составляет 0,16% или ~ 112 г на 70 кг веса. Суточная потребность взрослого человека в сере около 4–5 г. метионин
Слайд 121
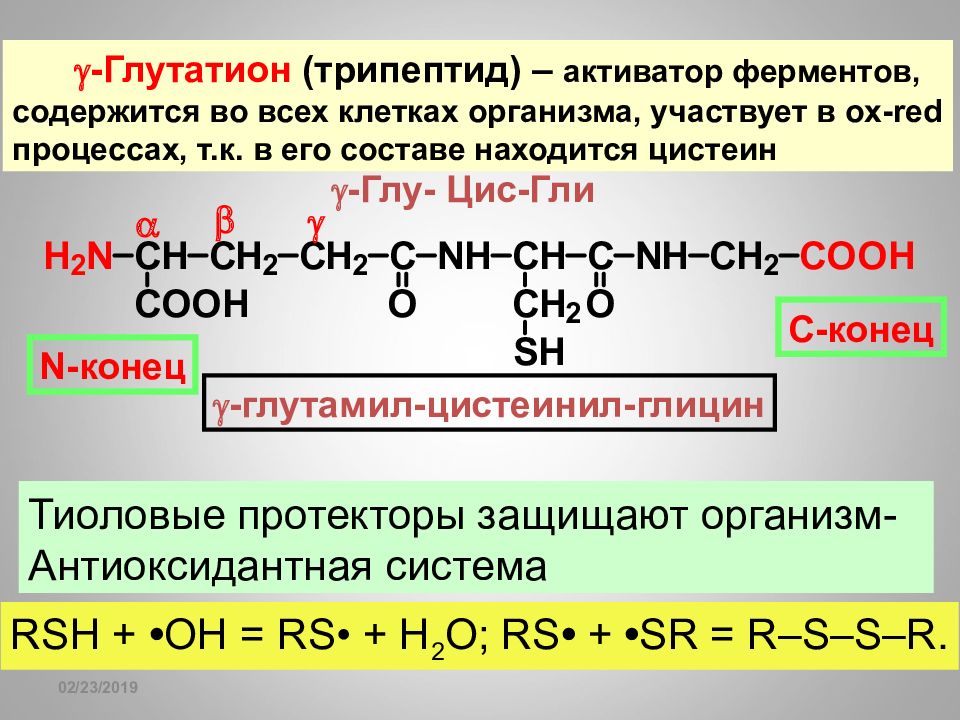
16.02.2019 -Глутатион (трипептид) – активатор ферментов, содержится во всех клетках организма, участвует в ox-red процессах, т.к. в его составе находится цистеин -Глу- Цис-Гли N -конец С-конец -глутамил-цистеинил-глицин Тиоловые протекторы защищают организм- Антиоксидантная система RSH + • ОН = RS• + H 2 O; RS • + • SR = R–S–S–R.
Слайд 122
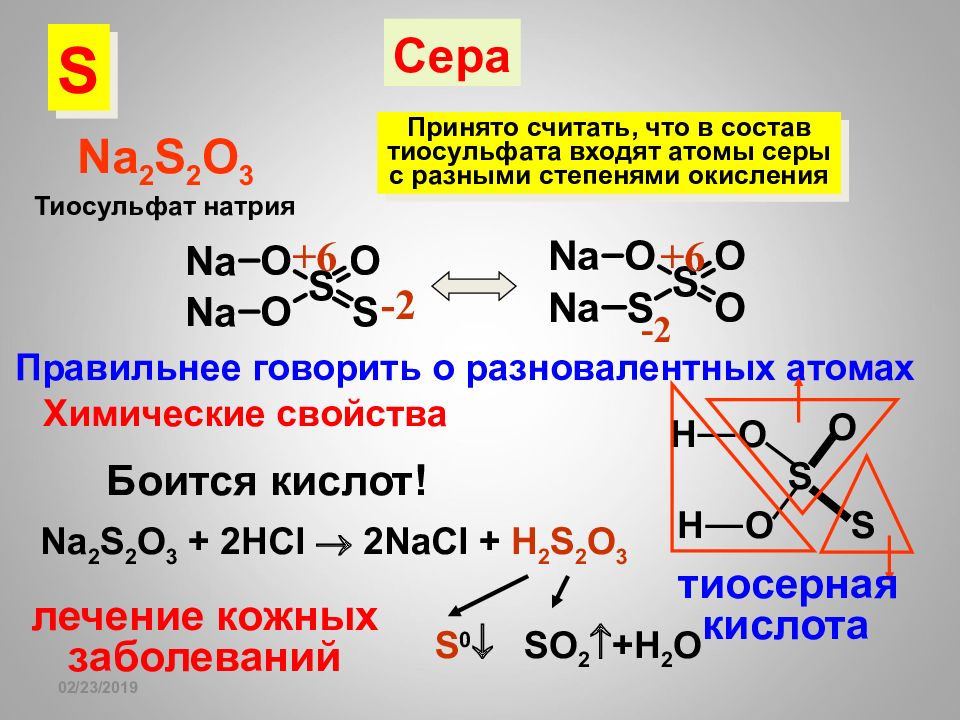
16.02.2019 Na 2 S 2 O 3 +6 +6 -2 -2 Сера Тиосульфат натрия Принято считать, что в состав тиосульфата входят атомы серы с разными степенями окисления Правильнее говорить о разновалентных атомах Химические свойства Na 2 S 2 O 3 + 2HCl 2NaCl + H 2 S 2 O 3 S 0 SO 2 +H 2 O S O S O O H H тиосерная кислота лечение кожных заболеваний Боится кислот! S
Слайд 123
16.02.2019 Микроэлементы – массовая доля 10 –3 – 10 –5 % (Fe, F, Si, Mn, Co, Cu, Ni, Zn, Cr и др.). Катионы d -металлов находятся в организме только в виде комплексов разной устойчивости. Микроэлементы - организаторы жизни ( > 10 -5 %): Fe 2+ aq, Zn 2+ aq, Co 2+ aq, Cu 2+ aq, Mn 2+ aq, Fe 3+ aq, Co 3+ aq, Cu + aq, Mn 3+ aq В организме: 5 г 3 г 0,1 – 0,2 г Особенности: - мало распространены в природе; - способны к комплексообразованию; - переменная степень окисления.
Слайд 124
16.02.2019 Регуляторы Микроэлементы Металлы жизни : Na, K, Ca, Mg,Fe, Cu, Zn, Mn, Mo, Co Это элементы, входящие в структуру и в активные центры ферментов, и, таким образом, необходимые для регулирования многих биохимических реакций.
Слайд 125
16.02.2019 Ультрамикроэлементы : Cr, Ni, Ag, Au, Sn … Особенности: - c клонны к ox-red превращениям; - склонны к комплексообразованию; - функции мало изучены Классификация по функции 1. Элементы, образующие основную массу биополимеров и соответствующих мономеров – белки, нуклеиновые кислоты, углеводы, липиды. За исключением водорода ( H ) это р -элементы: C, N, O, P, S. Эти элементы называют органогенами.
Слайд 126
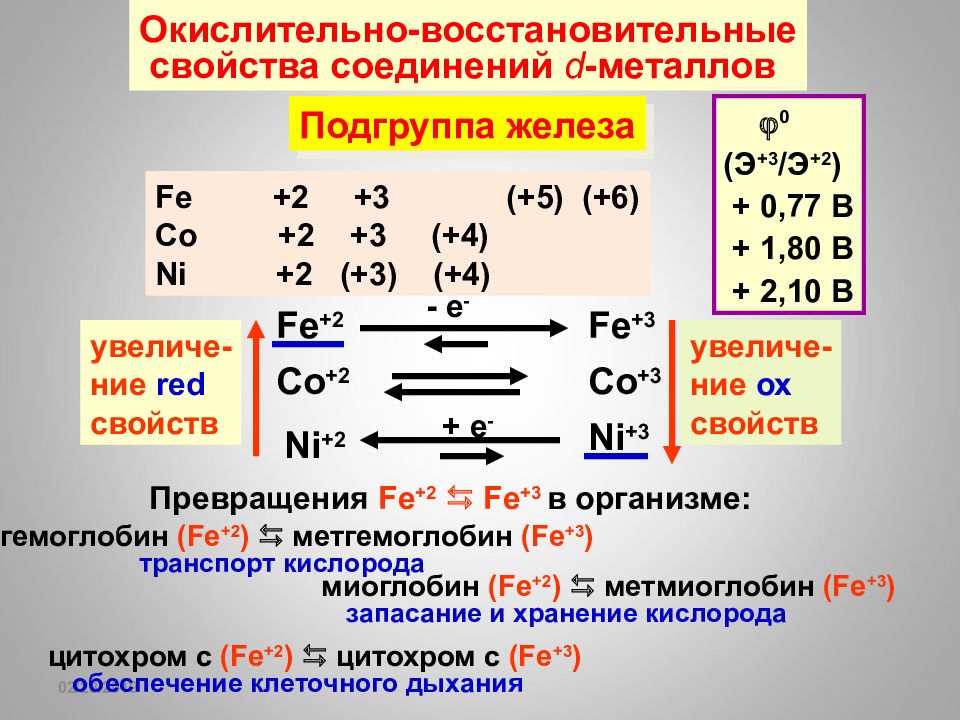
16.02.2019 Окислительно-восстановительные свойства соединений d - металлов Подгруппа железа Fe +2 +3 (+5) (+6) Co +2 +3 (+4) Ni +2 (+3) (+4) Co +2 Co +3 увеличе- ние ох свойств Ni +2 Ni +3 + e - увеличе- ние red свойств Fe +3 Fe +2 - e - 0 ( Э +3 / Э +2 ) + 0,77 В + 1,80 В + 2,10 В Превращения Fe +2 Fe +3 в организме: гемоглобин ( Fe +2 ) метгемоглобин ( Fe + 3 ) транспорт кислорода миоглобин ( Fe +2 ) метмиоглобин ( Fe + 3 ) запасание и хранение кислорода цитохром с ( Fe +2 ) цитохром с ( Fe + 3 ) обеспечение клеточного дыхания
Слайд 127
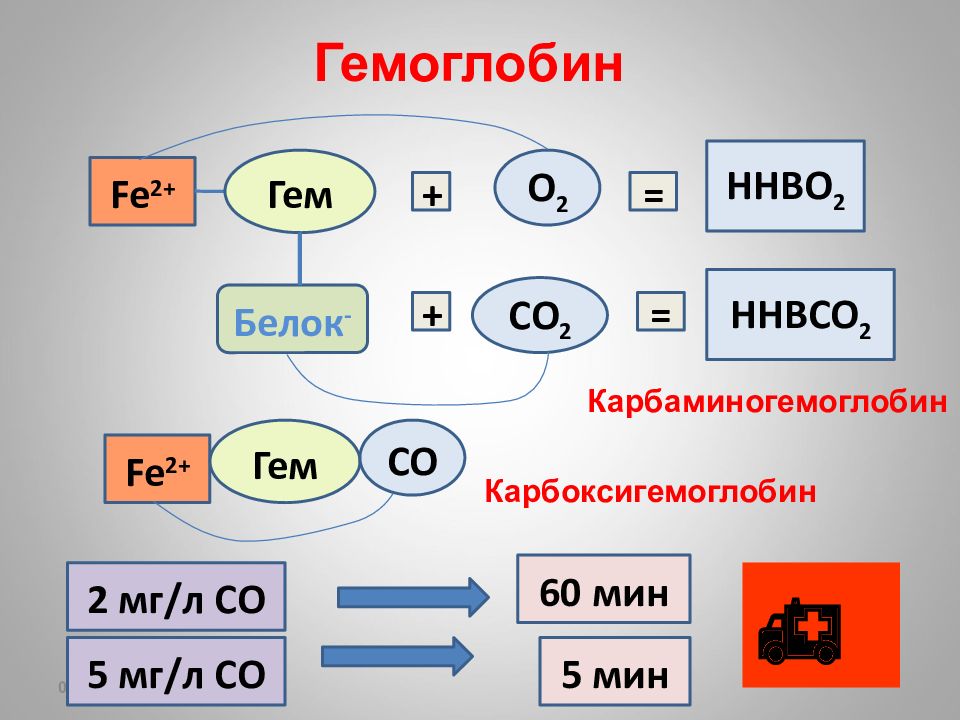
16.02.2019 Гемоглобин Fe 2+ Гем + О 2 = НН BO 2 + C О 2 = НН BCO 2 Белок - Fe 2+ Гем СО Карбаминогемоглобин Карбоксигемоглобин 2 мг / л СО 60 мин 5 мг / л СО 5 мин
Слайд 128
16.02.2019 Гемоглобин Fe 2+ Гем + окислители Метгемоглобин Fe 3+ = Белок - NO 3 - + 2H + + 2 ḕ = NO 2 - + H 2 O МетН b(Fe 3+ - ОН ) + CN - МетН b(Fe 3+ -CN) + ОН - + NO NO + HHb HHbNO
Слайд 129
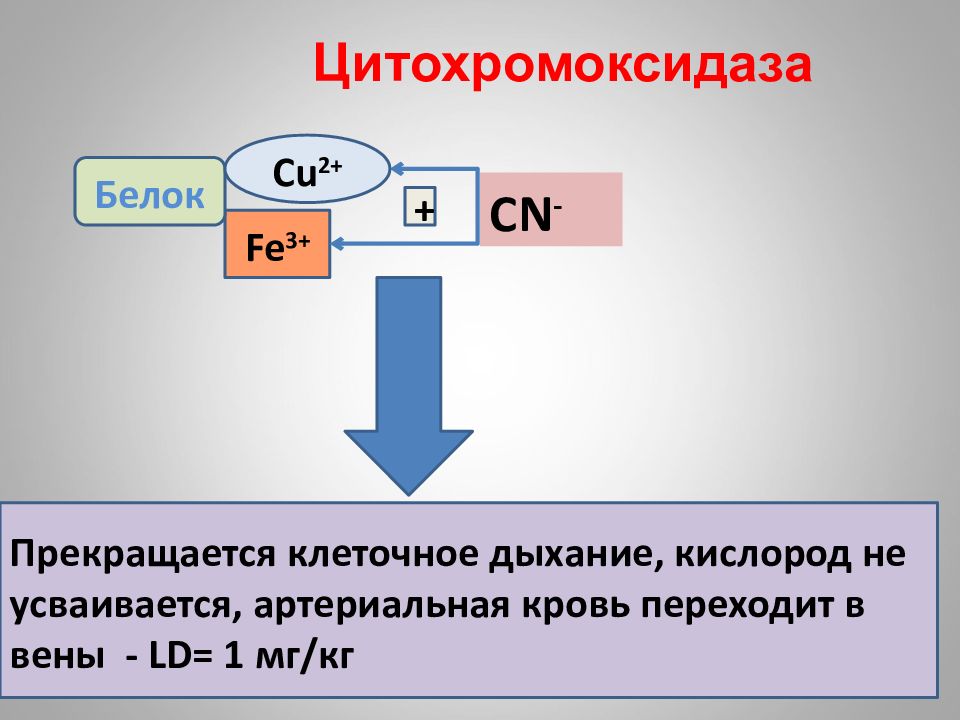
16.02.2019 Цитохромоксидаза Fe 3 + + Белок Прекращается клеточное дыхание, кислород не усваивается, артериальная кровь переходит в вены - LD= 1 мг / кг Cu 2+ CN -
Слайд 130
16.02.2019 Токсичные металлы Токсичность С d, Hg, Ag, Au, Pb обусловлена в основном ингибированием тиоловых групп в белках и ферментах R-SH + Ag + R-SAg + H + 2R-SH + Hg 2+ (R-S) 2 Hg + 2H + 2R-SH + Hg 2 2+ (R-S) 2 Hg + Hg + 2H + унитиол, D- пеницилламин, 2,3-димеркаптоянтарная кислота и др. Li, Be, Sr, Ba, Cd, Hg, Pb… Антидоты при отравлении солями Hg +2
Слайд 131
16.02.2019 Итак, 78 элементов входят в состав человеческого организма, из них 6 – органогены ( C, N, O, P, S, Н ), 26 – активно принимают участие в метаболизме ( Ca, K, Na, Li, Cl, Mg, Fe, F, Al, Si, Cr, Mn, Co, Ni, Cu, Zn, As, Se, Br, Sr, Mo, Cd, Sn, I, В, Pb ), 46 – обнаружены в очень малых количествах, биогенная роль их не выяснена.
Слайд 132
16.02.2019 Живая материя – открытая система, существование которой возможно лишь при условии постоянного химического взаимодей-ствия с внешней неживой природой. Поэтому важнейшие биогенные химические соединения образуют соединения, которые: легко проникают в клетку; отличаются структурным многообразием; обладают большим запасом свободной энергии. Ухудшающееся качество окружающей среды приводит к интоксикации организма, когда токсические вещества поступают через загрязненную воду, воздух и продукты питания, возникают серьезные патологические изменения. Согласно медицинским данным, здоровье человека зависит от экологического состояния среды приблизительно на 20 – 30%.
Слайд 134
16.02.2019 Характерные симптомы дефицита химических элементов в организме человека Дефицит элемента Типичный симптом Ca Mg Fe Zn Cu Mn Mo Co Ni Cr Si F I Se Замедление роста скелета Мускульные судороги Анемия, нарушение иммунной системы Повреждение кожи, замедление роста, замедление сексуального созревания Слабость артерий, нарушение деятельности печени, вторичная анемия Бесплодность, ухудшение роста скелета Замедление клеточного роста, склонность к кариесу Злокачественная анемия Учащение депрессий, дерматиты Симптомы диабета Нарушение роста скелета Кариес зубов Нарушение работы щитовидной железы, замедление метаболизма Мускульная (в частности, сердечная) слабость
Слайд 135
16.02.2019 Заболевания, связанные с недостатком или избытком каких-либо химических элементов в данном географическом районе называются эндемическими. Эндемические заболевания поражают человека, животных, растения. Эндемический зоб – гипофункция щитовидной железы
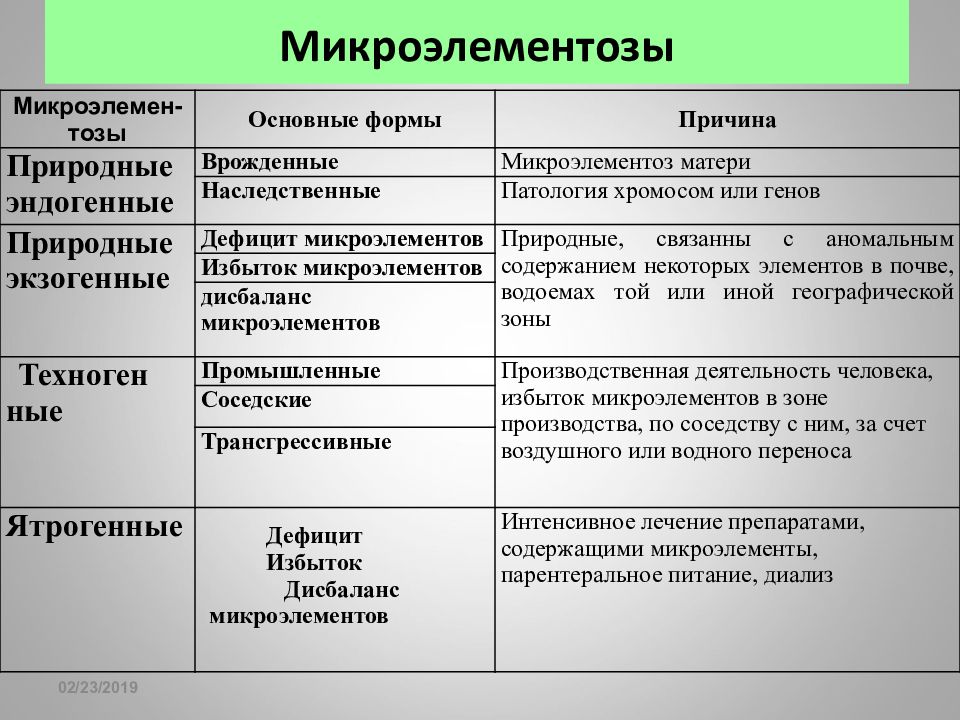
Слайд 136: Микроэлементозы
16.02.2019 Микроэлементозы Микроэлемен-тозы Основные формы Причина Природные эндогенные Врожденные Микроэлементоз матери Наследственные Патология хромосом или генов Природные экзогенные Дефицит микроэлементов Природные, связанны с аномальным содержанием некоторых элементов в почве, водоемах той или иной географической зоны Избыток микроэлементов дисбаланс микроэлементов Техноген ные Промышленные Производственная деятельность человека, избыток микроэлементов в зоне производства, по соседству с ним, за счет воздушного или водного переноса Соседские Трансгрессивные Ятрогенные Дефицит Избыток Дисбаланс микроэлементов Интенсивное лечение препаратами, содержащими микроэлементы, парентеральное питание, диализ
Слайд 137
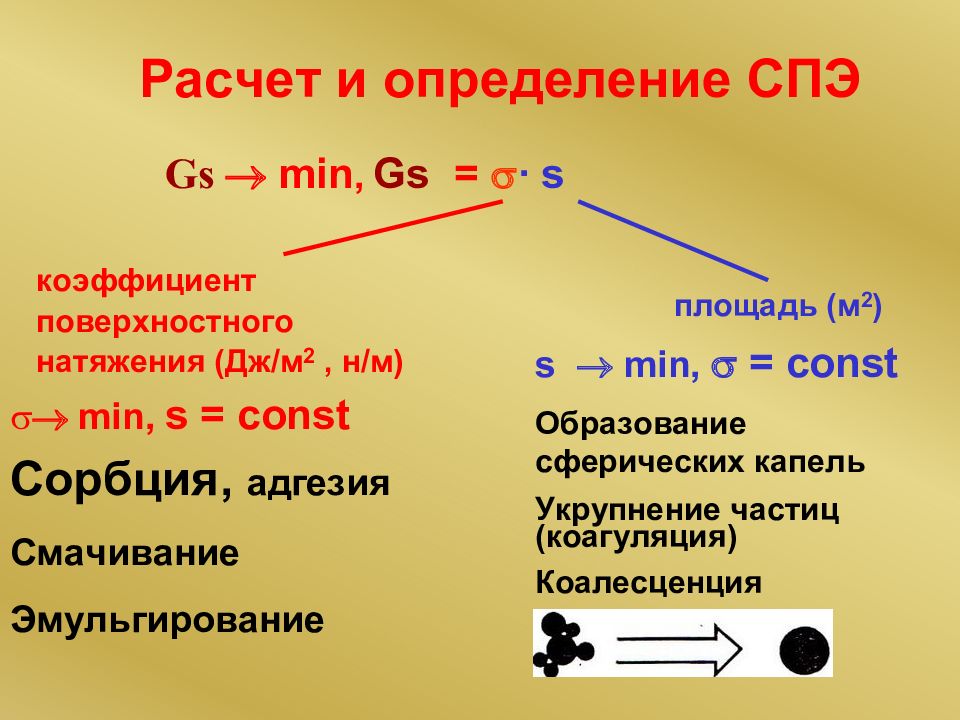
16.02.2019 Поверхностные явления Гетерогенные системы состоят из двух и более фаз Поверхностные явления наблюдаются на поверхности раздела фаз Фазы отделены поверхностью раздела, где свойства системы изменяются скачкообразно Поверхностное натяжение Сорбция Адгезия Смачивание Капиллярная конденсация Фаза имеет одинаковый химический состав и характеризуется равенством ТД параметров
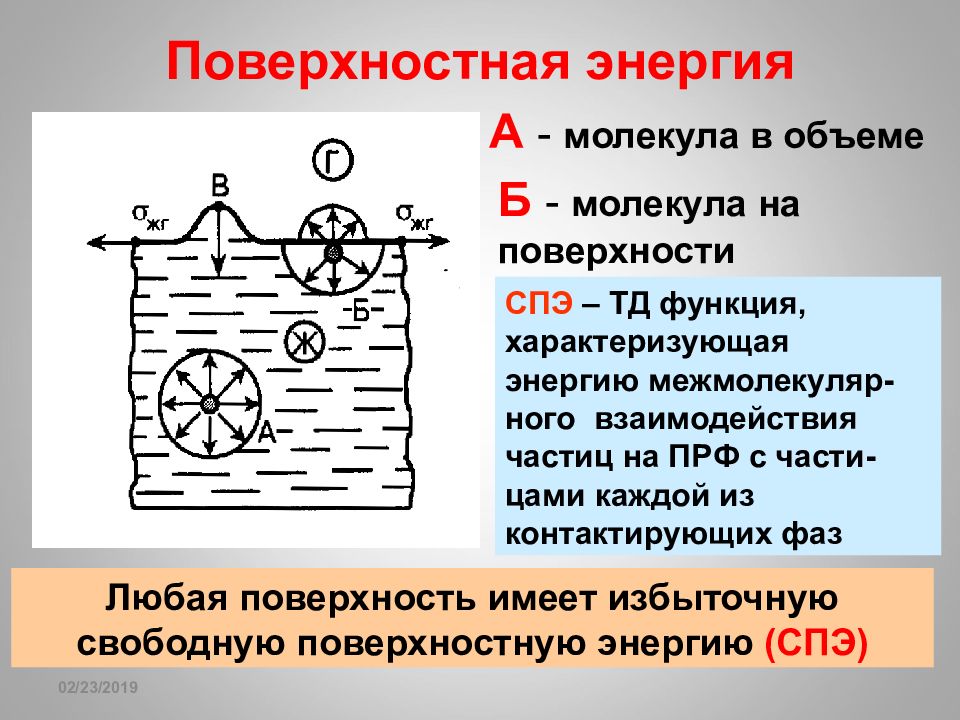
Слайд 138
16.02.2019 Поверхностная энергия А - молекула в объеме Б - молекула на поверхности Любая поверхность имеет избыточную свободную поверхностную энергию (СПЭ) СПЭ – ТД функция, характеризующая энергию межмолекуляр- ного взаимодействия частиц на ПРФ с части- цами каждой из контактирующих фаз
Слайд 140
16.02.2019 СПЭ в биологии и медицине Полная альвеолярная поверхность легких при вдохе равна 70—80 м 2, что примерно в 40 раз больше наружной поверхности тела. Большая удельная поверхность органов и тканей необходима для активного обмена веществ: он происходит лишь в том случае, когда уменьшается СПЭ. Суммарная поверхность эритроцитов, контактирующих со всеми альвеолами в течение 1 мин – 3750 м 2. В печени суммарная площадь внутренней митохондриальной мембраны составляет 40м 2 на 1 г белка.
Слайд 141
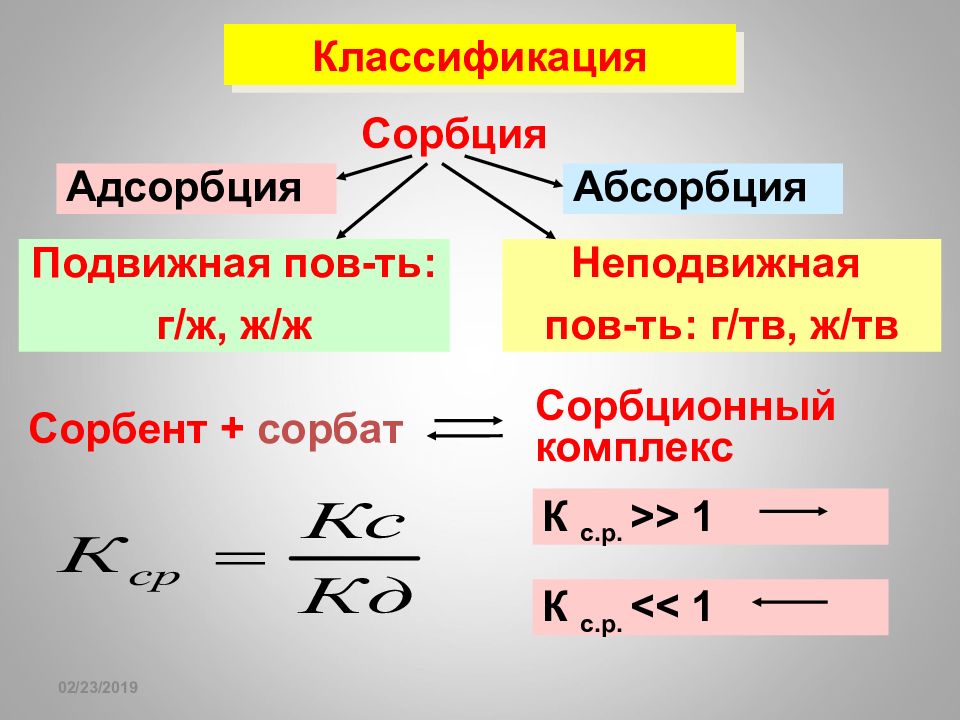
16.02.2019 Адсорбция – самопроизвольный процесс накопления вещества на поверхности раздела фаз. Адсорбент – вещество, на котором происходит адсорбция. Вещество, молекулы которого могут адсорбироваться, называется адсорбтивом, а уже адсорбированные молекулы – адсорбатом. Сорбция Абсорбция – процесс поглощения одного вещества всем объемом другого, а не только его поверхностью. Сорбция – гетерогенный процесс поглощения веще-ства тв.телом или жид-ю в-в из окр. среды
Слайд 142
16.02.2019 К с.р. >> 1 Классификация Сорбент + сорбат Сорбция Адсорбция Абсорбция Неподвижная пов-ть: г / тв, ж / тв Подвижная пов-ть: г / ж, ж / ж Сорбционный комплекс К с.р. << 1
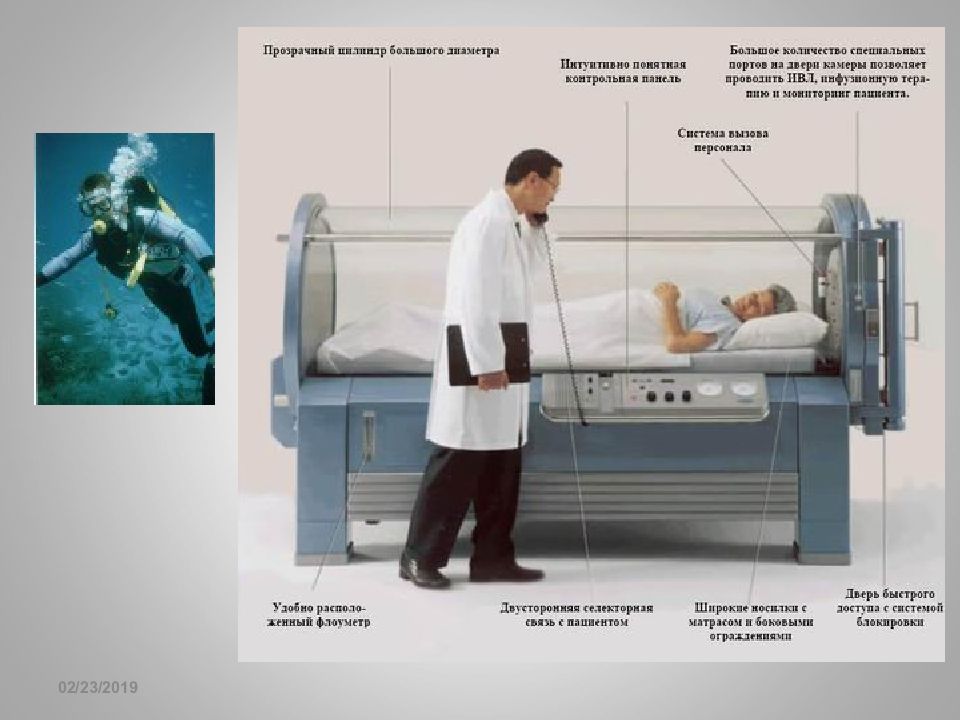
Слайд 143
16.02.2019 Абсорбция газов в жидкости Закон Генри с = K р(Х); р(Х) = р общ N(X) Профессиональные заболевания водолазов, рабочих в кессонах, летчиков, космонавтов. Абсорбция Абсорбция – растворение вещества в растворителе (абсорбент) Закономерность – «подобное с подобным» HCl абс-ся H 2 O, а О 2 – перфтордекалином С 10 F 22 ( основа эмульсионного кровезаменителя) Закон Сеченова : lnC 0 /C = K c C эл Газы-токсиканты хорошо растворяются в воде
Слайд 145: Адсорбция – поглощение газов, паров или жидкостей поверхностным слоем твердого тела
16.02.2019 Адсорбция – поглощение газов, паров или жидкостей поверхностным слоем твердого тела.
Слайд 146
16.02.2019 Адсорбция Процесс самопроизвольный Процесс избирательный Первые исследования в области адсорбции – Т.Е. Ловиц (1757-1804) Предложил использовать уголь для очистки спирта от сивушных масел и для дезодорации воздуха. G < 0 S < 0 H < 0
Слайд 147
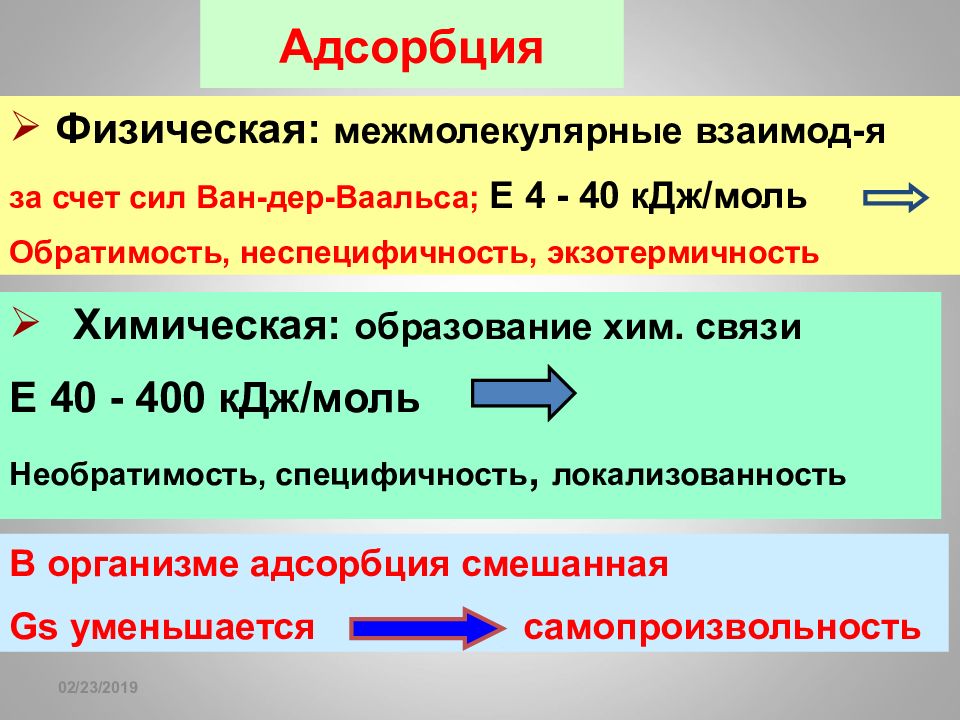
16.02.2019 Адсорбция Химическая: образование хим. связи Е 40 - 400 кДж / моль Необратимость, специфичность, локализованность Физическая: межмолекулярные взаимод-я за счет сил Ван-дер-Ваальса; Е 4 - 40 кДж / моль Обратимость, неспецифичность, экзотермичность В организме адсорбция смешанная Gs уменьшается самопроизвольность
Слайд 148: Адсорбция на неподвижной поверхности
16.02.2019 Адсорбция на неподвижной поверхности Количественная характеристика адсорбции Удельная адсорбция – равновесное количество поглощаемого вещества, единицей поверхности или массы адсорбента
Слайд 149: Адсорбция газов и паров
16.02.2019 Адсорбция газов и паров Количество поглощенных газов и паров зависит: 1. Природа и площадь поверхности адсорбента; Адсорбенты полярные (гидрофильные) – силикагель Адсорбенты неполярные (гидрофобные) – актив. уголь 2. Природа поглощаемого газа или пара 3. Концентрация газа или пара (изотерма адсорбции) 4. Температура (Адсорбент + адсорбат) - силы Ван-дер-Ваальса и водородные связи
Слайд 150: 1. Адсорбция происходит лишь на активных центрах поверхности
16.02.2019 1. Адсорбция происходит лишь на активных центрах поверхности. адсорбент Активные центры Основные положения теории Ленгмюра адсорбат 2. Адсорбция мономолекулярна
Слайд 151: 4. Процесс адсорбции равновесен адс = дес
16.02.2019 4. Процесс адсорбции равновесен адс = дес 3. Процесс адсорбции обратим и носит динамический характер Уравнение Ленгмюра Нобелевская премия за работы по теории поверхностных явлений (1932) Г - предельная адсорбция Г , К - константы для пары адсорбент-адсорбтив. К дес, К адс - константы скорости процессов адсорбции и десорбции
Слайд 152
16.02.2019 Г С I II III Г Г 2 Изотерма адсорбции I – область малых концентраций, С << К, тогда Г = ( Г / К)С ( I участок) С >>K, тогда Г = Г ( III участок) С = К, то Г = Г С /2C = Г /2 II – средние концентрации, III – высокие концентрации.
Слайд 153
16.02.2019 Применение адсорбции газов и паров 1. Очистка воздуха от отравляющих веществ (противогазы, респираторы) Н.Д.Зелинский 2. Регенерация воздуха в замкнутых помещениях подводных лодок и космических кораблей 3. Газовая хроматография
Слайд 154
16.02.2019 Адсорбция из растворов (конкуренция между раств. веществом и растворителем Молекулярная Ионная Молекулярная адсорбция зависит от: Природы адсорбента (гидрофильные, гидрофобные); Природы растворителя: чем хуже растворитель смачивает поверхность адсорбента, тем хуже растворяет вещество, тем лучше адсорбируется растворенное вещество
Слайд 155
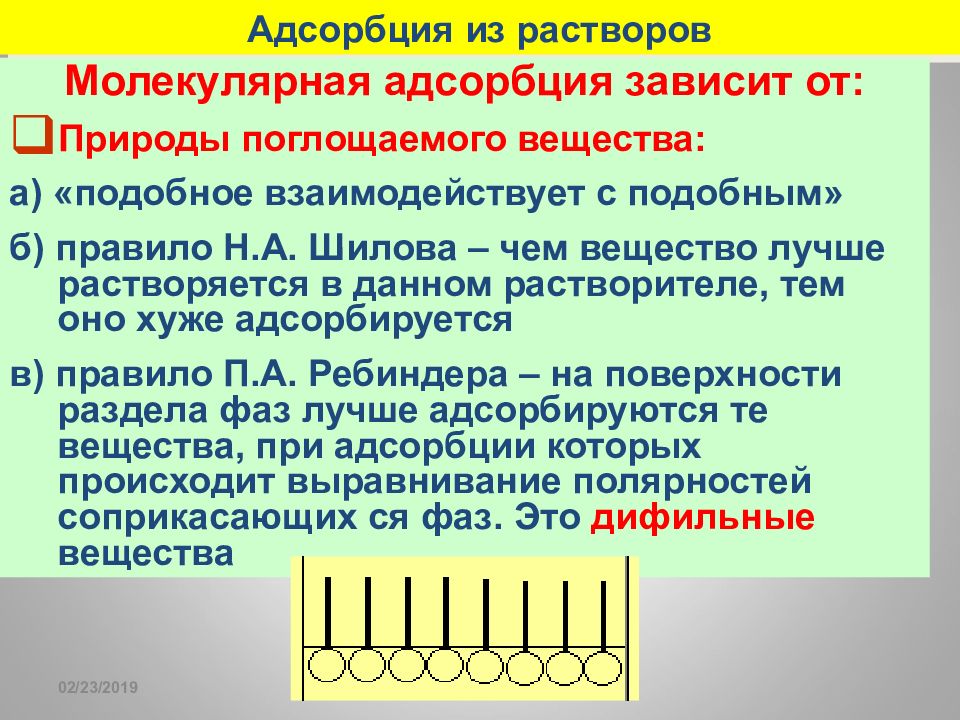
16.02.2019 Адсорбция из растворов Молекулярная адсорбция зависит от: Природы поглощаемого вещества: а) «подобное взаимодействует с подобным» б) правило Н.А. Шилова – чем вещество лучше растворяется в данном растворителе, тем оно хуже адсорбируется в) правило П.А. Ребиндера – на поверхности раздела фаз лучше адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающих ся фаз. Это дифильные вещества
Слайд 156
16.02.2019 P асчет адсорбции Г (гамма) - адсорбция, С 0 – начальная концентрация адсорбтива, моль / л; С р – равновесная концентрация адсорбтива, моль / л; V – объем раствора, л или м 3. m – масса адсорбента, г или кг S – площадь адсорбента, см 2 или м 2
Слайд 157
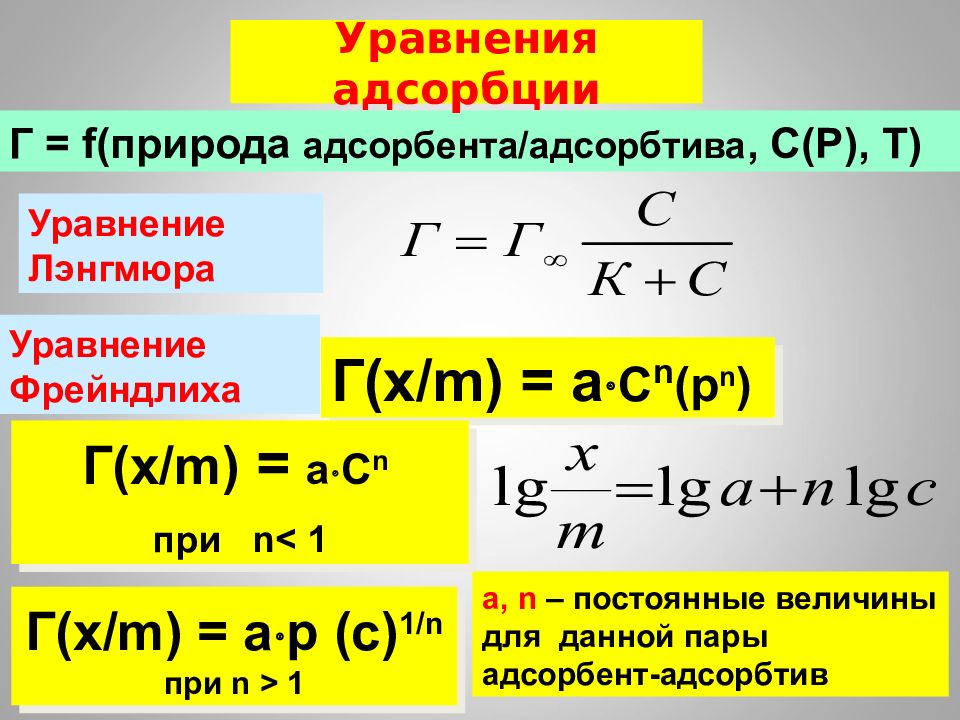
16.02.2019 Г = f( природа адсорбента / адсорбтива, С(Р), Т) Уравнение Лэнгмюра Уравнение Фрейндлиха Уравнения адсорбции Г( x/m) = a C n ( p n ) a, n – постоянные величины для данной пары адсорбент-адсорбтив Г( x/m) = aC n при n < 1 Г( x/m) = ap (с) 1/n при n > 1
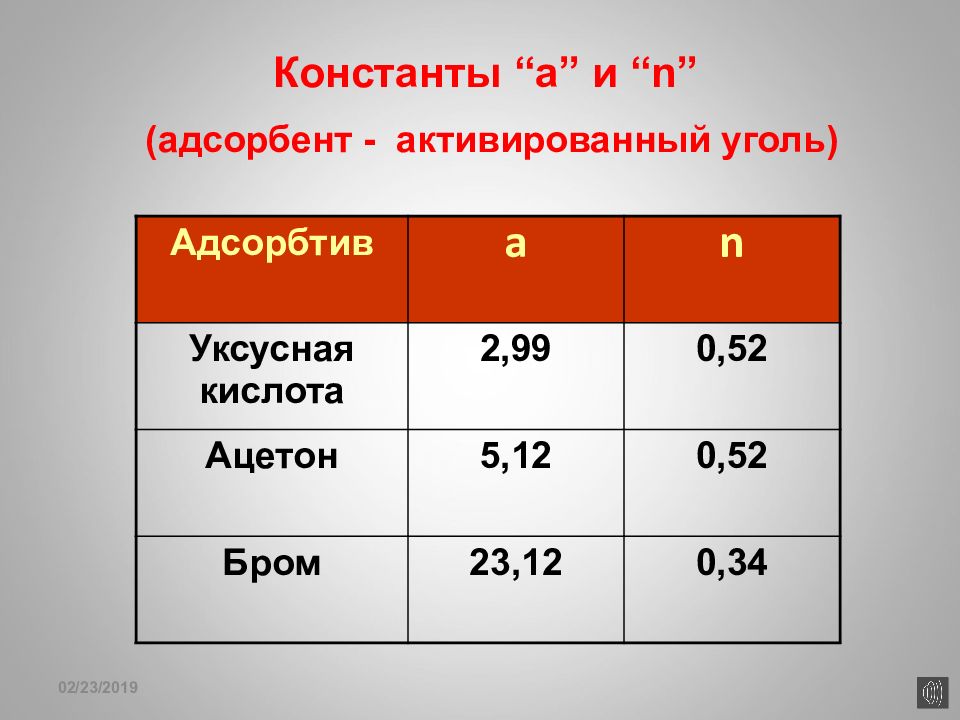
Слайд 158
16.02.2019 Константы “a” и “n” (адсорбент - активированный уголь) Адсорбтив a n Уксусная кислота 2,99 0,52 Ацетон 5,12 0,52 Бром 23,12 0,34
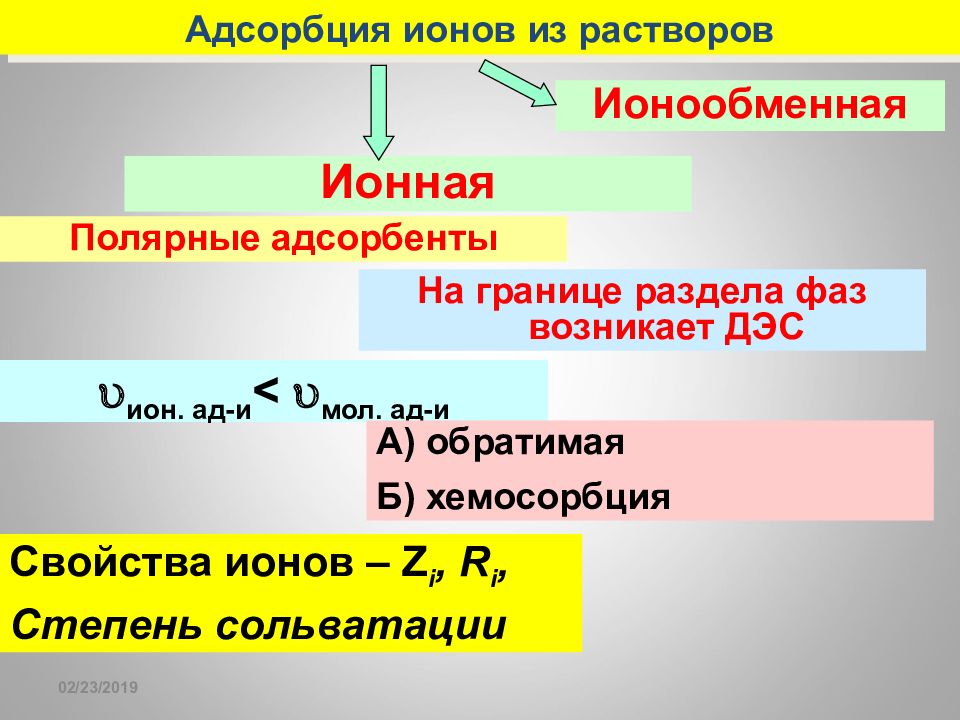
Слайд 159
16.02.2019 Адсорбция ионов из растворов Ионная Ионообменная Полярные адсорбенты На границе раздела фаз возникает ДЭС ион. ад-и < мол. ад-и А) обратимая Б) хемосорбция Свойства ионов – Z i, R i, Степень сольватации
Слайд 160
16.02.2019 Избирательность адсорбции Многовалентные ионы адсорбируются сильнее одновалентных (кроме Н + ) Способность к адсорбции одинаково заряженных ионов определяется их местом в лиотропных рядах С s + > Rb + > K + > Na + > Li + CNS - > I - > NO 3 - > Br - > Cl - Фрагменты лиотропных рядов катионов и анионов:
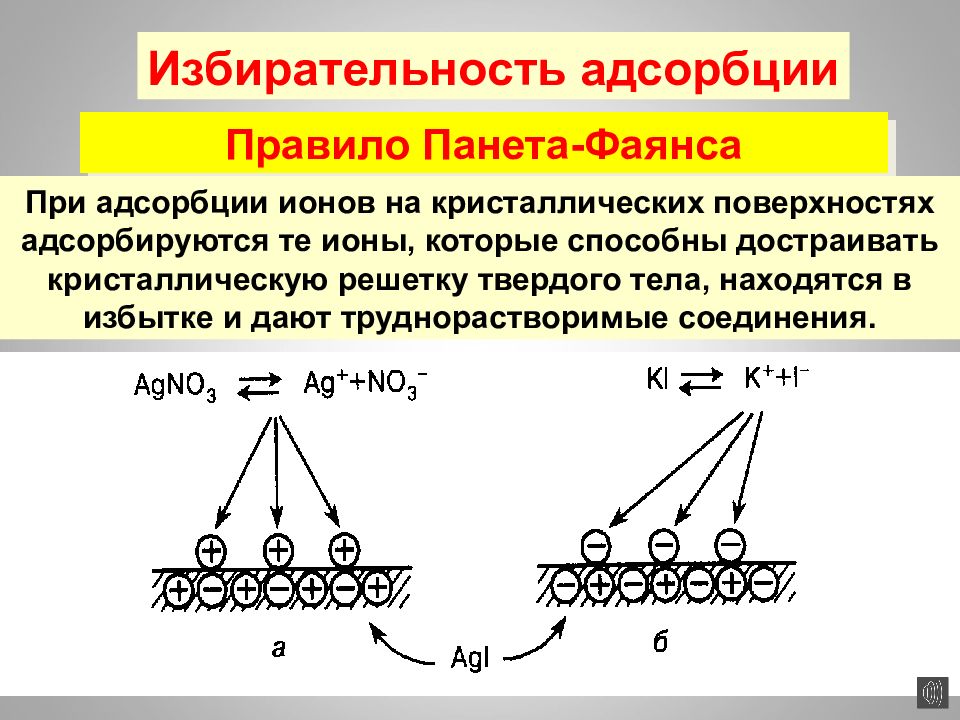
Слайд 161
16.02.2019 Избирательность адсорбции Правило Панета-Фаянса При адсорбции ионов на кристаллических поверхностях адсорбируются те ионы, которые способны достраивать кристаллическую решетку твердого тела, находятся в избытке и дают труднорастворимые соединения.
Слайд 162
16.02.2019 Ионообменная адсорбция 1 – каркас 2 – фиксированный ион 3 – подвижный ион, способный к ионному обмену
Слайд 163: Иониты
16.02.2019 Иониты Катиониты R - X Kat +y R - X ( каркас, с закрепленным анионом) Kat +y ( катионы, способные к ионообмену) Аниониты R + X An -y R + X ( каркас, с закрепленным катионом) An -y ( анионы, способные к ионообмену) Природные иониты – ткани растений и животных, почва
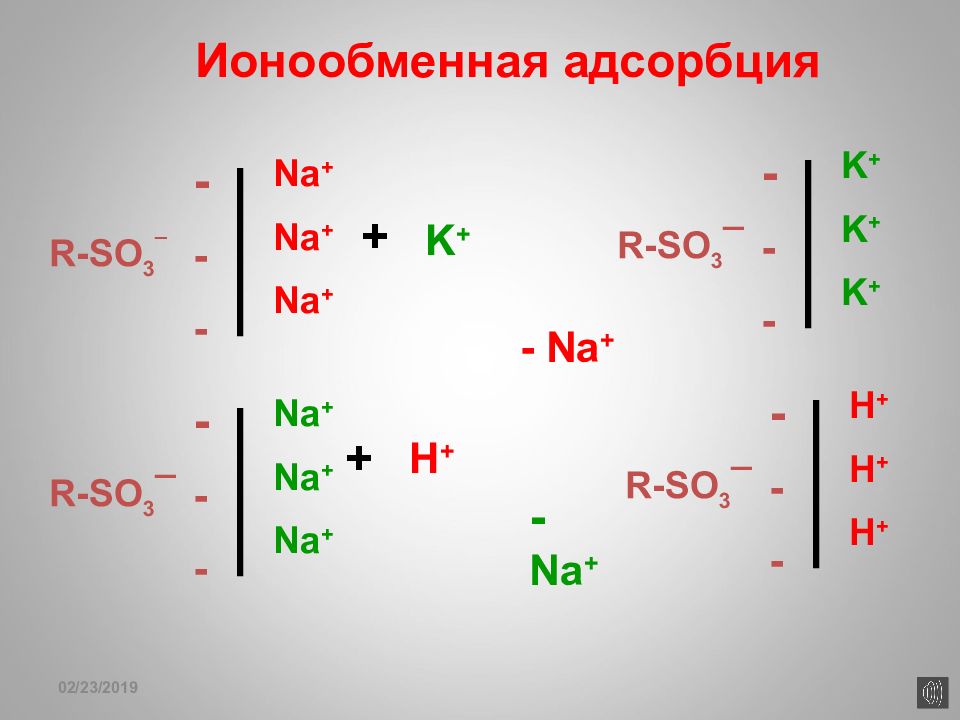
Слайд 164
16.02.2019 R-SO 3 ¯ - - - Na + Na + Na + + K + R-SO 3 ¯ - - - H + H + H + - Na + R-SO 3 ¯ - - - Na + Na + Na + + H + - Na + R-SO 3 ¯ - - - K + K + K + Ионообменная адсорбция
Слайд 165
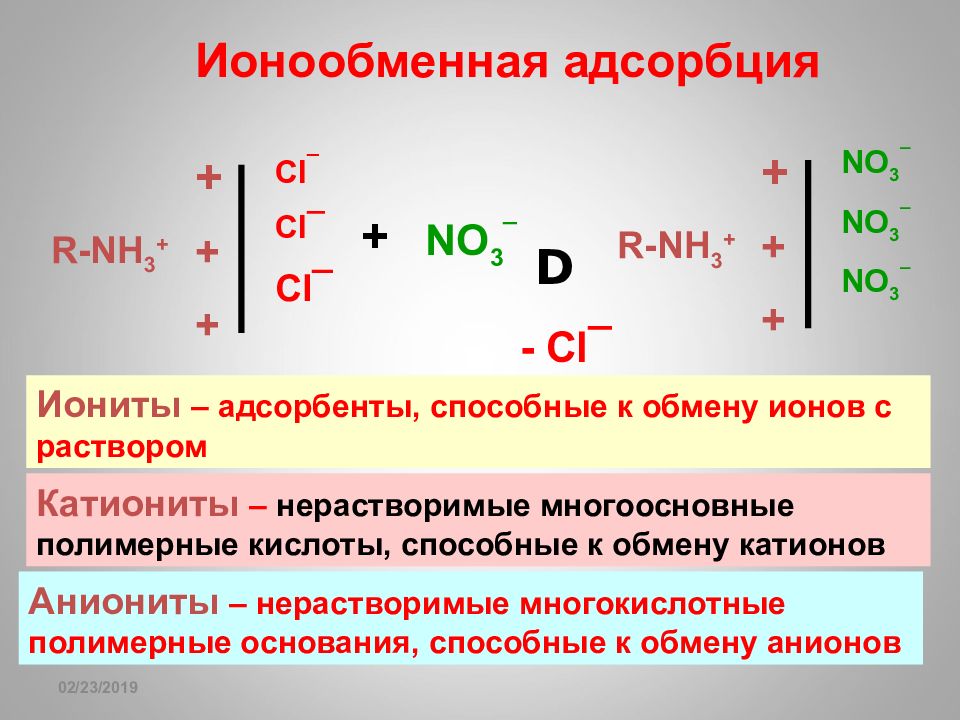
16.02.2019 R-NH 3 + + + + Cl ¯ Cl ¯ Cl ¯ + NO 3 ¯ D - Cl ¯ R-NH 3 + + + + NO 3 ¯ NO 3 ¯ NO 3 ¯ Ионообменная адсорбция Иониты – адсорбенты, способные к обмену ионов с раствором Катиониты – нерастворимые многоосновные полимерные кислоты, способные к обмену катионов Аниониты – нерастворимые многокислотные полимерные основания, способные к обмену анионов
Слайд 166: Иониты
16.02.2019 Иониты Природные: Алюмосиликаты (цеолиты, гидрослюда и др.) Древесина, торф, целлюлоза, сульфированные угли Синтетические : Алюмосиликаты (пермутиты) Органические ионообменные смолы RSO 3 H, RCOOH, RPO(OH) 2 (катиониты) RNH 2, RN(CH 3 ) 2, Z=NH (аниониты)
Слайд 167
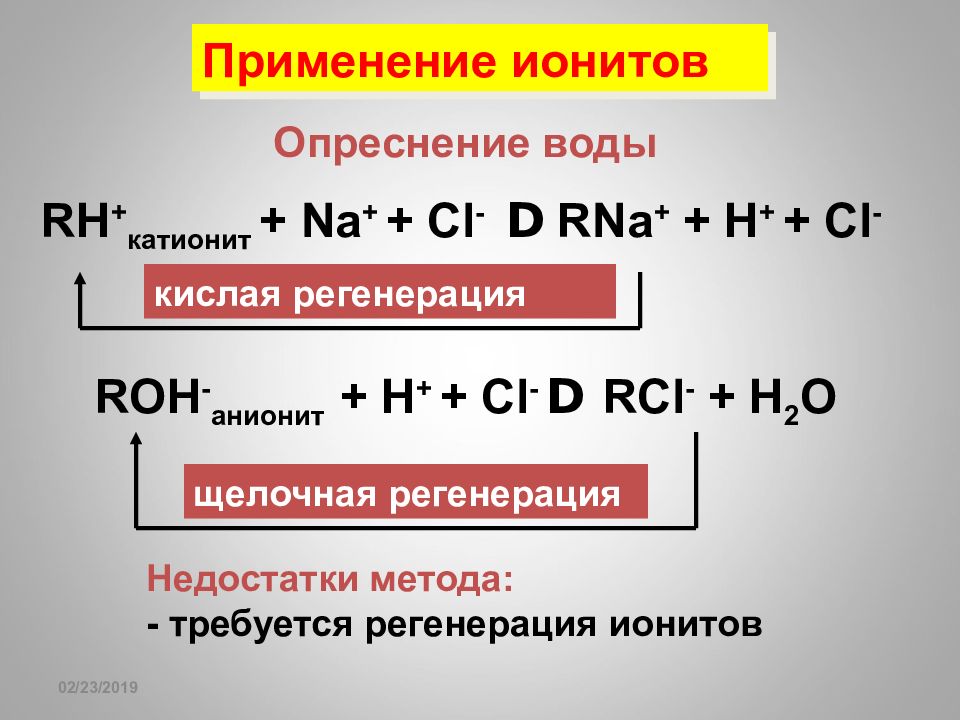
16.02.2019 Применение ионитов Опреснение воды RH + катионит + Na + + Cl - D RNa + + H + + Cl - ROH - анионит + H + + Cl - D RCl - + H 2 O щелочная регенерация кислая регенерация Недостатки метода: - требуется регенерация ионитов
Слайд 168
16.02.2019 Применение ионитов Катиониты применяются для уменьшения жесткости воды Аниониты применяются для очистки воды от анионов Удаление Са 2+ при консервировании крови Детоксикация организма при отравлениях Беззондовая диагностика кислотности желудочного сока
Слайд 169
16.02.2019 Уравнение Гиббса 1. Г < 0 (отрицательная адсорбция) Адсорбция на подвижной поверхности > 0 С адсорбтива на поверхности < С адсорбтива в объеме Вещества, вызывающие отрицательную адсорбцию, называются поверхностно-инактивными веществами (ПИАВ) Для воды: неорганические соединения: кислоты, основания, соли.
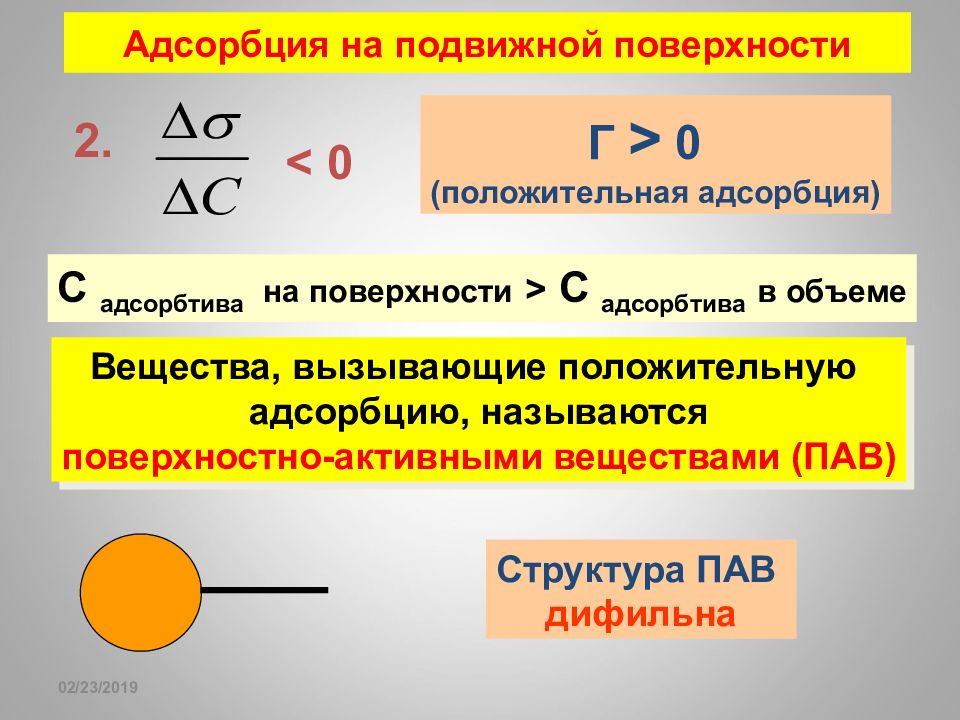
Слайд 170
16.02.2019 2. Г > 0 (положительная адсорбция) С адсорбтива на поверхности > С адсорбтива в объеме Адсорбция на подвижной поверхности < 0 Вещества, вызывающие положительную адсорбцию, называются поверхностно-активными веществами (ПАВ) Структура ПАВ дифильна
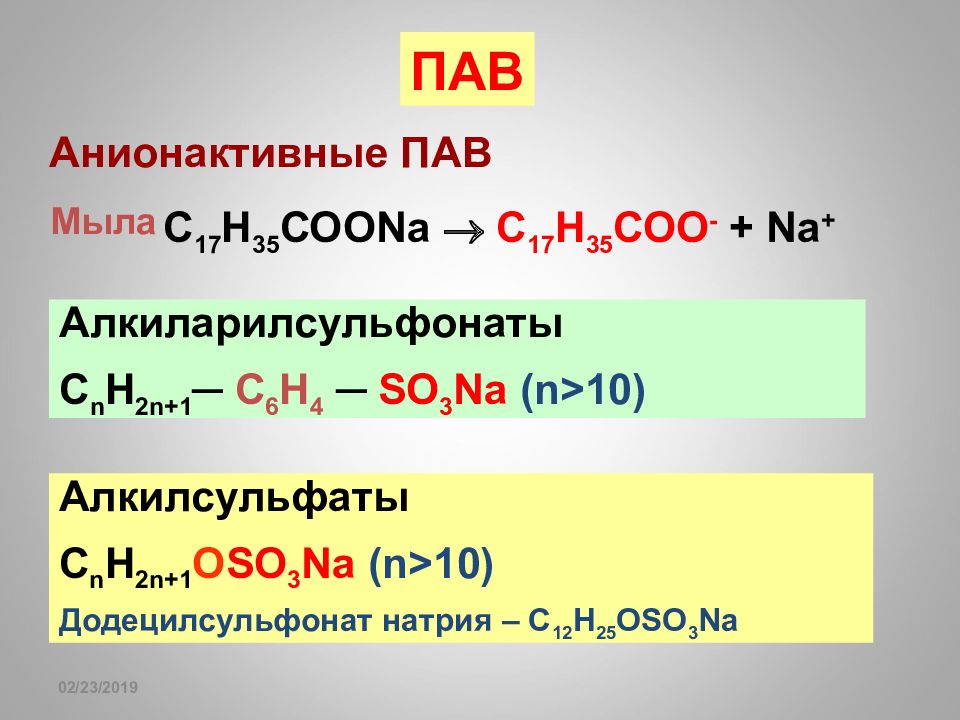
Слайд 171
16.02.2019 ПАВ Анионактивные ПАВ Мыла С 17 Н 35 СОО Na С 17 Н 35 СОО - + Na + Алкиларилсульфонаты С n Н 2n+1 ─ C 6 H 4 ─ SO 3 Na (n >10) Алкилсульфаты С n Н 2n+1 О SO 3 Na (n >10) Додецилсульфонат натрия – С 12 Н 25 OSO 3 Na
Слайд 172
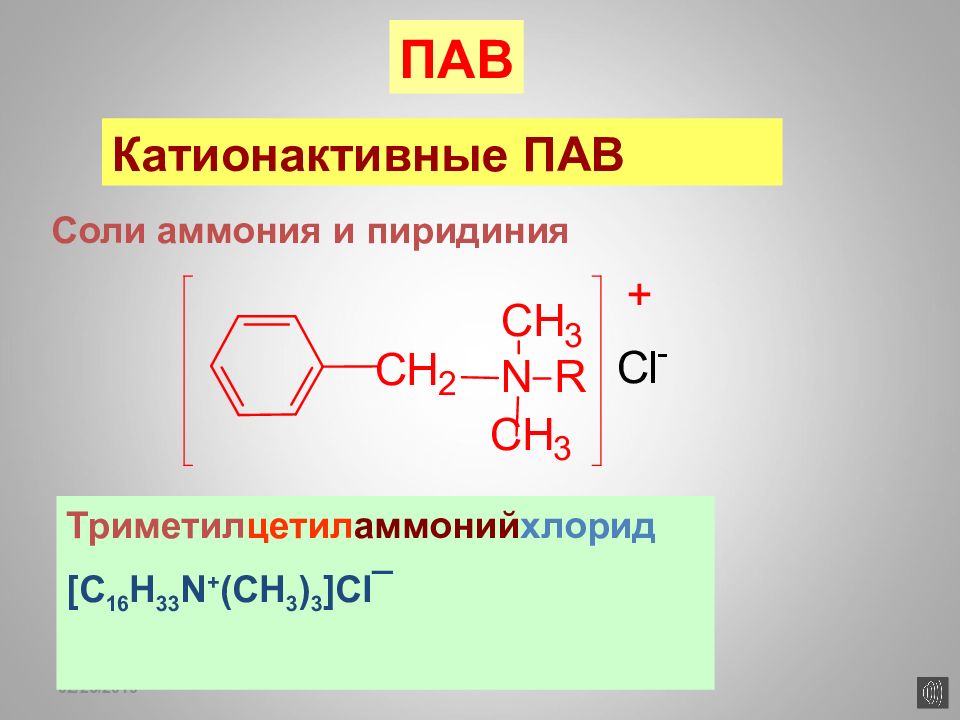
16.02.2019 Соли аммония и пиридиния Катионактивные ПАВ ПАВ Триметил цетил аммоний хлорид [C 16 H 33 N + (CH 3 ) 3 ]Cl ¯
Слайд 173
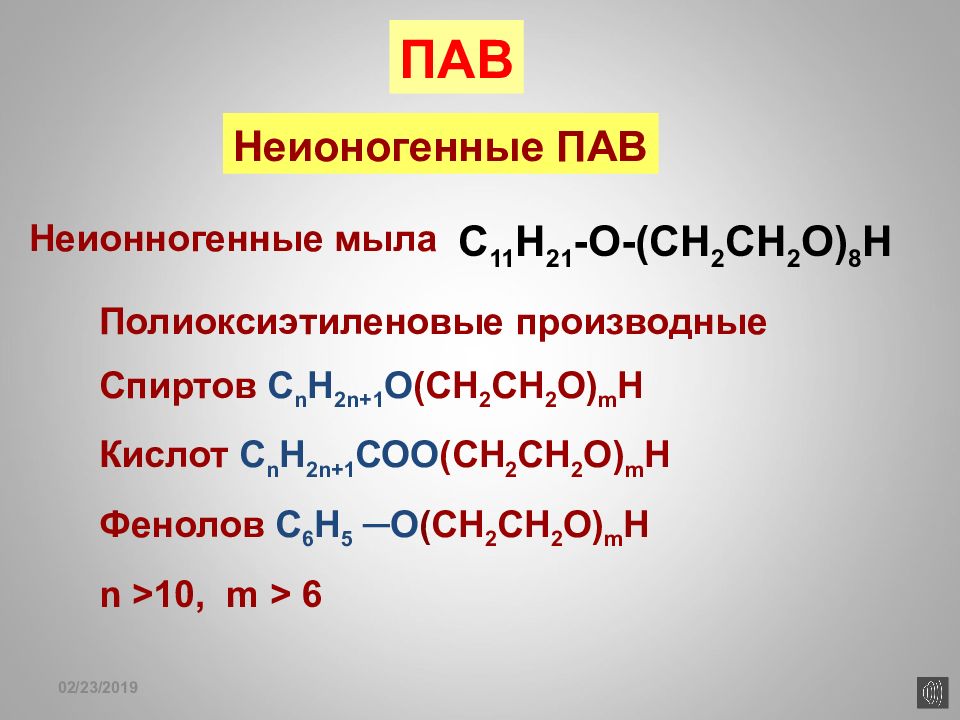
16.02.2019 Неионогенные ПАВ C 11 H 21 -O-(CH 2 CH 2 O) 8 H ПАВ Неионногенные мыла Полиоксиэтиленовые производные Спиртов С n H 2n+1 O (CH 2 CH 2 O) m H Кислот С n H 2n+1 СО O (CH 2 CH 2 O) m H Фенолов С 6 Н 5 ─О ( CH 2 CH 2 O) m H n >10, m > 6
Слайд 175
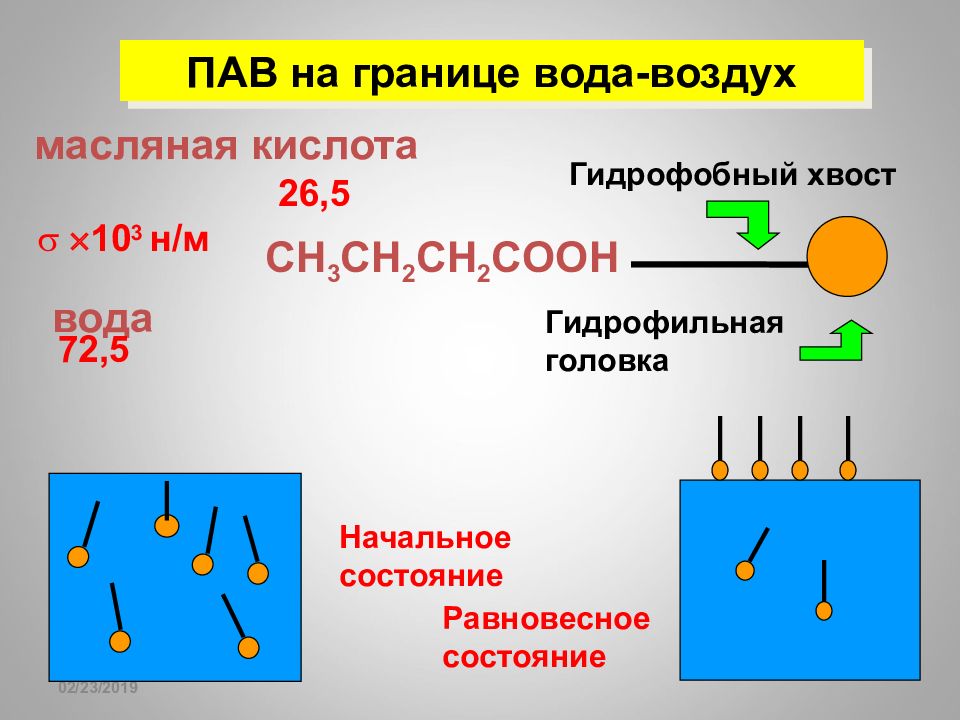
16.02.2019 ПАВ на границе вода-воздух вода 10 3 н / м 72,5 масляная кислота 26,5 Начальное состояние С H 3 CH 2 CH 2 COOH Гидрофобный хвост Гидрофильная головка Равновесное состояние
Слайд 176
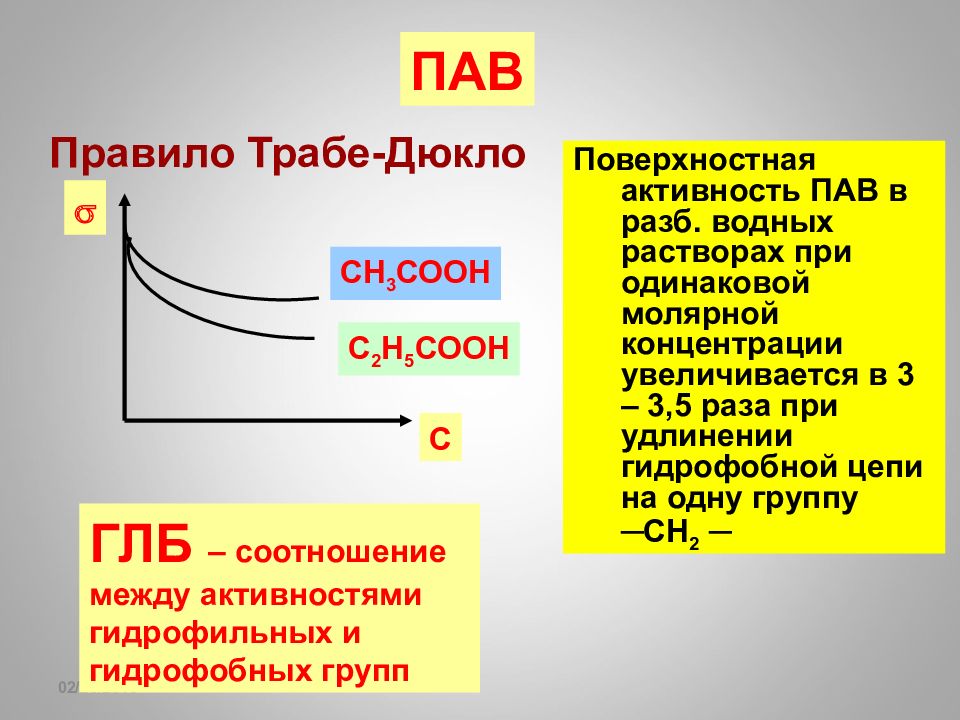
16.02.2019 ПАВ Правило Трабе-Дюкло Поверхностная активность ПАВ в разб. водных растворах при одинаковой молярной концентрации увеличивается в 3 – 3,5 раза при удлинении гидрофобной цепи на одну группу ─СН 2 ─ С С 2 Н 5 СООН СН 3 СООН ГЛБ – соотношение между активностями гидрофильных и гидрофобных групп
Слайд 177
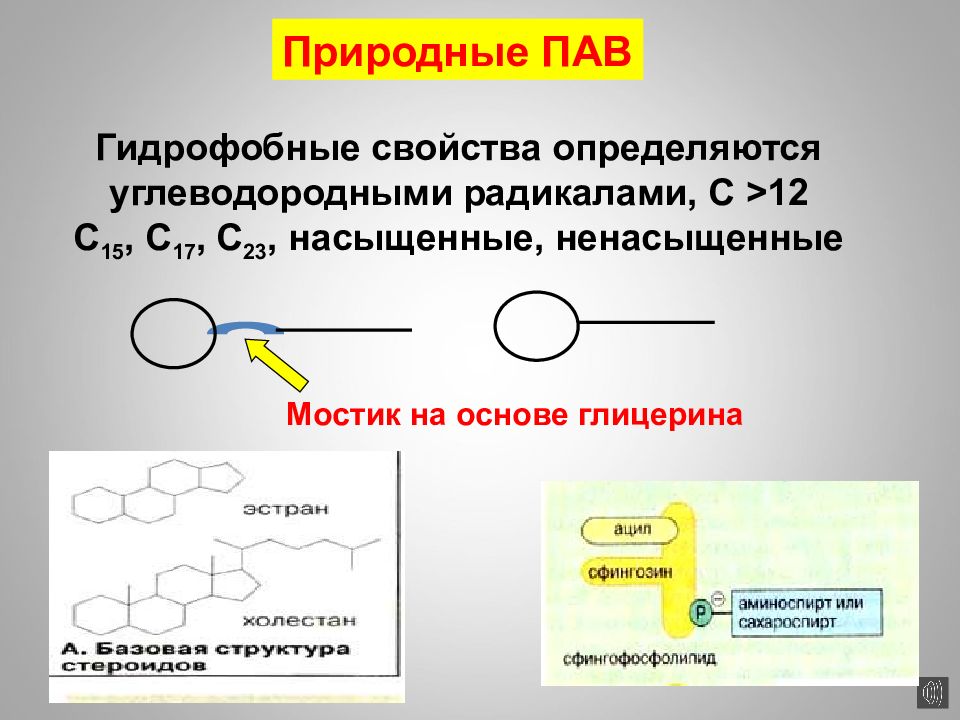
16.02.2019 Природные ПАВ Мостик на основе глицерина Гидрофобные свойства определяются углеводородными радикалами, С > 12 С 15, С 17, С 23, насыщенные, ненасыщенные
Слайд 179
16.02.2019 Применение ПАВ в медицине Моющие средства; дегазирующие средства; стабилизаторы лекарственных суспензий; эмульгаторы при стабилизации эмульсий для внутривенного применения; бактерицидные препараты (катионактивные ПАВ); смачиватели для улучшения растекания лекарственных форм;
Слайд 180: Колориметрия
16.02.2019 Колориметрия Колориметрия — метод количественного определения содержания веществ в растворах по интенсивности их окраски. В основе колориметрии лежит закон Бугера—Ламберта—Беера, согласно которому интенсивность окраски пропорциональна концентрации окрашенного вещества в растворе и толщине его слоя. Колориметрию можно производить визуальными и фотоэлектрическими способами при помощи колориметров (ФЭК).
Слайд 181: Колориметрия
16.02.2019 К визуальным способам колориметрии принадлежат: 1. определение при помощи стандартных серий (цветовой шкалы) 2. способ уравновешивания. При использовании стандартных серий сравнивают интенсивность окраски исследуемого раствора с окрасками стандартных растворов, соответствующих различным известным концентрациям испытуемого вещества. В колориметрах, используемых при способе уравновешивания, интенсивность света, проходящего через испытуемый и стандартный растворы, уравнивается изменением толщины слоя одного из растворов. Колориметрия
Слайд 182: Колориметрия
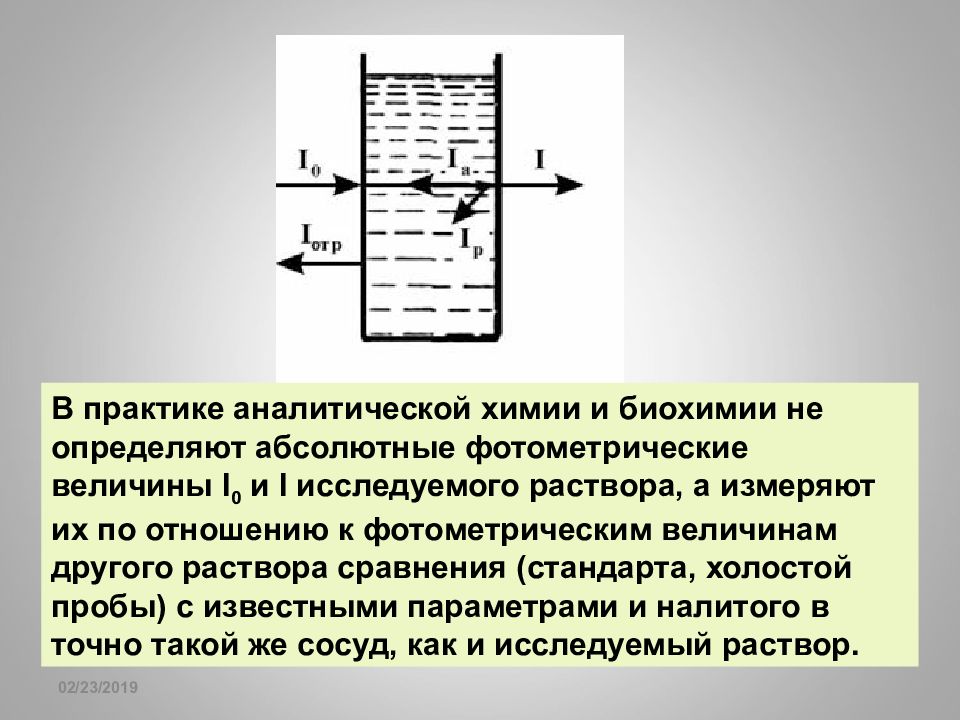
16.02.2019 Принцип фотоэлектрической колориметрии заключается в регистрации фотоэлементом интенсивности монохроматического света (выделенного светофильтром), прошедшего через окрашенный раствор. Колориметрия При прохождении белого света с интенсивностью I 0 через прозрачный стеклянный сосуд, заполненный раствором, происходит ослабление этого света. Выходящий свет будет иметь другую, меньшую, интенсивность I. Ослабление светового потока связано, в основном, с поглощением световой энергии I а раствором. Кроме того, имеет место отражение света I отр от границ раздела воздух-стекло, стекло-раствор. Также, в растворе происходит рассеяние света I р мельчайшими взвешенными частицами.
Слайд 183
16.02.2019 В практике аналитической химии и биохимии не определяют абсолютные фотометрические величины I 0 и I исследуемого раствора, а измеряют их по отношению к фотометрическим величинам другого раствора сравнения (стандарта, холостой пробы) с известными параметрами и налитого в точно такой же сосуд, как и исследуемый раствор.
Последний слайд презентации: 16.02.2019 Кафедра фундаментальной и клинической биохимии Тема: Фотоэлектроколориметрия
16.02.2019 Фотометрические исследования проводятся на фотометрах и спектрофотометрах, с помощью которых измеряют оптические плотности окрашенных растворов исследуемых веществ в спектральном диапазоне поглощения веществ. Фотоэлектроколориметрия Фотоколори́метр — оптический прибор, измерения концентрации веществ в растворах в котором, ведутся в луче полихроматического узко спектрального света, формируемого светофильтром. Применение различных светофильтров с узкими спектральными диапазонами пропускаемого света позволяет определять по отдельности концентрации разных компонентов одного и того же раствора. В отличие от спектрофотометра фотоколориметры просты, недороги и при этом обеспечивают точность, достаточную для многих применений.