Первый слайд презентации: Водно - солевой, минеральный обмен веществ у гидробионтов
Лекция 1
Слайд 2
Вода составляет основную массу организмов растений и животных; её относительное содержание в тканях колеблется в пределах 50-80%, а у ряда видов и значительно выше. Так, в теле медуз содержится около 95% воды, в тканях многих моллюсков – до 92. От количества воды и растворённых солей в значительной мере зависит внутриклеточный и межклеточный обмен, а у гидробионтов – и осмотические взаимоотношения с внешней средой. Газообмен у животных возможен только при наличии влажных поверхностей. У наземных организмов испарение влаги участвует в формировании теплового баланса со средой.
Слайд 3
Водный обмен организма со средой складывается из двух противоположных процессов: поступление воды в организм и отдача её во внешнюю среду. У высших растений этот процесс представлен всасыванием воды из почвы корневой системой, проведением её (вместе с растворёнными веществами) к отдельным органам и клеткам и выведением в процессе транспирации. В водном обмене около 5% воды используется для фотосинтеза, а остальное – на компенсацию испарения и поддержание тургора. Животные получают влагу в виде питья, и этот путь для многих форм, даже водных, оказывается необходимым. Выведение воды происходит с мочой и экскрементами, а также путём испарения.
Слайд 4
Водный обмен теснейшим образом связан с обменом солей. Определённый набор солей (ионов) представляет собой необходимое условие нормальных функций организма, так как соли входят в состав тканей, играя важную роль в обменных механизмах клеток. Изменение количества воды и солей влечёт за собой соответствующие сдвиги осмотических процессов и ионного равновесия. Водный и солевой аспекты обмена веществ связаны общими приспособлениями, поэтому обычно говорят об адаптациях водно-солевого обмена к условиям среды. Особо большое значение поддержание устойчивого водно-солевого обмена имеет для первичноводных организмов, у которых осмотические процессы осуществляются не только на суборганизменном уровне, но и с окружающей их водной средой, для которой солёность выступает как один из важнейших параметров.
Слайд 5
По степени солёности естественные водоёмы подразделяются на пресные с солёностью менее 0,5 ‰, солоноватоводные – солёность колеблется в пределах 0,5 - 16 солёные – больше 16 ‰. Солёность океанических водоёмов составляет 32-38 ‰ (в среднем 35 ‰), но самое высокое содержание солей характеризует не морские, а некоторые внутренние водоёмы типа солёных озёр, где концентрация электролитов доходит до 370 ‰.
Слайд 6
По характеру водно-солевого обмена гидробионты делятся на пресноводных и морских, хотя некоторые эвригалинные (приспособленные к широкому диапазону солевых концентраций) формы могут обитать и в тех, и в других условиях. Для всех первичноводных организмов характерно наличие проницаемых для воды покровов, поэтому различие осмотической концентрации водной среды и жидкостей организма создаёт осмотический ток воды в сторону большего осмотического давления. Результат осмотических процессов неодинаков для обитателей разных типов водоёмов.
Слайд 7
У большинства обитателей морских водоёмов концентрация солей в организме близка к таковой окружающей среды, а благодаря проницаемости покровов любые изменения солёности немедленно уравновешиваются осмотическим током воды. Такие организмы принято называть пойкилоосмотическими. Таковы практически все цианобактерии и низшие растения, а также большинство морских беспозвоночных животных; последних часто называют осмоконформерами.
Слайд 8
Существует небольшая группа изотоничных организмов (кишечно-полостные, иглокожие). Осмотическое давление жидкостей их тела близко к таковому морской воды и изменяется параллельно изменениям внешней солёности. У большинства других беспозвоночных регистрируется некоторое превышение осмотического давления внутренней среды организма (его гипертоничность), что обеспечивает постоянный приток в организм воды в пределах, легко уравновешивающихся процессами выделения.
Слайд 9
Способность изотоничных животных переносить некоторые изменения солёности среды определяются главным образом механизмами клеточной устойчивости к обводнению или дегидратации. Диапазон такой устойчивости обычно не очень велик, поэтому изоосмотические осмоконформеры распространены, как правило, в морских водоёмах с относительно устойчивой солёностью.
Слайд 10
Беспозвоночным осморегуляторам (высшие раки, моллюски, насекомые и др.) свойственно переносить более значительные колебания солёности. Это обеспечивается механизмами активной регуляции осмотического давления внутренней среды, которые включают изменения проницаемости мембран, активный перенос ионов (включая выведение избытка солей), а также изменения внутриклеточной концентрации свободных аминокислот в направлении, уравновешивающем суммарное осмотическое давление в клетке с внешней средой.
Слайд 11
У пойкилоосмотических организмов имеется возможность осуществления активной ионной регуляции, которая определяет отличия количественных показателей содержания отдельных ионов в среде и в организме. Это основа жизнедеятельности организмов-концентраторов, способных избирательно извлекать из среды и накапливать в организме отдельные соли. В отличие от осморегуляции ионная регуляция свойственна большинству живых организмов.
Слайд 12
Животных, способных к активной регуляции осмотического давления жидкостей тела, поддерживающих относительное постоянство этого параметра внутренней среды независимо от окружающей воды, называют гомойоосмотическими, или авторегуляторами.
Слайд 13
Пресноводные жизненные формы всегда гипертоничны, в силу чего внутрь организма направлен постоянный осмотический поток воды. Они относятся к гомойоосмотическим формам.
Слайд 14
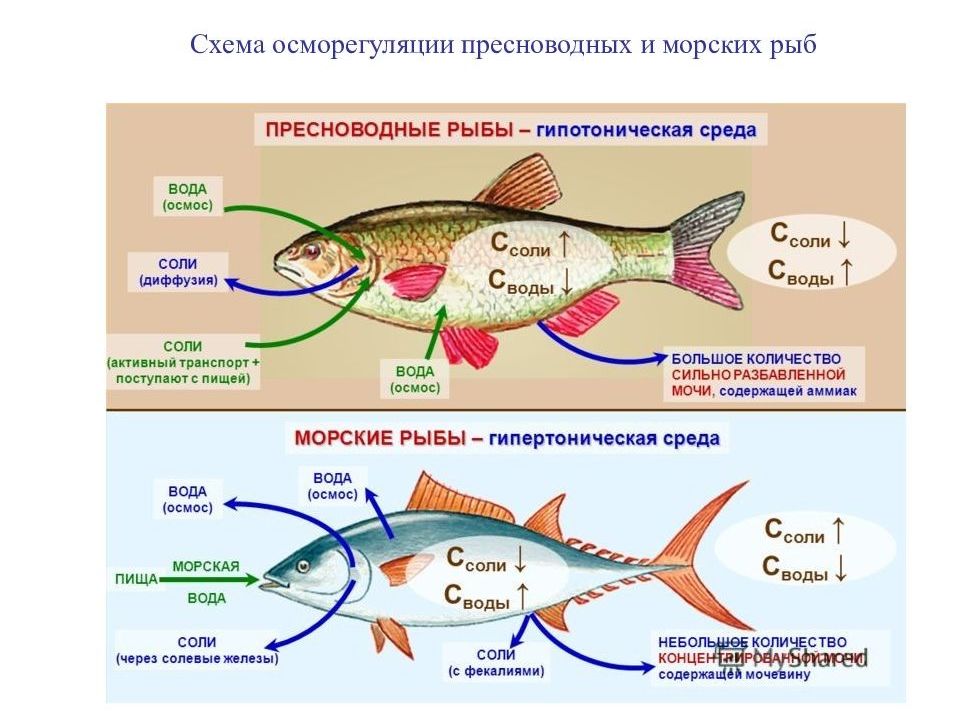
Наиболее эффективная адаптация позвоночных к обитанию в гипотонической среде – образование клубочковых почек, действие которых основано на принципах избирательной ультрафильтрации и реабсорбции. Продукты азотистого обмена – аммиак и мочевина – растворимы в воде и легко выводятся не только через почки, но и через жабры. Действие осморегуляторных механизмов может изменяться в зависимости от соотношения осмотических давлений водной среды и жидкостей организма. Это открыло водным позвоночным возможность освоения различных по солёности водоёмов.
Слайд 15
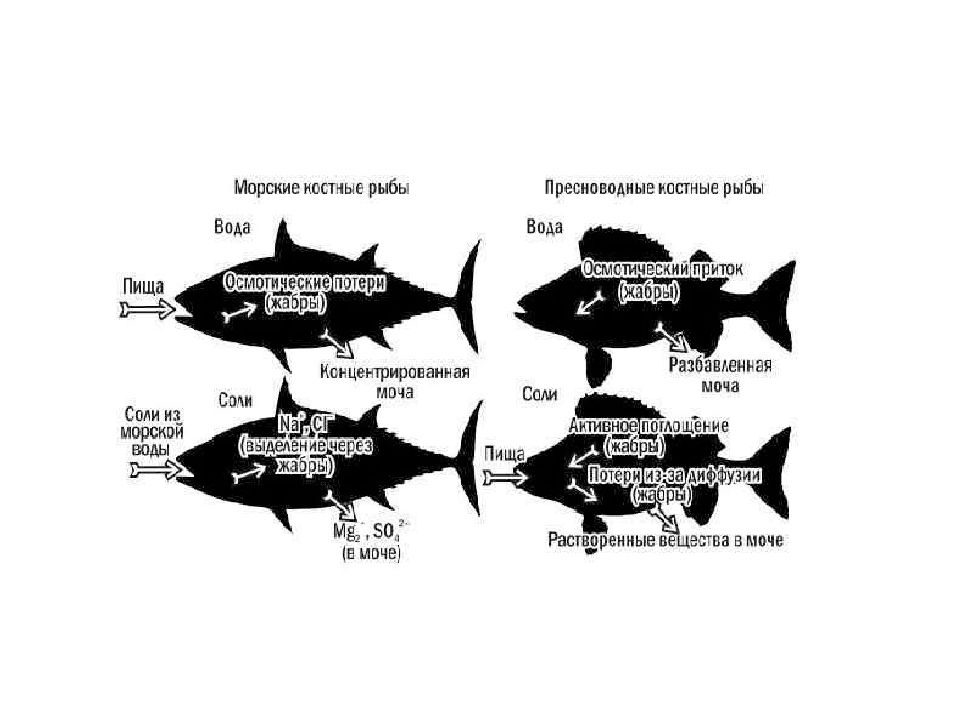
Морские формы существуют в условиях гипертоничности внешней среды, обусловливающей постоянные осмотические потери воды (в основном через жабры). Пополнение потерь воды у них происходит путём питья. Избыток получаемых при этом солей выводится через почки и с фекалиями (главным образом двухвалентные ионы), а также активно экскретируются особыми клетками жаберного эпителия (преимущественно Na+ и C1-).
Слайд 16
Замечательным примером широкой приспособляемости к солевому режиму служат проходные формы некоторых круглоротых (миноги) и рыб. При миграциях из моря в реки механизм осморегуляции у них полярно преобразуется (смена гипо- и гипертонического состояния организма), что основано на пресноводном типе строения почек у всех водных позвоночных.
Гидробионт – морские и пресноводные организмы, постоянно обитающие в водной среде. Диссимиляция – процесс расщепления в живом организме органических веществ на более простые соединения. Ему сопутствует ассимиляция – процесс усвоения органических веществ, поступающих в организм. Осмотическое давление – избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя сквозь мембрану с избирательной проницаемостью. Осмос - процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя). Ионы – соли. Реабсорбция – процесс обратного всасывания в кровь солей, сахаров и ряда других нужных организму веществ (происходит в почках).
Слайд 18: Осморегуляция в море. Костные рыбы
Задачи осморегуляции в морской воде прямо противоположны пресноводному типу: в море осмотическое давление внутренней среды организма несколько ниже, чем морской воды, и в силу этого организм постоянно обезвоживается. В результате фильтрационная функция почек, направленная на усиленное выведение воды, у морских рыб ослаблена.
Слайд 19
Снижение уровня почечной фильтрации все же не компенсирует потери воды, поэтому морские рыбы регулярно пьют воду, получая при этом избыточное количество солей. Соответственно изменившимся задачам осморегуляции реабсорбция ионов в почечных канальцах морских косных рыб резко снижена, зато здесь происходит интенсивное обратное всасывание воды из первичной мочи. Интенсивно всасывается вода и в мочевом пузыре костистых рыб, стенки которого обладают высокой осмотической проницаемостью. Избыток солей помимо почек выводится через кишечник: здесь происходит интенсивное всасывание воды, в то время как соли концентрируются и выводятся с фекалиями.
Слайд 20
Существенную роль в выведении избытка солей играют жабры. Если двухвалентные ионы в значительном количестве выводятся через почки и пищеварительный тракт, то одновалентные экскретируются почти исключительно через жабры, выполняющие у рыб двойную функцию – дыхания и выделения. В целом схему осморегуляции морских костистых рыб можно представить следующим образом. Гипертоничность внешней среды обуславливает постоянные осмотические потери воды (в основном через жабры), которые восполняются путем питья. Избыток получаемых при этом солей выводится через почки и с фекалиями, а также активно экскретируется через жабры.
Слайд 21: Осморегуляция в море. Хрящевые рыбы
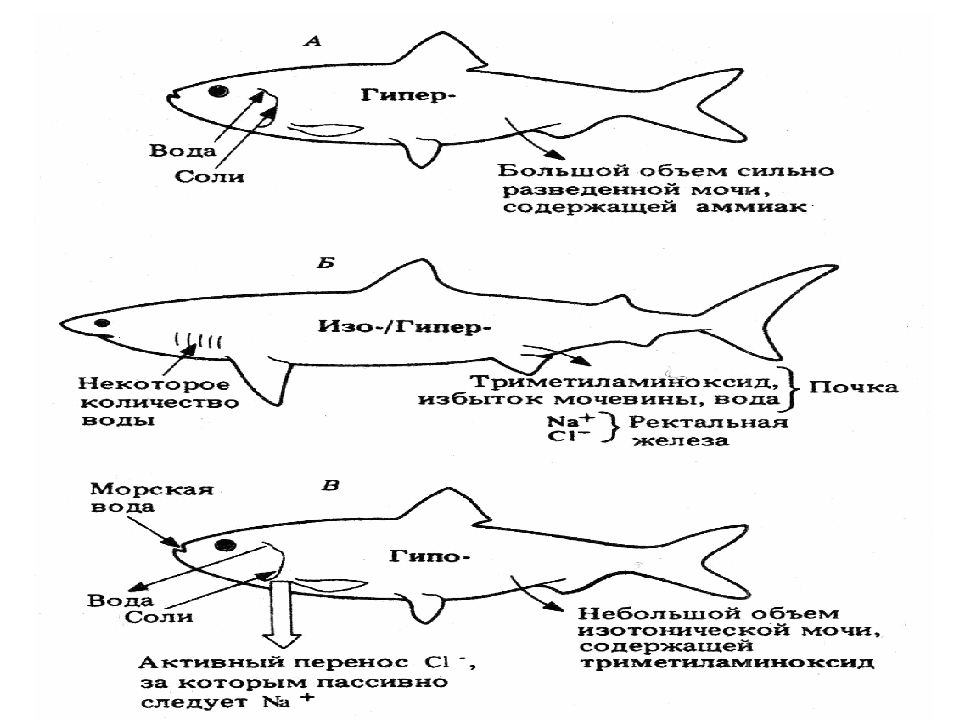
Приспособление к обитанию в морской среде у хрящевых рыб основано на других принципах. Концентрация солей в их крови сходна с таковой у костистых рыб и ниже, чем в морской воде. Однако осмотическое давление жидкостей тела у этих рыб практически равно осмотическому давлению морской воды, слегка даже превышая его. Достигается это тем, что в почках хрящевых рыб идет активная реабсорбция мочевины; практически вся она возвращается из первичной мочи в кровь, повышая ее суммарное осмотическое давление. Проницаемость жабр для мочевины у этих рыб в отличие от костистых понижена, и избыток мочевины выводится практически только через почки.
Слайд 22
Помимо мочевины в крови хрящевых рыб накапливается триметиламиноксид, также обладающий высокой осмотической активностью. Таким образом, сохраняя концентрацию биологически важных солей неизменной, хрящевые рыбы по суммарному осмотическому давлению внутренней среды почти не отличаются от морской воды; оно меняется соответственно изменениям внешней солености. Хрящевых рыб называют метизотоническими животными. На снижение солености среды хрящевые рыбы реагируют уменьшением реабсорбции мочевины и усилением выведения ее с мочой. Благодаря этим регуляторным процессам акуловые рыбы выдерживают большие колебания солености среды, появляясь даже в пресных водах. Поскольку внутренняя среда хрящевых рыб слегка гипертонична по отношению к морской воде, происходит умеренный осмотический приток воды в организм, который обеспечивает потребности мочеобразования. Поэтому в отличие от костистых рыб акуловые не пьют морскую воду и не получают с ней дополнительной солевой нагрузки.
Слайд 27: Белки
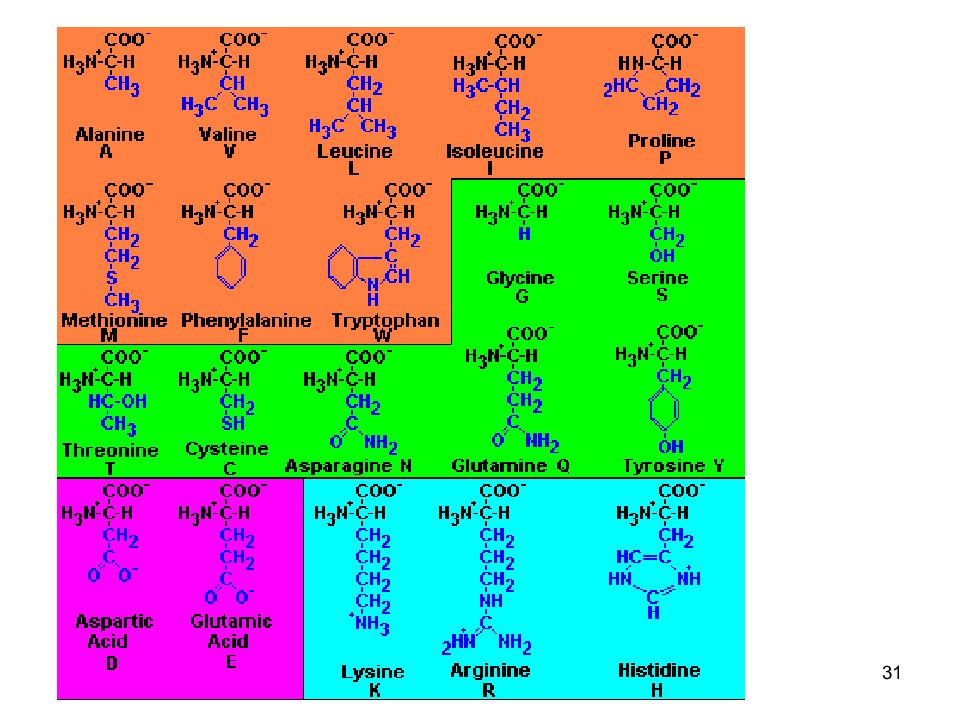
27 Белки полимерные молекулы, мономеры - аминокислоты. В составе белков в организме человека встречают 20 α-аминокислот. Индивидуальность белковых молекул - порядок чередования аминокислот в белке. Аминокислоты - буквы алфавита, ими, как в слове, записывается информация. От последовательности аминокислот зависит пространственная структура и функции белка.
Слайд 28: Общие структурные особенности аминокислот, входящих в состав белков
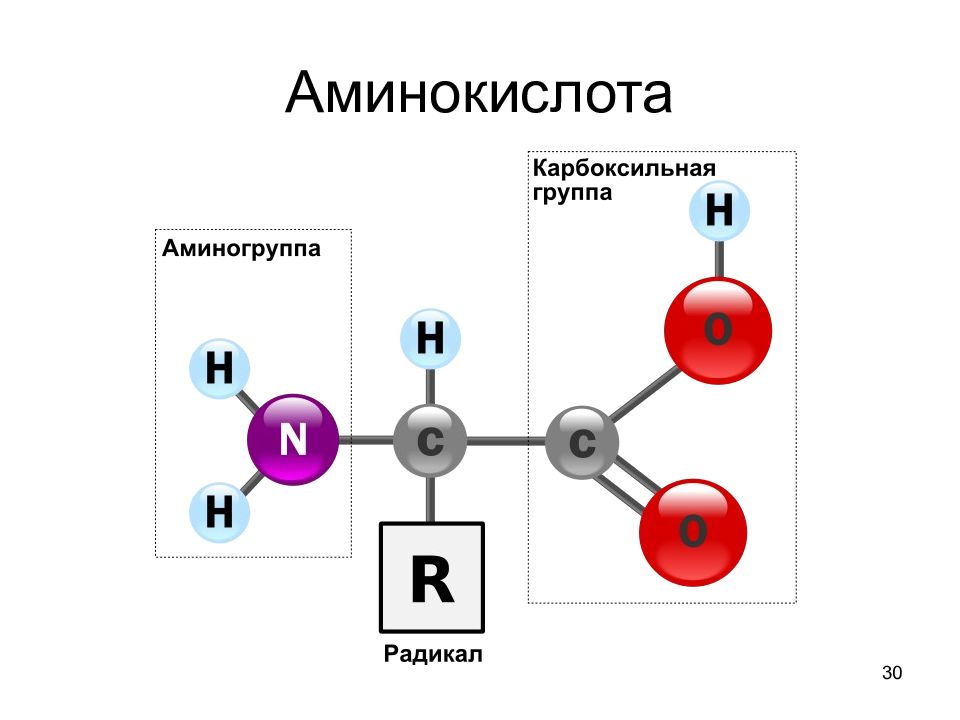
28 Общие структурные особенности аминокислот, входящих в состав белков наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
Слайд 29
29 В водных растворах при нейтральном значении рН α- аминокислоты существуют в виде биполярных ионов. в природе а/к -в двух изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Слайд 32: Классификация аминокислот
32 Классификация аминокислот По радикалу Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозин Полярные заряженные отрицательно при pH<7: аспарагиновая к-та, глутаминовая к-та Полярные заряженные положительно при pH>7: лизин, аргинин, гистидин
Слайд 33: Классификация аминокислот
33 Классификация аминокислот По функциональным группам (радикалам) Ароматические: фенилаланин, тирозин, триптофан Гетероциклические: гистидин, пролин Серосодержащие: цистеин, метионин Нециклические: все остальные
Слайд 34: Классификация аминокислот
34 Классификация аминокислот Незаменимые валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан, аргинин, гистидин. Заменимые глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Слайд 35: Пептидная связь
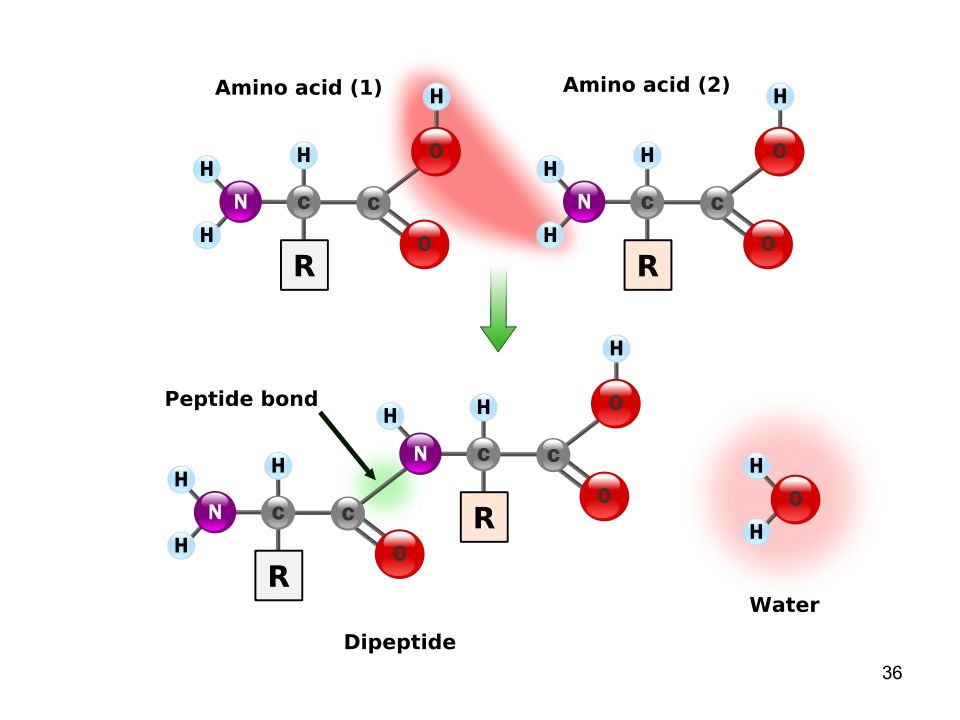
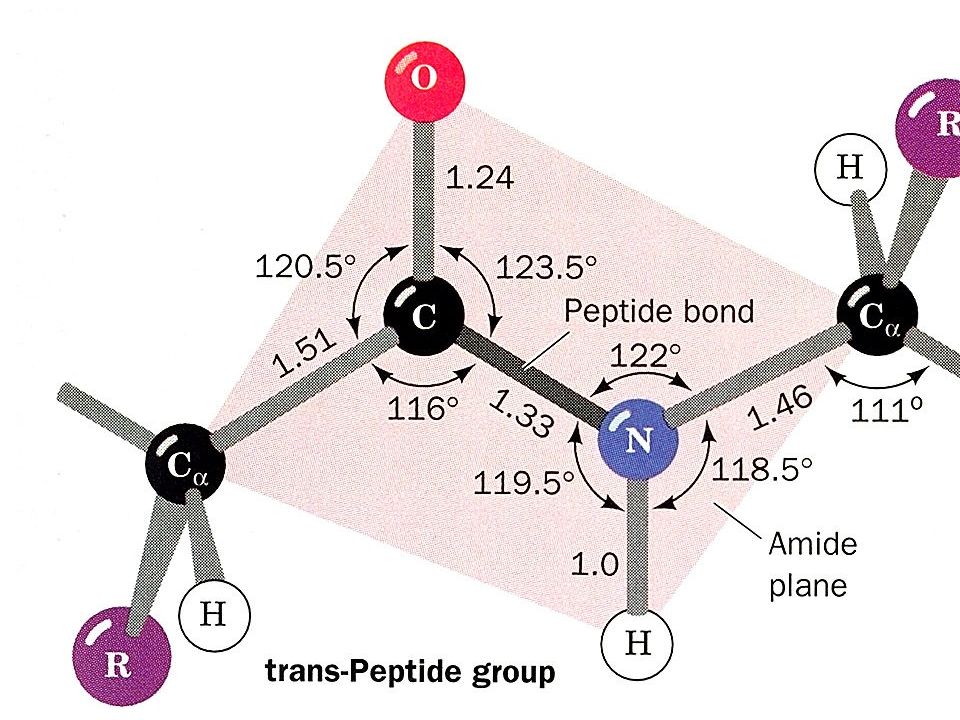
35 Пептидная связь α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между а-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью. отщепление молекулы воды
Слайд 37: Пептиды
37 Пептиды Пептиды до 10 аминокислот - олигопептиды по количеству аминокислот: трипептид, пентапептид, октапептид Пептиды, содержащие более 10 аминокислот – полипептиды Полипептиды, из более 50 аминокислотных остатков – белки, хотя глюкагон, состоящий из 29 аминокислот, называют белковым гормоном
Слайд 39: СТРУКТУРА БЕЛКА
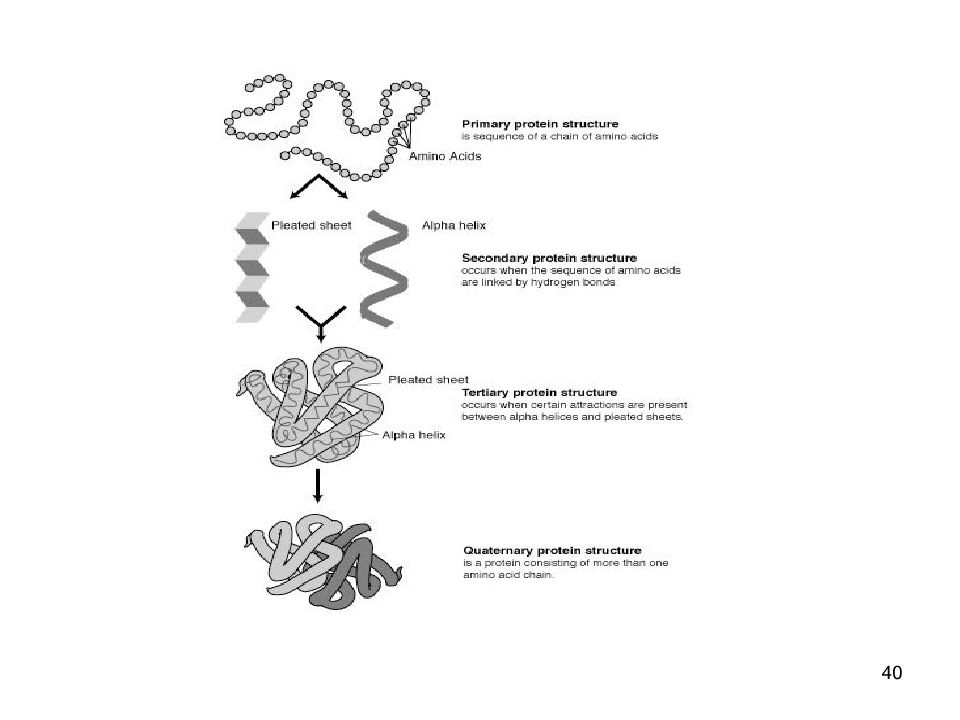
39 СТРУКТУРА БЕЛКА Пептидные цепи содержат а/к остатки, соединены пептидными связями. (прочные, разрыв - фермент) Белок имеет определённую пространственную структуру, она определяет функции белка. Различают 4 уровня структурной организации белков
Слайд 41: Первичная структура белка
41 Первичная структура белка линейная последовательность а/к в полипептидной цепи первичная структура каждого белка закодирована в одном гене
Слайд 42: Вторичная структура белка
42 Вторичная структура белка Линейные цепи а\к приобретают пространственную трёхмерную структуру - "конформацию". образуется за счёт взаимодействия функциональных групп аминокислот обусловлена первичной структурой белка.
Слайд 43: Вторичная структура белка
43 Вторичная структура белка регулярные структуры двух типов: α-спираль и β-структура.
Слайд 44: α- Спираль
44 α- Спираль пептид закручивается в виде спирали водородных связи образуются между атомами кислорода карбонильных групп и атомами азота аминогрупп через 4 аминокислотных остатка Водородные связи ориентированы вдоль оси спирали На один виток α-спирали приходится 3,6 аминокислотных остатка.
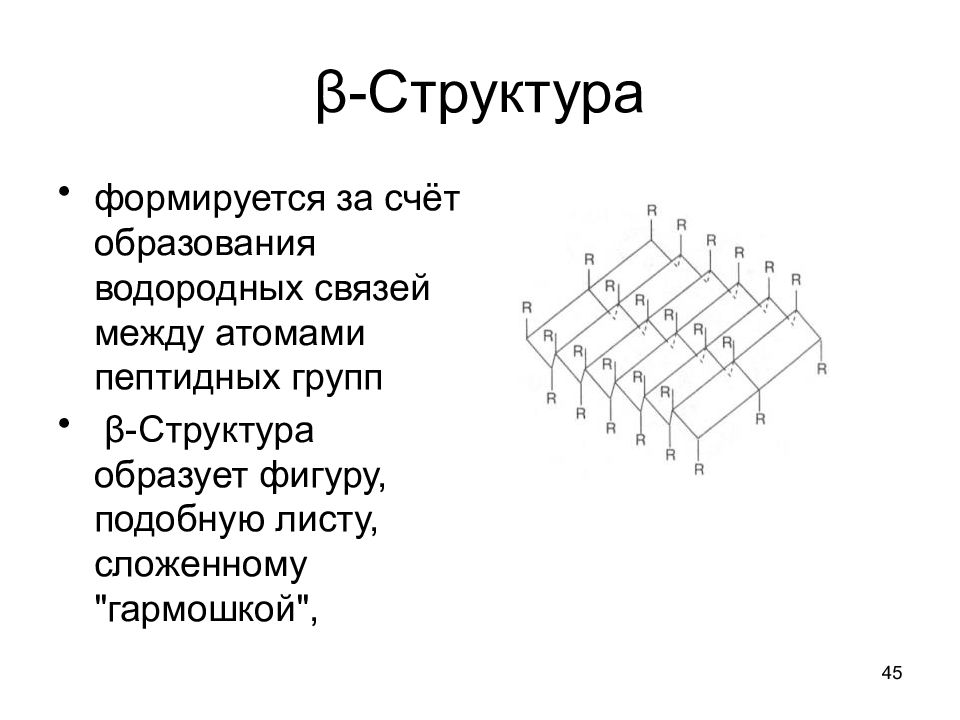
Слайд 45: β-Структура
45 β-Структура формируется за счёт образования водородных связей между атомами пептидных групп β-Структура образует фигуру, подобную листу, сложенному "гармошкой",
Слайд 47: Третичная структура белков
47 Третичная структура белков трёхмерная пространственная структура образуетсяза счёт взаимодействий между радикалами аминокислот, стоящих на значительном расстоянии друг от друга в цепи функционально активная конформация - "нативная структура".
Слайд 48: Доменная структура белков
48 Доменная структура белков Если полипептидная цепь белка содержит более 200 аминокислот, как правило, её пространственная структура сформирована в виде двух или более доменов. Домен - участок полипептидной цепи, который в процессе формирования пространственной структуры приобрёл независимо от других участков той же цепи конформацию глобулярного белка.
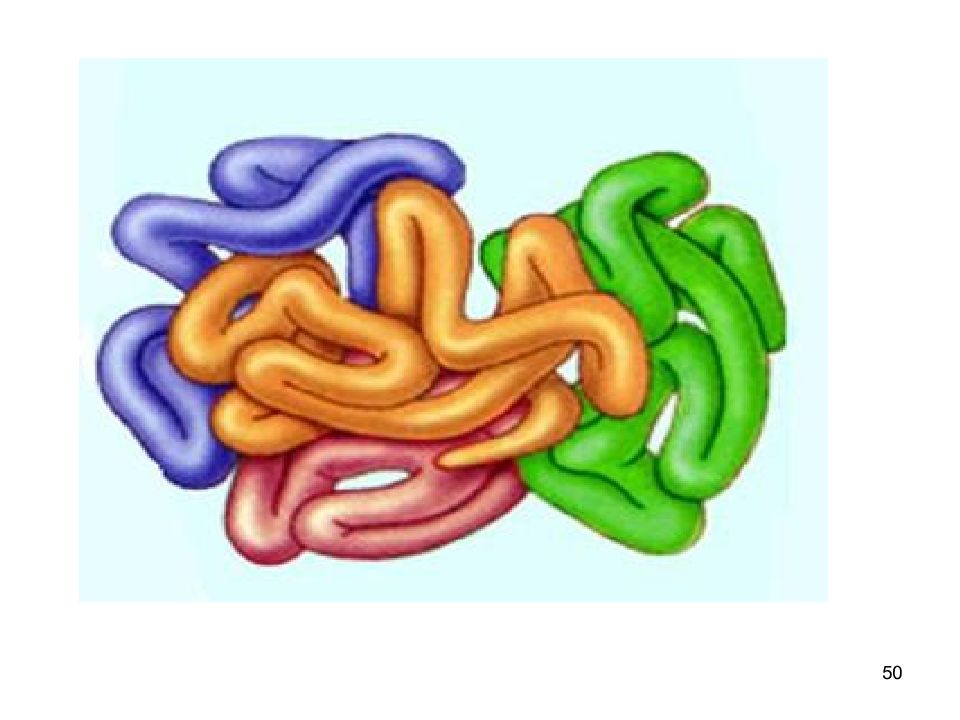
Слайд 49: Четвертичная структура белков
49 Четвертичная структура белков существуют белки, состоящие из двух и более полипептидных цепей после формирования трёхмерной структуры каждой полипептидной цепи они объединяются связи, соединяющие полипептидные цепи: гидрофобные, ионные, водородные отдельные полипептидные цепи - субъединицы
Слайд 51: Функции белков в организме
51 Функции белков в организме Каталитическая функция Структурная функция Защитная функция Регуляторная функция Сигнальная функция Транспортная функция Запасная (резервная) функция белков Рецепторная функция Моторная (двигательная) функция
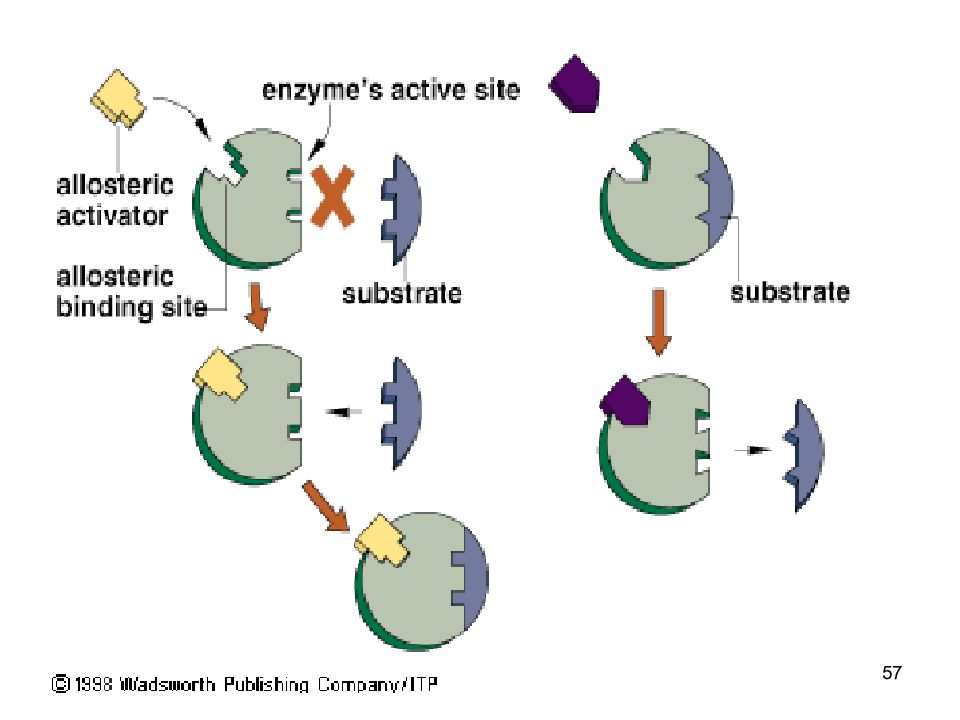
Слайд 52: Каталитическая функция
52 Каталитическая функция Ферменты (энзимы) – белки - увеличивают скорость протекания химической реакции, при этом не расходуются биологическая функция фермента обусловлена наличием в его структуре активного центра (АЦ) в АЦ фермента есть участки связывания субстрата, и участки химического превращения субстрата ( каталитический участок ).
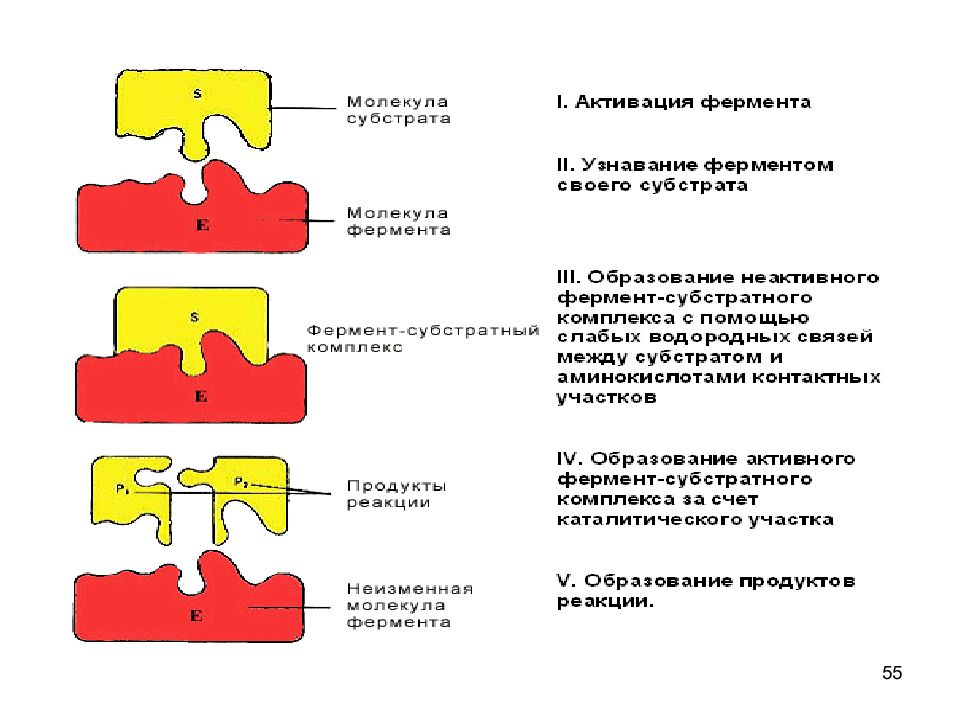
Слайд 53: Фермент-субстратные реакции
53 Фермент-субстратные реакции В участке связывания субстрат связывается с ферментом - фермент-субстратный комплекс. В каталитическом участке субстрат превращается в продукт продукт отщепляется от активного центра фермента.
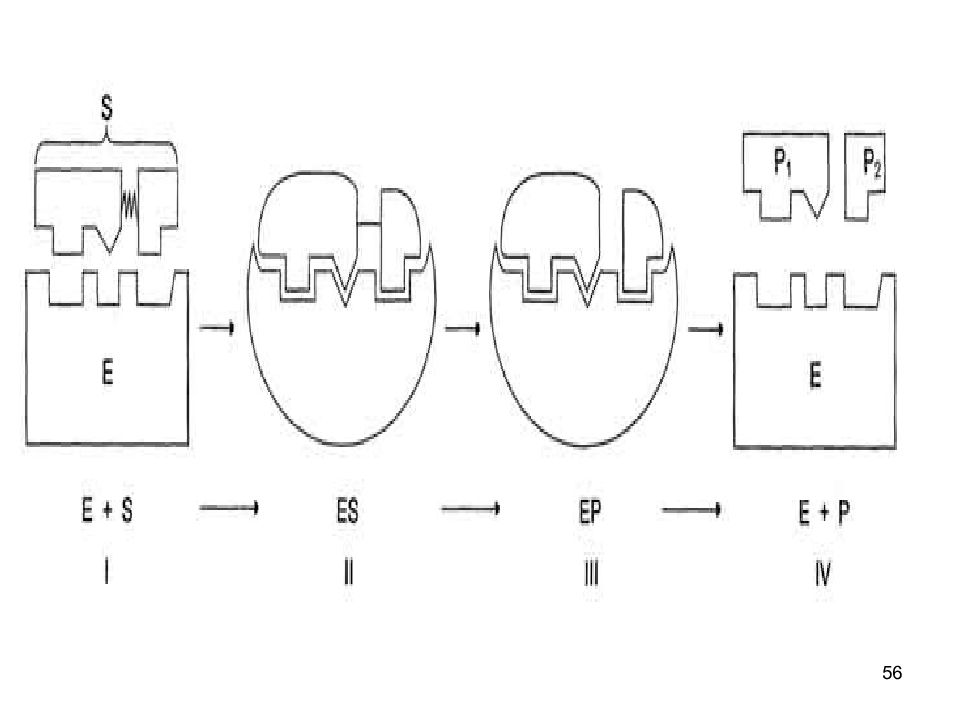
Слайд 54: Катализ
54 Катализ Схематично процесс катализа можно представить следующим уравнением : Е + S ↔ ES ↔ ЕР ↔ Е + Р, где Е - фермент (энзим), S - субстрат, Р - продукт.
Слайд 58: Специфичность
58 Специфичность наиболее важное свойство ферментов. субстратная сп.- способность фермента взаимодействовать лишь с одним или несколькими определёнными субстратами.
Слайд 59: Специфичность
59 Специфичность Выделяют абсолютную субстратную специфичность (катализ 1 субстрата) - аргиназа; групповую субстратную специфичность однотипные реакции с группой структурно похожих субстратов - панкреатическая липаза ; стереоспецифичность специфичность ферментов к стереоизомерам (L-аминокислотам )
Слайд 60: Каталитическая специфичность
60 Каталитическая специфичность Фермент превращает субстрат по одному из возможных путей его превращения Зависит от строения каталитического участка активного центра фермента глюкозо-6-фосфат в клетках печени человека - субстрат 4 различных ферментов; фосфоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы
Слайд 63: ОБМЕН И ФУНКЦИИ АМИНОКИСЛОТ
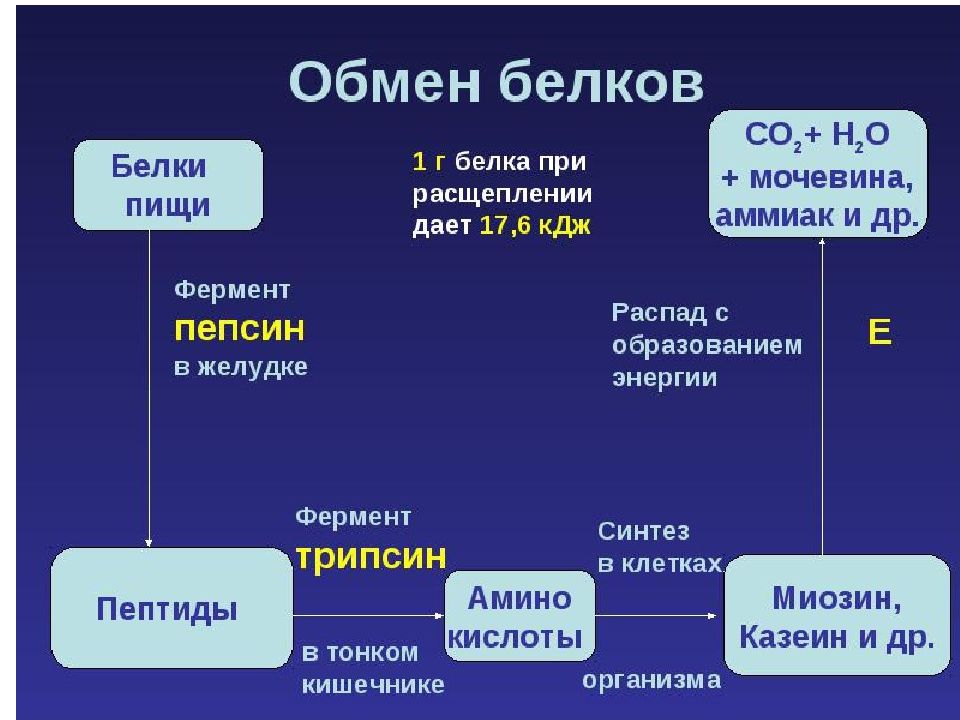
Значение аминокислот для организма в первую очередь определяется тем, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Объясняется это тем, что белки входят во все основные структурные компоненты клеток, тканей и органов тела человека и животных, выполняют ферментативные функции, участвуют в переносе веществ через мембраны и т.д. Важную роль в координации работы всех систем клеток играют белковые гормоны.
Слайд 64
Аминокислоты непосредственно участвуют в биосинтезе не только белков, но и большого количества других биологически активных соединений, регулирующих процессы обмена веществ в организме, таких как нейромедиаторы и гормоны - производные аминокислот. Аминокислоты служат донорами азота при синтезе всех азотсодержащих небелковых соединений, в том числе нуклео-тидов, тема, креатина, холина и других веществ.
Слайд 65
Катаболизм аминокислот может служить источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет и др.) и преимущественно белковом питании. Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме.
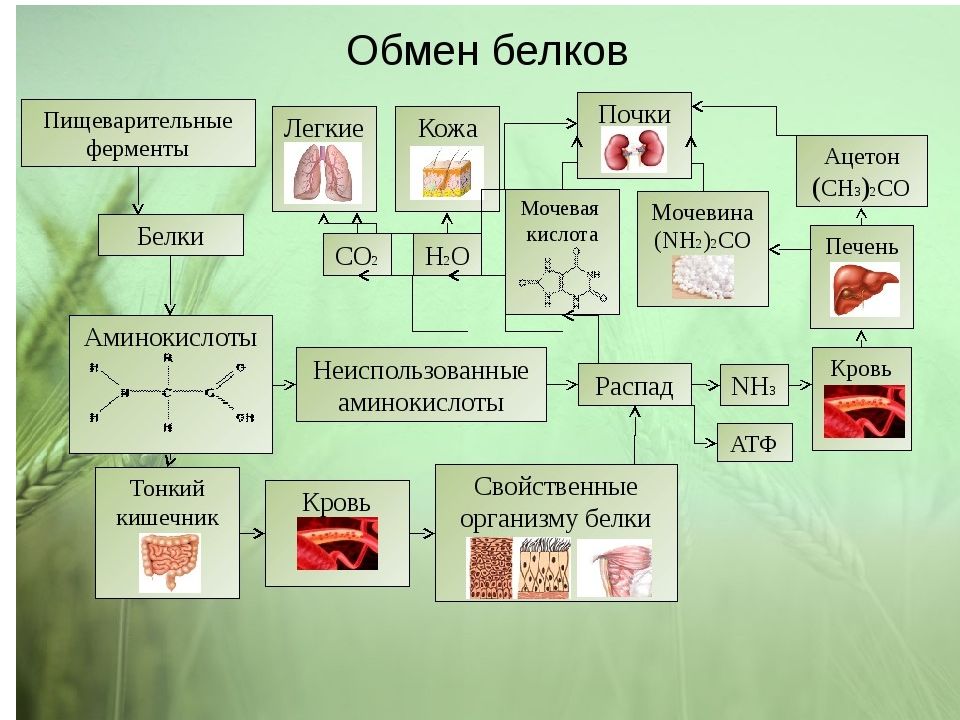
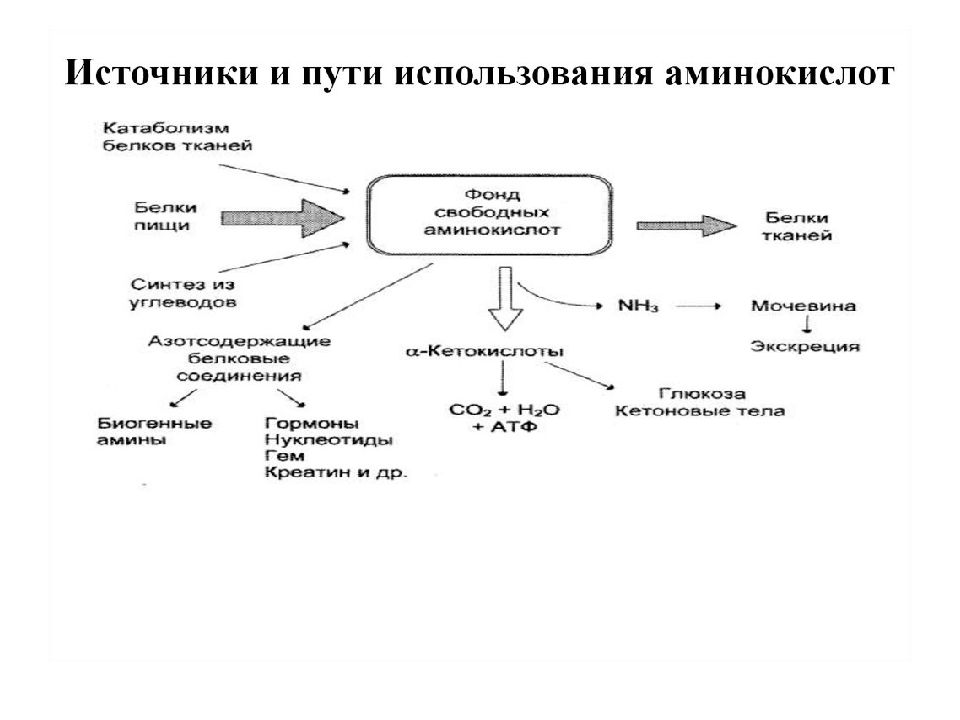
Слайд 67
Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Многие клетки, за исключением высокоспециализированных (например, эритроцитов), используют аминокислоты для синтеза белков, а также большого количества других веществ: фосфолипидов мембран, гема, пуриновых и пиримидиновых нуклеотидов, биогенных аминов (катехоламинов, гистамина) и других соединений
Слайд 68
Какой-либо специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде триацилглицеролов), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных.
Слайд 69
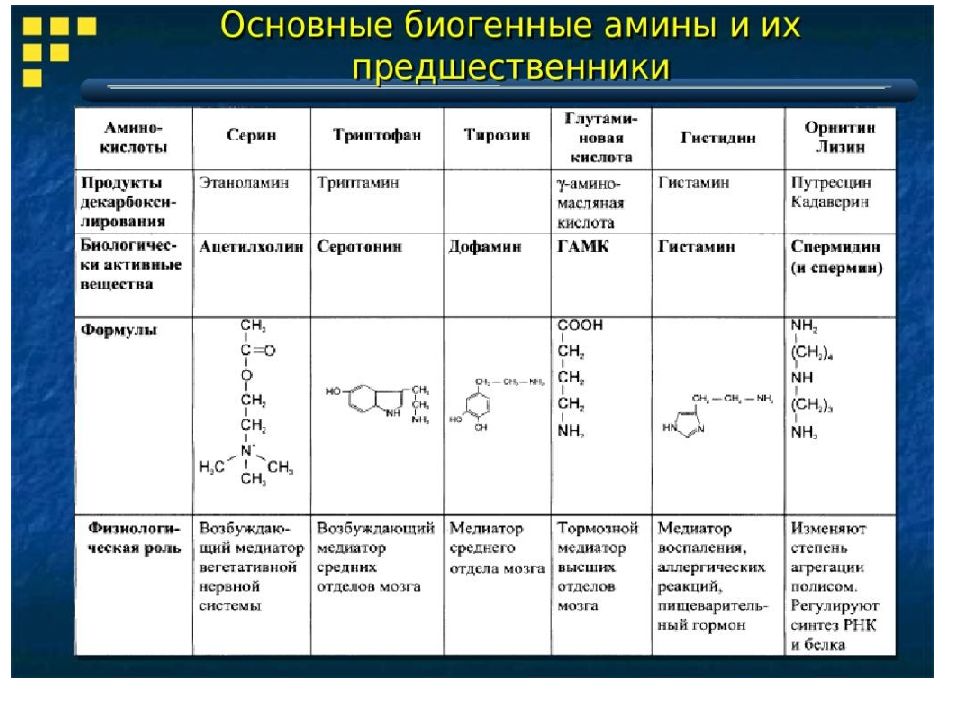
Большую роль в организме играют непептидные азотсодержащие соединения - производные аминокислот. К ним можно отнести гормоны надпочечников (норадреналин, адреналин), щитовидной железы (тироксин, трийодтиронин), а также медиаторы ЦНС (ацетилхолин, ГАМК и др.), медиатор воспаления (гистамин) и другие соединения.
Слайд 71: Воздействие токсикантов на белковый обмен
Имеются указания нa изменения содержания сывороточных и тканевых белков у рыб и под влиянием других токсических веществ, в частности хлорорганических пестицидов, четыреххлористого углерода, хлорофоса и др. Хотя мышечные белки по фракционному составу и количественному содержанию более стабильны, чем сывороточные белки, но и они претерпевают изменения под влиянием различных токсических веществ. Некоторые тяжелые металлы, например, такие как медь, хром, олово, кадмий, снижают содержание растворимых мышечных белков у рыб. Снижается оно и под влиянием нефтяного загрязнения. Вообще токсическое действие тяжелых металлов и нефтепродуктов проявляется в изменении содержания не только мышечных, но и сывороточных белков рыб. Воздействие на рыб ртути и свинца, например, вызывает снижение концентрации общего сывороточного белка и альбуминов, но приводит к увеличению концентрации глобулинов.
Слайд 72
Таким образом, изменение скорости и интенсивности биосинтеза белка – один из реальных механизмов воздействия токсических веществ на обмен веществ рыб, а изменение концентрации общего сывороточного или тканевого белка – хороший биохимический показатель как острого, так и хронического отравления рыб. Другим важнейшим биохимическим показателем токсического действий различных групп веществ на белковый обмен может служить уровень содержаняи аммиака в крови и тканях, прежде всего в мозговой ткани.
Слайд 73
рыбы (наряду с ракообразными) относятся к группе аммониотелических животных, у которых конечным продуктом катаболизма белков и аминокислот является аммиак: Аммиак и его водный раствор аммоний высокотоксичны. В нормальных условиях образующийся в различных тканях аммиак детоксицируется с помощью глютаминовой кислоты. Взаимодействие аммиака и глютаминовой кислоты ведет к образованию глютамина, который поступает в печень, где от него отщепляется аммиак. Нарушение этих тонко сбалансированных процессов образования и детоксикация аммиака в центральной нервной системе приводит к развитию двигательного возбуждения и судорожного состояния.
Слайд 74
Динамика изменения количества аммиака в мозге у карасей по ходу развития фенольной интоксикации показала серьезные сдвиги в белковом обмене организма, обусловленные воздействием фенола на центральную нервную систему рыб. Опытным путем доказано, что в головном мозге рыб происходит резкое повышение концентрации аммиака во время двигательного возбуждения и судорог, характерных для фенольной интоксикации. Иными словами, биохимические изменения в головном мозге рыб во время сильнейшего двигательного возбуждения аналогичны имеющим место у теплокровных животных. Сходство биохимических изменений в головном мозге рыб и теплокровных, проявляющееся в увеличении содержания высокотоксичного аммиака, является следствием нарушения детоксикации аммиака у рыб в системе дикарбоновые кислоты – аммиак – глютамин.
Последний слайд презентации: Водно - солевой, минеральный обмен веществ у гидробионтов
Анализ данных по изменению количества свободных и связанных аминокислот в различных органах и тканях рыб под влиянием токсикантов, позволяет сделать следующие выводы: в процессе интоксикации рыб суммарное содержание свободных аминокислот увеличивается в крови, печени, головном мозге, кишечнике и мышцах, причем, в мышцах эти изменения менее выражены и подчас более разнонаправлены, чем в других органах. Колебания аминокислотного состава органов и тканей отравленных рыб могут вызываться разными причинами, в том числе угнетением синтеза белка, нарушением трансаминирования, дезаминирования и декарбоксилирования, и, наконец, усилением распада белков, ведущего к увеличению суммарного содержания свободных аминокислот.