Первый слайд презентации: Лекция № 15 Аминокислоты, белки
«Жизнь есть форма существования белковых тел» Фридрих Энгельс Белки – наиболее распространенные биополимеры, состоящие из аминокислот.
Слайд 2
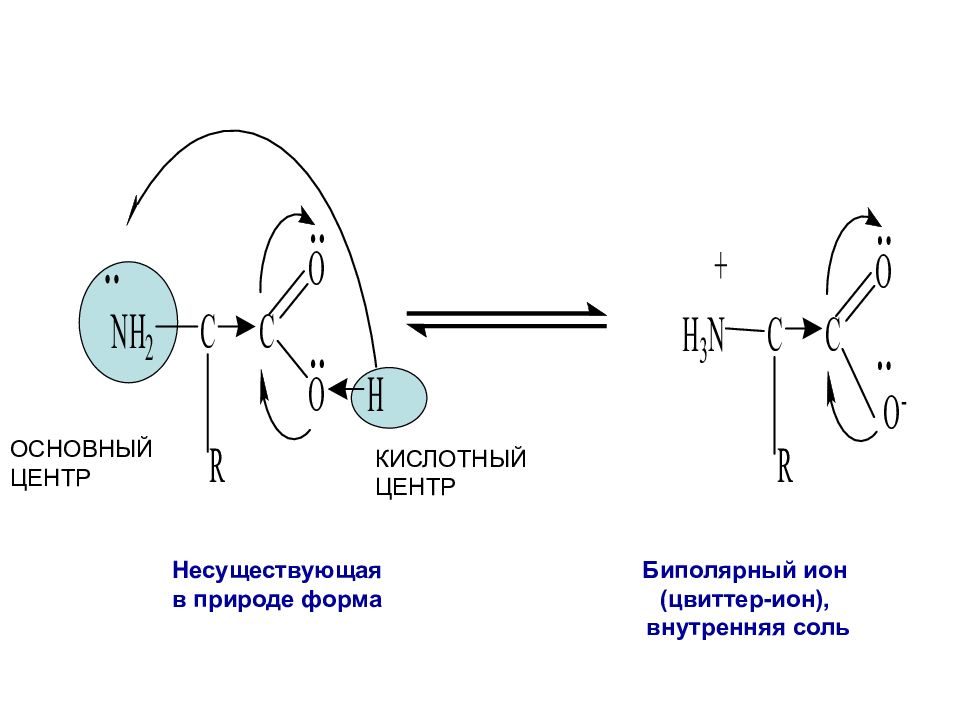
Аминокислоты — бифункциональные соединения, в молекуле которых одновременно содержатся карбоксильные и амино- группы.
Слайд 3
Несуществующая в природе форма Биполярный ион (цвиттер-ион), внутренняя соль ОСНОВНЫЙ ЦЕНТР КИСЛОТНЫЙ ЦЕНТР
Слайд 4
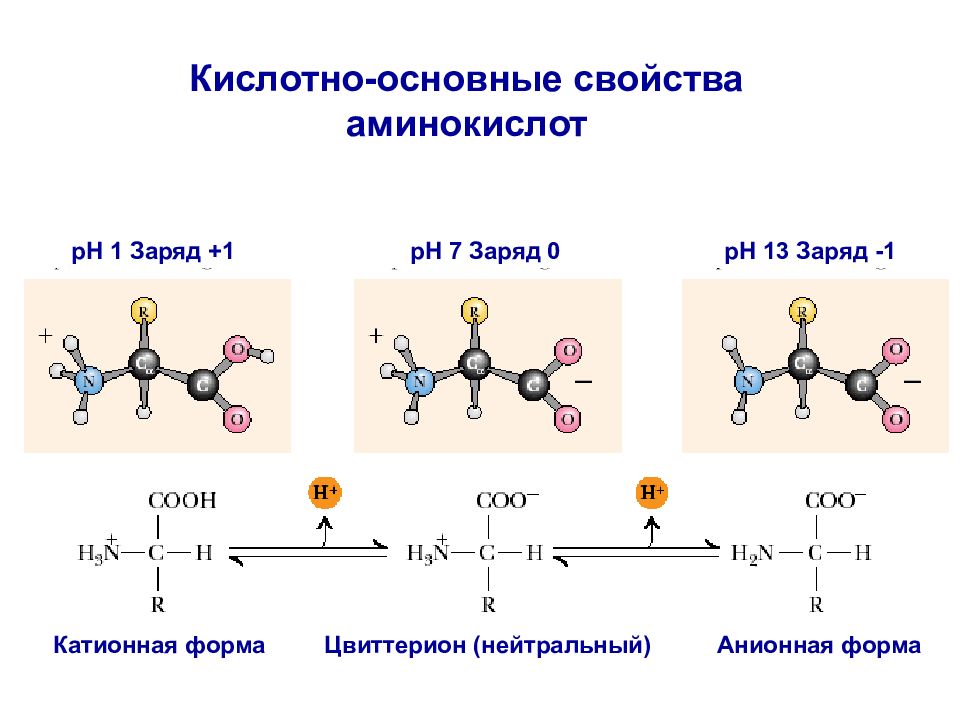
pH 1 Заряд +1 pH 7 Заряд 0 pH 13 Заряд -1 Цвиттерион (нейтральный) Анионная форма Катионная форма Кислотно-основные свойства аминокислот
Слайд 5: Кислотно-основные взаимодействия
А-Н + : В ↔ А - + В-Н кислота основание сопряженное сопряженная основание кислота По теории Бренстеда-Лоури Кислоты - доноры протонов, основания- акцепторы протонов +
Слайд 6
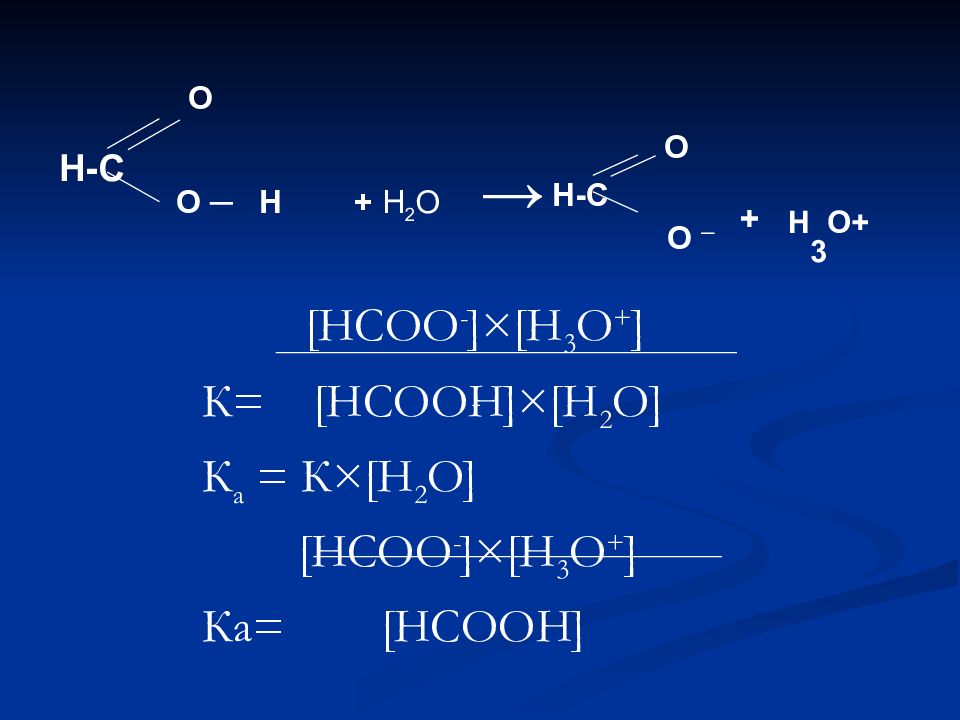
[ НСОО - ]×[ Н 3 О + ] К= [ НСООН ]×[ Н 2 О ] К а = К ×[ Н 2 О ] [ НСОО - ]×[ Н 3 О + ] К a = [ НСООН ] Н-С О О ─ Н + Н 2 О → Н-С О О ─ + Н 3 О+
Слайд 7: Чем ниже кислотность, тем выше рК а
К а = 1,75 × 10 -5 рК а = - lg К а = 4,75 К а 1,0 × 10 -5 1,0 × 10 -10 1,0 × 10 -20 1,0 × 10 -40 рК а 5 10 20 40
Слайд 8
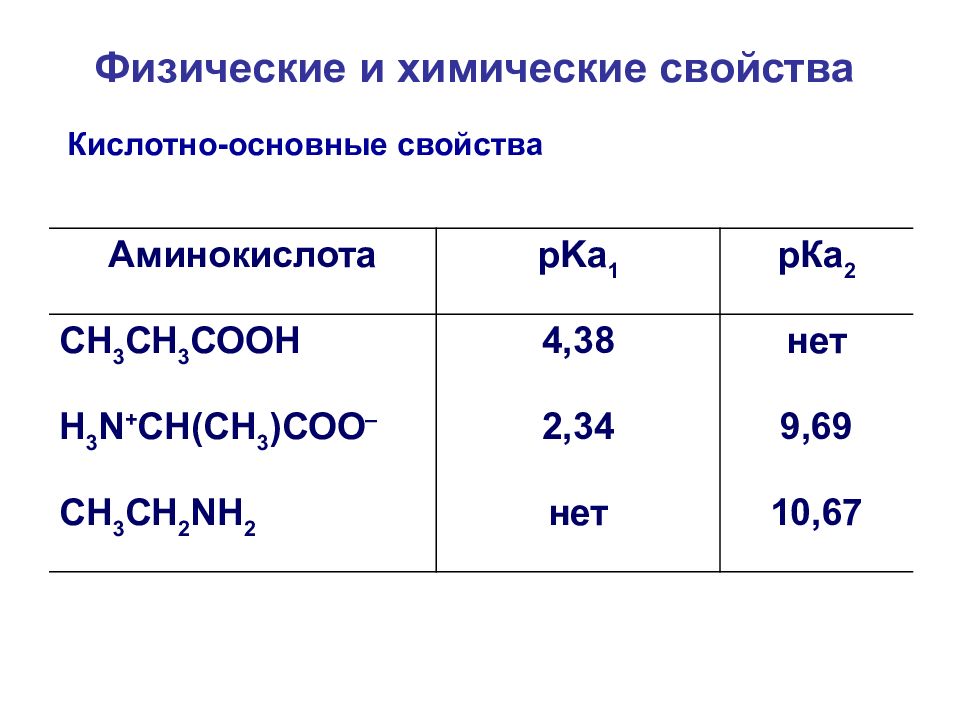
Кислотно-основные свойства Аминокислота pKa 1 рКа 2 СН 3 СН 3 СООН 4,38 нет Н 3 N + СН(СН 3 )СОО – 2,34 9,69 CH 3 CH 2 NH 2 нет 10,67 Физические и химические свойства
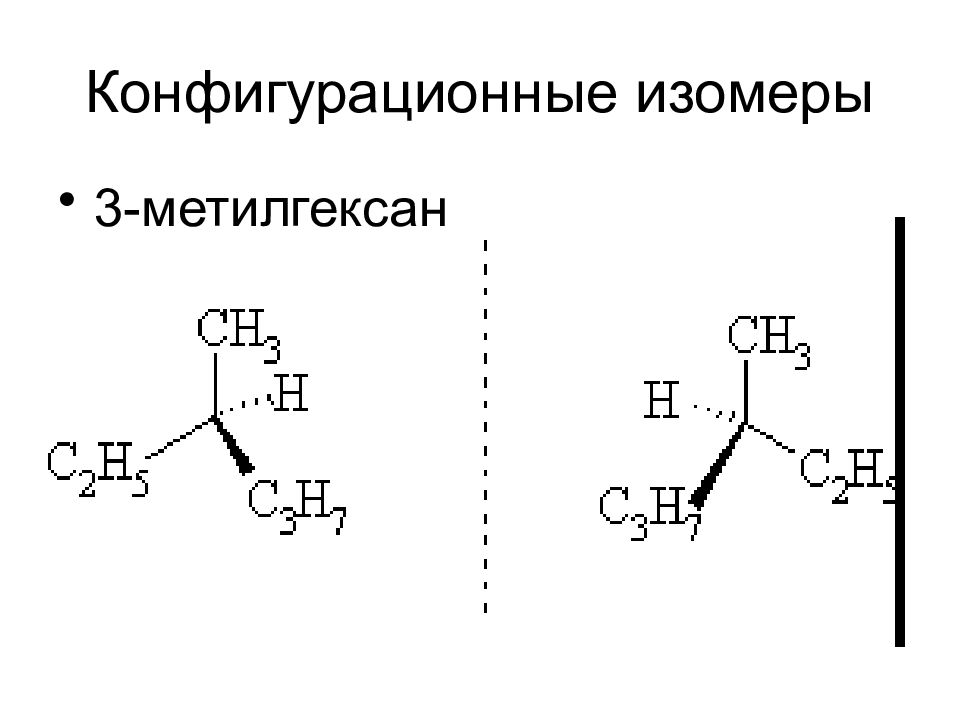
Слайд 9
СТЕРЕОИЗОМЕРИЯ Изомерами называются соединения с одинаковым составом, отличающиеся между собой последовательностью связывания атомов и (или) расположением их в пространстве. подразделяется на : 1. Конфигурационную 2. Конформационную
Слайд 10
Термины конфигурация и конформация не являются синонимами Под конфигурацией понимают пространственную организацию молекулы, определяемую наличием в ней: 1. двойных связей, вокруг которых изменение положения заместителей возможно лишь при условии разрыва связи 2. наличие хиральных центров с расположенными вокруг них в определенной последовательности замещающими группами
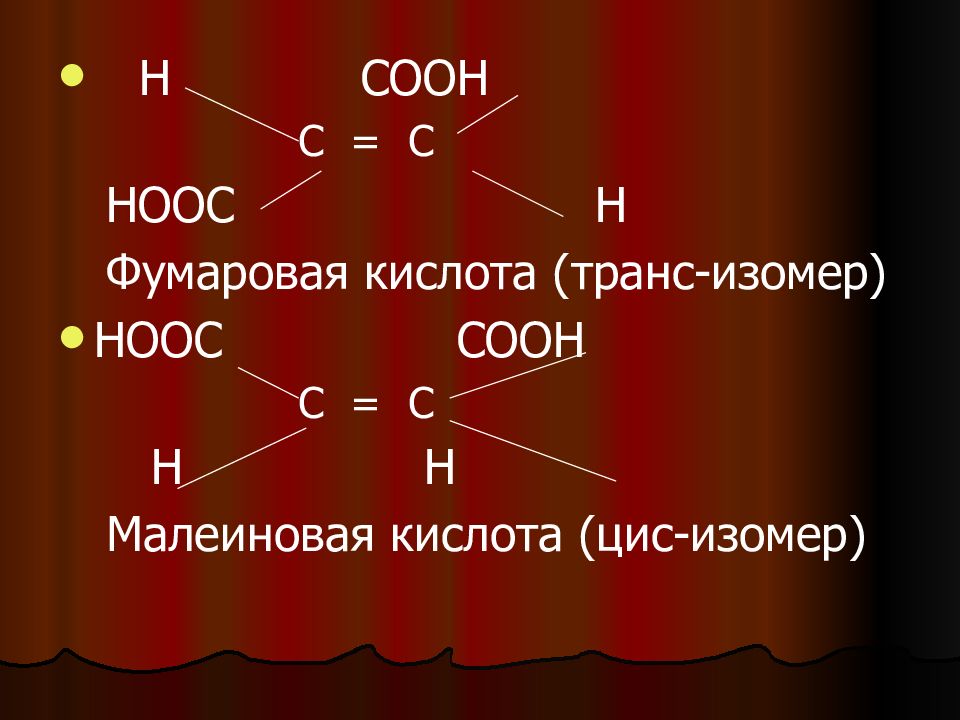
Слайд 11
Н СООН С = С НООС Н Фумаровая кислота (транс-изомер) НООС СООН С = С Н Н Малеиновая кислота (цис-изомер)
Слайд 13
Если подходить к молекуле как к геометрическому телу, то молекулa с атомом С в sp 3 - гибридизации, имеющим одинаковые заместители (СН 4, С Cl 4 и др.) представляет собой правильный тетраэдр с валентными углами равными 109°28'. Если с центральным углеродным атомом связаны разные заместители, то валентные углы могут отклоняться от этой величины; разными оказываются и длины связей - тетраэдр становится неправильной пирамидой.
Слайд 15: Понятие хирального центра
Хиральный центр или ассиметричный угле-родный атом – это атом в SP 3 – гибридизации, имеющий 4 различных заместителя.
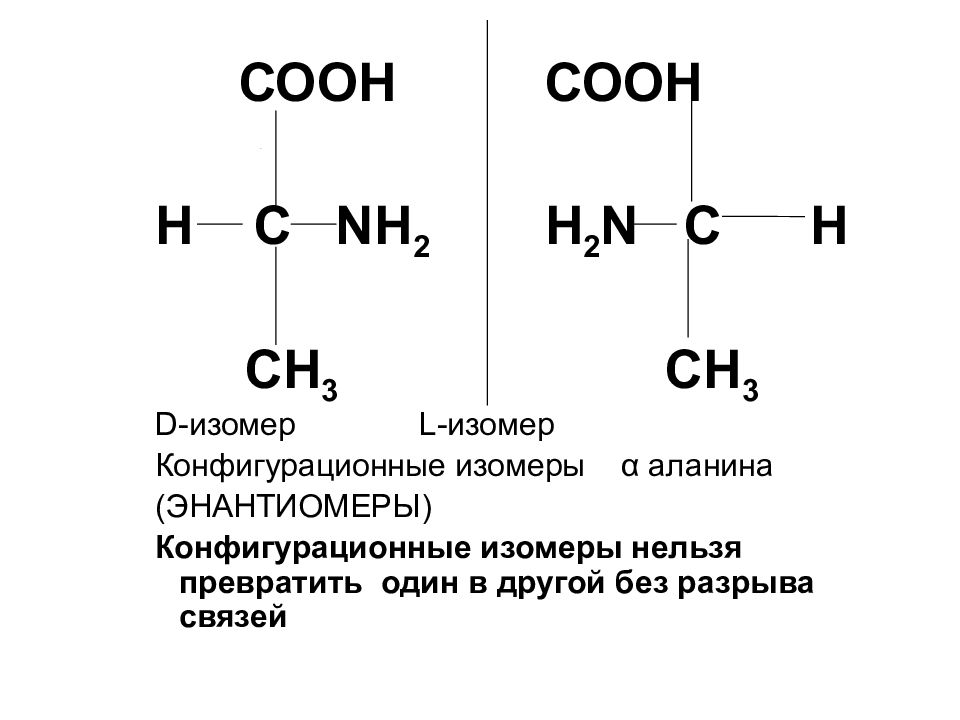
Слайд 16
СООН СООН Н С NH 2 H 2 N C H CH 3 CH 3 D- изомер L -изомер Конфигурационные изомеры α аланина (ЭНАНТИОМЕРЫ) Конфигурационные изомеры нельзя превратить один в другой без разрыва связей
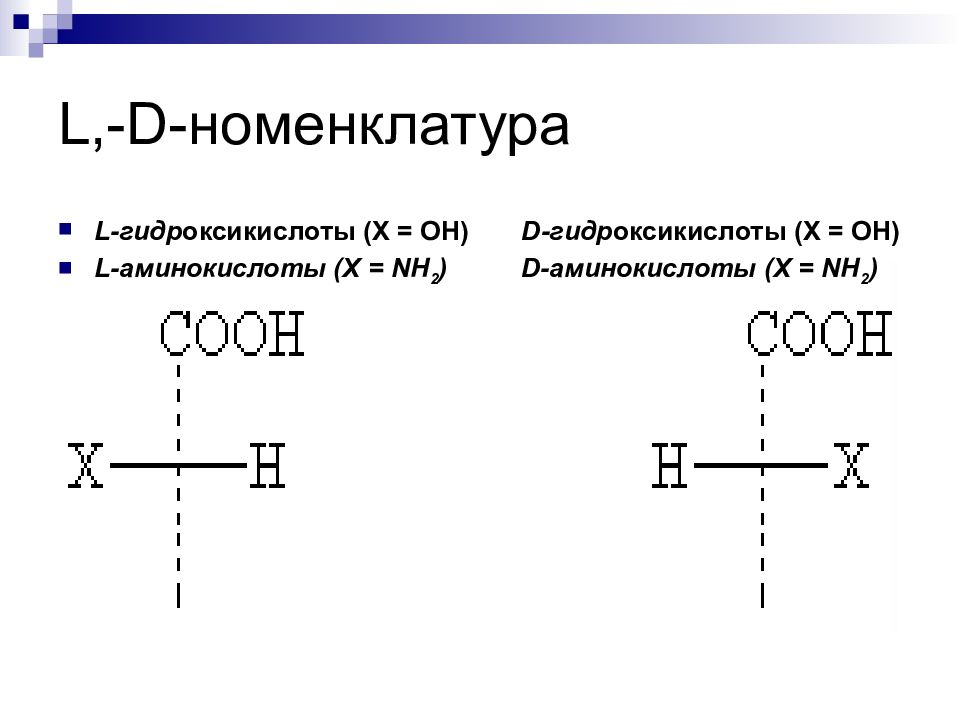
Слайд 18: L,-D- номенклатура
L-гидр оксикислоты (Х = ОН) D-гидр оксикислоты (Х = ОН) L-аминокислоты (Х = NH 2 ) D-аминокислоты (Х = NH 2 )
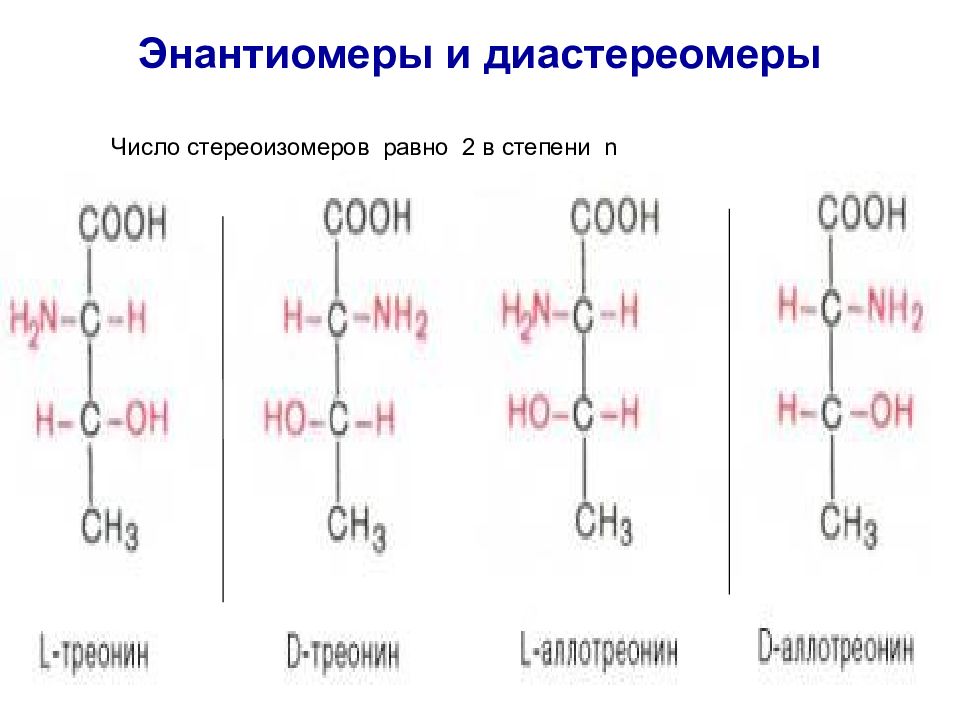
Слайд 20: Энантиомеры и диастереомеры
Все природные a- аминокислоты относятся к L– ряду. Число стереоизомеров равно 2 в степени n
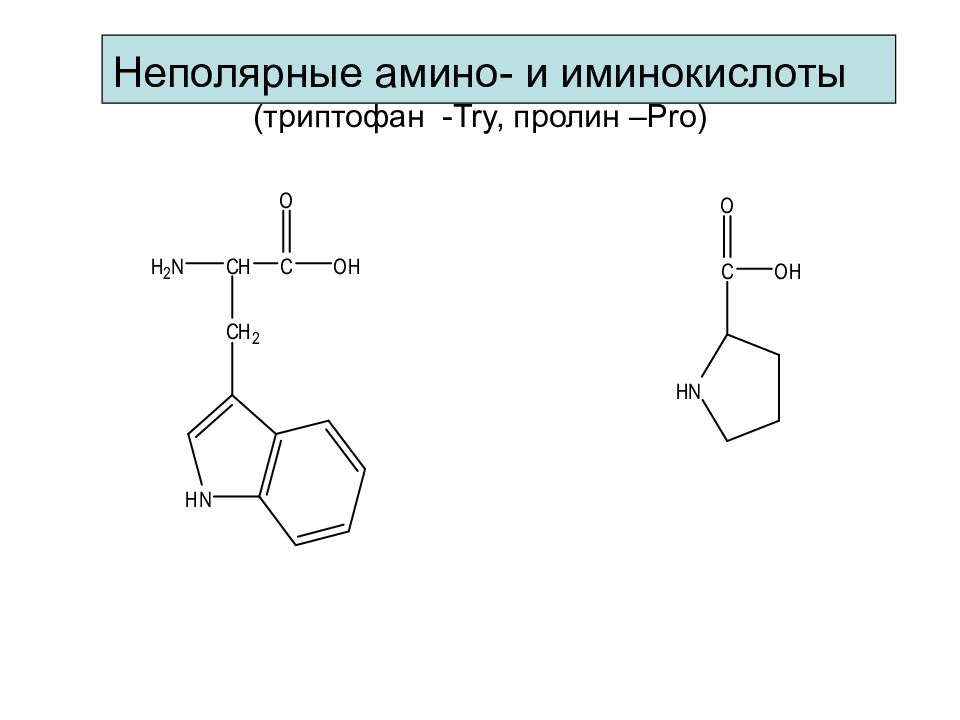
Слайд 21: Классификация аминокислот
1. Различают α -, β -, γ -, δ - аминокислоты. Природные аминокислоты - α -строения. 2. Аминокислоты различают по количеству амино- и карбоксильных групп. 3. Аминокислоты различают по природе радикала у α -углеродного атома
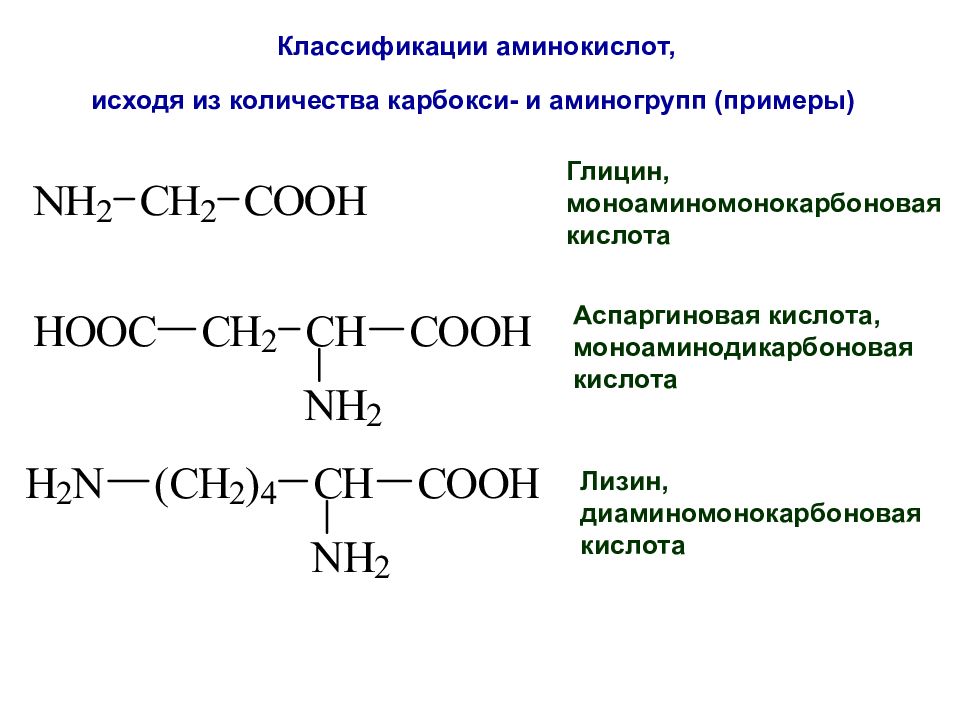
Слайд 22: Классификации аминокислот, исходя из количества карбокси- и аминогрупп (примеры)
Глицин, моноаминомонокарбоновая кислота Аспаргиновая кислота, моноаминодикарбоновая кислота Лизин, диаминомонокарбоновая кислота
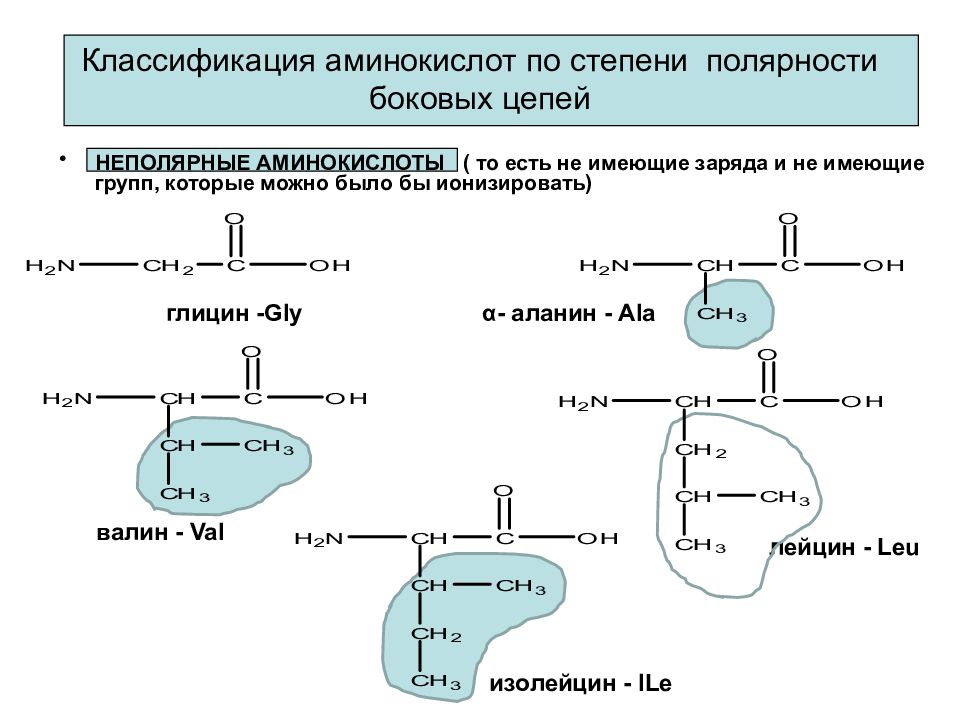
Слайд 23: Классификация аминокислот по степени полярности боковых цепей
НЕПОЛЯРНЫЕ АМИНОКИСЛОТЫ ( то есть не имеющие заряда и не имеющие групп, которые можно было бы ионизировать) глицин - Gly α - аланин - Ala валин - Val лейцин - Leu изолейцин - ILe
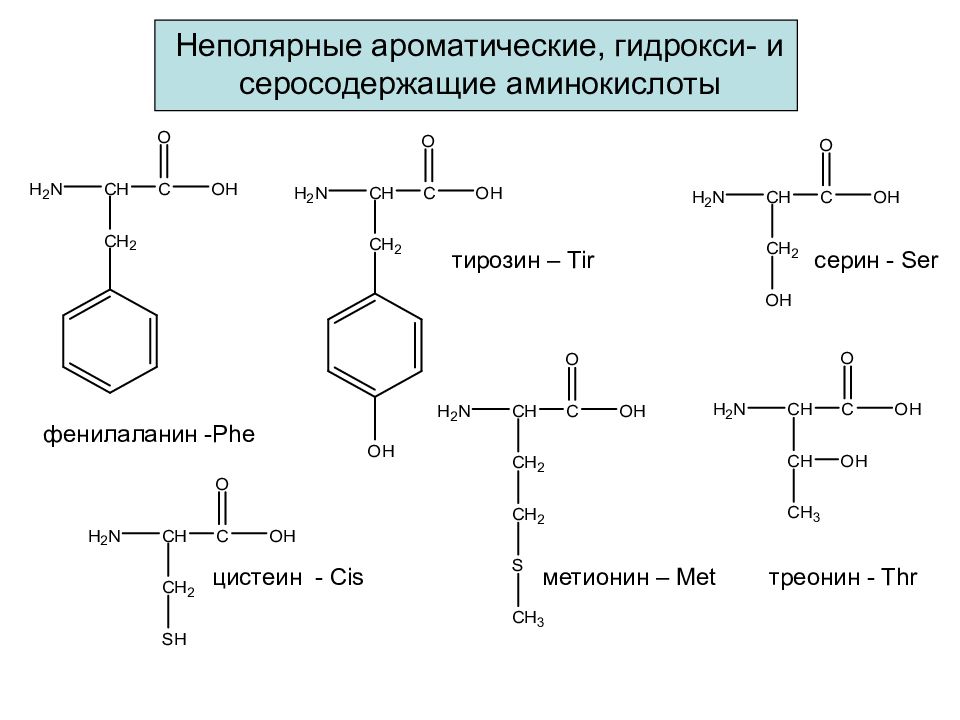
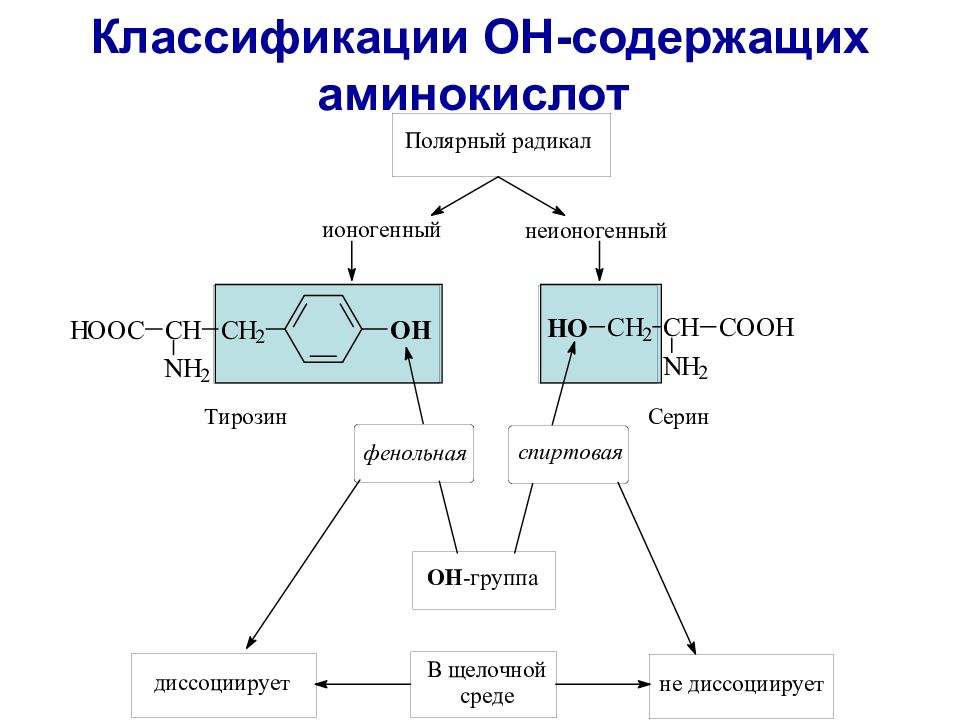
Слайд 24: Неполярные ароматические, гидрокси- и серосодержащие аминокислоты
фенилаланин - Phe метионин – Met цистеин - Cis тирозин – Tir серин - Ser треонин - Thr
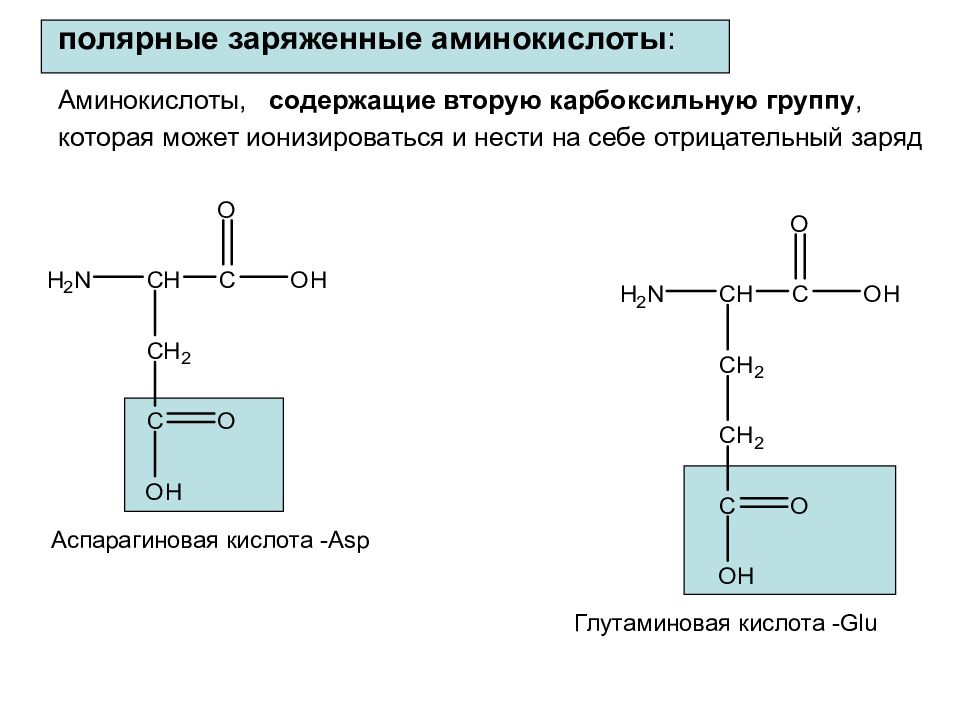
Слайд 26: полярные заряженные аминокислоты : Аминокислоты, содержащие вторую карбоксильную группу, которая может ионизироваться и нести на себе отрицательный заряд
Аспарагиновая кислота - Asp Глутаминовая кислота - Glu
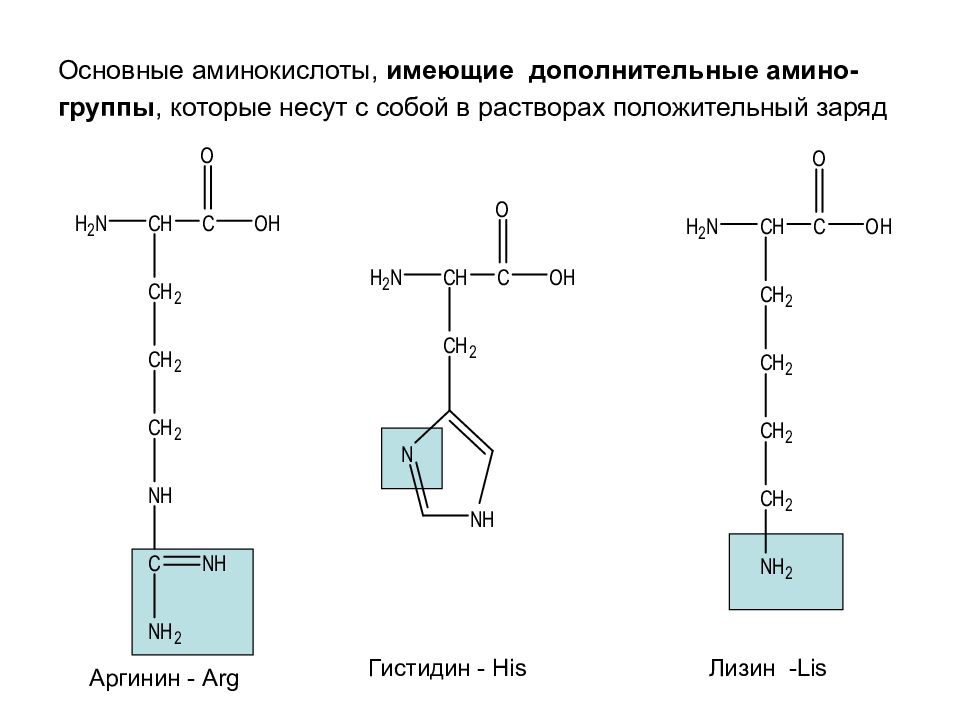
Слайд 27: Основные аминокислоты, имеющие дополнительные амино-группы, которые несут с собой в растворах положительный заряд
Аргинин - Arg Гистидин - His Лизин - Lis
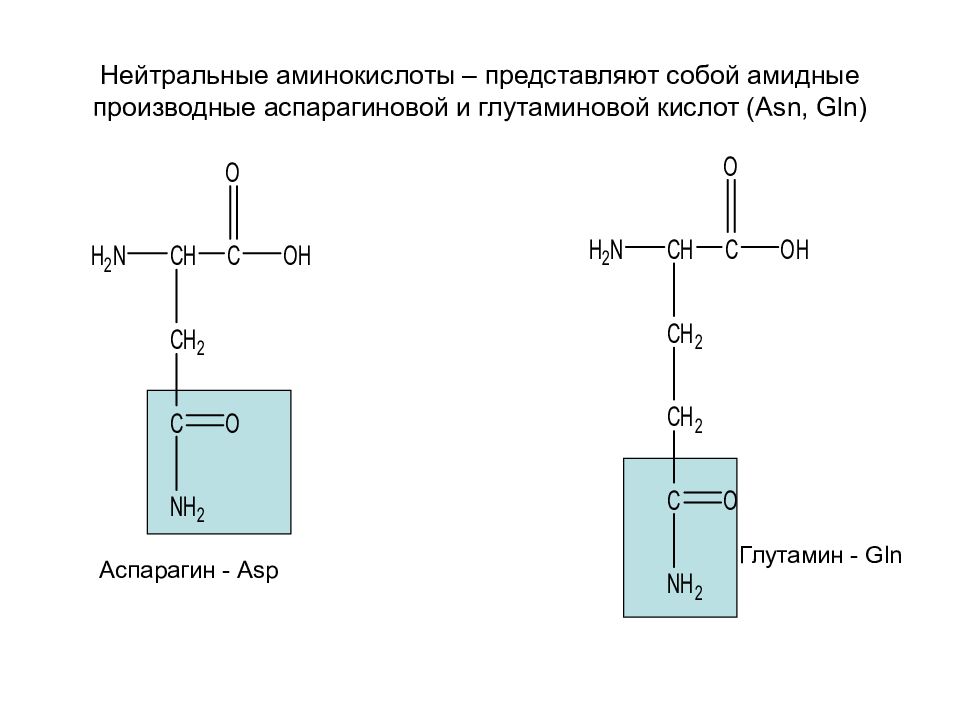
Слайд 28: Нейтральные аминокислоты – представляют собой амидные производные аспарагиновой и глутаминовой кислот ( Asn, Gln)
Аспарагин - Asp Глутамин - Gln
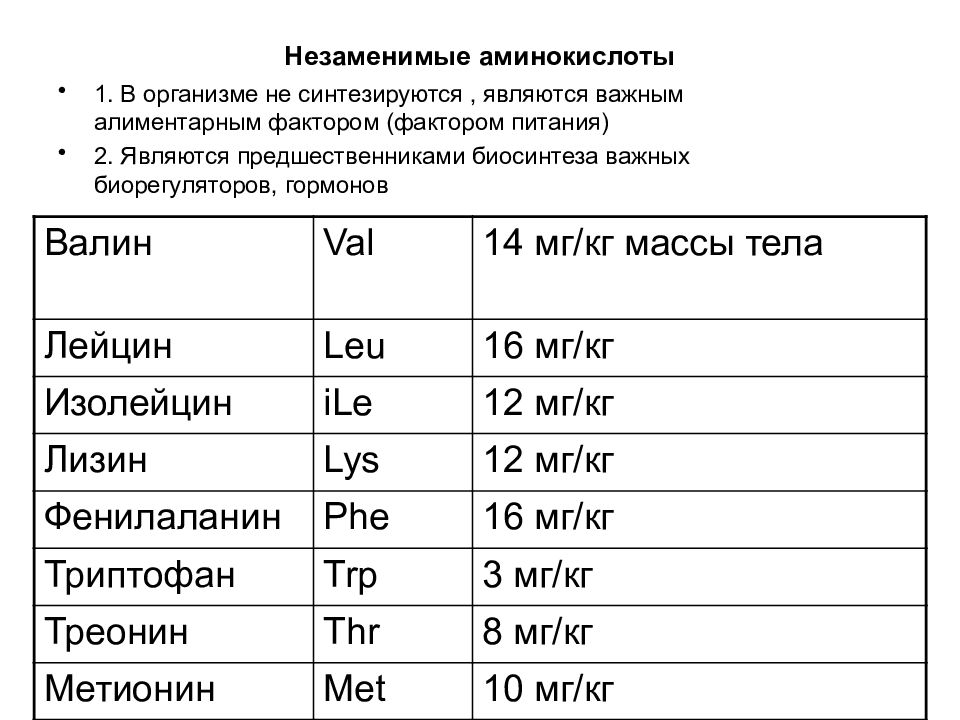
Слайд 30: Незаменимые аминокислоты
1. В организме не синтезируются, являются важным алиментарным фактором (фактором питания) 2. Являются предшественниками биосинтеза важных биорегуляторов, гормонов Валин Val 14 мг/кг массы тела Лейцин Leu 16 мг/кг Изолейцин iLe 12 мг/кг Лизин Lys 12 мг/кг Фенилаланин Phe 16 мг/кг Триптофан Trp 3 мг/кг Треонин Thr 8 мг/кг Метионин Met 10 мг/кг
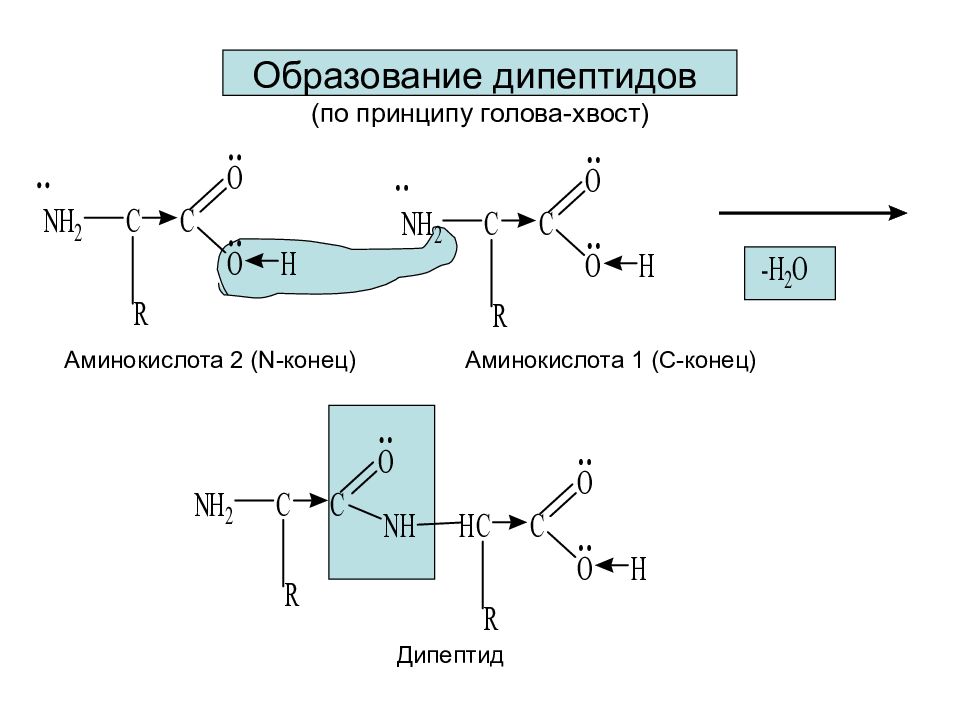
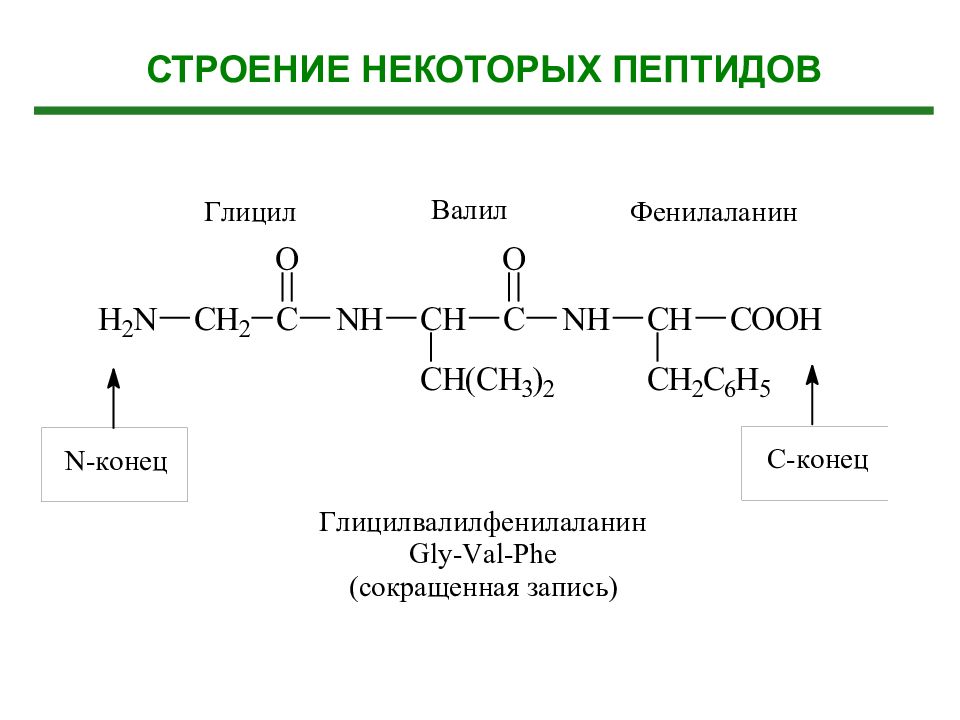
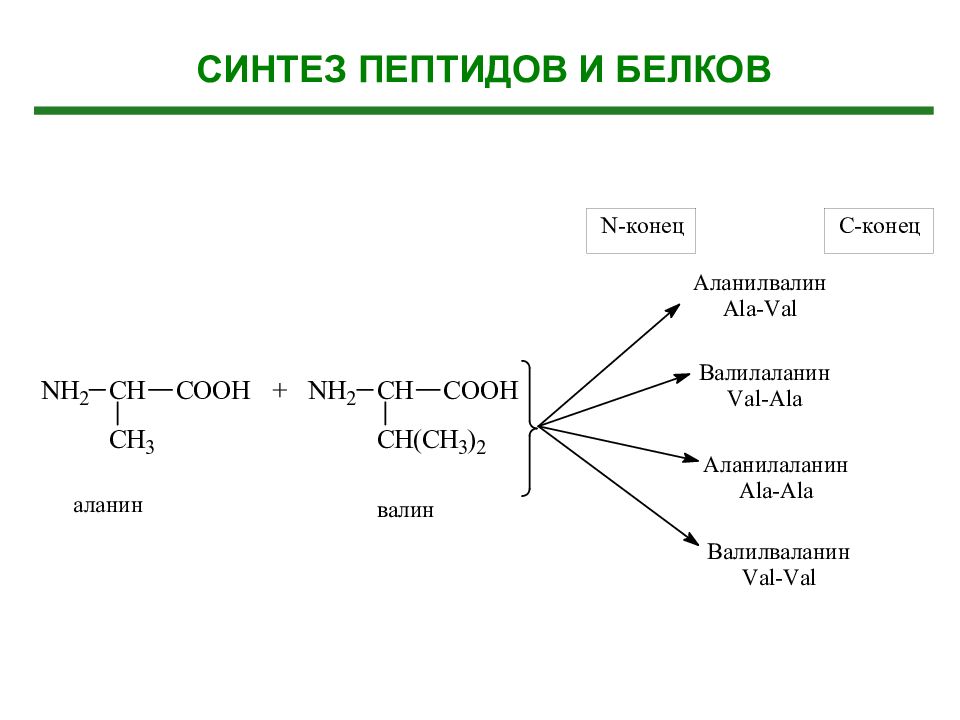
Слайд 31: Образование дипептидов (по принципу голова-хвост)
Аминокислота 1 (С - конец) Аминокислота 2 ( N -конец) Дипептид
Слайд 35
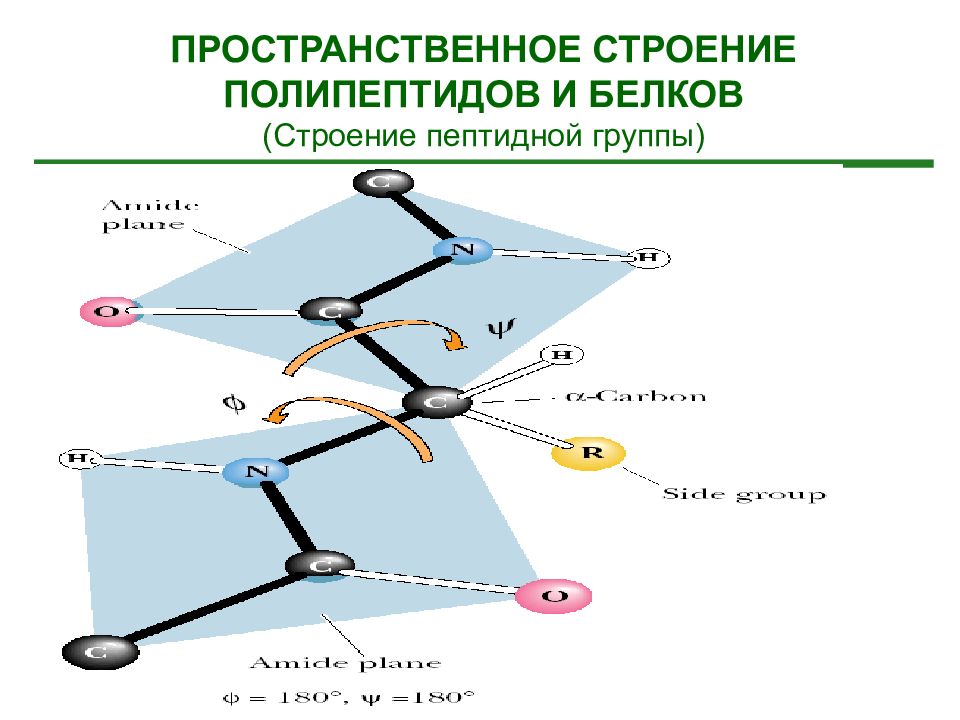
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Строение пептидной группы)
Слайд 36: Классификация пептидов в зависимости от количества остатков аминокислот
1. Дипептиды (2 аминокислоты) 2. Олигопептиды (до 10 аминокислот) 3. Полипептиды (от 11 до 100 аминокислот) 4. Белки (свыше 100 аминокислот)
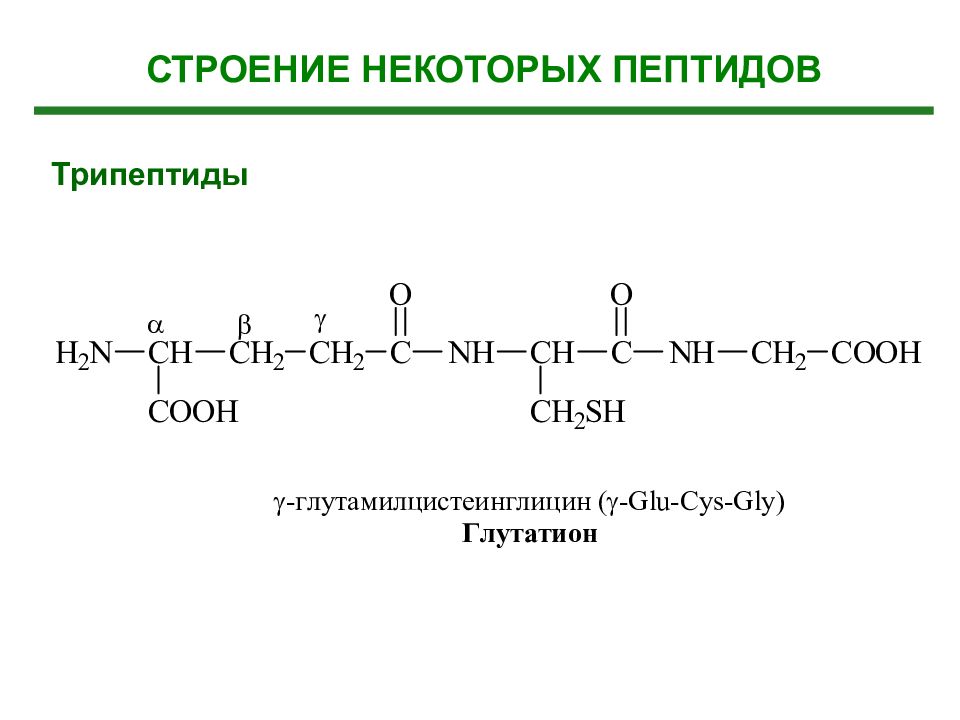
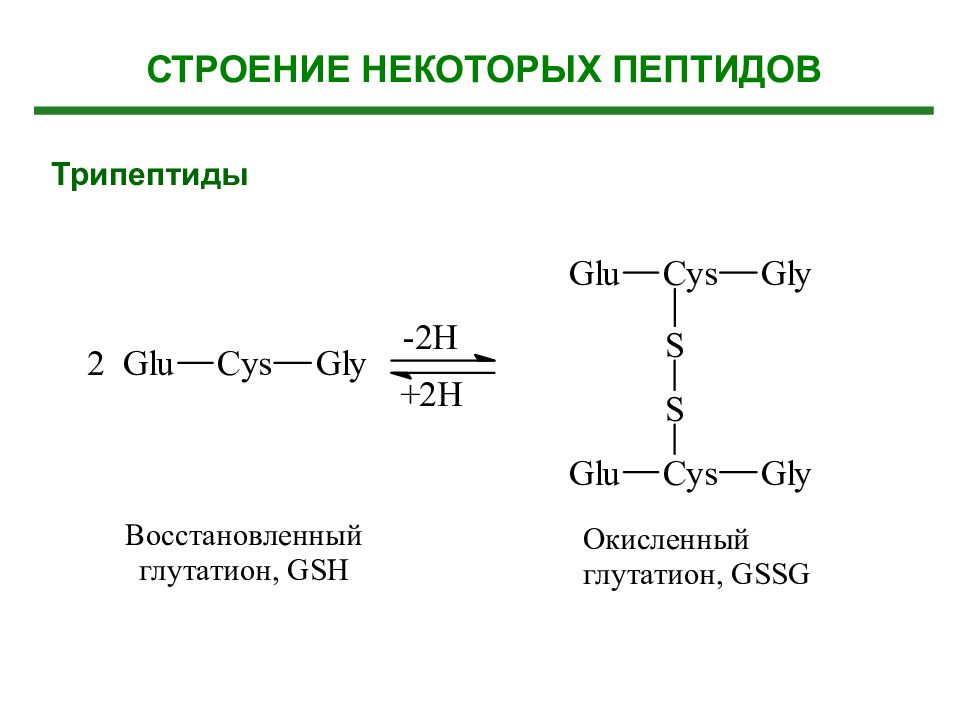
Слайд 37: Дипептиды, полипептиды Биологическая роль
1. Эндогенные биорегуляторы (органоспецифичны) 2. Гормоны (более 100 гормонов) 3. Токсические пептиды
Слайд 38
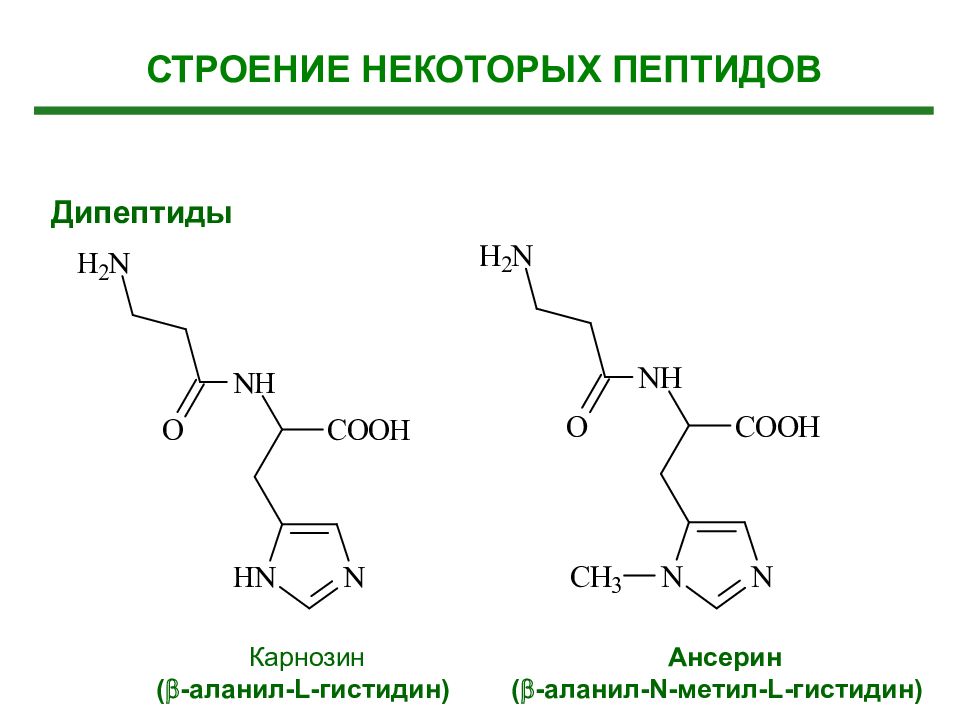
Дипептиды Карнозин ( -аланил- L -гистидин) Ансерин ( -аланил- N -метил- L -гистидин) СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
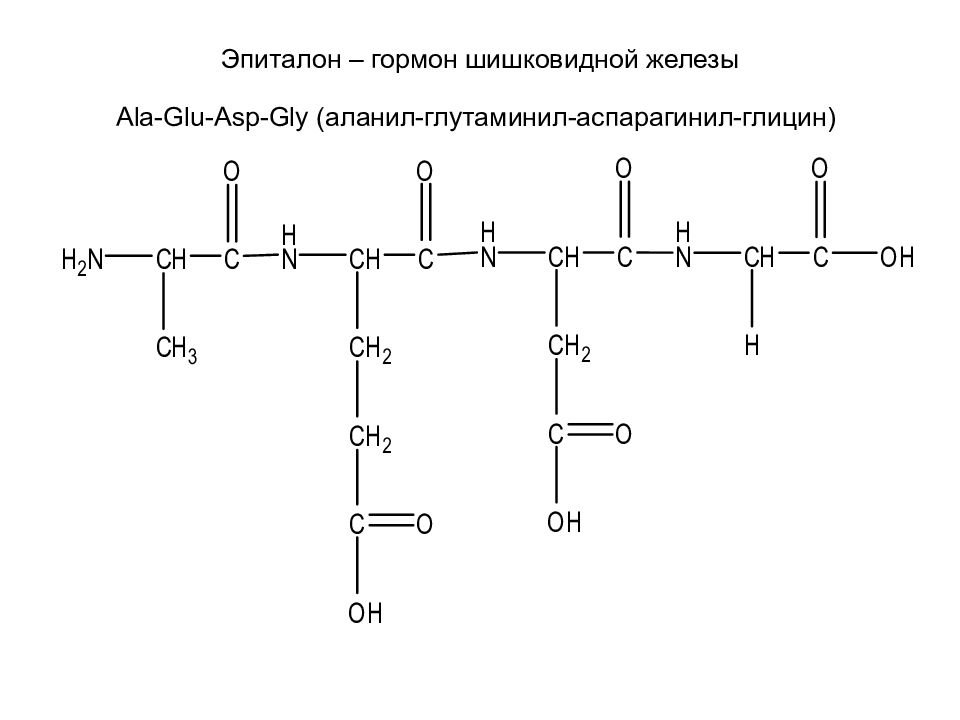
Слайд 41: Эпиталон – гормон шишковидной железы Ala - Glu - Asp - Gly (аланил-глутаминил-аспарагинил-глицин)
Слайд 43
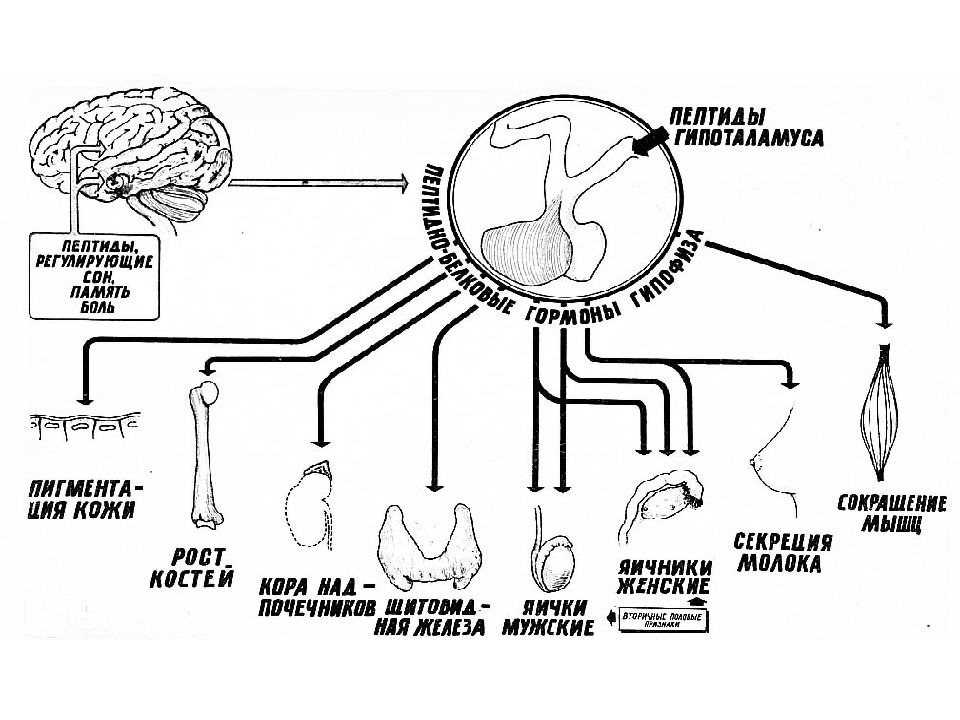
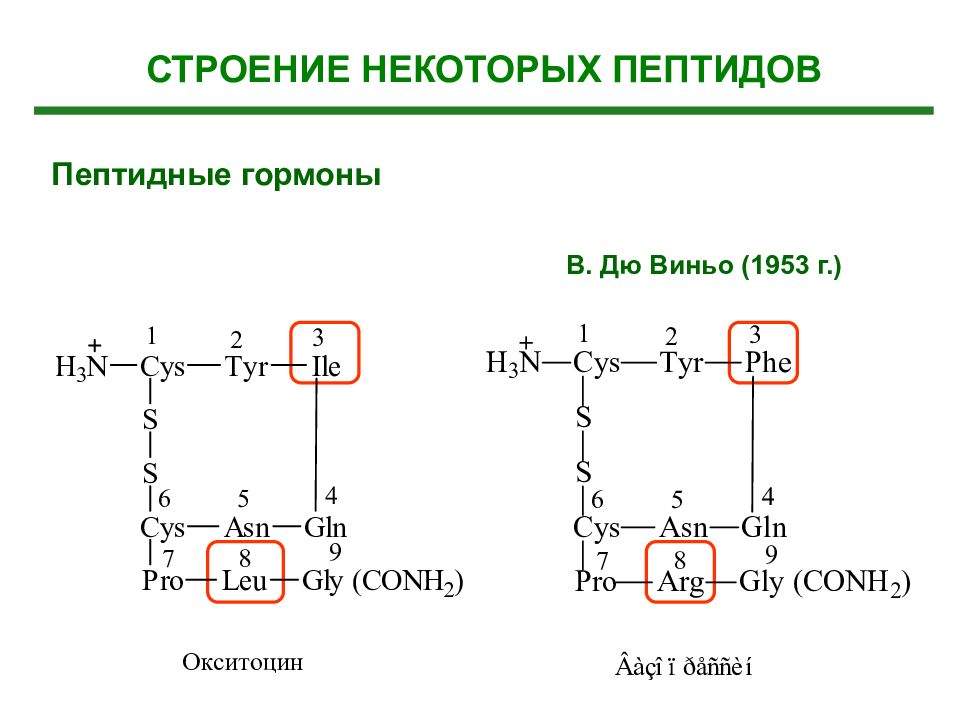
Гормоны гипофиза Кортикотропин (адренокортикотропный гормон (АКТГ )– 39 аминокислот ά - Меланотропин ( -меланостимулирующий гормон) – 18 аминокислот Окситоцин – 9 аминокислот Вазопрессин – 9 аминокислот
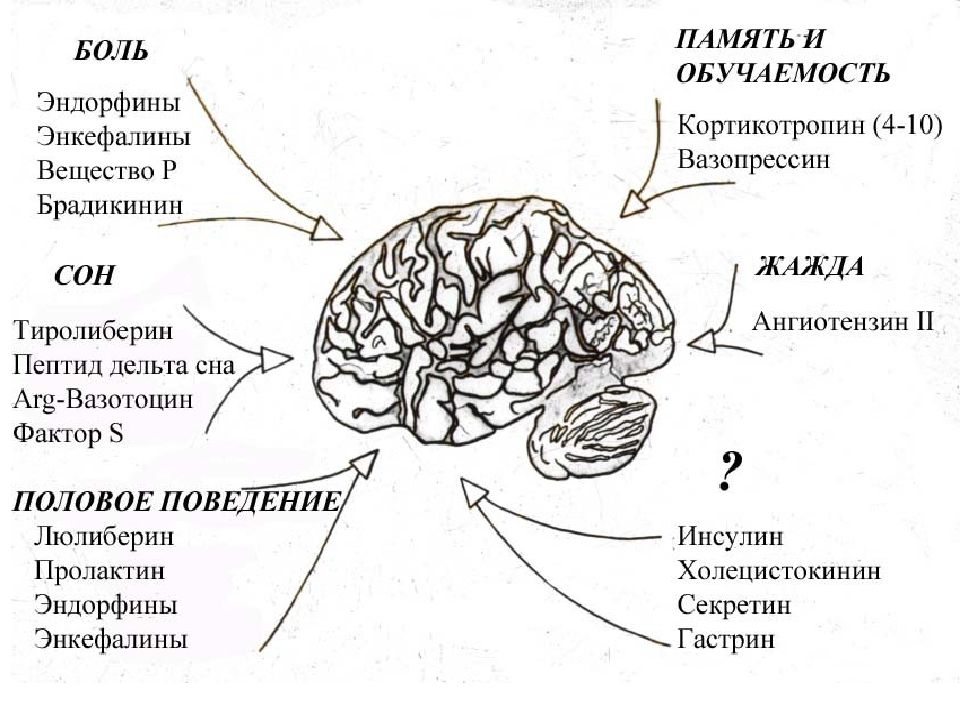
Слайд 45: Нейропептиды Эндорфины мозга – это гормоны, обладающие морфиноподобным, анальгизирующим действием. Эндорфины - собственный опий организма. Их действие связано с пептидом (энкефалином), расположенным с N -конца молекулы эфдорфина
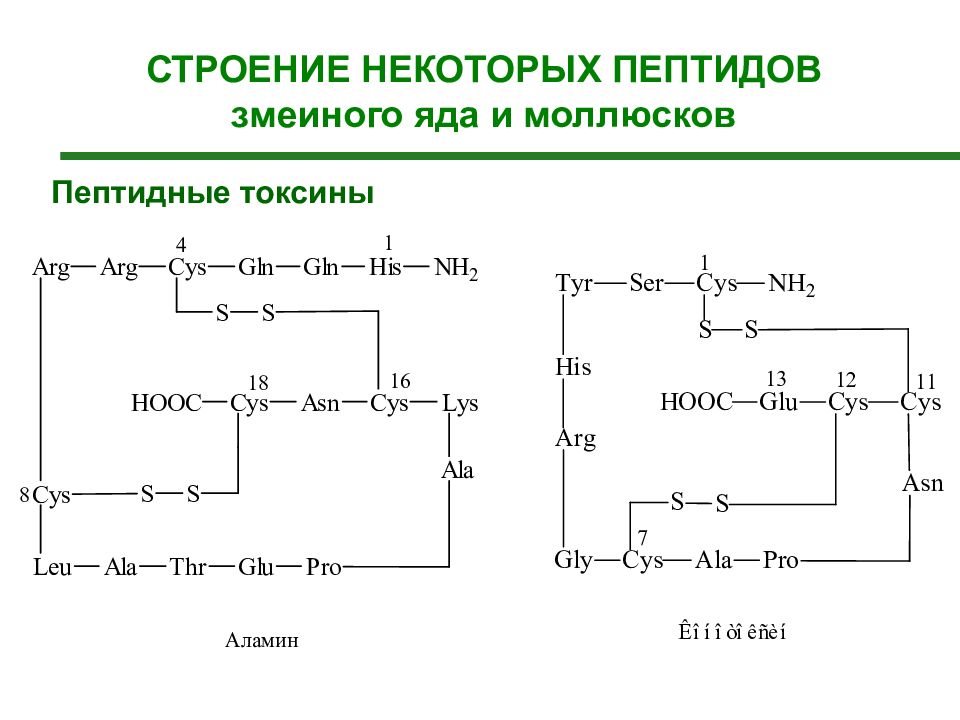
СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ
Слайд 46
Нейропептиды СТРОЕНИЕ НЕКОТОРЫХ ПЕПТИДОВ Существует также группа поведенческих пептидов. Скотофобин – особый пептид (из 15 аминокислот), вызывающий светобоязнь.
Слайд 48
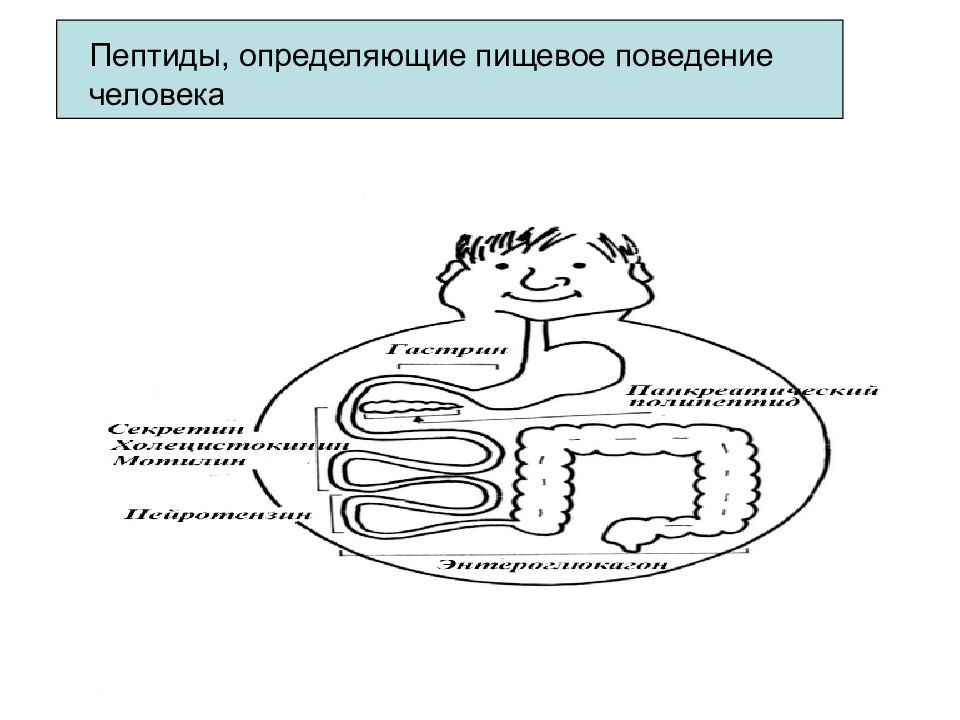
Ангиотензин I декапептид - синтезируется в печени. В мембране кровеносных сосудов, особенно в легких под действием ферментов он превращается в ангиотензин II. Этот октапептид является гормоном и одновременно нейромедиатором. Ангиотензин II благодаря выраженному суживающему действию на сосуды повышает кровяное давление, в почках способствует уменьшению выведения ионов Na+ и воды. Эритропоэтин — полипептидный гормон, образуется в основном в почках и печени. Г ормон контролирует дифференцировку стволовых клеток костного мозга и обеспечивает превращение их в эритроциты. Секреция эритропоэтина стимулируется при гипоксии (p O2 ↓).
Слайд 50: Токсические пептиды
Пептиды пчелиного яда - продукта ядовитых желез пчелы (апамин, мелитин, пептид 401 (МСД-пептид), адолапин, протеазные ингибиторы, секапин, терциапин и др.) Пептиды- токсины ядовитых грибов Аматоксины (35 видов ) определяют токсическое действие грибов. Смертельно опасная доза составляет 0,1 мг/кг массы тела человека Фаллотоксины - токсины бледной поганки и близких к ней видов ядовитых грибов Фаллотоксины оказывают специфическое гепатотоксическое действие. Токсины моллюсков (коннотоксины) - группа пептидов, выделенных из яда хищных морских моллюсков рода Conus. Токсины используются моллюсками для защиты, жертва лишается чувствительности. На основе коннотоксинов получен новый класс обезболивающих средств. Токсины змеиного яда – нейротоксины - парализуют нервную систему жертвы. геморрагины - разрушают эндотелий сосудов, вызывают кровоточивость, нарушающие свертывание крови, некроз тканей и дисфункцию многих органов, снижение сердечного выброса; Многие змеиные яды вызывают полиорганную недостаточность Бактериальные токсины –например, дифтерийный токсин.
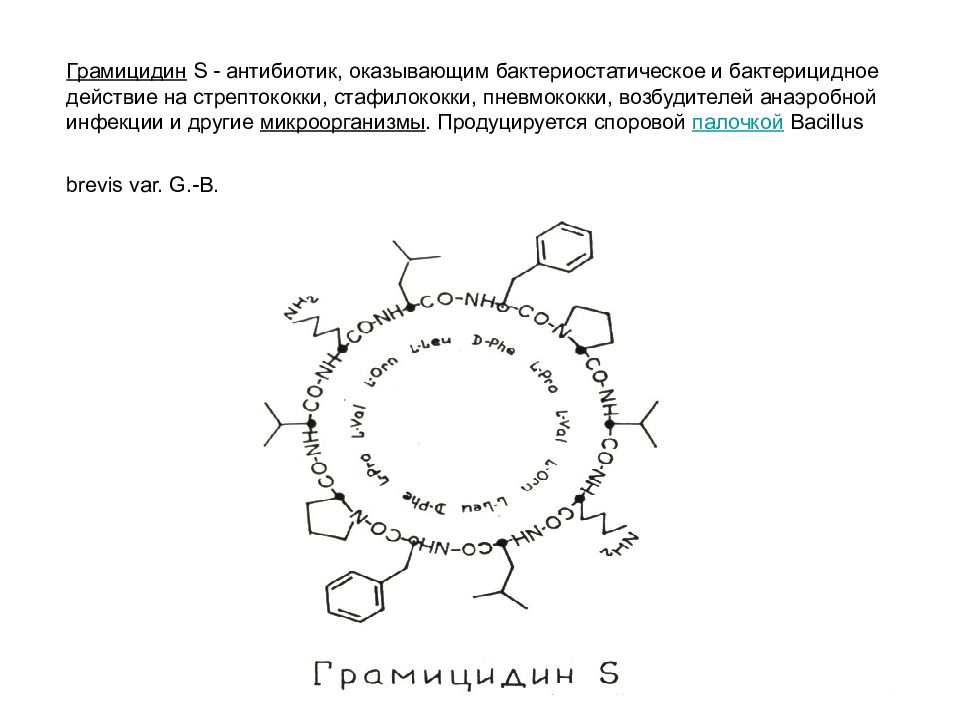
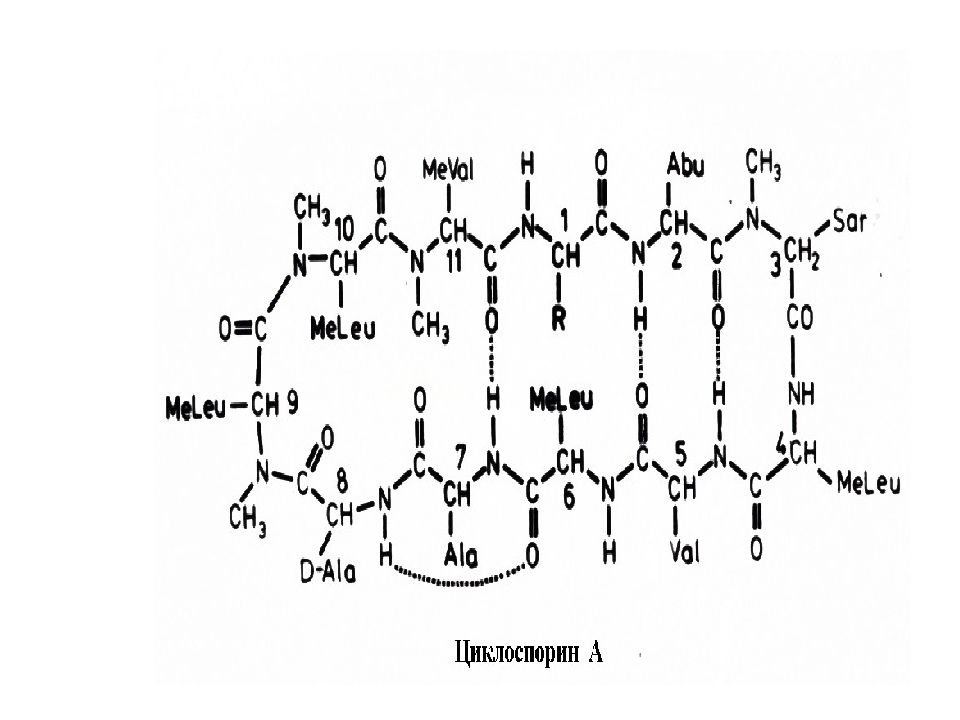
Слайд 53: Грамицидин S - антибиотик, оказывающим бактериостатическое и бактерицидное действие на стрептококки, стафилококки, пневмококки, возбудителей анаэробной инфекции и другие микроорганизмы. Продуцируется споровой палочкой Bacillus brevis var. G.-B
Слайд 54: Грамицидин А обладает свойством образовывать ионселективный трансмембранный канал, не уступающий по характеристикам белковым каналам, которые представлены, например, в нервной системе
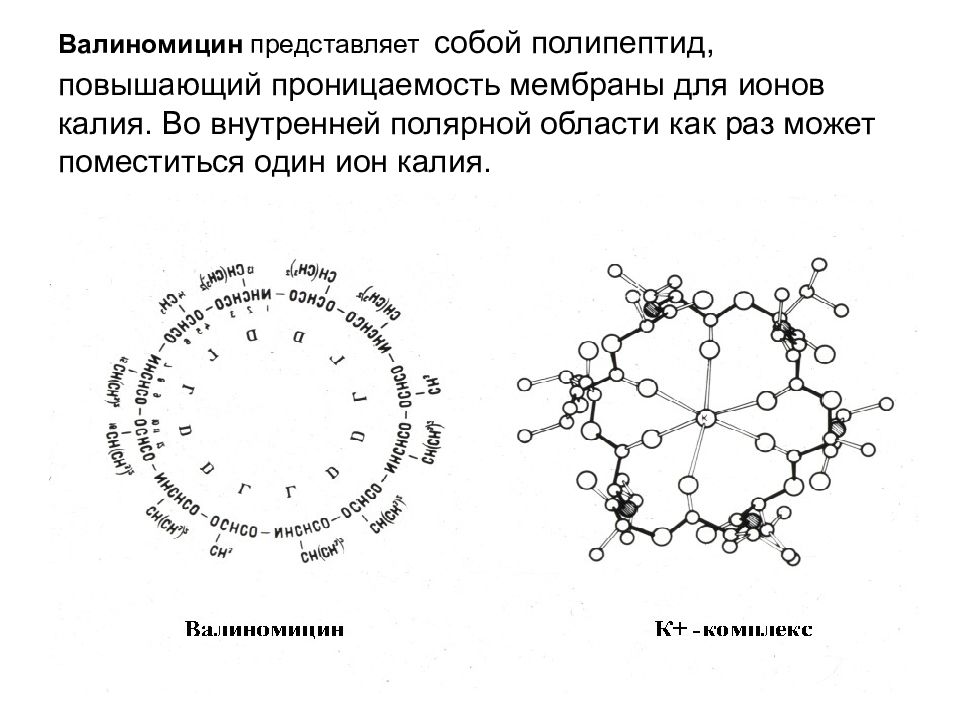
Слайд 55: Валиномицин представляет собой полипептид, повышающий проницаемость мембраны для ионов калия. Во внутренней полярной области как раз может поместиться один ион калия
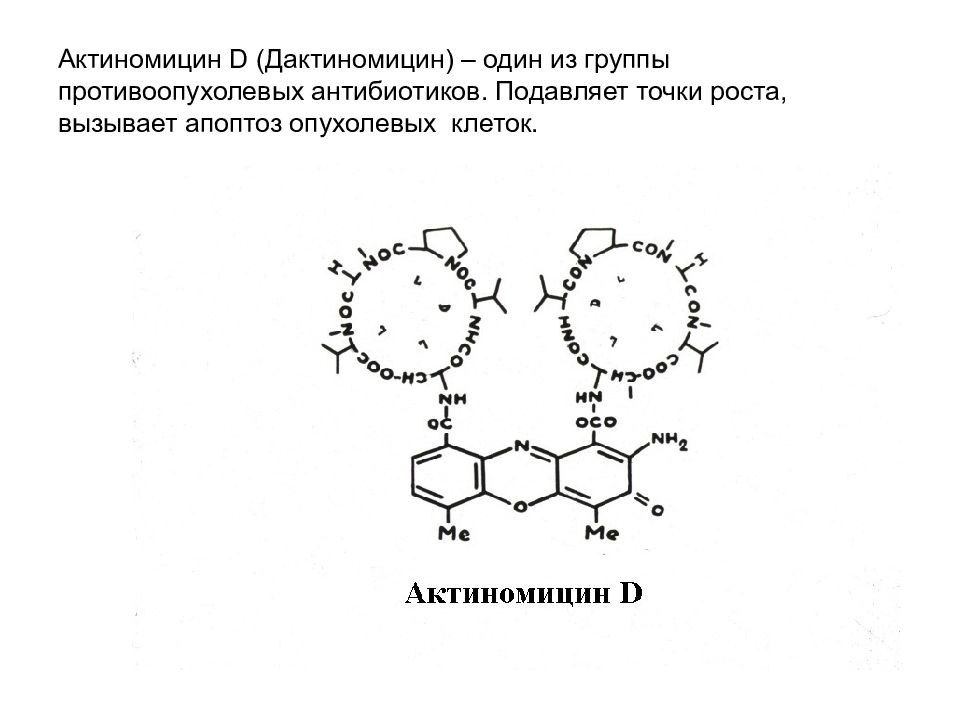
Слайд 56: Актиномицин D (Дактиномицин) – один из группы противоопухолевых антибиотиков. Подавляет точки роста, вызывает апоптоз опухолевых клеток
Слайд 57: Антимикробные пептиды – возможная альтернатива традиционным антибиотикикам
Антимикробные пептиды – это относительно короткие молекулы (в среднем 30-40 аминокислот), способные убивать клетки микроорганизмов. Являются первичным эшелоном защиты от патогенов и задействованы в системе врожденного иммунитета. Открыто 800 таких пептидов. Ряд пептидов производится собственно микроорганизмами. Например, Lactococus casea, молочнокислые бактерии – продуцирует высокоактивный пептид низин (популярная добавка ко всем «иммунизирующим» иогуртам типа Актимель)
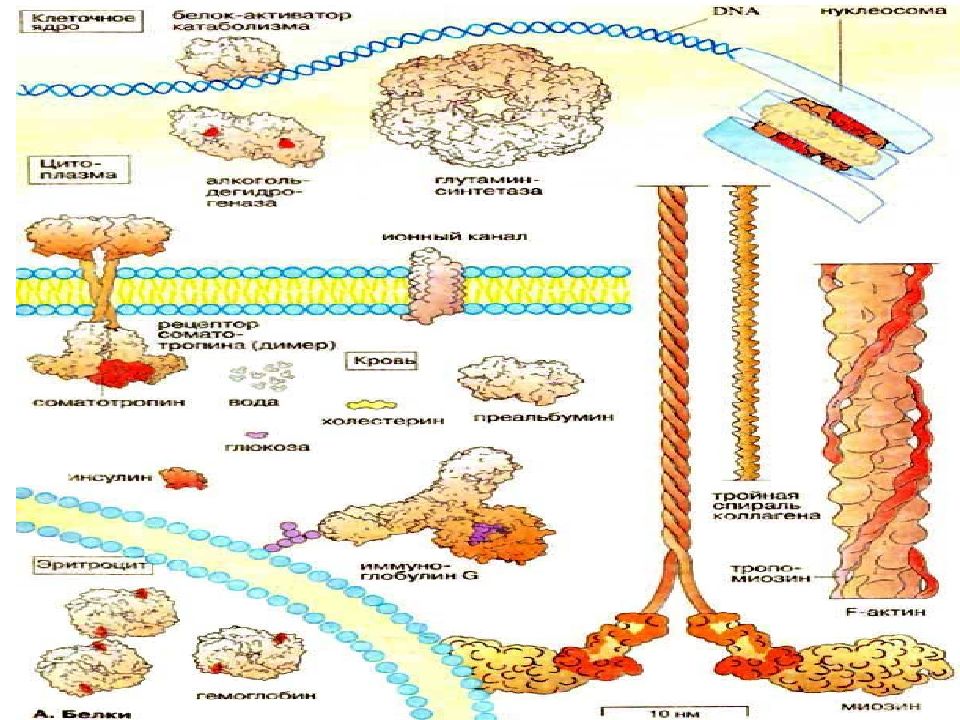
Слайд 58: Белки- наиболее распространенные биополимеры
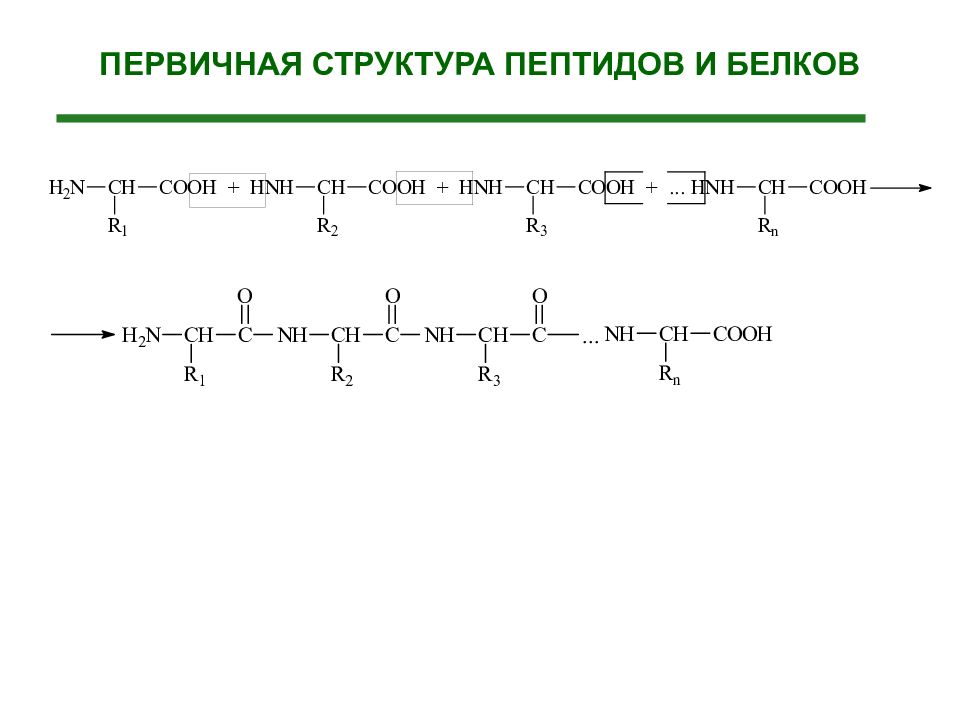
Последовательность аминокислот, связанных в белке пептидными связями, составляет его первичную структуру. При записи первичной структуры аминокислоты обозначают обычно трехбуквенным кодом, по первым трем буквам названия, либо используют однобуквенный код.
Слайд 59: Протеомика
Протеомика –наука, исследующая протеом — совокупность всех протеиновых (белковых, пептидных) молекул, которые имеются в клетке. Рrotos означает «первый, первенствую-щий». В мифологии известен бог Протей способный превращаться в любое существо и владеющий даром прорицания.
Слайд 60: Функции белков
1. Структурообразующие функции. Отвечают за поддержание формы клеток и тканей ( коллаген). Транспортные функции (гемоглобин, трансферрин, церуллоплазмин, преальбумин, ионные каналы, интегральные белки). Защитные функции. Белки имунной системы ( иммуноглобулины). Регуляторные функции. Гормоны ( соматотропин, инсулина и др. ). Каталитические функции. 2100 белков – ферментов (супероксиддисмутаза, каталаза, алкогольдегидрогеназа). Двигательные функции. Белки – отвечающие за мышечное сокращение (актин, миозин, тропомиозин). Запасные функции. Запасные белки, которые мобилизуются при крайней необходимости (казеин).
Слайд 61
Модель строения спирали коллагена Структурообразующие функции. Структурные белки отвечают за поддержание формы и стабильности клеток и тканей. Например, коллаген.
Слайд 63: Первичная структура белка
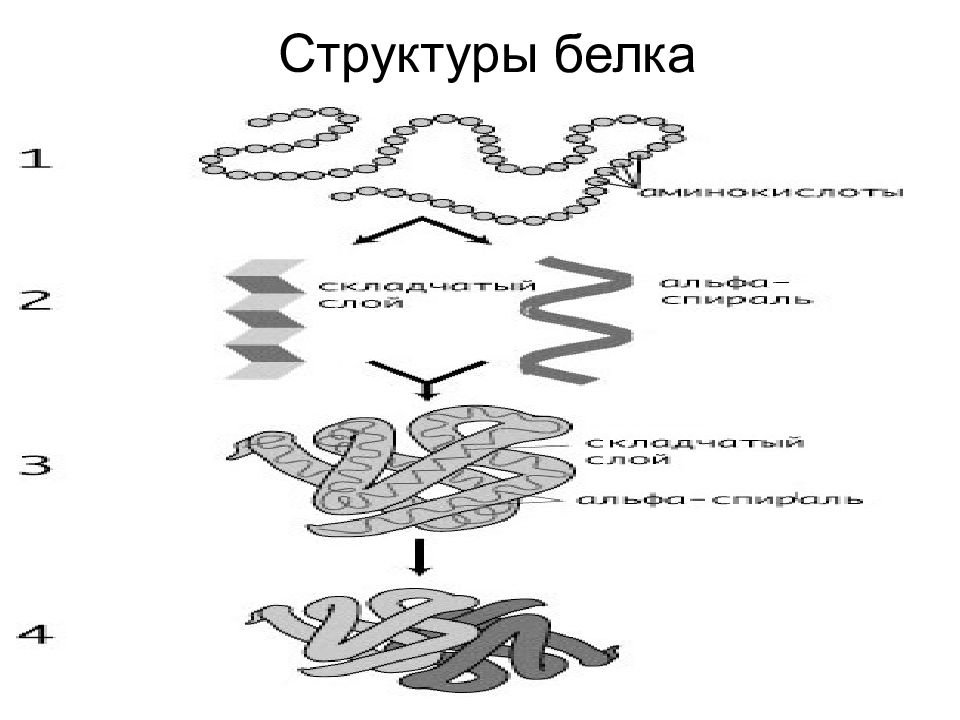
Первичная структура белка - это последовательность расположения аминокислотных остатков в полипептидной цепи Последовательность аминокислот в белке определяется структурой ДНК.
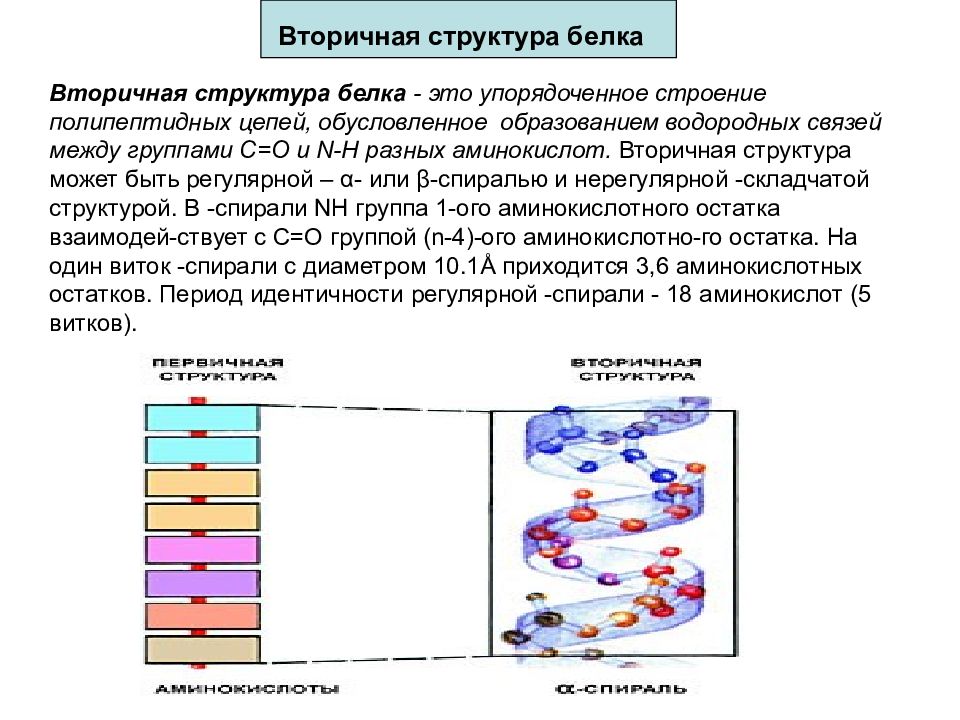
Слайд 64: Вторичная структура белка
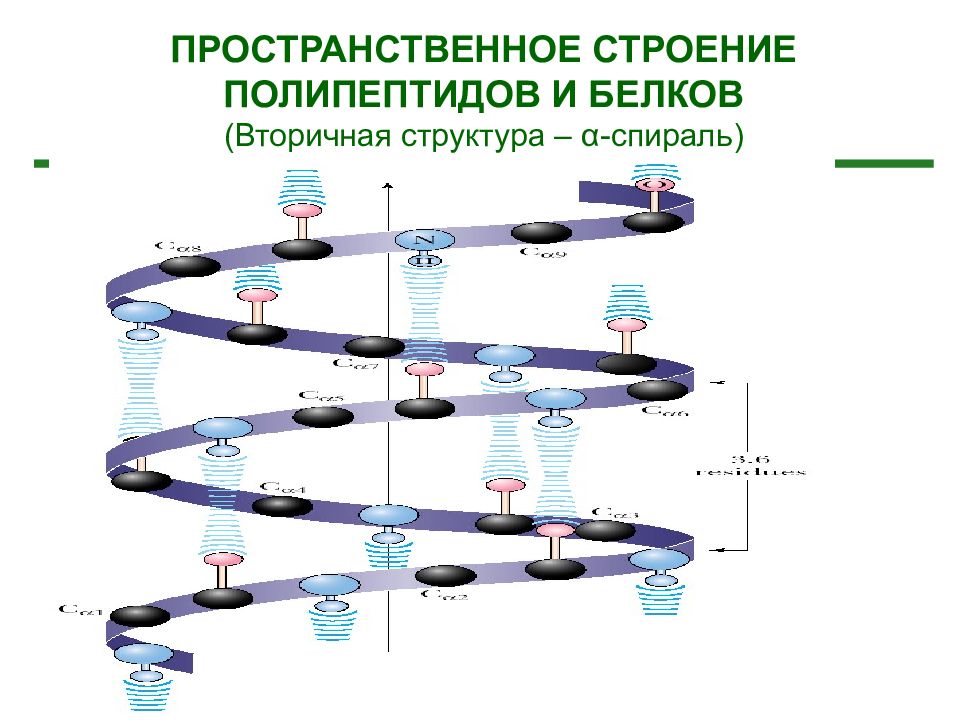
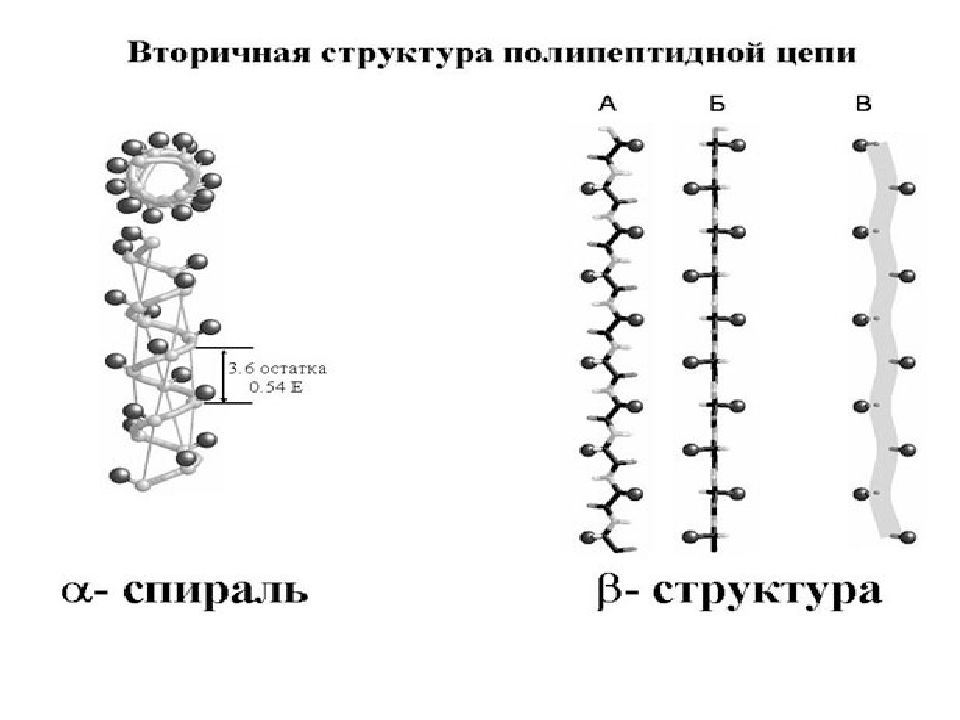
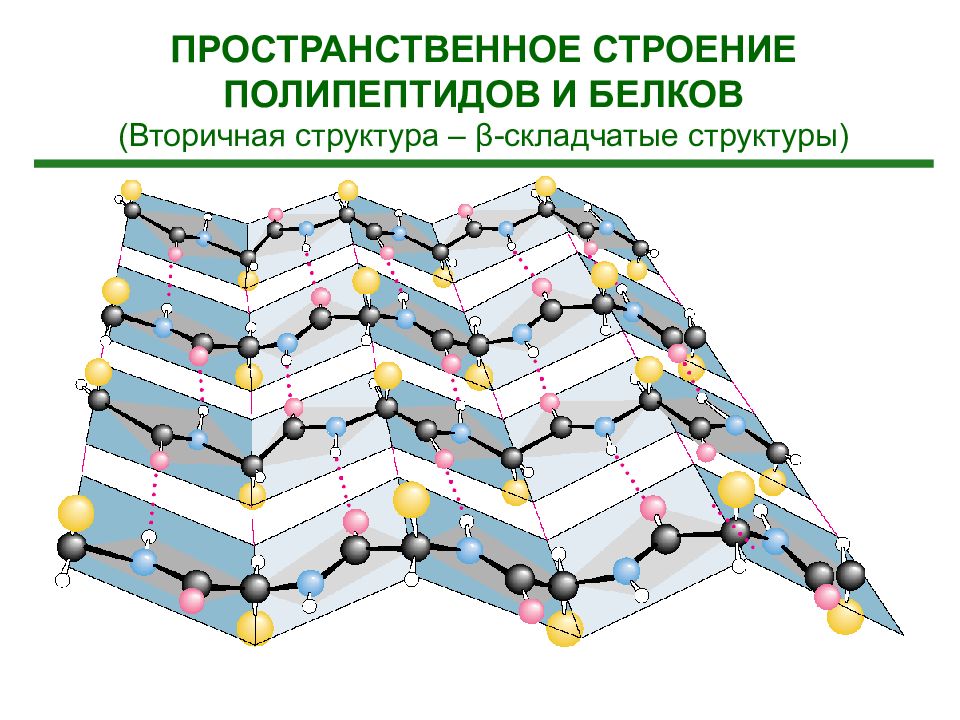
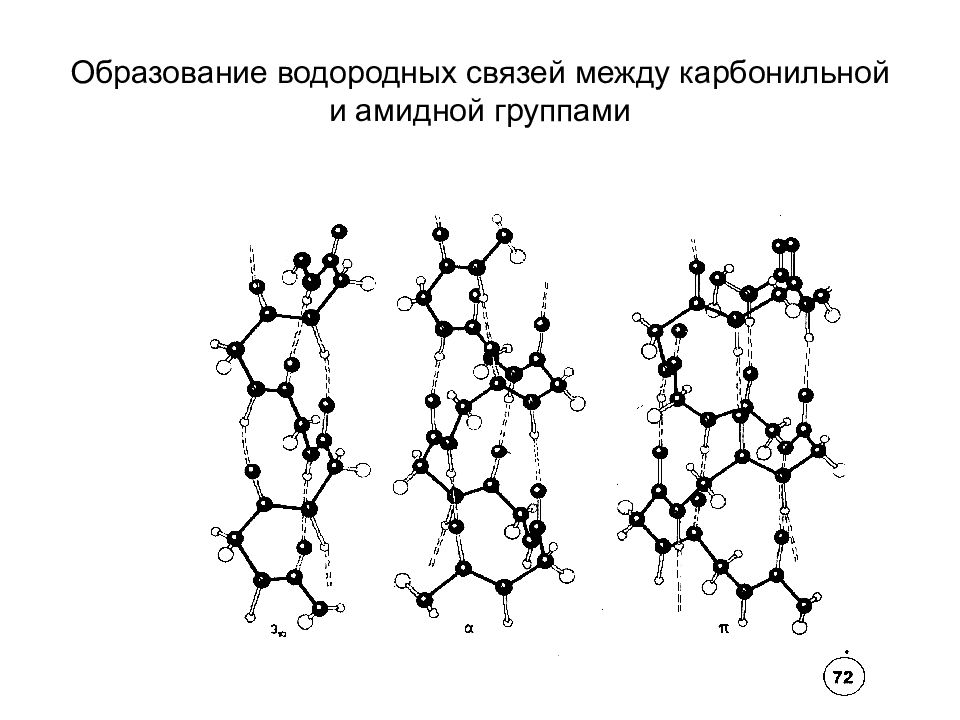
Вторичная структура белка - это упорядоченное строение полипептидных цепей, обусловленное образованием водородных связей между группами С=О и N-H разных аминокислот. Вторичная структура может быть регулярной – α - или β - спиралью и нерегулярной -складчатой структурой. В -спирали NH группа 1-ого аминокислотного остатка взаимодей-ствует с С=О группой (n-4)-ого аминокислотно-го остатка. На один виток -спирали с диаметром 10.1Å приходится 3,6 аминокислотных остатков. Период идентичности регулярной -спирали - 18 аминокислот (5 витков).
Слайд 65
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Вторичная структура – α -спираль )
Слайд 67
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Вторичная структура – β-складчатые структуры)
Слайд 68
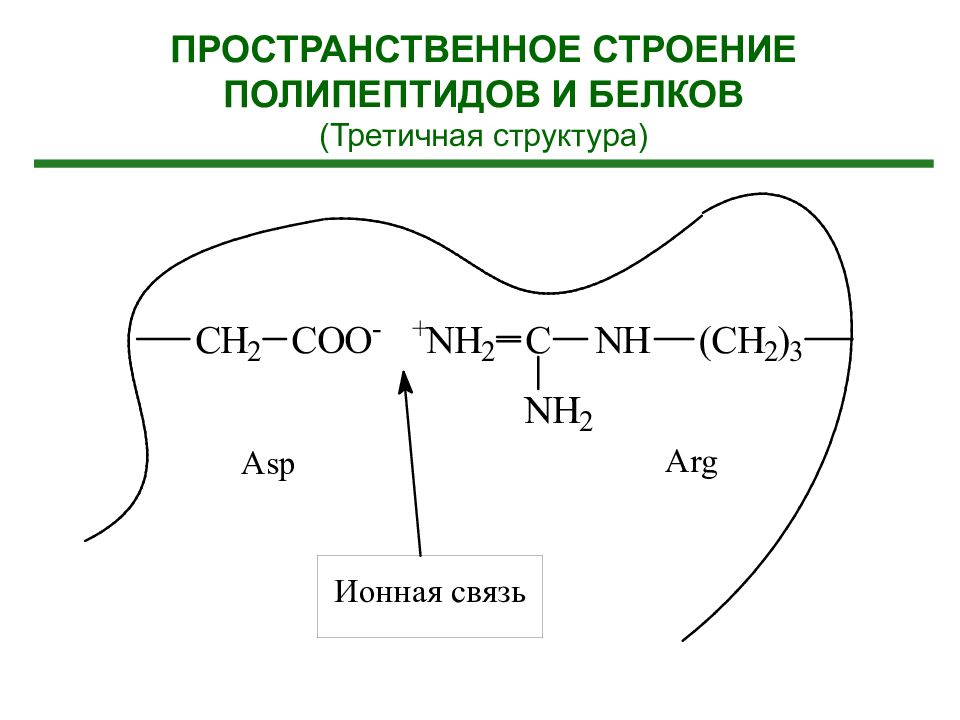
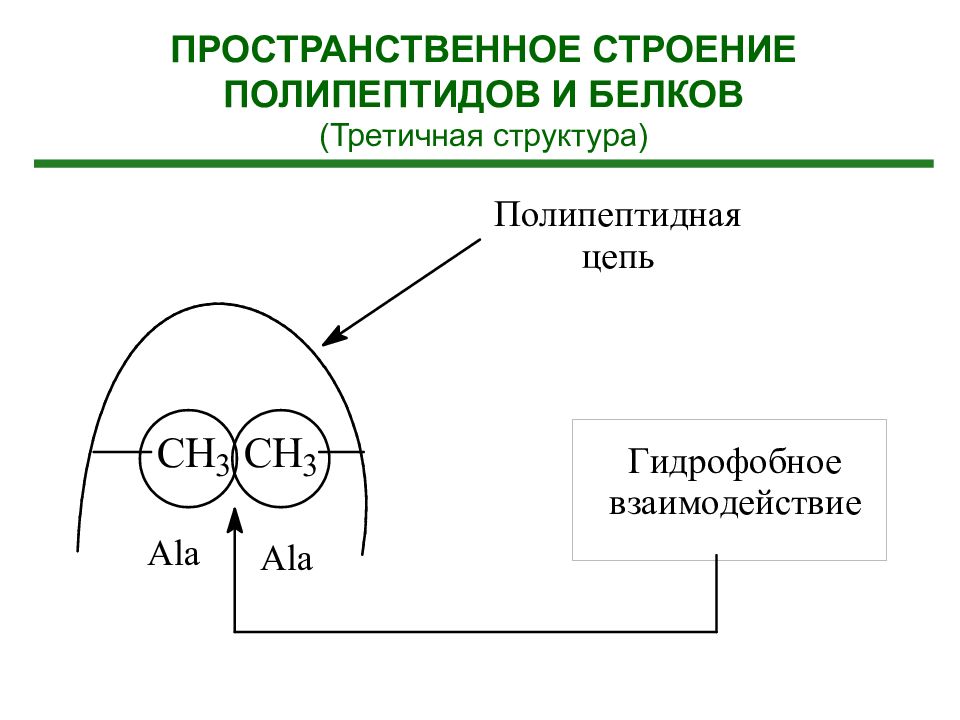
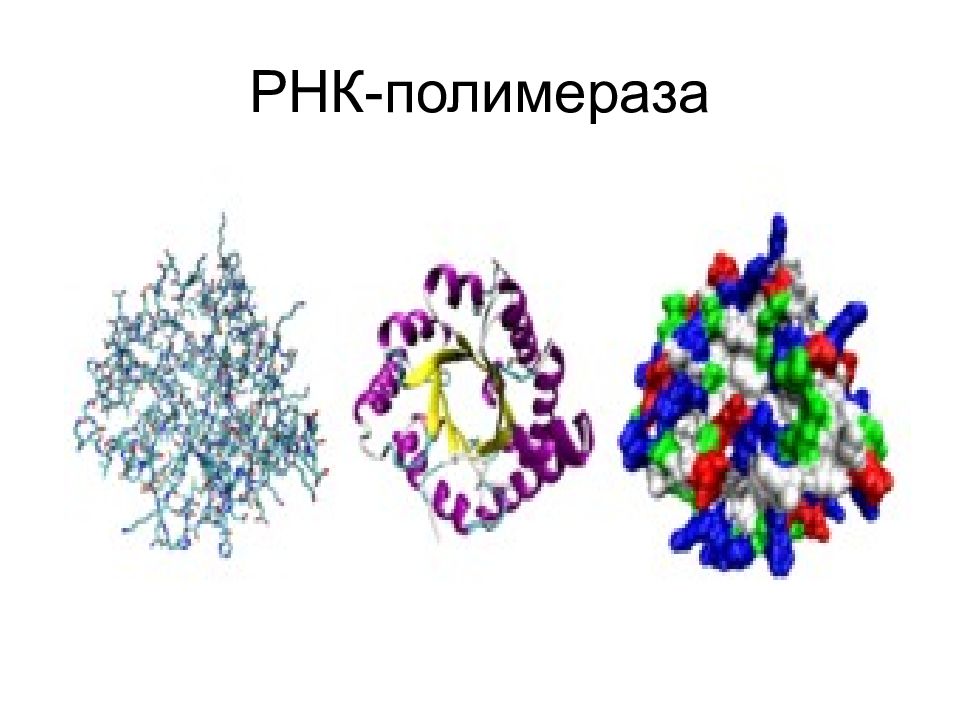
Третичная структура белка - расположение элементов вторичной структуры (альфа-спиралей) в пространстве относительно друг друга (пространственная конформация полипептида) (формирование глобулы)
Слайд 69: Что же заставляет белки сворачиваться?
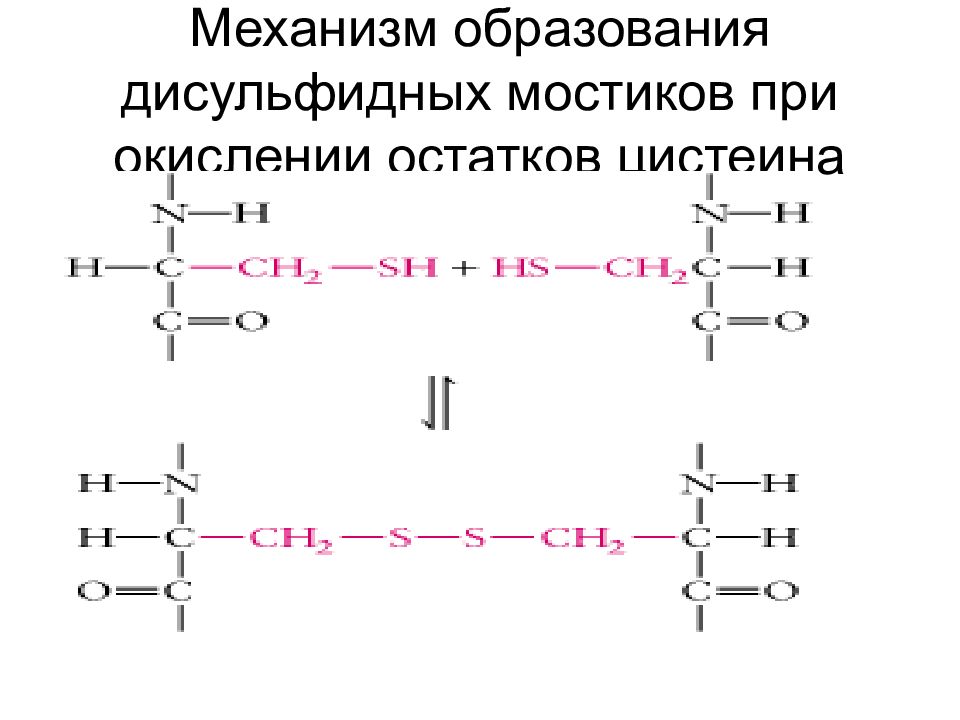
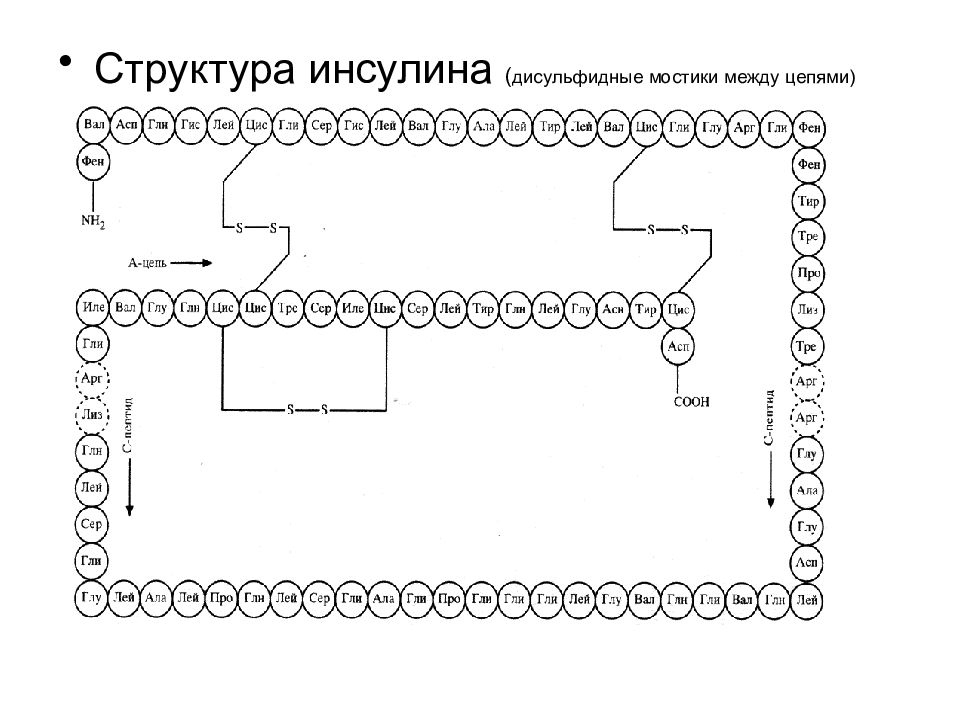
Гидрофобные взаимодействия. Существуют полярные и неполярные аминокислоты. В водном окружении гидрофобные (неполярные) аминокислоты прячутся внутрь спирали, образуя структуру с минимальной потенциальной энергией. Ионные взаимодействия. Заряженные разноименные остатки аминокислотные остатки притягиваются друг к другу, а разноименные – отталкиваюися. Наличие гидрофобных или заряженных участков в полипептидной цепи, определяет то, как белок свернется. Ковалентные связи между остатками двух цистеинов (дисульфидные мостики), образующиеся а счет окисления аминокислоты цистеина. Водородные связи. Участвуют все аминокислоты, имеющие гидроксильные, амидные или карбоксильные группы.
Слайд 70
Третичная структура полностью задается первичной структурой белка Определяющими являются гидрофобные взаимодействия аминокислот в силу их многочисленности. Гидрофобное ядро существует у большинства белков. На поверхности третичной структуры белка находятся, как правило – SH –группы цистеина.
Слайд 71: Механизм образования дисульфидных мостиков при окислении остатков цистеина
Слайд 77: Белок при попадании в водный раствор принимает ту конформацию, в которой он должен работать. Если в первичной структуре белков имеются нарушения, то белки сворачиваются неправильно, то это может иметь катастрофические последствия. ПРИОННЫЕ БЕЛКИ
(Болезнь -коровье бешенство - губчатая энцефалопатия) Только в Англии в 2005 г. было уничтожено 12 млн., в 2008 – 4 млн. коров. Коровье бешенство вызывается не вирусом и не бактерией, а особым клеточным агентом – неправильно свернутым белком. Это происходит потому, что белки, которые в норме в клетке взаимодействовали бы с этим белком, не могут этого сделать, так как он свернут неправильно, и поэтому клетка начинает неправильно функционировать.
Слайд 78
У людей есть аналог болезни коровьего бешенства. Это заболевание куру. Оно описано у народов, имеющих привычку съедать мозги умерших предков (из уважения к последним). В них как раз и находились инфекционные белки. Известны наследственные заболевания, обусловленные мутацией по 1 или 2 аминокислотам. Серповидно-клеточная анемия как пример влияния первичной структуры на третичную и четвертичную. В эритроцитах содержится гемоглобин - комплекс белка глобина с небелковой железосодержащей частью - гемом. Глобин состоит из двух альфа- и двух бета- полипептидных цепей. В белковой части глогина 574 аминокислоты, в результате мутации заменяется 2 аминокислоты. Такой гемоглобин теряет растворимость, образуется волокнистый осадок, деформирующий эритроцит. Дети - рецессивные гомозиготы по такому аллелю не доживают до двух лет (в популяции – 25%). У гетерозигот 85% нормальных и 15% дефектных эритроцитов.
Слайд 80
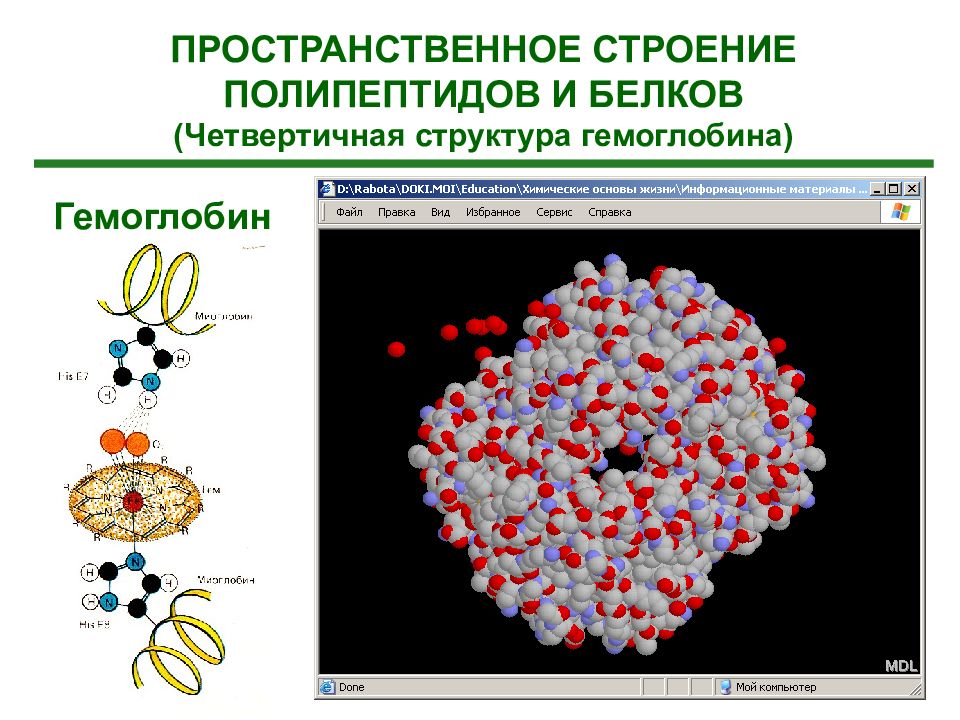
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ПОЛИПЕПТИДОВ И БЕЛКОВ (Четвертичная структура гемоглобина) Гемоглобин
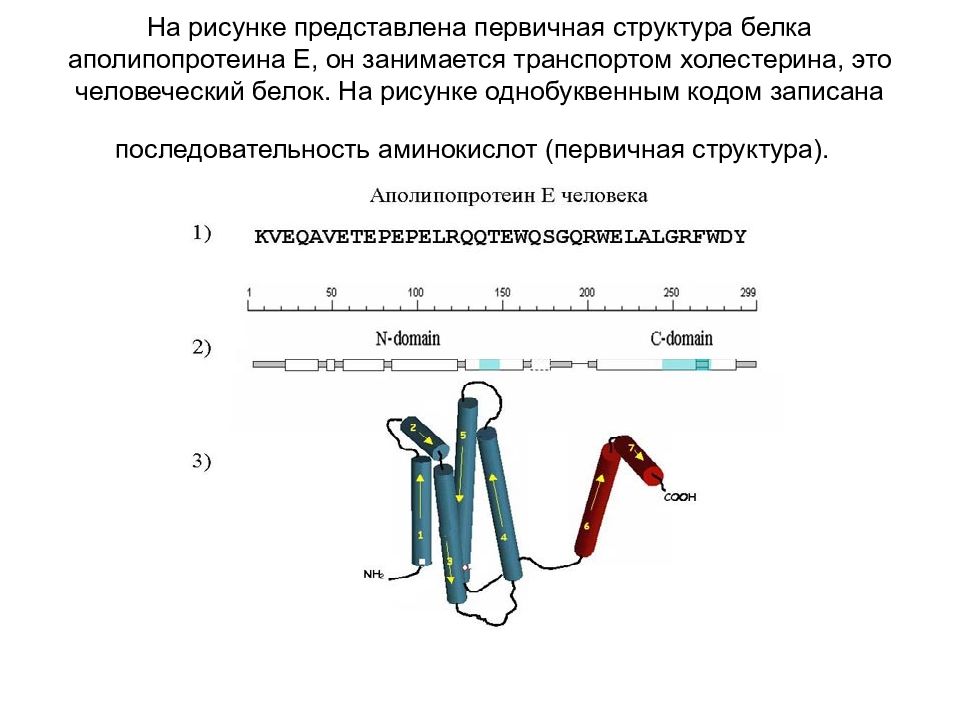
Слайд 81: На рисунке представлена первичная структура белка аполипопротеина Е, он занимается транспортом холестерина, это человеческий белок. На рисунке однобуквенным кодом записана последовательность аминокислот (первичная структура)
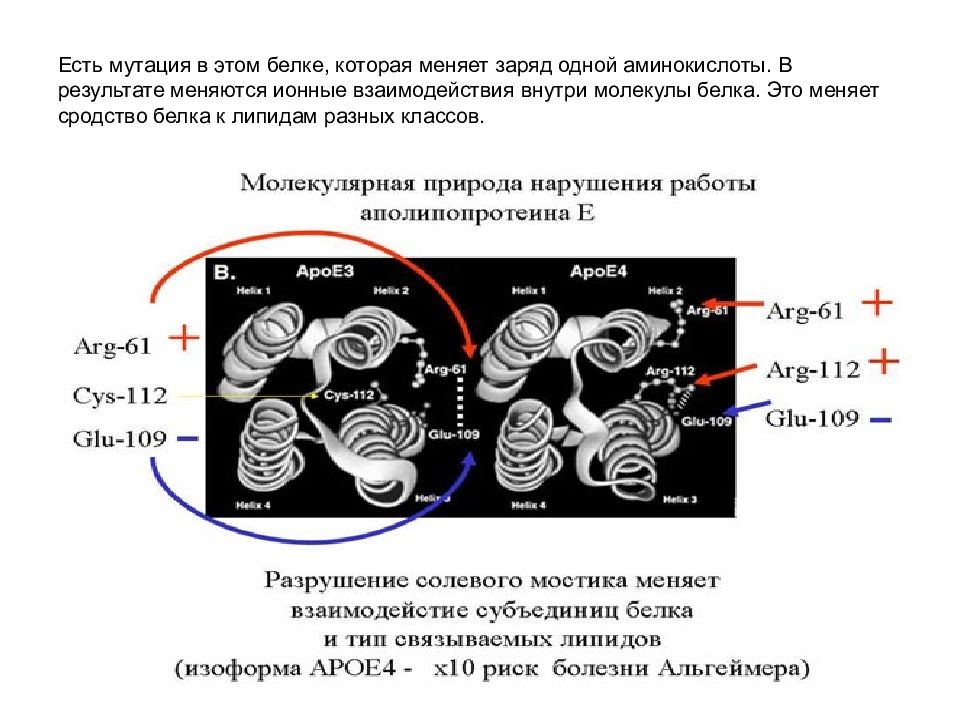
Слайд 82: Есть мутация в этом белке, которая меняет заряд одной аминокислоты. В результате меняются ионные взаимодействия внутри молекулы белка. Это меняет сродство белка к липидам разных классов
Слайд 83
Функция аполипопротеида заключается в переносе липидов и холестерина. У людей с такой мутацией более высокий уровень холестерина и выше уровень риска развития старческого слабоумия. Примерно у 15% европейцев и американцев отмечается такая мутация, у бушменов же это число достигает 40%, но старческого слабоумия у них не бывает, так как у них низко холестериновая диета и много физических нагрузок. У людей же с западной «диетой» - проявляются последствия мутации - возникает гиперхолестеринемия.
Слайд 85: Кристаллы различных белков, выращенные на космической станции «Мир» и во время полётов шаттлов НАСА. Высокоочищенные белки при низкой температуре образуют кристаллы, которые используют для получения модели данного белка
Слайд 86
Расшифровка белка- крайне трудоемкий процесс. На расшифровку гемоглобина потребовалось 26 лет. В настоящее время ежегодно расшифровывают 60-70 белков, на это тратится 80-90 млд. долларов и усилия многих химиков, биохимиков и молекулярных биологов. Изучая первичную структуру белков можно определить участок ДНК, кодирующий определенный белок.
Слайд 87
Образование эфиров глицин — кристаллическое вещество с Т пл =292°С метиловый эфир глицина — жидкость с Т кип =130°С. Э. Фишер (1901) химические свойства аминокислот
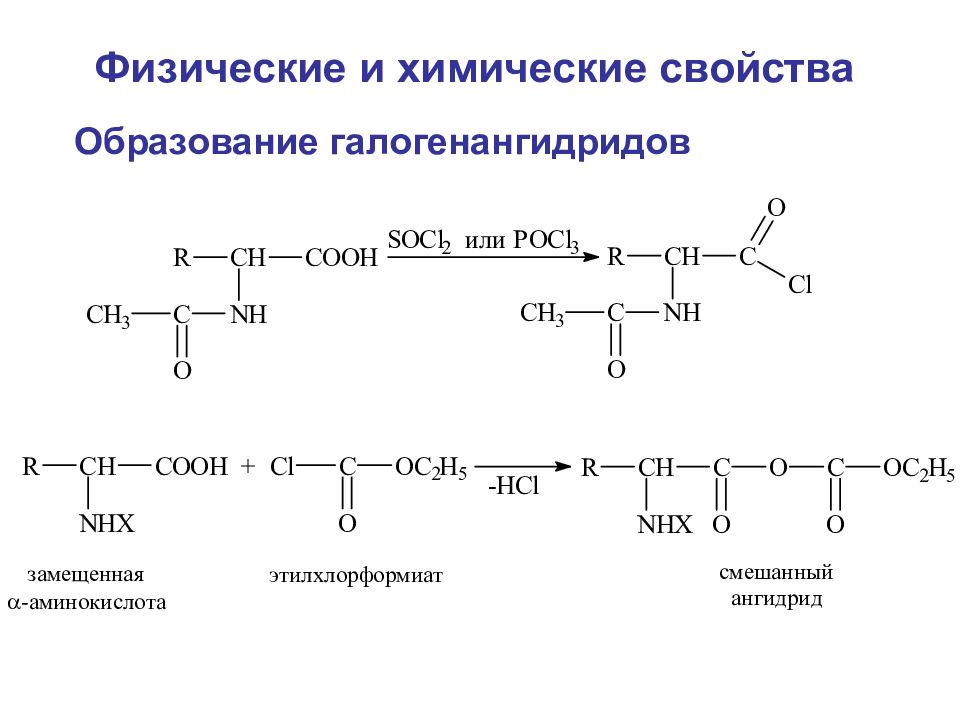
Слайд 89
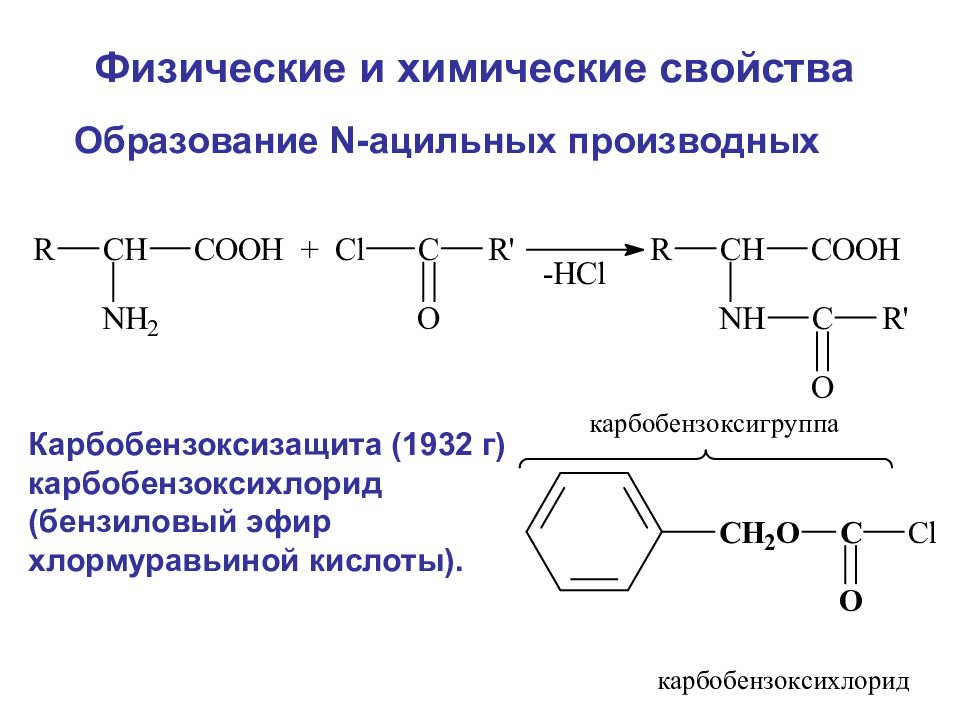
Образование N-ацильных производных Карбобензоксизащита (1932 г) карбобензоксихлорид (бензиловый эфир хлормуравьиной кислоты). Физические и химические свойства
Слайд 90
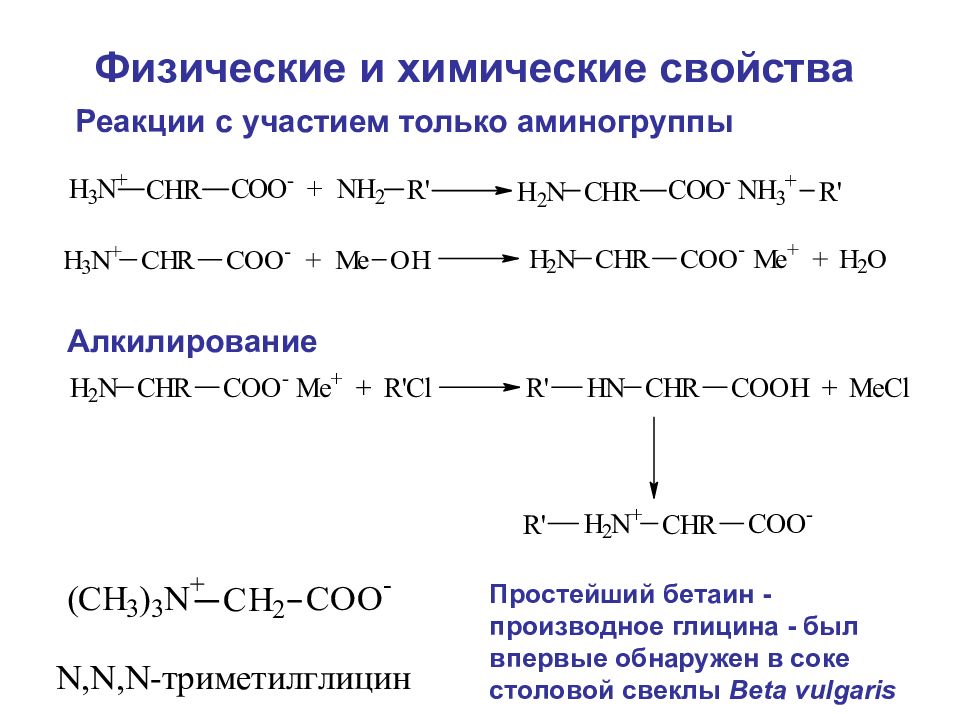
Реакции с участием только аминогруппы Алкилирование Простейший бетаин - производное глицина - был впервые обнаружен в соке столовой свеклы Beta vulgaris Физические и химические свойства
Слайд 91
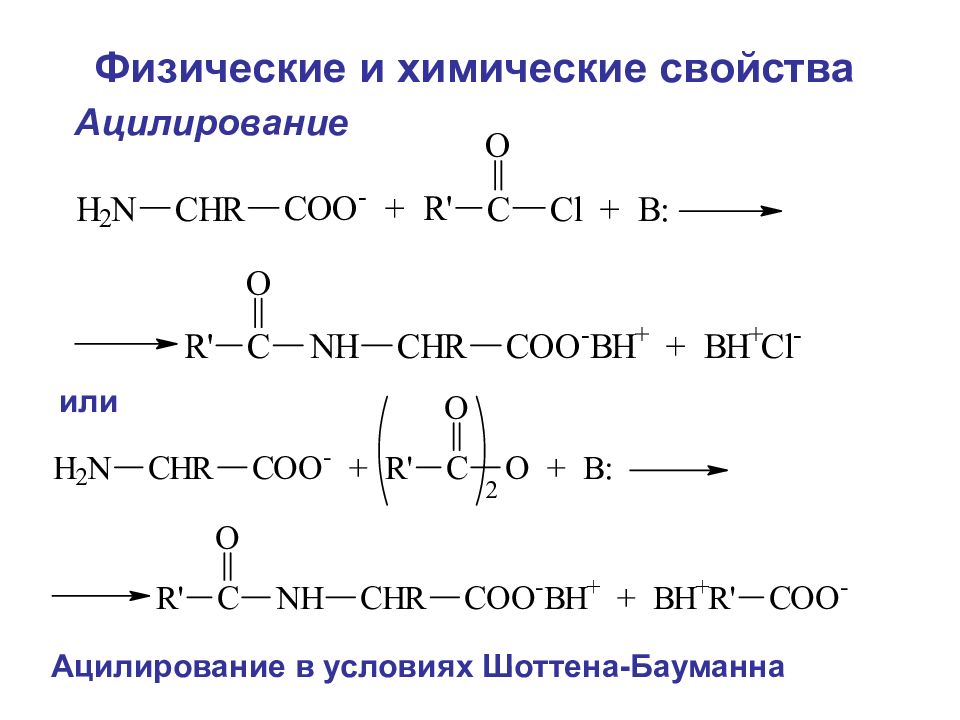
Ацилирование Ацилирование в условиях Шоттена-Бауманна или Физические и химические свойства
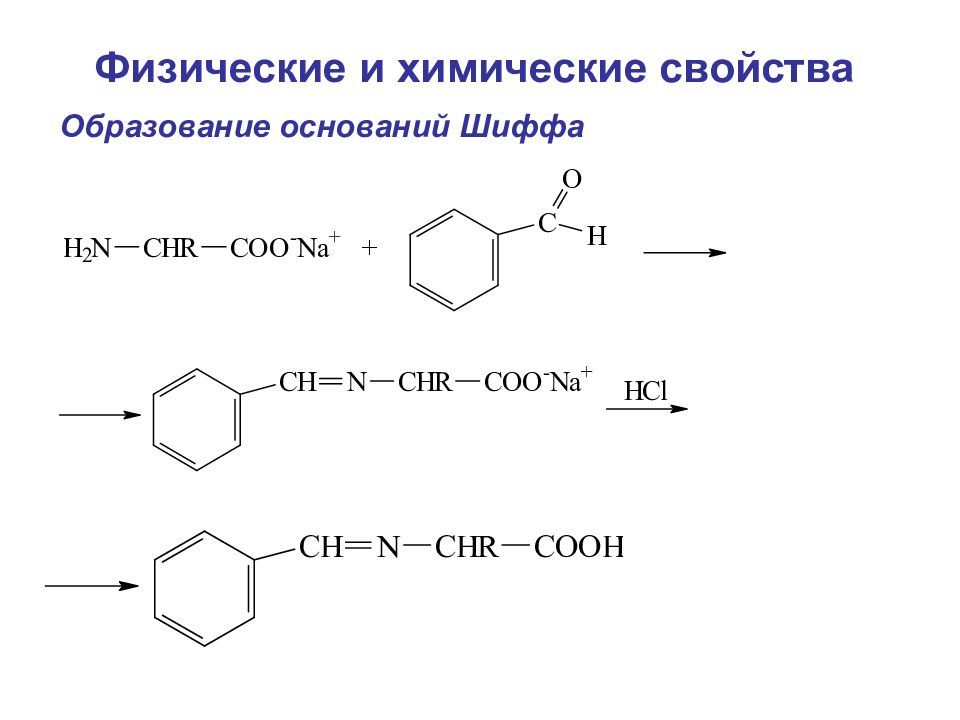
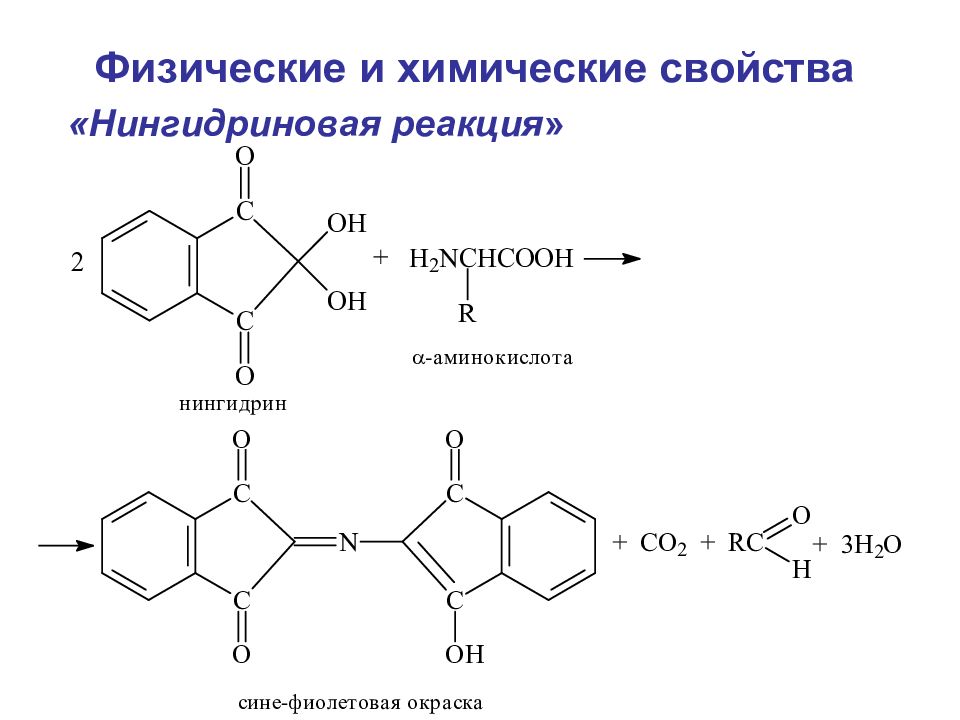
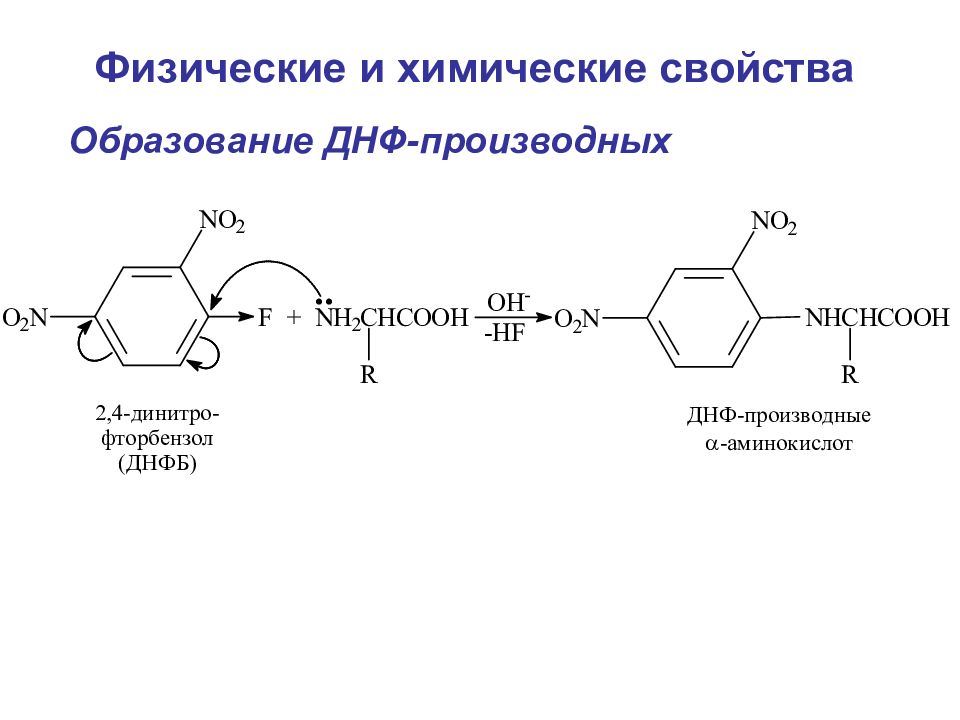
Слайд 94
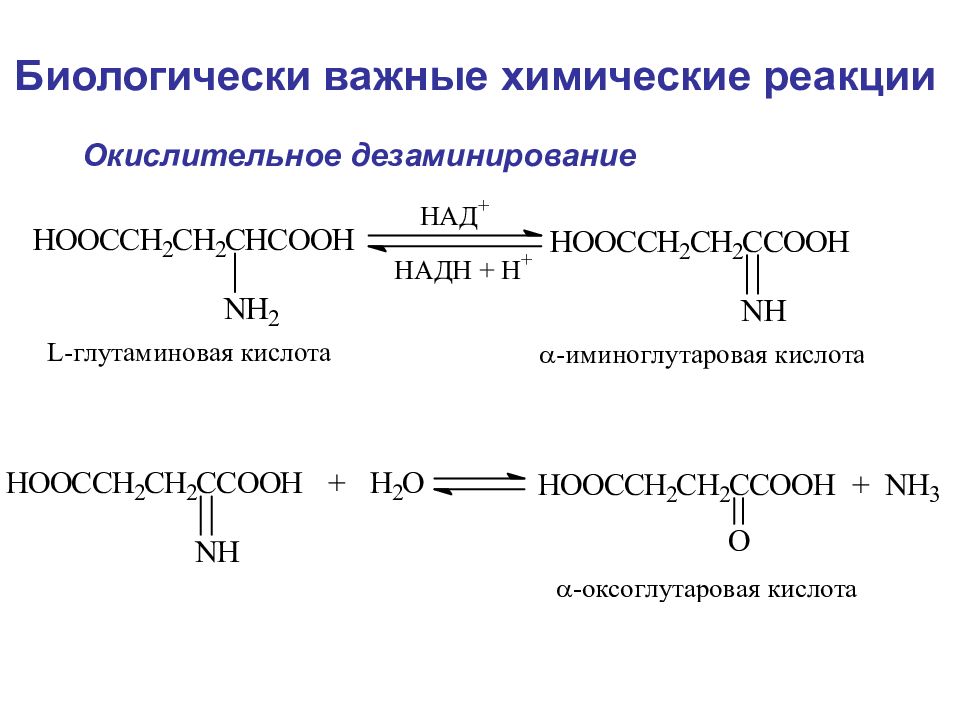
Дезаминирование аминокислот Метод Ван-Слайка А. В нутримолекулярное дезаминирование (таким образом у некоторых микроорганизмов и высших растений аспарагиновая кислота превращается в фумаровую) Физические и химические свойства
Слайд 95
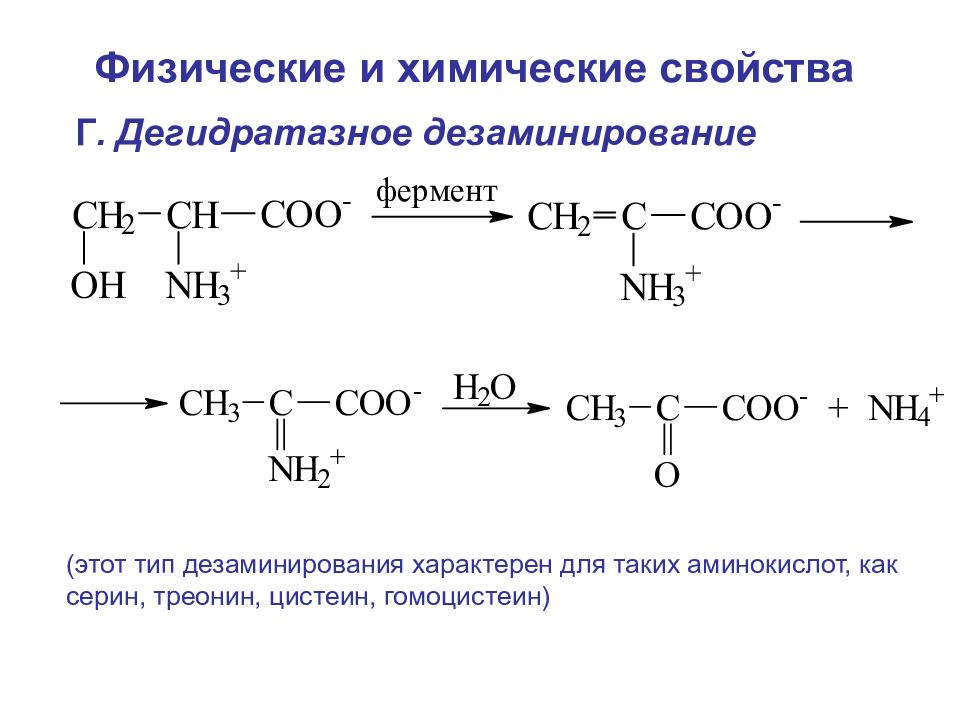
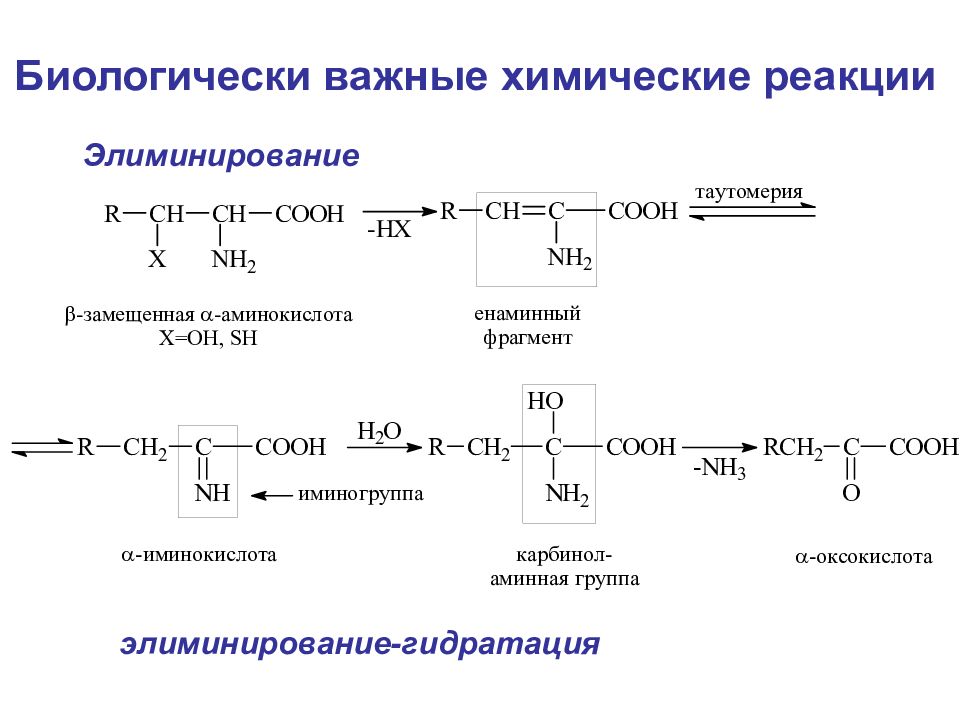
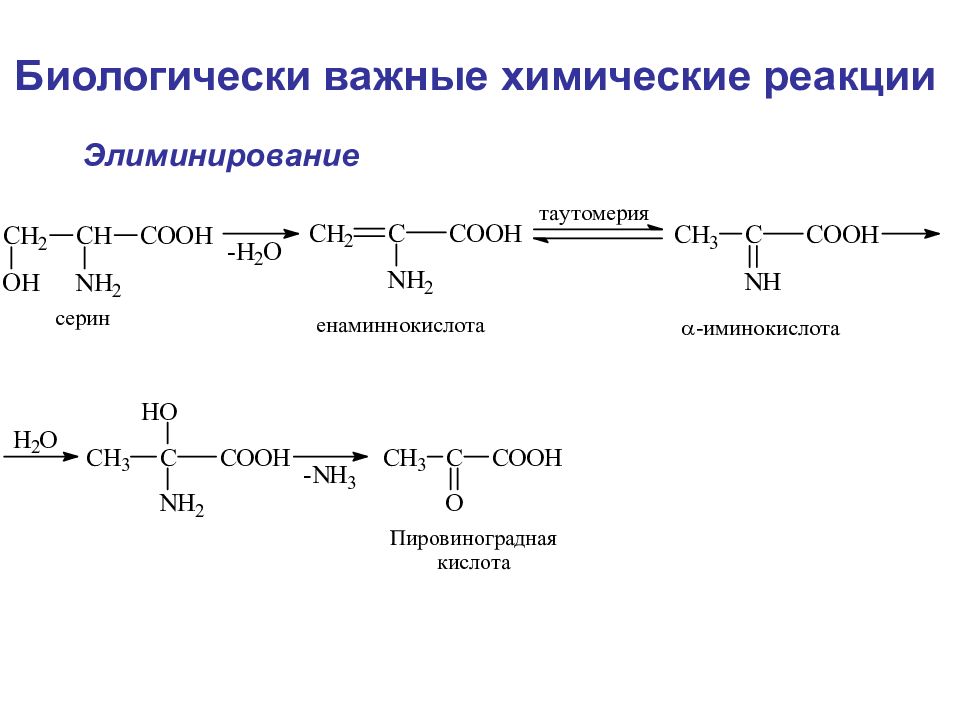
Г. Дегидратазное дезаминирование (этот тип дезаминирования характерен для таких аминокислот, как серин, треонин, цистеин, гомоцистеин) Физические и химические свойства
Слайд 97
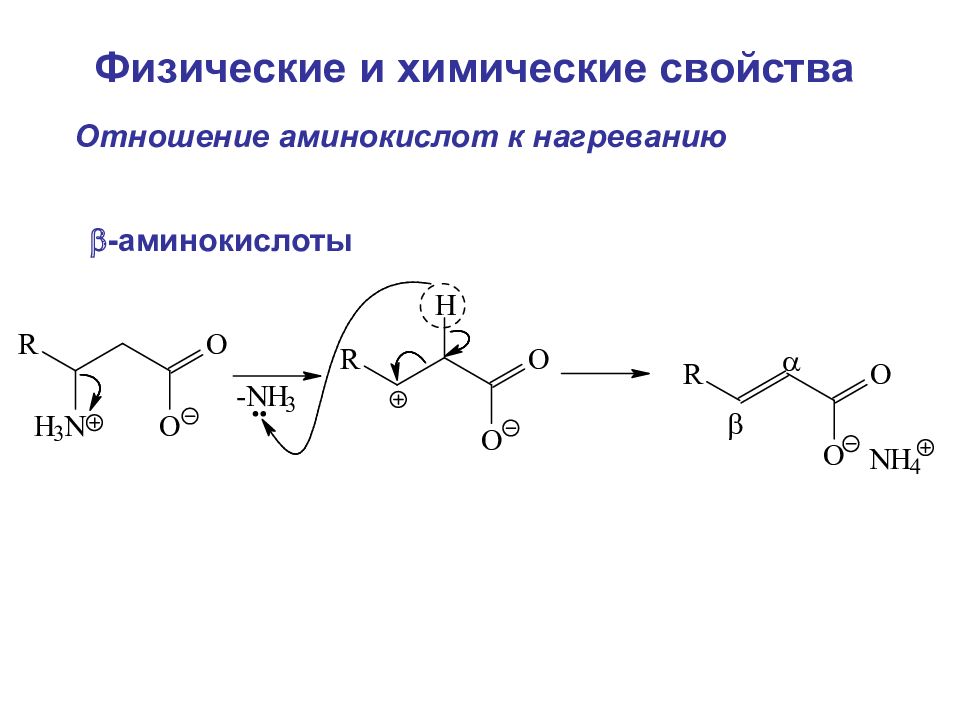
Отношение аминокислот к нагреванию -аминокислоты Физические и химические свойства
Слайд 98
Отношение аминокислот к нагреванию -аминокислоты Физические и химические свойства
Слайд 99
Отношение аминокислот к нагреванию -аминокислоты Физические и химические свойства
Слайд 100
Отношение аминокислот к нагреванию -аминокислоты Физические и химические свойства
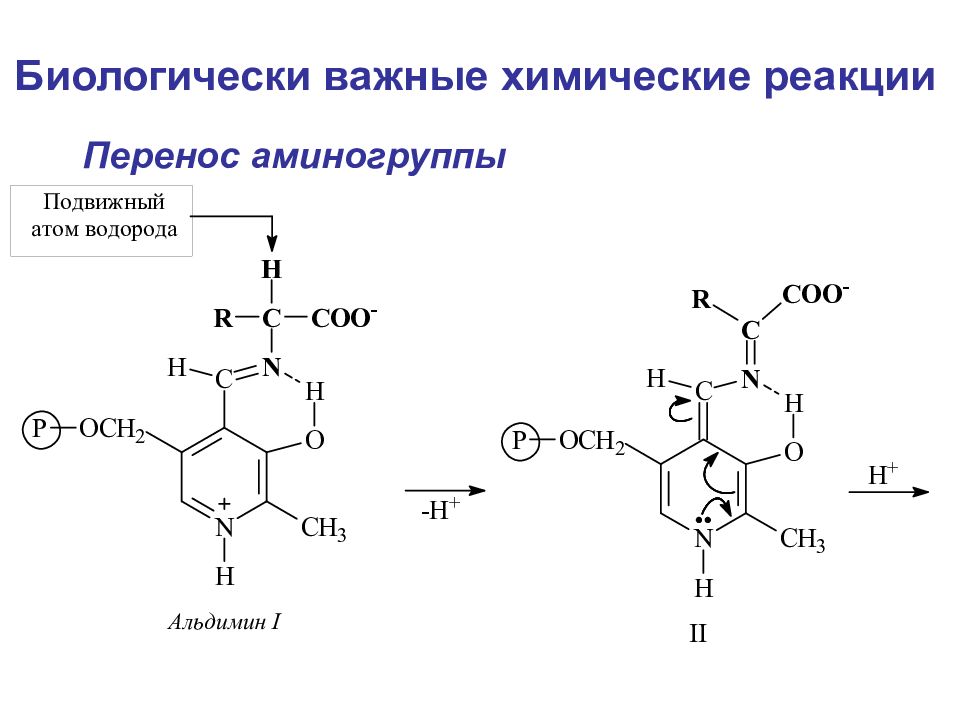
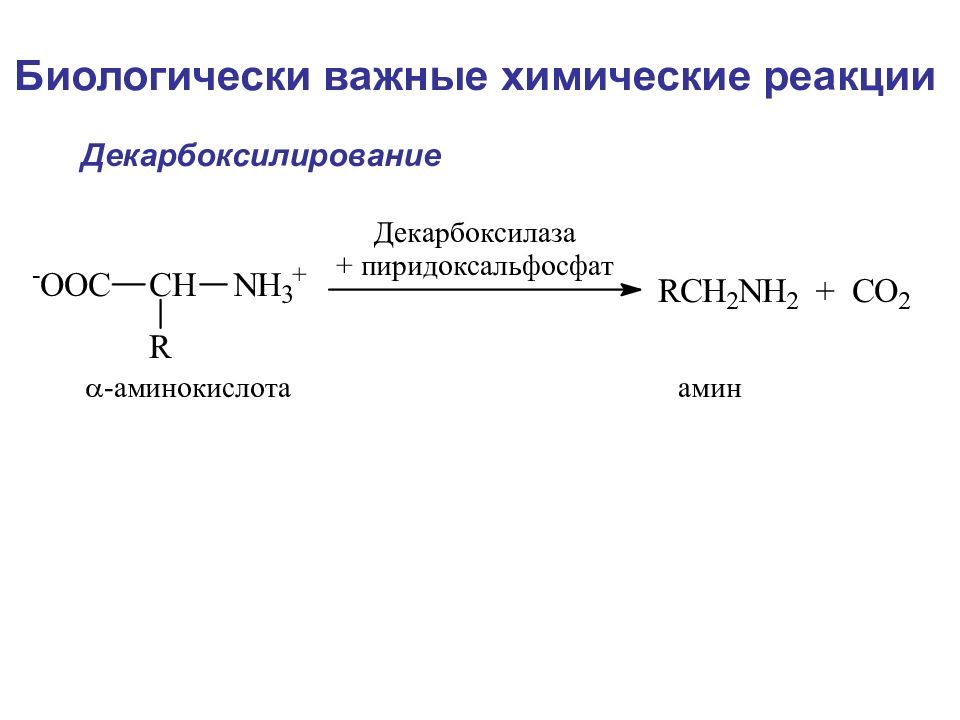
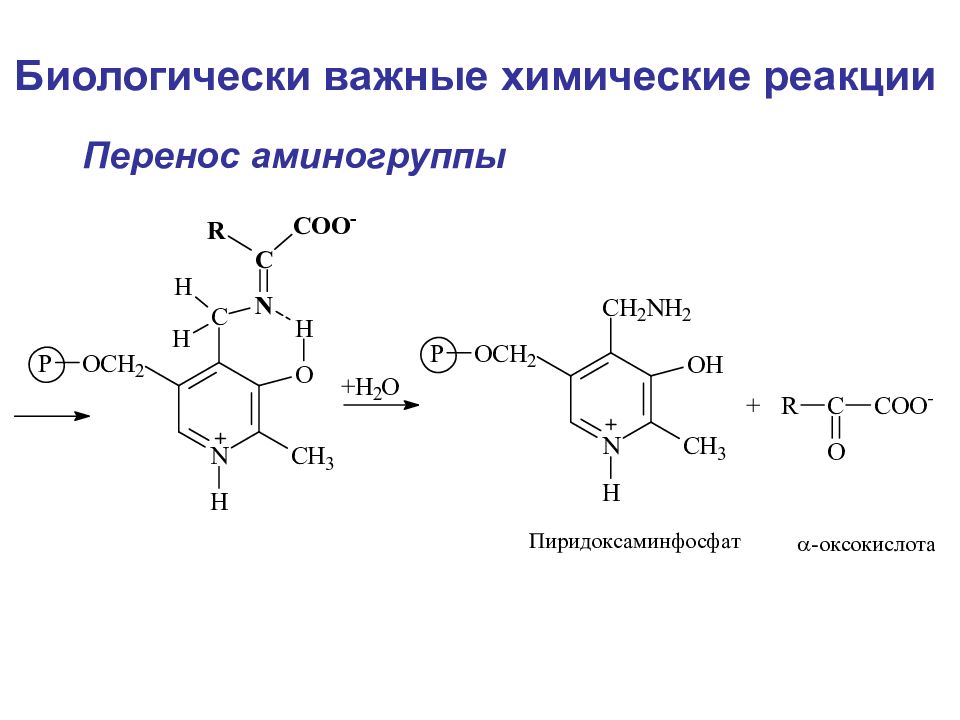
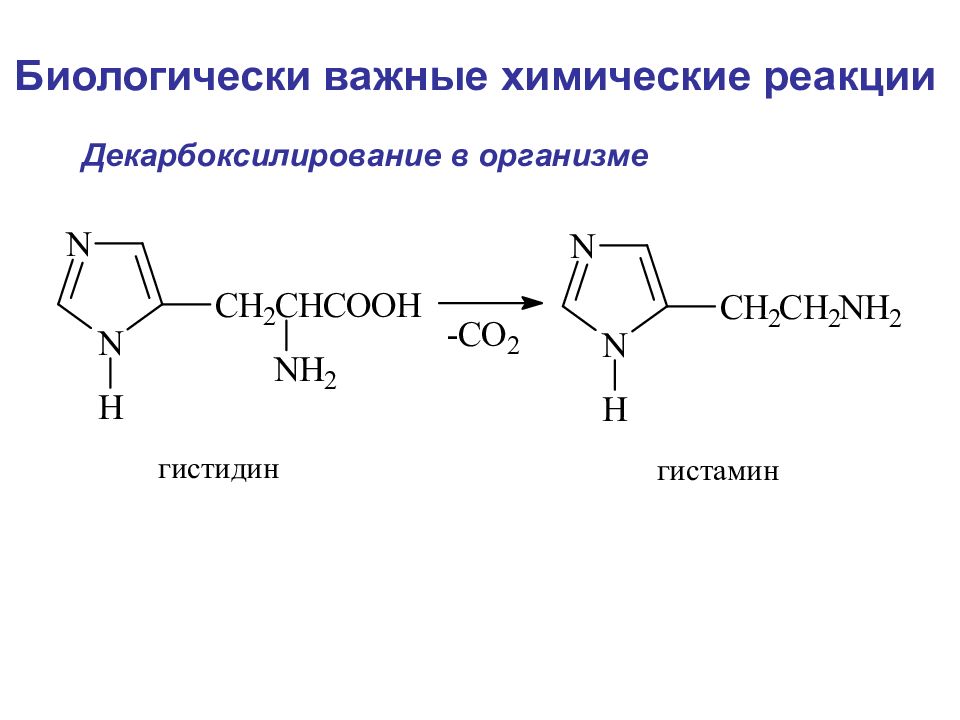
Слайд 108
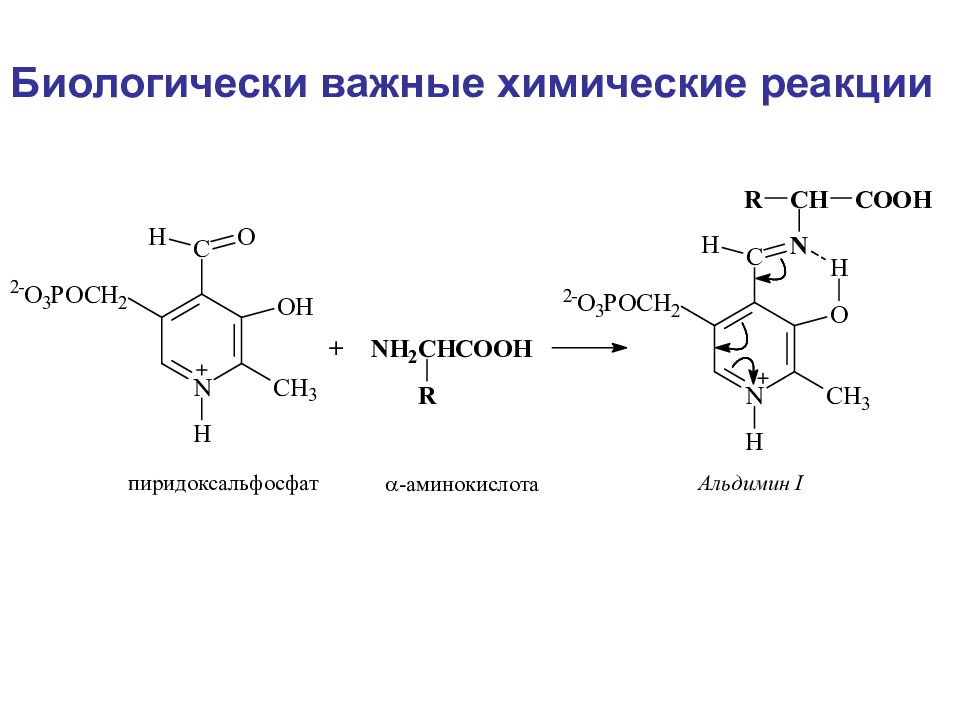
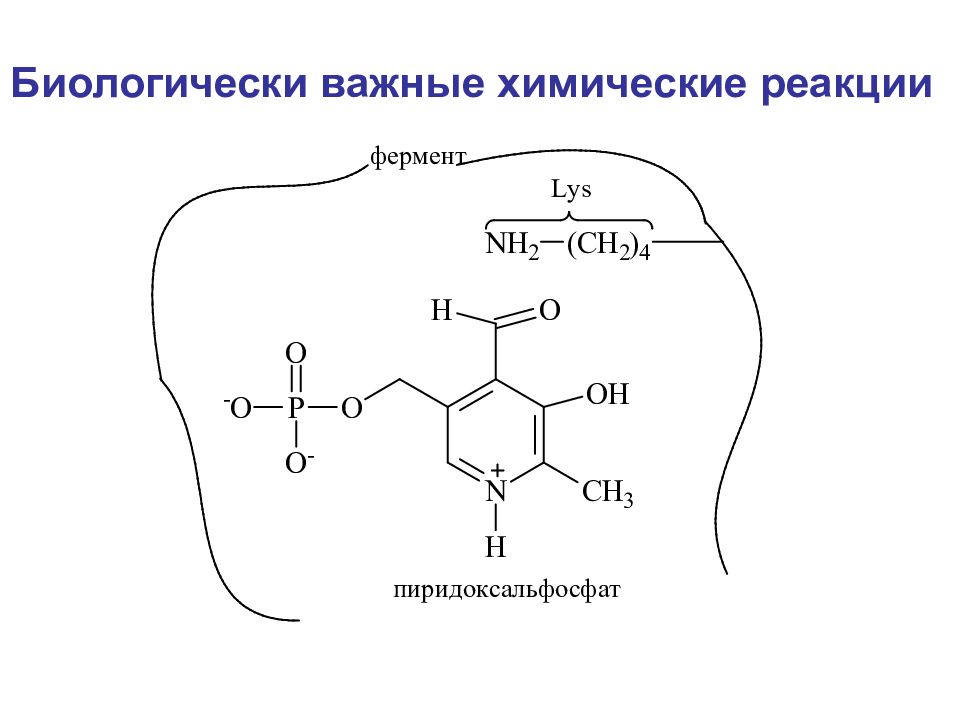
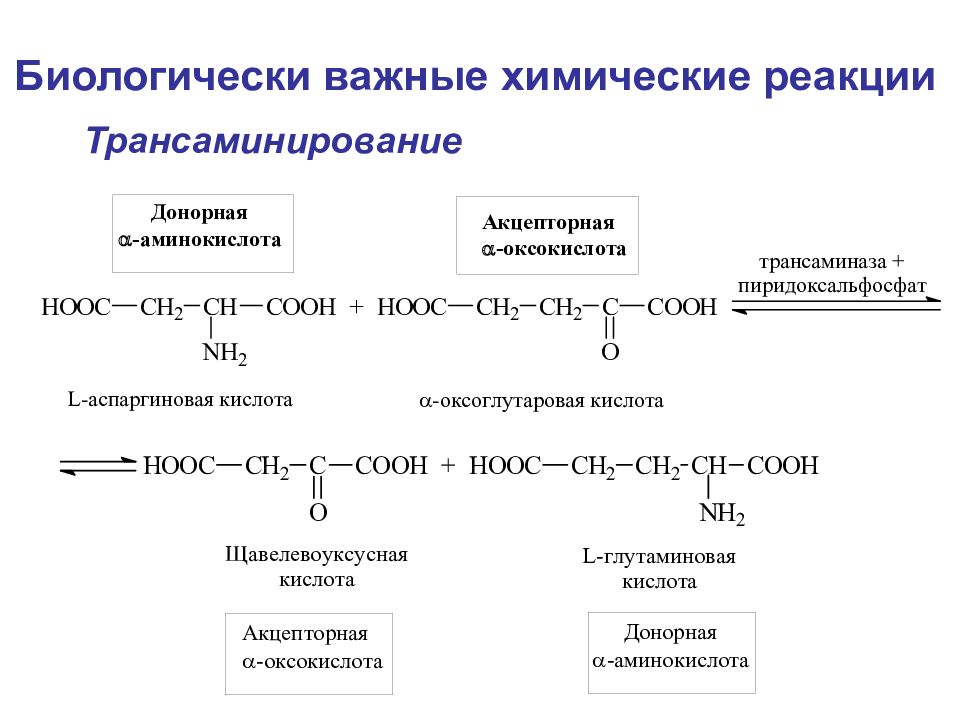
Биологически важные химические реакции Элиминирование элиминирование-гидратация