Первый слайд презентации: Введение в специальность
Геологический факультет МГУ им. М.В.Ломоносова Кафедра геологии и геохимии горючих ископаемых
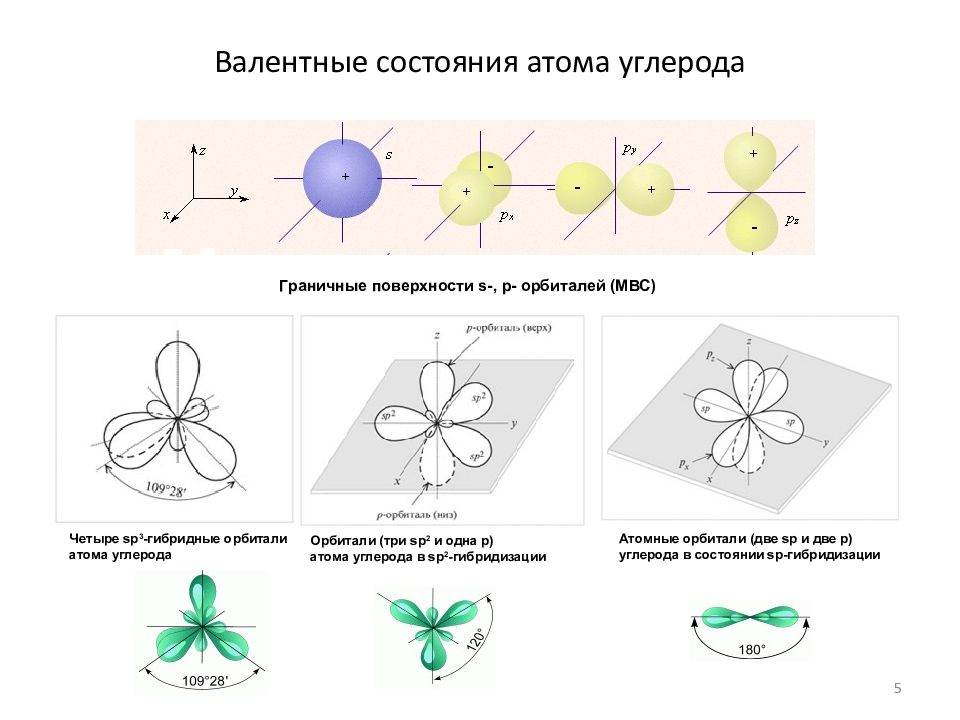
Слайд 5: Валентные состояния атома углерода
Граничные поверхности s-, p- орбиталей (МВС) Четыре sp 3 -гибридные орбитали атома углерода Орбитали (три sp 2 и одна р) атома углерода в sp 2 -гибридизации Атомные орбитали (две sp и две р) углерода в состоянии sp-гибридизации 5
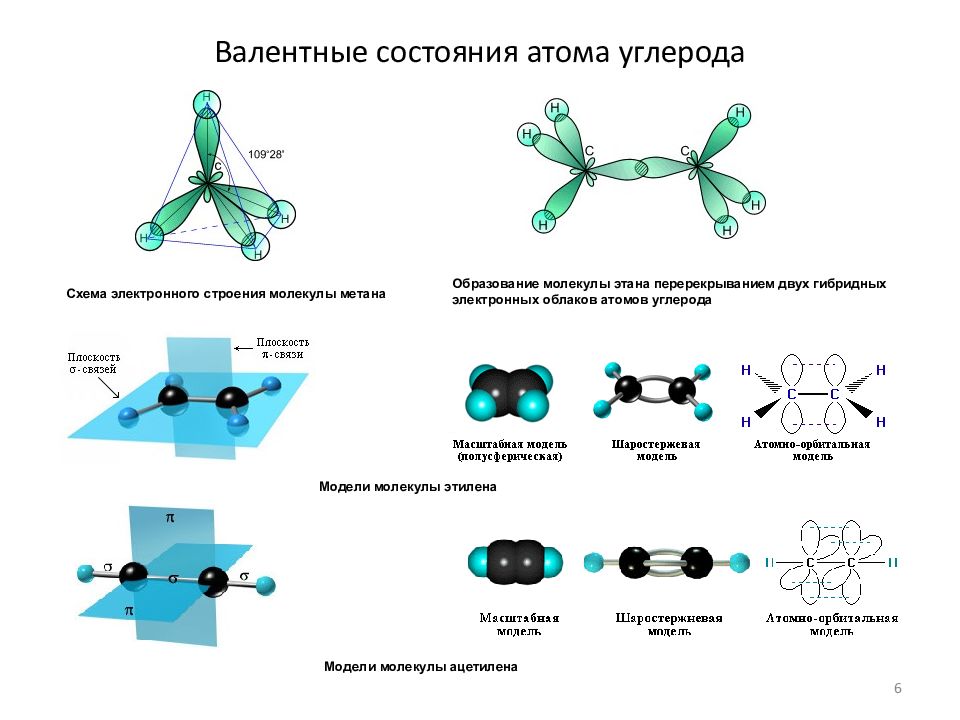
Слайд 6: Валентные состояния атома углерода
Схема электронного строения молекулы метана Образование молекулы этана перерекрыванием двух гибридных электронных облаков атомов углерода Модели молекулы этилена Модели молекулы ацетилена 6
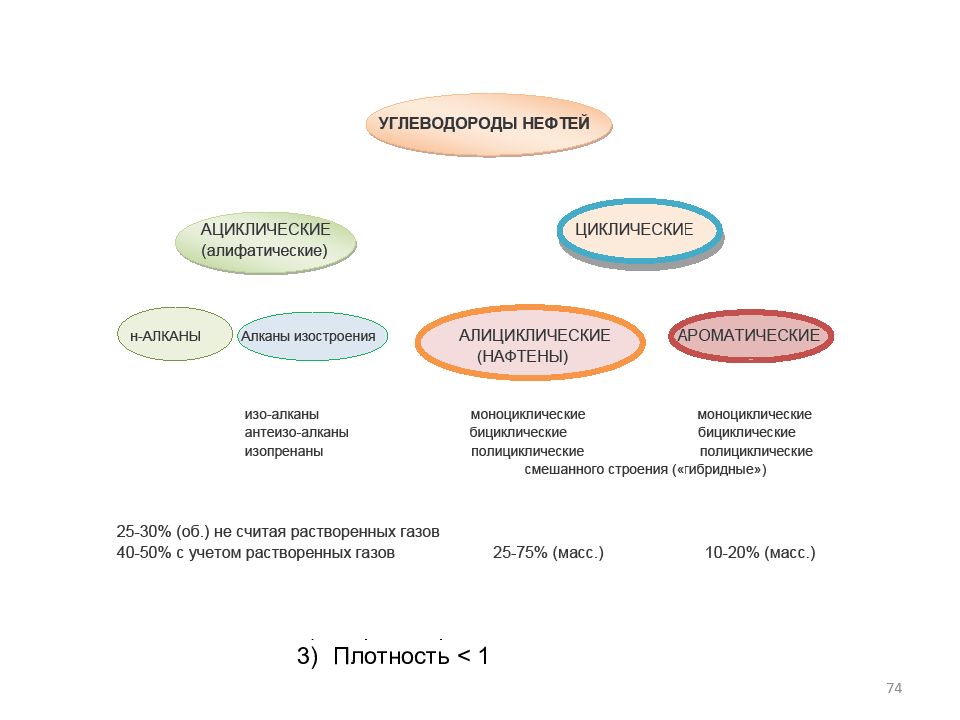
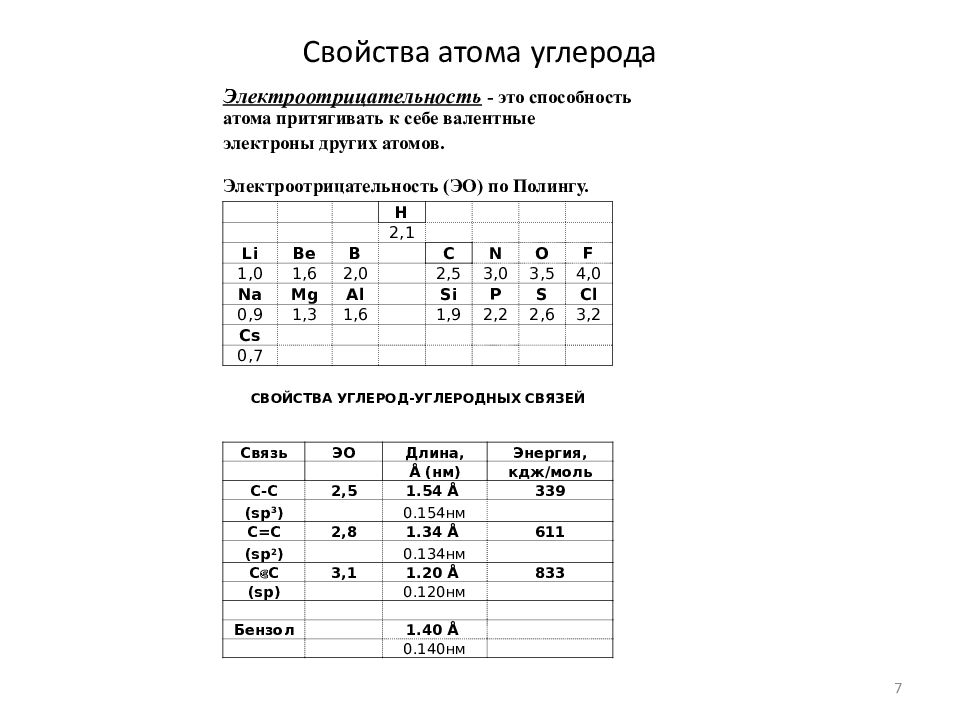
Слайд 7: Свойства атома углерода
H 2,1 Li Be B C N O F 1,0 1,6 2,0 2,5 3,0 3,5 4,0 Na Mg Al Si P S Cl 0,9 1,3 1,6 1,9 2,2 2,6 3,2 Cs 0,7 Электроотрицательность - это способность атома притягивать к себе валентные электроны других атомов. Электроотрицательность (ЭО) по Полингу. СВОЙСТВА УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ Связь ЭО Длина, Энергия, Å (нм) кдж/моль C-C 2,5 1.54 Å 339 (sp 3 ) 0.154нм C=C 2,8 1.34 Å 611 (sp 2 ) 0.134нм C є C 3,1 1.20 Å 833 (sp) 0.120нм Бензол 1.40 Å 0.140нм 7
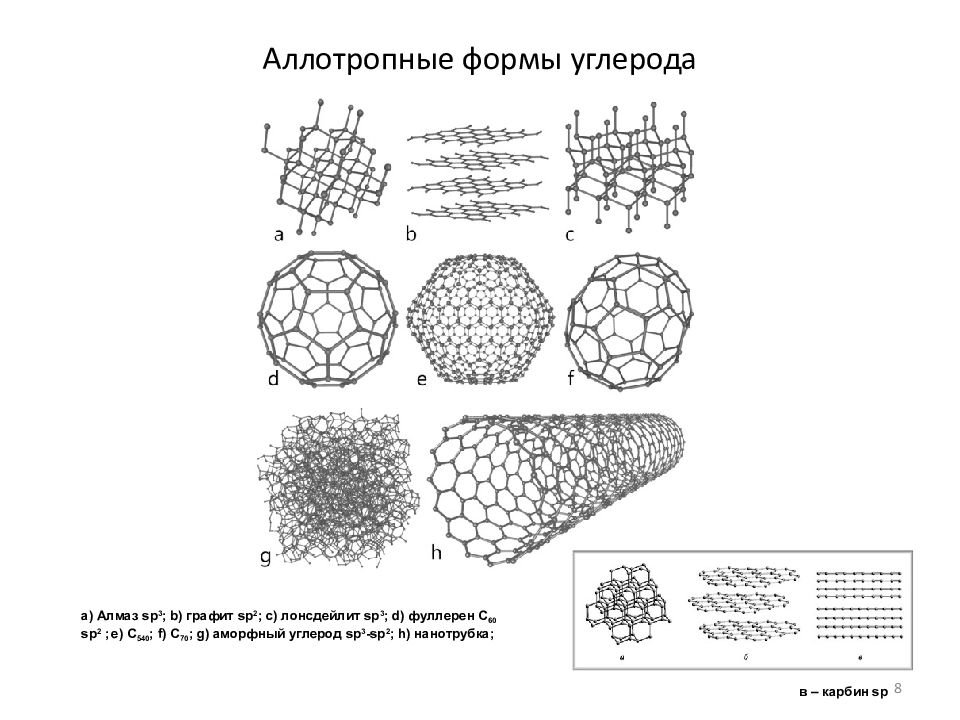
Слайд 8: Аллотропные формы углерода
a) Алмаз sp 3 ; b) графит sp 2 ; c) лонсдейлит sp 3 ; d) фуллерен С 60 sp 2 ; e) С 540 ; f) С 70 ; g) аморфный углерод sp 3 -sp 2 ; h) нанотрубка ; в – карбин sp 8
Слайд 10: Аллотропные формы углерода
Графен (sp 2 ) является двумерным кристаллом, состоящим из одиночного слоя атомов углерода, собранных в гексагональную решётку 10
Слайд 11: Аллотропные формы углерода
Фуллерен С 60 Фуллерен С 60 в кристаллической форме Чистый фуллерен С 60 в растворе толуола 11
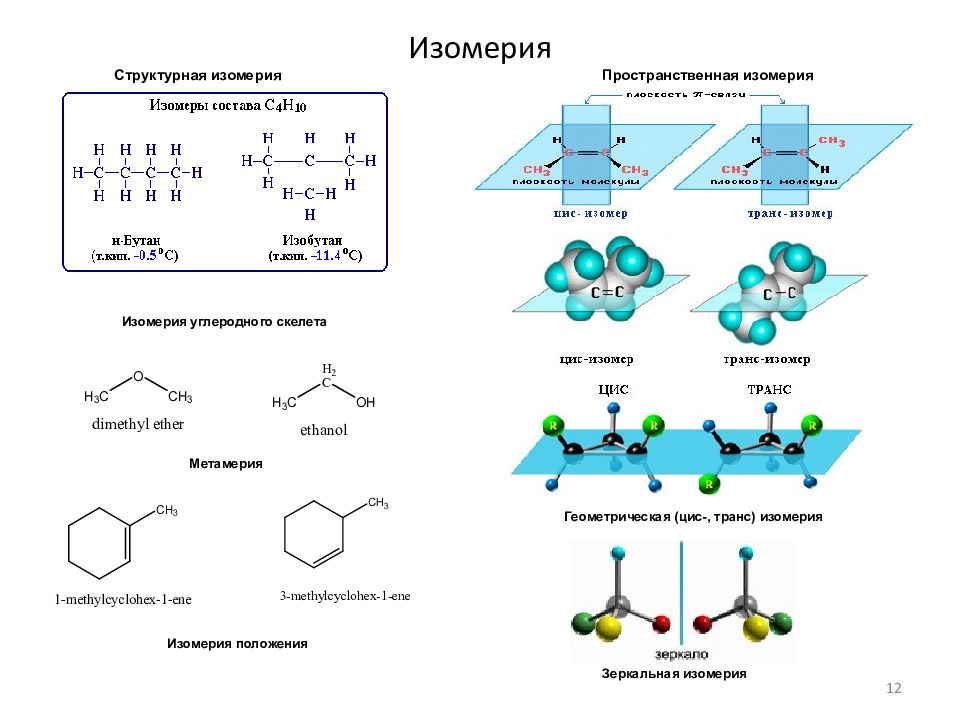
Слайд 12: Изомерия
Структурная изомерия Пространственная изомерия Зеркальная изомерия Изомерия углеродного скелета Геометрическая (цис-, транс) изомерия Метамерия Изомерия положения 12
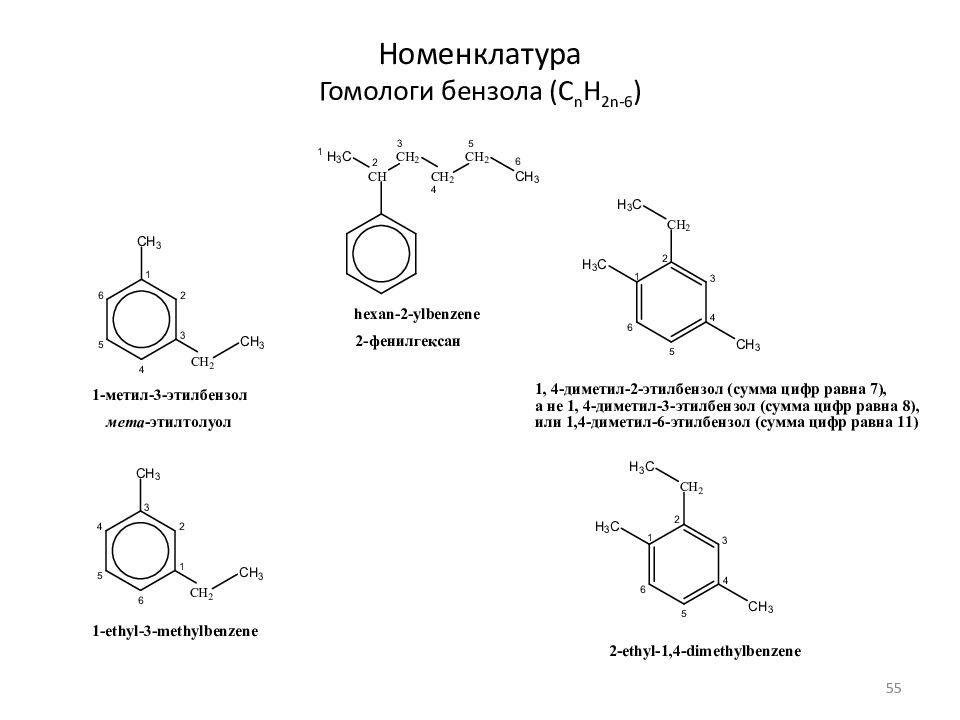
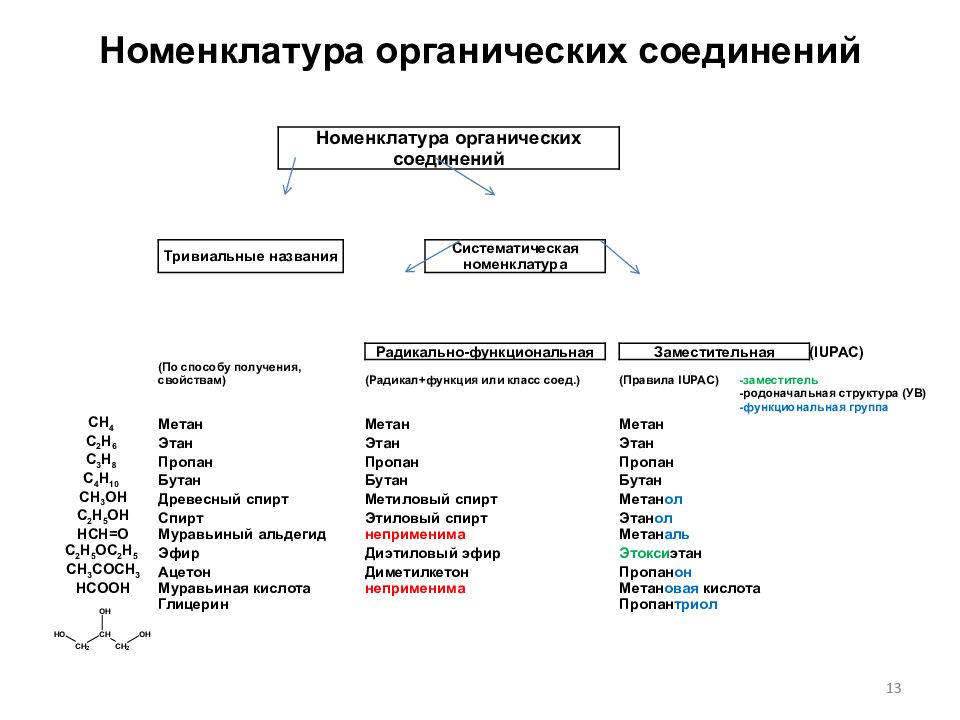
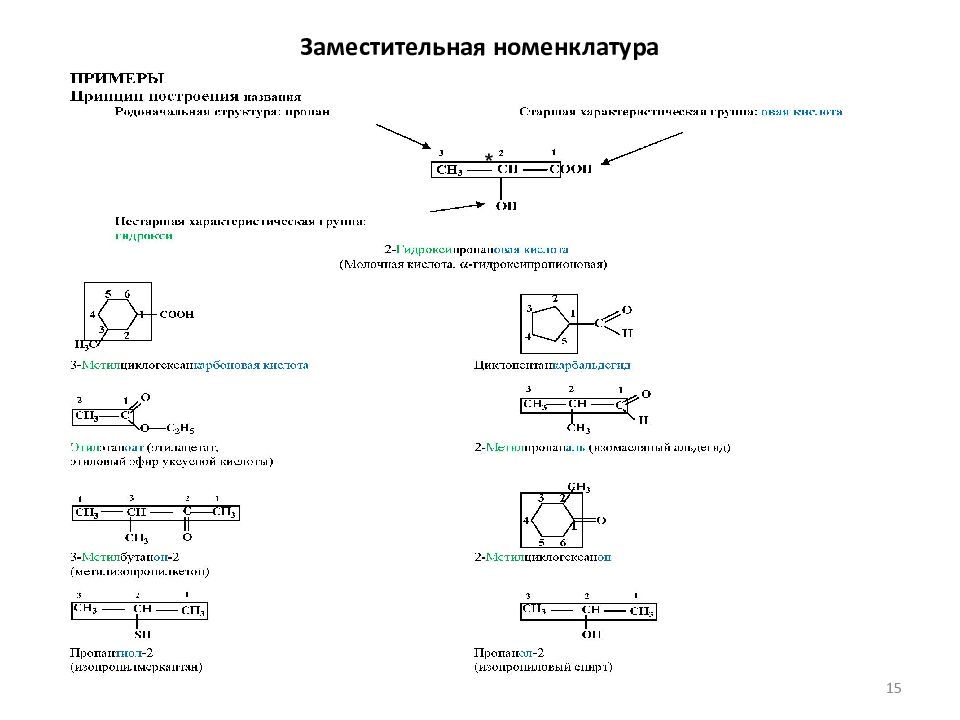
Слайд 13: Номенклатура органических соединений
Номенклатура органических соединений Тривиальные названия Систематическая номенклатура Радикально-функциональная Заместительная ( IUPAC) (По способу получения, свойствам) (Радикал+функция или класс соед.) (Правила IUPAC) -заместитель - родоначальная структура (УВ) -функциональная группа CH 4 Метан Метан Метан C 2 H 6 Этан Этан Этан C 3 H 8 Пропан Пропан Пропан C 4 H 10 Бутан Бутан Бутан CH 3 OH Древесный спирт Метиловый спирт Метан ол C 2 H 5 OH Спирт Этиловый спирт Этан ол HCH=O Муравьиный альдегид неприменима Метан аль C 2 H 5 OC 2 H 5 Эфир Диэтиловый эфир Этокси этан CH 3 COCH 3 Ацетон Диметилкетон Пропан он HC ОО H Муравьиная кислота неприменима Метан овая кислота Глицерин Пропан триол 13
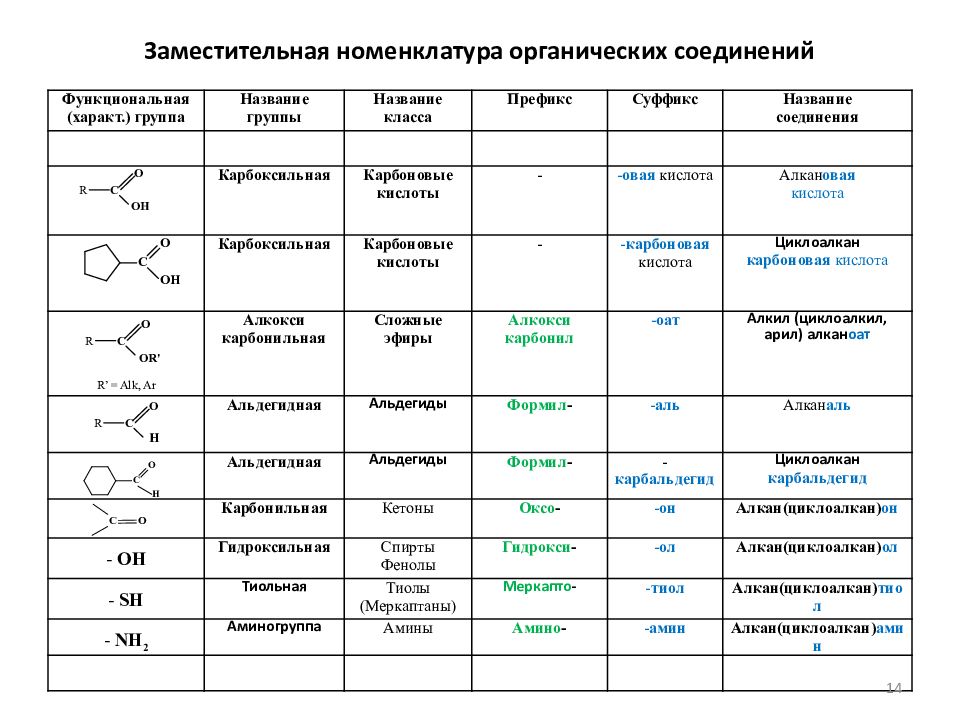
Слайд 14: Заместительная номенклатура органических соединений
Функциональная ( характ.) группа Название группы Название класса Префикс Суффикс Название соединения Карбоксильная Карбоновые кислоты - - овая кислота Алкан овая кислота Карбоксильная Карбоновые кислоты - - карбоновая кислота Циклоалкан карбоновая кислота R’ = Alk, Ar Алкокси карбонильная Сложные эфиры Алкокси карбонил - оат Алкил (циклоалкил, арил) алкан оат Альдегидная Альдегиды Формил - - аль Алкан аль Альдегидная Альдегиды Формил - - карбальдегид Циклоалкан карбальдегид Карбонильная Кетоны Оксо - - он Алкан ( циклоалкан ) он - OH Гидроксильная Спирты Фенолы Гидрокси - - ол Алкан ( циклоалкан ) ол - SH Тиольная Тиолы (Меркаптаны) Меркапто - - тиол Алкан ( циклоалкан ) тиол - NH 2 Аминогруппа Амины Амино - - амин Алкан ( циклоалкан ) амин 14
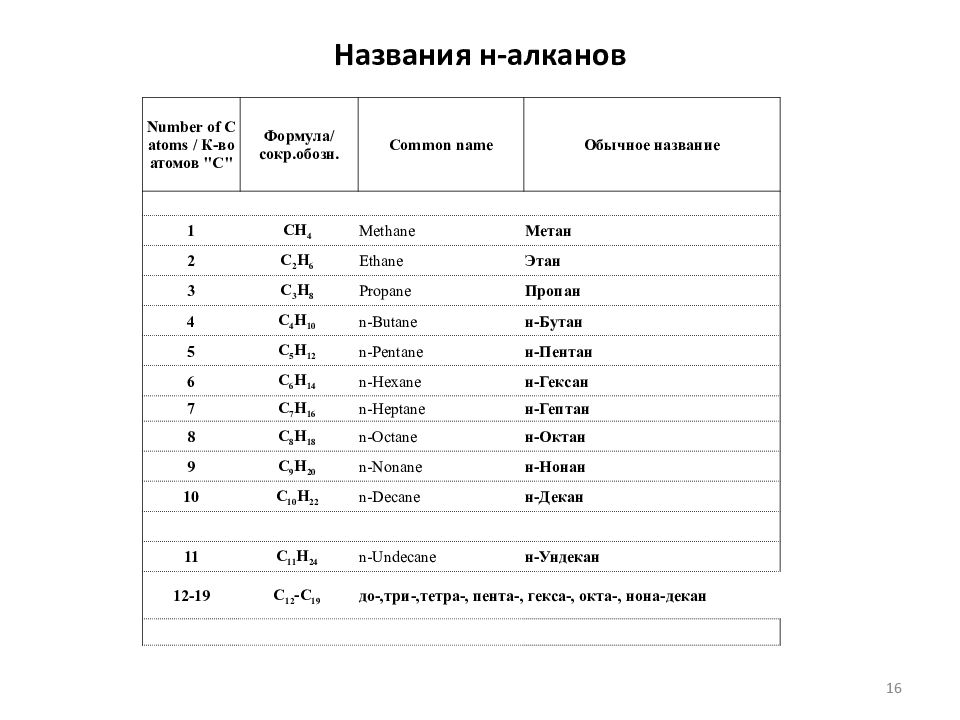
Слайд 16: Названия н-алканов
Number of C atoms / К-во атомов "С" Формула/ сокр.обозн. Common name Обычное название 1 CH 4 Methane Метан 2 C 2 H 6 Ethane Этан 3 C 3 H 8 Propane Пропан 4 C 4 H 10 n-Butane н-Бутан 5 C 5 H 12 n-Pentane н-Пентан 6 C 6 H 14 n-Hexane н-Гексан 7 C 7 H 16 n-Heptane н-Гептан 8 C 8 H 18 n-Octane н-Октан 9 C 9 H 20 n-Nonane н-Нонан 10 C 10 H 22 n-Decane н-Декан 11 C 11 H 24 n-Undecane н-Ундекан 12-19 C 12 -C 19 до-,три-,тетра -, пента-, гекса -, окта-, нона-декан 16
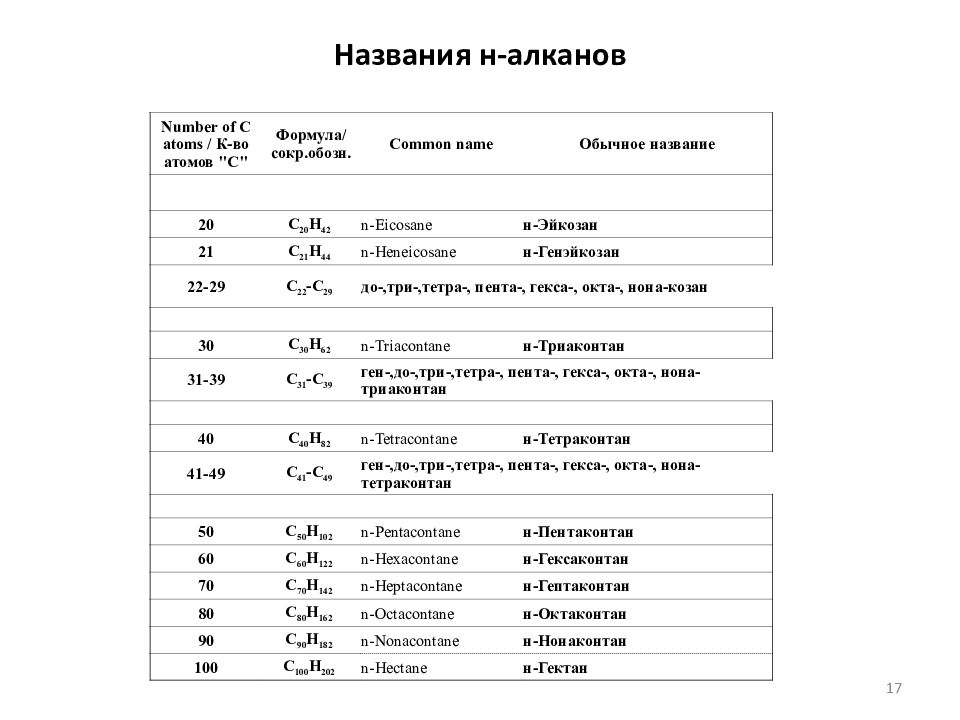
Слайд 17: Названия н-алканов
Number of C atoms / К-во атомов "С" Формула/ сокр.обозн. Common name Обычное название 20 C 20 H 42 n- Eicosane н-Эйкозан 21 C 21 H 44 n- Heneicosane н-Генэйкозан 22-29 C 22 -C 29 до-,три-,тетра -, пента-, гекса -, окта-, нона-козан 30 C 30 H 62 n-Triacontane н-Триаконтан 31-39 C 31 -C 39 ген-,до-,три-,тетра-, пента-, гекса-, окта-, нона-триаконтан 40 C 40 H 82 n-Tetracontane н-Тетраконтан 41-49 C 41 -C 49 ген-,до-,три-,тетра-, пента-, гекса-, окта-, нона-тетраконтан 50 C 50 H 102 n-Pentacontane н-Пентаконтан 60 C 60 H 122 n-Hexacontane н-Гексаконтан 70 C 70 H 142 n-Heptacontane н-Гептаконтан 80 C 80 H 162 n-Octacontane н-Октаконтан 90 C 90 H 182 n-Nonacontane н-Нонаконтан 100 C 100 H 202 n- Hectane н-Гектан 17
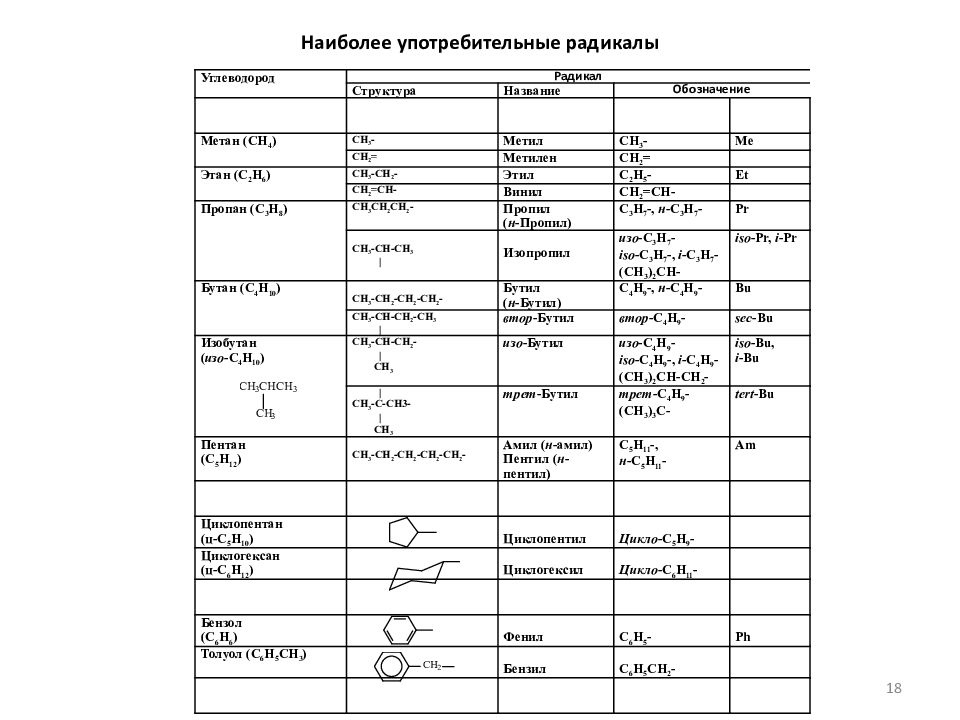
Слайд 18: Наиболее употребительные радикалы
У глеводород Радикал Структура Название Обозначение Метан (СН 4 ) СН 3 - Метил СН 3 - Me СН 2 = Метилен СН 2 = Этан (С 2 Н 6 ) СН 3 -СН 2 - Этил С 2 Н 5 - Et СН 2 =СН- Винил СН 2 =СН- Пропан (С 3 Н 8 ) СН 3 СН 2 СН 2 - Пропил ( н -Пропил) С 3 Н 7 -, н -С 3 Н 7 - Pr СН 3 -СН-СН 3 | Изопропил изо -С 3 Н 7 - iso -С 3 Н 7 -, i -С 3 Н 7 - (СН 3 ) 2 СН- iso -Pr, i -Pr Бутан (С 4 Н 10 ) СН 3 -СН 2 -СН 2 -СН 2 - Бутил ( н -Бутил) С 4 Н 9 -, н -С 4 Н 9 - Bu СН 3 -СН- C Н 2 - СН 3 | втор -Бутил втор -С 4 Н 9 - sec -Bu Изобутан ( изо -С 4 Н 10 ) СН 3 -СН-СН 2 - | СН 3 изо -Бутил изо -С 4 Н 9 - iso -С 4 Н 9 -, i -С 4 Н 9 - (СН 3 ) 2 СН-СН 2 - iso -Bu, i -Bu | СН 3 -С-СН 3 - | СН 3 трет -Бутил трет -С 4 Н 9 - (СН 3 ) 3 С- tert -Bu Пентан (С 5 Н 12 ) СН 3 -СН 2 -СН 2 -СН 2 -СН 2 - Амил ( н -амил) Пентил ( н -пентил) С 5 Н 11 -, н -С 5 Н 11 - Am Циклопентан (ц-С 5 Н 10 ) Циклопентил Цикло -С 5 Н 9 - Циклогексан (ц-С 6 Н 12 ) Циклогексил Цикло -С 6 Н 11 - Бензол (С 6 Н 6 ) Фенил C 6 H 5 - Ph Толуол ( C 6 H 5 CH 3 ) Бензил C 6 H 5 CH 2 - 18
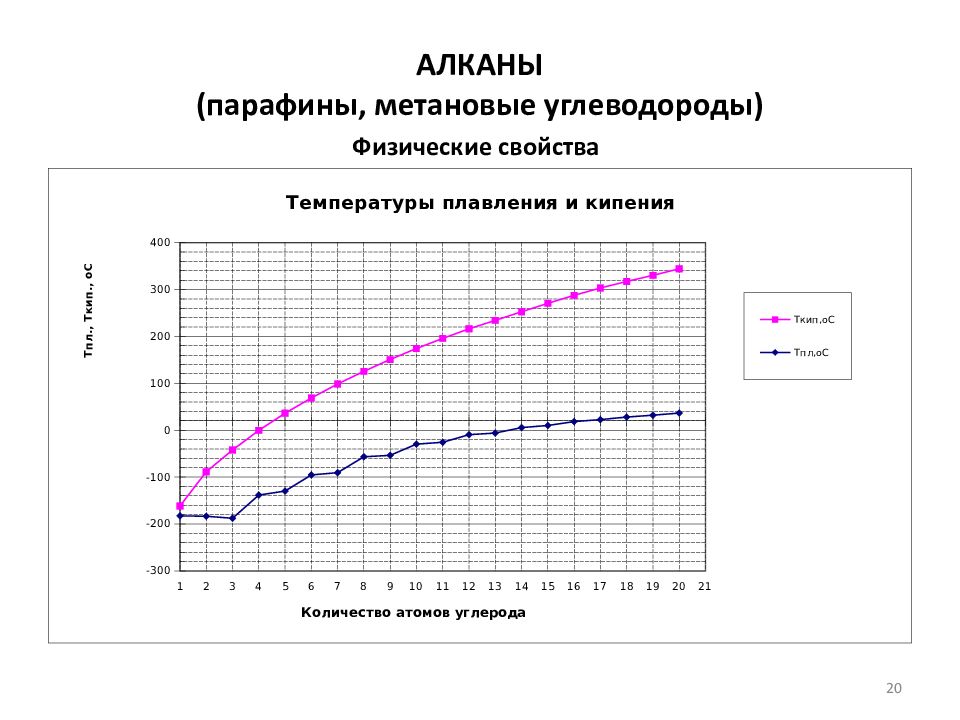
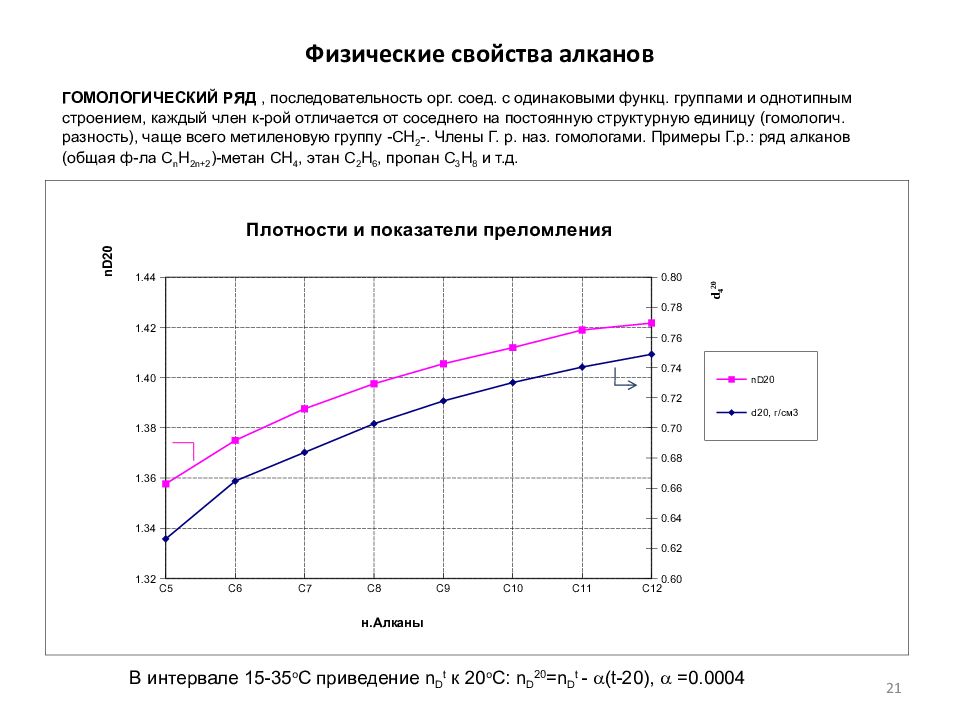
Слайд 21: Физические свойства алканов
ГОМОЛОГИЧЕСКИЙ РЯД, последовательность орг. соед. с одинаковыми функц. группами и однотипным строением, каждый член к-рой отличается от соседнего на постоянную структурную единицу (гомологич. разность), чаще всего метиленовую группу -СН 2 -. Члены Г. р. наз. гомологами. Примеры Г.р.: ряд алканов (общая ф-ла С n Н 2n+2 )-метан СН 4, этан С 2 Н 6, пропан С 3 Н 8 и т.д. В интервале 15-35 о С приведение n D t к 20 о С: n D 20 =n D t - a (t-20), a =0.0004 21
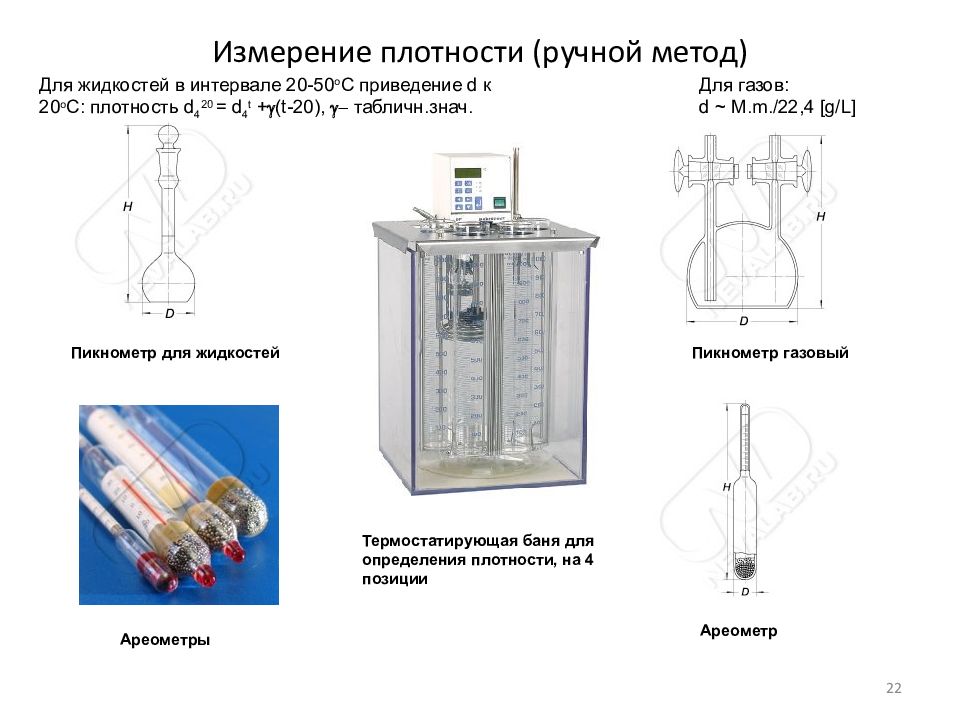
Слайд 22: Измерение плотности (ручной метод)
Пикнометр для жидкостей Пикнометр газовый Ареометры Ареометр Термостатирующая баня для определения плотности, на 4 позиции Для газов: d ~ M. m. /22,4 [g/L] Для жидкостей в интервале 20-50 о С приведение d к 20 о С: плотность d 4 20 = d 4 t + g (t-20), g - табличн.знач. 22
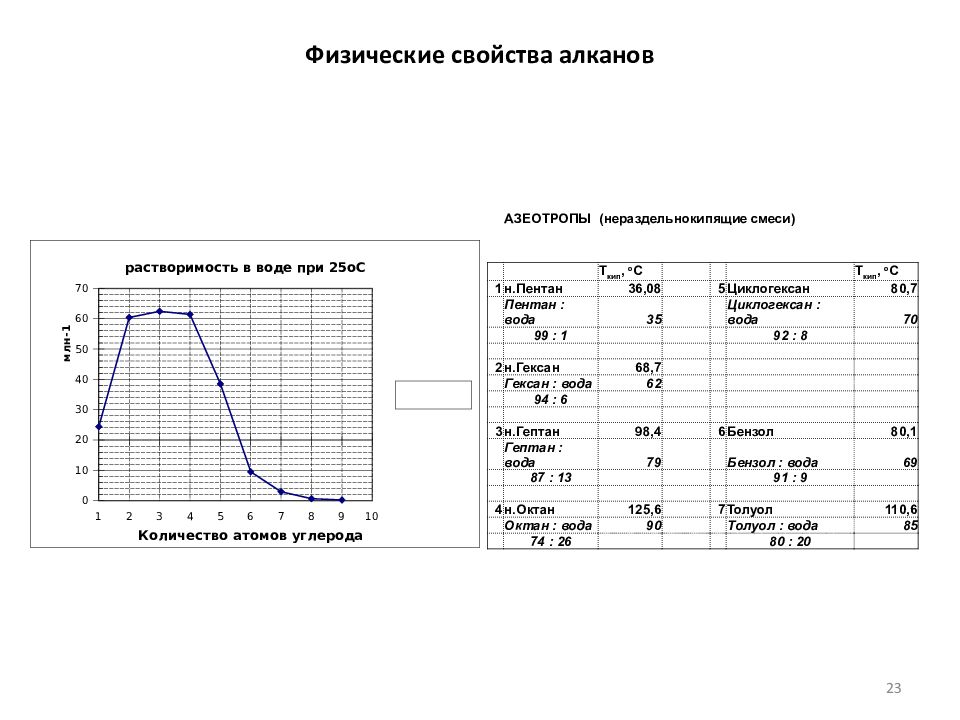
Слайд 23: Физические свойства алканов
АЗЕОТРОПЫ (нераздельнокипящие смеси) Т кип, о С Т кип, о С 1 н.Пентан 36,08 5 Циклогексан 80,7 Пентан : вода 35 Циклогексан : вода 70 99 : 1 92 : 8 2 н.Гексан 68,7 Гексан : вода 62 94 : 6 3 н.Гептан 98,4 6 Бензол 80,1 Гептан : вода 79 Бензол : вода 69 87 : 13 91 : 9 4 н.Октан 125,6 7 Толуол 110,6 Октан : вода 90 Толуол : вода 85 74 : 26 80 : 20 23
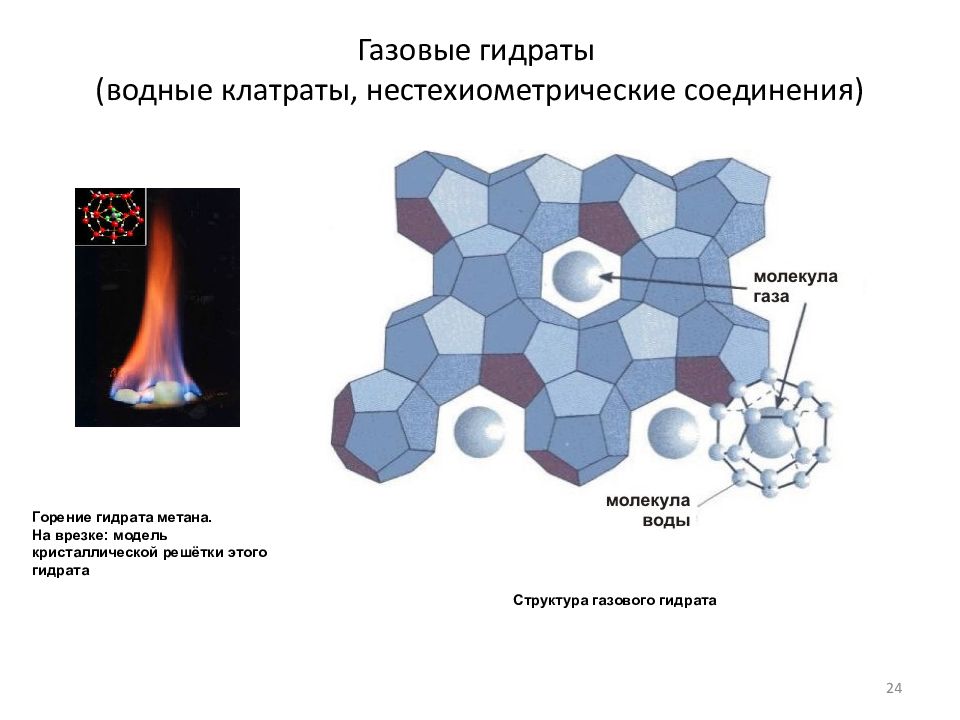
Слайд 24: Газовые гидраты (водные клатраты, нестехиометрические соединения)
Структура газового гидрата Горение гидрата метана. На врезке: модель кристаллической решётки этого гидрата 24
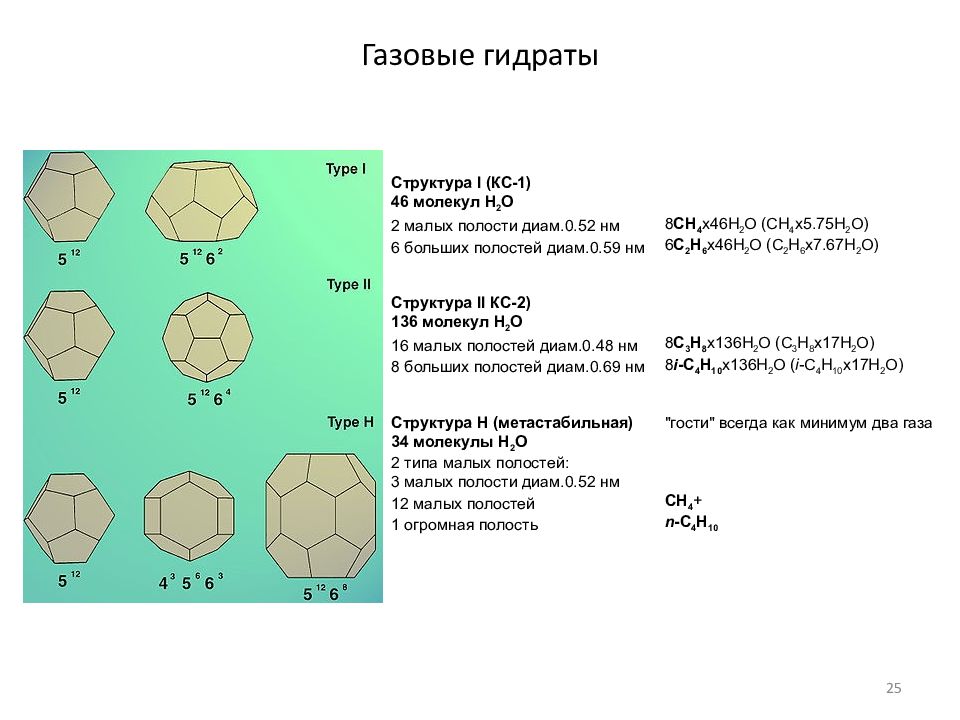
Слайд 25: Газовые гидраты
Структура I (КС-1) 46 молекул Н 2 О 2 малых полости диам.0.52 нм 8 CH 4 x46H 2 O (CH 4 x5.75H 2 O) 6 больших полостей диам.0.59 нм 6 C 2 H 6 x46H 2 O (C 2 H 6 x7.67H 2 O) Структура II КС-2) 136 молекул Н 2 О 16 малых полостей диам.0.48 нм 8 C 3 H 8 x136H 2 O (C 3 H 8 x17H 2 O) 8 больших полостей диам.0.69 нм 8 i -C 4 H 10 x136H 2 O ( i -C 4 H 10 x17H 2 O) Структура H ( метастабильная) "гости" всегда как минимум два газа 34 молекулы Н 2 О 2 типа малых полостей: 3 малых полости диам.0.52 нм 12 малых полостей CH 4 + 1 огромная полость n -C 4 H 10 25
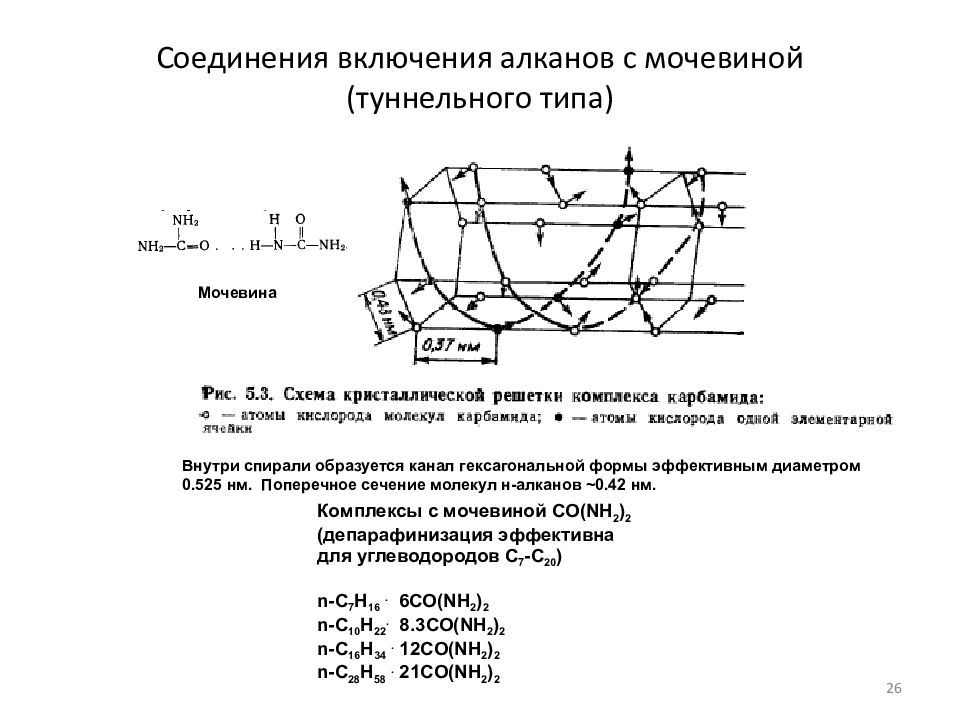
Слайд 26: Соединения включения алканов с мочевиной (туннельного типа)
Внутри спирали образуется канал гексагональной формы эффективным диаметром 0.525 нм. Поперечное сечение молекул н-алканов ~ 0.42 нм. Мочевина Комплексы с мочевиной CO(NH 2 ) 2 ( депарафинизация эффективна для углеводородов С 7 -C 20 ) n-C 7 H 16. 6CO(NH 2 ) 2 n-C 10 H 22. 8.3CO(NH 2 ) 2 n-C 16 H 34. 12CO(NH 2 ) 2 n-C 28 H 58. 21CO(NH 2 ) 2 26
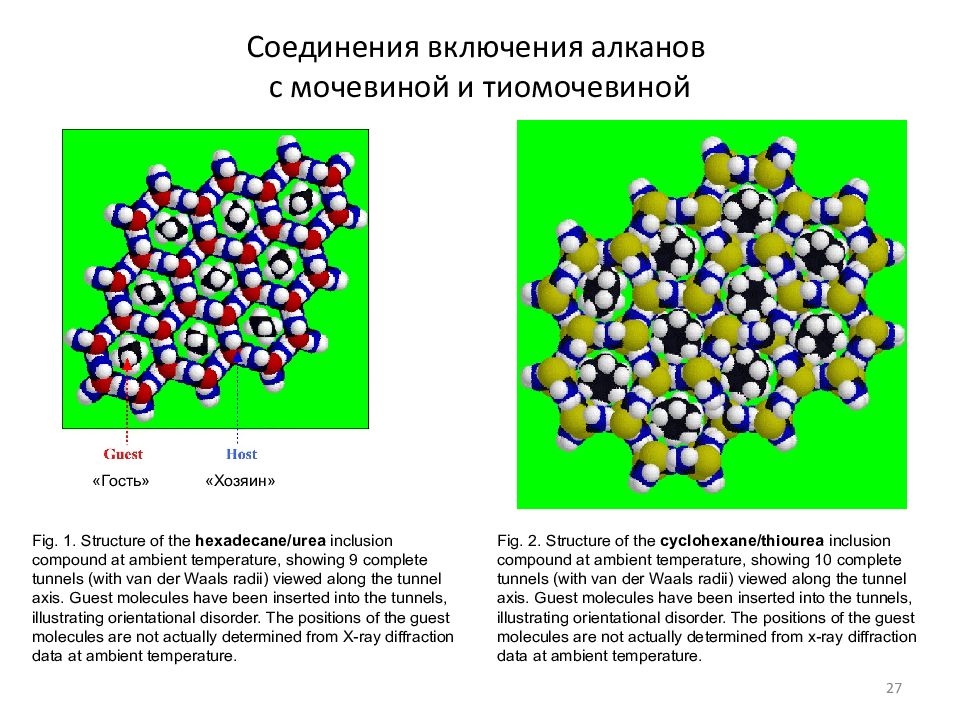
Слайд 27: Соединения включения алканов с мочевиной и тиомочевиной
Fig. 1. Structure of the hexadecane/urea inclusion compound at ambient temperature, showing 9 complete tunnels (with van der Waals radii) viewed along the tunnel axis. Guest molecules have been inserted into the tunnels, illustrating orientational disorder. The positions of the guest molecules are not actually determined from X-ray diffraction data at ambient temperature. Fig. 2. Structure of the cyclohexane/thiourea inclusion compound at ambient temperature, showing 10 complete tunnels (with van der Waals radii) viewed along the tunnel axis. Guest molecules have been inserted into the tunnels, illustrating orientational disorder. The positions of the guest molecules are not actually determined from x-ray diffraction data at ambient temperature. «Гость» «Хозяин» 27
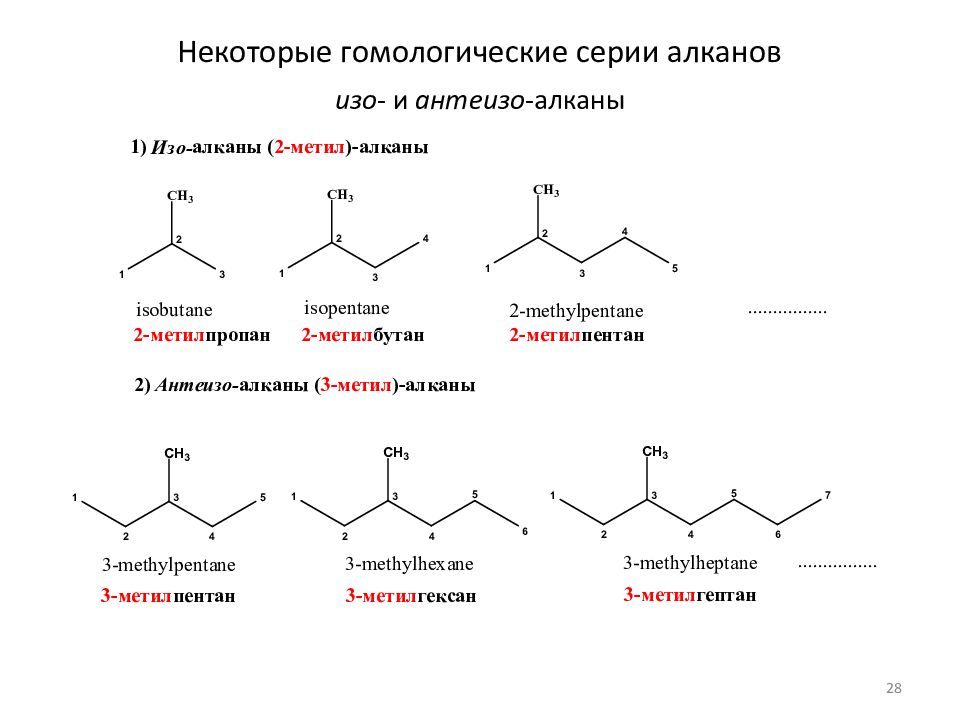
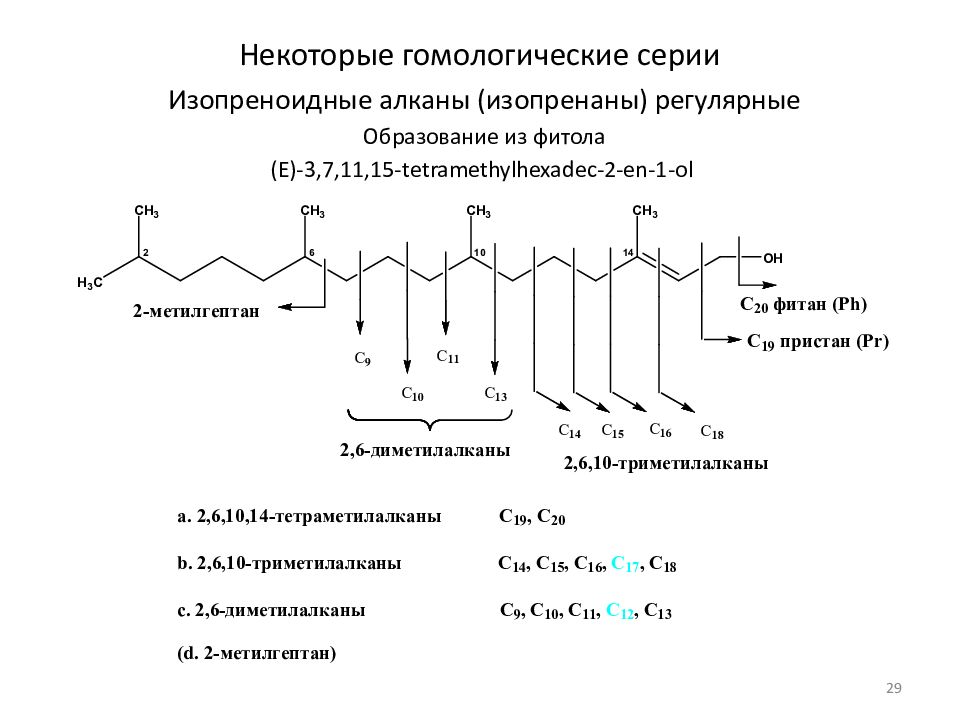
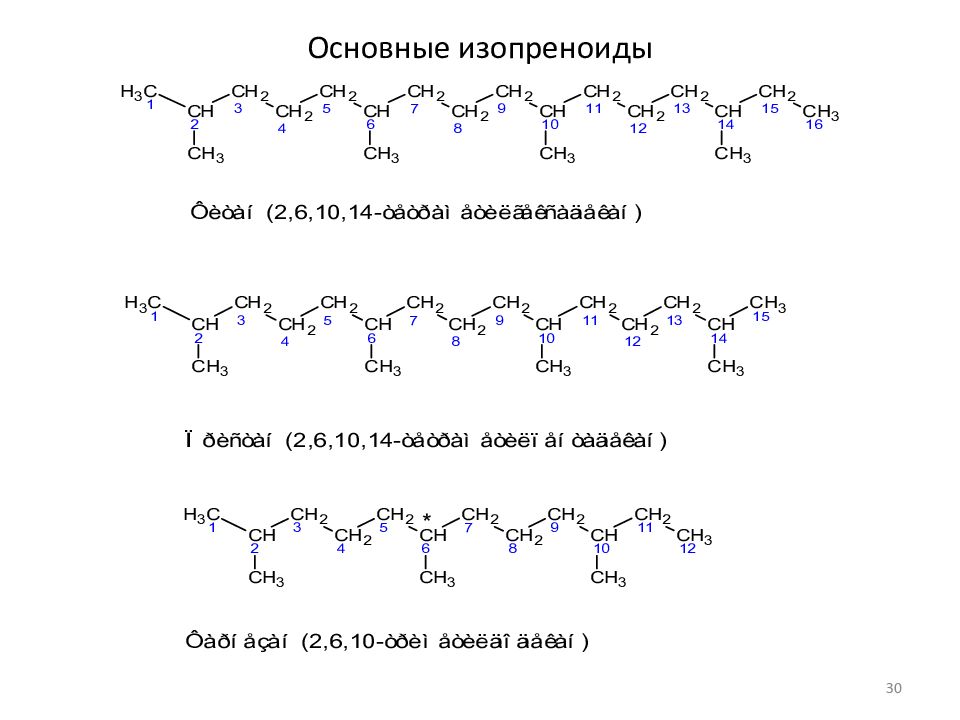
Слайд 29: Некоторые гомологические серии
Изопреноидные алканы (изопренаны) регулярные Образование из фитола (E)-3,7,11,15-tetramethylhexadec-2-en-1-ol 29
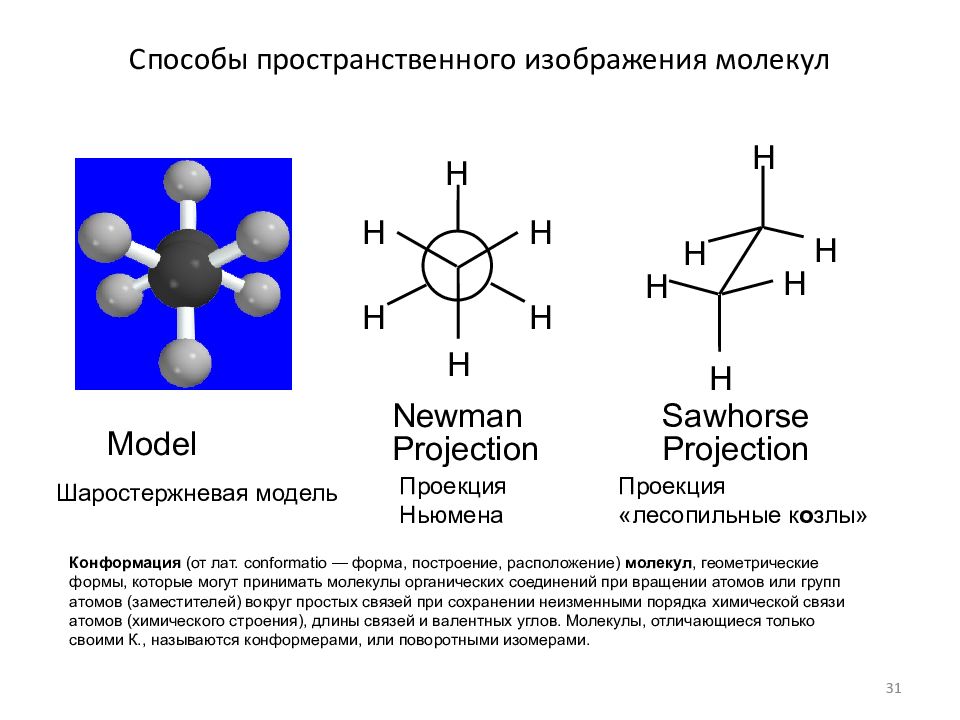
Слайд 31: Способы пространственного изображения молекул
Конформация (от лат. conformatio — форма, построение, расположение) молекул, геометрические формы, которые могут принимать молекулы органических соединений при вращении атомов или групп атомов (заместителей) вокруг простых связей при сохранении неизменными порядка химической связи атомов (химического строения), длины связей и валентных углов. Молекулы, отличающиеся только своими К., называются конформерами, или поворотными изомерами. Newman Projection Sawhorse Projection Model H H H H H H H H H H H H Проекция «лесопильные к о злы» Проекция Ньюмена Шаростержневая модель 31
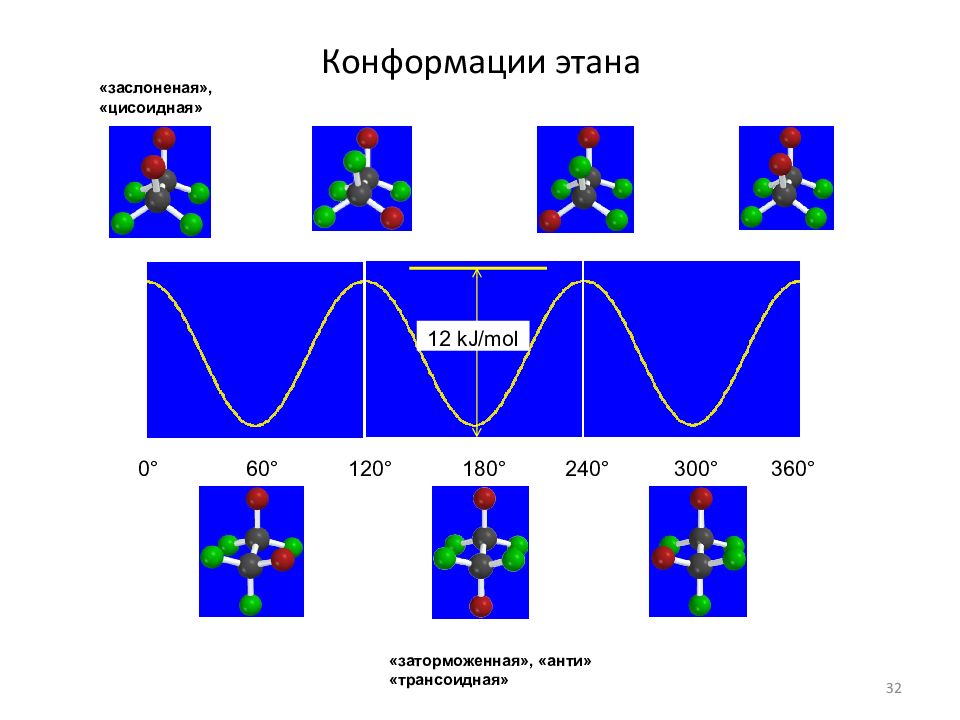
Слайд 32: Конформации этана
0° 60° 120° 180° 240° 300° 360° 12 kJ/mol «заторможенная», «анти» «трансоидная» «заслоненая», «цисоидная» 32
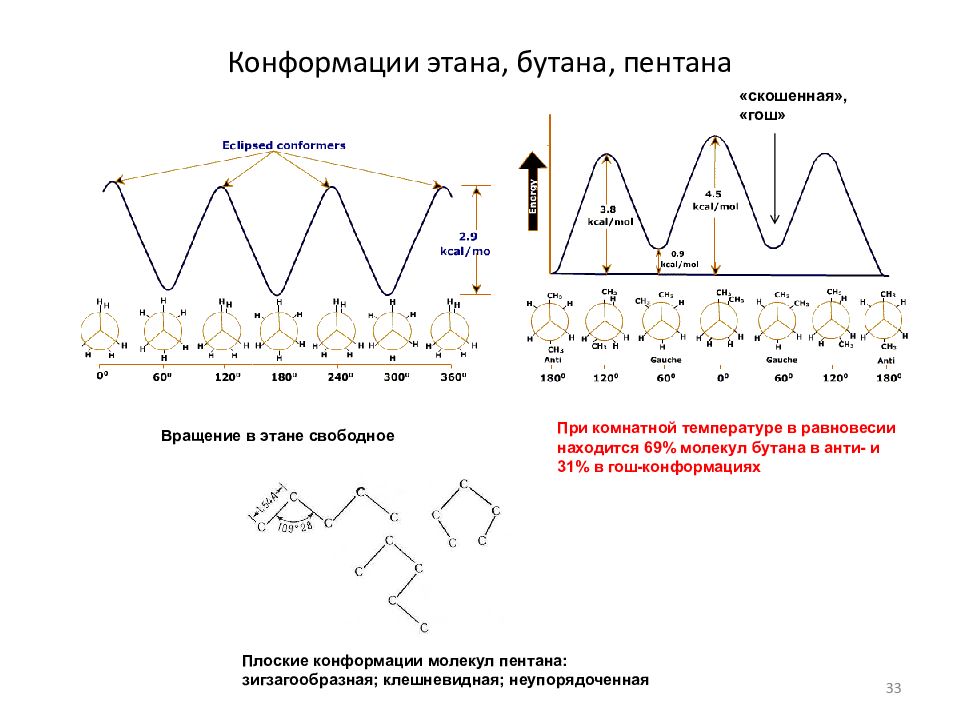
Слайд 33: Конформации этана, бутана, пентана
Вращение в этане свободное При комнатной температуре в равновесии находится 69% молекул бутана в анти- и 31% в гош-конформациях Плоские конформации молекул пентана: зигзагообразная; клешневидная; неупорядоченная «скошенная», «гош» 33
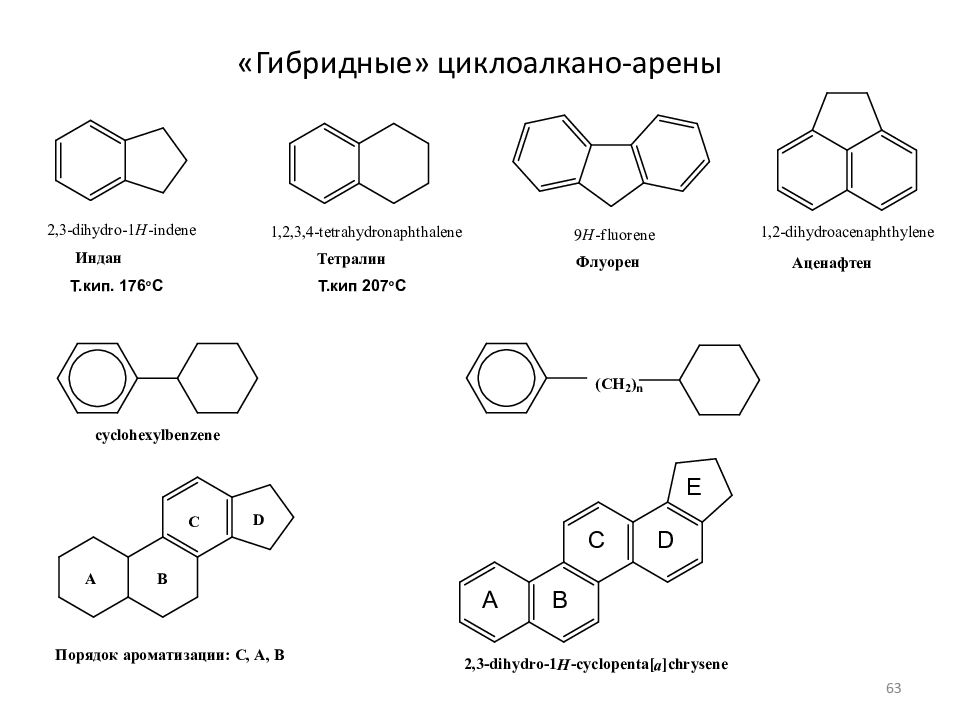
Слайд 34: Циклоалканы (циклопарафины, цикланы) [ полиметилены – моноциклические циклоалканы (CH 2 ) n ] [ нафтены – циклоалканы, содержащие пяти- и шестичленные циклы ]
Напряжение по Байеру 49 o 28'/2 =24 o 44' 9 o 44' 0 o 44' -5 o 16' -9 o 33 ' -12 o 46' Напр. по H o f ккал/м ( тепл. образ.) 27,2 26,8 6,6 0 6 10 Напр. по H o f ккал/м : С 9 (12,5 ккал/м), С 10 (13 ккал/м), С 11 (11 ккал/м), С 12 (4 ккал/м), С 14 (2 ккал/м). Теплота сгорания на CH 2 группу, ккал/м МАЛЫЕ ЦИКЛЫ 166.6 - 164,0 ОБЫЧНЫЕ 158,7- 157,4 СРЕДНИЕ ДО С12 ( C13 ) МАКРОЦИКЛЫ > C 13 ТИПЫ НАПРЯЖЕНИЯ В ЦИКЛАХ. 1) УГЛОВОЕ (только малые), 2) ТОРСИОННОЕ (заслоненное), ТРАНСАННУЛЯРНОЕ (в средних циклах). 34
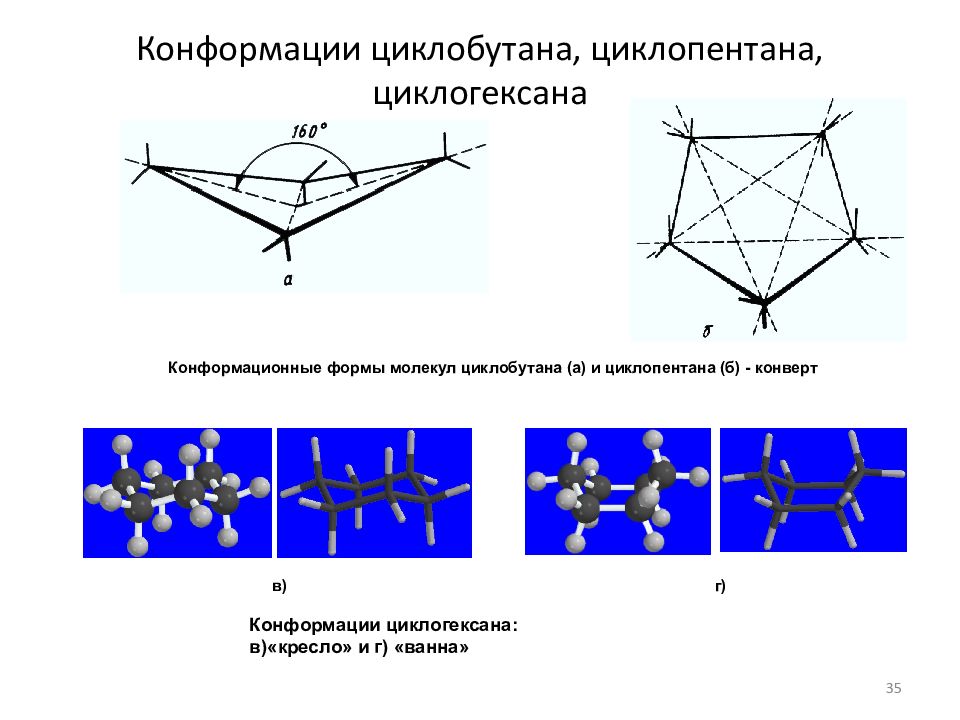
Слайд 35: Конформации циклобутана, циклопентана, циклогексана
Конформационные формы молекул циклобутана (а) и циклопентана (б) - конверт Конформации циклогексана: в)«кресло» и г) «ванна» в) г) 35
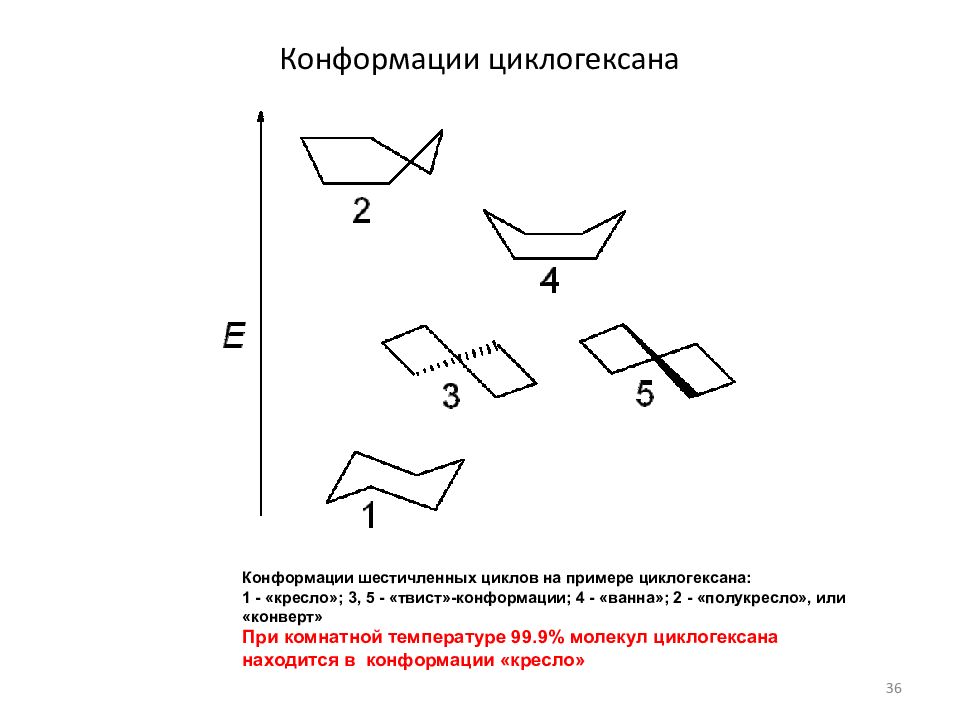
Слайд 36: Конформации циклогексана
Конформации шестичленных циклов на примере циклогексана: 1 - «кресло»; 3, 5 - «твист»-конформации; 4 - «ванна»; 2 - «полукресло», или «конверт» При комнатной температуре 99.9% молекул циклогексана находится в конформации «кресло» 36
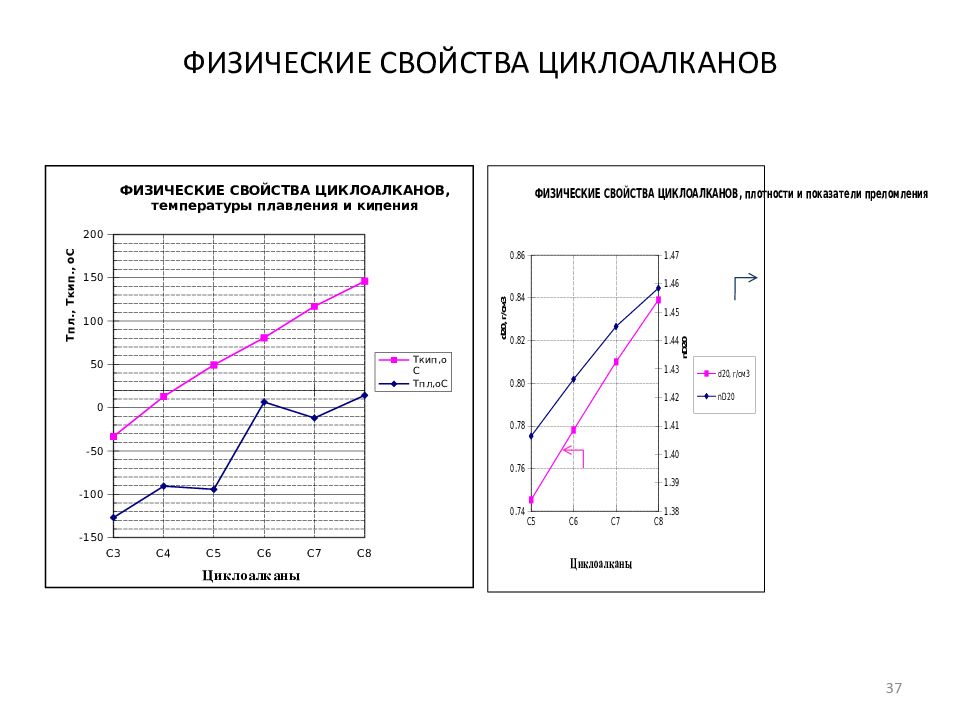
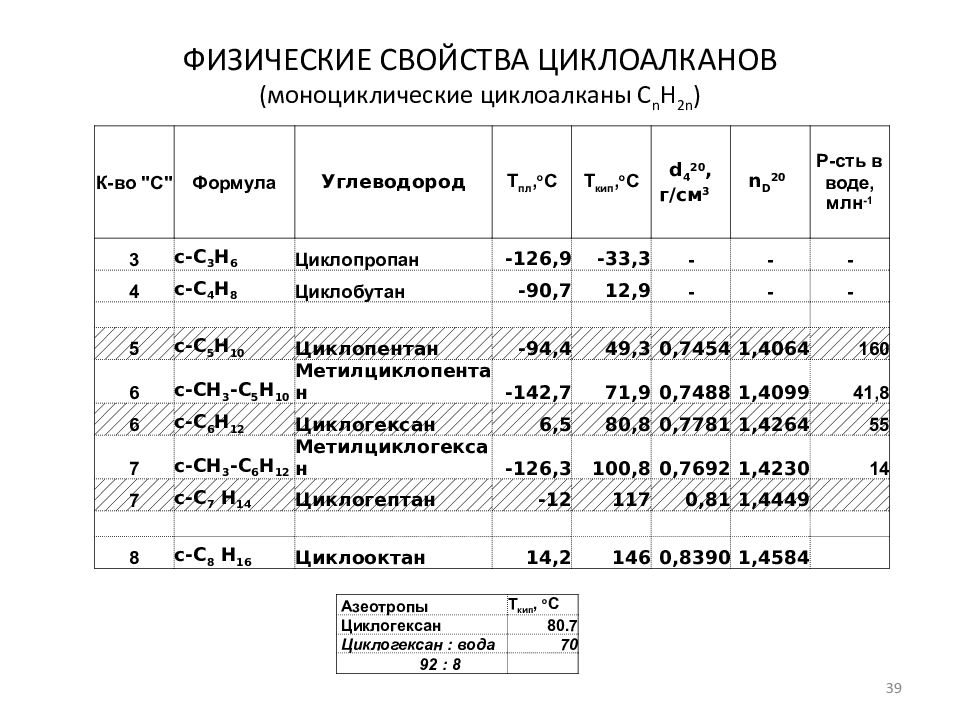
Слайд 39: ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ (моноциклические циклоалканы C n H 2n )
К-во " C" Формула Углеводород Т пл, о С Т кип, о С d 4 20, г/см 3 n D 20 Р-сть в воде, млн -1 3 c- С 3 H 6 Циклопропан -126,9 -33,3 - - - 4 c- С 4 H 8 Циклобутан -90,7 12,9 - - - 5 c- С 5 H 10 Циклопентан -94,4 49,3 0,7454 1,4064 160 6 c-CH 3 - С 5 H 10 Метилциклопентан -142,7 71,9 0,7488 1,4099 41,8 6 c- С 6 H 12 Циклогексан 6,5 80,8 0,7781 1,4264 55 7 c-CH 3 - С 6 H 12 Метилциклогексан -126,3 100,8 0,7692 1,4230 14 7 c- С 7 H 14 Циклогептан -12 117 0,81 1,4449 8 c- С 8 H 16 Циклооктан 14,2 146 0,8390 1,4584 Азеотропы Т кип, о С Циклогексан 80.7 Циклогексан : вода 70 92 : 8 39
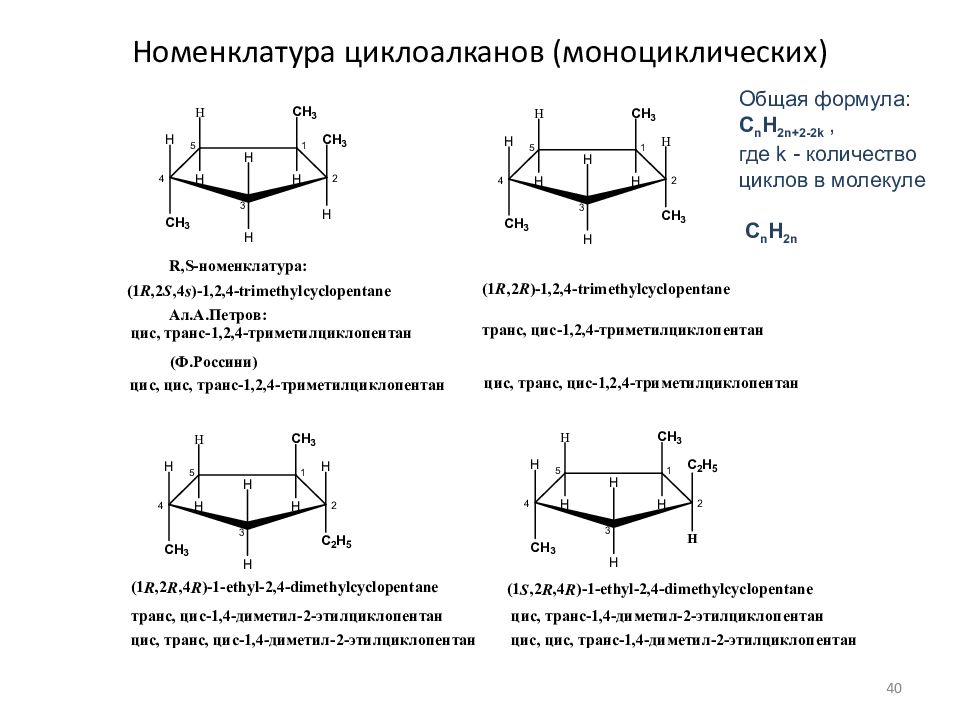
Слайд 40: Номенклатура циклоалканов (моноциклических)
Общая формула: C n H 2n+ 2 - 2 k, где k - количество циклов в молекуле C n H 2n 40
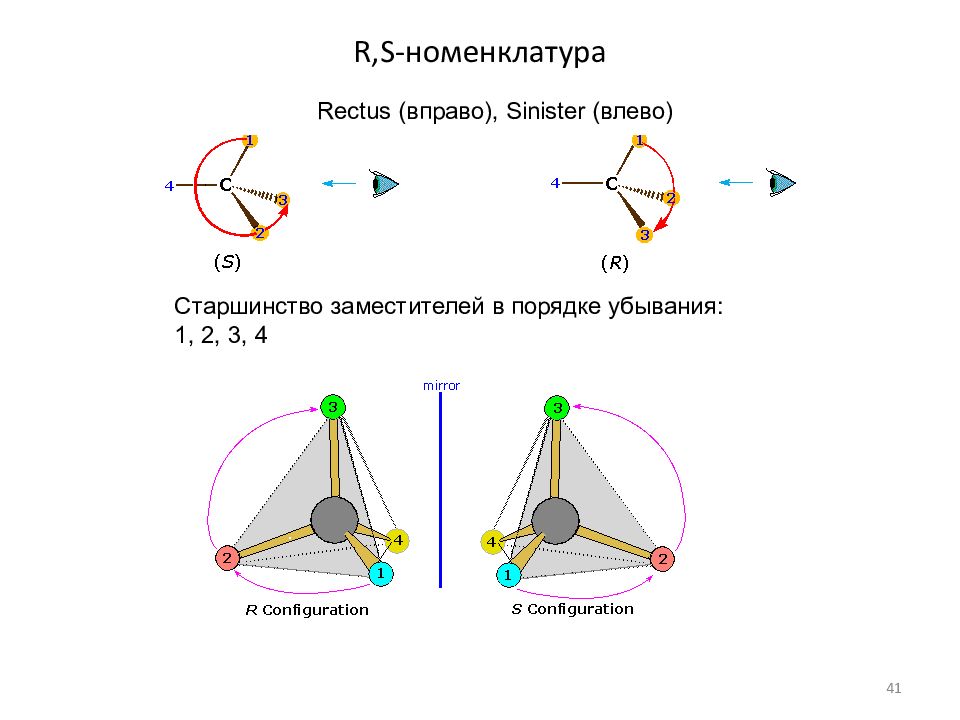
Слайд 41: R,S- номенклатура
Старшинство заместителей в порядке убывания: 1, 2, 3, 4 Rectus (вправо), Sinister (влево) 41
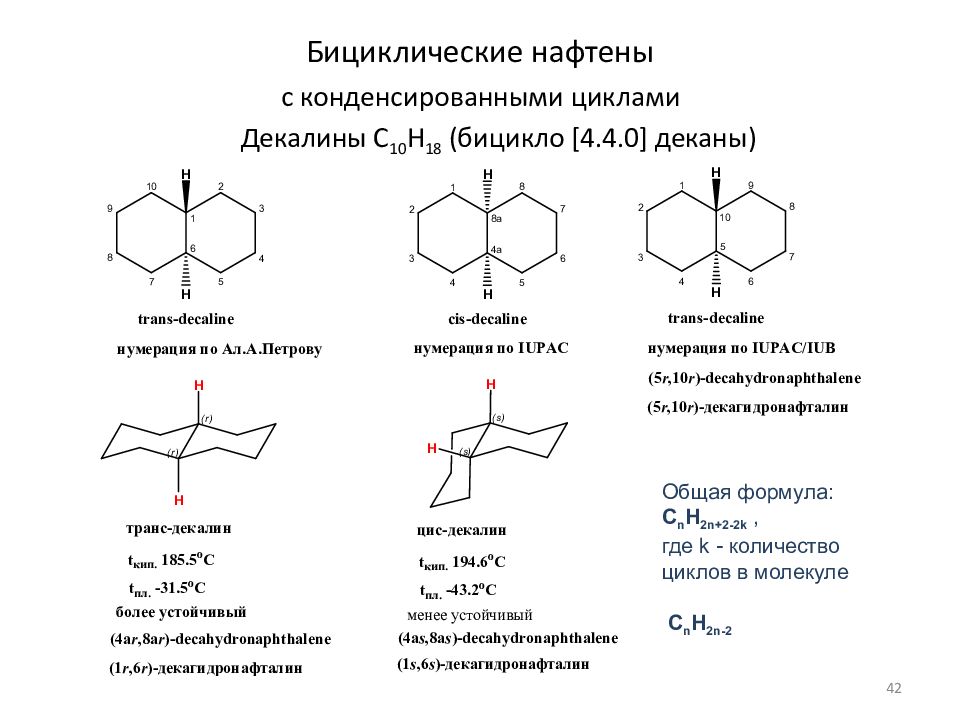
Слайд 42: Бициклические нафтены с конденсированными циклами
Декалины C 10 H 18 (бицикло [4.4.0] деканы) Общая формула: C n H 2n+ 2 - 2 k, где k - количество циклов в молекуле C n H 2n- 2 42
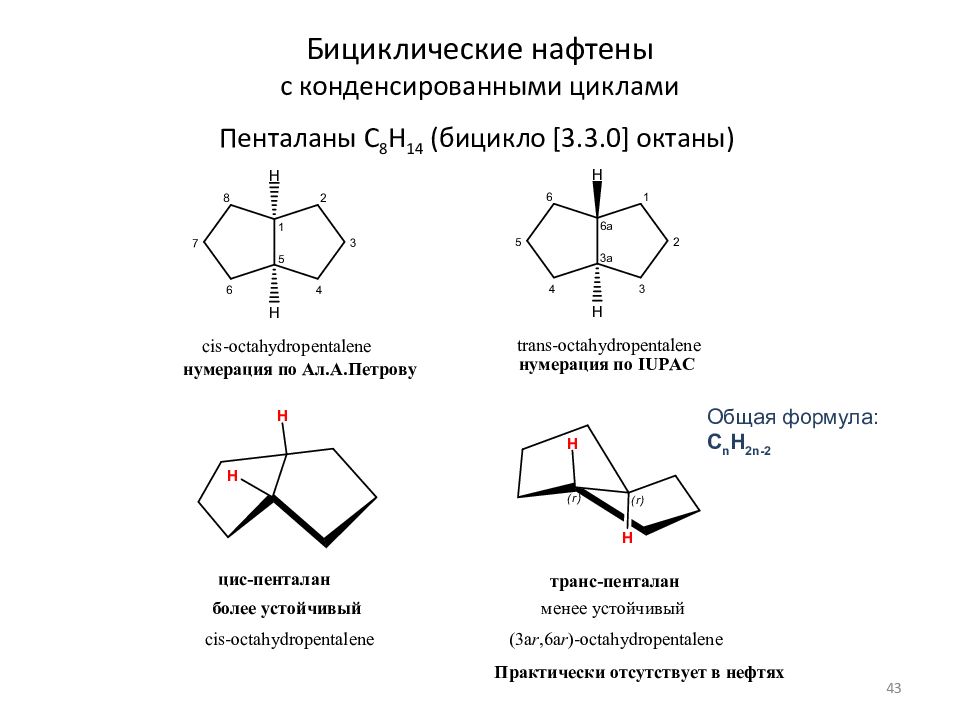
Слайд 43: Бициклические нафтены с конденсированными циклами
Пенталаны C 8 H 1 4 (бицикло [3.3.0] октаны) Общая формула: C n H 2n- 2 43
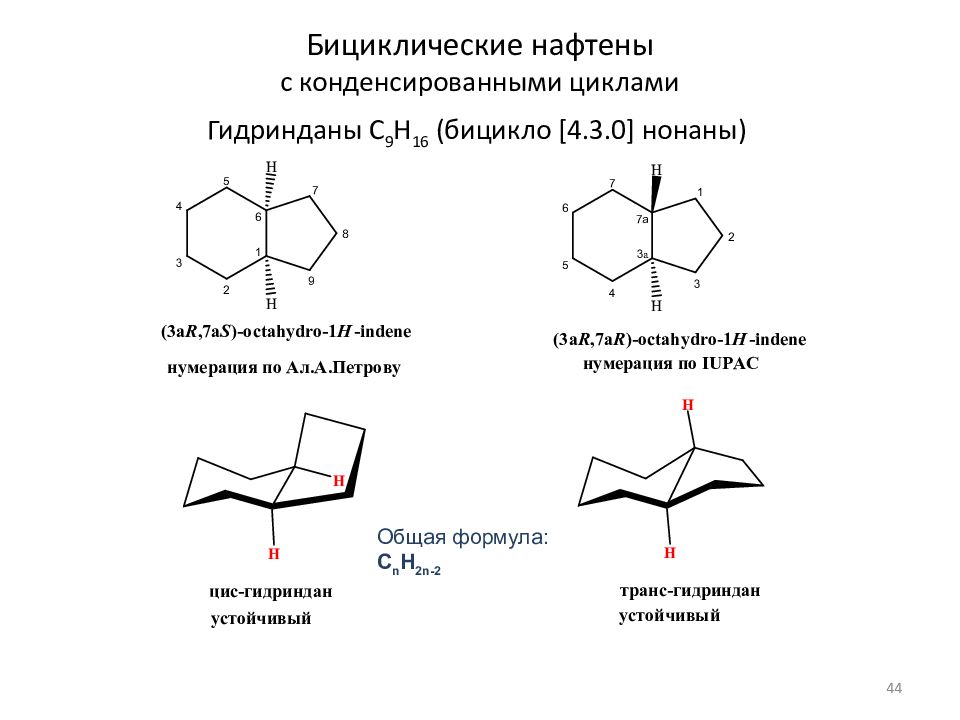
Слайд 44: Бициклические нафтены с конденсированными циклами
Гидринданы C 9 H 1 6 (бицикло [4.3.0] нонаны) Общая формула: C n H 2n- 2 44
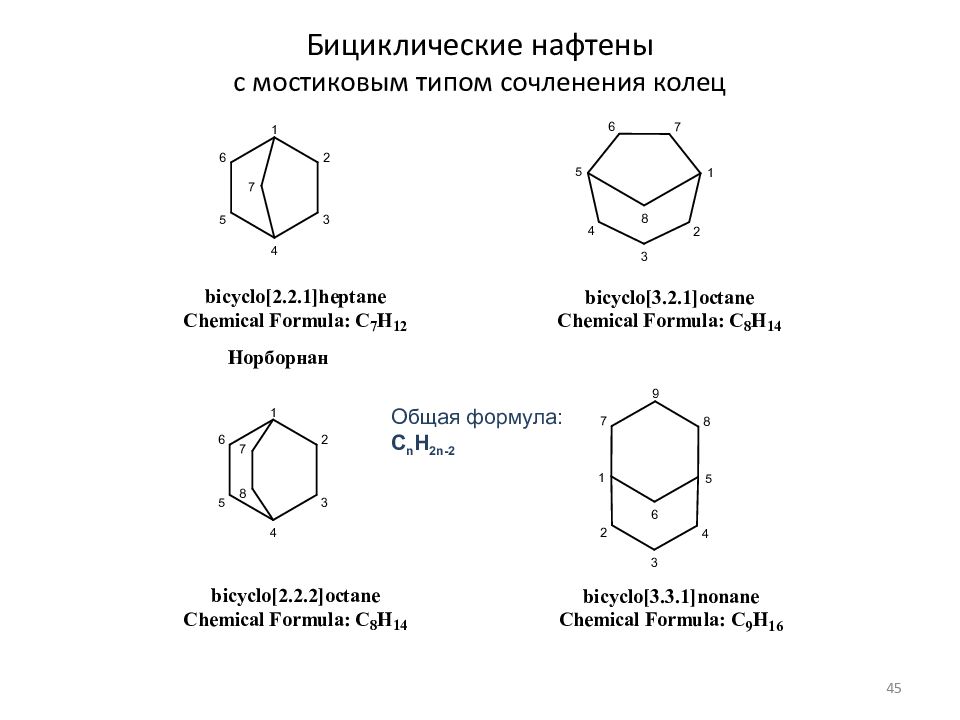
Слайд 45: Бициклические нафтены с мостиковым типом сочленения колец
Общая формула: C n H 2n- 2 45
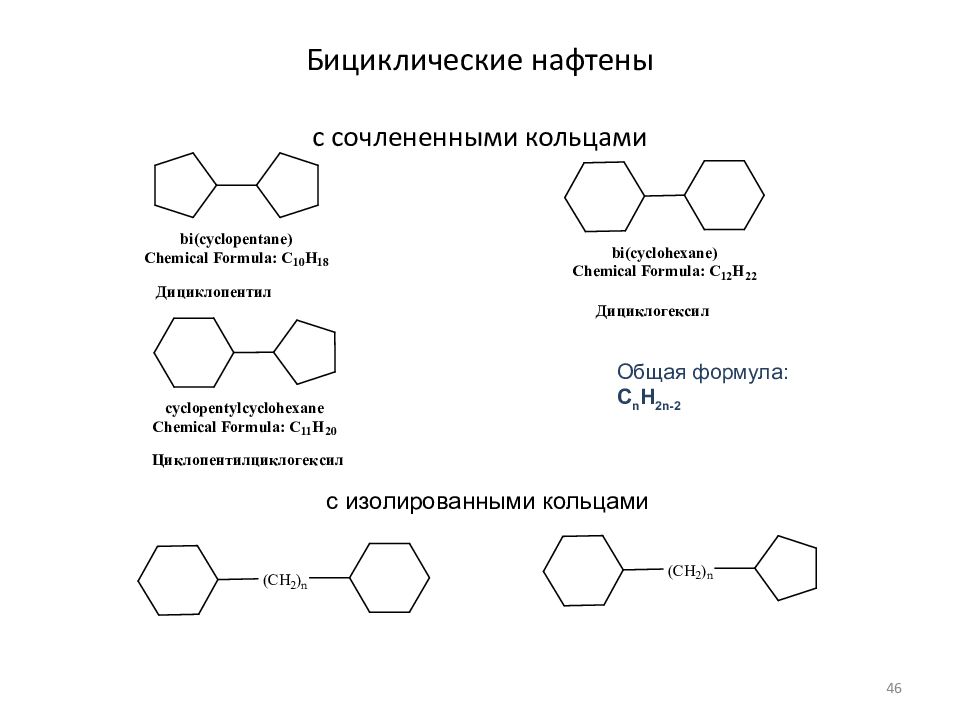
Слайд 46: Бициклические нафтены с сочлененными кольцами
Общая формула: C n H 2n- 2 с изолированными кольцами 46
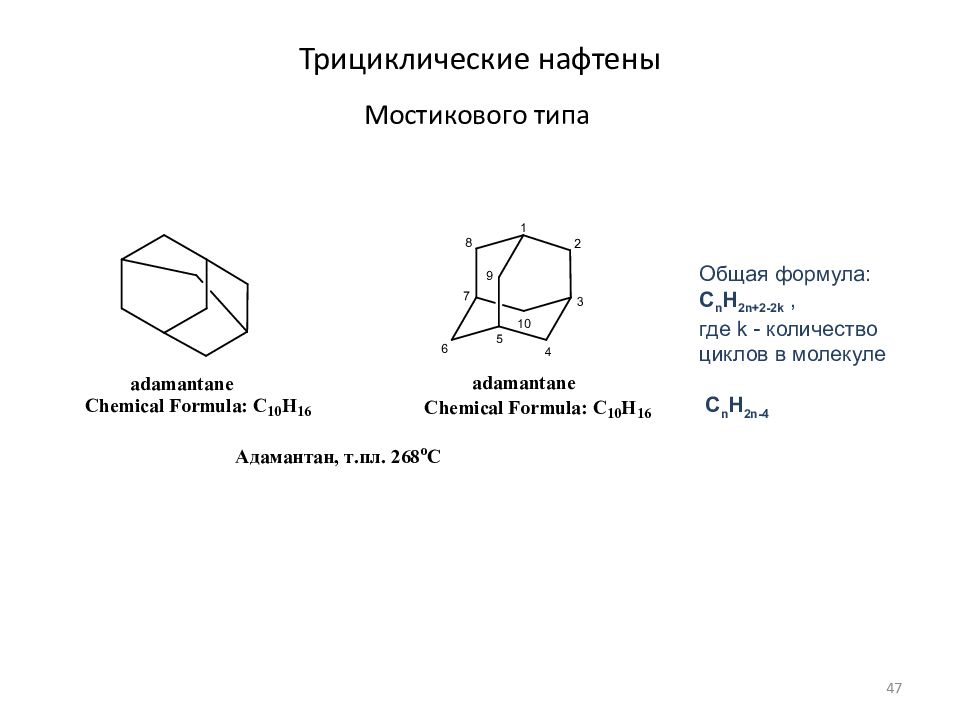
Слайд 47: Трициклические нафтены
Мостикового типа Общая формула: C n H 2n+ 2 - 2 k, где k - количество циклов в молекуле C n H 2n- 4 47
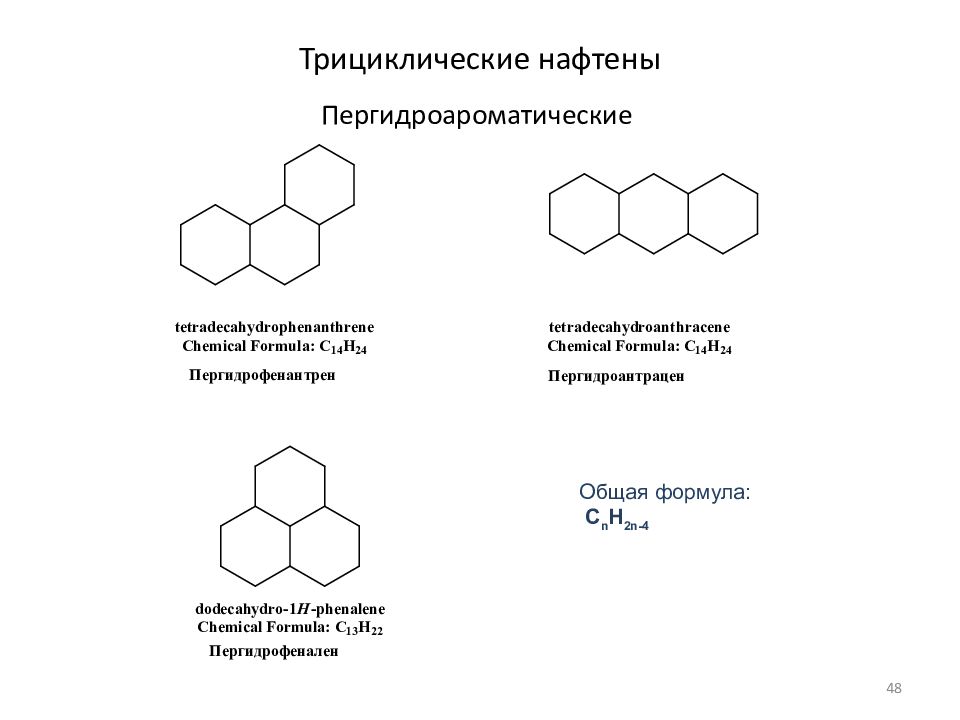
Слайд 48: Трициклические нафтены
Пергидроароматические Общая формула: C n H 2n- 4 48
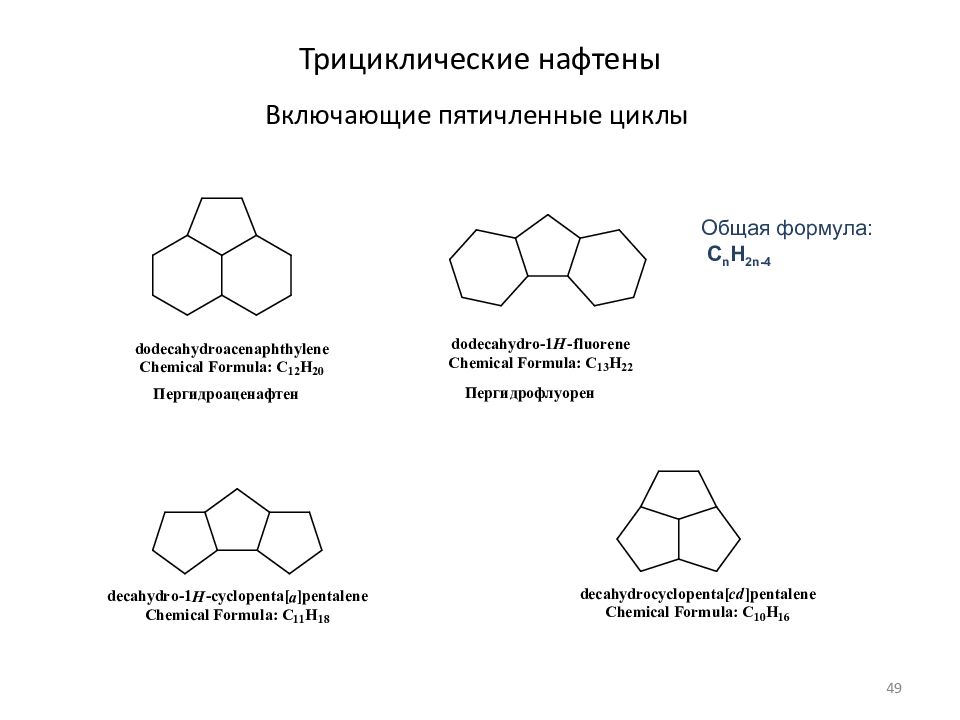
Слайд 49: Трициклические нафтены
Включающие пятичленные циклы Общая формула: C n H 2n- 4 49
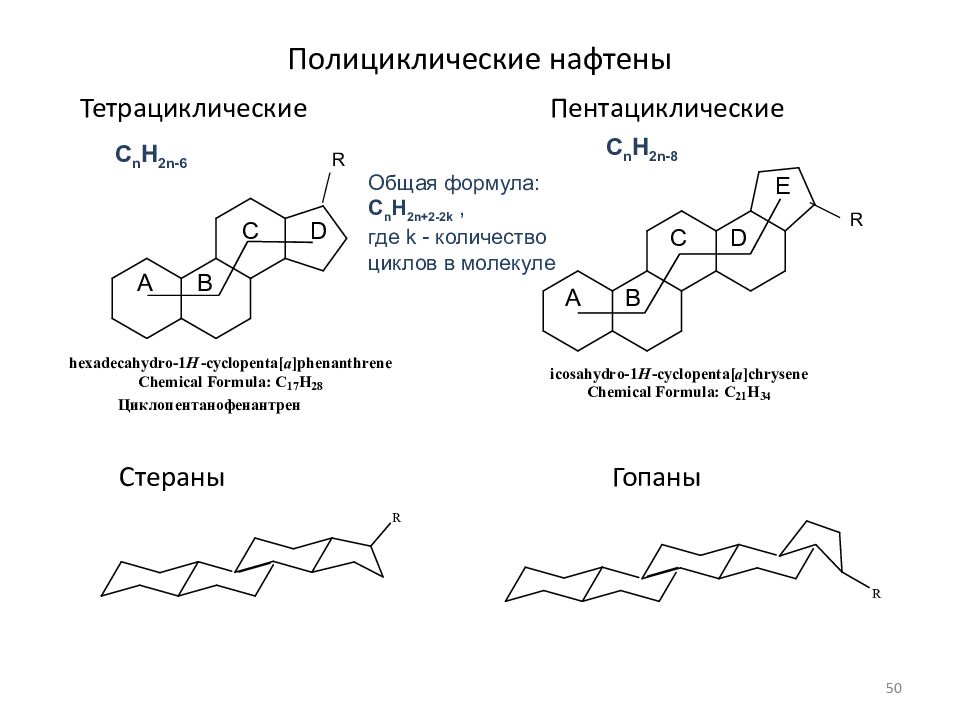
Слайд 50: Полициклические нафтены
Тетрациклические Пентациклические Стераны Гопаны R R Общая формула: C n H 2n+ 2 - 2 k, где k - количество циклов в молекуле C n H 2n-6 C n H 2n-8 A B C D A B D C E 50
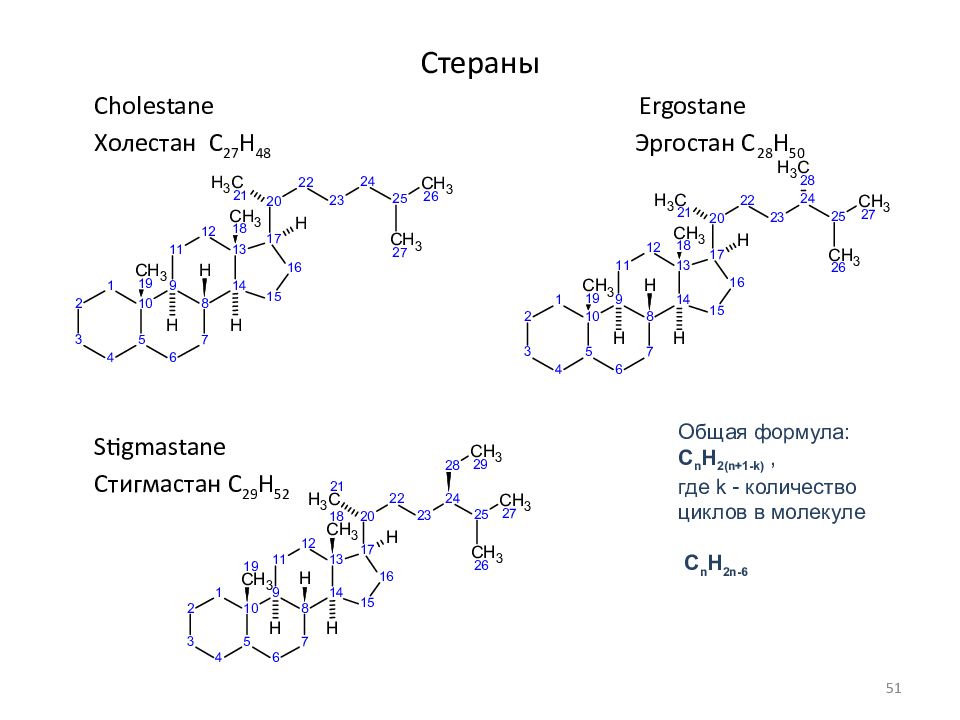
Слайд 51: Стераны
Cholestane Ergostane Холестан C 27 H 48 Эргостан C 28 H 50 Stigmastane Стигмастан C 29 H 52 Общая формула: C n H 2(n+1-k), где k - количество циклов в молекуле C n H 2n-6 51
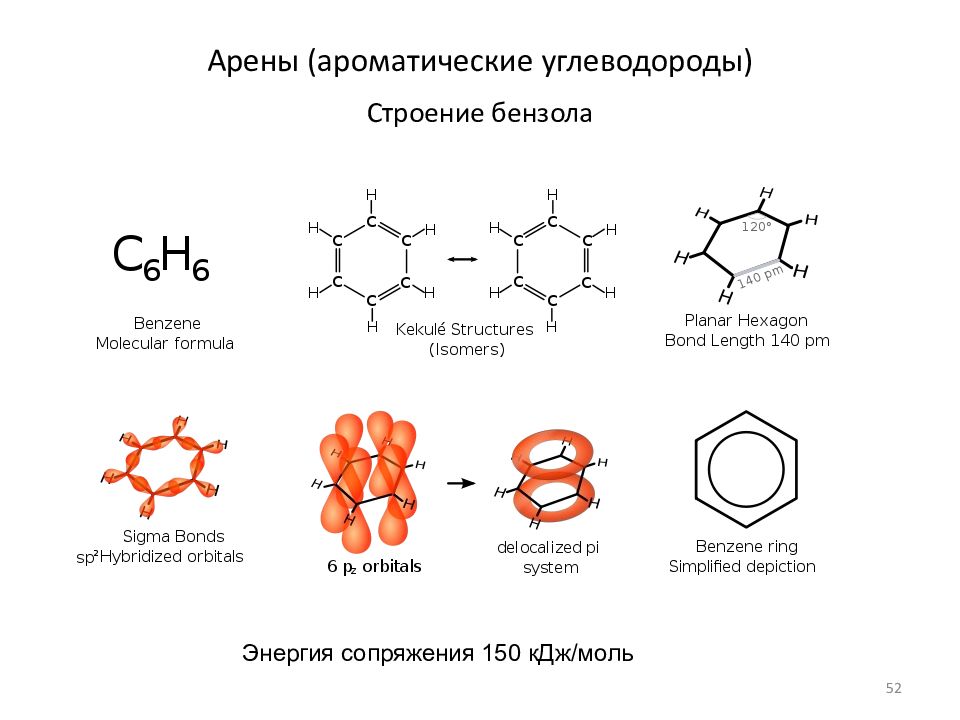
Слайд 52: Арены (ароматические углеводороды)
Строение бензола Энергия сопряжения 150 кДж/моль 52
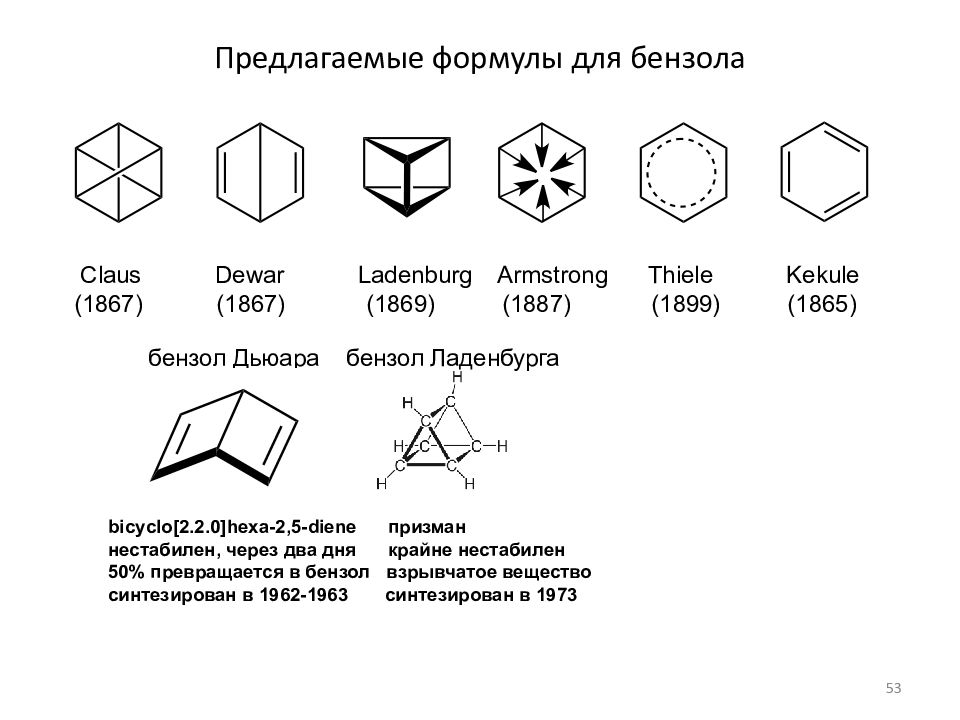
Слайд 53: Предлагаемые формулы для бензола
Claus Dewar Ladenburg Armstrong Thiele Kekule (1867) (1867) (1869) (1887) (1899) (1865) бензол Дьюара бензол Ладенбурга bicyclo[2.2.0]hexa-2,5-diene призман нестабилен, через два дня крайне нестабилен 50% превращается в бензол взрывчатое вещество синтезирован в 1962-1963 синтезирован в 1973 53
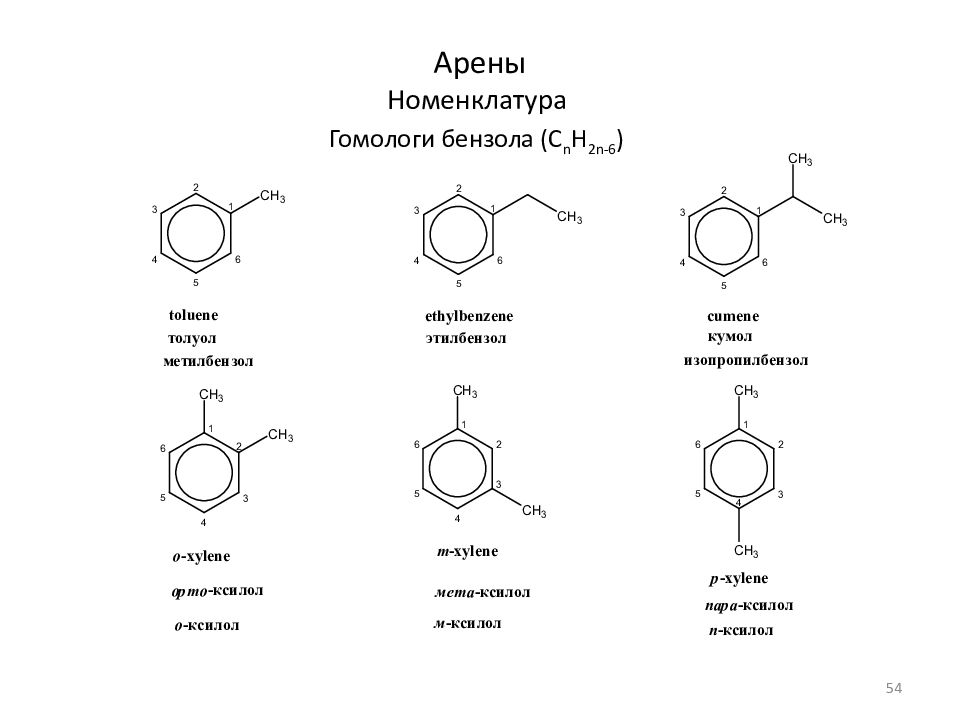
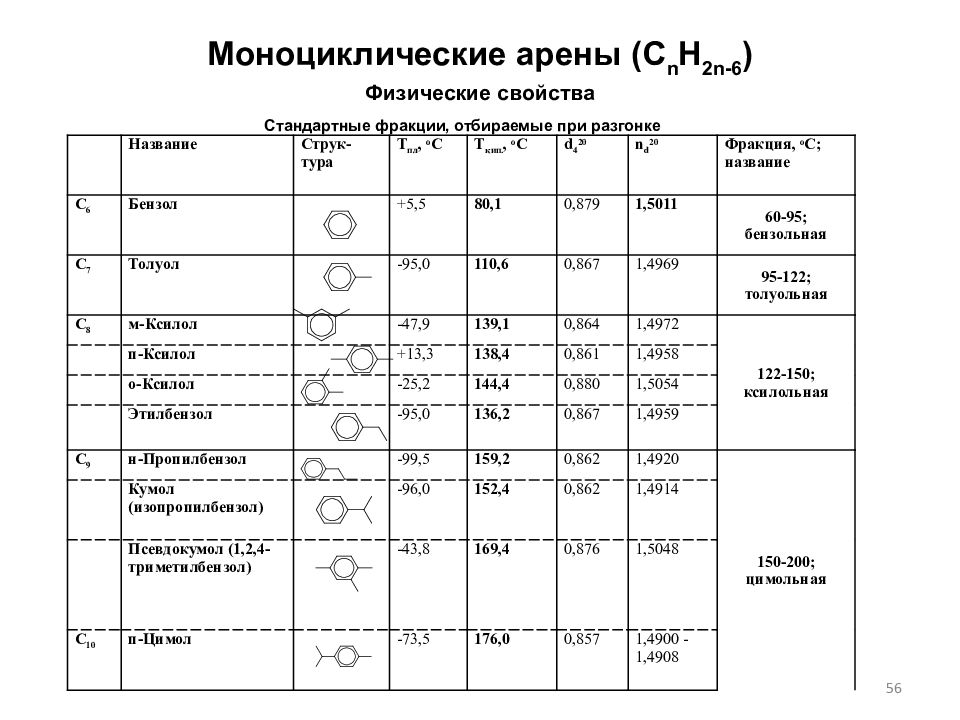
Слайд 56: Моноциклические арены (C n H 2n-6 ) Физические свойства
Название Струк - тура Т пл, o C Т кип., o C d 4 20 n d 20 Фракция, o C ; название C 6 Бензол +5,5 80,1 0,879 1,5011 60-95; бензольная C 7 Толуол -95,0 110,6 0,867 1,4969 95-122; толуольная C 8 м-Ксилол -47,9 139,1 0,864 1,4972 122-150; ксилольная п-Ксилол + 13,3 138,4 0,861 1,4958 о-Ксилол -25,2 144,4 0,880 1,5054 Этилбензол -95,0 136,2 0,867 1,4959 C 9 н-Пропилбензол -99,5 159,2 0,862 1,4920 150-200; цимольная Кумол (изопропилбензол) -96,0 152,4 0,862 1,4914 Псевдокумол (1,2,4-триметилбензол) -43,8 169,4 0,876 1,5048 C 10 п-Цимол -73,5 176,0 0,857 1,4900 -1,4908 Стандартные фракции, отбираемые при разгонке 56
Слайд 57
Определение группового углеводородного состава нефтяных фракций (до 200 о ) методом анилиновых точек Арены X=K(t-t 0 ), где X - содержание ароматических УВ во фракции, вес.% ; K - коэффициент, показывающий количество аром. УВ, соответствующее понижению анилиновой точки смеси насыщенных УВ на 1 о С; t - максимальная анилиновая точка фракции после удаления аром. УВ, о С ; t 0 - максимальная анилиновая точка исходной фракции, о С. ( ГОСТ 12329, ASTM D611 ) Нафтены Для фракций до 150 о С X 1 =K 1 (t 1 -t) /d 4 20, где X 1 - содержание нафтеновых УВ в деароматизированной фракции, вес.% ; K 1 – анилиновый коэффициент для нафтеновых УВ; t 1 – средняя максимальная анилиновая точка чистых парафиновых УВ, о С. d 4 20 - Плотность деароматизированной фракции Для фракций выше 150 о С X 1 =K 1 (t 1 -t) Содержание нафтеновых УВ ( вес.% ) на исходную фракцию ( X 2 ): X 2 = X 1 (100- X )/100 Парафины Содержание парафиновых УВ, вес.% : X 3 =100-( X + X 2 ) K, K1, t1 – табличные данные Олеум H 2 SO 4 ·xSO 3 или H 2 S 2 O 7 57
Слайд 58: Азеотропы с водой
Азеотропы Т кип, о С Азеотропы Т кип, о С 1 Бензол 80,1 Бензол 80,1 Бензол : вода 69 Этанол 78,3 91 : 9 3 Бензол : этанол : вода 2 Толуол 110,6 74 : 19 : 7 65 Толуол : вода 85 4 Бензол : вода 80 : 20 91 : 9 69 Люминесценция 58
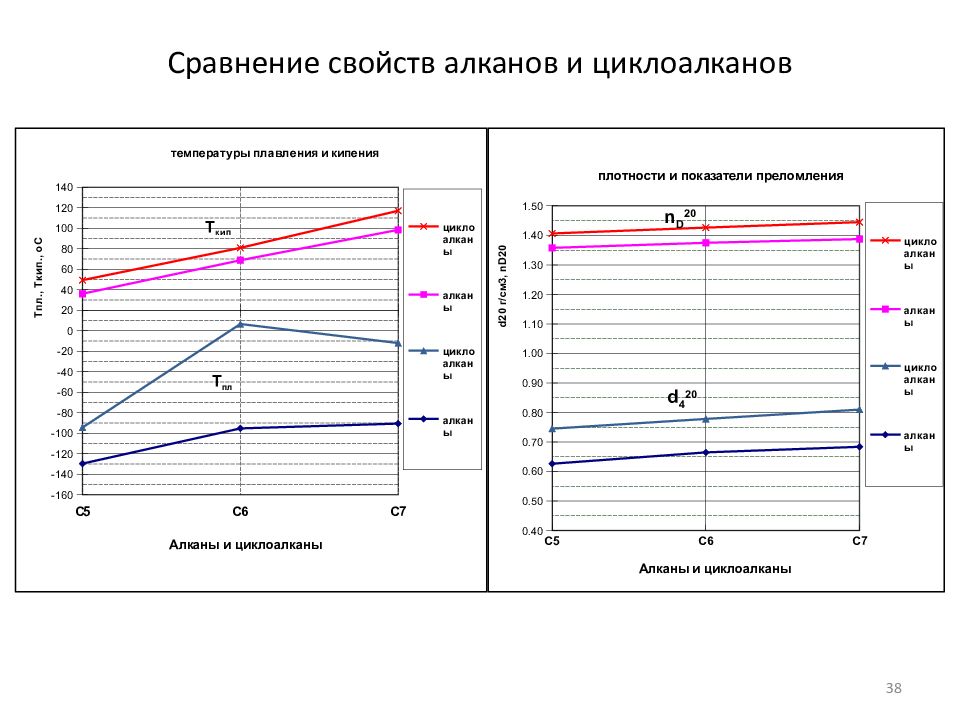
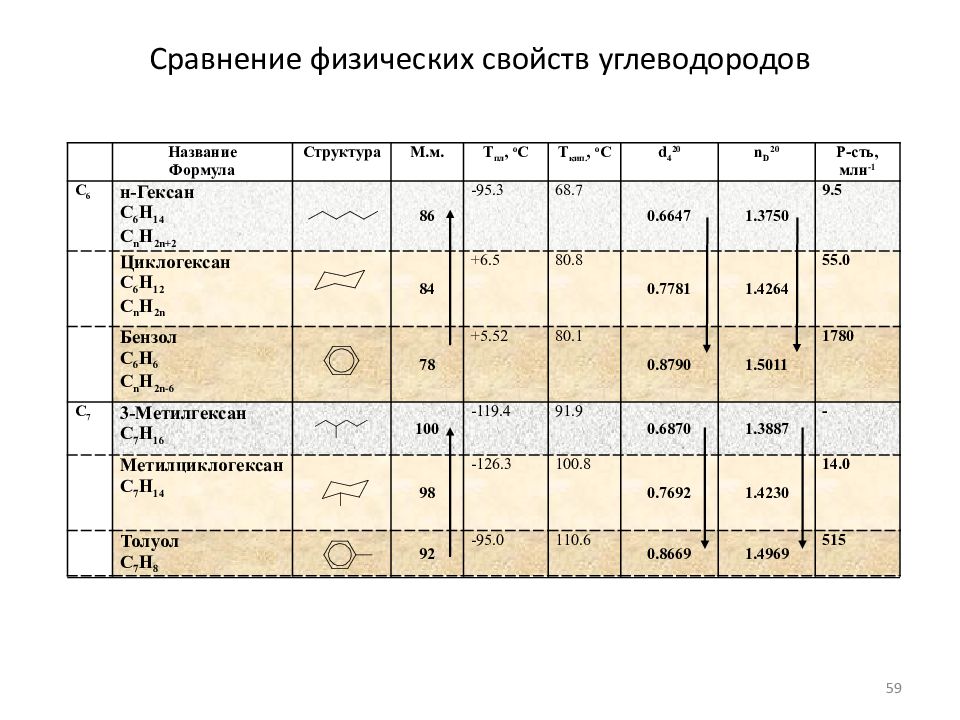
Слайд 59: Сравнение физических свойств углеводородов
Название Формула Структура М.м. Т пл, o C Т кип., o C d 4 20 n D 20 Р-сть, млн -1 C 6 н-Гексан C 6 H 14 C n H 2n+2 86 -95.3 68.7 0.6647 1.3750 9.5 Циклогексан C 6 H 1 2 C n H 2n 84 +6.5 80.8 0.7781 1.4264 55.0 Бензол C 6 H 6 C n H 2n-6 78 +5.52 80.1 0.8790 1.5011 1780 C 7 3-Метилгексан C 7 H 1 6 100 -119.4 91.9 0.6870 1.3887 - Метилциклогексан C 7 H 1 4 98 -126.3 100.8 0.7692 1.4230 14.0 Толуол C 7 H 8 92 -95.0 110.6 0.8669 1.4969 515 59
Слайд 60: Структурно-групповой анализ керосиновых, масляных и смолистых фракций нефтей
Метод позволяет найти долю атомов углерода (%), содержащихся: в ароматических кольцах С А, нафтеновых кольцах С н и в парафиновых цепях С п. С А +С н +С п = 100 % ; n и d определяются при 20 о С для жидких фракций и при 70 о С для твердых. Недостатком метода n—d—M является допущение, что все кольца в среднем содержат шесть атомов углерода. Кроме того, принимается, что если число колец в молекуле больше одного, то все кольца в ней находятся в катаконденсированном состоянии. Таким образом, предполагается, что при каждом дополнительном кольце привносятся четыре атома углерода. Применимость метода доказана для масляных фракций, содержащих до 75 % углерода в кольцевых структурах — ароматических и нафтеновых (при условии, что процентное содержание углерода в ароматических структурах не превышает более чем в 1,5 раза содержание его в нафтеновых, а число колец в молекуле не превышает четырех, из которых не более половины ароматические). По уравнениям или номограммам находят: С А, С кол - процентное содержание углерода в ароматических и кольчатых структурах ( ароматических+нафтеновых ) К А - среднее число ароматических колец в молекуле К о – общее число колец ( ароматических+нафтеновых ) С н =С кол -С А ; С п =100-С кол ; среднее число нафтеновых колец в молекуле К н =К о -К А ( ASTM D3238 ) Метод n-d-M : метод дает возможность составить представление о «средней» молекуле данной фракции и определять распределение углерода и содержание колец в УВ нефтяных фракций, кипящих выше 200 °С и не содержащих непредельных соединений. 60
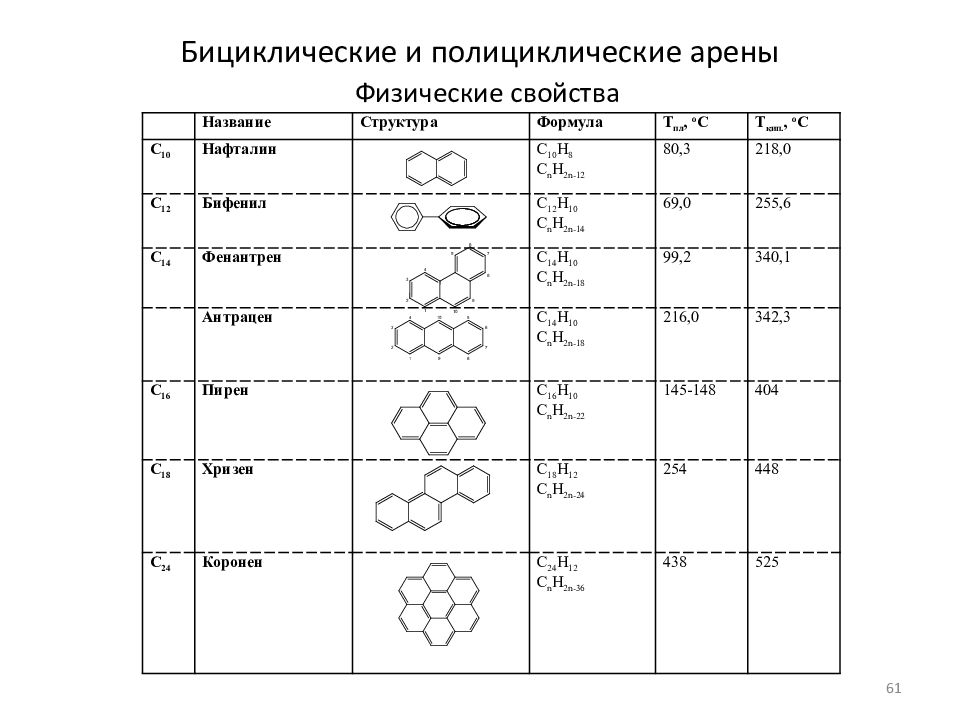
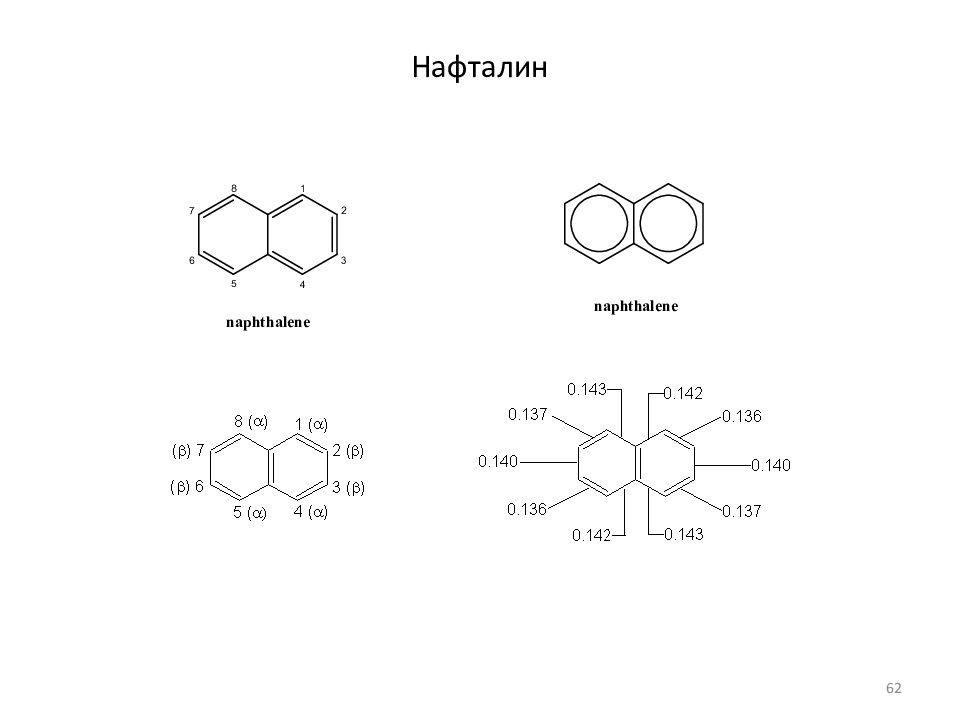
Слайд 61: Бициклические и полициклические арены
Физические свойства Название Структура Формула Т пл, o C Т кип., o C C 10 Нафталин C 10 H 8 C n H 2n-12 80,3 218,0 C 12 Бифенил C 12 H 10 C n H 2n-14 69,0 255,6 C 14 Фенантрен C 1 4 H 10 C n H 2n-1 8 99,2 340,1 Антрацен C 1 4 H 10 C n H 2n-1 8 216,0 342,3 C 16 Пирен C 1 6 H 10 C n H 2n- 22 145-148 404 C 18 Хризен C 1 8 H 1 2 C n H 2n- 24 254 448 C 24 Коронен C 24 H 1 2 C n H 2n- 36 438 525 61
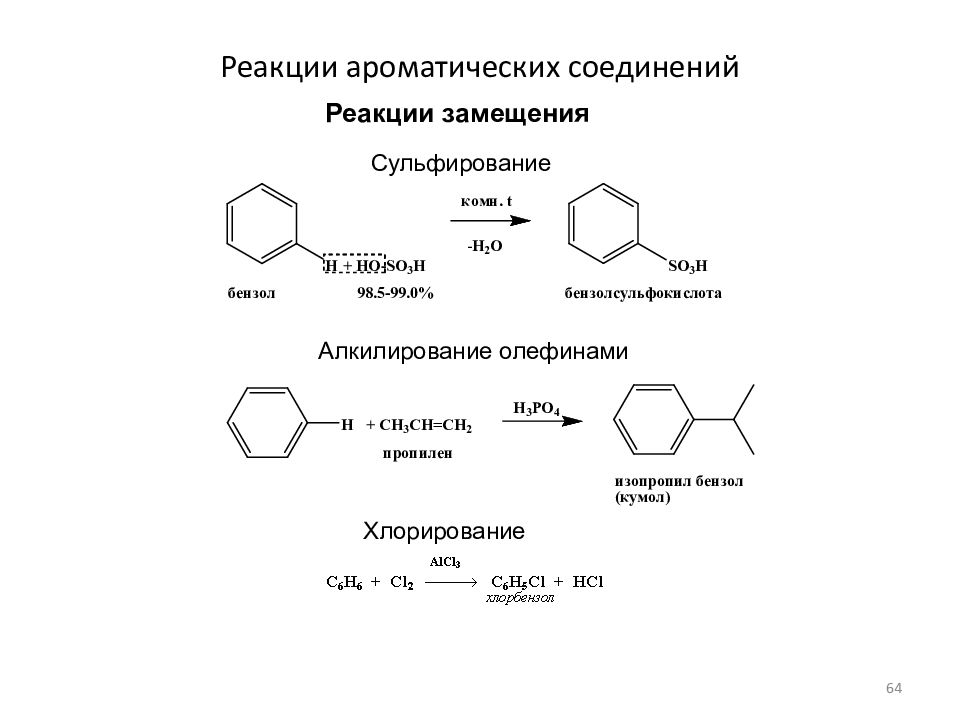
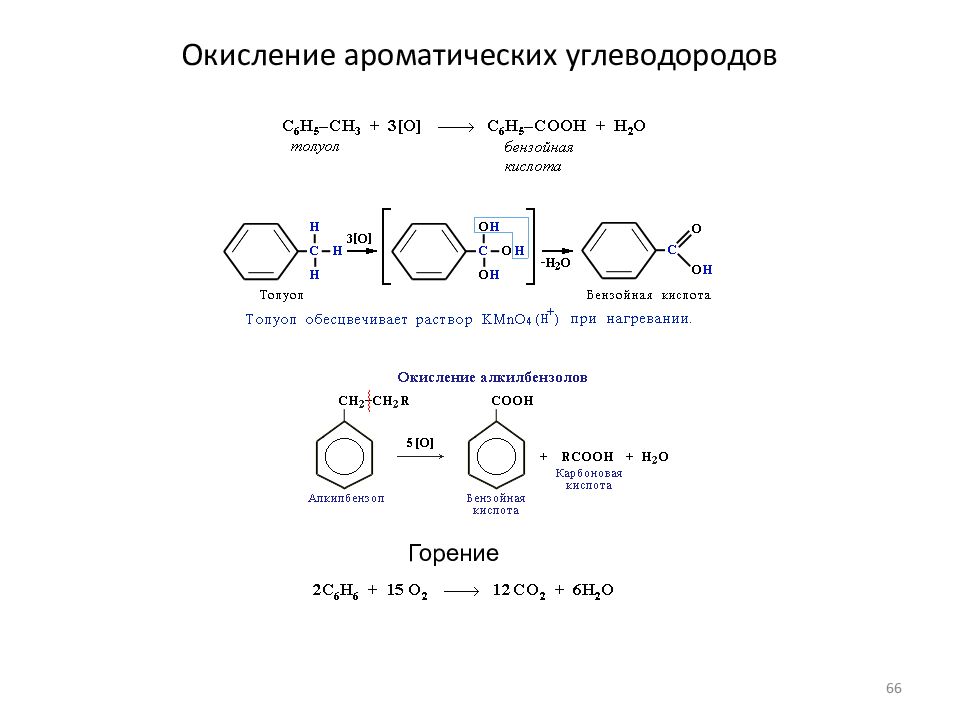
Слайд 64: Реакции ароматических соединений
Реакции замещения Алкилирование олефинами Сульфирование Хлорирование 64
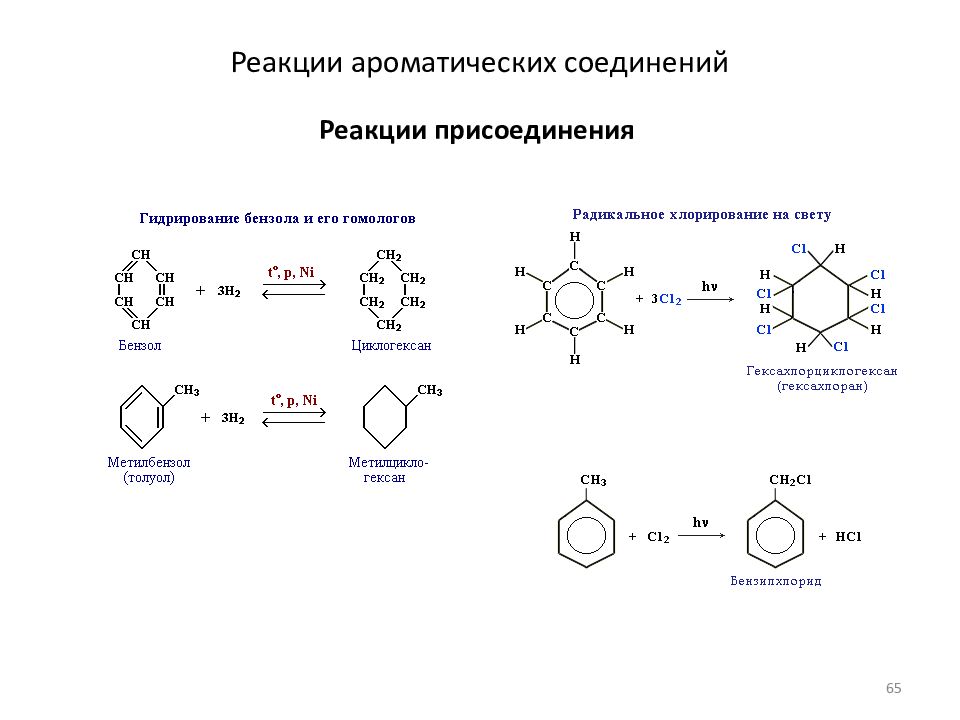
Слайд 65: Реакции ароматических соединений
Реакции присоединения Реакции ароматических соединений 65
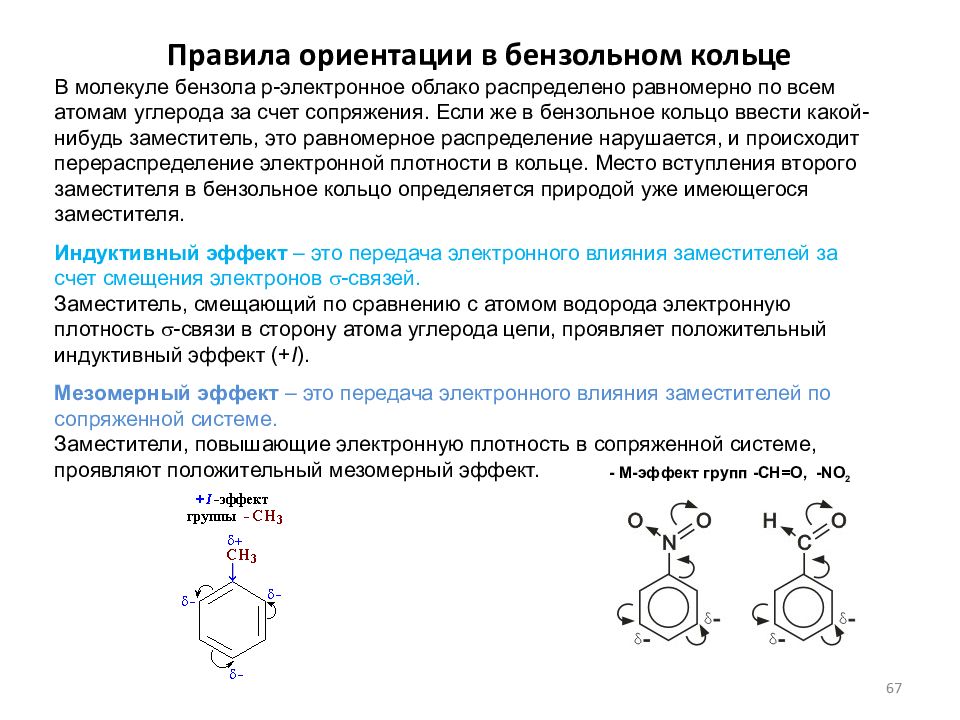
Слайд 67: Правила ориентации в бензольном кольце
В молекуле бензола p-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя. Индуктивный эффект – это передача электронного влияния заместителей за счет смещения электронов s -связей. Заместитель, смещающий по сравнению с атомом водорода электронную плотность s -связи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+ I ). Мезомерный эффект – это передача электронного влияния заместителей по сопряженной системе. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект. - M -эффект групп -СН=О, -NO 2 67
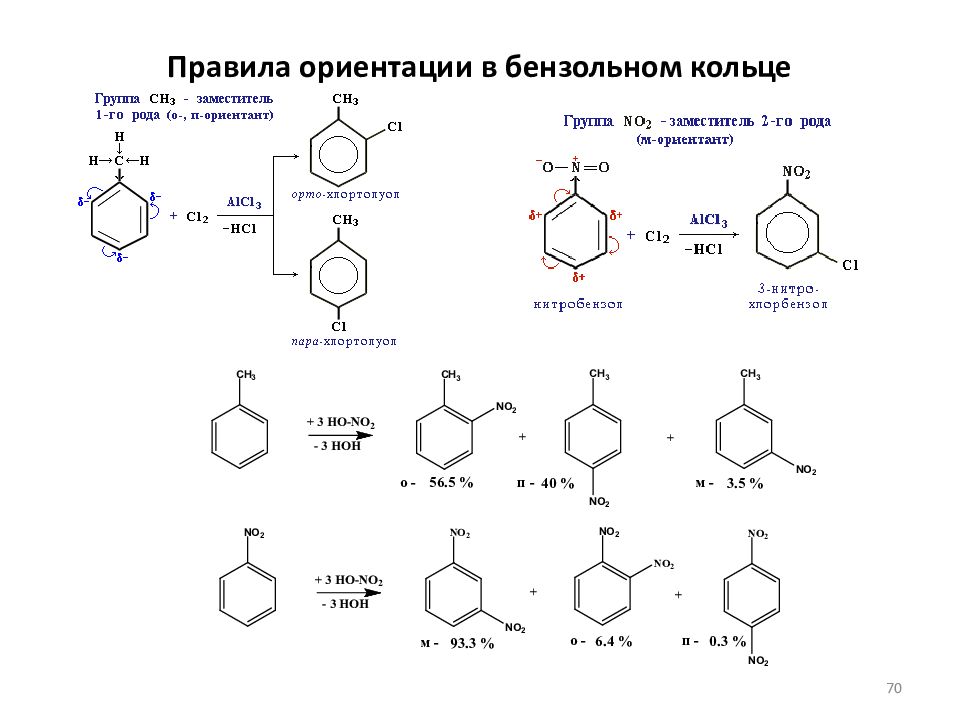
Слайд 68: Правила ориентации в бензольном кольце
I. Заместители, обладающие +I-эффектом или +M-эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода. -СН 3 (R-) -ОН (-OR) - NH 2 -CI (-F,- В r,-I) +I +M,-I +M,-I + М,- I Ориентанты 1-го рода, повышая электронную плотность в бензольном кольце, увеличивают его активность в реакциях электрофильного замещения по сравнению с незамещенным бензолом. Особое место среди ориентантов 1-го рода занимают галогены. Являясь орто-пара-ориентантами, они замедляют электрофильное замещение. Причина - сильный –I-эффект электроотрицательных атомов галогенов, понижащий электронную плотность в кольце. 68
Слайд 69: Правила ориентации в бензольном кольце
II. Заместители, обладающие -I-эффектом или - M-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода : -S0 3 H -ССl 3 -СООН -СН=О -NO 2 - М -I -М, -I -М, -I -M, –I Ориентанты 2-го рода уменьшают электронную плотность в бензольном кольце, особенно в орто- и пара-положениях. Поэтому электрофил атакует атомы углерода не в этих положениях, а в мета-положении, где электронная плотность несколько выше. Все ориентанты 2-го рода, уменьшая в целом электронную плотность в бензольном кольце, снижают его активность в реакциях электрофильного замещения. 69
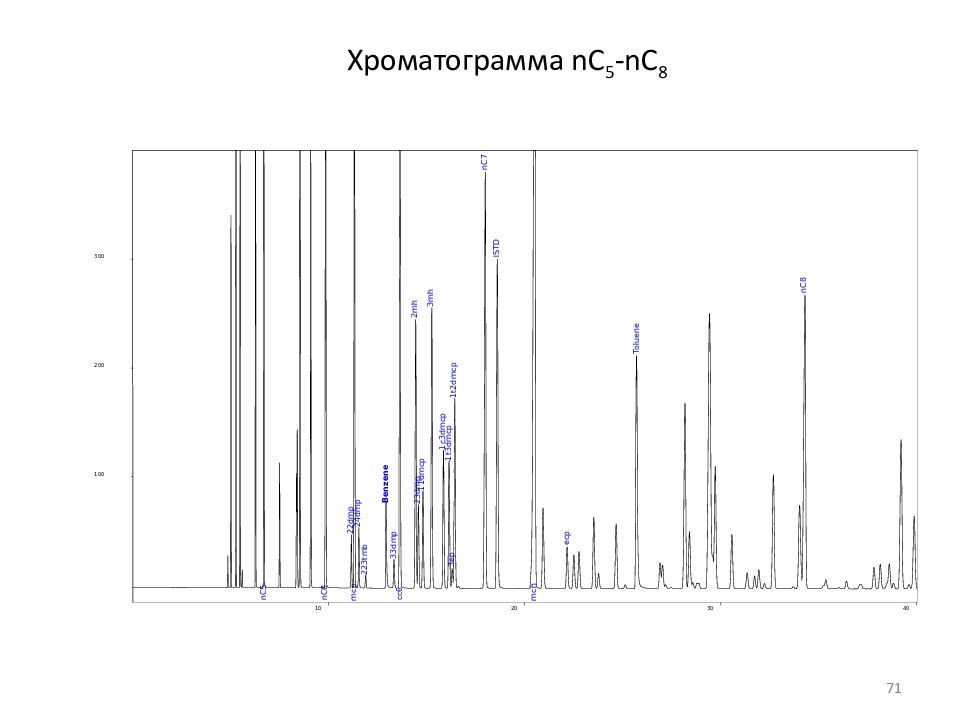
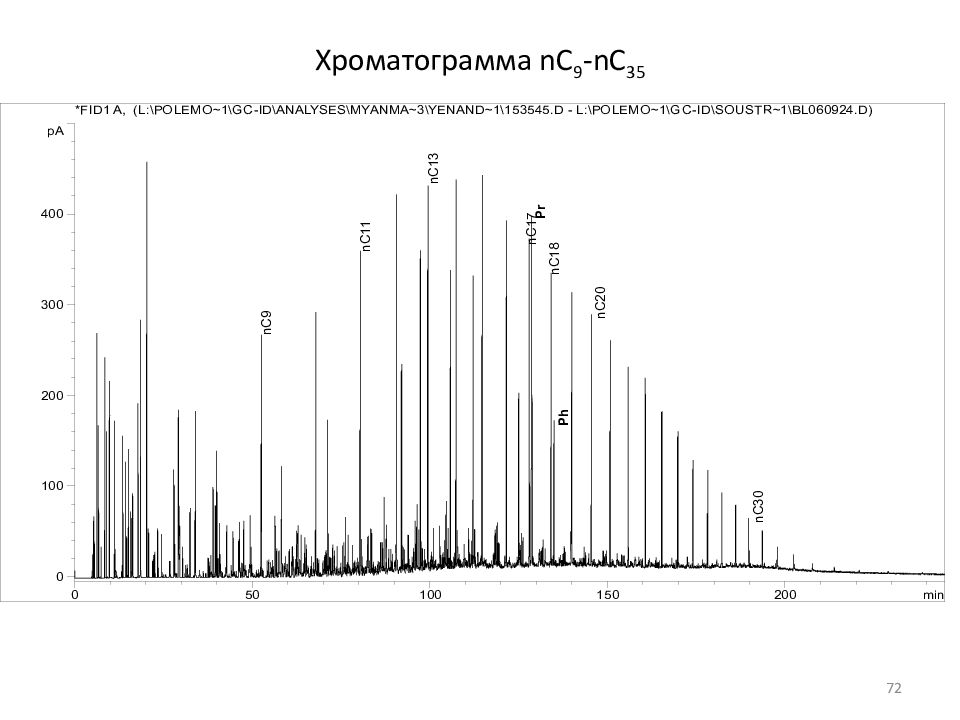
Слайд 71: Хроматограмма nC 5 -nC 8
nC5 nC6 22dmp mcp 24dmp 223tmb Benzene 33dmp cc6 2mh 23dmp 11dmcp 3mh 1c3dmcp 1t3dmcp 3ep 1t2dmcp nC7 ISTD mch ecp Toluene nC8 10 20 30 40 100 200 300 71
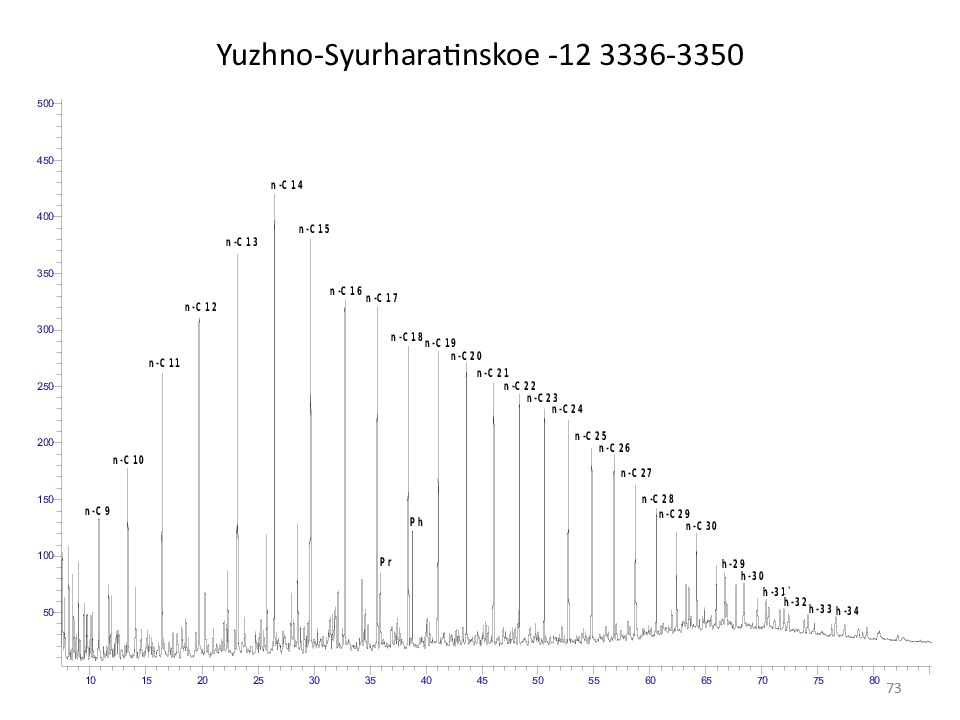
Слайд 75: Геохимические типы нефтей, биодеградация
Биодеградация нефтей (окисление микроорганизмами, биологическое окисление, биологическая эволюция) Биологическая эволюция: А1 А2 Б2 Б1 Условия (зависят от глубины залегания): T, Влага Аэробные и анаэробные условия Порядок биодеградации : н-алканы (в первую очередь С 12 -С 18 ) изо-, антеизо-алканы изопренаны (в последнюю очередь пристан и фитан ) моноциклические нафтены стераны, гопаны ароматические УВ Хемофоссилии ( биометки, биомаркеры ) - соединения, сохранившие явную структурную связь с исходными с исходными биомолекулами. А 1 ~ 200 0 м, 9 0 о С А 2 ~1 200м, 40 о С Б 2 ~1 200м, 40 о С Б 1 ~1 200м, 40 о С 75
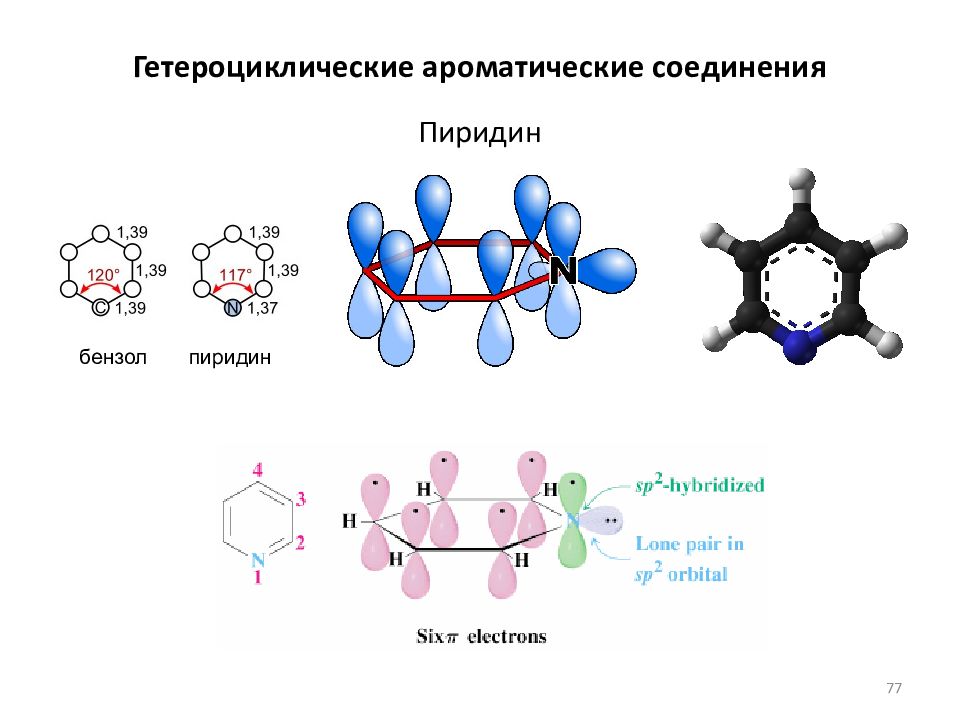
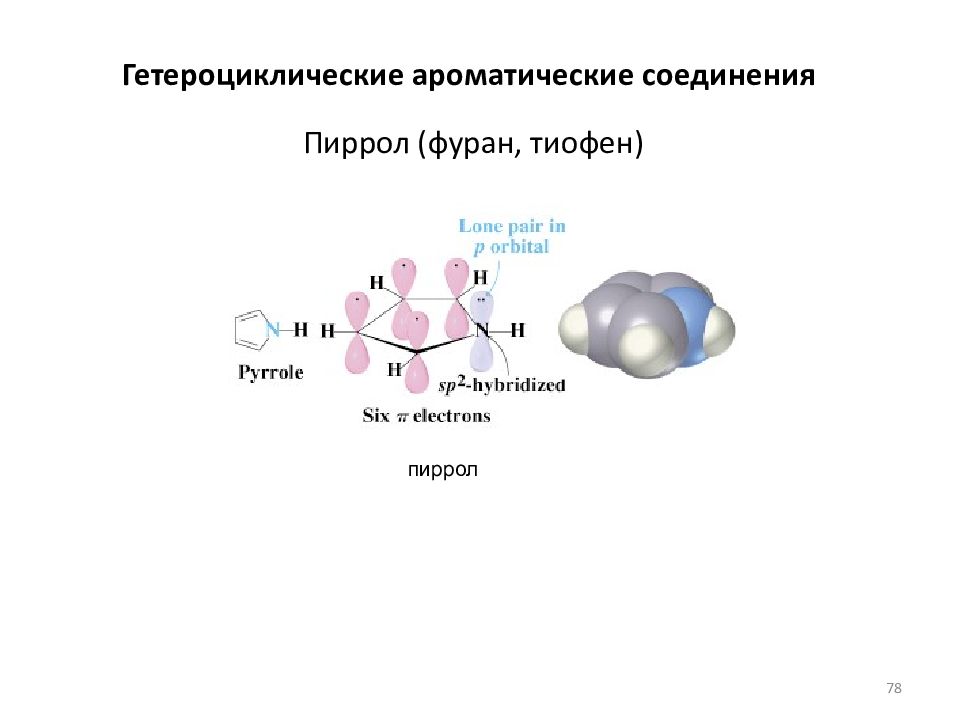
Слайд 78: Пиррол (фуран, тиофен)
пиррол Гетероциклические ароматические соединения 78
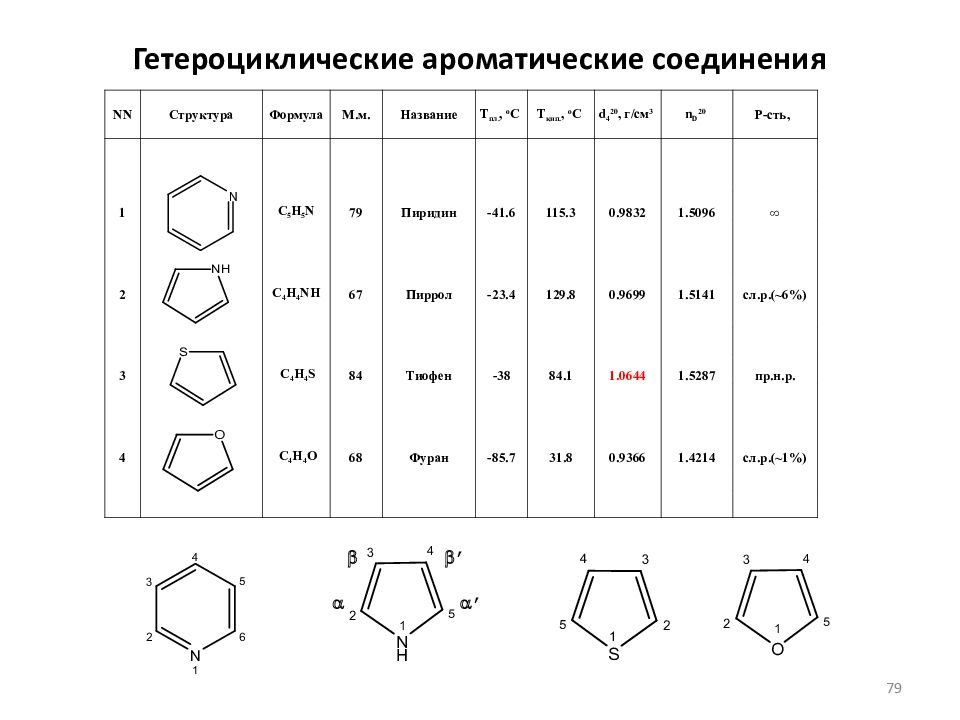
Слайд 79: Гетероциклические ароматические соединения
NN Структура Формула М.м. Название Т пл., o C Т кип., o C d 4 20, г/см 3 n D 20 Р-сть, 1 C 5 H 5 N 79 Пиридин -41.6 115.3 0.9832 1.5096 ∞ 2 C 4 H 4 NH 67 Пиррол -23.4 129.8 0.9699 1.5141 сл.р.(~6%) 3 C 4 H 4 S 84 Тиофен -38 84.1 1.0644 1.5287 пр.н.р. 4 C 4 H 4 O 68 Фуран -85.7 31.8 0.9366 1.4214 сл.р.(~1%) a b a ’ b ’ 79
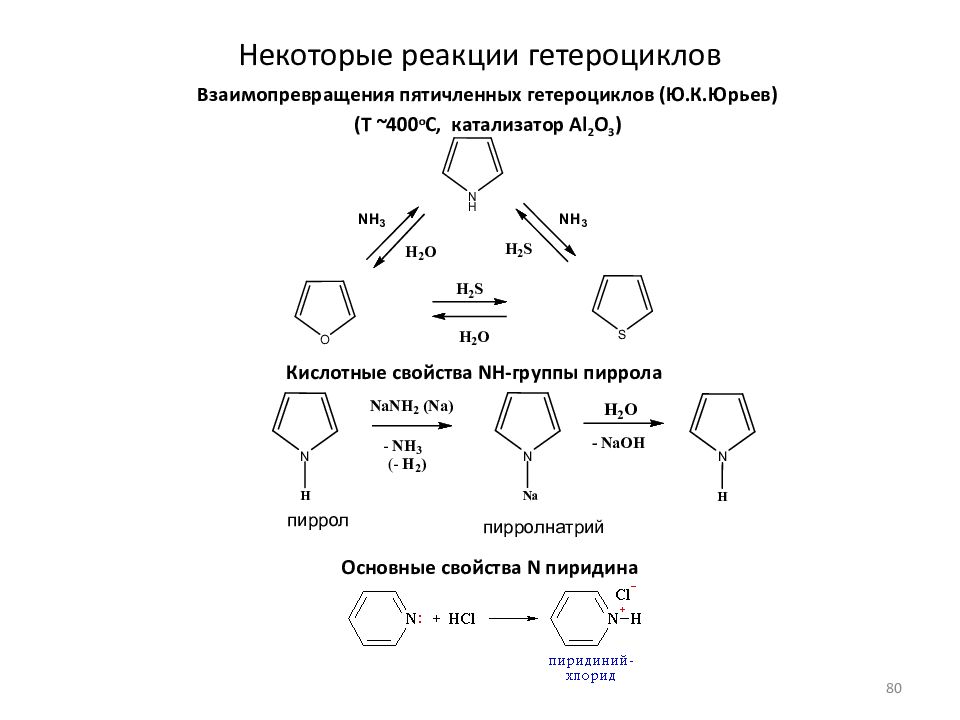
Слайд 80: Некоторые реакции гетероциклов
Взаимопревращения пятичленных гетероциклов (Ю.К.Юрьев) (T ~400 o C, катализатор Al 2 O 3 ) пиррол пирролнатрий Кислотные свойства NH- группы пиррола Основные свойства N пиридина 80
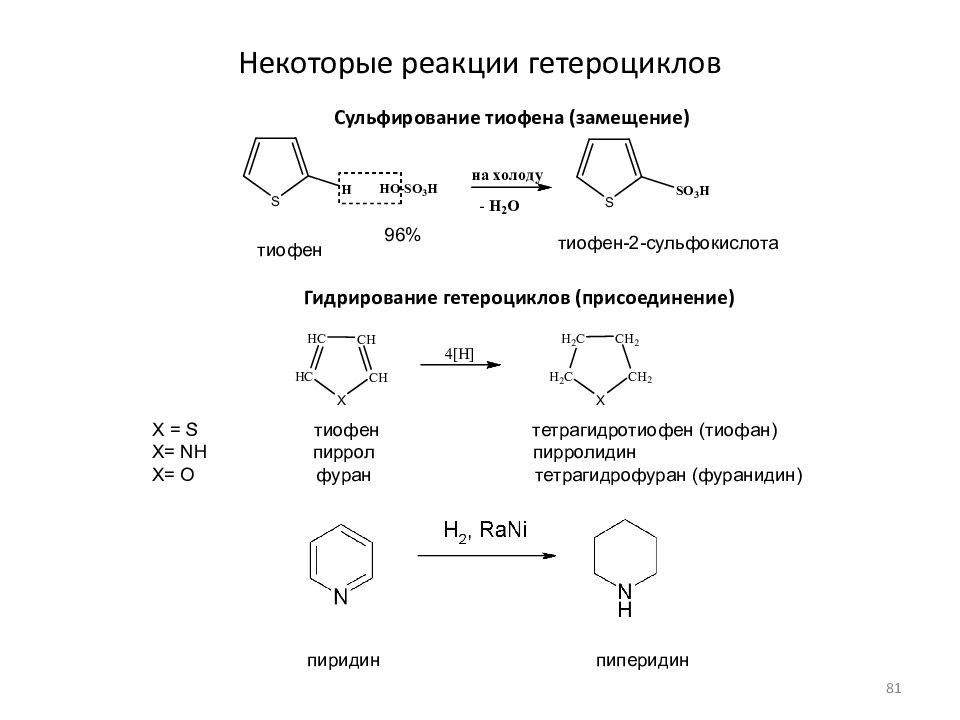
Слайд 81: Некоторые реакции гетероциклов
Сульфирование тиофена (замещение) тиофен тиофен-2-сульфокислота Гидрирование гетероциклов (присоединение) X = S тиофен тетрагидротиофен (тиофан) X= NH пиррол пирролидин X= O фуран тетрагидрофуран (фуранидин) пиридин пиперидин 96% 81
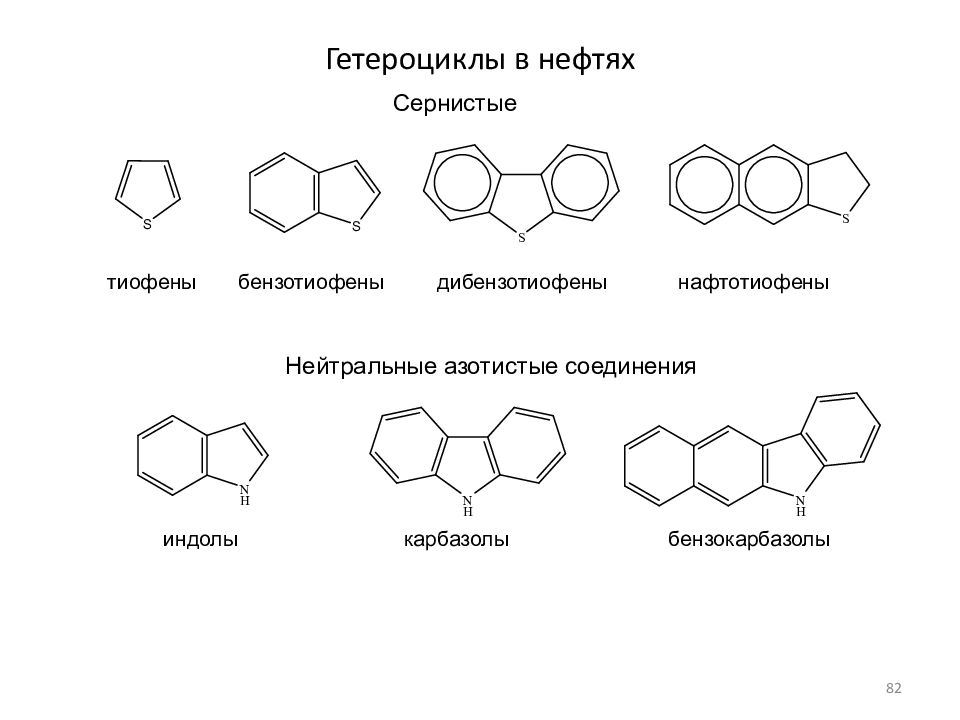
Слайд 82: Гетероциклы в нефтях
тиофены бензотиофены дибензотиофены нафтотиофены индолы карбазолы бензокарбазолы Сернистые Нейтральные азотистые соединения 82
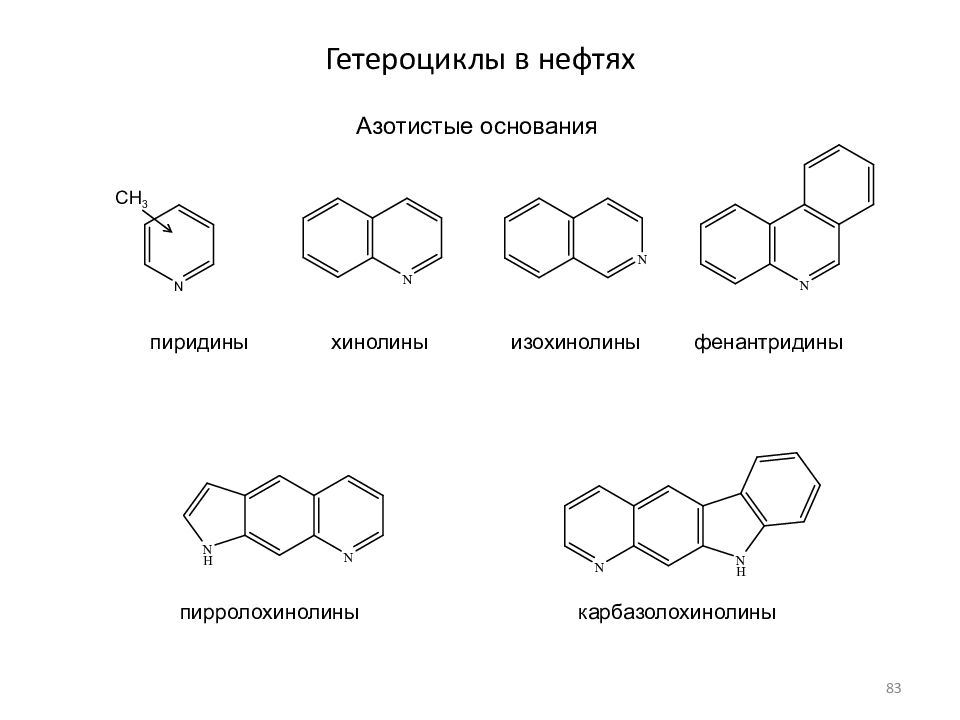
Слайд 83: Гетероциклы в нефтях
Азотистые основания CH 3 пиридины хинолины изохинолины фенантридины пирролохинолины карбазолохинолины 83
Слайд 84: ХЛОРОФИЛЛ
ХЛОРОФИ́ЛЛ (от греч. χλωρός, «зелёный» и φύλλον, «лист») — зелёный пигмент, обусловливающий окраску ХЛОРОПЛАСТОВ - особых клеточных структур - растений в зелёный цвет, в хлоропластах он связан с белками и липидами этих структур. При его участии осуществляется процесс фотосинтеза. По химическому строению хлорофиллы — магниевые комплексы различных тетрапирролов. Хлорофиллы имеют порфириновое строение и структурно близки гему. ХЛОРОПЛА́СТЫ (от греч. «chloros» — зеленый и «plastos» - вылепленный, образованный), внутриклеточные органоиды растительной клетки, в которых осуществляется фотосинтез; окрашены в зеленый цвет (в них присутствует хлорофилл). Реакция фотосинтеза : 6 CO 2 ( газ) + 12 H 2 O 18 ( ж ) C 6 H 12 O 6 + 6 O 2 18 + 6 H 2 O фотон 84
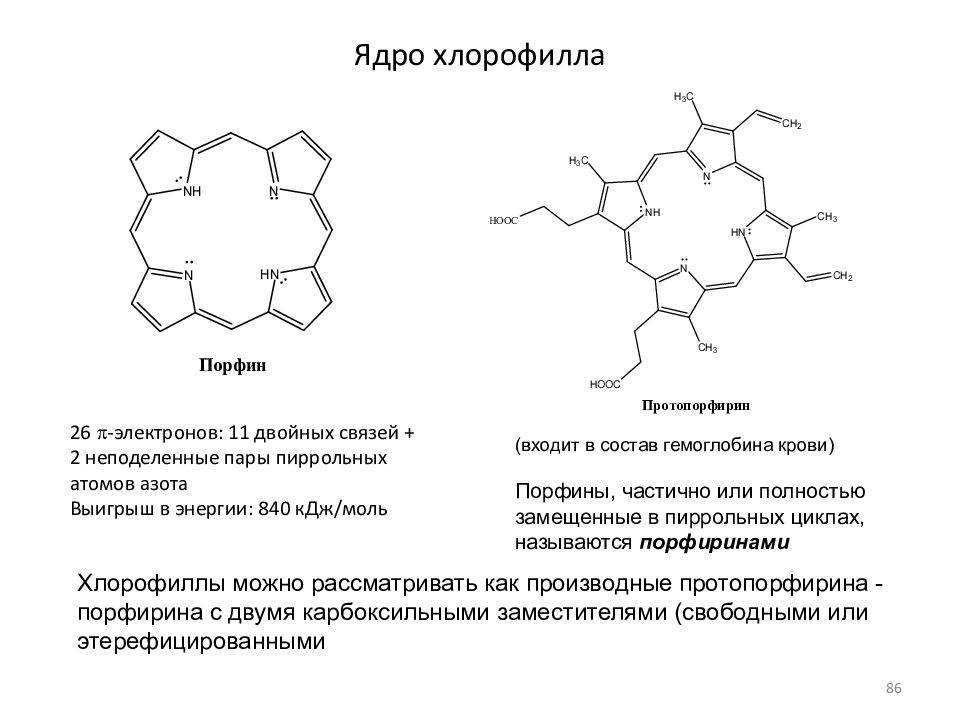
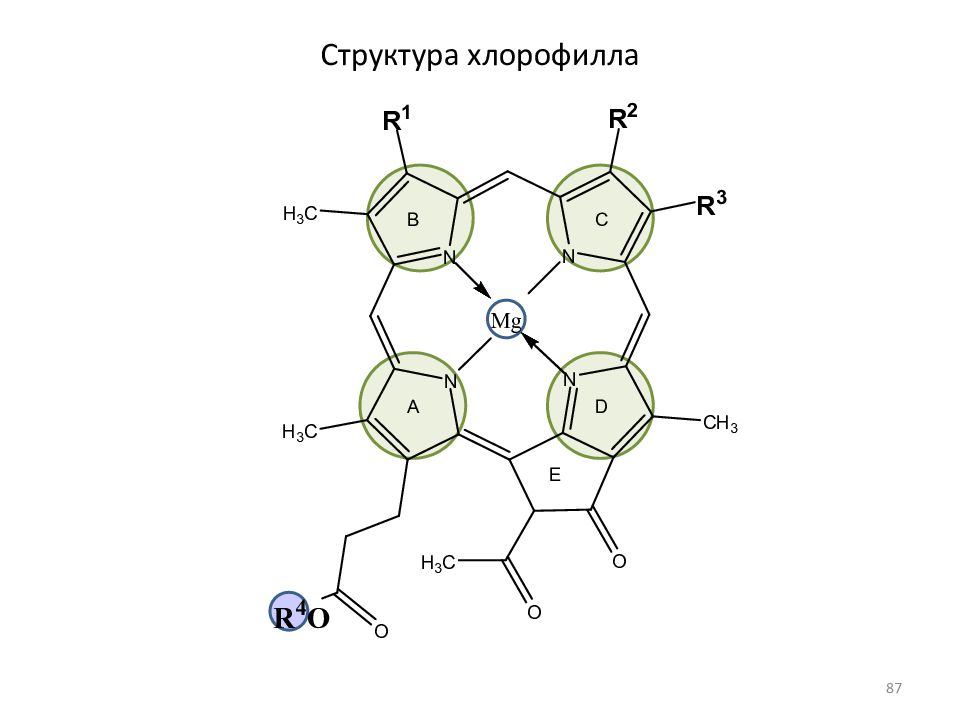
Слайд 86: Ядро хлорофилла
26 p -электронов: 11 двойных связей + 2 неподеленные пары пиррольных атомов азота Выигрыш в энергии: 840 кДж/моль (входит в состав гемоглобина крови) Порфины, частично или полностью замещенные в пиррольных циклах, называются порфиринами Хлорофиллы можно рассматривать как производные протопорфирина - порфирина с двумя карбоксильными заместителями (свободными или этерефицированными 86
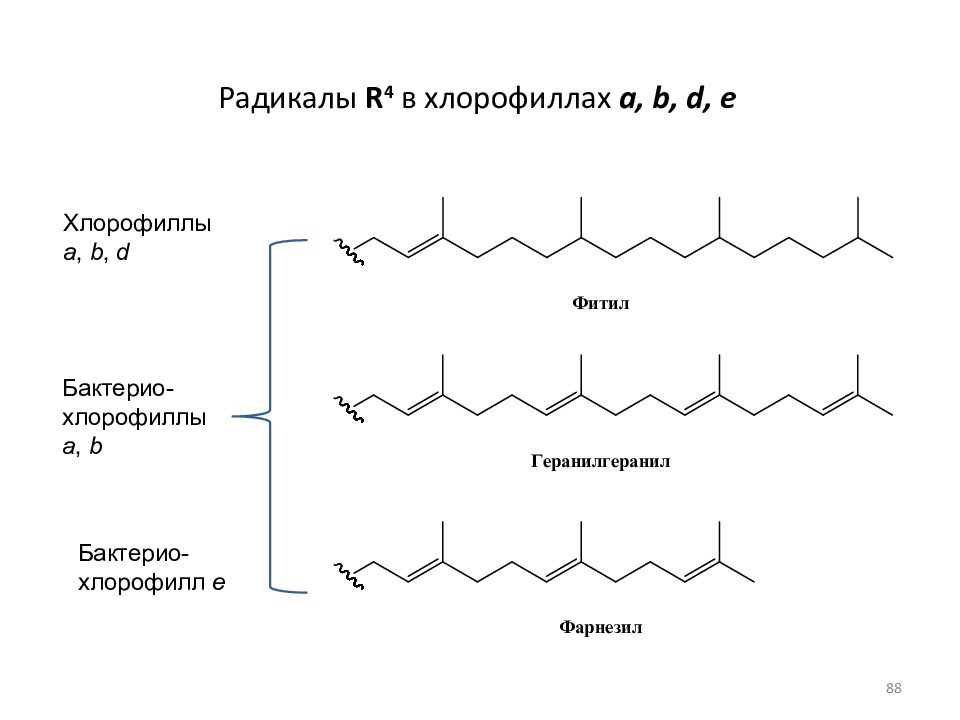
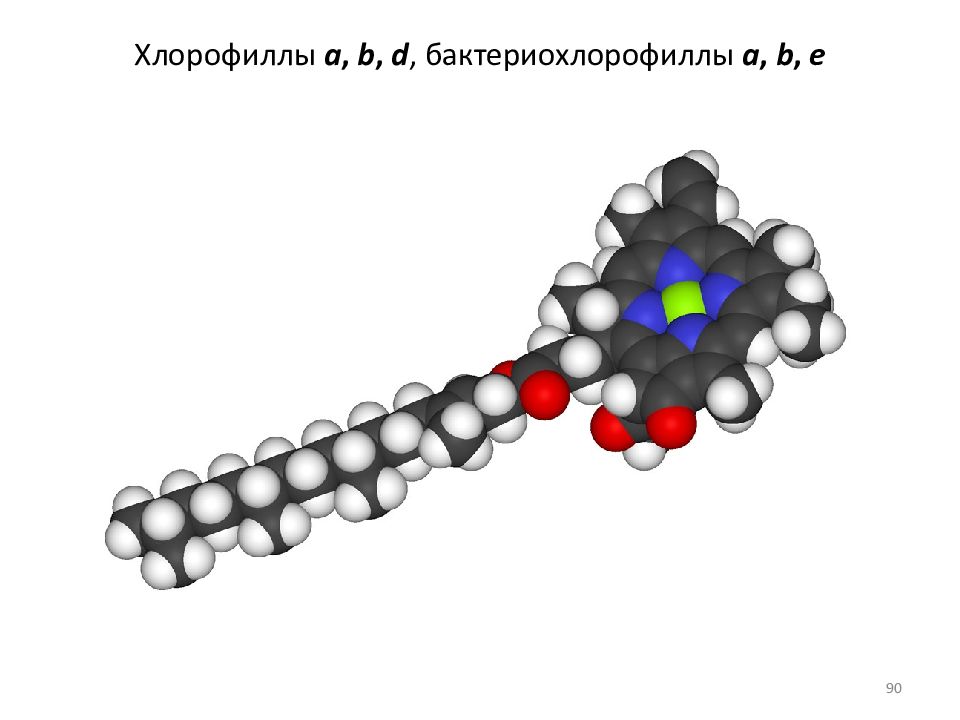
Слайд 88: Радикалы R 4 в хлорофиллах a, b, d, e
Хлорофиллы a, b, d Бактерио- хлорофилл e Бактерио- x лорофиллы a, b 88
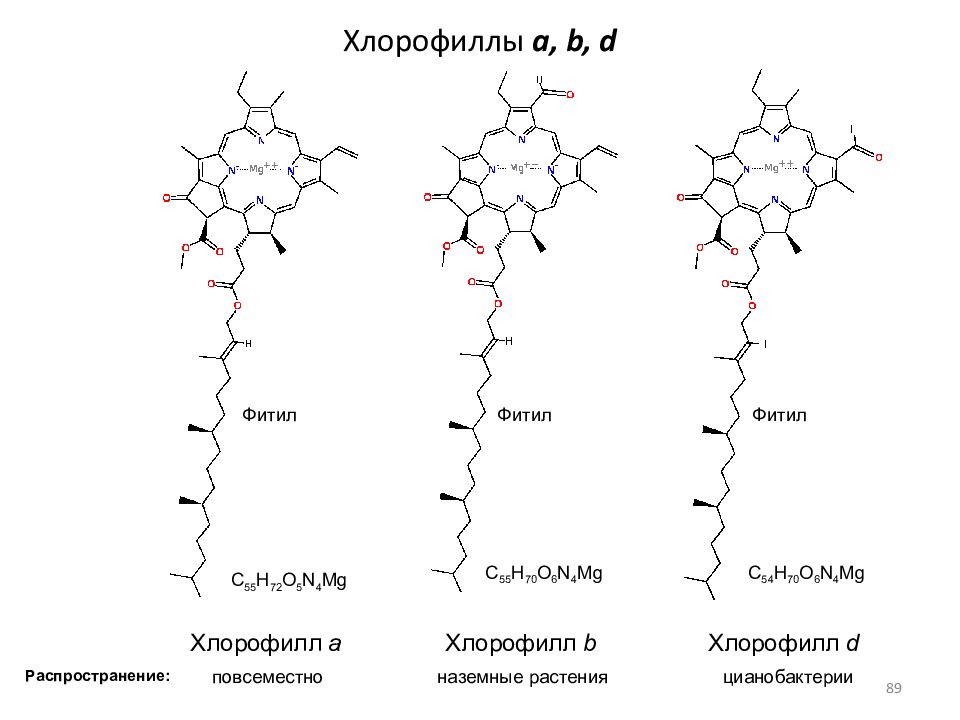
Слайд 89: Хлорофиллы a, b, d
Хлорофилл a Хлорофилл b Хлорофилл d Фитил Фитил Фитил Распространение: цианобактерии наземные растения повсеместно C 55 H 72 O 5 N 4 Mg C 55 H 70 O 6 N 4 Mg C 54 H 70 O 6 N 4 Mg 89
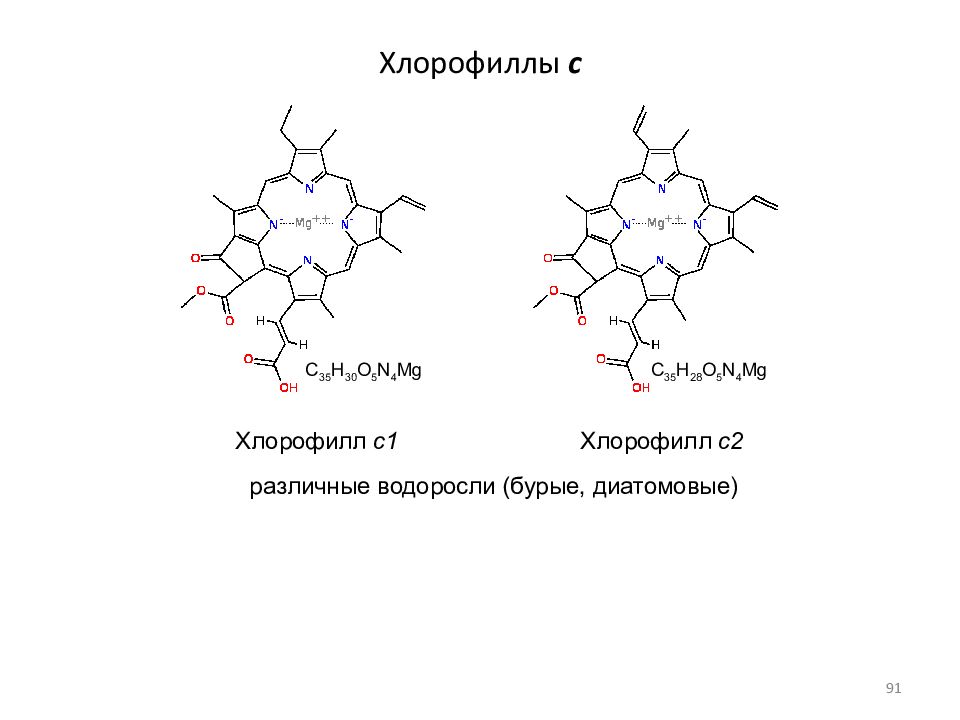
Слайд 91: Хлорофиллы c
Хлорофилл c1 Хлорофилл c2 различные водоросли (бурые, диатомовые) C 35 H 30 O 5 N 4 Mg C 35 H 28 O 5 N 4 Mg 91
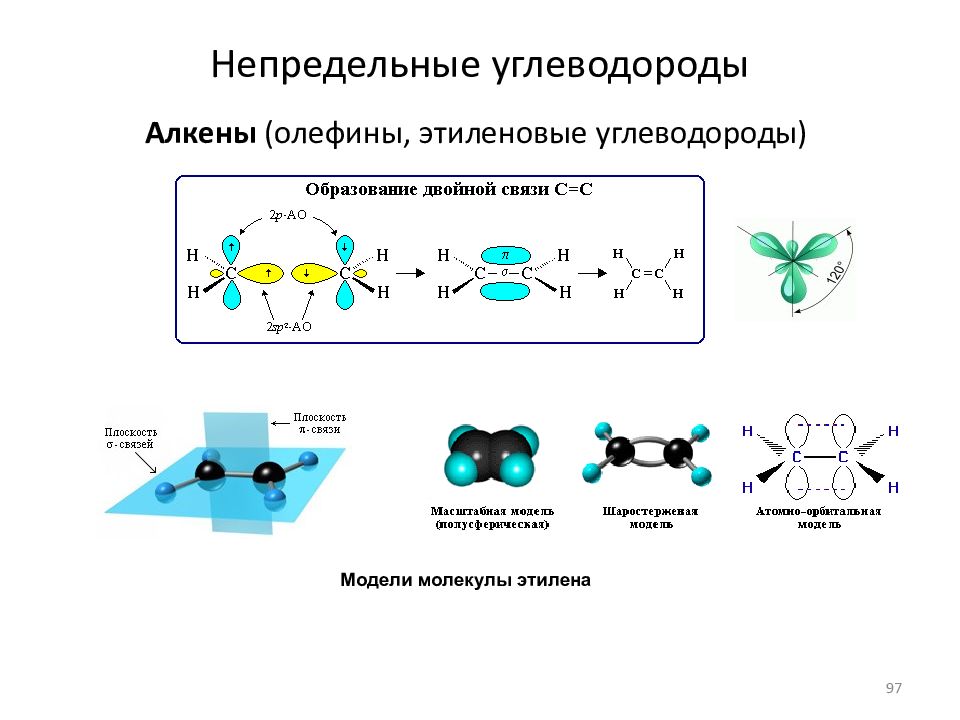
Слайд 97: Непредельные углеводороды
Алкены (олефины, этиленовые углеводороды) Модели молекулы этилена 97
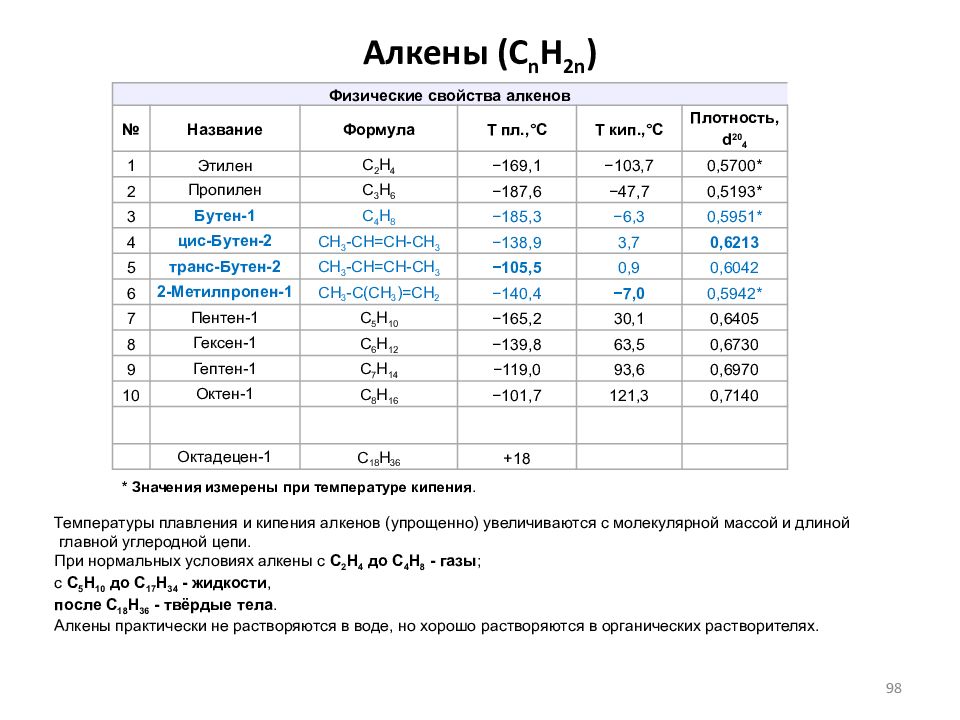
Слайд 98: Алкены ( C n H 2n )
Физические свойства алкенов № Название Формула Т пл.,°С Т кип.,°С Плотность, d 20 4 1 Этилен С 2 H 4 −169,1 −103,7 0,5700* 2 Пропилен C 3 H 6 −187,6 −47,7 0,5193* 3 Бутен-1 C 4 H 8 −185,3 −6,3 0,5951* 4 цис-Бутен-2 CH 3 -CH=CH-CH 3 −138,9 3,7 0,6213 5 транс-Бутен-2 CH 3 -CH=CH-CH 3 −105,5 0,9 0,6042 6 2-Метилпропен-1 CH 3 -C(CH 3 )=CH 2 −140,4 −7,0 0,5942* 7 Пентен-1 С 5 H 10 −165,2 30,1 0,6405 8 Гексен-1 С 6 H 12 −139,8 63,5 0,6730 9 Гептен-1 С 7 H 14 −119,0 93,6 0,6970 10 Октен-1 С 8 H 16 −101,7 121,3 0,7140 Октадецен-1 С 18 H 36 +18 * Значения измерены при температуре кипения. Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях алкены с C 2 H 4 до C 4 H 8 - газы ; с C 5 H 10 до C 17 H 34 - жидкости, после C 18 H 36 - твёрдые тела. Алкены практически не растворяются в воде, но хорошо растворяются в органических растворителях. 98
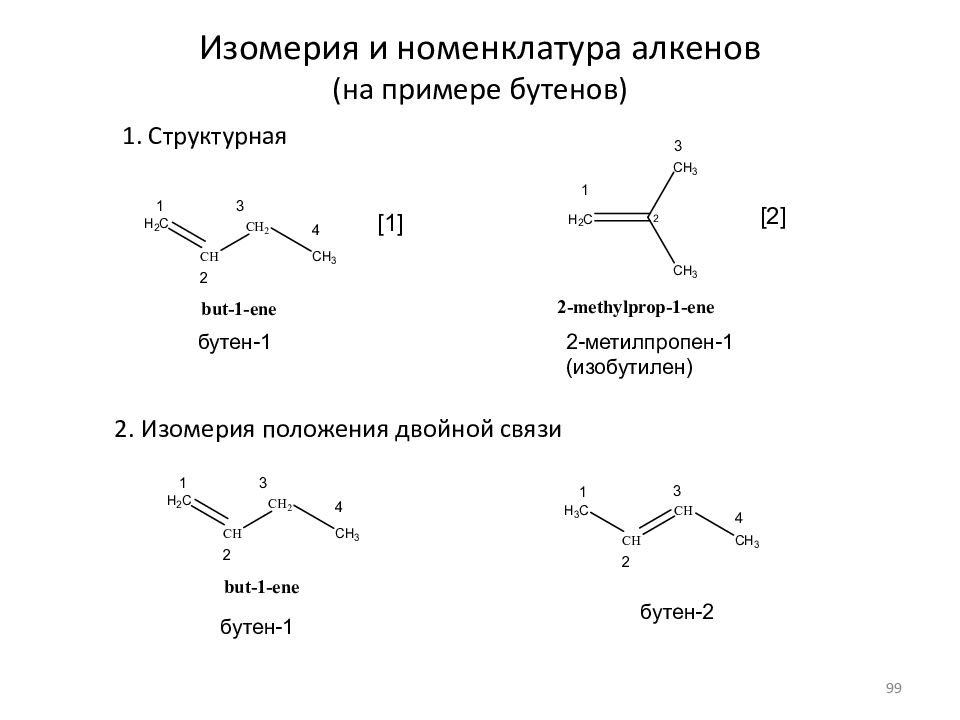
Слайд 99: Изомерия и номенклатура алкенов (на примере бутенов)
1. Структурная 2. Изомерия положения двойной связи бутен-1 2-метилпропен-1 (изобутилен) бутен-1 бутен-2 [ 1 ] [ 2 ] 99
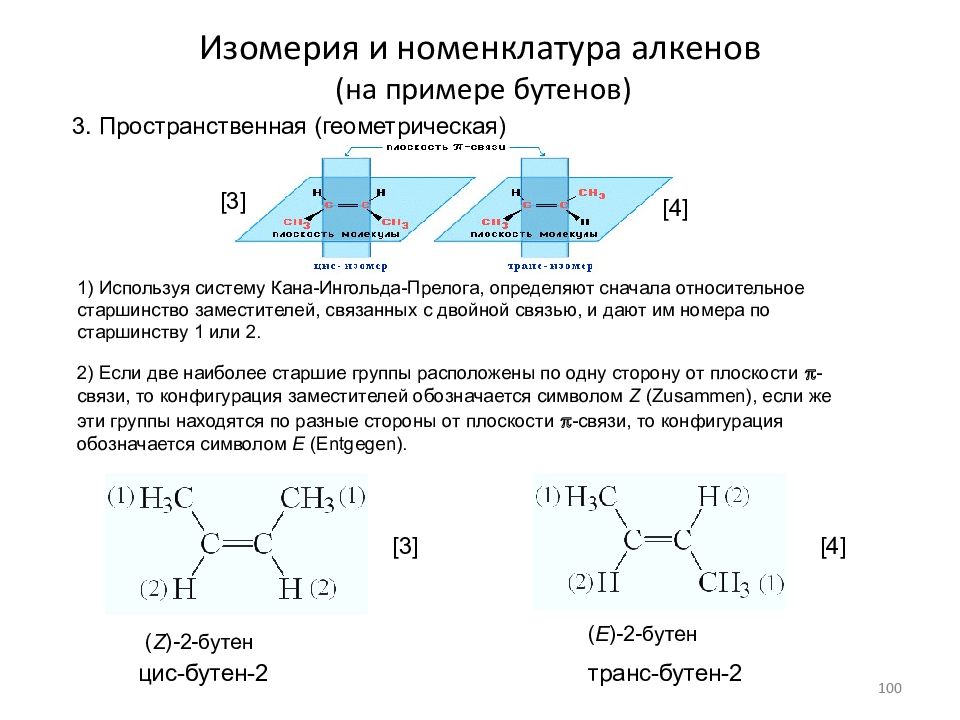
Слайд 100: Изомерия и номенклатура алкенов (на примере бутенов)
1) Используя систему Кана-Ингольда-Прелога, определяют сначала относительное старшинство заместителей, связанных с двойной связью, и дают им номера по старшинству 1 или 2. 2) Если две наиболее старшие группы расположены по одну сторону от плоскости p -связи, то конфигурация заместителей обозначается символом Z (Zusammen), если же эти группы находятся по разные стороны от плоскости p -связи, то конфигурация обозначается символом Е (Entgegen). ( Е )-2-бутен ( Z )-2- бутен транс-бутен-2 цис-бутен-2 3. Пространственная (геометрическая) [3] [4] [3] [4] 100
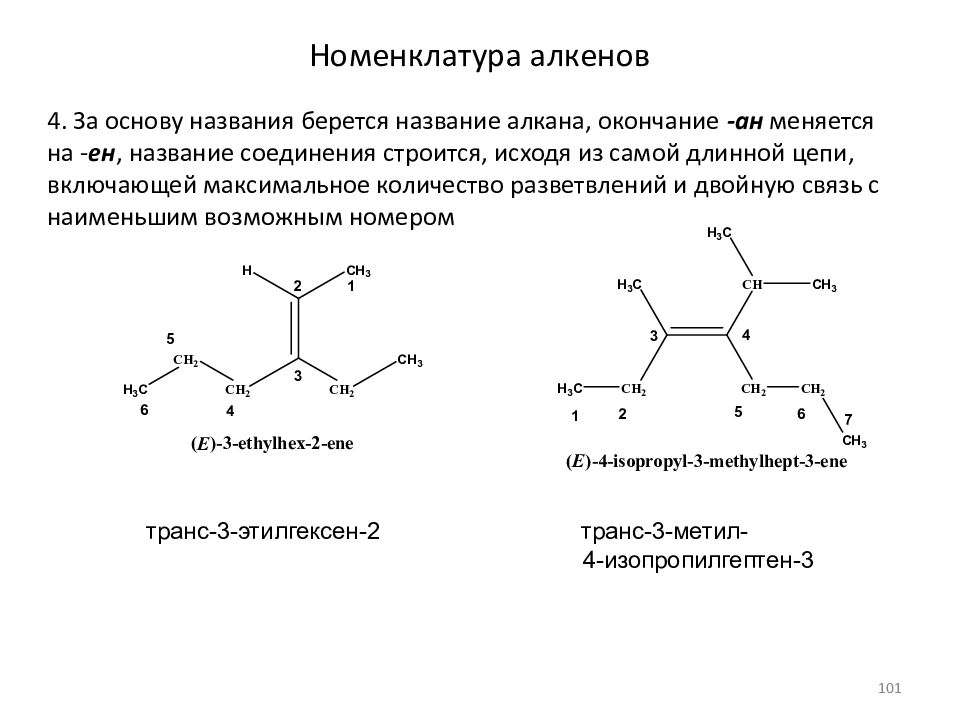
Слайд 101: Номенклатура алкенов
4. За основу названия берется название алкана, окончание -ан меняется на - ен, название соединения строится, исходя из самой длинной цепи, включающей максимальное количество разветвлений и двойную связь с наименьшим возможным номером транс-3-этилгексен-2 транс-3-метил- 4-изопропилгептен-3 101
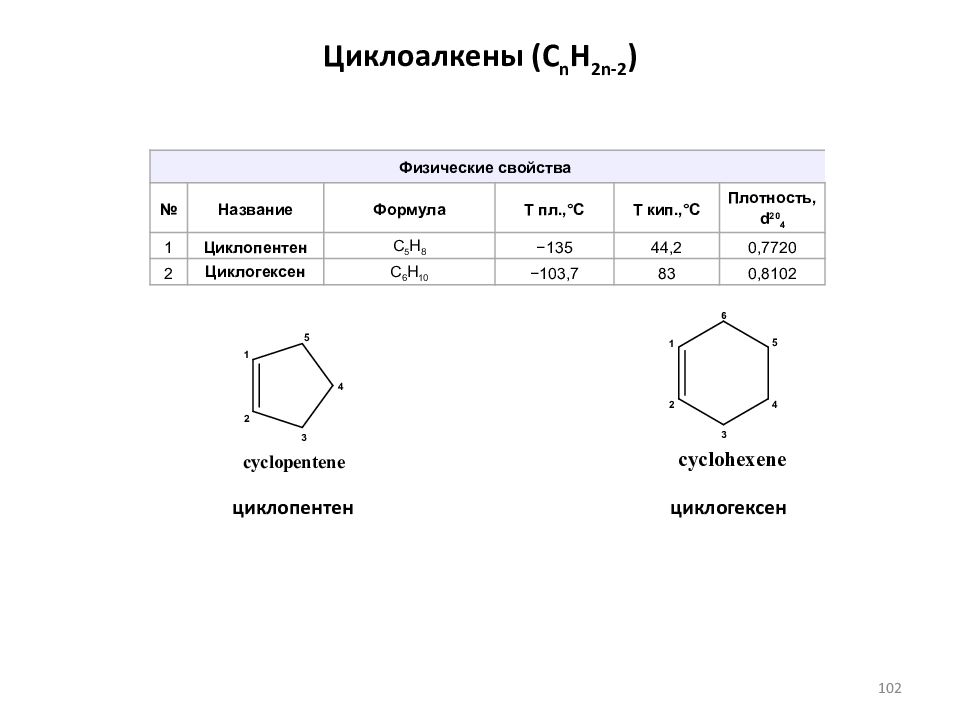
Слайд 102: Циклоалкены ( C n H 2n-2 )
циклопентен циклогексен Физические свойства № Название Формула Т пл.,°С Т кип.,°С Плотность, d 20 4 1 Циклопентен С 5 H 8 − 1 35 44, 2 0,7 720 2 Циклогексен C 6 H 10 − 1 03, 7 83 0, 8102 102
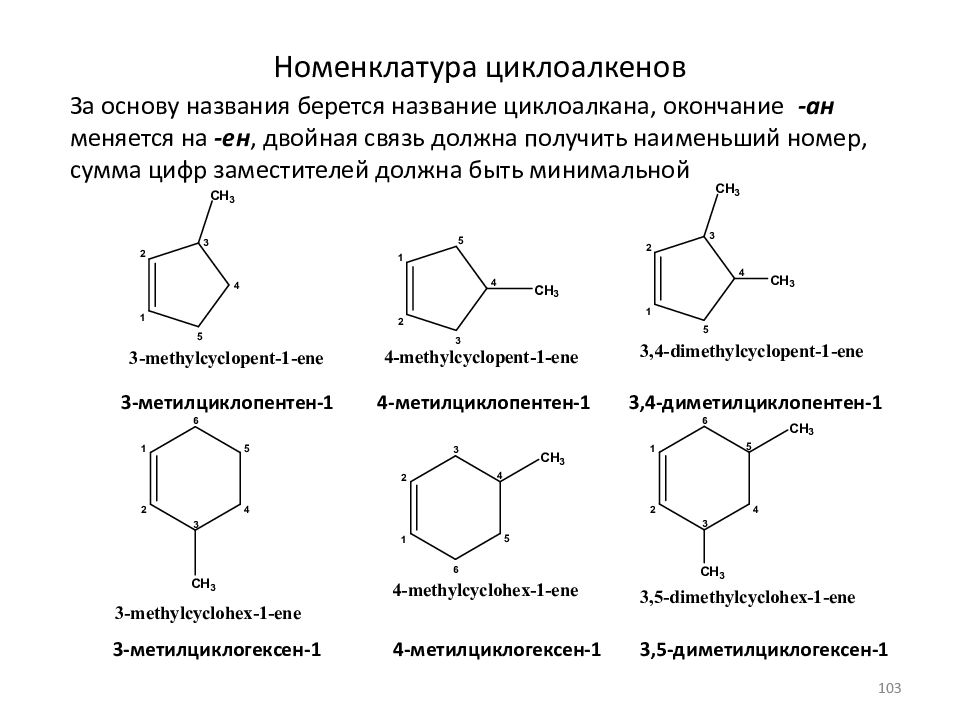
Слайд 103: Номенклатура циклоалкенов
За основу названия берется название циклоалкана, окончание -ан меняется на -ен, двойная связь должна получить наименьший номер, сумма цифр заместителей должна быть минимальной 3- метилциклопентен -1 4 - метилциклопентен -1 3,4-диметилциклопентен-1 3- метилциклогексен -1 4 - метилциклогексен -1 3,5-диметилциклогексен-1 103
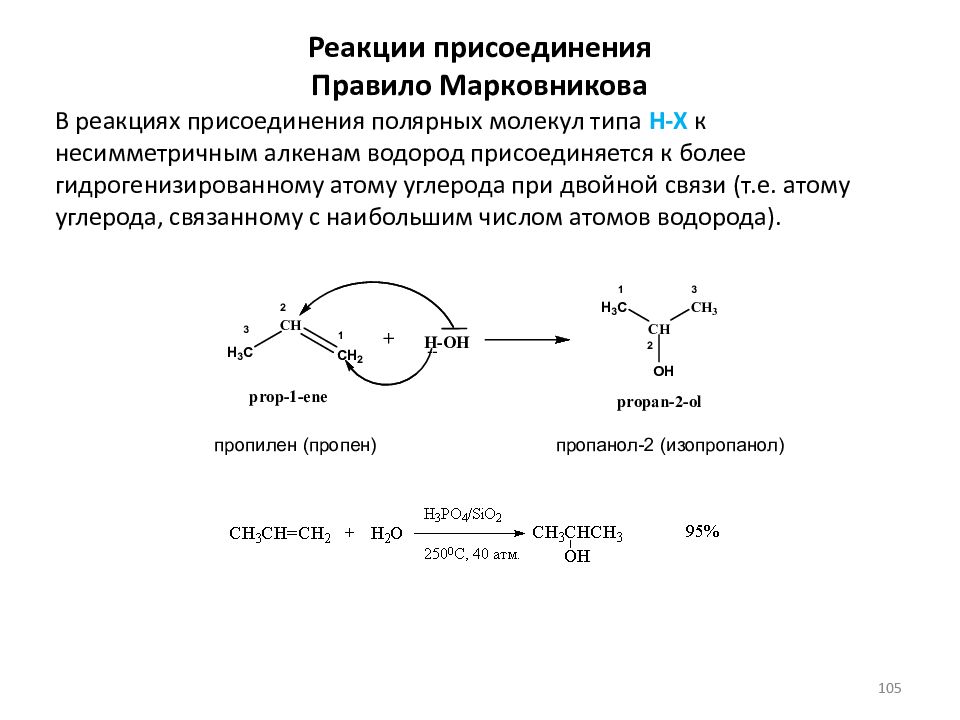
Слайд 105: Реакции присоединения Правило Марковникова
В реакциях присоединения полярных молекул типа Н-Х к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода). пропилен (пропен) пропанол-2 (изопропанол) 105
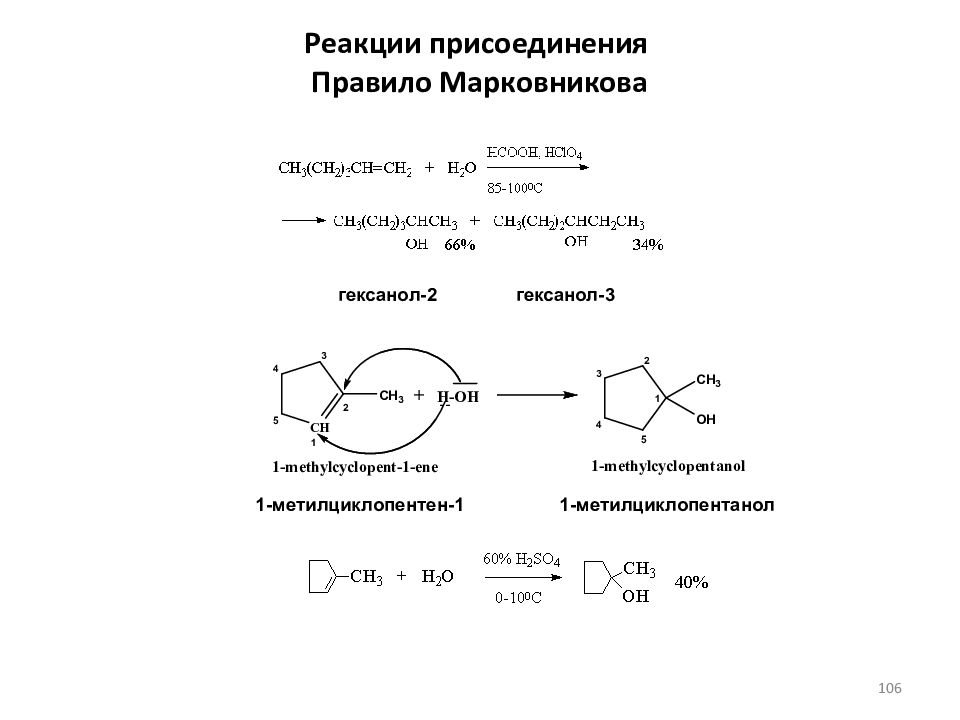
Слайд 106: Реакции присоединения Правило Марковникова
гексанол-2 гексанол-3 1-метилциклопентен-1 1-метилциклопентанол 106
Слайд 107: Реакции присоединения
изобутилен метил-трет-бутиловый эфир (МТБЭ ) Алкилирование спиртов алкенами Алкилирование алкенов алканами изобутилен изобутан 2,2,4-триметилпентан Цепной катионный процесс 107
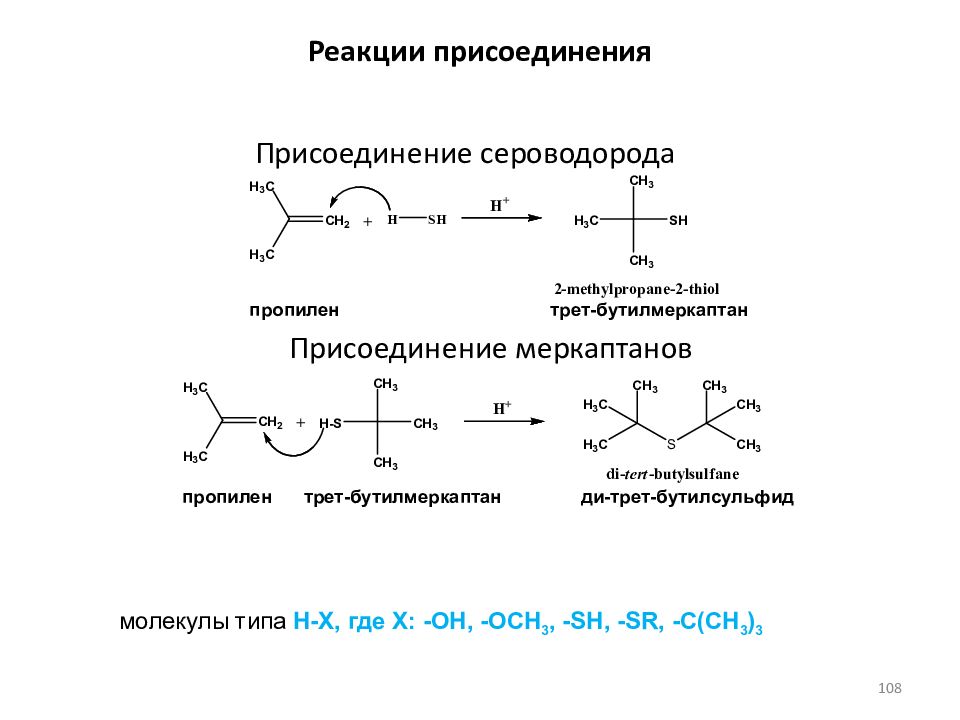
Слайд 108: Реакции присоединения
Присоединение сероводорода Присоединение меркаптанов пропилен трет-бутилмеркаптан пропилен трет-бутилмеркаптан ди-трет-бутилсульфид молекулы типа Н-Х, где X : -OH, -OCH 3, -SH, -SR, -C(CH 3 ) 3 108
Слайд 109: Димеризация (изобутилен)
Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н + ) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион: Этот карбокатион присоединяется к следующей молекуле алкена с образованием " димерного карбокатиона ": " Димерный карбокатион " стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1): 60% H 2 SO 4,70 o C - 20% - 80% 109
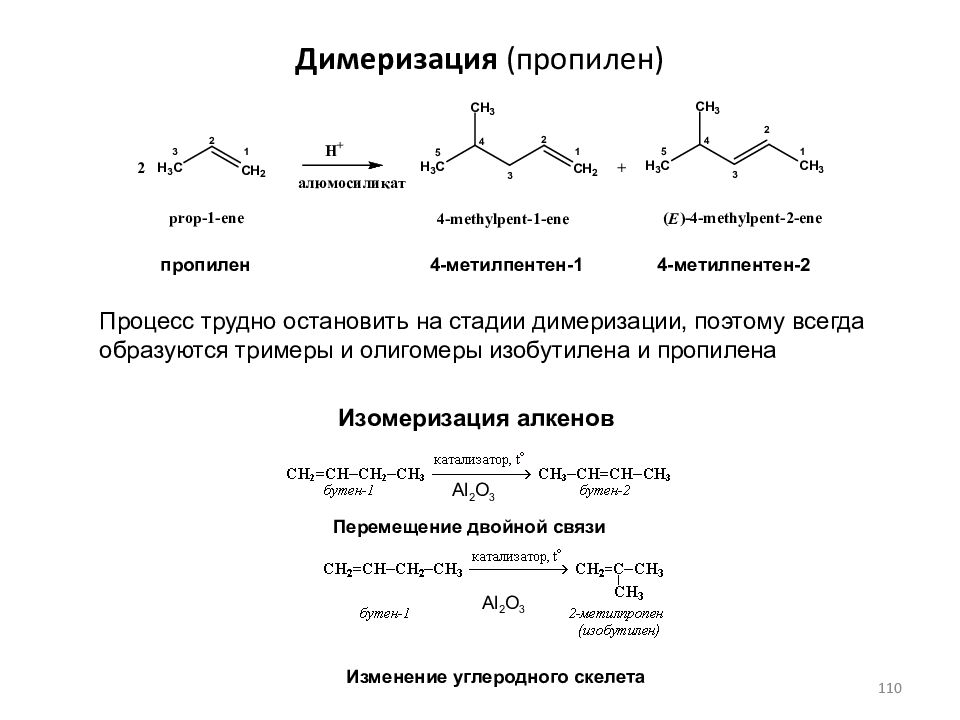
Слайд 110: Димеризация (пропилен)
пропилен 4-метилпентен-1 4-метилпентен-2 Процесс трудно остановить на стадии димеризации, поэтому всегда образуются тримеры и олигомеры изобутилена и пропилена Изомеризация алкенов Al 2 O 3 Al 2 O 3 Перемещение двойной связи Изменение углеродного скелета 110
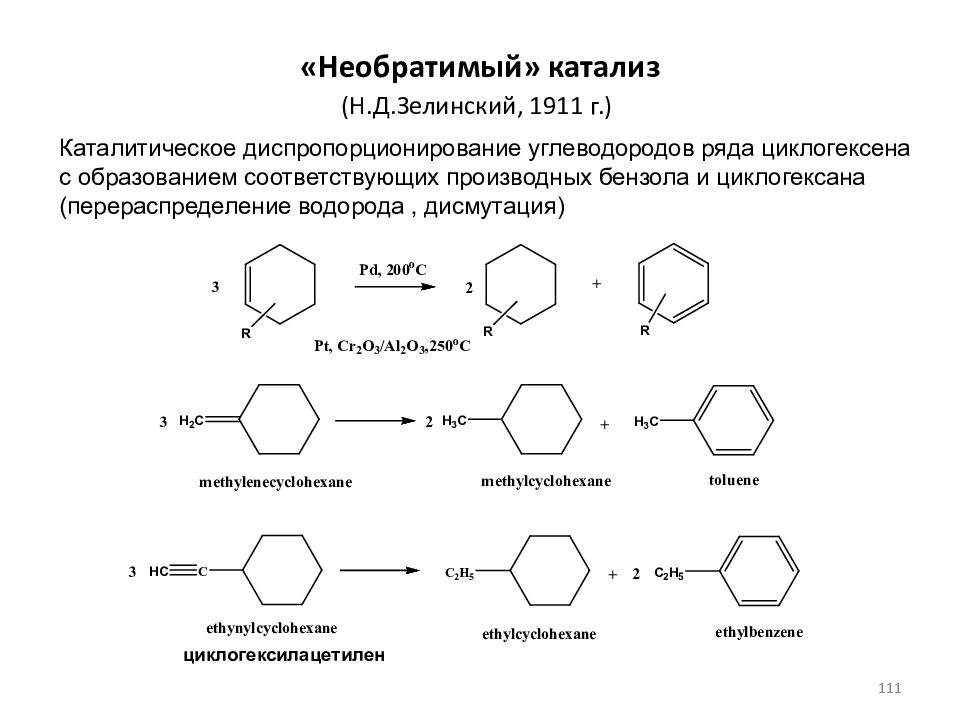
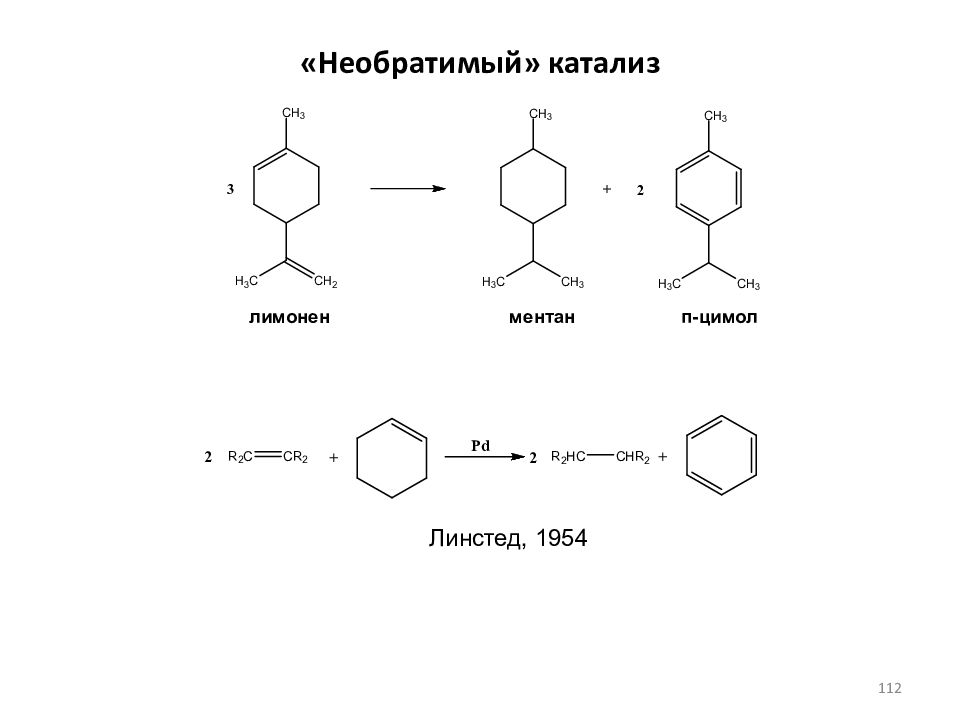
Слайд 111: Необратимый» катализ
(Н.Д.Зелинский, 1911 г.) Каталитическое диспропорционирование углеводородов ряда циклогексена с образованием соответствующих производных бензола и циклогексана (перераспределение водорода, дисмутация) циклогексилацетилен 111
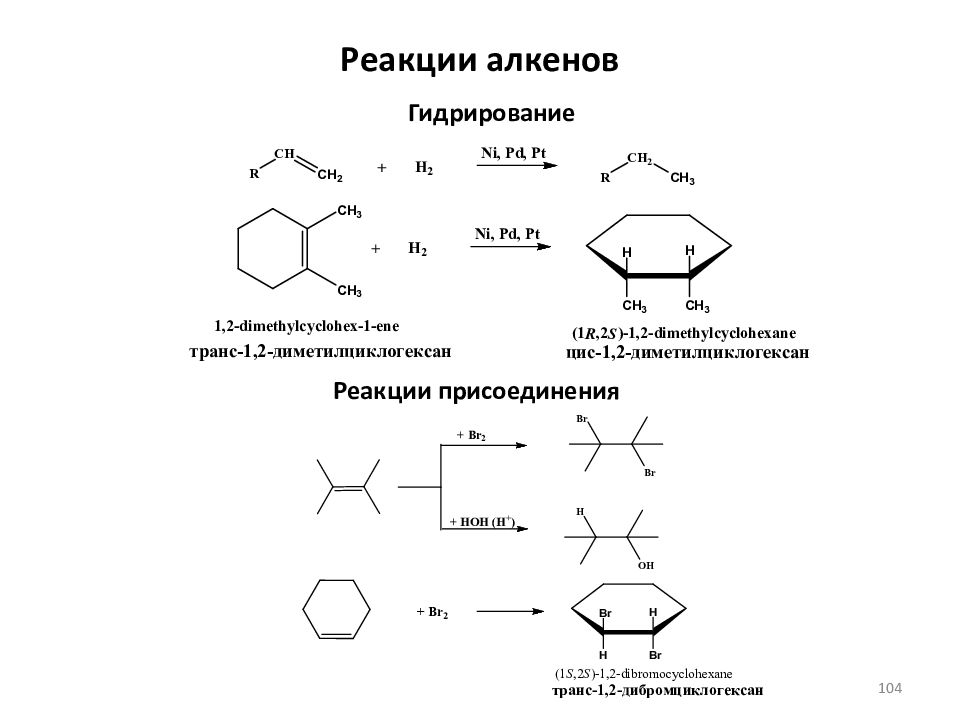
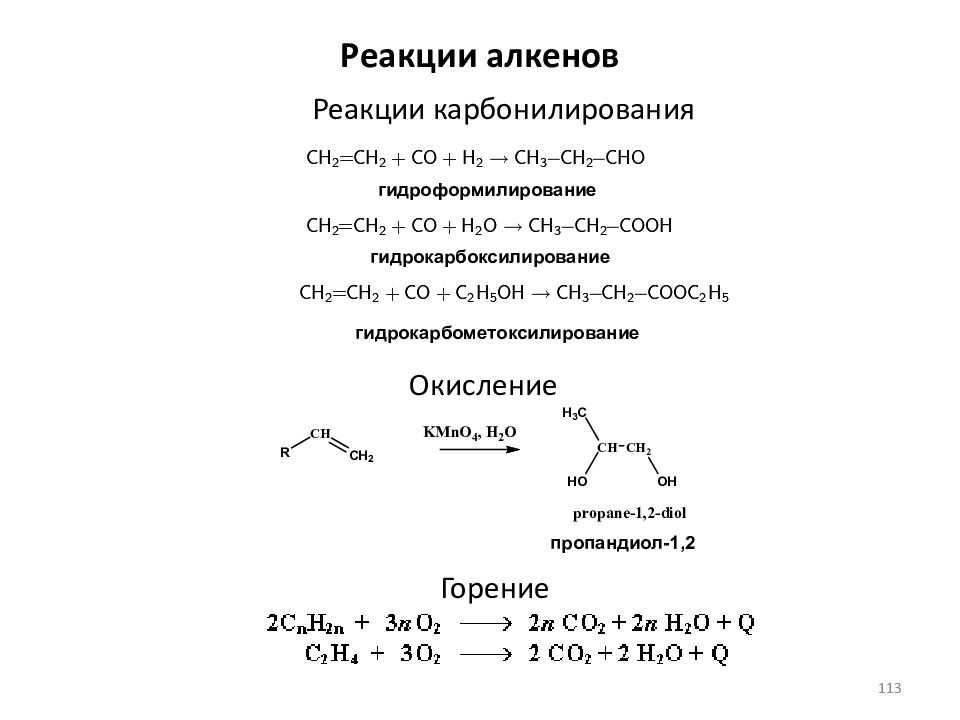
Слайд 113: Реакции алкенов
Реакции карбонилирования гидроформилирование гидрокарбоксилирование гидрокарбометоксилирование Окисление пропандиол-1,2 Горение 113
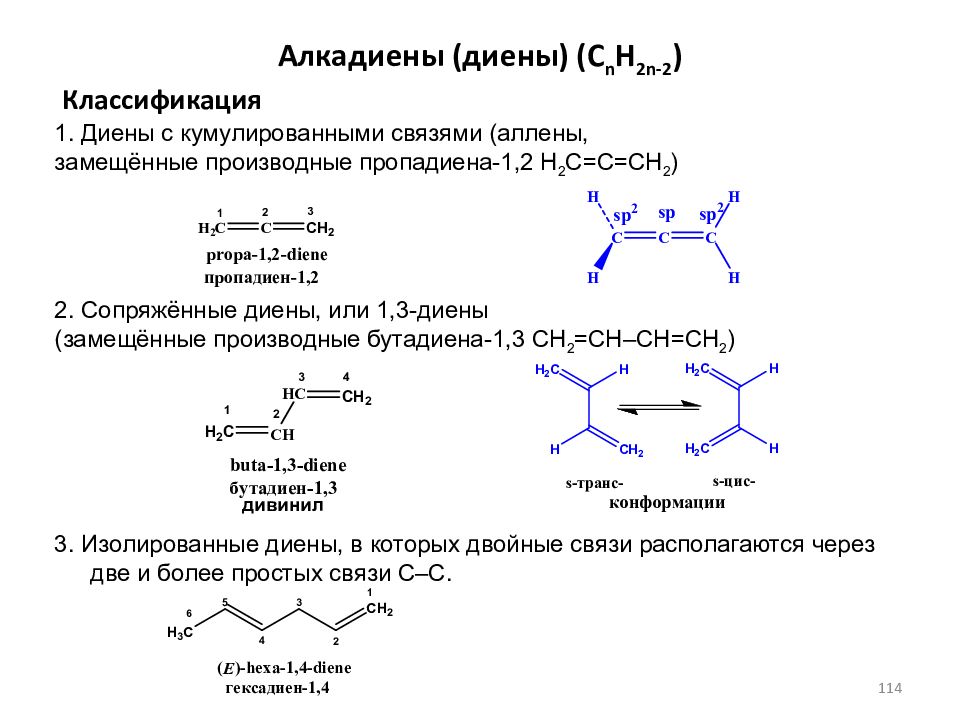
Слайд 114: Алкадиены (диены) ( C n H 2n-2 )
Классификация 1. Диены с кумулированными связями (аллены, замещённые производные пропадиена-1,2 H 2 C=C=CH 2 ) 2. Сопряжённые диены, или 1,3-диены (замещённые производные бутадиена-1,3 CH 2 =CH–CH=CH 2 ) 3. Изолированные диены, в которых двойные связи располагаются через две и более простых связи С–С. дивинил 114
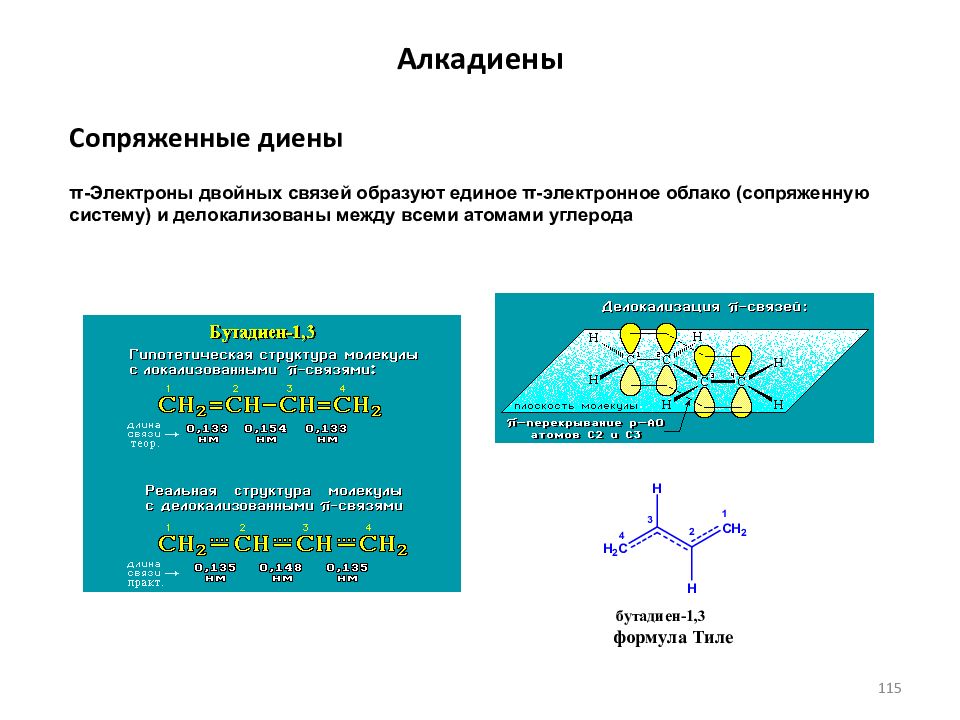
Слайд 115: Алкадиены
Сопряженные диены π-Электроны двойных связей образуют единое π-электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода 115
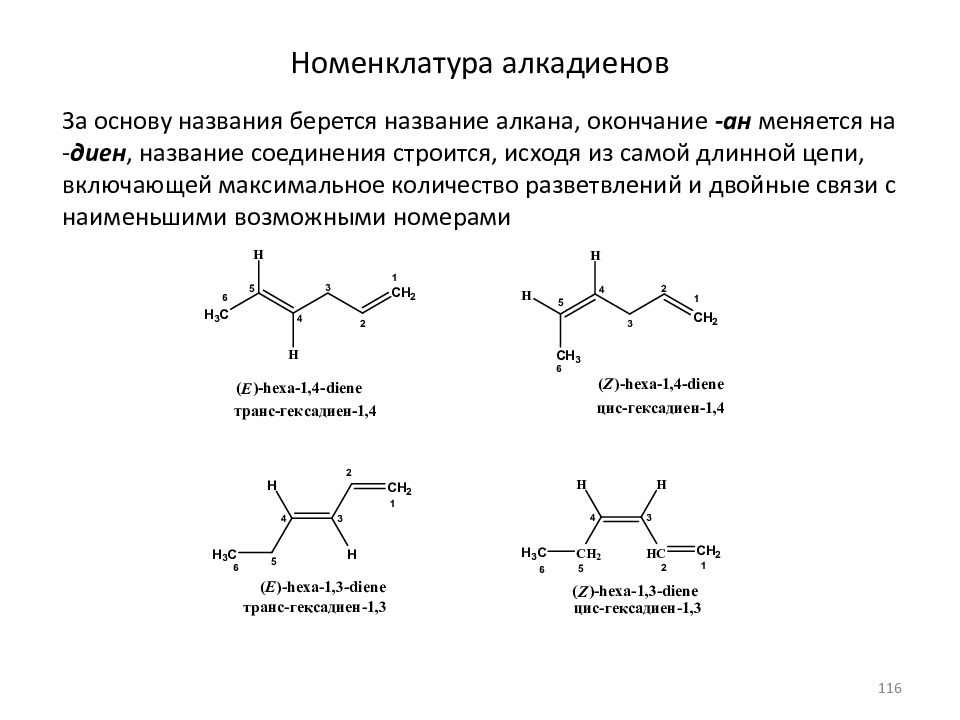
Слайд 116: Номенклатура алкадиенов
За основу названия берется название алкана, окончание -ан меняется на - диен, название соединения строится, исходя из самой длинной цепи, включающей максимальное количество разветвлений и двойные связи с наименьшими возможными номерами 116
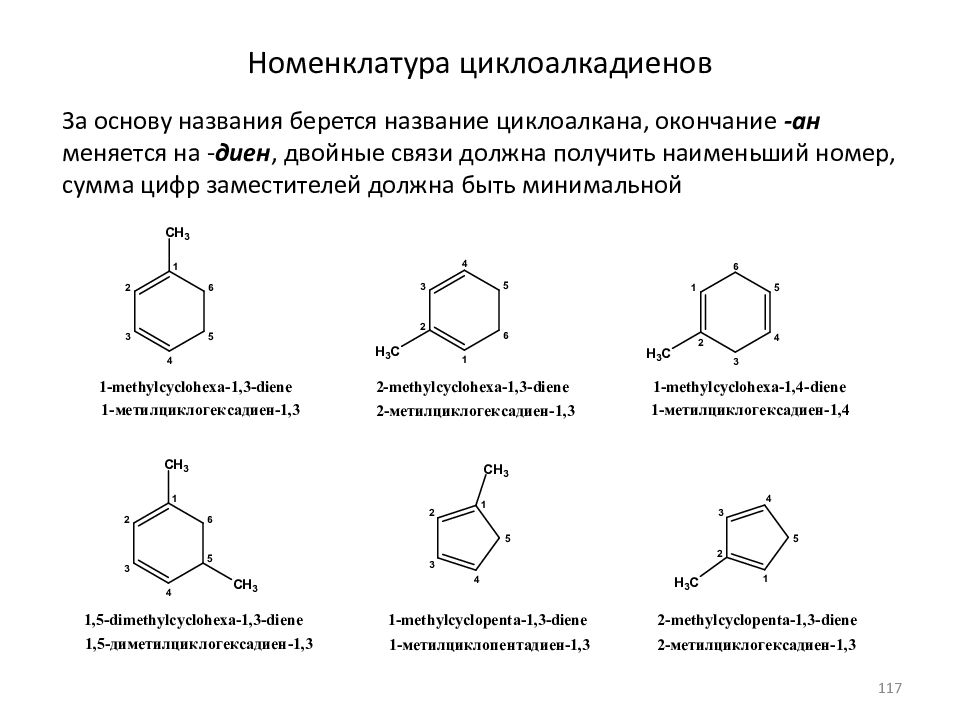
Слайд 117: Номенклатура циклоалкадиенов
За основу названия берется название циклоалкана, окончание -ан меняется на - диен, двойные связи должна получить наименьший номер, сумма цифр заместителей должна быть минимальной 117
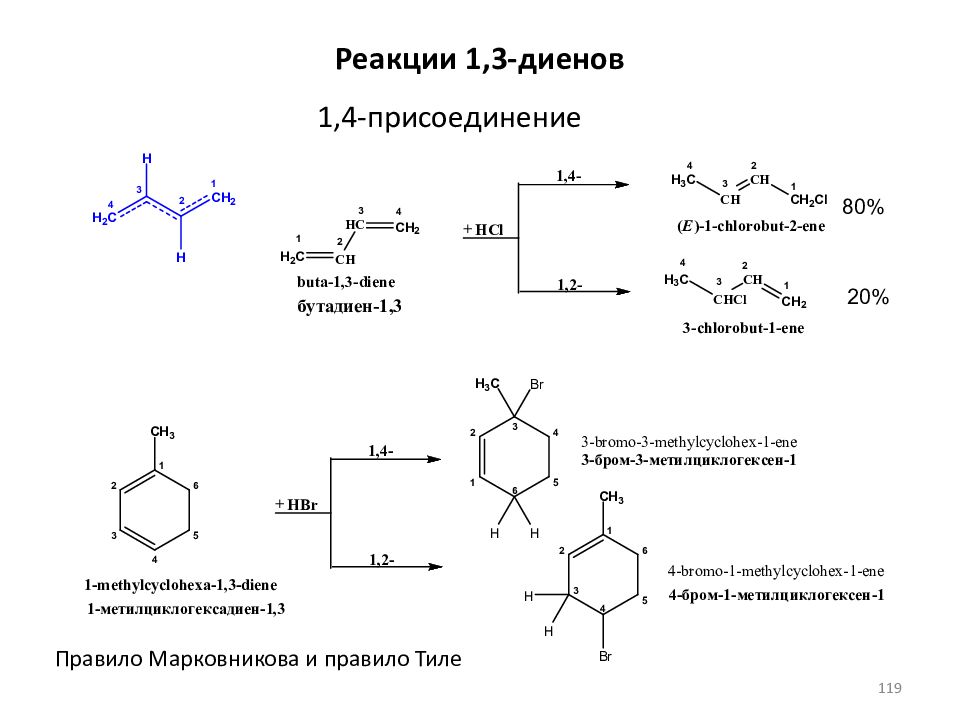
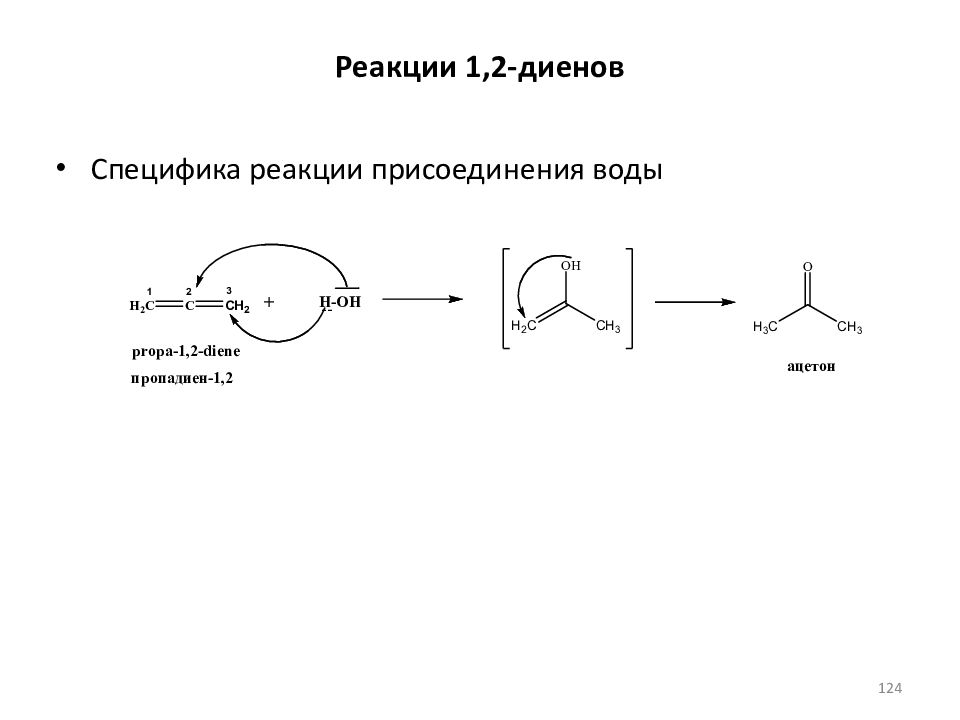
Слайд 119: Реакции 1,3- диенов
1,4-присоединение 80% 20% Правило Марковникова и правило Тиле 119
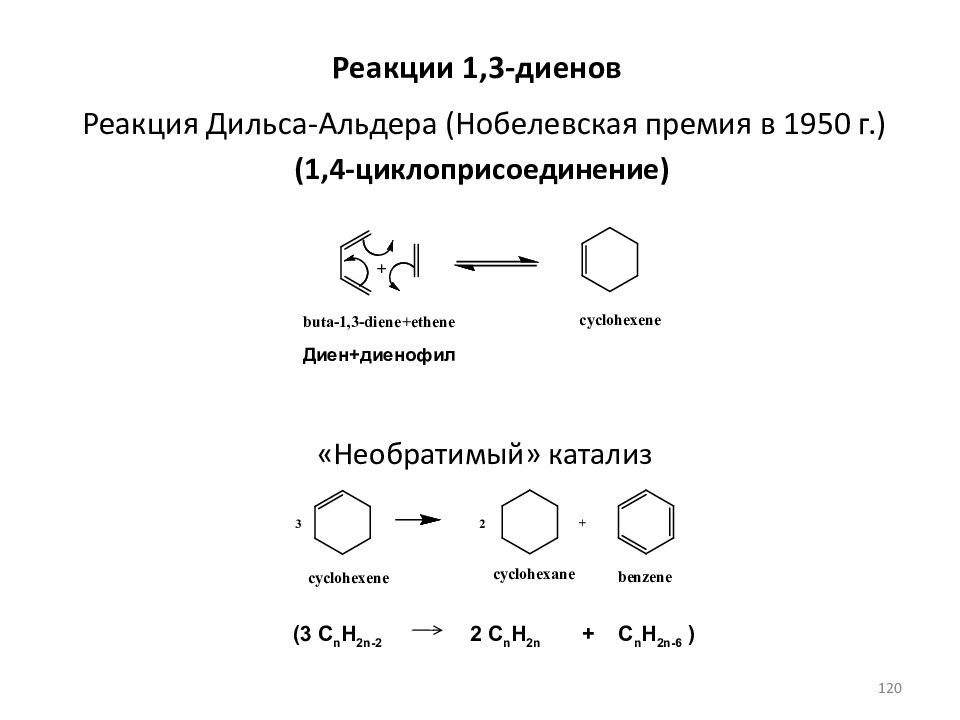
Слайд 120: Реакция Дильса-Альдера (Нобелевская премия в 1950 г.)
(3 C n H 2n-2 2 C n H 2n + C n H 2n-6 ) (1,4-циклоприсоединение) «Необратимый» катализ Диен+диенофил Реакции 1,3- диенов 120
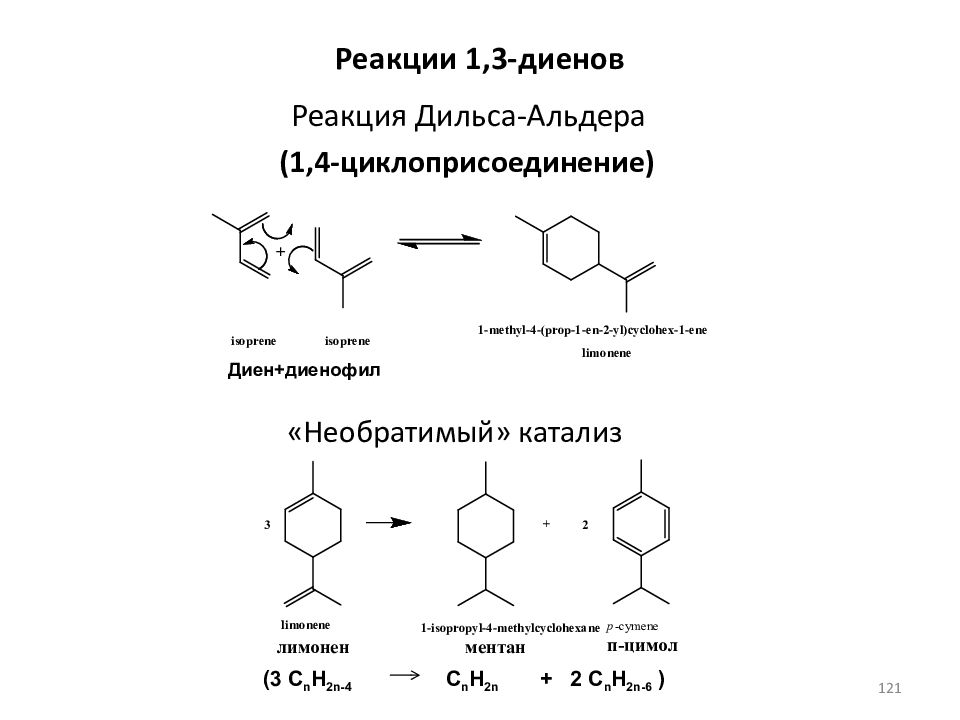
Слайд 121: Реакция Дильса-Альдера
(1,4-циклоприсоединение) «Необратимый» катализ Диен+диенофил Реакции 1,3- диенов (3 C n H 2n-4 C n H 2n + 2 C n H 2n-6 ) 121
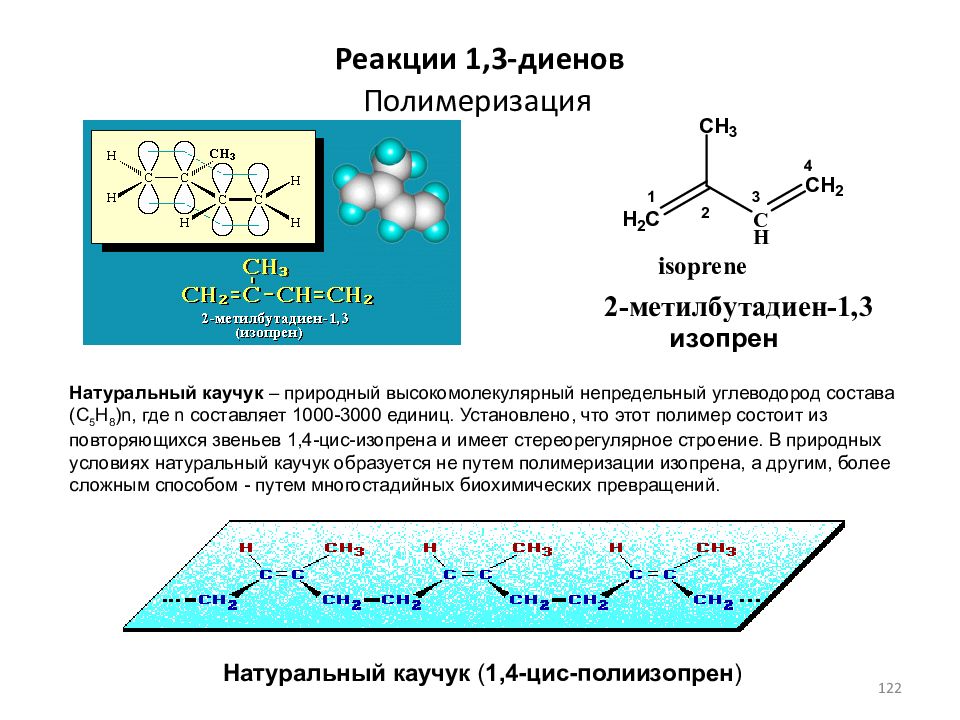
Слайд 122: Полимеризация
Реакции 1,3- диенов изопрен Натуральный каучук ( 1,4-цис-полиизопрен ) Натуральный каучук – природный высокомолекулярный непредельный углеводород состава (С 5 Н 8 )n, где n составляет 1000-3000 единиц. Установлено, что этот полимер состоит из повторяющихся звеньев 1,4-цис-изопрена и имеет стереорегулярное строение. В природных условиях натуральный каучук образуется не путем полимеризации изопрена, а другим, более сложным способом - путем многостадийных биохимических превращений. 122
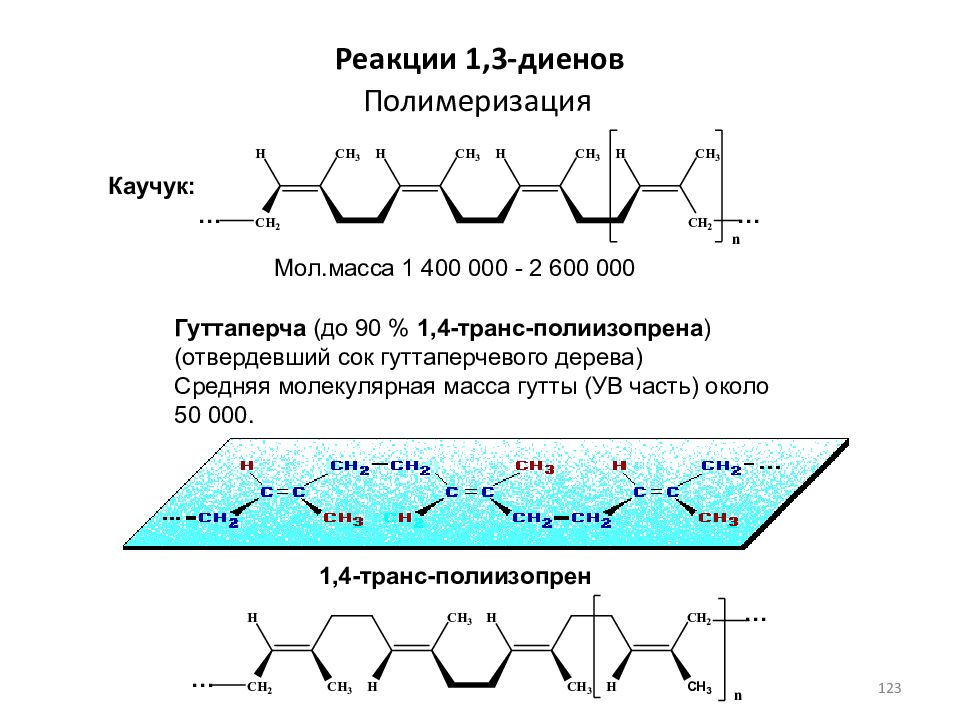
Слайд 123: Полимеризация
Реакции 1,3- диенов Гуттаперча (до 90 % 1,4-транс-полиизопрена ) (отвердевший сок гуттаперчевого дерева) Средняя молекулярная масса гутты (УВ часть) около 50 000. Каучук: 1,4-транс-полиизопрен Мол.масса 1 400 000 - 2 600 000 … … … … 123
Слайд 125: Терпены
Полиизопреновые структуры с невысокой степенью полимеризации содержатся в смоле хвойных деревьев, в эфирных маслах растений (герани, розы, лаванды, лимона и др.), входят в состав некоторых липидов. Много терпенов выделяется из хвойной смолы например сосны. Терпе́ны - класс углеводородов - продуктов биосинтеза общей формулы (C 5 H 8 ) n, с углеродным скелетом, формально являющихся производным (олигомером) изопрена. В больших количествах терпены содержатся в растениях семейства хвойные, во многих эфирных маслах. Терпены - основной компонент смол и бальзамов, так, скипидар получают из живицы. Название «Терпены» происходит от лат. «Oleum Tere p inthinae» — скипидар. 125
Слайд 126: Терпены
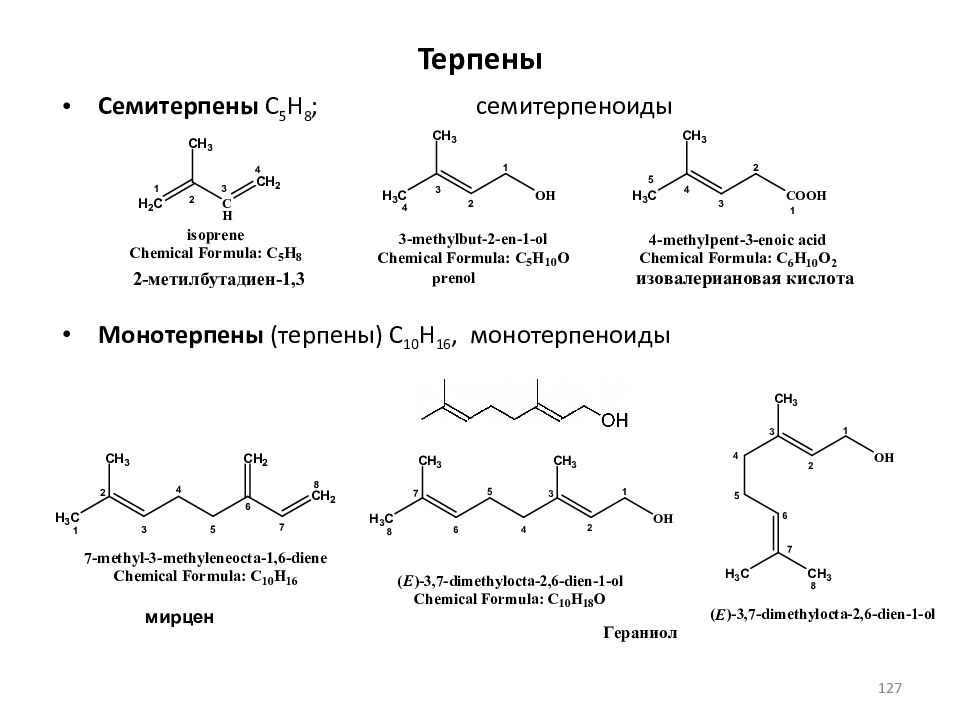
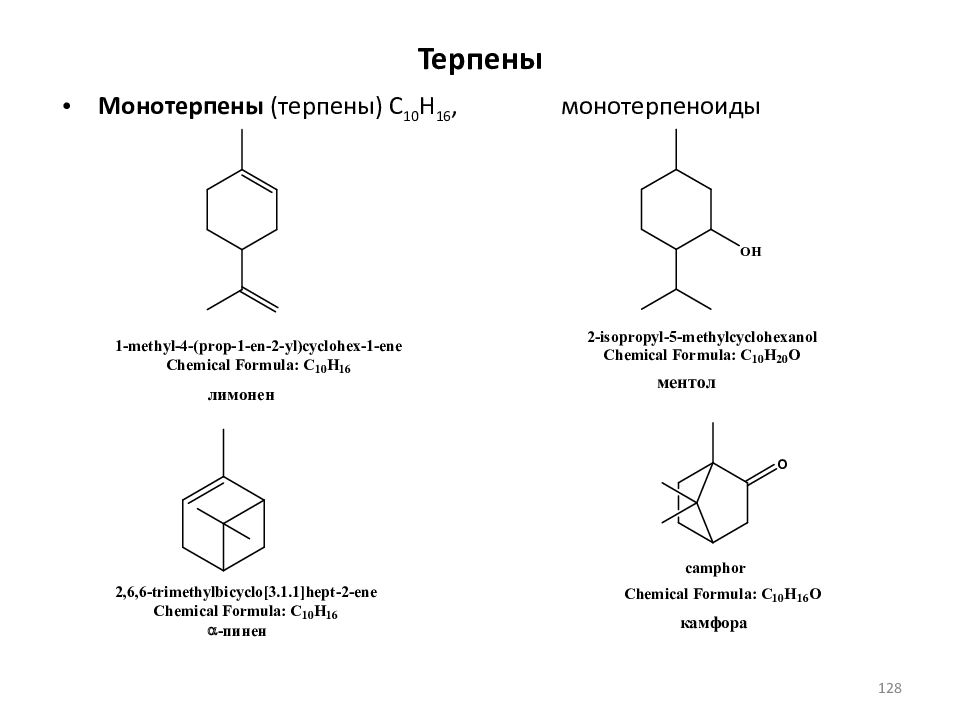
Терпены классифицируют по числу изопреновых звеньев, образующих углеродный скелет молекулы Семитерпены C 5 H 8 ; Монотерпены (терпены) C 10 H 16, Сесквитерпены (полуторатерпены) C 15 H 24, Дитерпены C 20 H 32, (C 10 H 16 ) 2 ; Тритерпены, C 30 H 48, (C 10 H 16 ) 3 ; Тетратерпены C 40 H 64, (C 10 H 16 ) 4 ; Политерпены (C 5 H 8 ) n, где n > 8. Сами углеводороды называют терпеновыми углеводородами ( терпенами ), а их кислородсодержащие производные – терпеноидами. 126
Слайд 127: Терпены
Семитерпены C 5 H 8 ; семитерпеноиды Монотерпены (терпены) C 10 H 16, монотерпеноиды мирцен 127
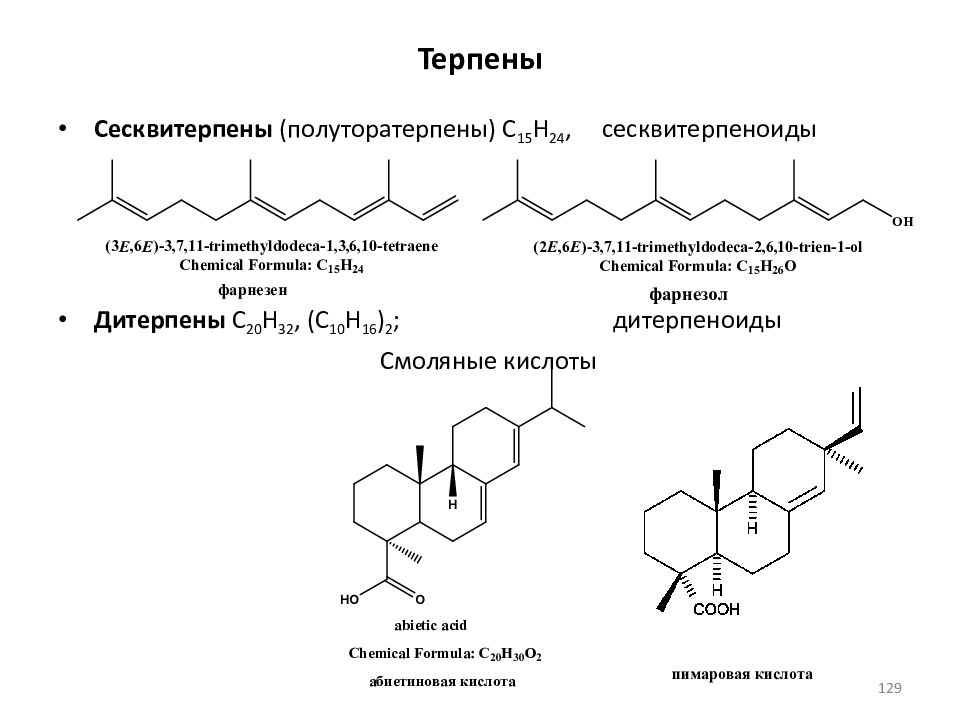
Слайд 129: Терпены
Сесквитерпены (полуторатерпены) C 15 H 24, сесквитерпеноиды Дитерпены C 20 H 32, (C 10 H 16 ) 2 ; дитерпеноиды Смоляные кислоты 129
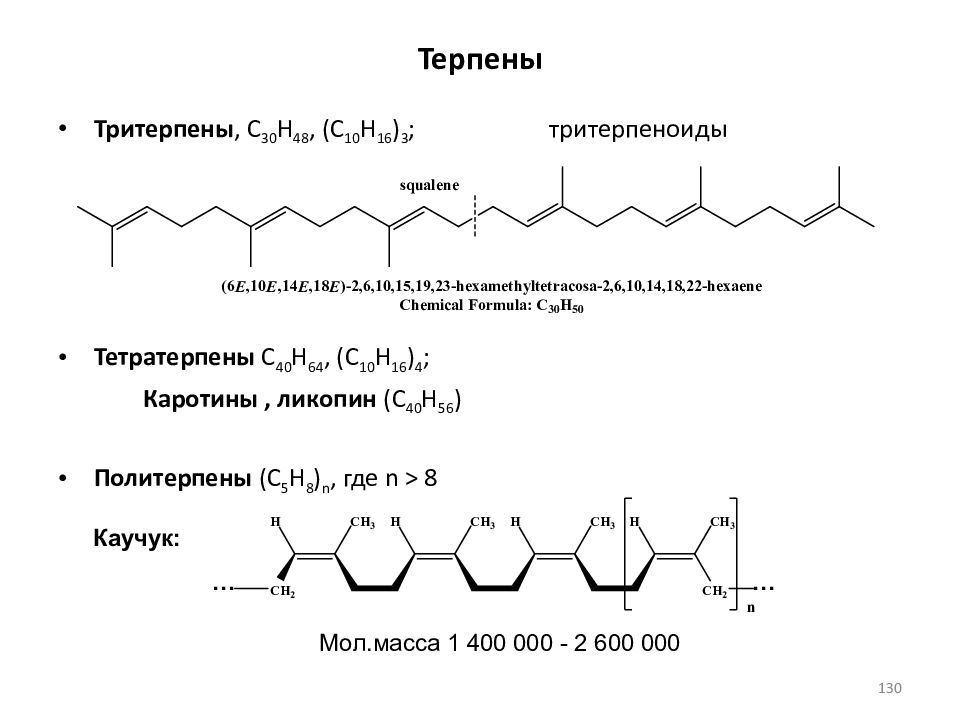
Слайд 130: Терпены
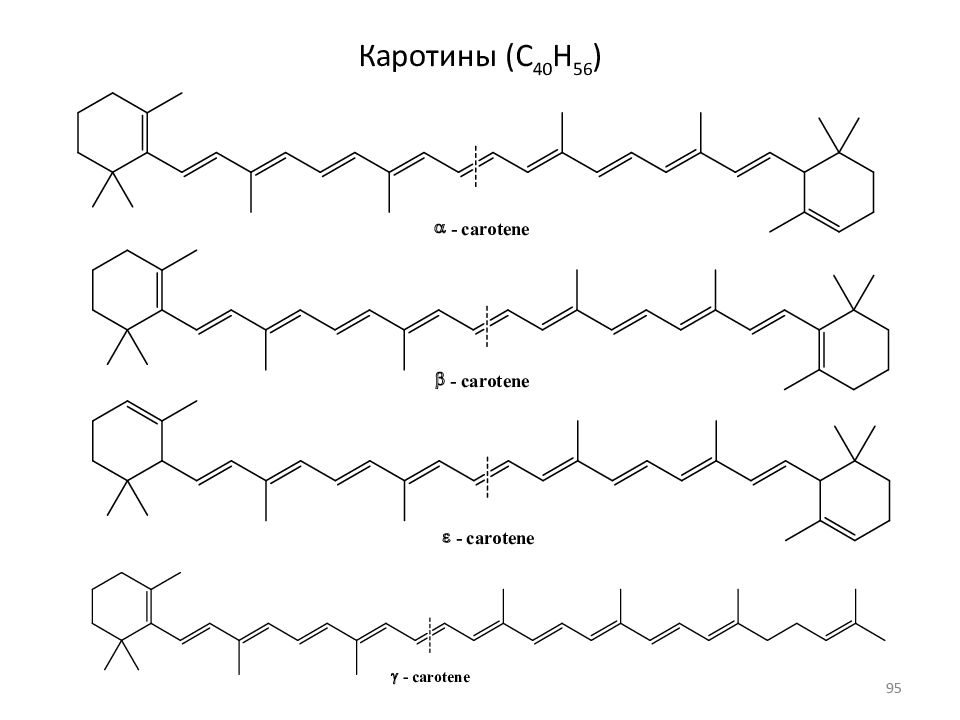
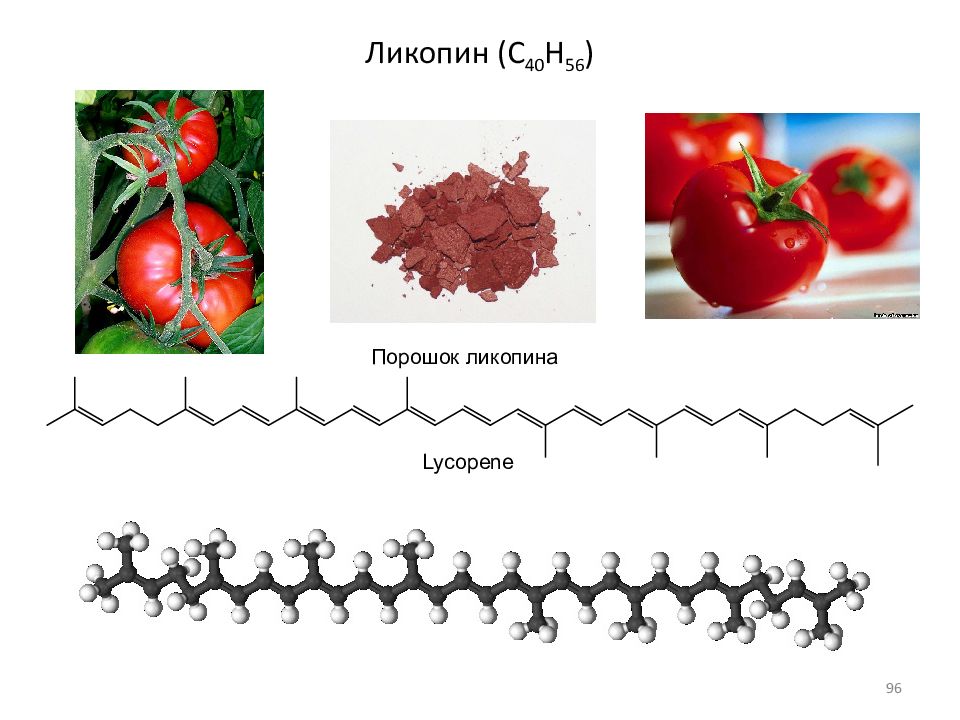
Тритерпены, C 30 H 48, (C 10 H 16 ) 3 ; тритерпеноиды Тетратерпены C 40 H 64, (C 10 H 16 ) 4 ; Каротины, ликопин ( C 4 0 H 56 ) Политерпены (C 5 H 8 ) n, где n > 8 Каучук: Мол.масса 1 400 000 - 2 600 000 … … 130
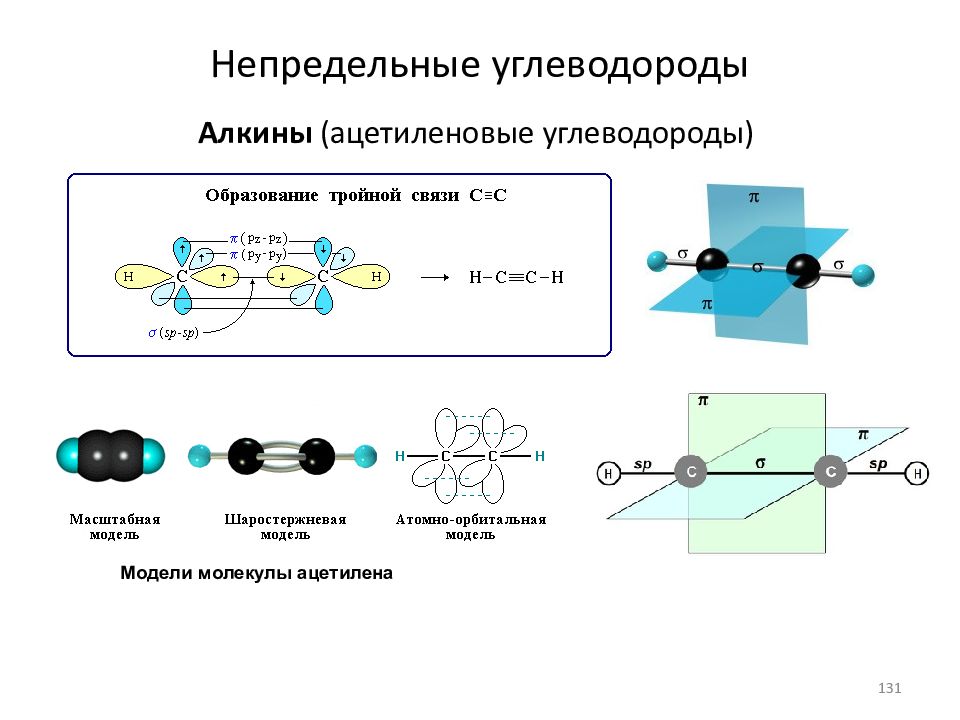
Слайд 131: Непредельные углеводороды
Алкины (ацетиленовые углеводороды) Модели молекулы ацетилена 131
Слайд 132: Изомерия и номенклатура алкинов ( C n H 2n-2 )
Структурная изомерия Изомерия положения тройной связи (начиная с С 4 Н 6 ): Изомерия углеродного скелета (начиная с С 5 Н 8 ): Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С 4 Н 6 : 132
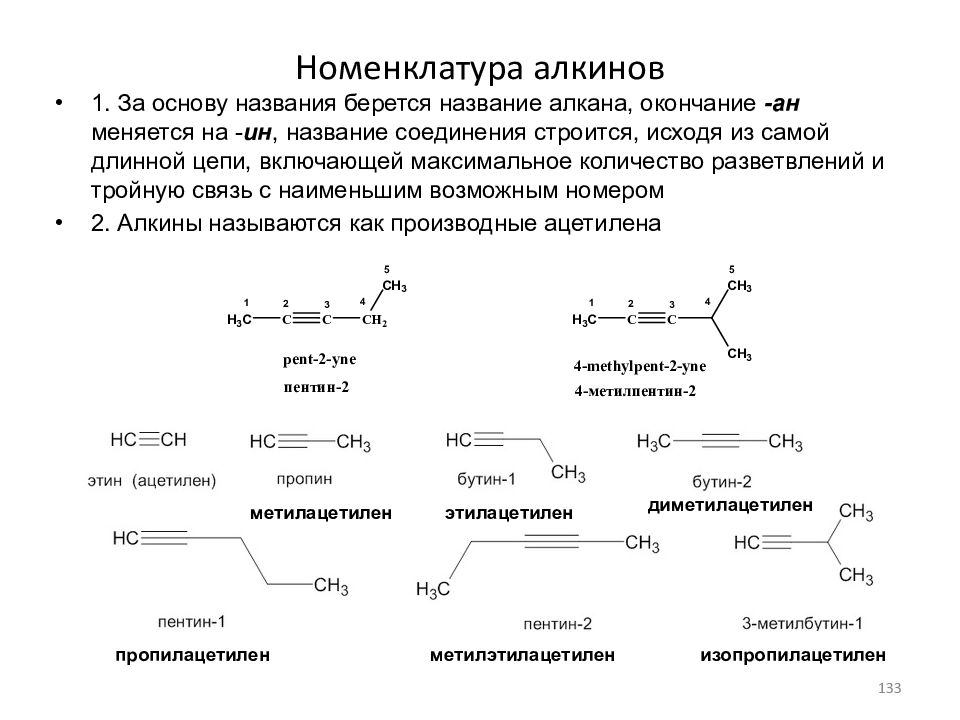
Слайд 133: Номенклатура алкинов
1. За основу названия берется название алкана, окончание -ан меняется на - ин, название соединения строится, исходя из самой длинной цепи, включающей максимальное количество разветвлений и тройную связь с наименьшим возможным номером 2. Алкины называются как производные ацетилена метилацетилен этилацетилен диметилацетилен изопропилацетилен пропилацетилен метилэтилацетилен 133
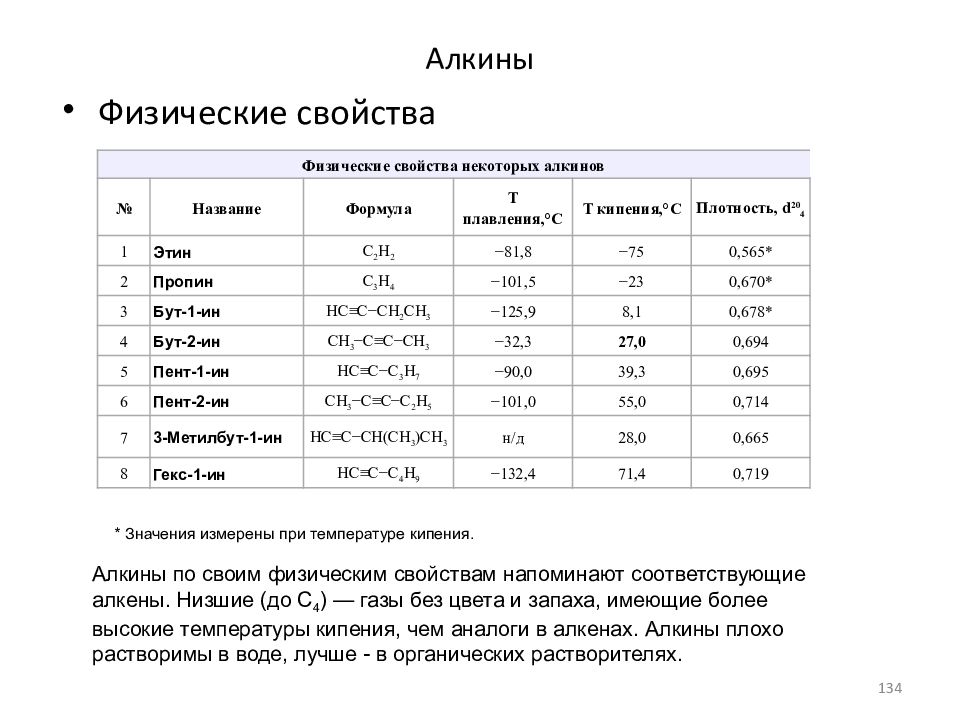
Слайд 134: Алкины
Физические свойства Физические свойства некоторых алкинов № Название Формула Т плавления,°С Т кипения,°С Плотность, d 20 4 1 Этин С 2 H 2 −81,8 −75 0,565* 2 Пропин C 3 H 4 −101,5 −23 0,670* 3 Бут-1-ин HC≡C−CH 2 CH 3 −125,9 8,1 0,678* 4 Бут-2-ин CH 3 −C≡C−CH 3 −32,3 27,0 0,694 5 Пент-1-ин HC≡C−C 3 H 7 −90,0 39,3 0,695 6 Пент-2-ин CH 3 −C≡C−C 2 H 5 −101,0 55,0 0,714 7 3-Метилбут-1-ин HC≡C−CH(CH 3 )CH 3 н/д 28,0 0,665 8 Гекс-1-ин HC≡C−C 4 H 9 −132,4 71,4 0,719 * Значения измерены при температуре кипения. Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С 4 ) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах. Алкины плохо растворимы в воде, лучше - в органических растворителях. 134






![Введение в специальность Циклоалканы (циклопарафины, цикланы) [ полиметилены – моноциклические циклоалканы (CH 2 ) n ] [ нафтены – циклоалканы, содержащие пяти- и шестичленные циклы ]](https://s0.showslide.ru/s_slide/c829c266fcb821e0096e5db185c05a46/6a134e7d-f5c9-4676-b75f-5c0df78106f6.jpeg)