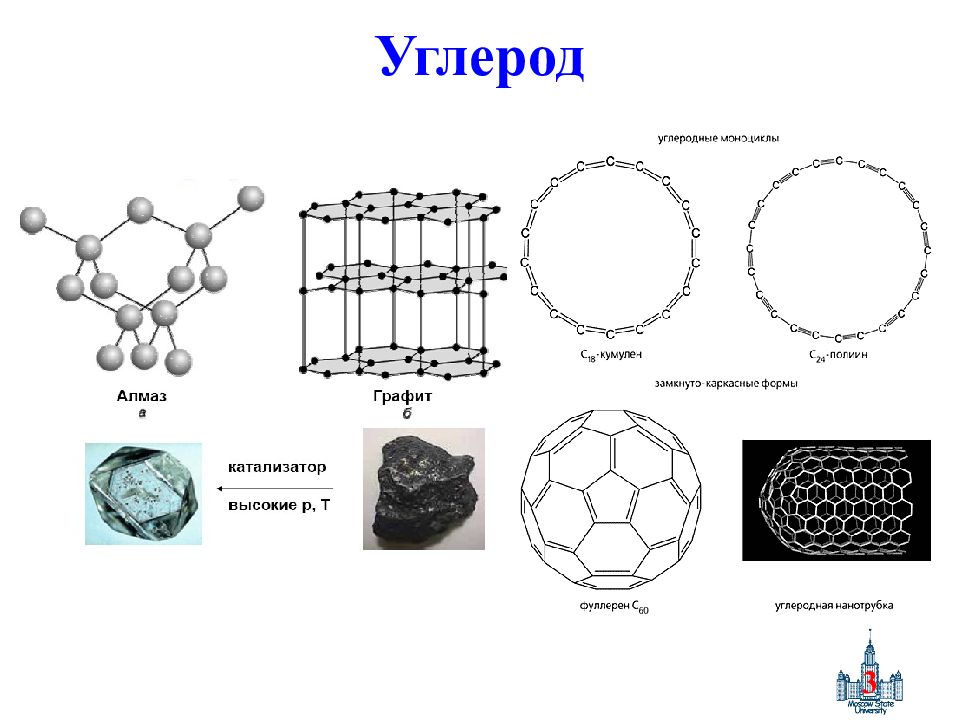
Первый слайд презентации
1 «Реальная структура твердого тела». Лекция 1. Термины. Классификация дефектов. Точечные дефекты. Лаборатория неорганического материаловедения, Химфак МГУ Москва 2006 Евгений Алексеевич ГУДИЛИН д.х.н., к.548 goodilin@inorg.chem.msu.ru fmg.inorg.chem.msu.ru 939-47-29
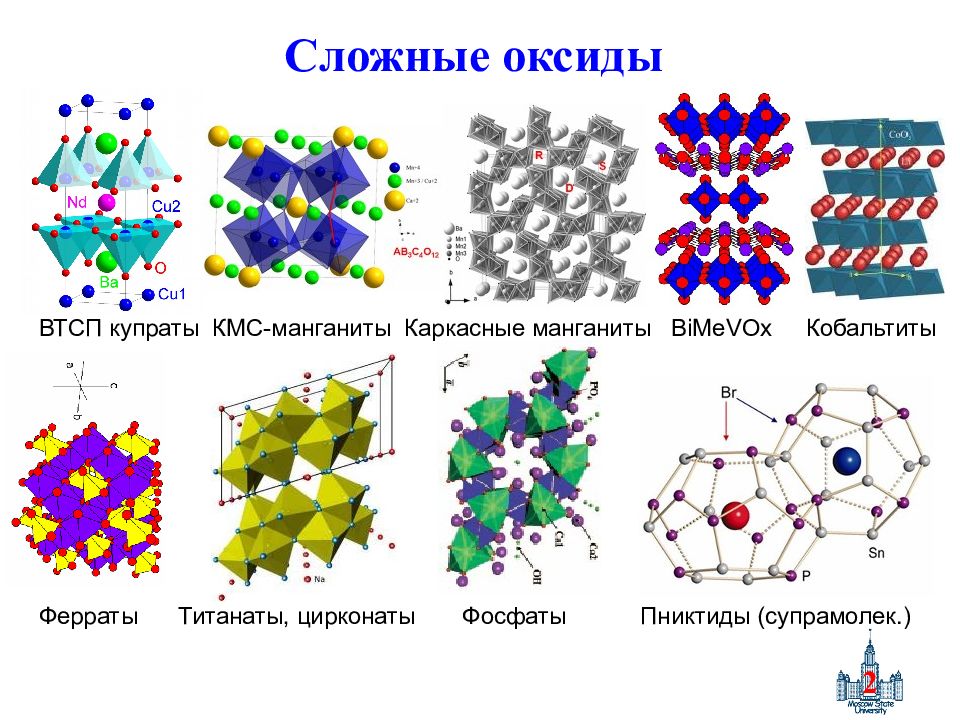
Слайд 2: Сложные оксиды
2 Сложные оксиды ВТСП купраты КМС-манганиты Каркасные манганиты BiMeVOx Кобальтиты Ферраты Титанаты, цирконаты Фосфаты Пниктиды (супрамолек.)
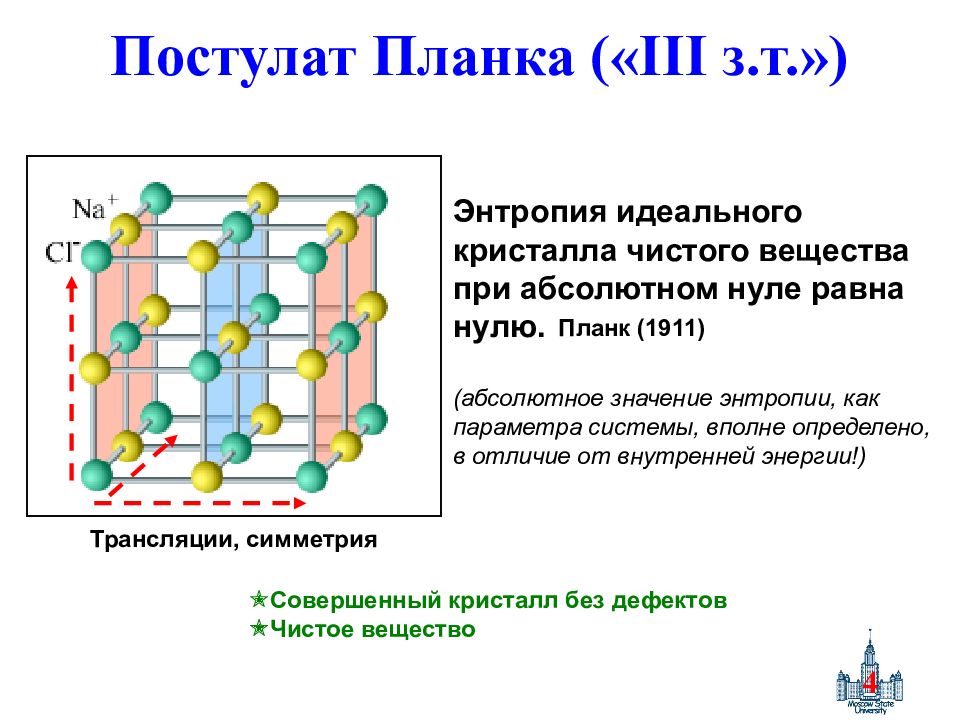
Слайд 4: Постулат Планка (« III з.т.»)
4 Постулат Планка (« III з.т.») Энтропия идеального кристалла чистого вещества при абсолютном нуле равна нулю. (абсолютное значение энтропии, как параметра системы, вполне определено, в отличие от внутренней энергии!) Трансляции, симметрия Планк (1911) Совершенный кристалл без дефектов Чистое вещество
Слайд 5: Огранка кристаллов
5 Концепция периодических цепочек связей Огранка кристаллов
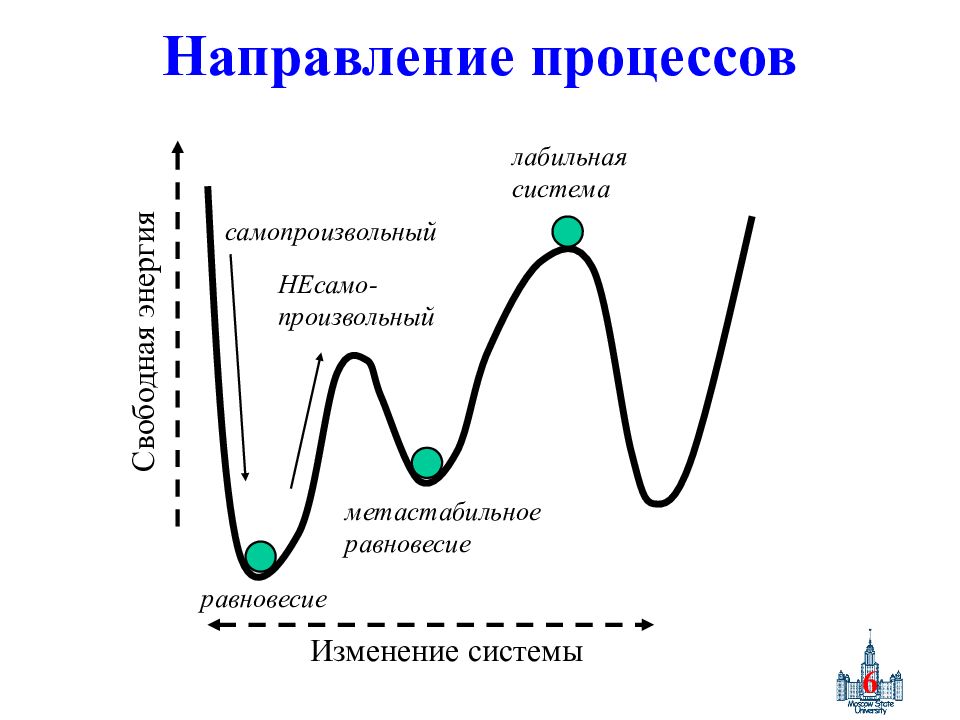
Слайд 6: Направление процессов
6 Направление процессов Изменение системы Свободная энергия самопроизвольный НЕсамо- произвольный равновесие метастабильное равновесие лабильная система
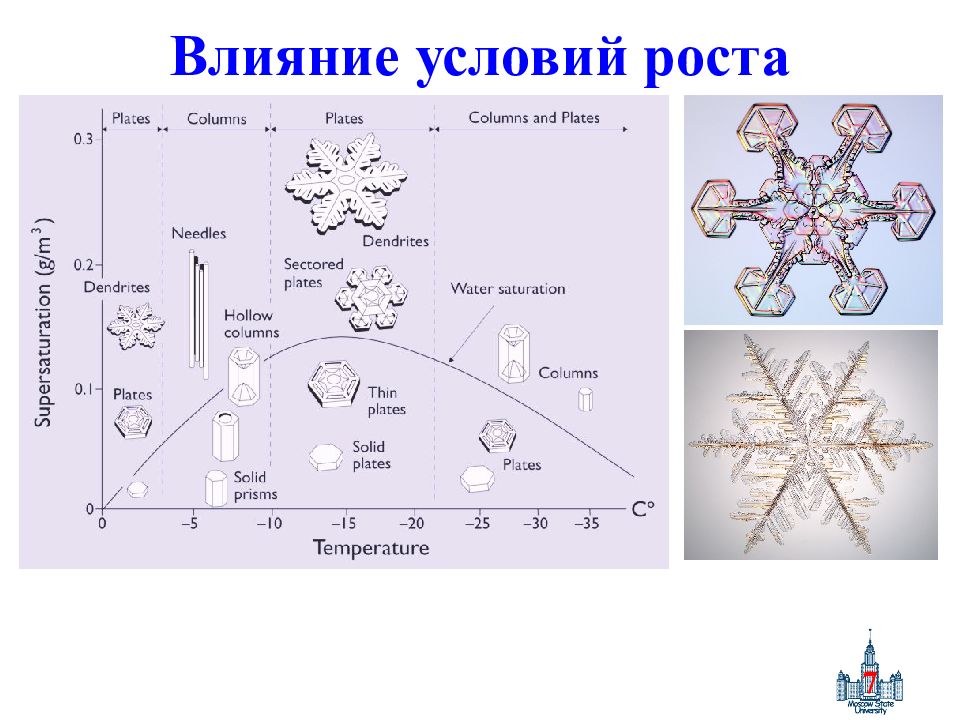
Слайд 8: Ростовая морфология
8 Ростовая морфология R 2 BaCu 3 O z Nd213: ренуклеация на дефектах типа двугранного угла
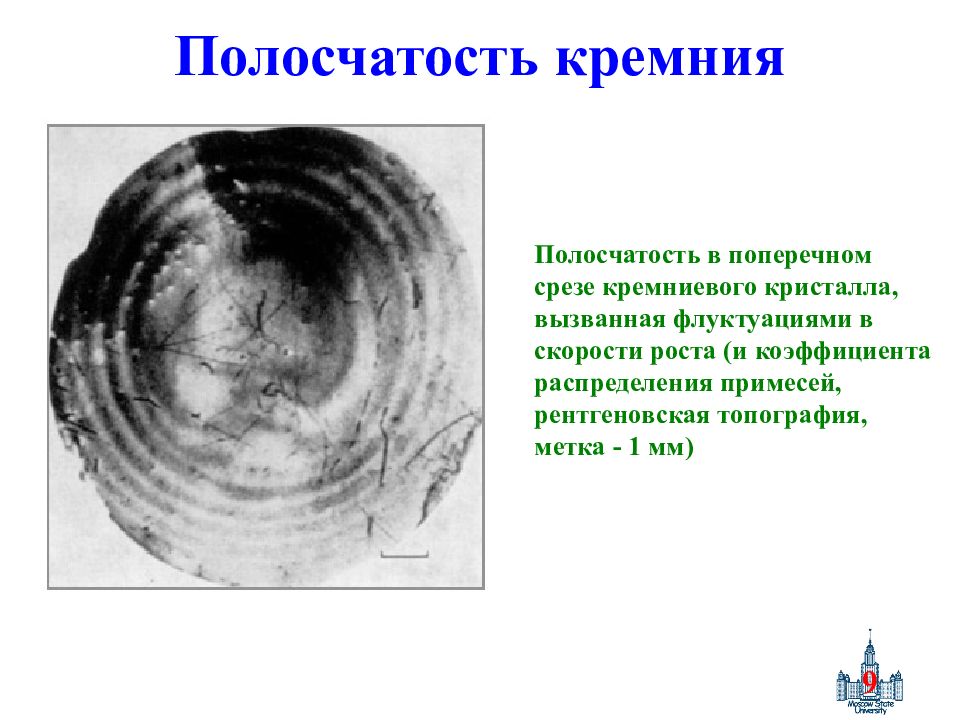
Слайд 9: Полосчатость кремния
9 Полосчатость кремния Полосчатость в поперечном срезе кремниевого кристалла, вызванная флуктуациями в скорости роста (и коэффициента распределения примесей, рентгеновская топография, метка - 1 мм)
Слайд 12: Кристаллы, керамика, композиты
12 Кристаллы, керамика, композиты ВТСП Вискеры-суперионики П / п Кобальтиты ВТСП Манганиты Цирконаты, биокерамика -спонтанная кристаллизация, метод Бриджмена, ПЖК, электрокристаллизация -керамический метод, расплавные технологии, керамические пены -криохимическая технология, пиролиз аэрозолей
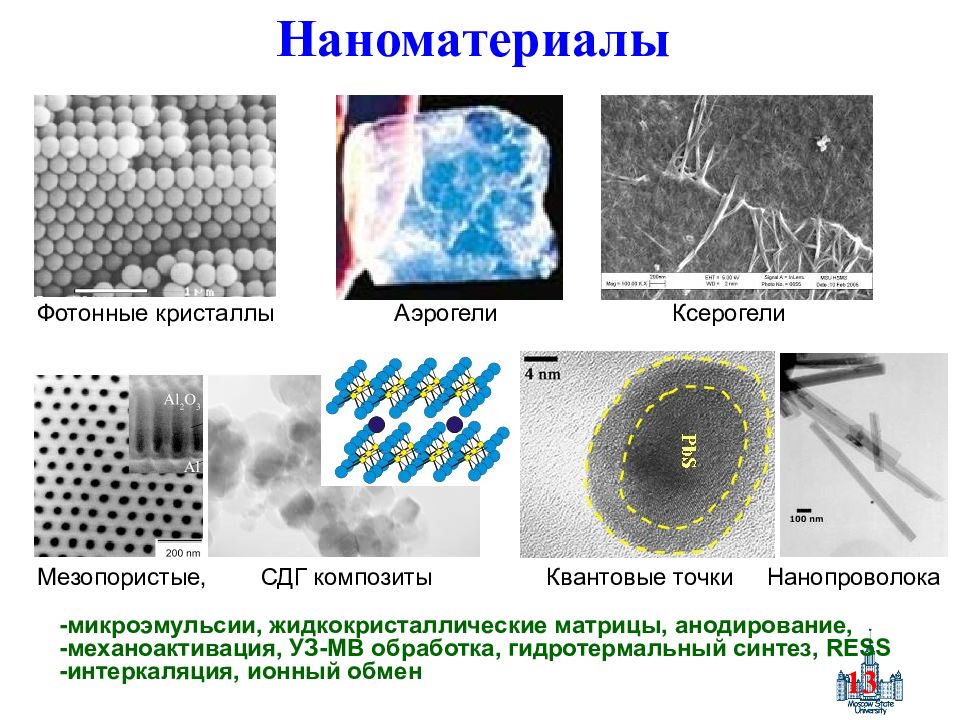
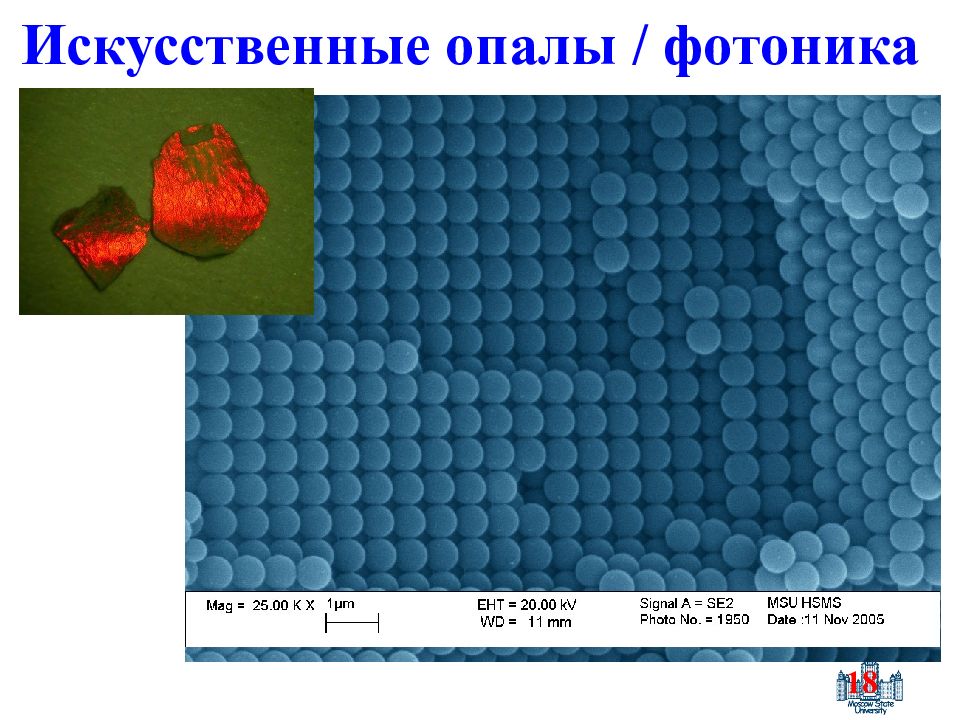
Слайд 13: Наноматериалы
13 Наноматериалы Мезопористые, СДГ композиты Квантовые точки Нанопроволока Фотонные кристаллы Аэрогели Ксерогели -микроэмульсии, жидкокристаллические матрицы, анодирование, -механоактивация, УЗ-МВ обработка, гидротермальный синтез, RESS -интеркаляция, ионный обмен
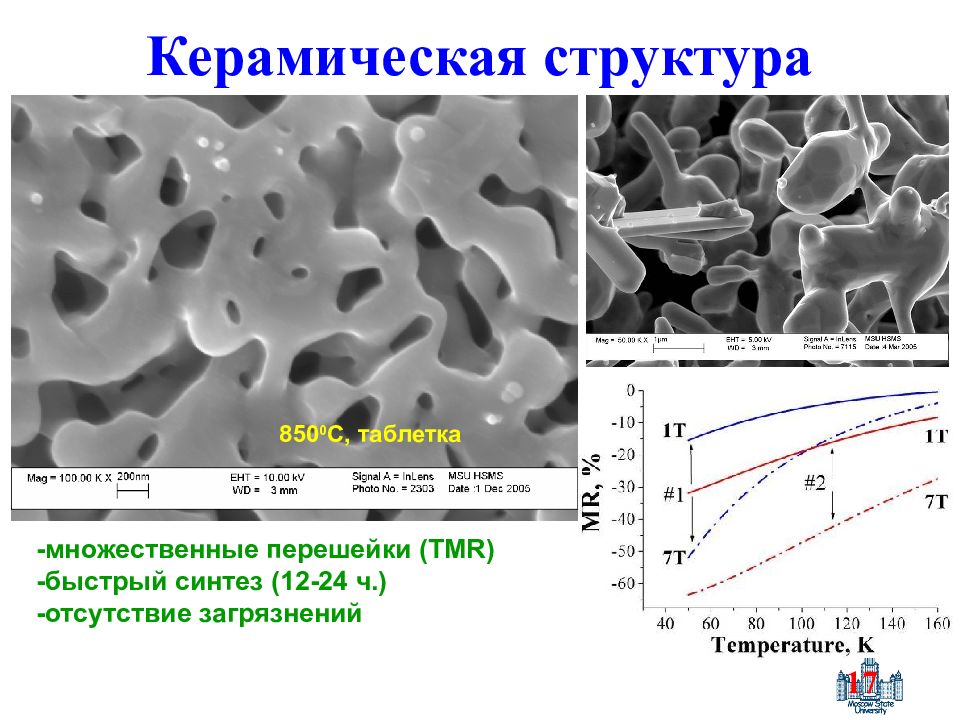
Слайд 17: Керамическая структура
17 Керамическая структура -множественные перешейки ( TMR ) -быстрый синтез (12-24 ч.) -отсутствие загрязнений 850 0 С, таблетка
Слайд 20: Кермет
20 Кермет Карбид бора в алюминии WC, TaC, BC TiC-Co (Cr, Bi, W, Mo, Fe, Al…) твердость карбидов + вязкость металла Износоустойчивость Удароустойчивость Термоустойчивость
Слайд 21: Бертоллиды. Как контролировать свойства ?
21 Бертоллиды. Как контролировать свойства ? Направление химических реакций определяется массой, свойствами реагентов и условиями реакции. Состав продуктов должен изменяться непрерывно, т. е. быть переменным. Клод Луи Бертолле (1748 - 1822) Джон Дальтон (1766-1844) Закон кратных соотношений. Николай Семенович Курнаков (1860-1941) Жозеф-Луи Пруст (1754 - 1826) Закон постоянства состава : состав не зависит от способа получения 1801 - 1808 г.г. смеси, а не индивиды непрерывный состав Физико- химический анализ Бертоллиды Дальтониды
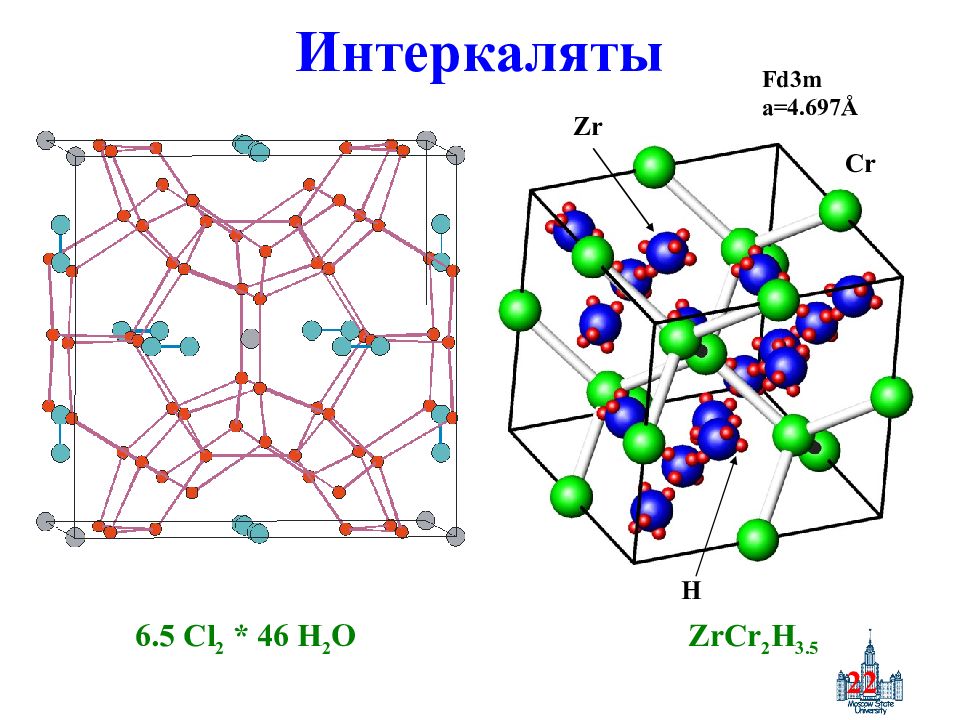
Слайд 22: Интеркаляты
22 Интеркаляты Fd3m a=4.697 Å Cr Zr H ZrCr 2 H 3.5 6.5 Cl 2 * 46 H 2 O
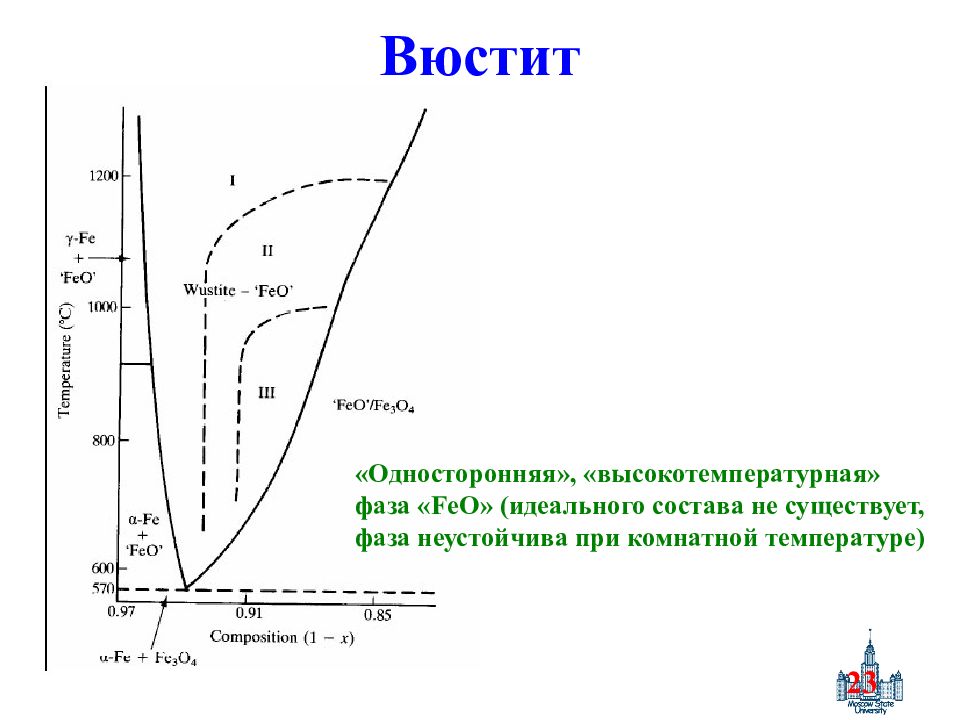
Слайд 23: Вюстит
23 Вюстит «Односторонняя», «высокотемпературная» фаза « FeO » (идеального состава не существует, фаза неустойчива при комнатной температуре)
Слайд 24: Область гомогенности
24 Область гомогенности microstructure C(M) Серии образцов ABCD: Одинаковая предыстория T prep. = const варьирование x C(M): Одинаковый состав ( x ) T prep. = const разная микроструктура C1…C4: Одинаковая предыстория Одинаковый состав ( x ) разные T prep.
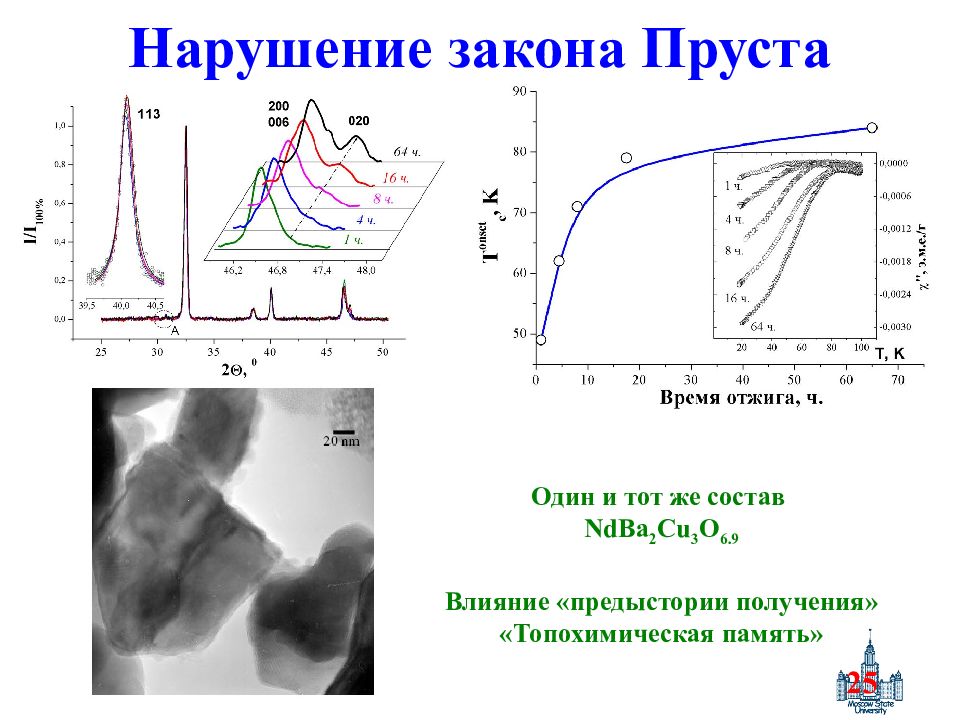
Слайд 25: Нарушение закона Пруста
25 Нарушение закона Пруста Один и тот же состав NdBa 2 Cu 3 O 6.9 Влияние «предыстории получения» «Топохимическая память»
Слайд 27: Признаки
27 Признаки Неравновесность Особое состояние (форма материала) Нестехиометрия / композиты Зависимость от предыстории получения Иерархическая дефектная структура
Слайд 28: Сравнение определений
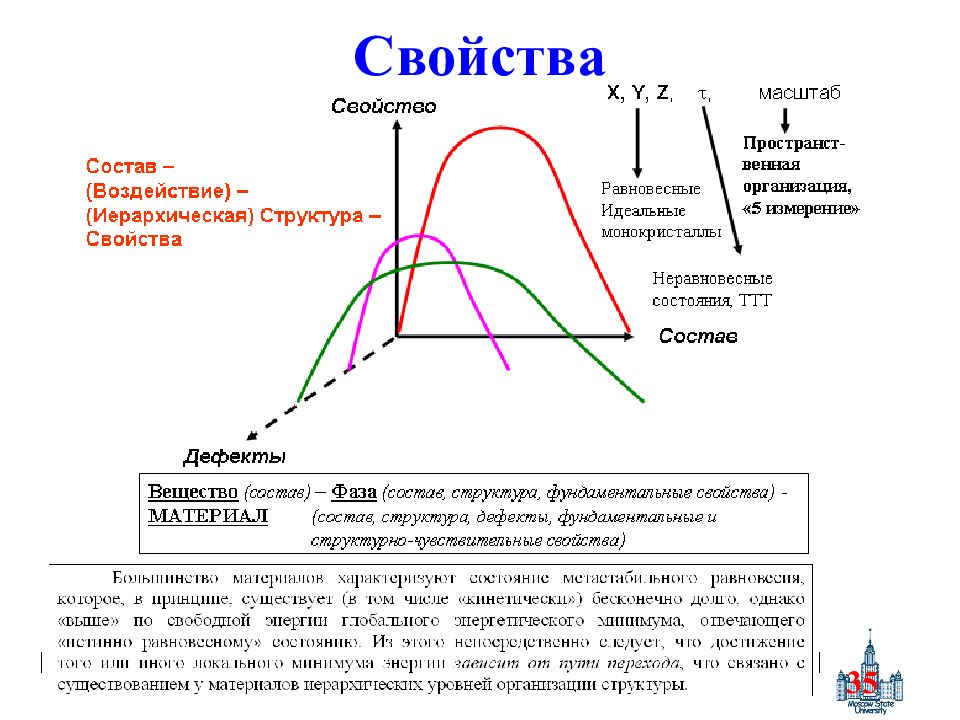
28 Сравнение определений Вещество – соединение химических элементов определенного состава Фаза - совокупности всех гомогенных частей гетерогенной системы с постоянным составом и свойствами, отделенной от других частей системы межфазными границами. Элемент – совокупность атомов Материал – вещество, обладающее свойствами, которые предопределяют то или иное его практическое применение. (акад. И.В.Тананаев) Состав + агрегатное состояние (газ, жидкость, твердое) + аллотропи я (различные молекулярные формы элемента) + полиморфизм (различные кристаллические формы вещества одного и того же состава) + дефекты. Лишь в гипотетическом, абсолютно химически чистом идеальном кристалле существует бесконечная решетка из строго периодически расположенных в пространстве атомов, которые находятся в покое в своих равновесных положениях. Совершенный кристалл – кристалл, в котором (дополнительно) существуют термические колебания атомов. Р еальный кристалл ограничен гранями и содержит точечные и протяженные дефекты. Дефекты (от лат. defectus — недостаток, изъян) – нарушения периодичности кристаллической структуры. Помимо статических дефектов, существуют отклонения от идеальной решётки другого рода, связанные с тепловыми колебаниями частиц, составляющих решётку (динамические дефекты).
Слайд 29: Классификация дефектов
29 Классификация дефектов 1. Нульмерные (точечные) дефекты – вакансии, межузельные атомы, примеси, центры окраски и пр. 2. Одномерные (линейные) дефекты – цепочки точечных дефектов, дислокации 3. Двумерные (поверхностные) дефекты – дефекты упаковки, границы блоков мозаики, границы зерен, двойников, межфазные границы, сама поверхность кристалла 4. Трехмерные (объемные) дефекты – пустоты, включения второй фазы (по Ван-Бюрену) - Равновесные дефекты (термодинамика) – точечные (определенная концентрация и тип) - Неравновесные дефекты («предыстория») – дислокации (10-100эВ), блоки мозаики, границы зерен Взаимодействие дефектов (дислокации и точечные дефекты) Собственные и несобственные дефекты
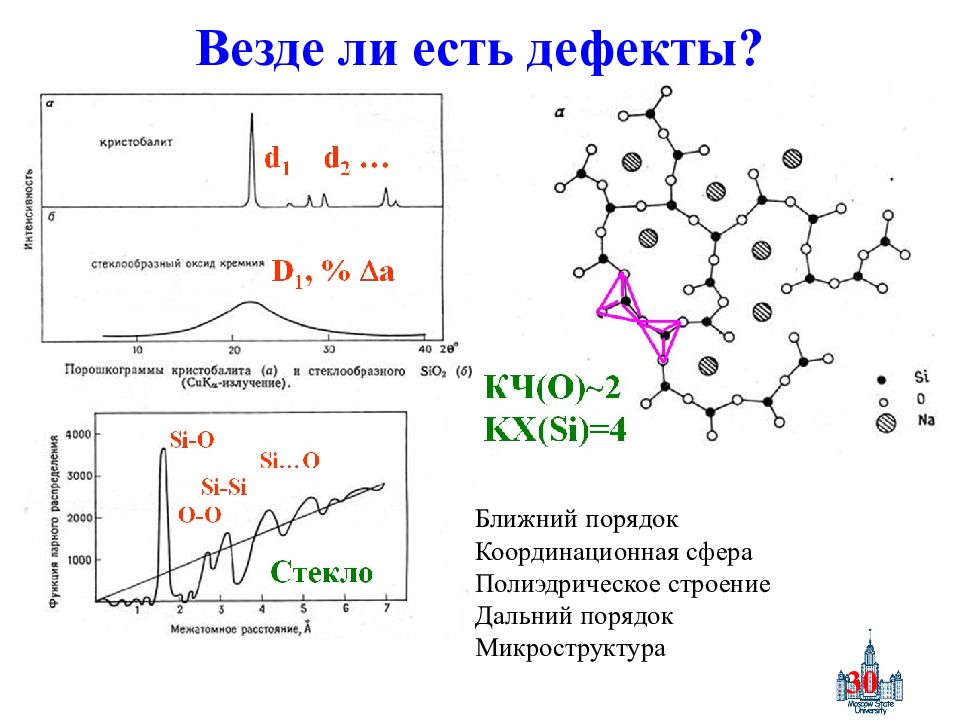
Слайд 30: Везде ли есть дефекты ?
30 Везде ли есть дефекты ? Ближний порядок Координационная сфера Полиэдрическое строение Дальний порядок Микроструктура
Слайд 32: Иглы для атомно-силовой микроскопии
32 Иглы для атомно-силовой микроскопии Фотолитография + ПЖК
Слайд 34: Нитевидные кристаллы SiO 2
34 Нитевидные кристаллы SiO 2 Система Ga-N-Si-O ( лит. данные )
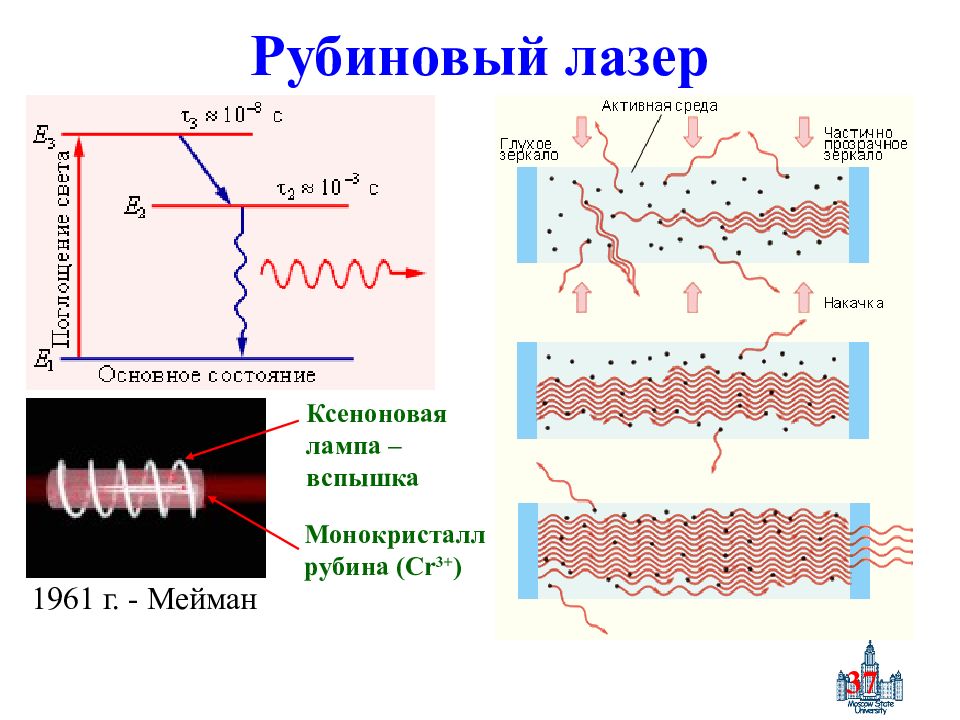
Слайд 37: Рубиновый лазер
37 Рубиновый лазер 1961 г. - Мейман Монокристалл рубина ( Cr 3+ ) Ксеноновая лампа – вспышка
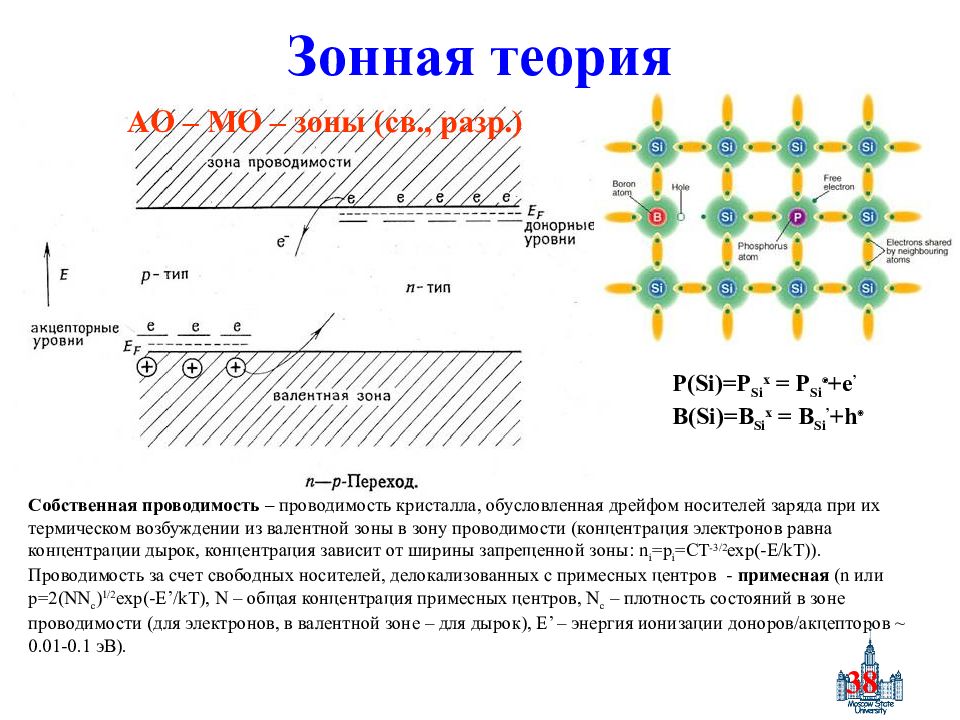
Слайд 38: Зонная теория
38 Зонная теория P(Si)=P Si x = P Si +e ’ B(Si)=B Si x = B Si ’ +h AO – MO – зоны (св., разр.) Собственная проводимость – проводимость кристалла, обусловленная дрейфом носителей заряда при их термическом возбуждении из валентной зоны в зону проводимости (концентрация электронов равна концентрации дырок, концентрация зависит от ширины запрещенной зоны : n i =p i =CT -3/2 exp(-E/kT) ). Проводимость за счет свободных носителей, делокализованных с примесных центров - примесная ( n или p=2(NN c ) 1/2 exp(-E’/kT), N – общая концентрация примесных центров, N c – плотность состояний в зоне проводимости (для электронов, в валентной зоне – для дырок), E’ – энергия ионизации доноров / акцепторов ~ 0.01-0.1 эВ).
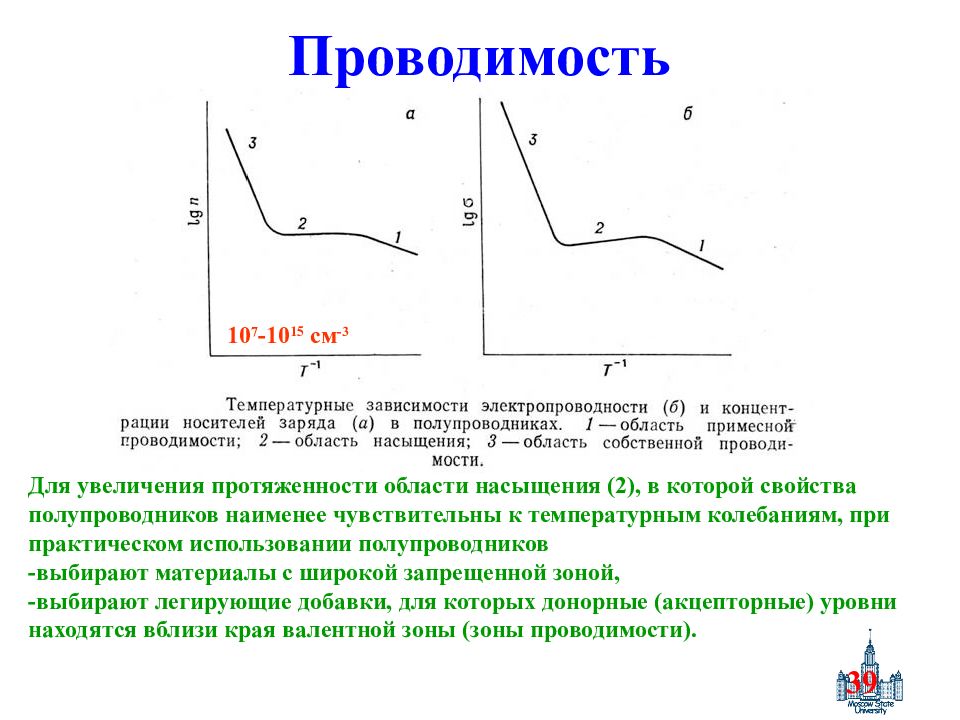
Слайд 39: Проводимость
39 Проводимость 10 7 -10 15 см -3 Для увеличения протяженности области насыщения (2), в которой свойства полупроводников наименее чувствительны к температурным колебаниям, при практическом использовании полупроводников -выбирают материалы с широкой запрещенной зоной, -выбирают легирующие добавки, для которых донорные (акцепторные) уровни находятся вблизи края валентной зоны (зоны проводимости).
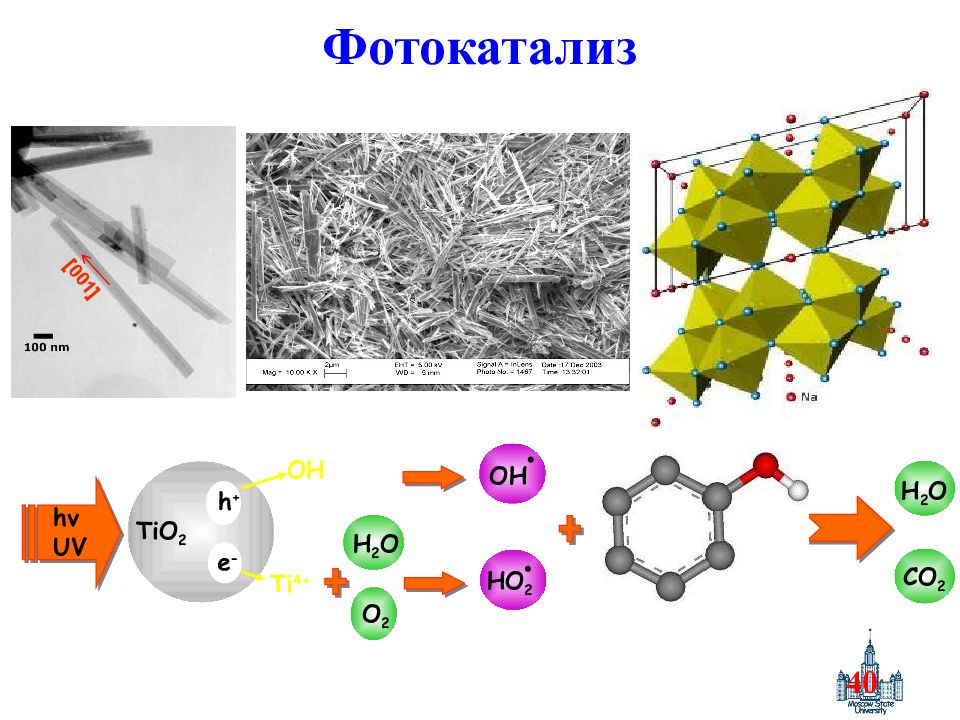
Слайд 40: Фотокатализ
40 [001] Фотокатализ h ν UV O 2 H 2 O HO 2 OH TiO 2 h + e - H 2 O CO 2 Ti 4+ OH
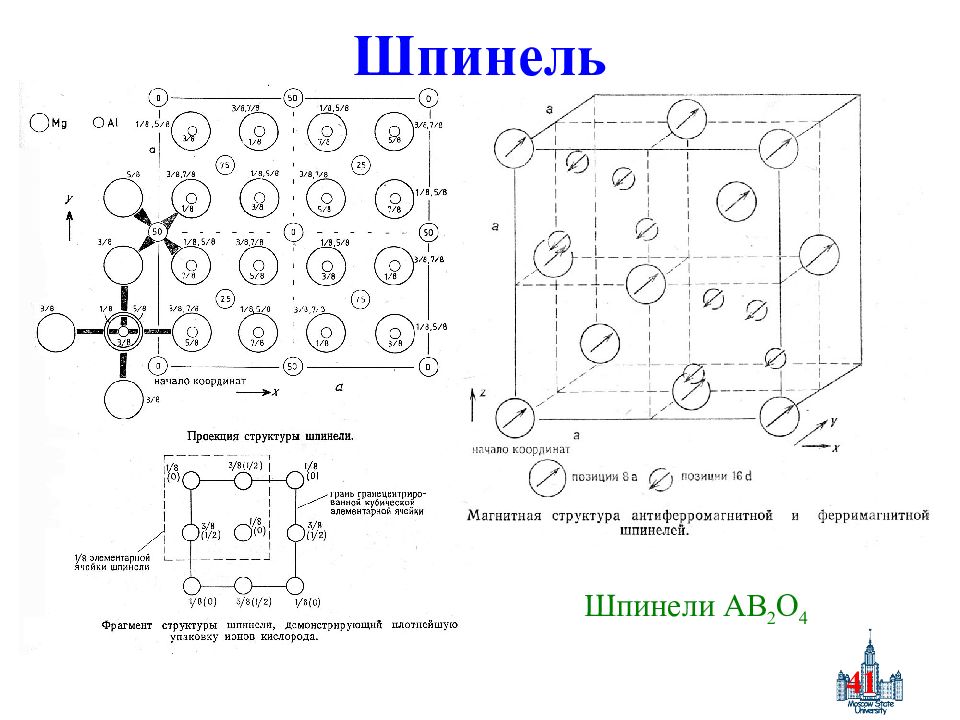
Слайд 42
42 Кубические Fd3m, n = 8. КПУ кислорода, в пустотах: ½ окт – В, 1/8 тетр. – А. [A 1- δ B δ ][A δ B 2- δ ] o O 4, δ – степень обращения γ - Fe 2 O 3 : [Fe 3+ ] т [V 1/3 Fe 1 2/3 3+ ]O 4 Факторы распределения: Ионные радикалы, электронное строение: Ni 2+, Cr 3+ - окт., Mn 2+, Fe 3+, Mg 2+ - люб., Cd 2+, Ga 3+ - тетр. 2. Электростатическая энергия – высокий заряд – октаэдр δ = f(T): δ (1+ δ )/(1- δ ) 2 = e -E/kT E – энергия перераспределения октаэдр ↔ тетраэдр δ увеличивается с Т, ∟АОВ ≈ 125 о, ∟ВОВ ≈ 90 o A ↑ B ↓ B ↓ μ = μ B – μ A ( в магнетонах Бора, « μ В »), μ А = gS A = n A, μ B = gS B = n B Описание
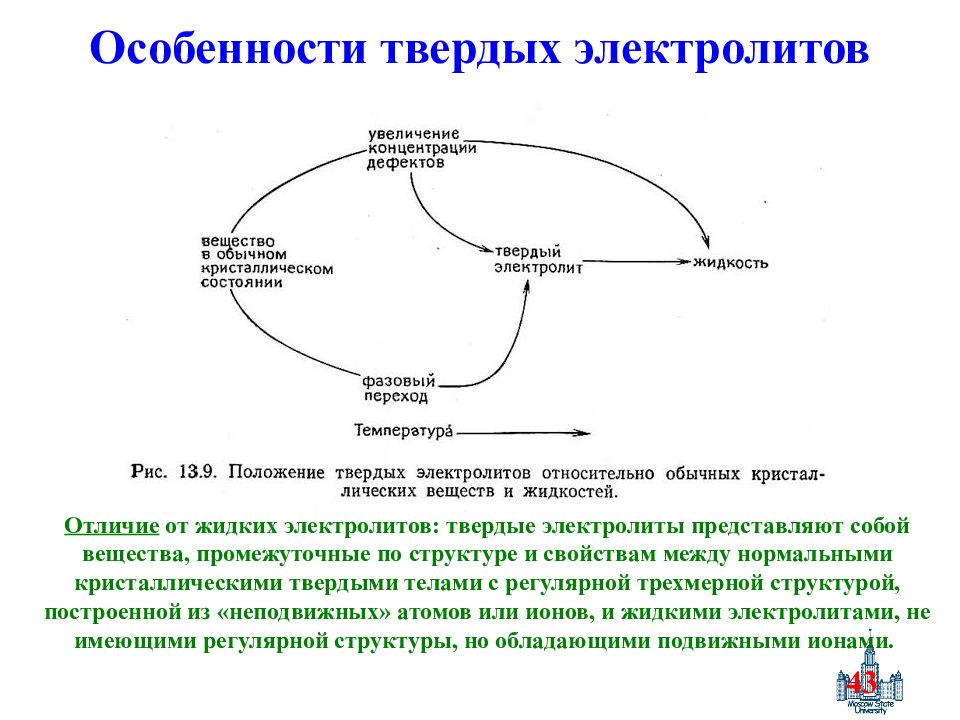
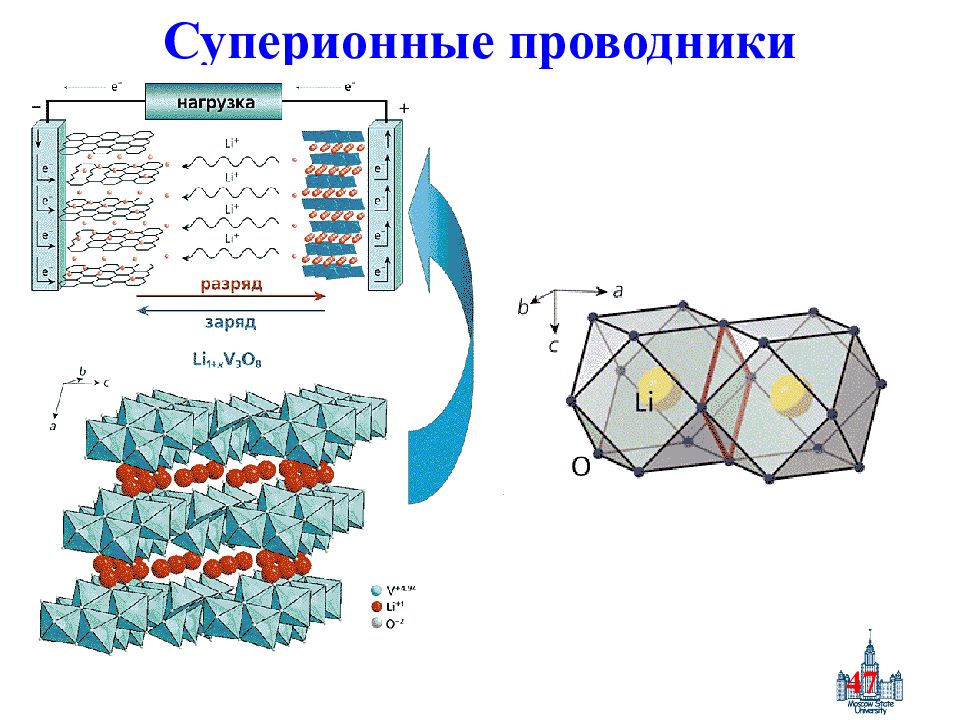
Слайд 43: Особенности твердых электролитов
43 Особенности твердых электролитов Отличие от жидких электролитов : твердые электролиты представляют собой вещества, промежуточные по структуре и свойствам между нормальными кристаллическими твердыми телами с регулярной трехмерной структурой, построенной из «неподвижных» атомов или ионов, и жидкими электролитами, не имеющими регулярной структуры, но обладающими подвижными ионами.
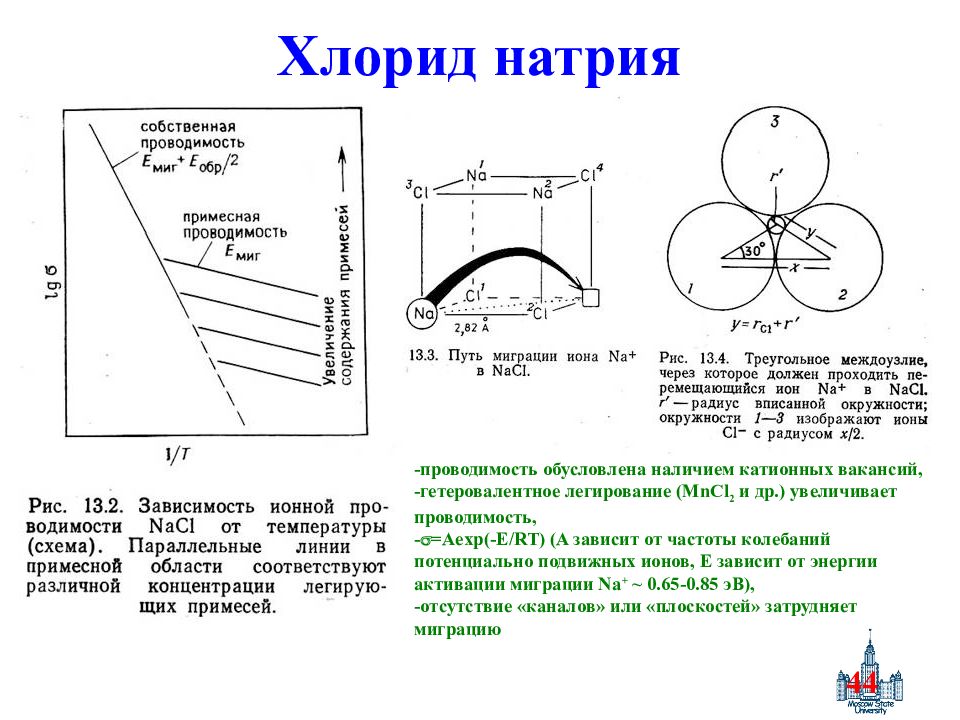
Слайд 44: Хлорид натрия
44 Хлорид натрия -проводимость обусловлена наличием катионных вакансий, -гетеровалентное легирование ( MnCl 2 и др.) увеличивает проводимость, - = Aexp(-E/RT) (A зависит от частоты колебаний потенциально подвижных ионов, Е зависит от энергии активации миграции Na + ~ 0.65-0.85 эВ ), -отсутствие «каналов» или «плоскостей» затрудняет миграцию
Слайд 45: AgCl (механизм проводимости)
45 AgCl (механизм проводимости) Доминирующий тип дефектов – дефекты Френкеля (подвижные междоузельные ионы Ag +, связанные с катионными вакансиями).
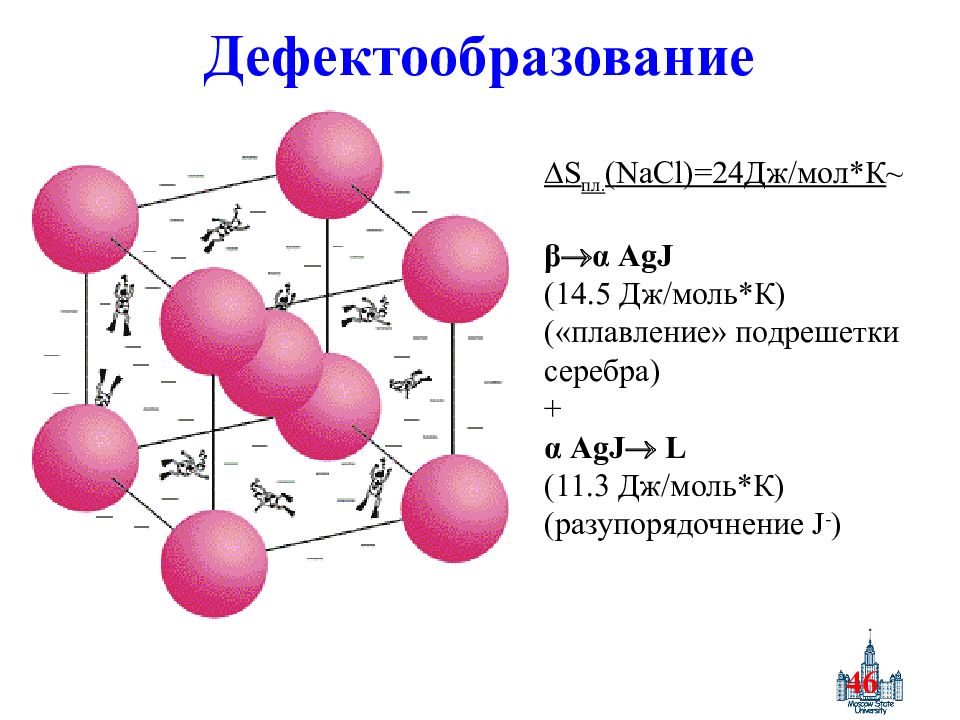
Слайд 46: Дефектообразование
46 Дефектообразование S пл. ( NaCl ) =24 Дж / мол*К ~ β α AgJ (14.5 Дж / моль*К ) («плавление» подрешетки серебра) + α AgJ L (11.3 Дж / моль*К ) ( разупорядочнение J - )
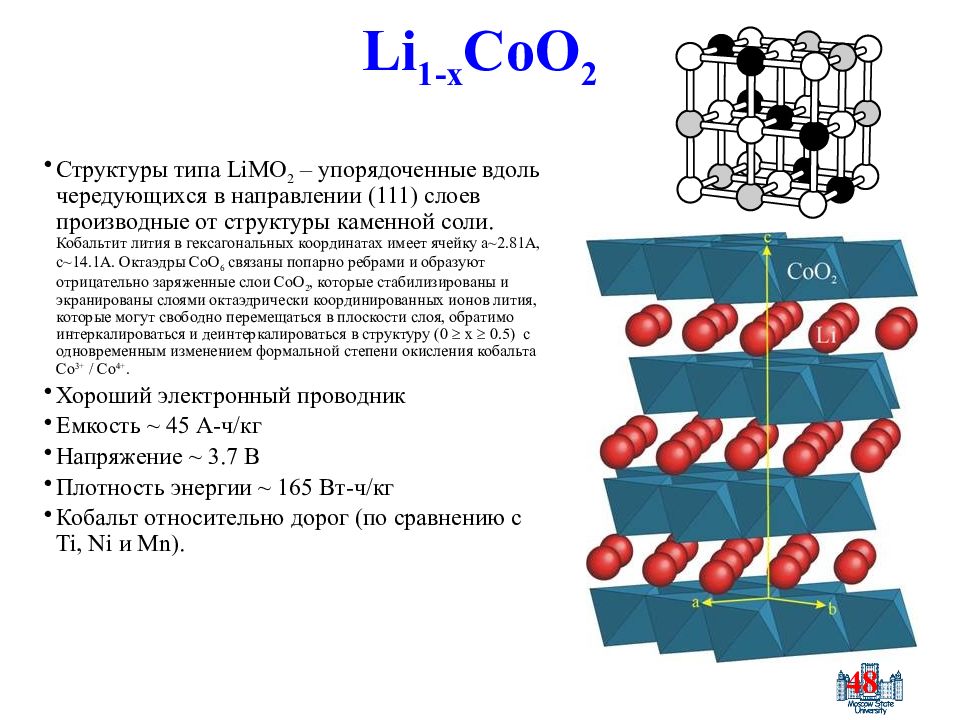
Слайд 48: Li 1-x CoO 2
48 Li 1-x CoO 2 Структуры типа LiMO 2 – упорядоченные вдоль чередующихся в направлении (111) слоев производные от структуры каменной соли. Кобальтит лития в гексагональных координатах имеет ячейку a~2.81A, c~14.1A. Октаэдры CoO 6 связаны попарно ребрами и образуют отрицательно заряженные слои CoO 2, которые стабилизированы и экранированы слоями октаэдрически координированных ионов лития, которые могут свободно перемещаться в плоскости слоя, обратимо интеркалироваться и деинтеркалироваться в структуру ( 0 x 0.5 ) с одновременным изменением формальной степени окисления кобальта Co 3+ / Co 4+. Хороший электронный проводник Емкость ~ 45 А - ч / кг Напряжение ~ 3.7 В Плотность энергии ~ 165 Вт - ч / кг Кобальт относительно дорог ( по сравнению с Ti, Ni и Mn).
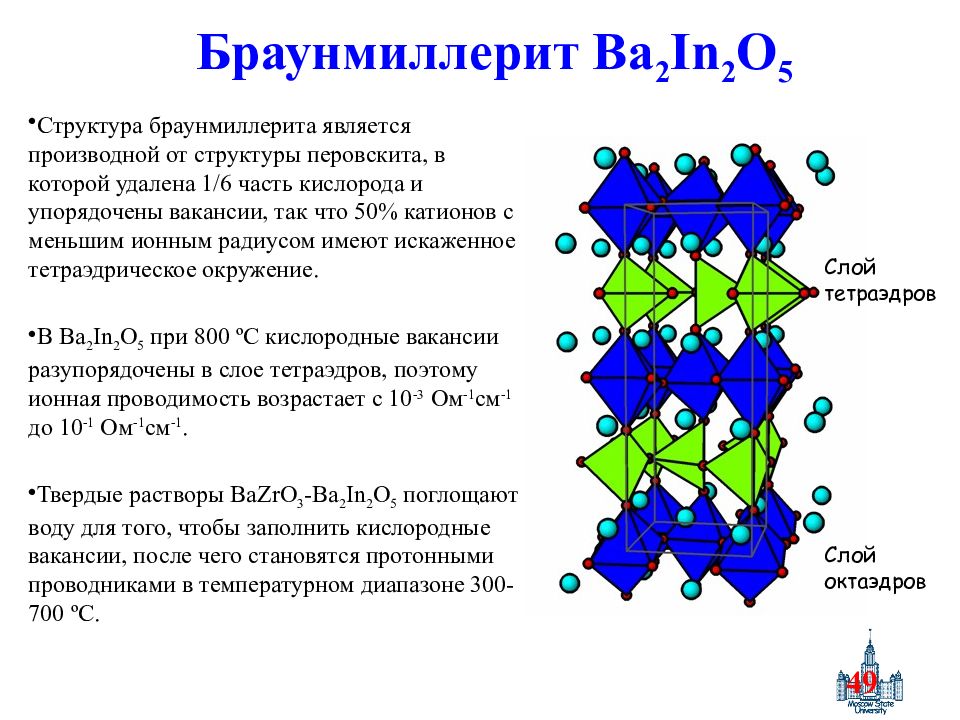
Слайд 49: Браунмиллерит Ba 2 In 2 O 5
49 Браунмиллерит Ba 2 In 2 O 5 Структура браунмиллерита является производной от структуры перовскита, в которой удалена 1/6 часть кислорода и упорядочены вакансии, так что 50% катионов с меньшим ионным радиусом имеют искаженное тетраэдрическое окружение. В Ba 2 In 2 O 5 при 800 ºC кислородные вакансии разупорядочены в слое тетраэдров, поэтому ионная проводимость возрастает с 10 -3 Ом -1 см -1 до 10 -1 Ом -1 см -1. Твердые растворы BaZrO 3 -Ba 2 In 2 O 5 поглощают воду для того, чтобы заполнить кислородные вакансии, после чего становятся протонными проводниками в температурном диапазоне 300-700 ºC. Слой тетраэдров Слой октаэдров
Слайд 50
50 Фазы Ауривиллиуса и BiMeVOx Фазы Ауривиллиуса (например, Bi 2 WO 6 ) содержат двумерные перовскито-подобные слои из соединяющихся по вершинам октаэдров, зажатых слоями типа Bi 2 O 2 2+. (Bi 2 O 2 )VO 3.5 – представитель дефектных фаз Ауривиллиуса, в которых 1/8 часть ктслорода в перовскитном слое вакантна. Мобильны только ионы кислорода в перовскитных слоях. Легирование V – позиций стабилизирует высокотемпературную модификацию с высокой проводимостью ( BiMeVO X ). (Bi 2 O 2 )Cu 0.1 V 0.9 O 3.35 имеет проводимость порядка 0.01 Ом -1 см -1 уже при 350 ºC.
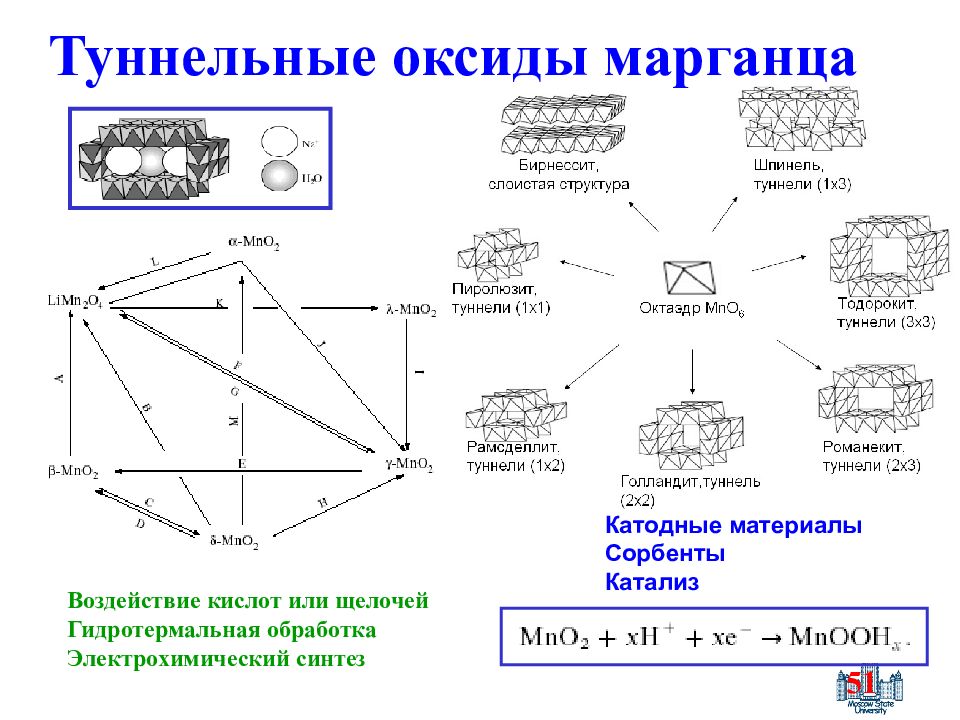
Слайд 51: Туннельные оксиды марганца
51 Воздействие кислот или щелочей Гидротермальная обработка Электрохимический синтез Катодные материалы Сорбенты Катализ Туннельные оксиды марганца
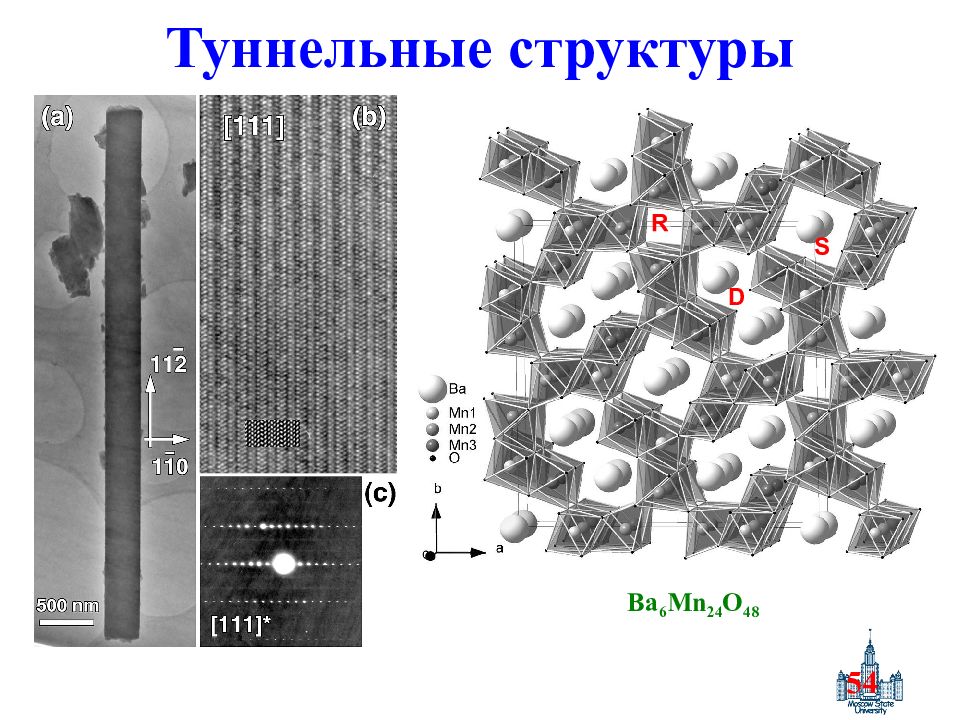
Слайд 53: Иерарархические уровни структуры
53 Иерарархические уровни структуры Увеличение площади поверхности до 16 м 2 / г
Слайд 58: Открытие ВТСП
58 Открытие ВТСП J.G.Bednorz, K.A.Muller Nobel Prize 1987 Kamerling Onnes: Жидкий He, “ плохой металл ” Hg T c ~ 4 K Е.В.Антипов, С.Н.Путилин и др. : Hg- ВТСП T c ~ 4+130 K “ химическая ” эволюция
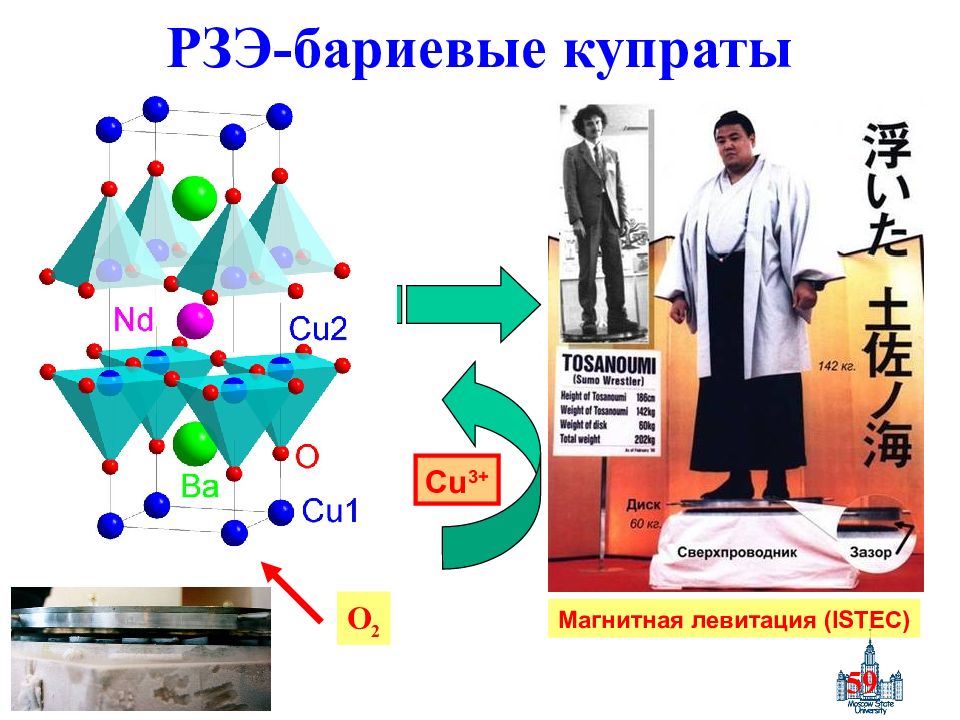
Слайд 59: РЗЭ-бариевые купраты
59 O 2 Магнитная левитация (ISTEC) Cu 3+ РЗЭ-бариевые купраты
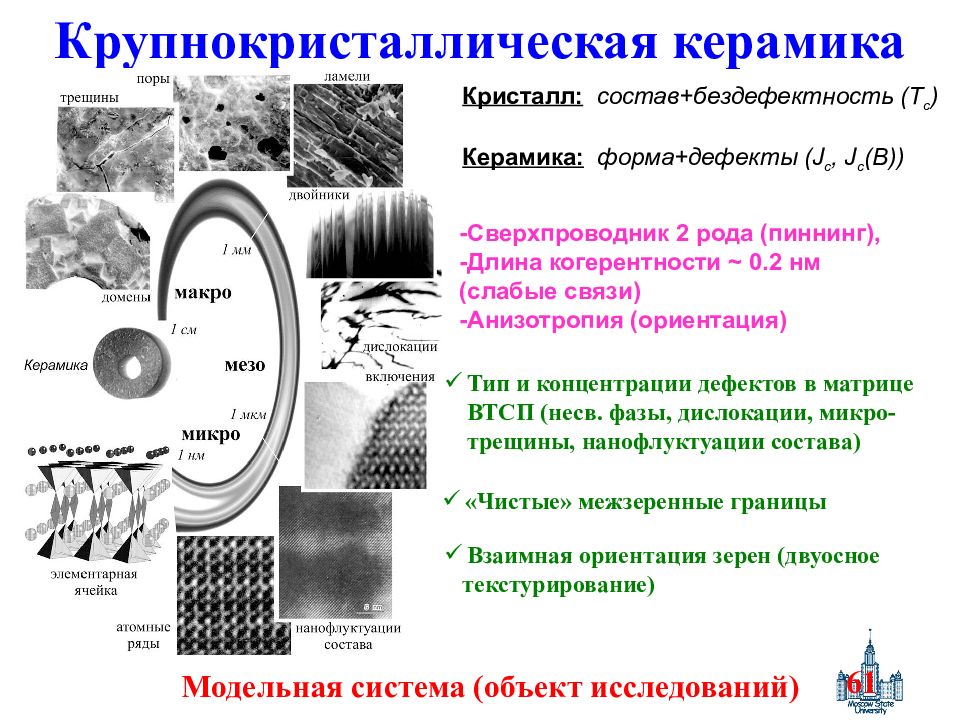
Слайд 61: Крупнокристаллическая керамика
61 Крупнокристаллическая керамика - Сверхпроводник 2 рода (пиннинг), -Длина когерентности ~ 0.2 нм (слабые связи) -Анизотропия (ориентация) Тип и концентрации дефектов в матрице ВТСП (несв. фазы, дислокации, микро-трещины, нанофлуктуации состава) «Чистые» межзеренные границы Взаимная ориентация зерен (двуосное текстурирование) Кристалл : состав+бездефектность (Т с ) Керамика : форма+дефекты ( J c, J c (B) ) Модельная система (объект исследований)
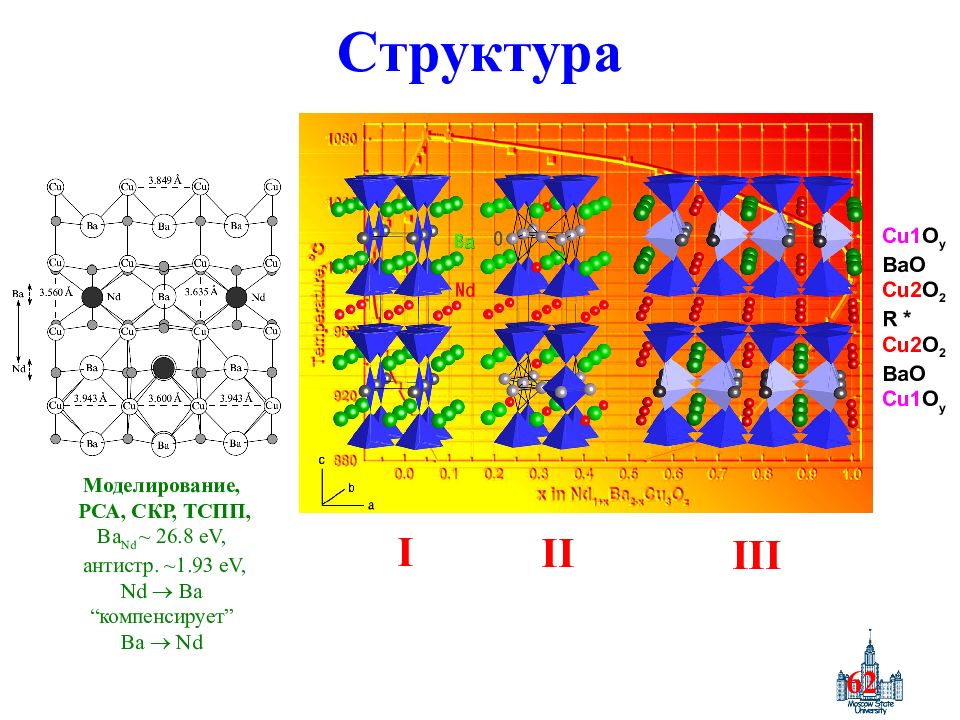
Слайд 62: Структура
62 Структура Cu 1 O y BaO Cu 2 O 2 R * Cu 2 O 2 BaO Cu 1 O y I II III Моделирование, РСА, СКР, ТСПП, Ba Nd ~ 26.8 eV, антистр. ~1.93 eV, Nd Ba “ компенсирует ” Ba Nd
Слайд 64: Ртутные ВТСП - гомологи
64 Ртутные ВТСП - гомологи -оптимальная концентрация заряда в сверхпроводящих плоскостях, -оптимальное количество сверхпроводящих плоскостей. Многие ВТСП фазы имеют гомологи ( «вставка» СП-плоскостей ): -Y123, 247, 124, -Bi 2 201, 2212, 2223, -… HgBa 2 Ca n Cu n+1 O z
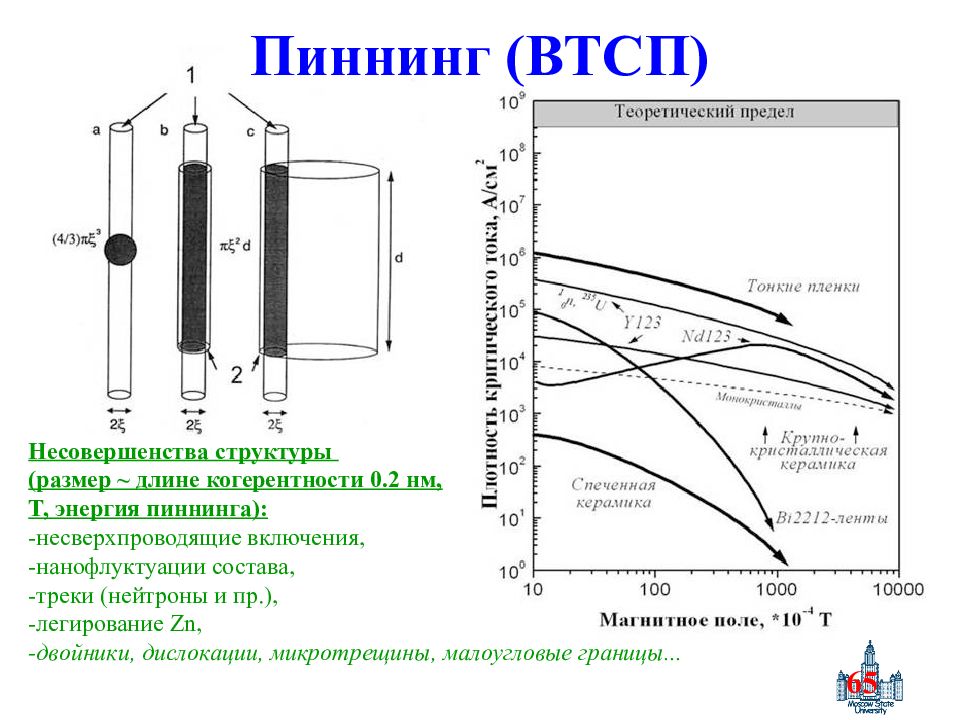
Слайд 65: Пиннинг (ВТСП)
65 Пиннинг (ВТСП) Несовершенства структуры (размер ~ длине когерентности 0.2 нм, T, энергия пиннинга) : - несверхпроводящие включения, -нанофлуктуации состава, -треки (нейтроны и пр.), -легирование Zn, -двойники, дислокации, микротрещины, малоугловые границы...
Слайд 66: Требуемая микроструктура
66 взаимная ориентация ансамбля кристаллитов в поликристаллическом функциональном материале (максимум интегрированных свойств, баланс внутрикристаллитных свойств и межкристаллитных границ) Требуемая микроструктура C a a’ Jc Критично : двуосное текстурирование («сильные связи» для повышения Jc(B) ) Разориентаци в 10 0 – падение тока на 1-2 порядка
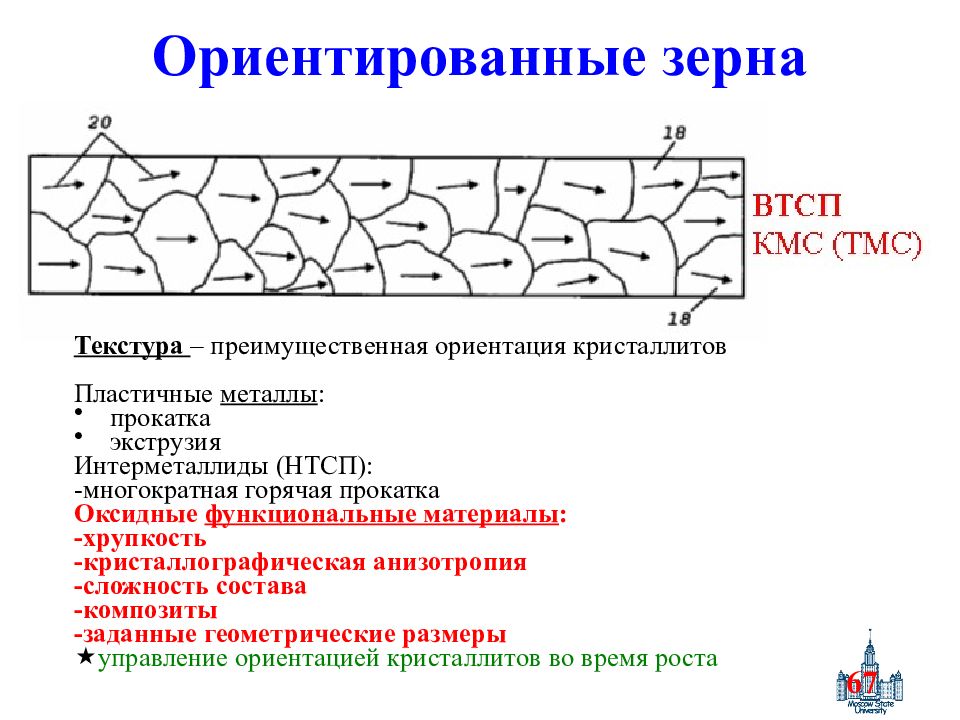
Слайд 67: Ориентированные зерна
67 Ориентированные зерна Текстура – преимущественная ориентация кристаллитов Пластичные металлы : прокатка экструзия Интерметаллиды (НТСП) : -многократная горячая прокатка Оксидные функциональные материалы : - хрупкость -кристаллографическая анизотропия -сложность состава -композиты -заданные геометрические размеры управление ориентацией кристаллитов во время роста
Слайд 69: Графоэпитаксиальное «дерево»
69 Графоэпитаксиальное «дерево» Дендриты, дендримеры, фракталы
Слайд 70
70 Соответствующий по симметрии рельеф ( ось второго порядка, пластинки ), Соответствие размеров кристаллов и элементов рельефа ( около 100 мкм ), Геометрические ограничения роста ( две параллельные стенки ), Контроль зародышеобразования (вблизи элементов рельефа) Параллельные внутренние стенки канавок 1 мм Ориентация кристаллитов a b Двойники ВТСП YBa 2 Cu 3 O 6.5
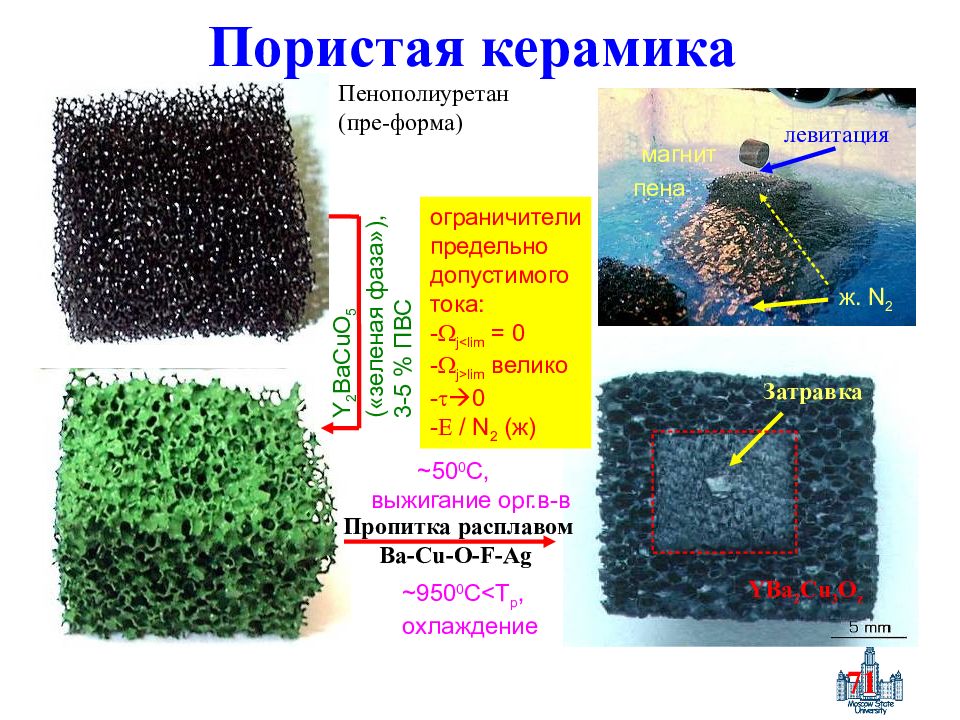
Слайд 71: Пористая керамика
71 Пористая керамика Пенополиуретан (пре-форма) Y 2 BaCuO 5 ( «зеленая фаза» ), 3-5 % ПВС Пропитка расплавом Ba-Cu-O-F-Ag ~950 0 C<T p, охлаждение ~50 0 C, выжигание орг.в-в YBa 2 Cu 3 O z Затравка ж. N 2 левитация пена магнит ограничители предельно допустимого тока : - j<lim = 0 - j>lim велико - 0 - / N 2 (ж)
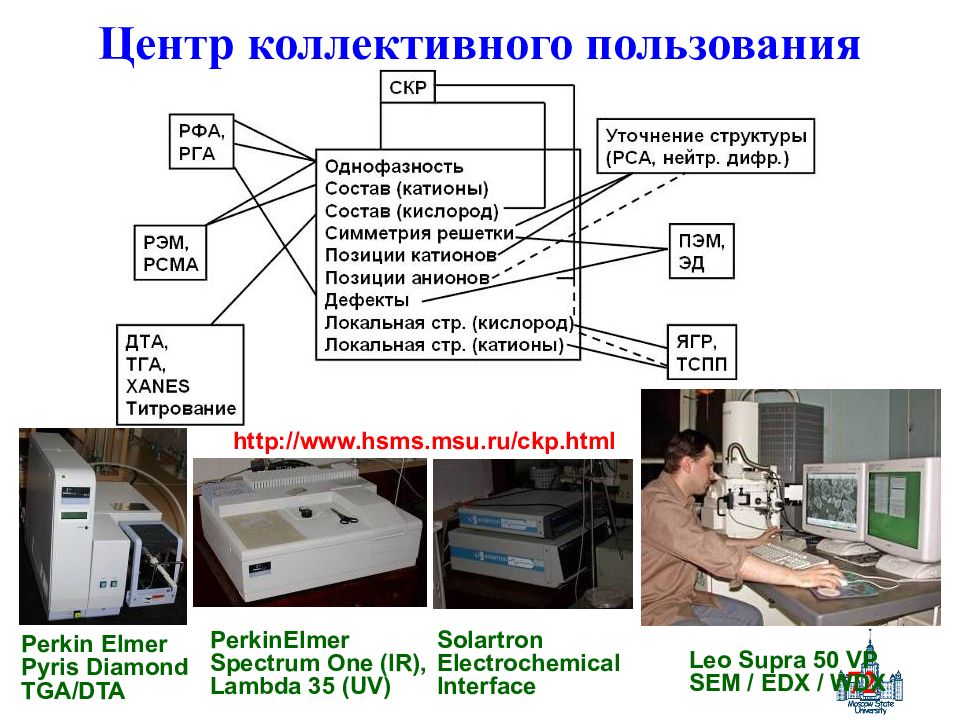
Слайд 72: Центр коллективного пользования
72 Центр коллективного пользования Solartron Electrochemical Interface Leo Supra 50 VP SEM / EDX / WDX Perkin Elmer Pyris Diamond TGA/DTA PerkinElmer Spectrum One (IR), Lambda 35 (UV) http://www.hsms.msu.ru/ckp.html
Слайд 74: Основная литература
74 Основная литература 1. А.Вест. Химия твердого тела. М.: Мир, 1988, т.1,2. 2. Ю.Д.Третьяков, Х.Лепис. Химия и технология твердофазных материалов. М.: МГУ, 1985. 3. В.И.Фистуль. Физика и химия твердого тела, т.1,2. М.: Металлургия, 1995. 4. С.С.Горелик, М.Я.Дашевский. Материаловедение полупроводников и диэлектриков. М.: Металлургия, 1988. 5. В.И.Фистуль. Новые материалы. Состояние, проблемы, перспективы. М.: МИСИС, 1995. 6. Ч.Н.Р.Рао, Дж.Гополакришнан. Новые направления в химии твердого тела. Новосибирск: Наука, 1990. 7. Л. ван Флек. Теоретическое и прикладное материаловедение. М.: Атомиздат, 1975. 8. О.Уайэтт, Д.Дью-Хьюз, Металлы. Керамики. Полимеры., М. : Атомиздат, 1979 9. У.Д.Кингери. Введение в керамику. М.: Изд-во лит-ры по строительству, 1967, 494 с.
Слайд 75: Электронные источники
75 Электронные источники http://perst.isssph.kiae.ru/ ( Перст – Перспективные Технологии ) http://www.rebco-effort.net/ ( EFFORT ) http://www.materialstoday.com/home.htm (Materials Today ! ) http://elibrary.ru/defaultx.asp, http://lib.hsms.msu.ru/ ( Электронная библиотека РФФИ и ФНМ ) http://www.superconductors.org/ (Популярные статьи по ВТСП) goodilin@inorg.chem.msu.ru ( PDF – файлы)
Слайд 76: Анкета
76 Анкета Что такое материал (общее определение) ? Назовите химические соединения (1-2 формулы), являющиеся типичными представителями : наноматериалов, катализаторов, стекол, диэлектриков, полупроводников, сверхпроводников, супериоников, магнитных и биоматериалов. Какие науки вносят наибольший вклад в изучение материалов ? Какие существуют методы физико-химического исследования материалов ?
Слайд 77
77 «Реальная структура твердого тела». Лекция 2. Метод апроксимации Броуэра. Лаборатория неорганического материаловедения, Химфак МГУ Москва 200 5 к.548 goodilin@inorg.chem.msu.ru fmg.inorg.chem.msu.ru 939-47-29
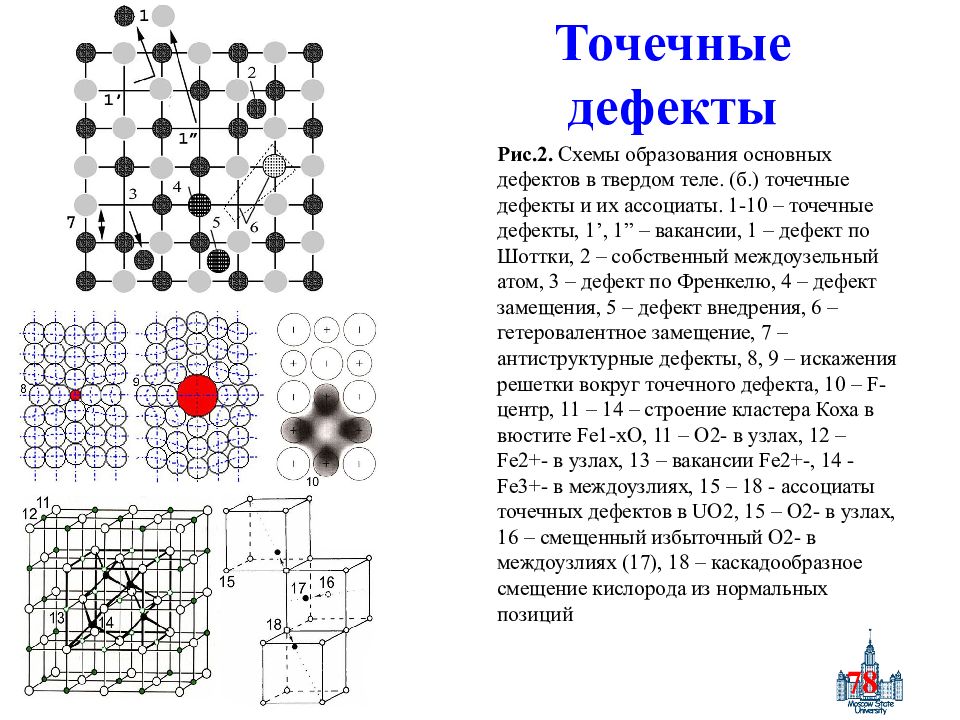
Слайд 78: Точечные дефекты
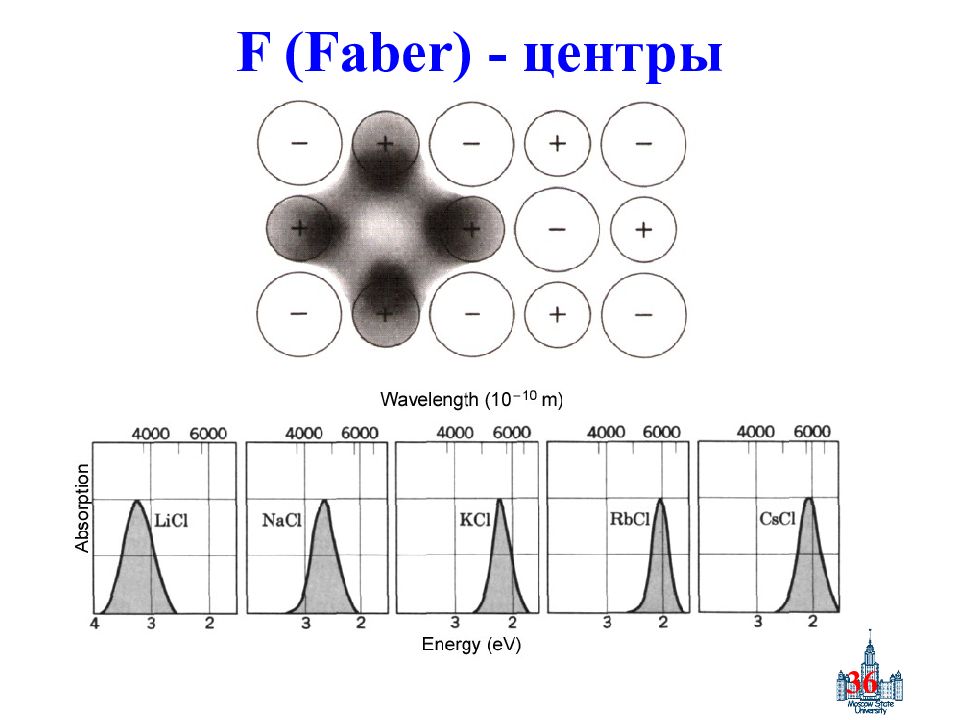
78 Точечные дефекты Рис.2. Схемы образования основных дефектов в твердом теле. (б.) точечные дефекты и их ассоциаты. 1-10 – точечные дефекты, 1’, 1” – вакансии, 1 – дефект по Шоттки, 2 – собственный междоузельный атом, 3 – дефект по Френкелю, 4 – дефект замещения, 5 – дефект внедрения, 6 – гетеровалентное замещение, 7 – антиструктурные дефекты, 8, 9 – искажения решетки вокруг точечного дефекта, 10 – F - центр, 11 – 14 – строение кластера Коха в вюстите Fe 1- xO, 11 – O 2- в узлах, 12 – Fe 2+- в узлах, 13 – вакансии Fe 2+-, 14 - Fe 3+- в междоузлиях, 15 – 18 - ассоциаты точечных дефектов в UO 2, 15 – O 2- в узлах, 16 – смещенный избыточный O 2- в междоузлиях (17), 18 – каскадообразное смещение кислорода из нормальных позиций
Слайд 79: Дефектность
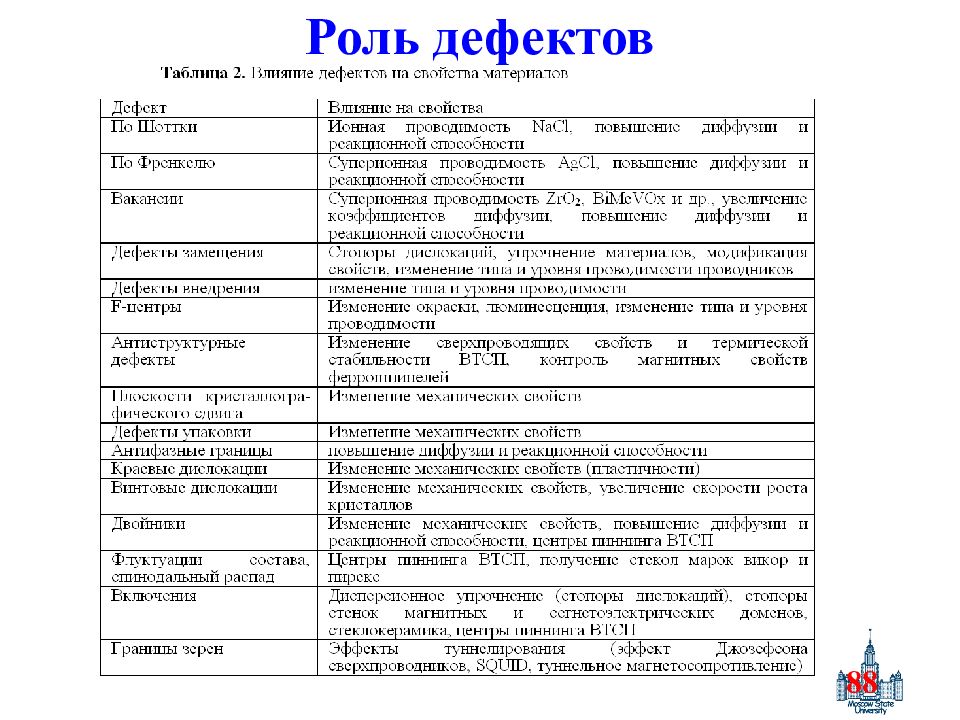
79 Дефектность Идеальных кристаллов не существует. “Кристаллы как люди: именно несовершенства делают их интересными” (Colin Humphreys). Большинство свойств материалов определяются дефектами (часто-искусственно введенными : полупроводники, суперионные проводники, ВТСП).
Слайд 80: Квазихимические уравнения
80 Квазихимические уравнения * закон сохранения массы, * закон сохранения (эффективного) заряда, * фиксированное соотношение между числом различных узлов решетки. 0 (стехиометрический кристалл) = Na (поверхность) + ½ Cl2 (адс.) + VNa’ + VCl , при поглощении кристаллами NaCl натрия образуются F-центры: 0 + Na(пар) = NaNax + VCl + e’ = NaNax + [VCl + e’]. LaF3 = LaCax + 2 FFx + Fix = LaCa + 2F Fx + Fi’ (+ CaF 2)
Слайд 82
82 М.Планк (1911) показал, что энтропия идеального кристалла в состоянии равновесия стремится к нулю по мере приближения к абсолютному нулю температуры. Для реального кристалла при отличных от 0К температурах происходит образование равновесных дефектов. Это термодинамически выгодный процесс, поскольку образование большинства дефектов невыгодно лишь энергетически, однако может быть выгодно с точки зрения общего уменьшения изобарно-изотермического потенциала системы из-за возрастания энтропии (Рис.3.). где G 0 – энергия Гиббса идеального кристалла, n g – потеря энергии при образовании n дефектов, S c – конфигурационная энтропия при образовании дефектов, N – количество регулярных узлов образовании дефектов по Френкелю количество вариантов размещения дефектов и узлов составит по формуле Стирлинга
Слайд 87: Квазихимические приближения
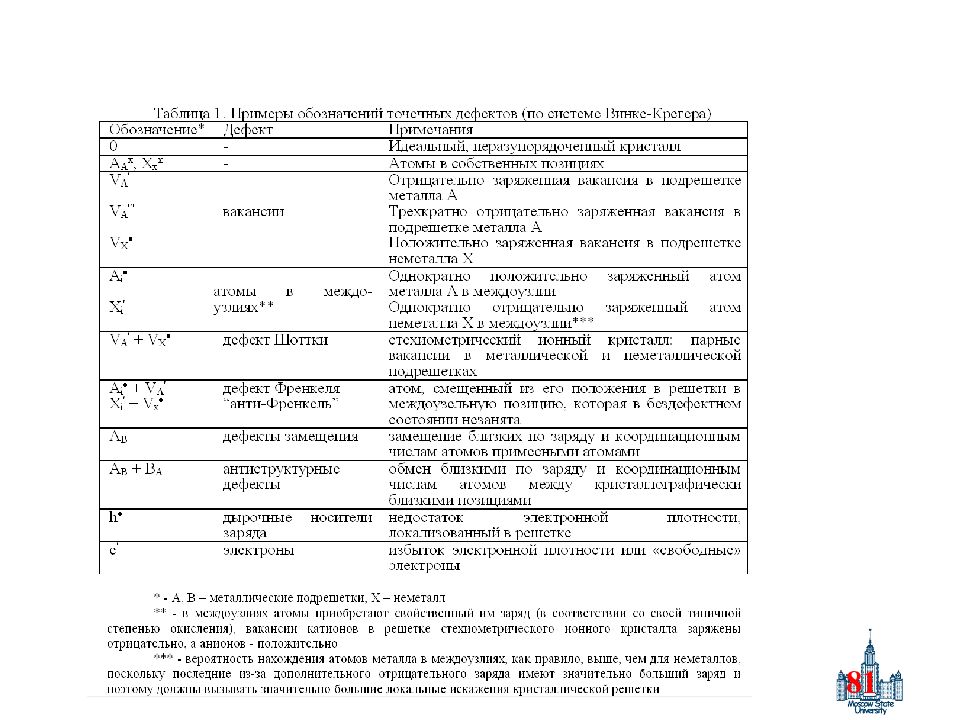
87 Квазихимические приближения Прописная буква – тип дефекта : A, B, … – атомы, V – вакансия (h – дырка, e – электрон). Нижний индекс – в какой позиции находится дефект : A A – атом в регулярном узле, A B – атом в «чужой» подрешетке, A i – атом в междоузлии, V i – свободное междоузлие. Верхний индекс – (эффективный) заряд – заряд атомов или вакансий по отношению к нормальным составляющим решетки : x – нейтральный, - положительный, ‘ – отрицательный (количество надстрочных индексов соответствует величине заряда) Дефекты рассматриваются как квазичастицы, к которым применимы законы сохранения заряда, вещества и количества окружающих данную позицию «противо»узлов (образование вакансии катиона должно автоматически привести к эквивалентным изменениям в анионной подрешетке и наоборот). Дефекты Шоттки – вакансии (в катионной и анионной подрешктке), дефекты Френкеля – переход атома в междоузлие, антиструктурные дефекты – обмен эквивалентного атомов / ионов между подрешетками.
Слайд 90: Законы Мерфи
90 Законы Мерфи Закон Мэрфи Если какая-нибудь неприятность может произойти, она случается Следствия : 1. Из всех неприятностей произойдет именно та, ущерб от которой больше; 2. Предоставленные сами себе, события имеют тенденцию развиваться от плохого к худшему; 3. Если эксперимент удался, что-то здесь не так ( п ервый закон Финэйгла) Следствия II з.т. : «чудес не бывает» «законы Мерфи» вероятность удачи < суммы вероятности неудач
Слайд 91: Энтропия («вероятностное определение»)
91 Энтропия («вероятностное определение») Энтропия - мера статистического беспорядка в замкнутой термодинамической системе. Все самопроизвольно протекающие процессы в замкнутой системе, приближающие систему к состоянию равновесия и сопровождающиеся ростом энтропии, направлены в сторону увеличения вероятности состояния ( Больцман ). Термодинамическая вероятность W состояния системы – это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние ( W >> 1).
Слайд 92: Вычисление энтропии
92 Вычисление энтропии 1 моль газа, число N способов размещения молекулы по двум половинкам сосуда (ми кросостояний ) : 1/N 0 – молекулы только в одной половинке сосуда (одно из микросостояний). Наибольшее число микросостояний - молекулы равномерно распределены по всему объему. S = k ln W, где k =1,38·10 –23 Дж/К (постоянная Больцмана)
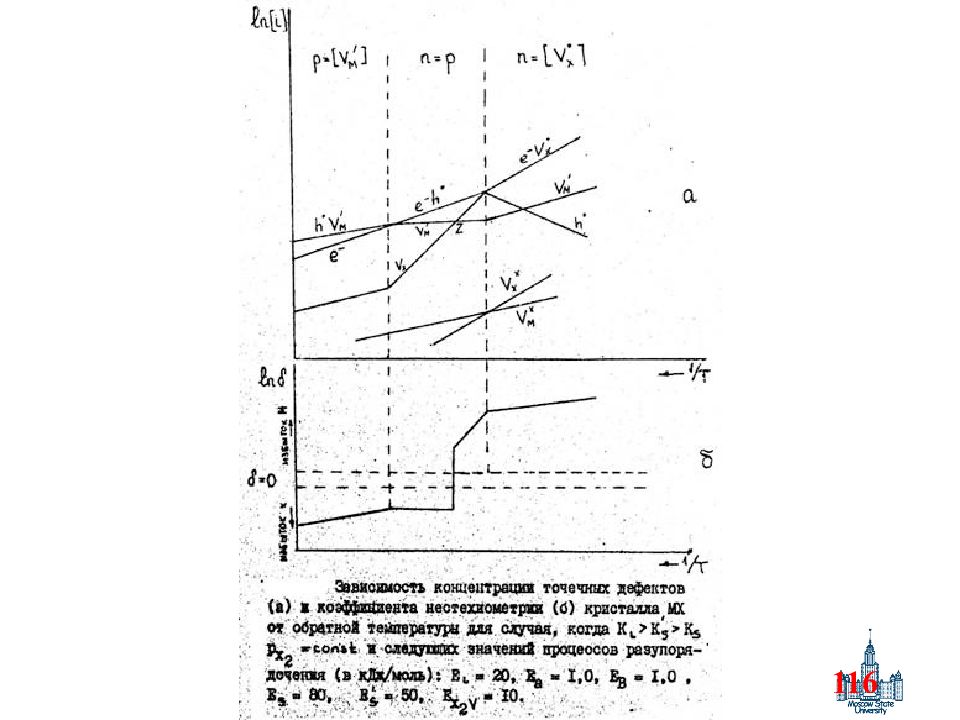
Слайд 100: Алгоритм записи
100 Алгоритм записи Участок : I, II, III, IV, V и др. Парциальное давление : низкое, среднее, высокое, … Квазихимическое уравнение : взаимодействие с газовой фазой Доминирующий тип дефекта : n, p, V X, V M, M i, V X *, V M ’, M i *, … Уравнение электронейтральности : упрощение с учетом дом-го типа дефектов ----- Упрощенные уравнения концентраций дефектов для данного участка ----- i- дефект : указание типа дефектов i- тангенс угла наклона : с учетом «+» или «-», в логарифмических координатах Выводы о типах носителей заряда в зависимости от внешних условий Тип кристалла : MX, MO, MO 2, M 2 O и пр. Соотношение констант : K i, K S, K F, K S ’, K F ’ и др.
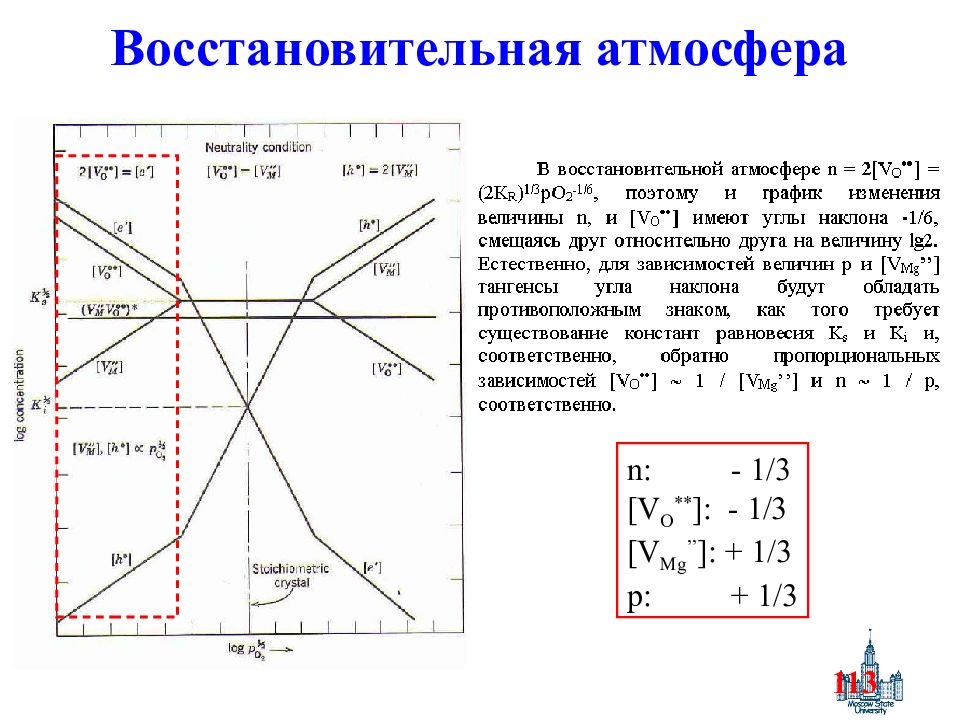
Слайд 113: Восстановительная атмосфера
113 Восстановительная атмосфера n: - 1/3 [V O ** ]: - 1/3 [V Mg ’’ ]: + 1/3 p: + 1/3
Слайд 114: Окислительная атмосфера
114 Окислительная атмосфера n: - 1/3 [V O ** ]: - 1/3 [V Mg ’’ ]: + 1/3 p: + 1/3
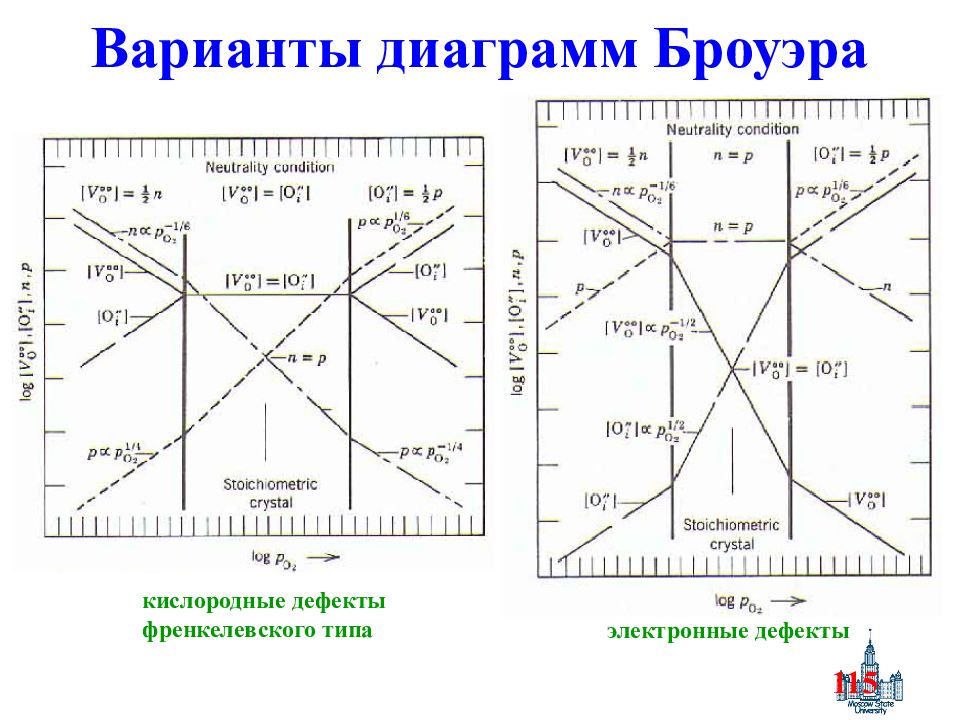
Слайд 115: Варианты диаграмм Броуэра
115 Варианты диаграмм Броуэра кислородные дефекты френкелевского типа электронные дефекты
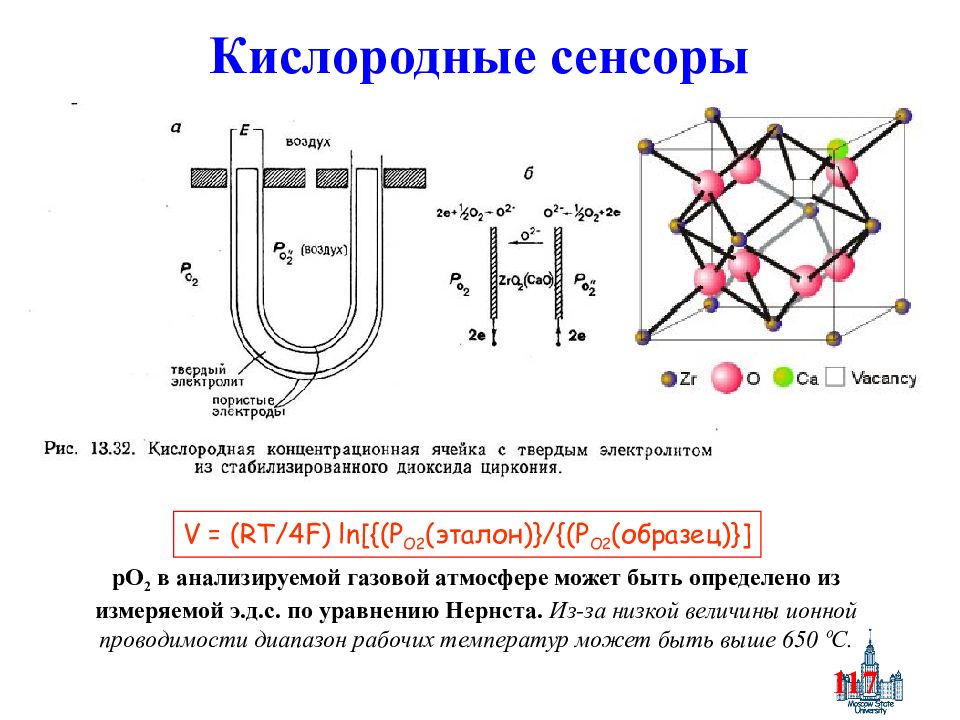
Слайд 117: Кислородные сенсоры
117 Кислородные сенсоры рО 2 в анализируемой газовой атмосфере может быть определено из измеряемой э.д.с. по уравнению Нернста. Из-за низкой величины ионной проводимости диапазон рабочих температур может быть выше 650 ºC. V = (RT/4F) ln[{(P O2 ( эталон )}/{(P O2 ( образец )}]
Слайд 118: Температурные диапазоны
118 Температурные диапазоны CaO(ZrO 2 ) = Ca Zr ’’ + V o + O o x 15 мол. % CaO t i = i /( i + e + h ) O=e’ + h (n~pO 2 1/4 ) При низких рО 2 O = 0.5 O 2 + V o + 2e’ (n~pO 2 -1/4 ) t i >0.99, если lg(pO 2 ( Па )) > -60500/T + 18.5 Легирование ZrO 2 (Zr 1-x Y x O 2-x/2, Zr 1-x Ca x O 2-x ): - Рост концентрации анионных вакансий ( низковалентный катион ) - Стабилизация кубической модификации ( крупные катионы ) Возможно также замещение Zr на катион с большим ионным радиусом (Ce 4+ ) для стабилизации кубической структуры, или более низковалентным катионом (Bi 3+ ) для увеличения концентрации вакансий.
Слайд 119: Анкета
119 Анкета Что такое материал (общее определение) ? В чем разница между функциональными, конструкционными и интеллектуальными материалами ? Назовите химические соединения (1-2 формулы), являющиеся типичными представителями : наноматериалов, катализаторов, полупроводников, сверхпроводников, супериоников, магнитных и биоматериалов. Какие науки вносят наибольший вклад в изучение материалов ? Какие существуют методы физико-химического исследования материалов ?