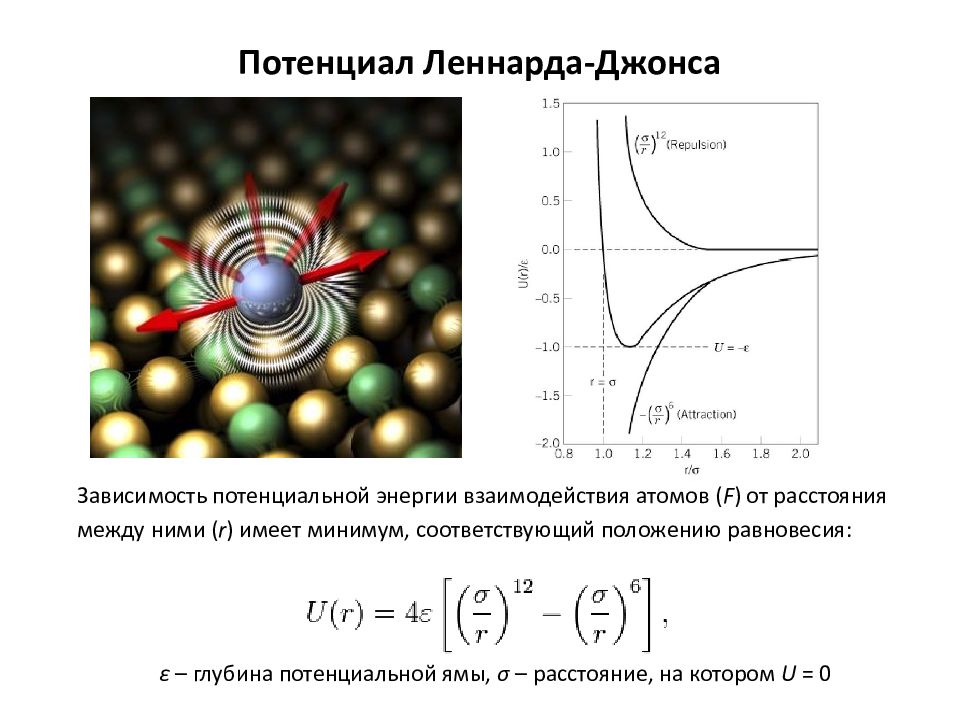
Слайд 2: Потенциал Леннарда-Джонса
Зависимость потенциальной энергии взаимодействия атомов ( F ) от расстояния между ними ( r ) имеет минимум, соответствующий положению равновесия: ε – глубина потенциальной ямы, σ – расстояние, на котором U = 0
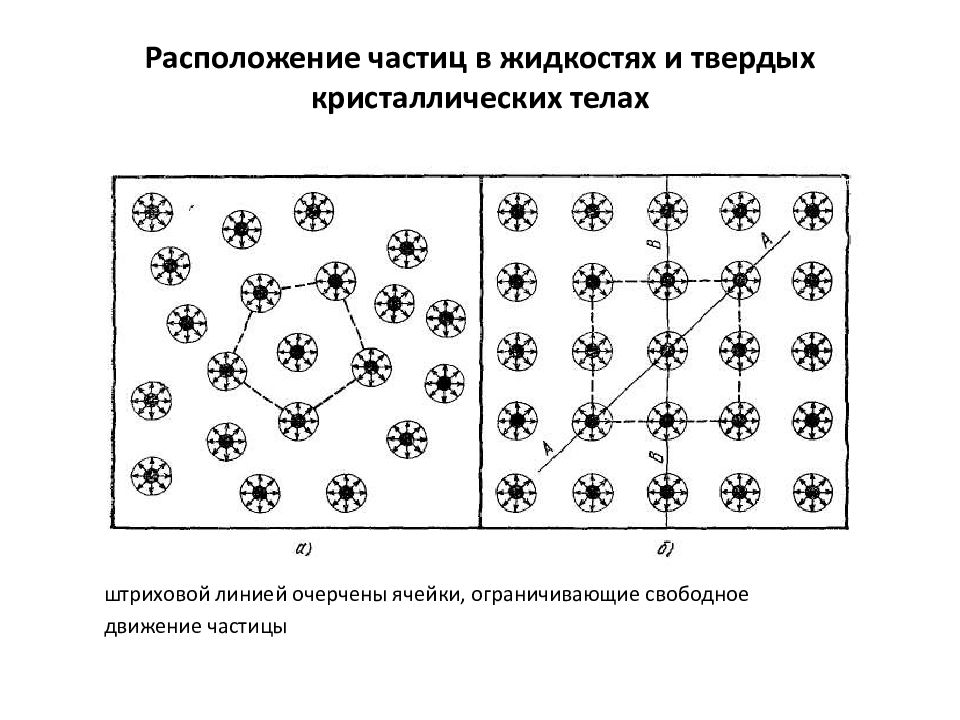
штриховой линией очерчены ячейки, ограничивающие свободное движение частицы
Слайд 4: Структура идеальных кристаллов
Кристалл – твердое тело, в котором атомы образуют трехмерно-периодическую пространственную укладку, т.н. кристаллическую решётку. Периодически повторяющееся размещение частиц в кристалле можно получить трансляцией его узлов – операцией их параллельного перемещения вдоль трех осей: х, у, z. а, b, с – векторы трансляции. Их величины – расстояния между соседними атомами – периоды трансляции или постоянная решётки. Параллелепипед, построенный из а, b, с – называется элементарной ячейкой, а его вершины называются узлами решётки.
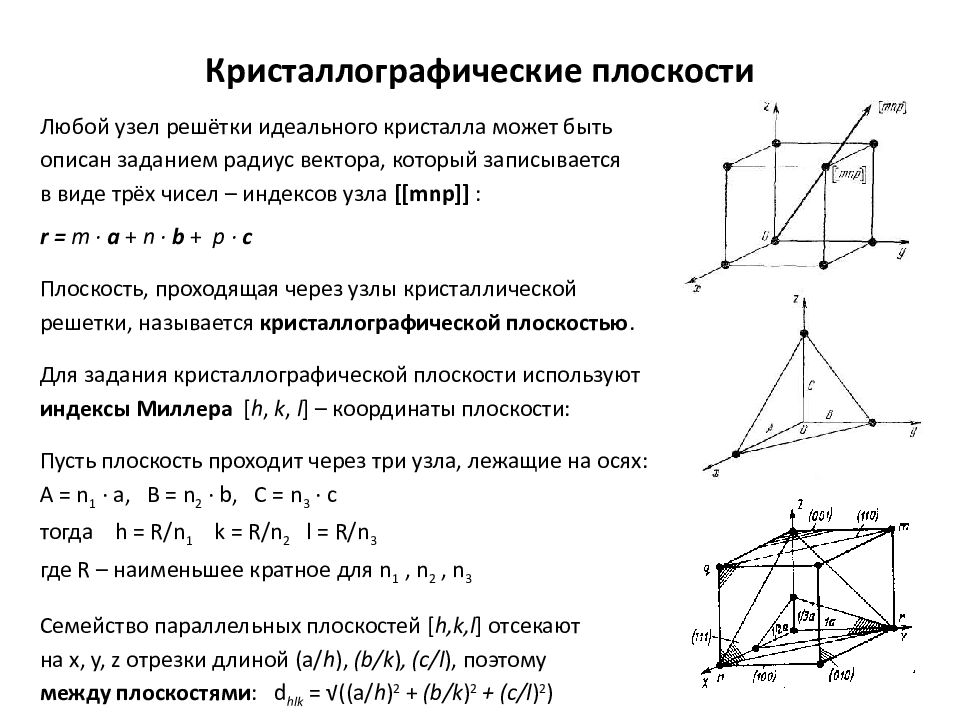
Слайд 5: Кристаллографические плоскости
Любой узел решётки идеального кристалла может быть описан заданием радиус вектора, который записывается в виде трёх чисел – индексов узла [[ mnp ]] : r = m ∙ а + n ∙ b + р ∙ с Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью. Для задания кристаллографической плоскости используют индексы Миллера [ h, k, l ] – координаты плоскости: Пусть плоскость проходит через три узла, лежащие на осях: А = n 1 ∙ а, B = n 2 ∙ b, C = n 3 ∙ с тогда h = R / n 1 k = R / n 2 l = R / n 3 где R – наименьшее кратное для n 1, n 2, n 3 Семейство параллельных плоскостей [ h,k,l ] отсекают на x, y, z отрезки длиной (a/ h ), (b/k ), (c/l ), поэтому между плоскостями : d hlk = √((a/ h ) 2 + (b/k ) 2 + (c/l ) 2 )
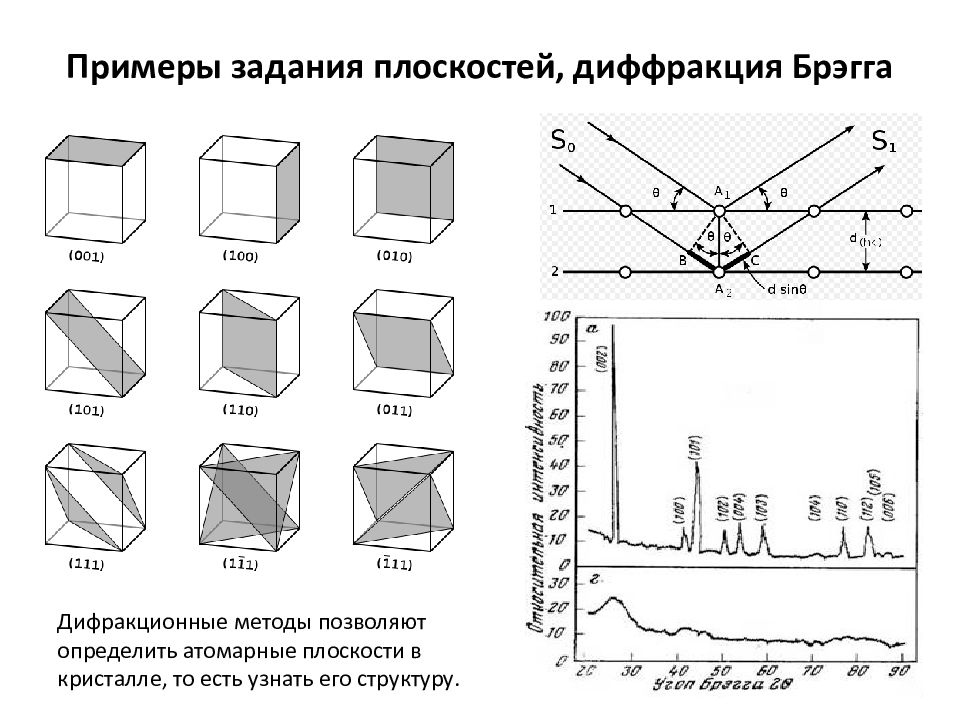
Слайд 6: Примеры задания плоскостей, диффракция Брэгга
Дифракционные методы позволяют определить атомарные плоскости в кристалле, то есть узнать его структуру.
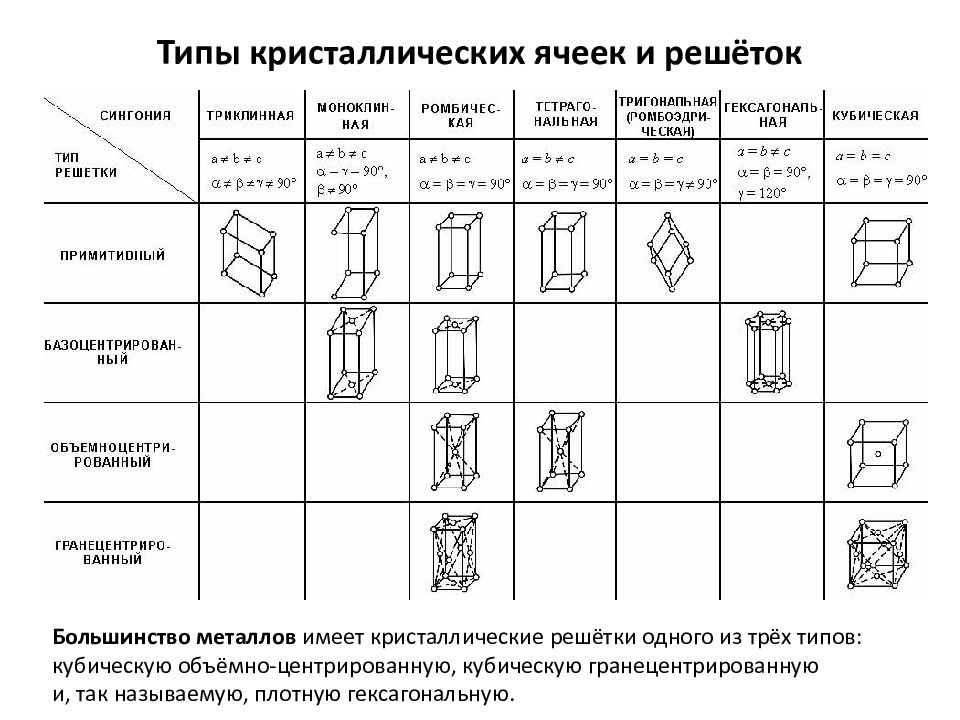
Слайд 7: Типы кристаллических ячеек и решёток
Большинство металлов имеет кристаллические решётки одного из трёх типов: кубическую объёмно-центрированную, кубическую гранецентрированную и, так называемую, плотную гексагональную.
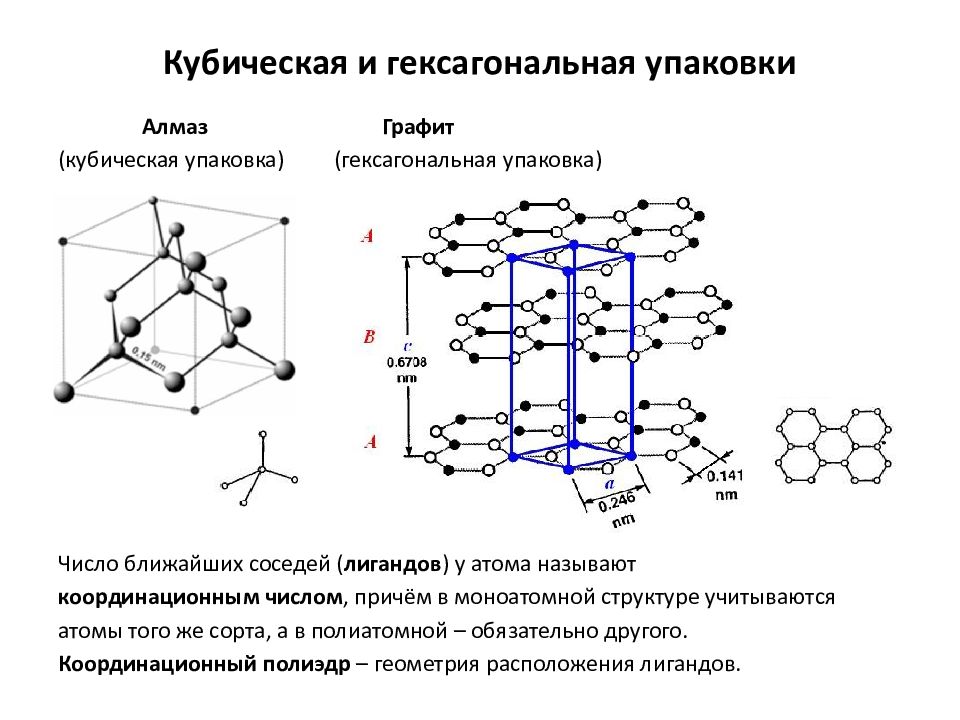
Слайд 8: Кубическая и гексагональная упаковки
Алмаз Графит (кубическая упаковка) (гексагональная упаковка) Число ближайших соседей ( лигандов ) у атома называют координационным числом, причём в моноатомной структуре учитываются атомы того же сорта, а в полиатомной – обязательно другого. Координационный полиэдр – геометрия расположения лигандов. Кубическая и гексагональная упаковки
Слайд 9: Плотная шаровая упаковка
Характерна для молекулярных кристаллов. Атомы в ней у выше- и нижележащих слоев располагаются друг между другом, максимально перекрывая пустоты, но так как её обычно формируют крупные ионы, то в пустотах могут располагаться мелкие ионы других атомов структуры. а, б - плотные шаровые слои в - двуслойная гексогональная ПШУ (… АВАВАВ …), кристаллы Mg, Be, Ru и Os г - трехслойная кубическая ПШУ (… АВСАВСАВС …), кристаллы Cu, Ag, Au, Ni д - объемноцентрированная кубическая кладка, кристаллы a-Fe, Na, К, Ba, Nb, Та е - простая кубическая кладка ж - стуктура NaCl c плотнейшей упаковкой ионов Cl -, где ионы Na + сидят в октаэдрических пустотах Плотная шаровая упаковка
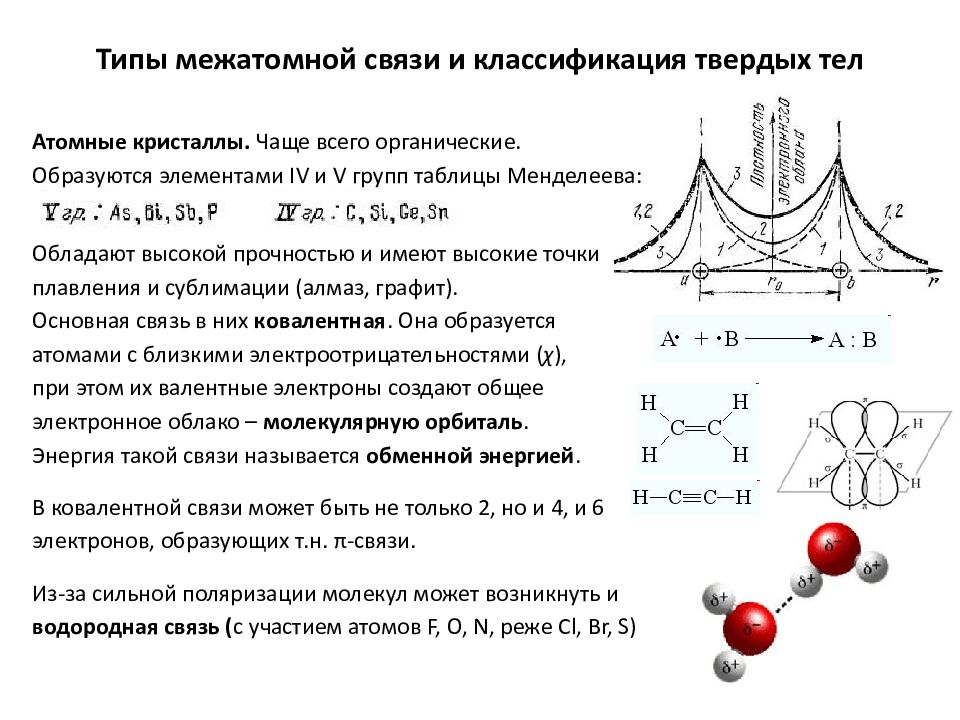
Слайд 10: Типы межатомной связи и классификация твердых тел
Атомные кристаллы. Чаще всего органические. Образуются элементами IV и V групп таблицы Менделеева: Обладают высокой прочностью и имеют высокие точки плавления и сублимации (алмаз, графит). Основная связь в них ковалентная. Она образуется атомами с близкими электроотрицательностями ( χ ), при этом их валентные электроны создают общее электронное облако – молекулярную орбиталь. Энергия такой связи называется обменной энергией. В ковалентной связи может быть не только 2, но и 4, и 6 электронов, образующих т.н. π -связи. Из-за сильной поляризации молекул может возникнуть и водородная связь ( с участием атомов F, O, N, реже Cl, Br, S)
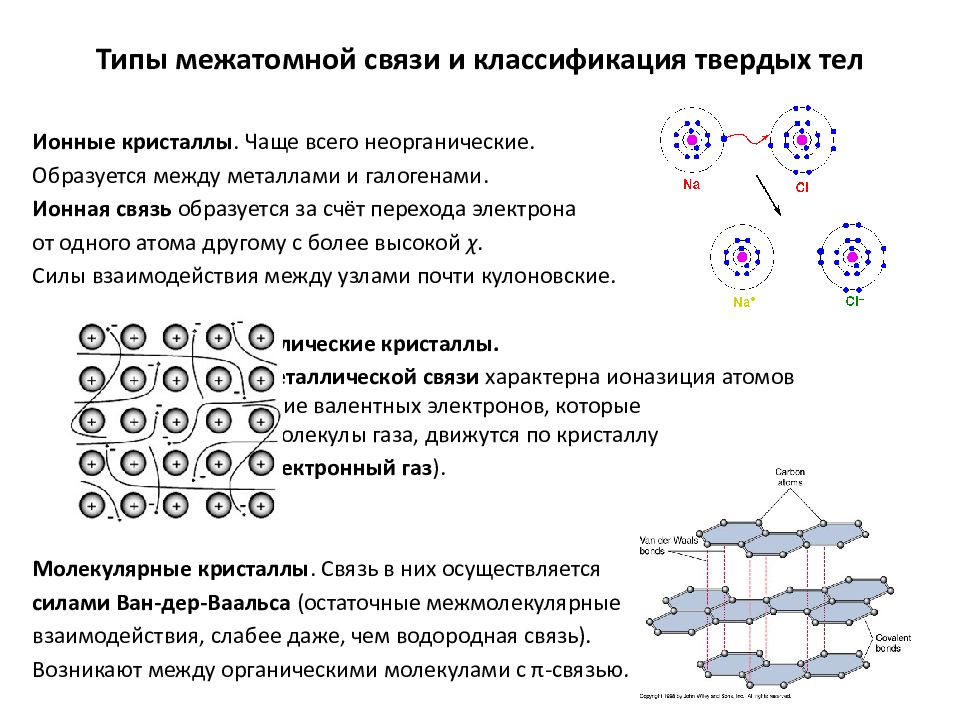
Слайд 11: Типы межатомной связи и классификация твердых тел
Ионные кристаллы. Чаще всего неорганические. Образуется между металлами и галогенами. Ионная связь образуется за счёт перехода электрона от одного атома другому с более высокой χ. Силы взаимодействия между узлами почти кулоновские. Металлические кристаллы. Для металлической связи характерна ионазиция атомов и обобществление валентных электронов, которые беспорядочно, как молекулы газа, движутся по кристаллу (т.н. электронный газ ). Молекулярные кристаллы. Связь в них осуществляется силами Ван-дер-Ваальса (остаточные межмолекулярные взаимодействия, слабее даже, чем водородная связь). Возникают между органическими молекулами с π -связью.
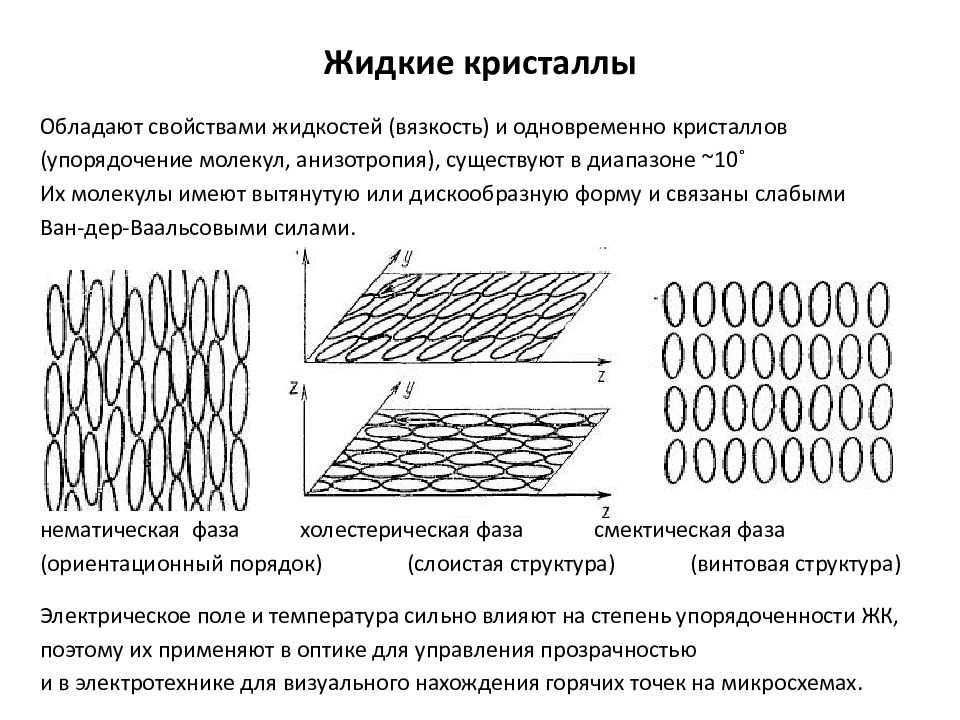
Слайд 12: Жидкие кристаллы
Обладают свойствами жидкостей (вязкость) и одновременно кристаллов (упорядочение молекул, анизотропия), существуют в диапазоне ~10˚ Их молекулы имеют вытянутую или дискообразную форму и связаны слабыми Ван-дер-Ваальсовыми силами. нематическая фаза холестерическая фаза смектическая фаза (ориентационный порядок) (слоистая структура) (винтовая структура) Электрическое поле и температура сильно влияют на степень упорядоченности ЖК, поэтому их применяют в оптике для управления прозрачностью и в электротехнике для визуального нахождения горячих точек на микросхемах.
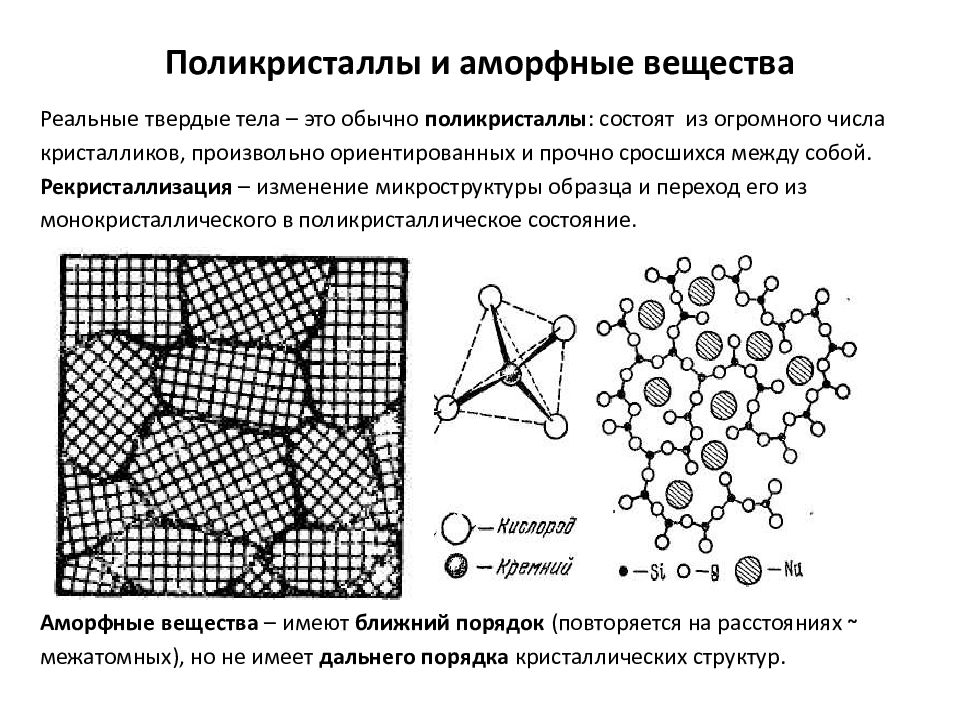
Слайд 13: Поликристаллы и аморфные вещества
Реальные твердые тела – это обычно поликристаллы : состоят из огромного числа кристалликов, произвольно ориентированных и прочно сросшихся между собой. Рекристаллизация – изменение микроструктуры образца и переход его из монокристаллического в поликристаллическое состояние. стекло: Аморфные вещества – имеют ближний порядок (повторяется на расстояниях ~ межатомных), но не имеет дальнего порядка кристаллических структур.
Слайд 14: Квазикристаллы
Квазикристалл – твёрдое тело с симметрией, запрещённой в классической кристаллографии, и наличием дальнего порядка. Наряду с кристаллами обладает дискретной картиной дифракции, чем также отличается от аморфных тел. Впервые наблюдались Данoм Шехтманом в быстроохлаждённом сплаве Al 6 Mn (названы « шехтманит »), за что в 2011 году ему была присвоена Нобелевская премия. Квазикристаллы Диффракционная картина с точечной симметрией икосаэдра, невозможной в трёхмерной периодической решётке. кристалл Ag-Al
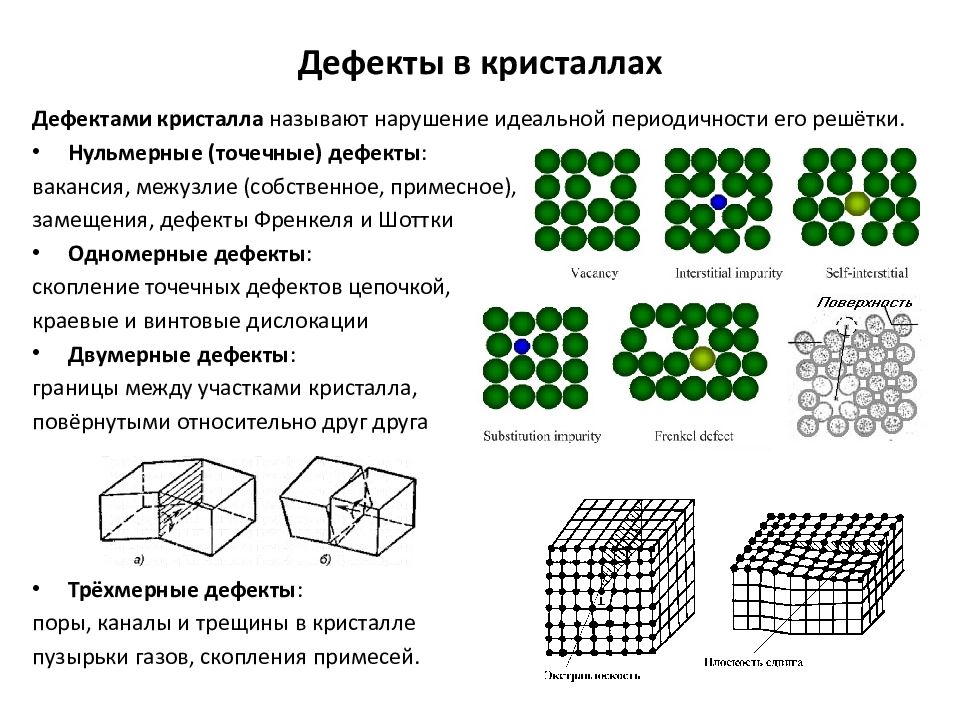
Слайд 15: Дефекты в кристаллах
Дефектами кристалла называют нарушение идеальной периодичности его решётки. Нульмерные (точечные) дефекты : вакансия, межузлие (собственное, примесное ), примесный атом замещения, дефекты Френкеля и Шоттки Одномерные дефекты : скопление точечных дефектов цепочкой, краевые и винтовые дислокации Двумерные дефекты : границы между участками кристалла, повёрнутыми относительно друг друга Трёхмерные дефекты : поры, каналы и трещины в кристалле пузырьки газов, скопления примесей. Дефекты в кристаллах
Слайд 16: Дефекты в кристаллах
Плотность дислокаций равна числу дислокационных линий, пересекающих единичную площадку поверхности кристалла. В наиболее совершенных кристаллах кремния и германия она равна 10 2 см ‑2. Дефекты влияют на оптические свойства кристалла, его электропроводность, теплопроводность, поляризуемость, магнитные свойства и т.д. Подвижность дислокаций определяет пластичность кристалла, а их скопления вызывают появление внутренних напряжений и увеличивают хрупкость. Объёмные дефекты снижают пластичность и также влияют на прочность. Искусственное введение примесных атомов при закалке или старении позволяет улучшать физико-механические свойства металлов и сплавов ( явления упрочнения ). Избавиться от дислокаций и точечных дефектов помогают термический отжиг и метод зонной плавки. Ковка и прокатка, наоборот, генерируют многочисленные дислокации, по-разному ориентированные в пространстве, что затрудняет разрушение кристалла по сетке дислокаций. Прочность металла таким образом увеличивается, но снижается пластичность. Дефекты в кристаллах
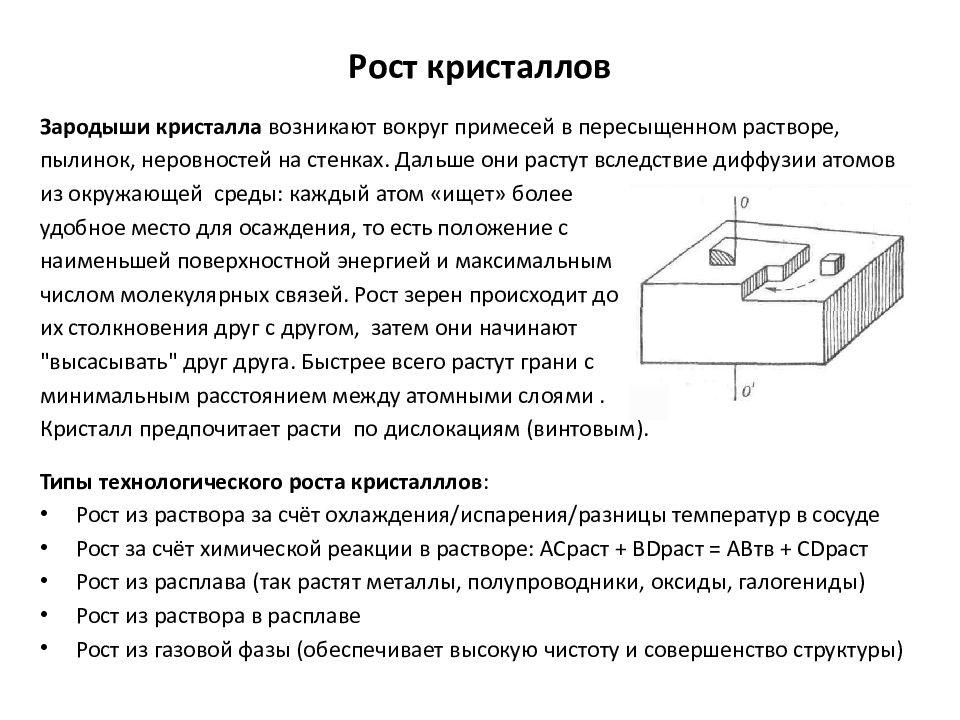
Слайд 17: Рост кристаллов
Зародыши кристалла возникают вокруг примесей в пересыщенном растворе, пылинок, неровностей на стенках. Дальше они растут вследствие диффузии атомов из окружающей среды: каждый атом «ищет» более удобное место для осаждения, то есть положение с наименьшей поверхностной энергией и максимальным числом молекулярных связей. Рост зерен происходит до их столкновения друг с другом, затем они начинают "высасывать" друг друга. Быстрее всего растут грани с минимальным расстоянием между атомными слоями. Кристалл предпочитает расти по дислокациям (винтовым). Типы технологического роста кристалллов : Рост из раствора за счёт охлаждения/испарения/разницы температур в сосуде Рост за счёт химической реакции в растворе: AC раст + BD раст = АВтв + CD раст Рост из расплава (так растят металлы, полупроводники, оксиды, галогениды) Рост из раствора в расплаве Рост из газовой фазы (обеспечивает высокую чистоту и совершенство структуры) Рост кристаллов
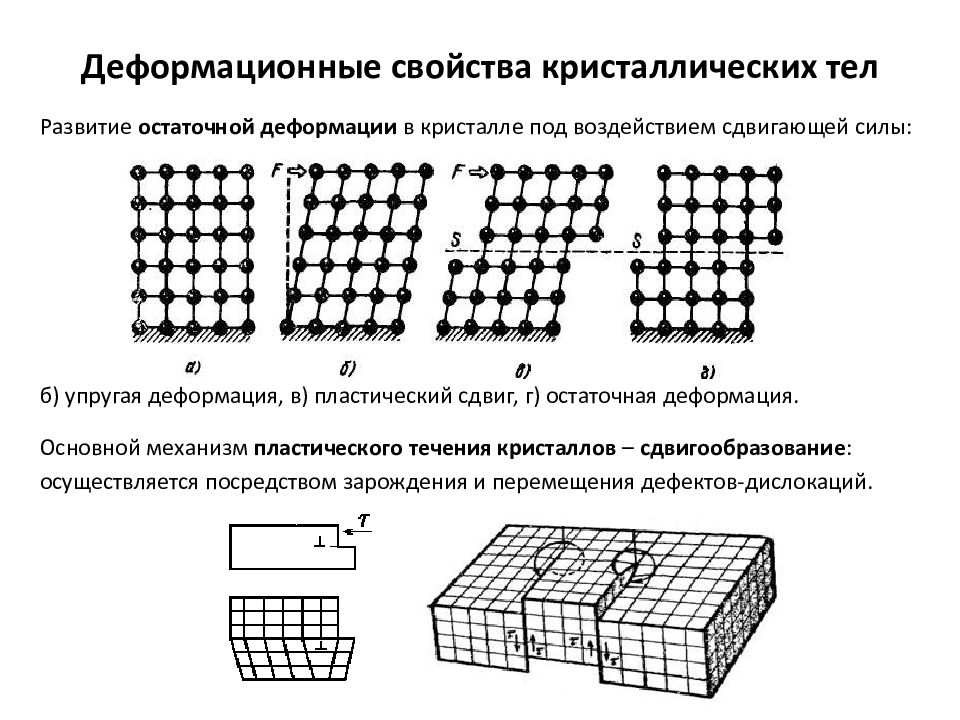
Слайд 18: Деформационные свойства кристаллических тел
Развитие остаточной деформации в кристалле под воздействием сдвигающей силы: б) упругая деформация, в) пластический сдвиг, г) остаточная деформация. Основной механизм пластического течения кристаллов – сдвигообразование : осуществляется посредством зарождения и перемещения дефектов-дислокаций. Деформационные свойства кристаллических тел
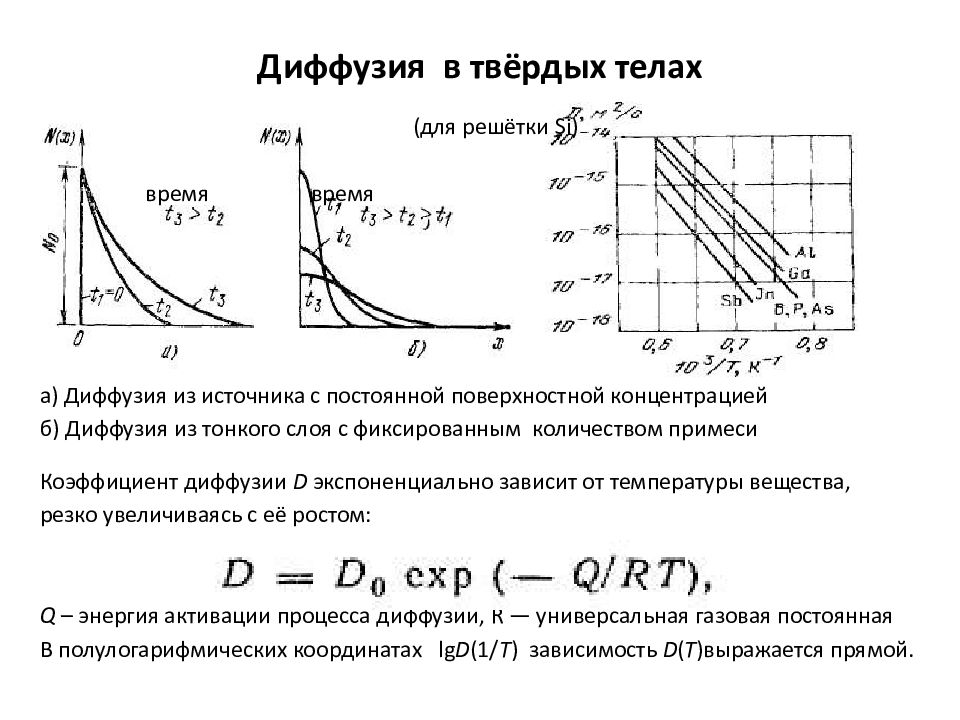
Слайд 19: Диффузия в твёрдых телах
Гетеродиффузия – диффузия чужеродных атомов в кристаллической решётке, может протекать как по вакансиям, так и по междоузлиям. Процесс диффузии описывается двумя законами Фика : 1. Плотность диффузионного потока примеси J пропорциональна градиенту (скорости падения) концентрации примеси ( dN / d x ): D – коэффициент диффузии, константа вещества: равна количеству вещества, проходящего в единицу времени через участок единичной площади при градиенте концентрации, равном единице (т.е. изменение 1 моль/л → 0 моль/л на единицу длины). 2. Скорость изменения концентрации с течением времени ( dN / dt ), зависит от градиента потока частиц ( dJ / dx ): Если D не зависит от x ( вещество однородно ), то: Диффузия в твёрдых телах
Последний слайд презентации: Лекция 1 Структура твёрдых тел Кристаллическая решетка Коэффициенты Миллера: Диффузия в твёрдых телах
( для решётки Si) время время а) Диффузия из источника с постоянной поверхностной концентрацией б) Диффузия из тонкого слоя с фиксированным количеством примеси Коэффициент диффузии D экспоненциально зависит от температуры вещества, резко увеличиваясь с её ростом: Q – энергия активации процесса диффузии, R — универсальная газовая постоянная В полулогарифмических координатах lg D (1/ Т ) зависимость D ( T ) выражается прямой. Диффузия в твёрдых телах