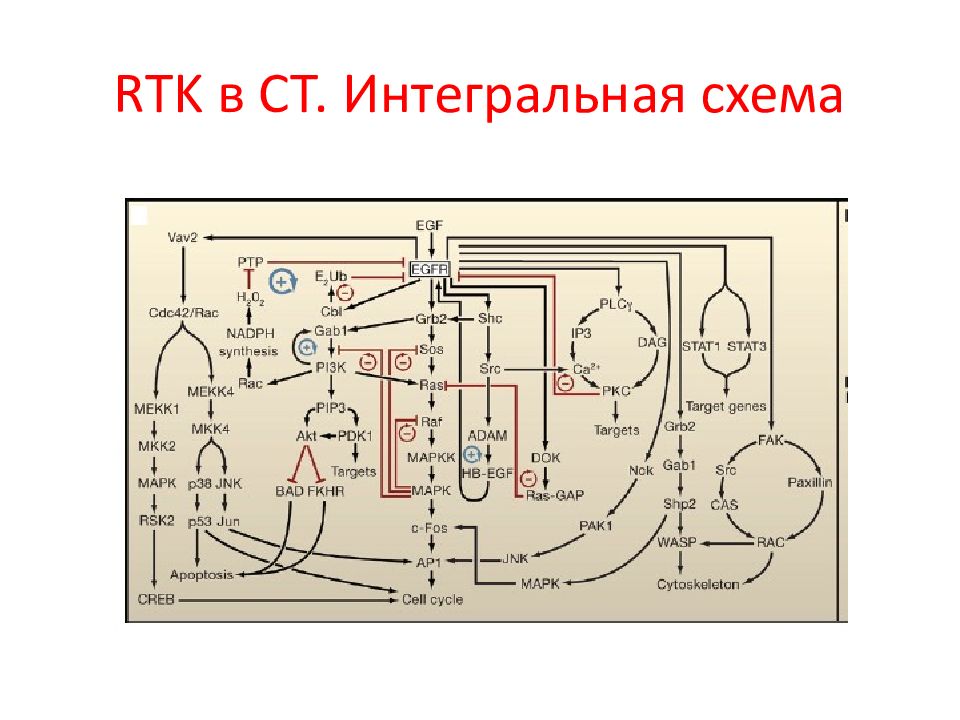
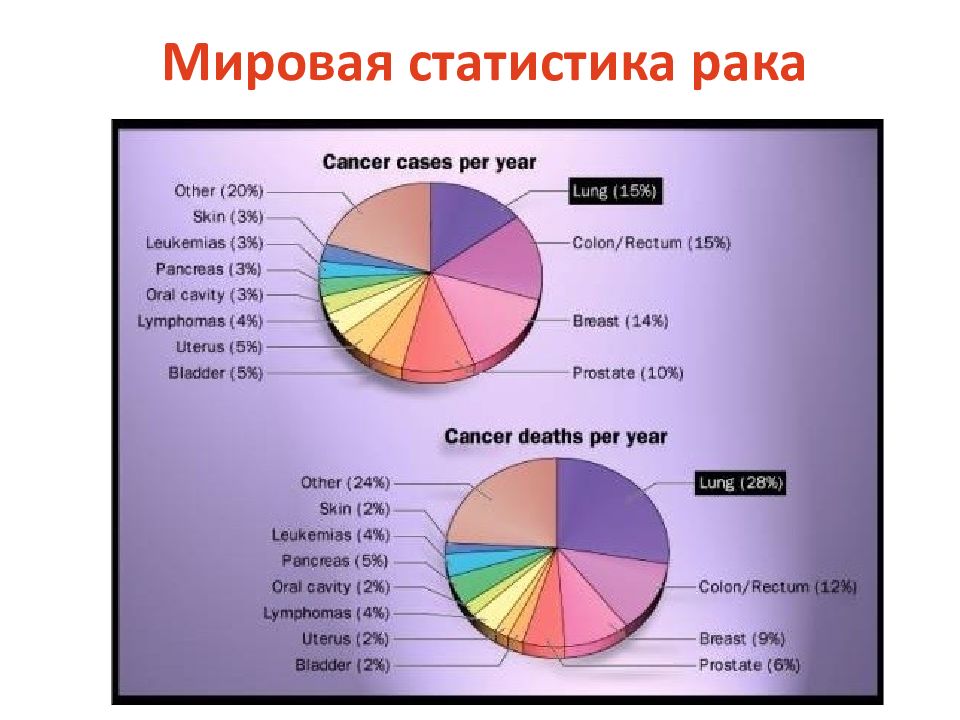
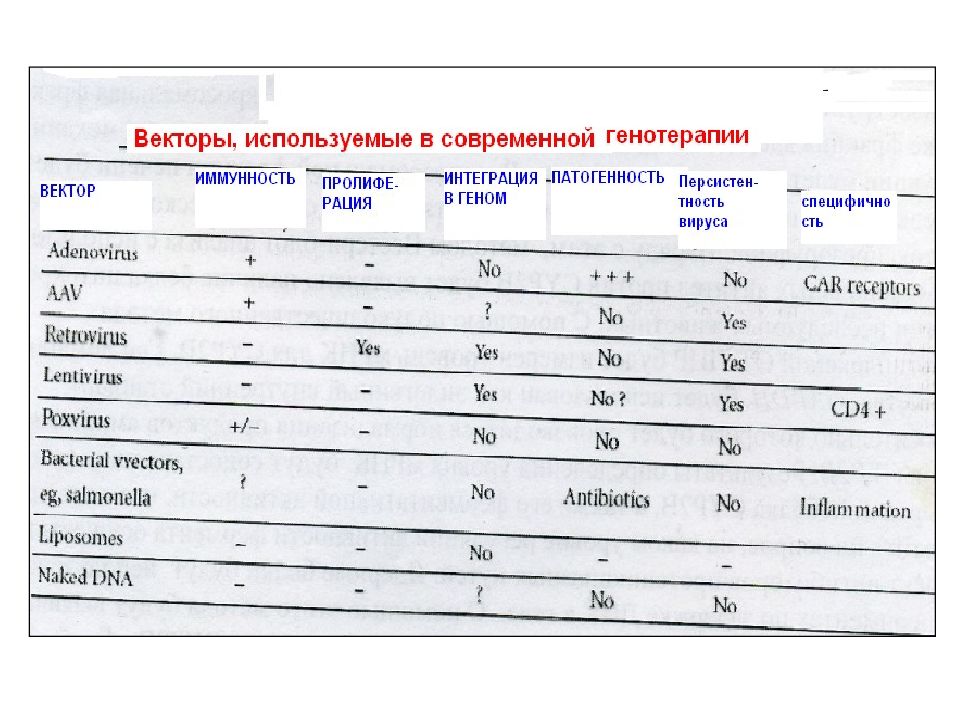
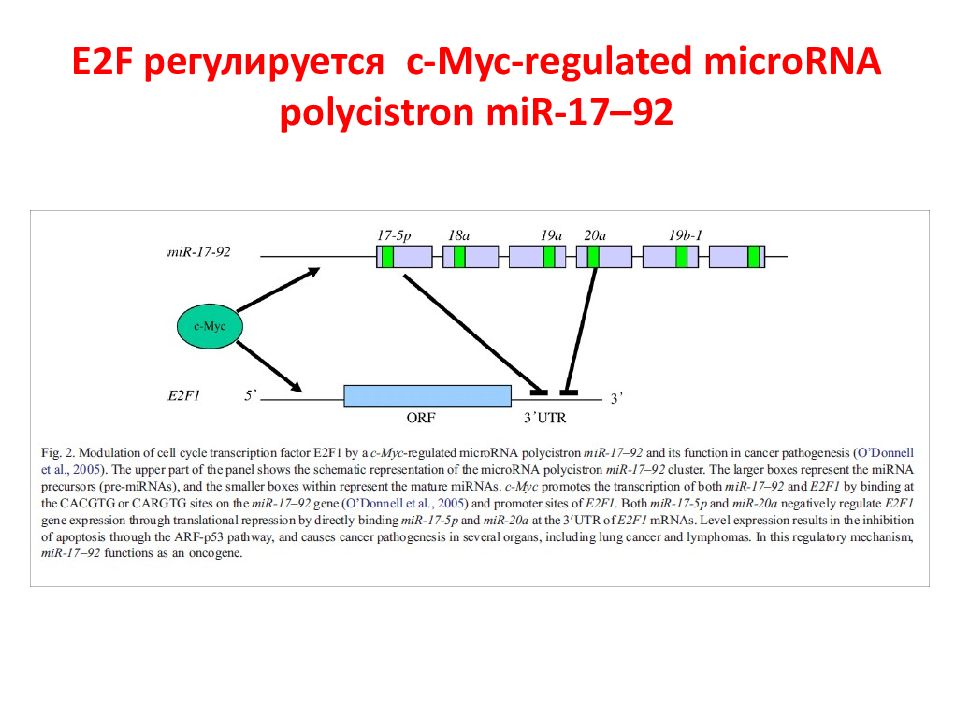
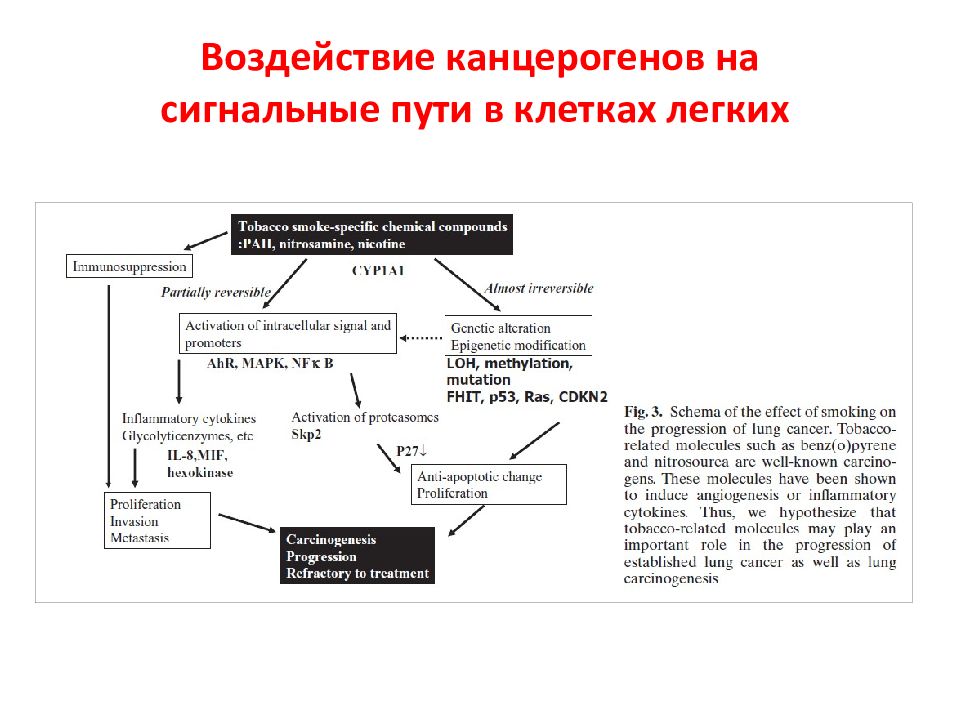
Первый слайд презентации: 5.2.1. Ассоциированные с мембраной белки (на примере RAS и SRC )
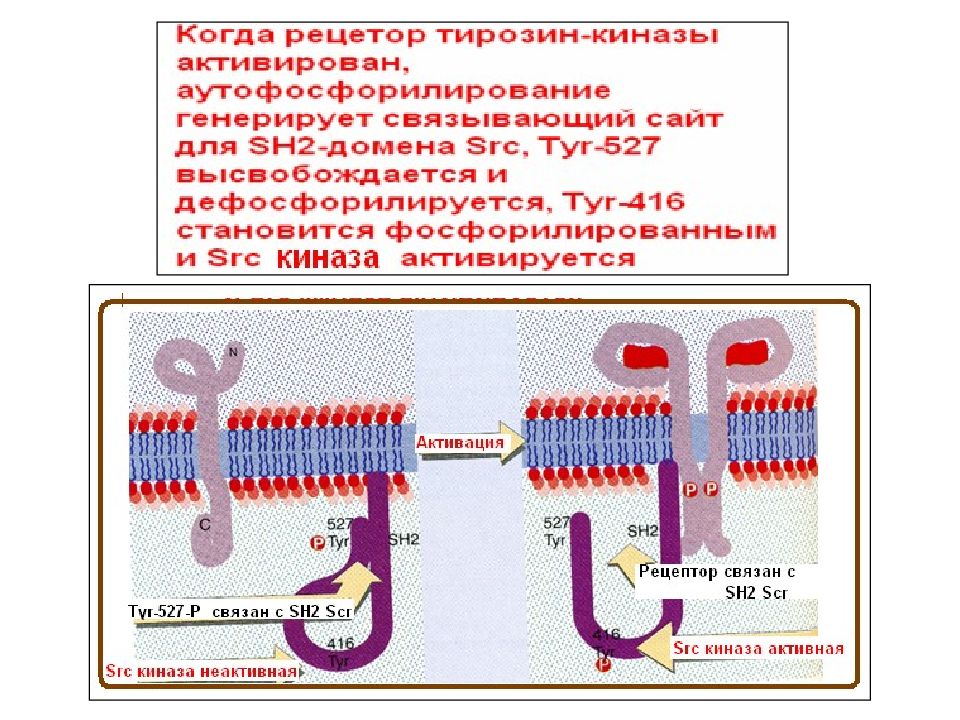
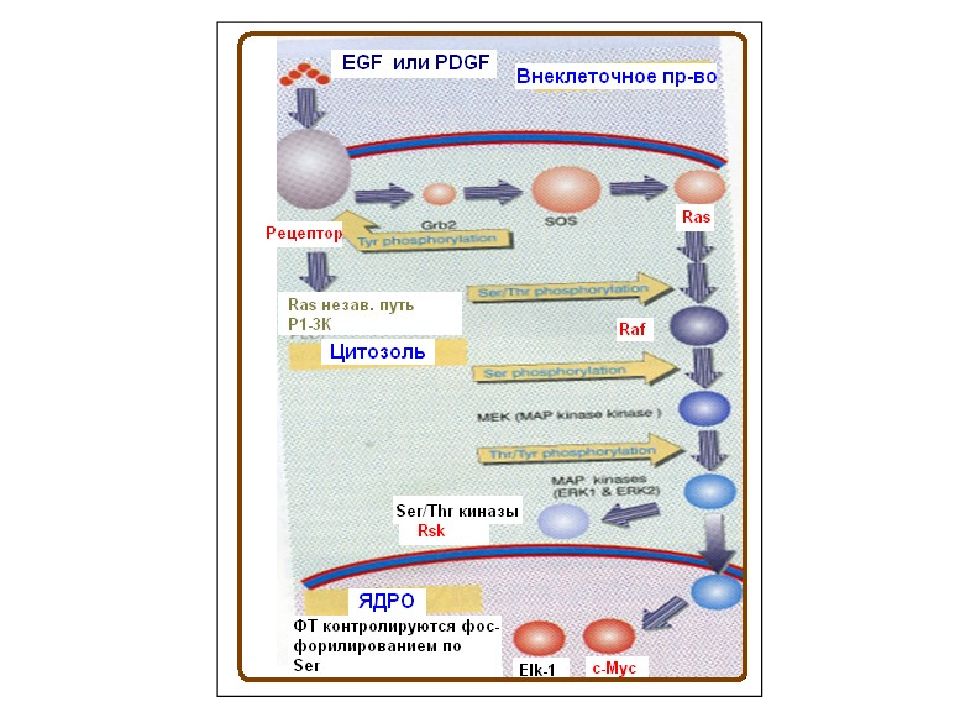
Слайд 2: Фосфорилирование рецептора приводит к двум последствиям:
1. Фосфорилирование усиливает киназную активность рецептора по типу положительной обратной связи. 2. Фосфорилирование тирозиновых остатков в цитоплазматических доменах обеспечивает прохождение сигнала к следующему этапу сигнальной трансдукции. Различают 3 типа белков, с которыми может взаимодействовать активированный рецептор: - Белок может быть мишенью для рецептора, если он сам не фосфорилирован. Мишень может быть также адаптерной молекулой, т.е. сама не обладать каталитической активностью (например, Grb-2) или быть ферментом, который активируется связыванием с рецептором (например, PI-3 киназа). - Белок является субстратом для фермента, который его фосфорилирует. Если субстрат сам является ферментом, то он активируется фосфорилированием (например, c - src, PLCγ ). Иногда субстрат – это киназа, тогда сигнальная трансдукции продолжается каскадом киназ. - Некоторые субстраты могут быть концевыми мишенями, как в случае с цитоскелетными белками, которые фосфорилируются с изменением их биохимических свойств, что сопровождается появлением новых клеточных структур. Этот механизм работает, например, в митозе, когда появляется веретено для разделения хромосом.
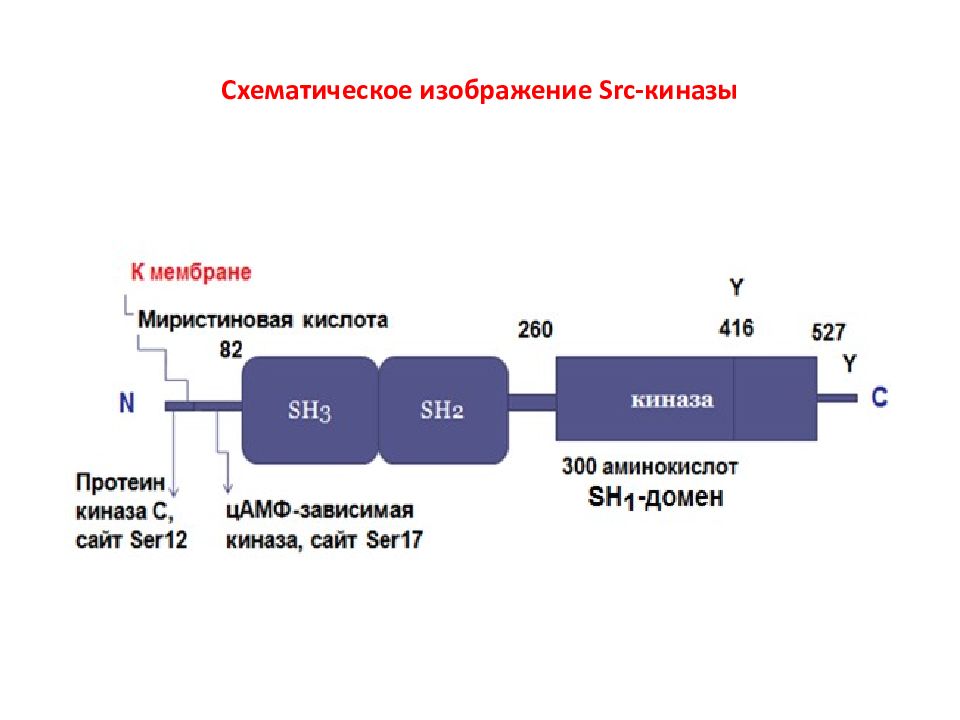
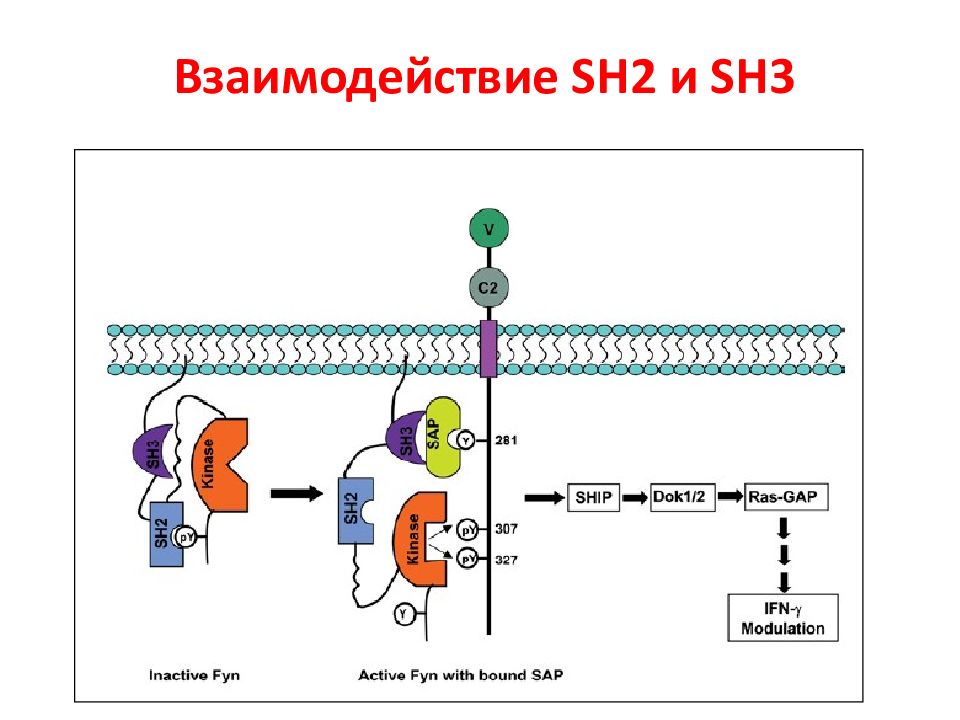
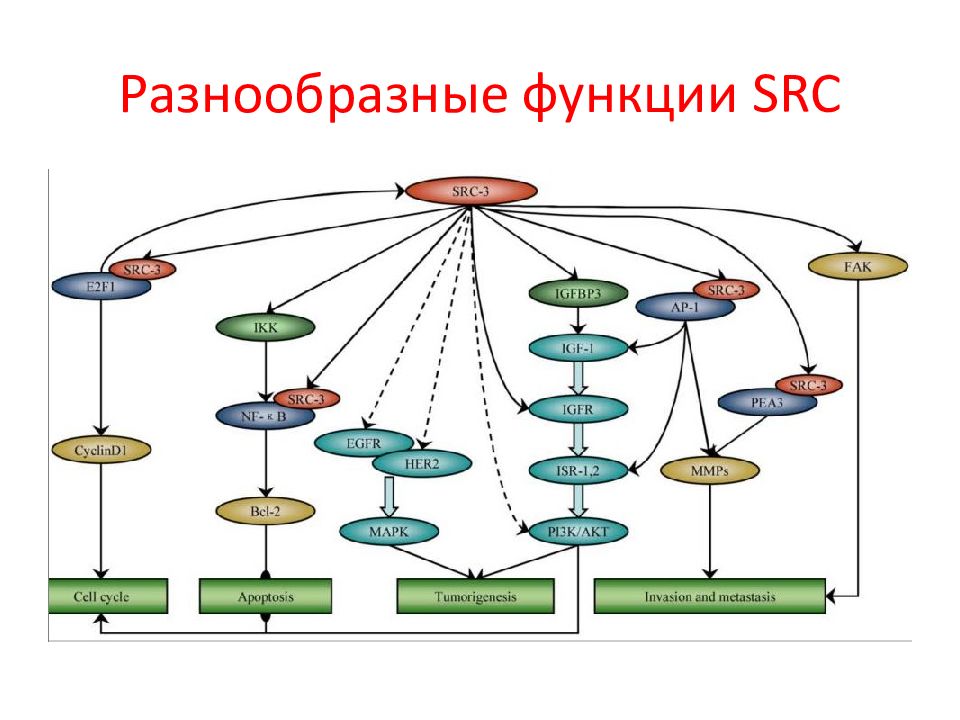
Слайд 3: Семейство Src- киназ
Прототипом семейства Src -киназ является белок c - Src ( pp 60 c - src ), впервые открытый как онкоген. Однако считается, что оригинальным белком этого семейства был его вирусный аналог, открытый Раусом в ранние 1900-ые годы. Раус описал трансформирующий фактор, присутствующий в тканях саркомы цыплят, который индуцировал опухоль у здоровых цыплят после инъекции тканевого гомогената. Этот фактор позднее стал известен как вирус саркомы Рауса, содержащий вирусный онкоген Scr. Клеточный аналог этого онкогена или протоонкоген впервые был охарактеризован Майклом Бишопом и Гарольдом Вармусом, за открытие которого в 1989 г. они получили Нобелевскую премию.
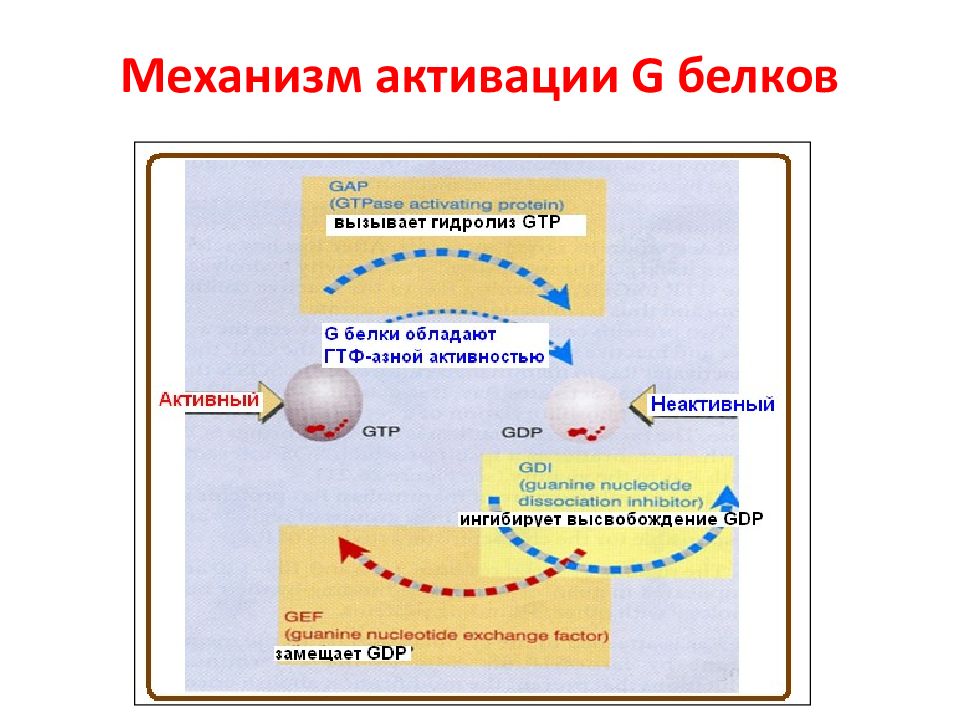
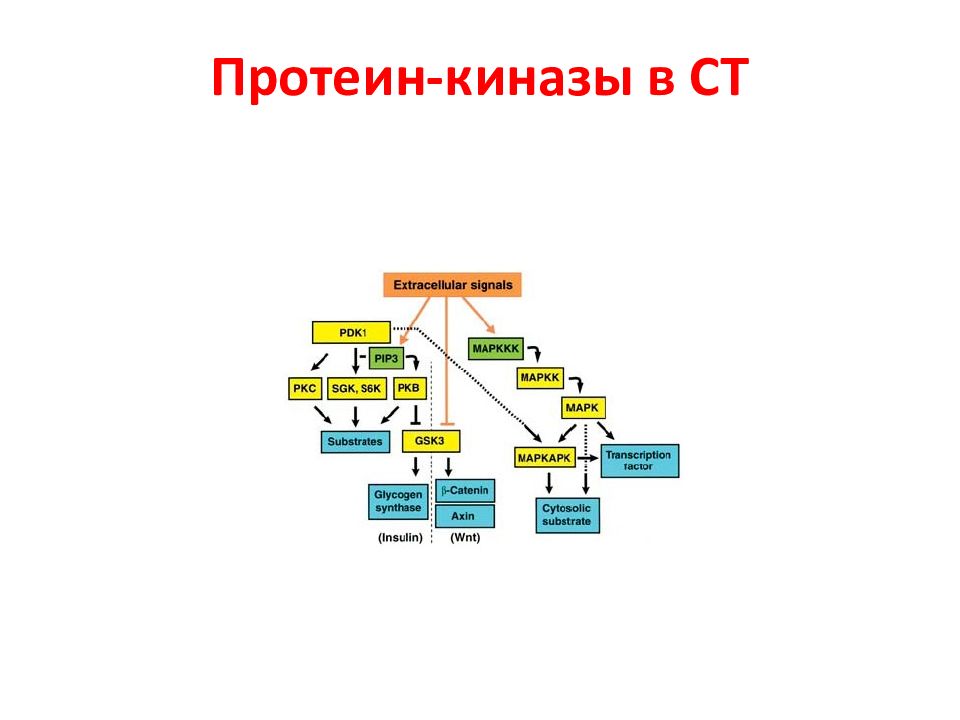
Слайд 9: G -белки в сигнальной трансдукции
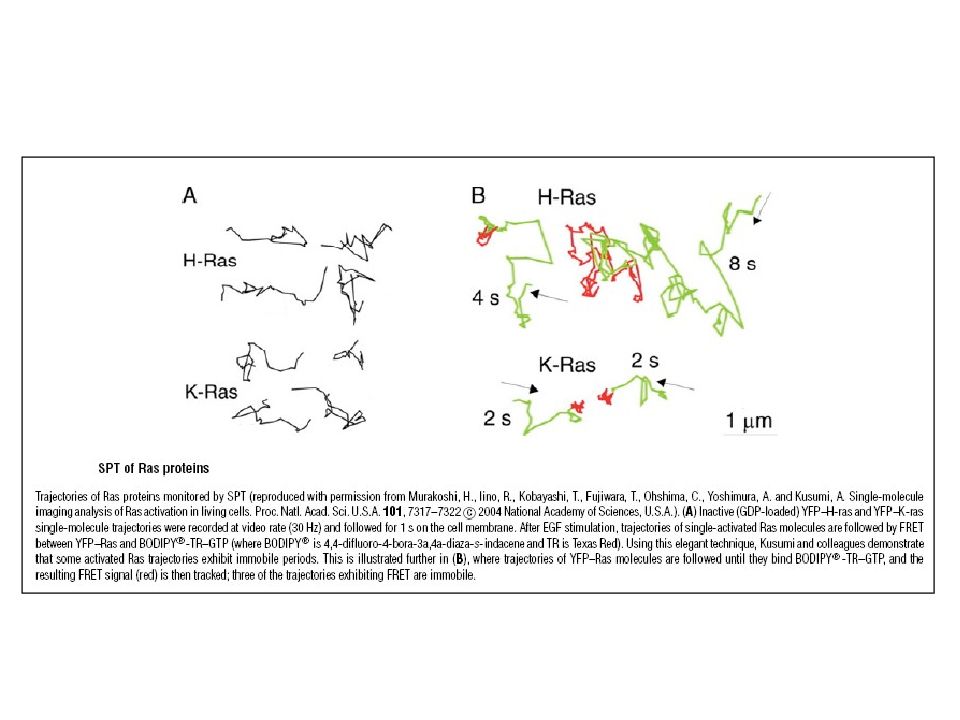
Слайд 10: Семейство белков RAS
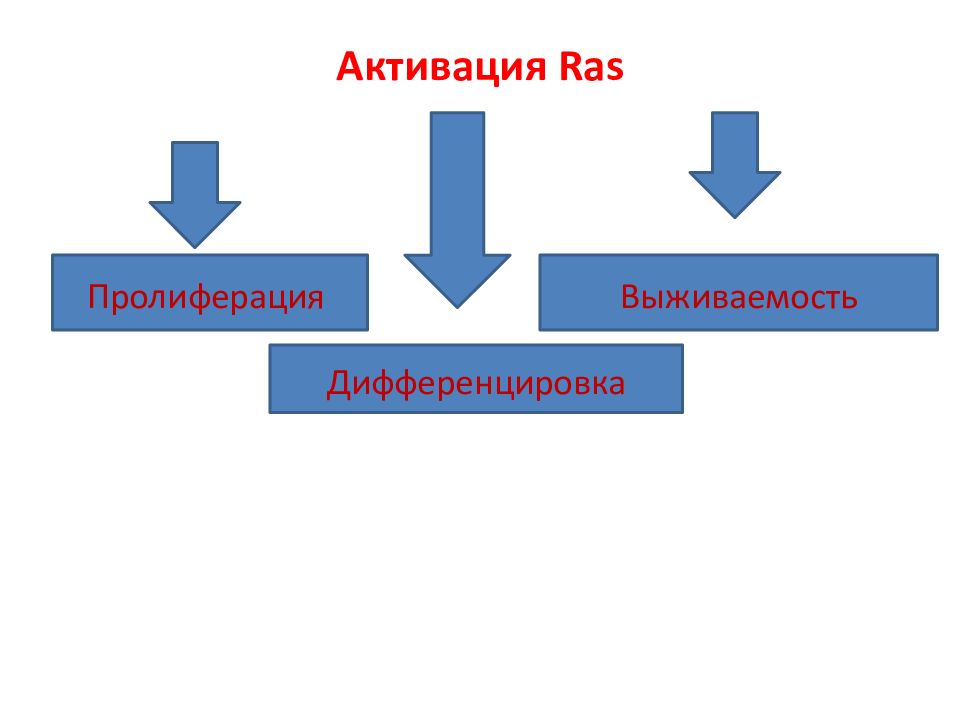
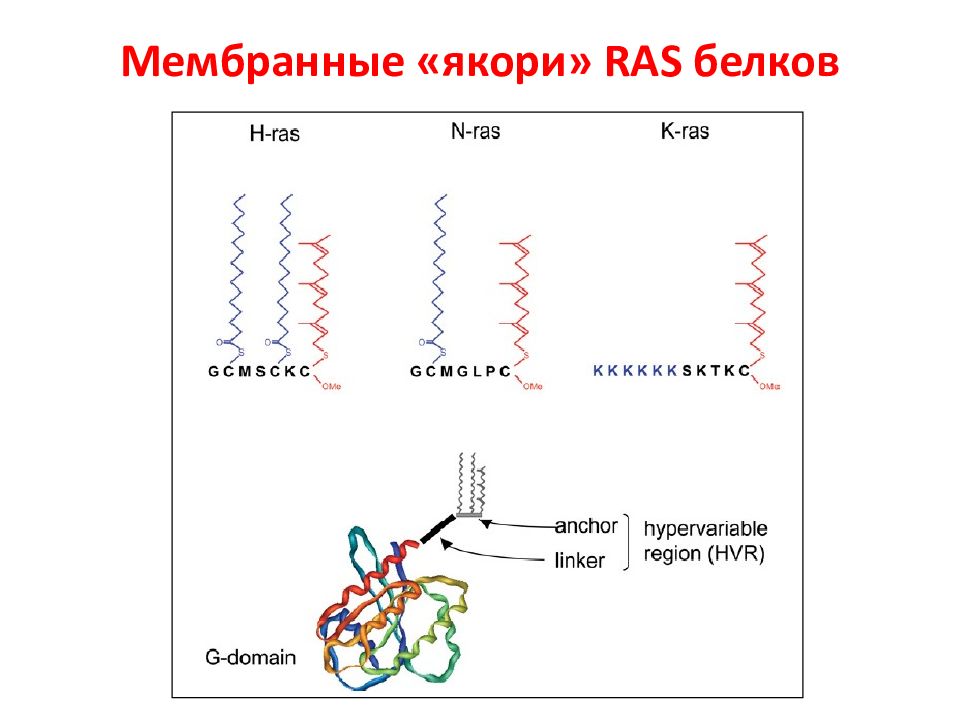
Суперсемейство RAS состоит из нескольких семейств белков: RAS, RHO, RAB, ARF, RAC и RAN. Наиболее изученным из низ являются белки RAS. Геном млекопитающих содержит 3 гена RAS, кодирующих небольшие ГТФ-азные белки молекулярной массой 21 kDa, обозначаемые как H - RAS ( Harvey - RAS ), N - RAS ( neuroblastoma - RAS ) и K - RAS ( Kristen -RAS), последний имеет две изоформы K - RAS 4 A и K - RAS 4 B, образуемые через альтернативный сплайсинг. KRAS 4 A слабо экспрессируется в клетках человека, в отличие от KRAS 4 B, который является доминантной формой. Кроме того, в геноме млекопитающих было идентифицировано более чем 150 RAS -подобных гена. Белки этого семейства также регулируют многие физиологические процессы, пролиферацию, дифференцировку и выживание клетки.
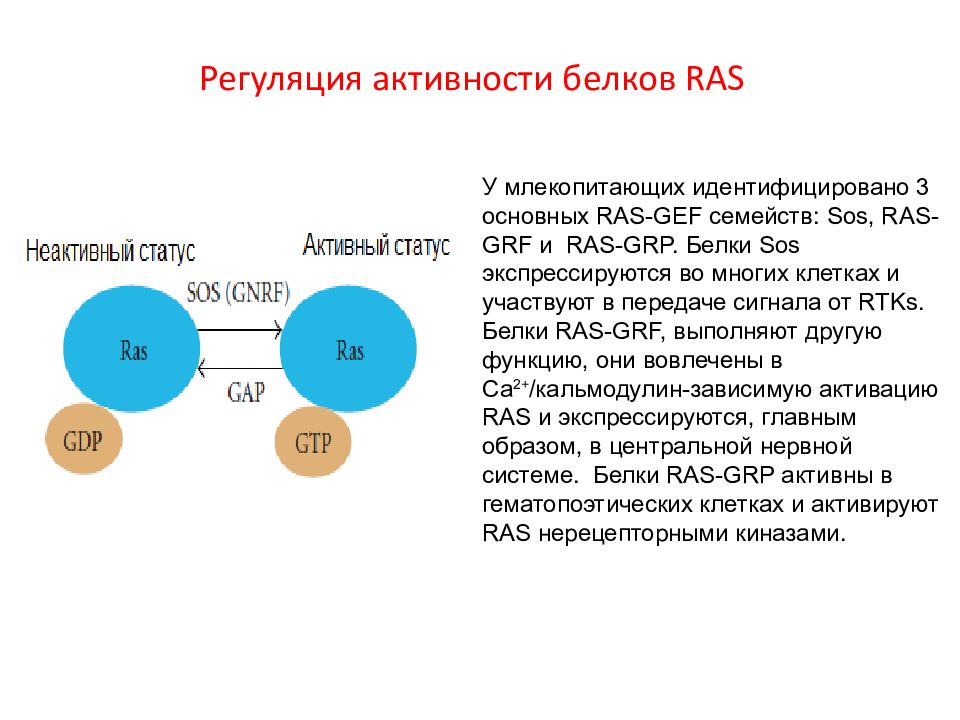
Слайд 12: Регуляция активности белков RAS
У млекопитающих идентифицировано 3 основных RAS - GEF семейств: Sos, RAS - GRF и RAS - GRP. Белки Sos экспрессируются во многих клетках и участвуют в передаче сигнала от RTKs. Белки RAS - GRF, выполняют другую функцию, они вовлечены в Са 2+ /кальмодулин-зависимую активацию RAS и экспрессируются, главным образом, в центральной нервной системе. Белки RAS - GRP активны в гематопоэтических клетках и активируют RAS нерецепторными киназами.
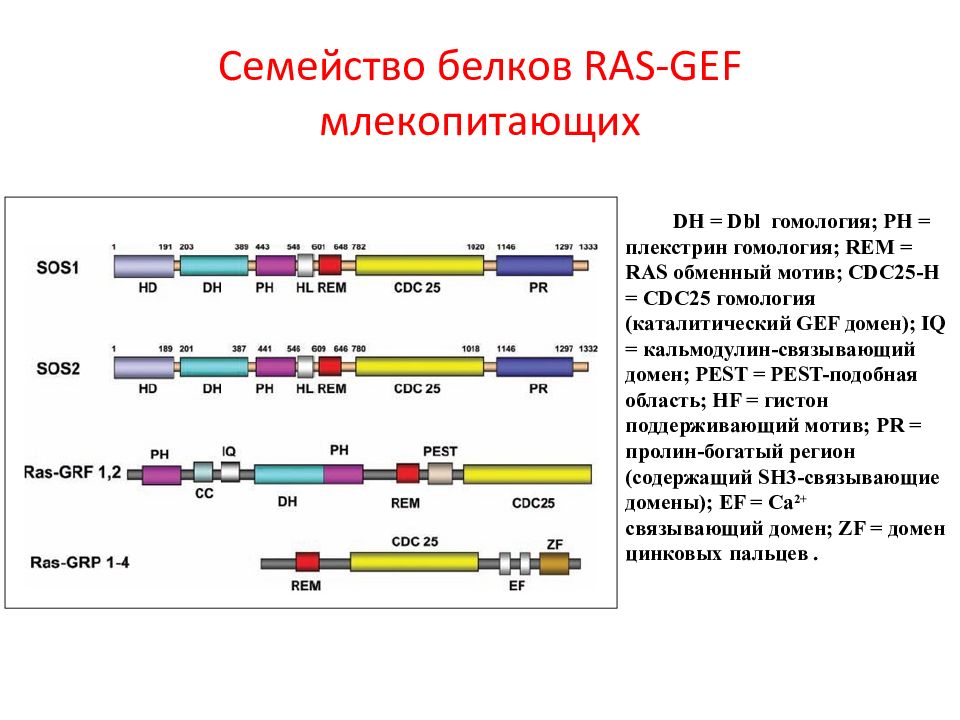
Слайд 13: Семейство белков RAS - GEF млекопитающих
DH = Dbl гомология; PH = плекстрин гомология; REM = RAS обменный мотив; CDC 25- H = CDC 25 гомология (каталитический GEF домен); IQ = кальмодулин-связывающий домен; PEST = PEST -подобная область; HF = гистон поддерживающий мотив; PR = пролин-богатый регион (содержащий SH 3-связывающие домены); EF = Ca 2+ связывающий домен; ZF = домен цинковых пальцев.
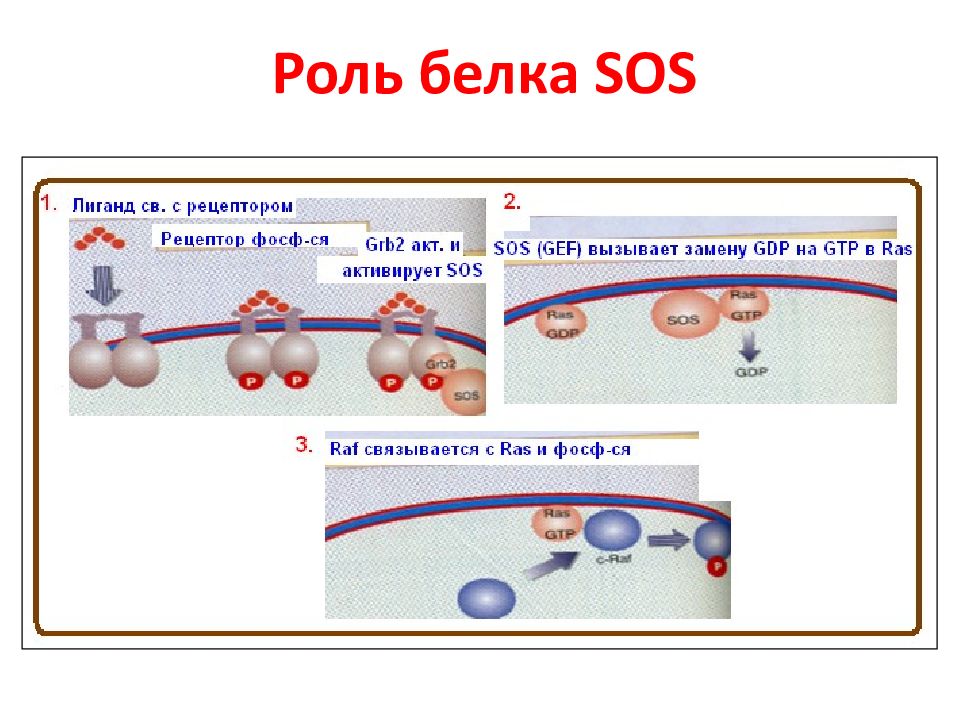
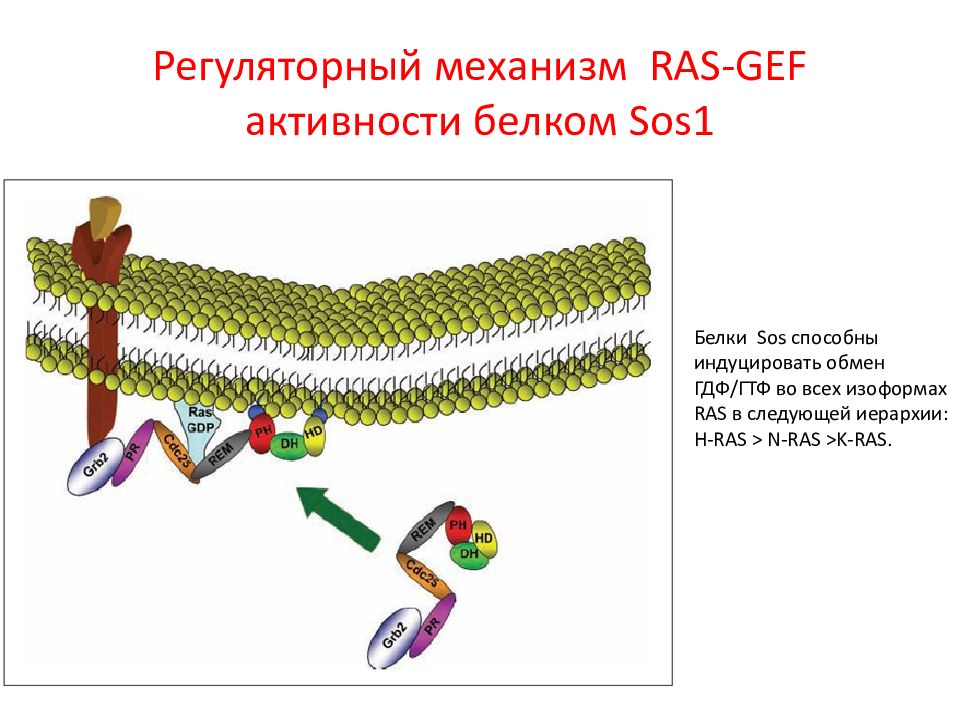
Слайд 15: Регуляторный механизм RAS - GEF активности белком Sos 1
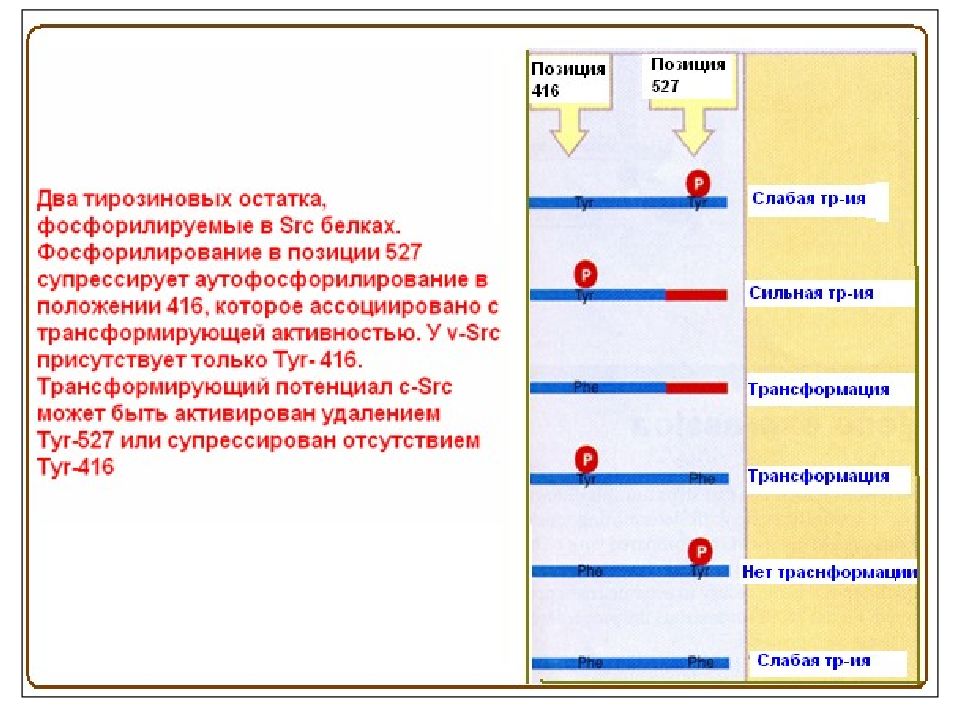
Белки Sos способны индуцировать обмен ГДФ/ГТФ во всех изоформах RAS в следующей иерархии: H - RAS > N - RAS >K-RAS.
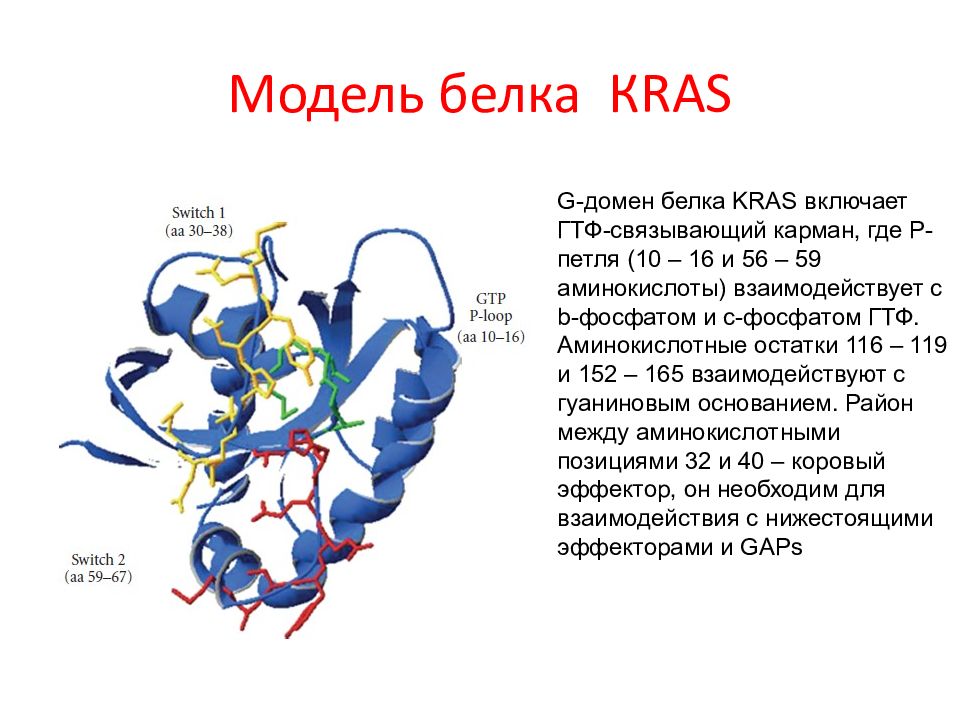
Слайд 17: Модель белка КRAS
G -домен белка KRAS включает ГТФ-связывающий карман, где Р-петля (10 – 16 и 56 – 59 аминокислоты) взаимодействует с b -фосфатом и c -фосфатом ГТФ. Аминокислотные остатки 116 – 119 и 152 – 165 взаимодействуют с гуаниновым основанием. Район между аминокислотными позициями 32 и 40 – коровый эффектор, он необходим для взаимодействия с нижестоящими эффекторами и GAPs
Слайд 18
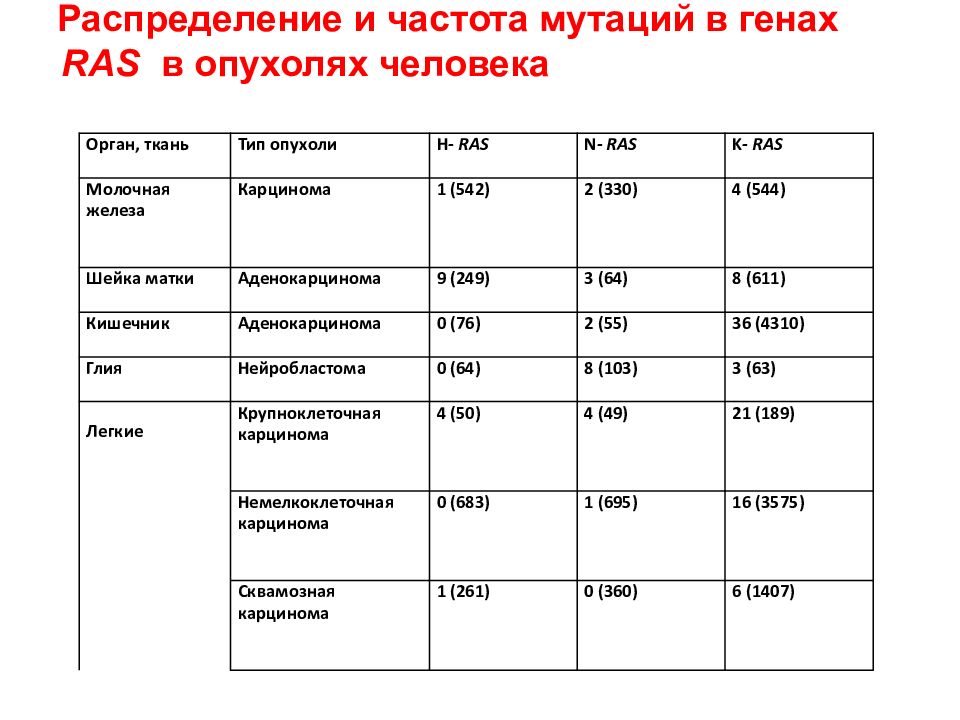
Орган, ткань Тип опухоли H - RAS N - RAS K - RAS Молочная железа Карцинома 1 (542) 2 (330) 4 (544) Шейка матки Аденокарцинома 9 (249 ) 3 (64) 8 (611) Кишечник Аденокарцинома 0 (76) 2 (55) 36 (4310) Глия Нейробластома 0 (64) 8 (103) 3 (63) Легкие Крупноклеточная карцинома 4 (50) 4 (49) 21 (189) Немелкоклеточная карцинома 0 (683) 1 (695) 16 (3575) Сквамозная карцинома 1 (261) 0 (360) 6 (1407) Распределение и частота мутаций в генах RAS в опухолях человека
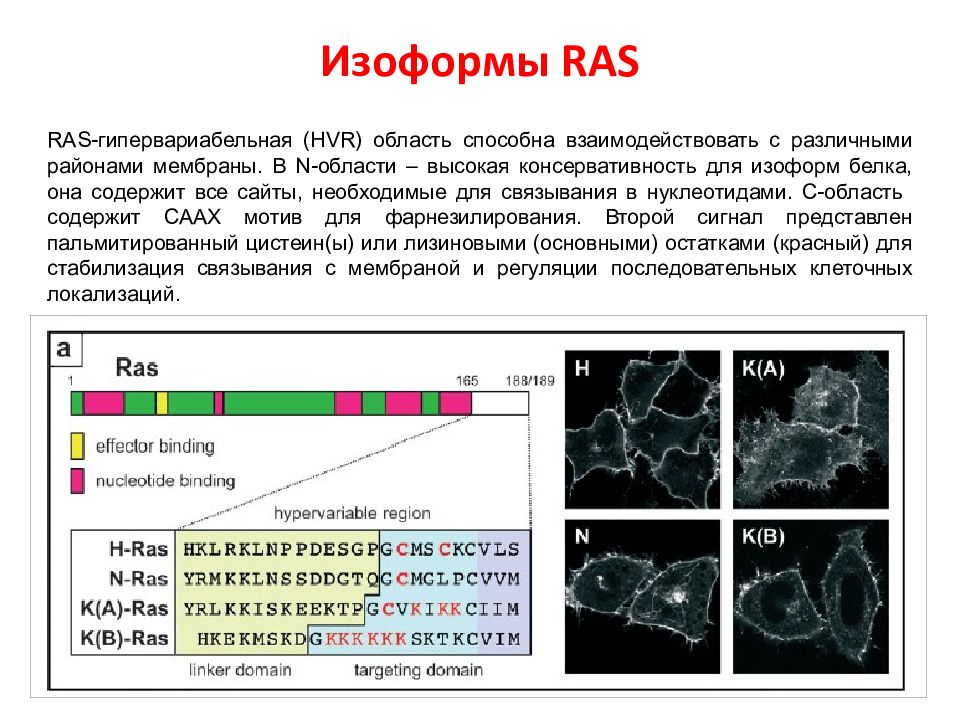
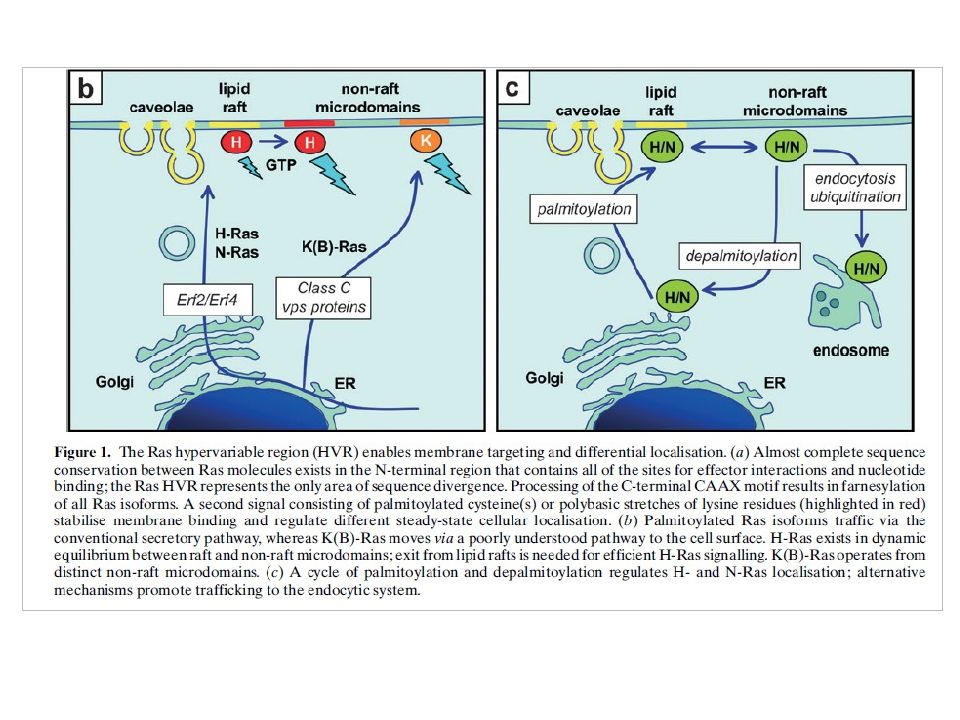
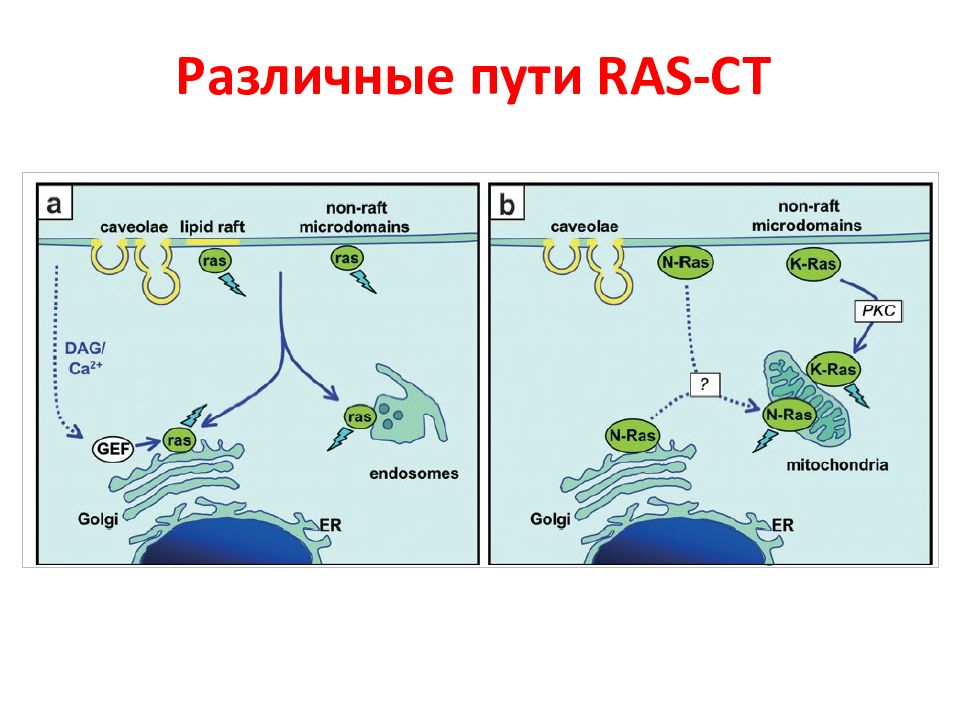
Слайд 20: Изоформы RAS
RAS -гипервариабельная ( HVR ) область способна взаимодействовать с различными районами мембраны. В N-области – высокая консервативность для изоформ белка, она содержит все сайты, необходимые для связывания в нуклеотидами. C -область содержит СААХ мотив для фарнезилирования. Второй сигнал представлен пальмитированный цистеин(ы) или лизиновыми (основными) остатками (красный) для стабилизация связывания с мембраной и регуляции последовательных клеточных локализаций.
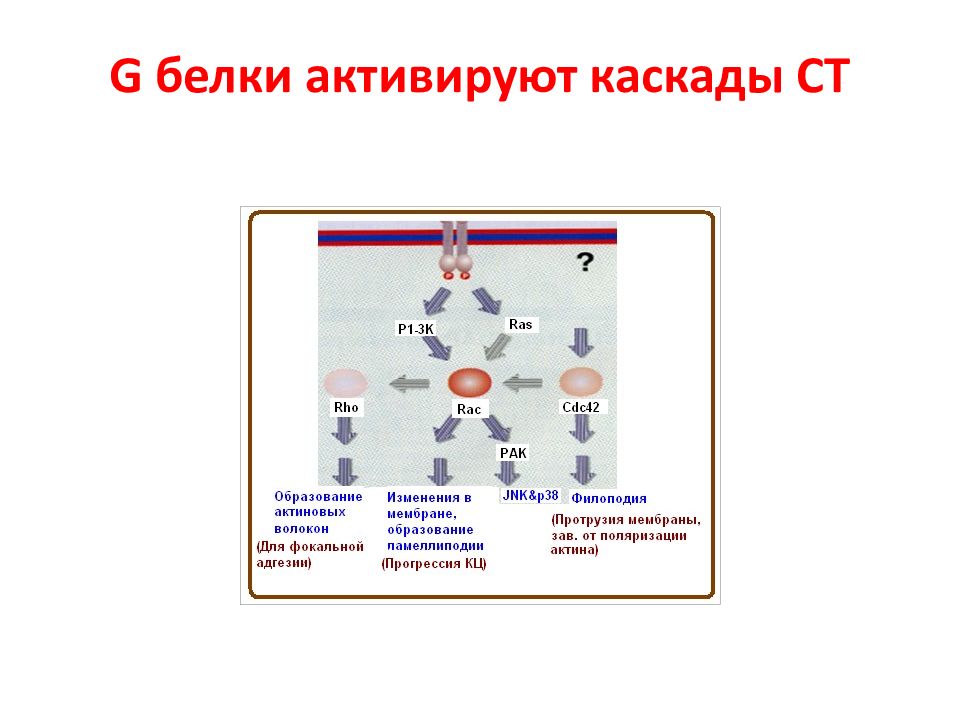
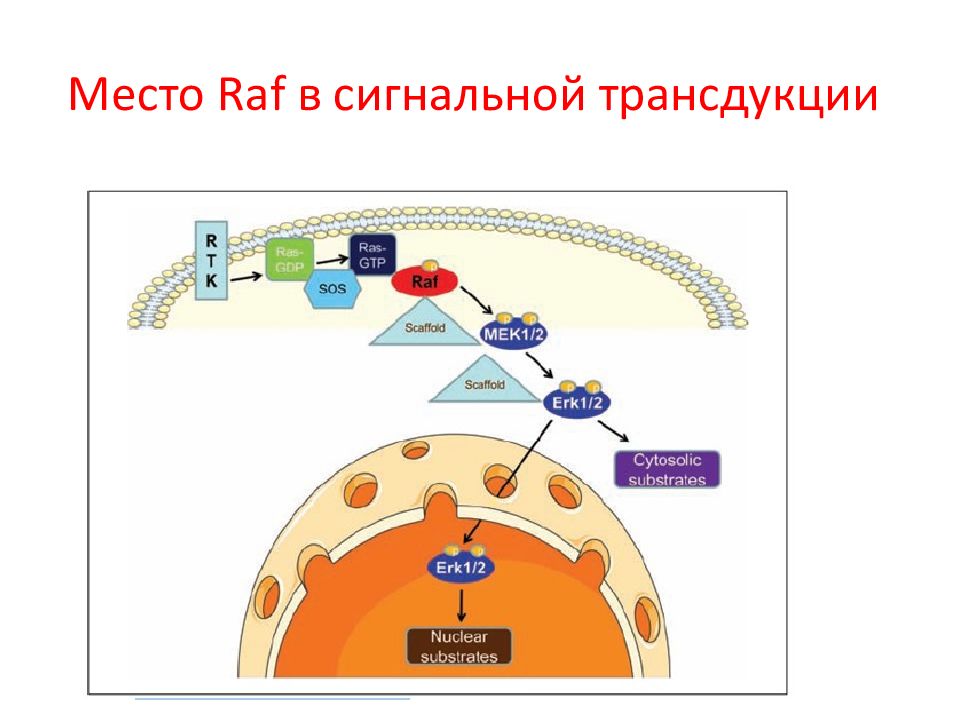
Слайд 25: G белки активируют каскады СТ
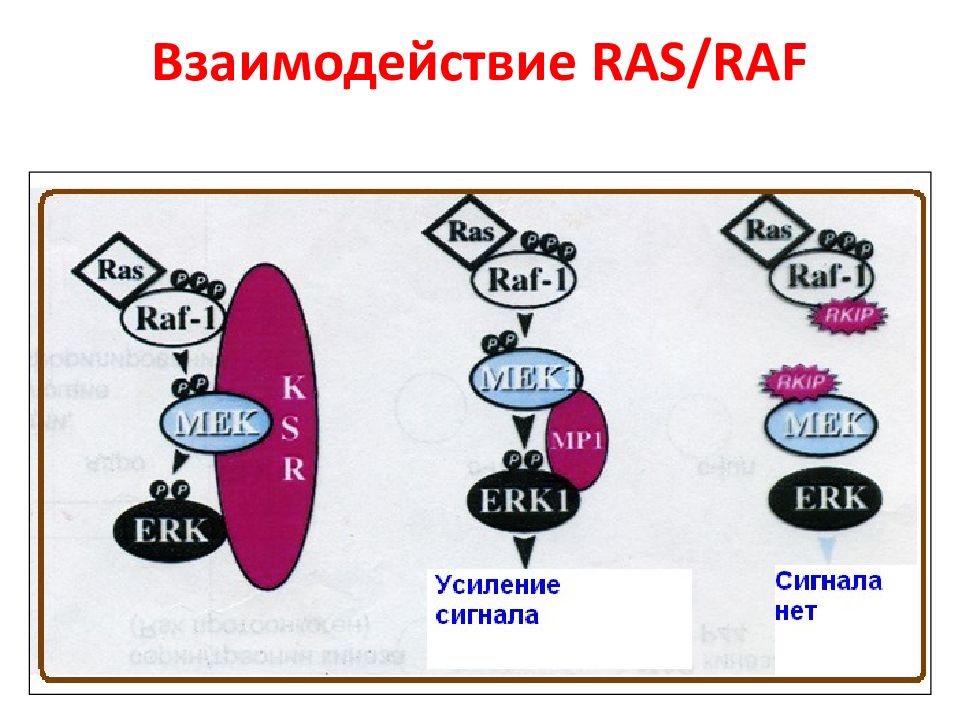
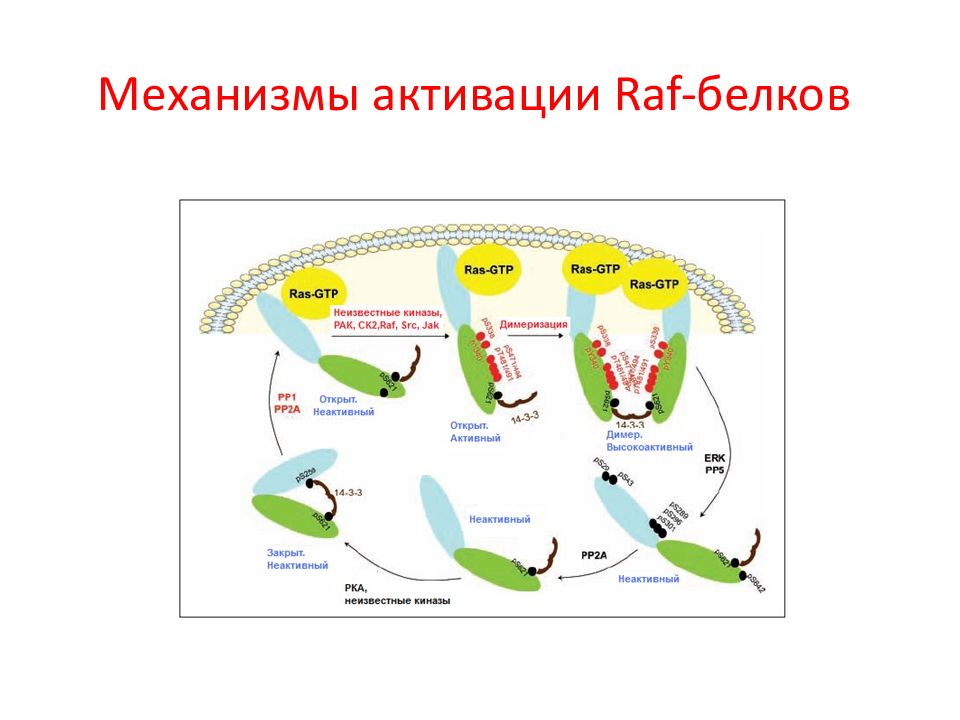
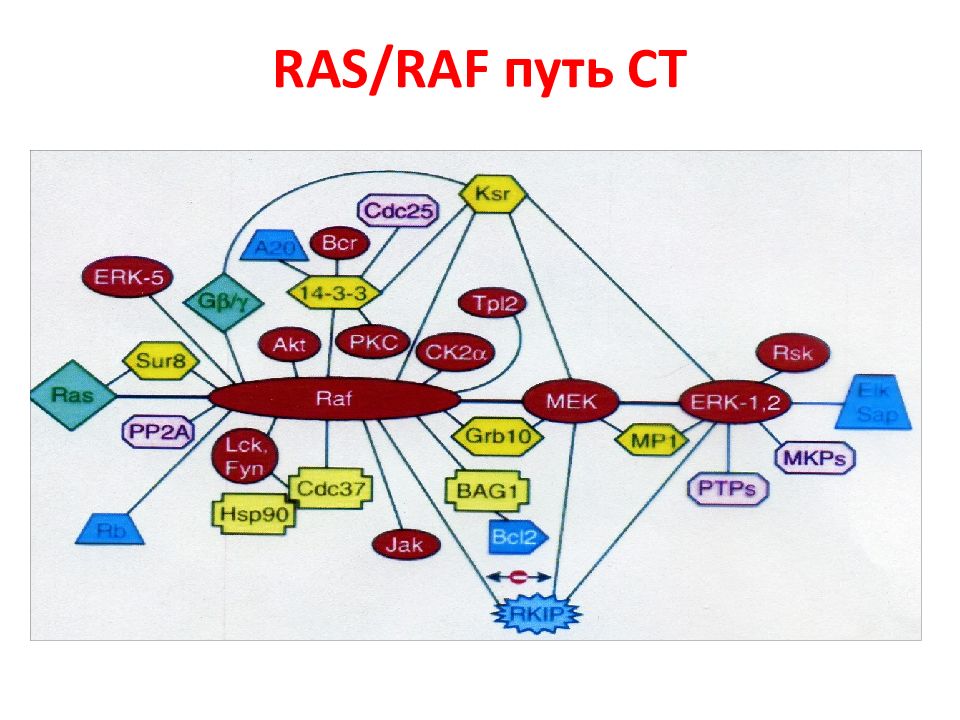
Слайд 30: Семейство белков Raf
Белки Raf были идентифицированы как прямые активаторы белков MEK и эффекторы Ras. Таким образом, стало ясно, что Raf являются основным связывающим звеном между Ras - и MEK - ERK -сигнальными участками. Интересно, что у дрожжей нет Raf-киназы, а филогенетически древняя изоформа этого белка B - Raf появилась у позвоночных. У млекопитающих выявлено 3 изоформы Raf: Raf -1, B - Raf и A - Raf, которые имеют общую консервативную область ( CR ), но проявляют разные свойства. В свою очередь, C R область состоит из 3-х участков: CR1, CR2, CR3.
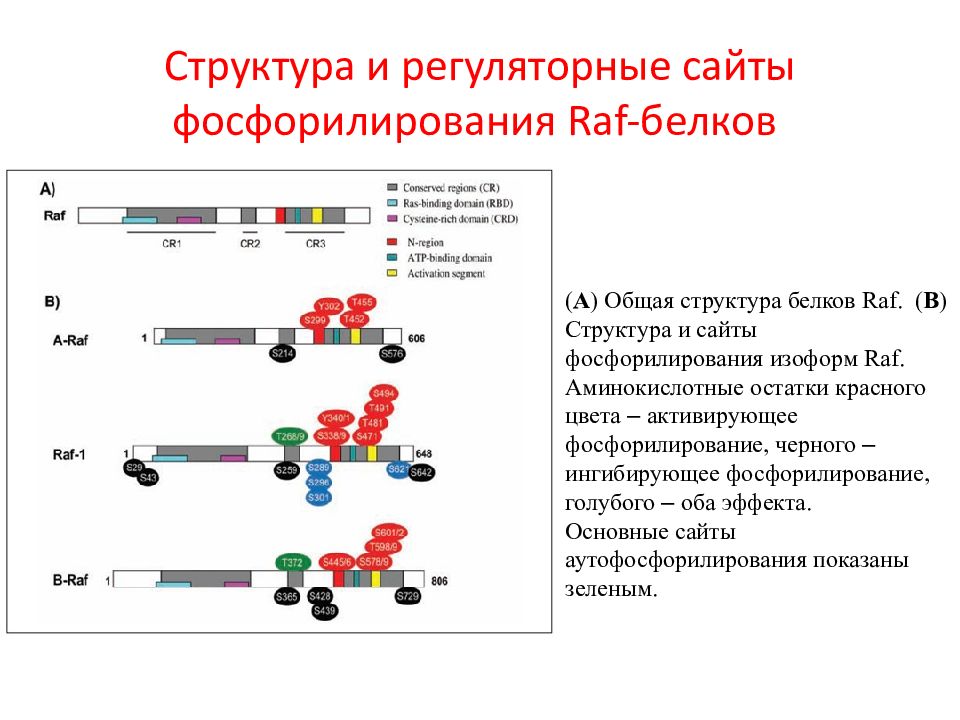
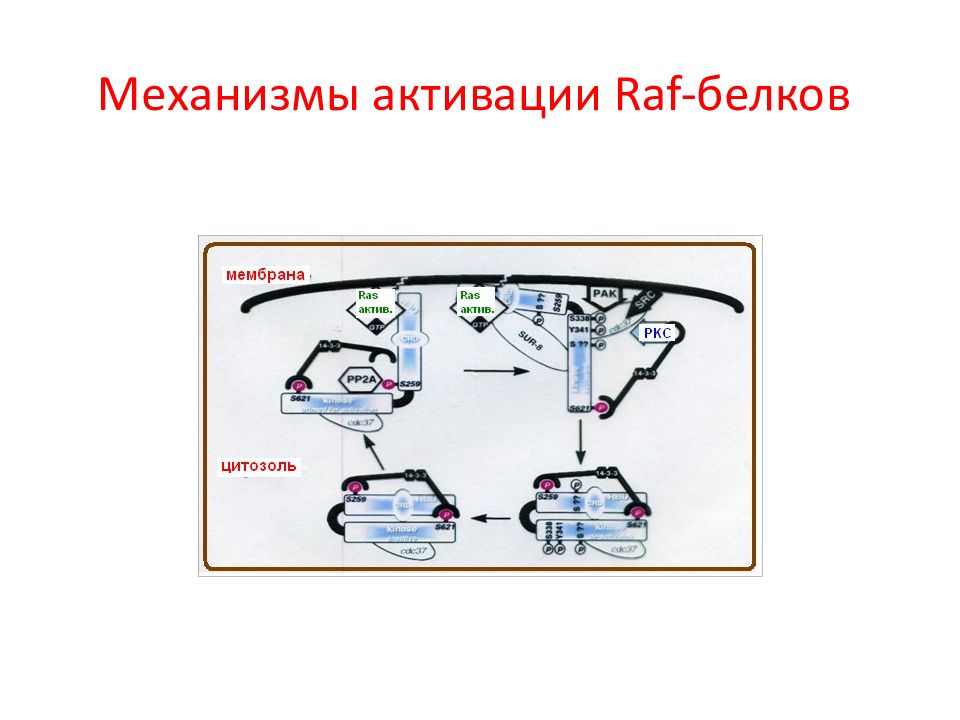
Слайд 31: Структура и регуляторные сайты фосфорилирования Raf-белков
( A ) Общая структура белков Raf. ( B ) Структура и сайты фосфорилирования изоформ Raf. Аминокислотные остатки красного цвета – активирующее фосфорилирование, черного – ингибирующее фосфорилирование, голубого – оба эффекта. Основные сайты аутофосфорилирования показаны зеленым.
Слайд 37
BRAF Copyright © Elsevier Ireland Ltd Terms and Conditions BRAF inhibitors: From the laboratory to clinical trials M.A. Rahman, A. Salajegheh, R.A. Smith and A.K.-Y. Lam Critical Reviews in Oncology/Hematology DOI: 10.1016/j.critrevonc.2013.12.008
Слайд 38
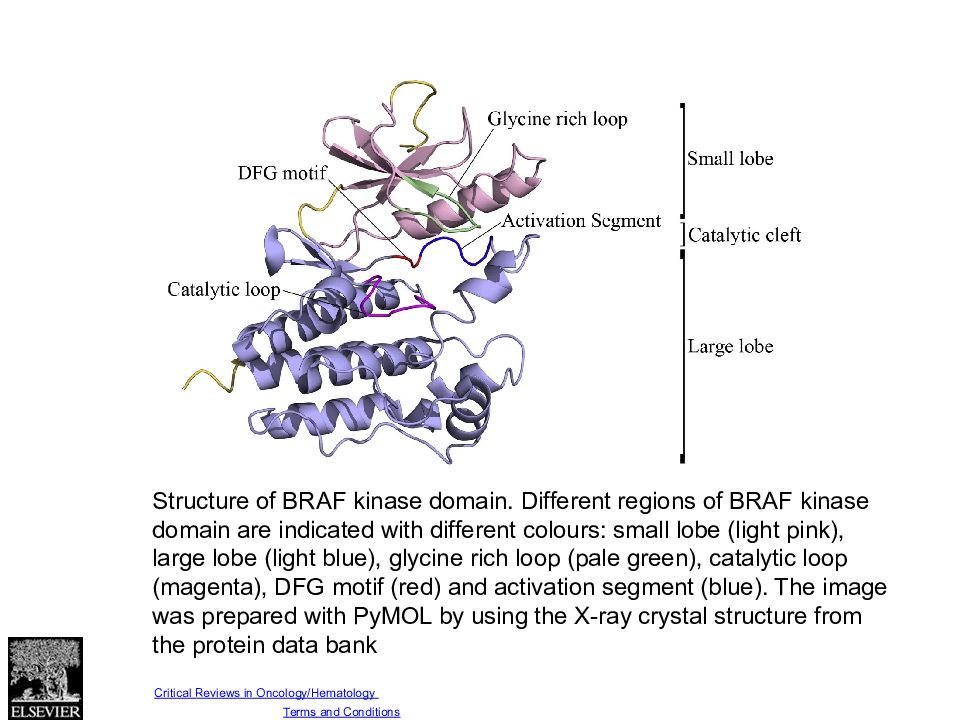
Fig. 1 Source: Critical Reviews in Oncology/Hematology (DOI:10.1016/j.critrevonc.2013.12.008 ) Copyright © Elsevier Ireland Ltd Terms and Conditions Structure of BRAF kinase domain. Different regions of BRAF kinase domain are indicated with different colours: small lobe (light pink), large lobe (light blue), glycine rich loop (pale green), catalytic loop (magenta), DFG motif (red) and activation segment (blue). The image was prepared with PyMOL by using the X-ray crystal structure from the protein data bank
Слайд 39
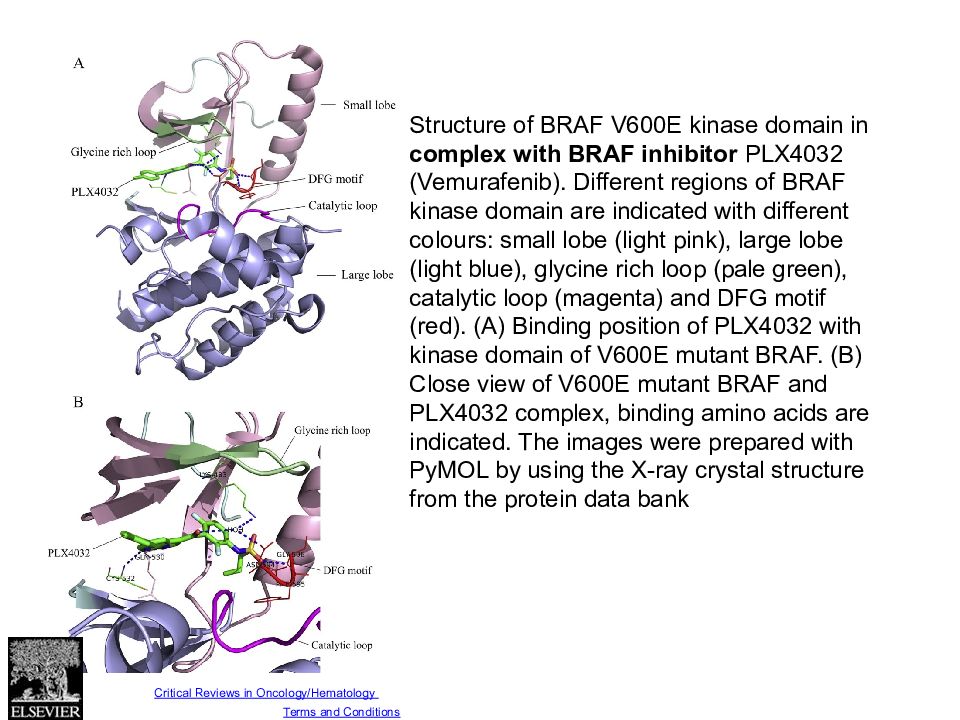
Fig. 2 Source: Critical Reviews in Oncology/Hematology (DOI:10.1016/j.critrevonc.2013.12.008 ) Copyright © Elsevier Ireland Ltd Terms and Conditions Structure of BRAF V600E kinase domain in complex with BRAF inhibitor PLX4032 (Vemurafenib). Different regions of BRAF kinase domain are indicated with different colours: small lobe (light pink), large lobe (light blue), glycine rich loop (pale green), catalytic loop (magenta) and DFG motif (red). (A) Binding position of PLX4032 with kinase domain of V600E mutant BRAF. (B) Close view of V600E mutant BRAF and PLX4032 complex, binding amino acids are indicated. The images were prepared with PyMOL by using the X-ray crystal structure from the protein data bank
Слайд 40
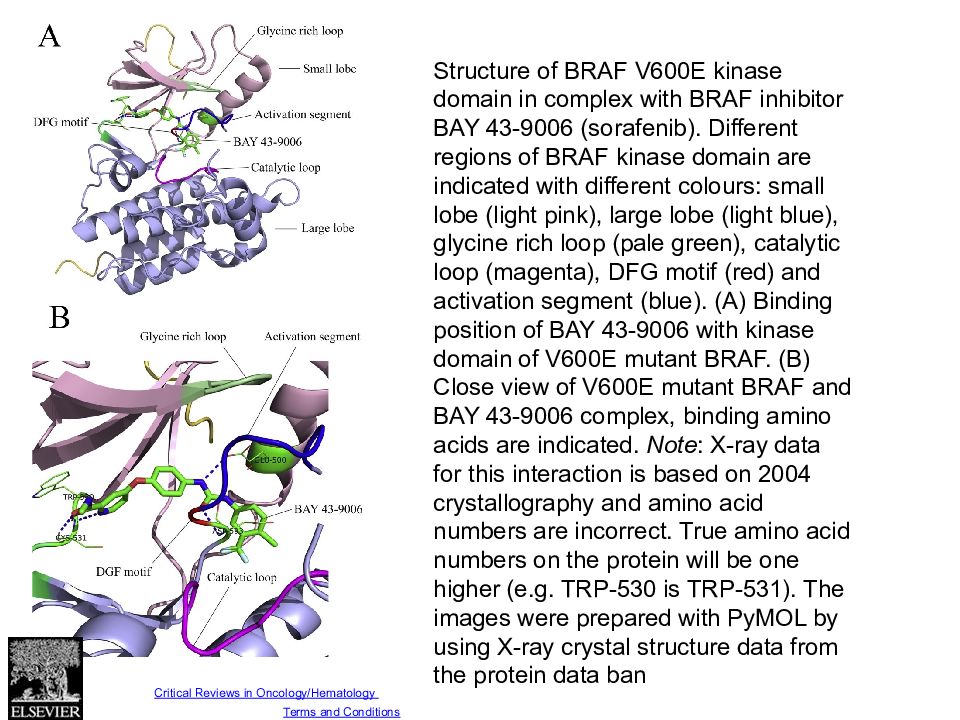
Fig. 3 Source: Critical Reviews in Oncology/Hematology (DOI:10.1016/j.critrevonc.2013.12.008 ) Copyright © Elsevier Ireland Ltd Terms and Conditions Structure of BRAF V600E kinase domain in complex with BRAF inhibitor BAY 43-9006 (sorafenib). Different regions of BRAF kinase domain are indicated with different colours: small lobe (light pink), large lobe (light blue), glycine rich loop (pale green), catalytic loop (magenta), DFG motif (red) and activation segment (blue). (A) Binding position of BAY 43-9006 with kinase domain of V600E mutant BRAF. (B) Close view of V600E mutant BRAF and BAY 43-9006 complex, binding amino acids are indicated. Note : X-ray data for this interaction is based on 2004 crystallography and amino acid numbers are incorrect. True amino acid numbers on the protein will be one higher (e.g. TRP-530 is TRP-531). The images were prepared with PyMOL by using X-ray crystal structure data from the protein data ban
Слайд 42
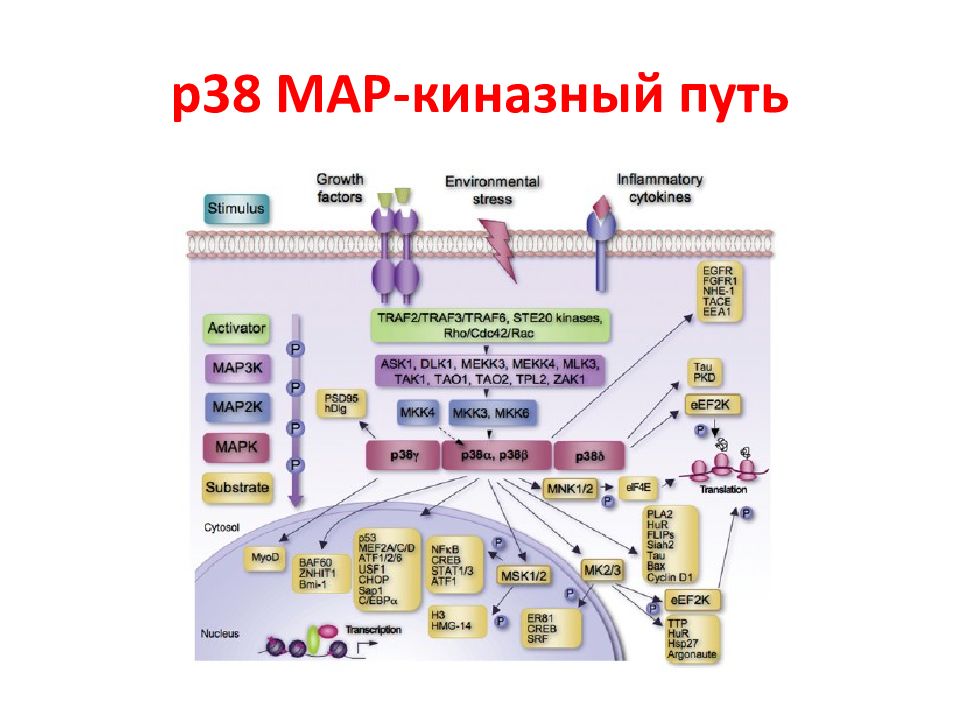
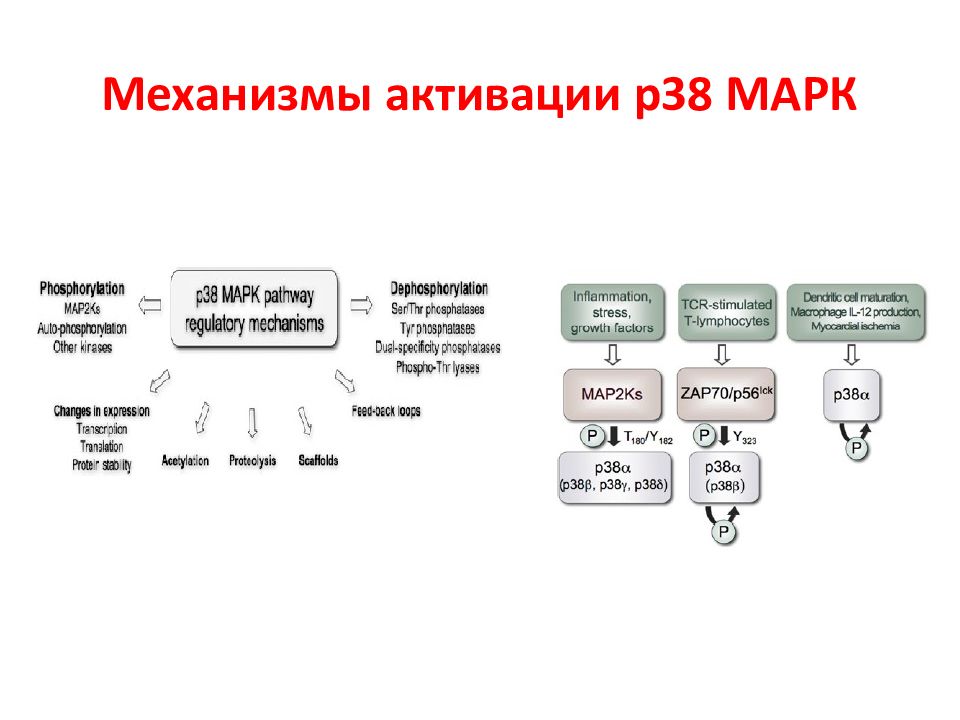
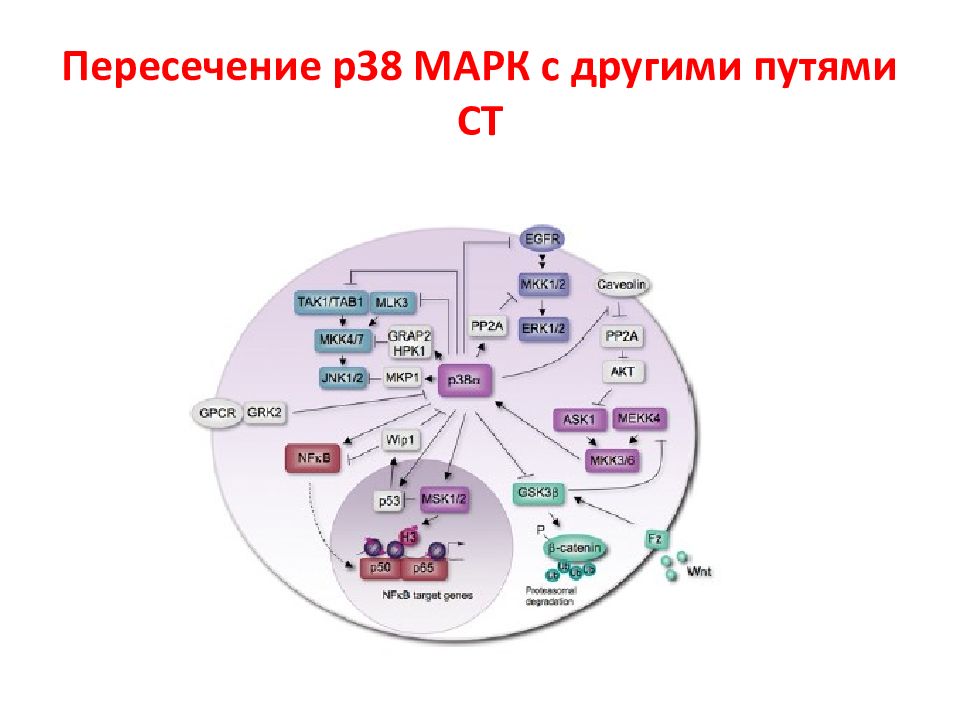
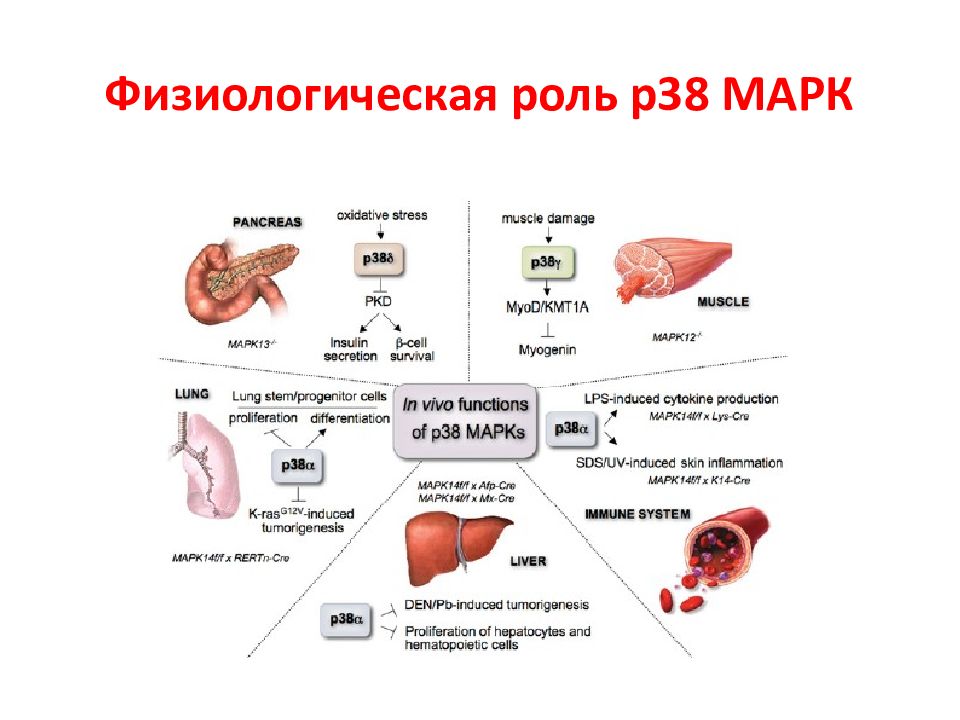
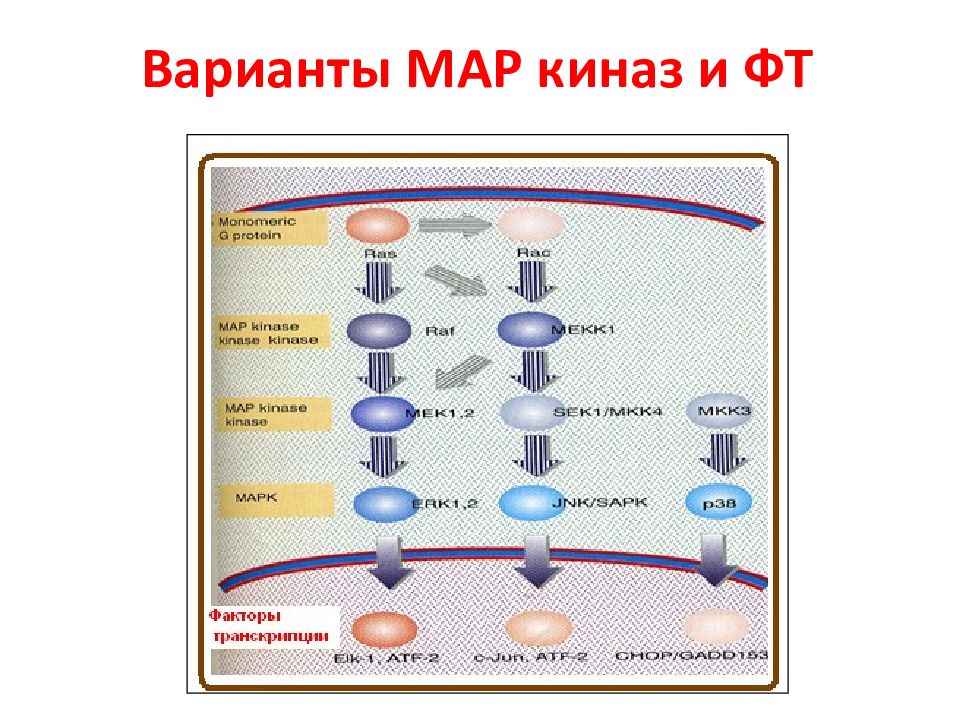
N Белки MAPK Тип сигнального пути 1 Внеклеточная сигнал-регулируемая киназа 1 и 2 (МЕК1 и МЕК2) ERK1/2 2 c - Jun N -терминальная киназа 1 – 3 JNK1-3 3 p38MAPK α, β, γ, δ p38 α - δ 4 ERK5 Большая MAPK Активированные белки Raf передают сигнал к нижестоящим цитозольным белкам MAP ( mitogen active protein ) или MAPK ( MAP kinase ), которые объединяются в семейство МЕК. Эта группа включает 4 различных каскада, которые называются по компоненте, стоящей после МАР киназы. Характеристика МАР киназ ERK1/2 каскад передает, г.о., митогенные сигналы, P38 и JNK – активированные стрессом, ERK5 – оба пути
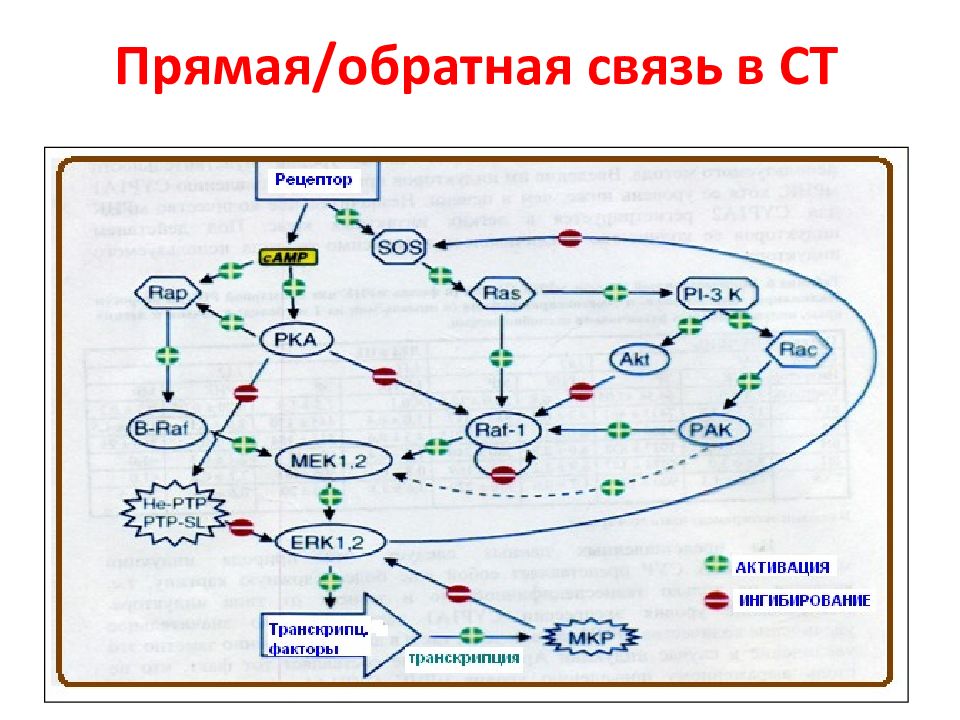
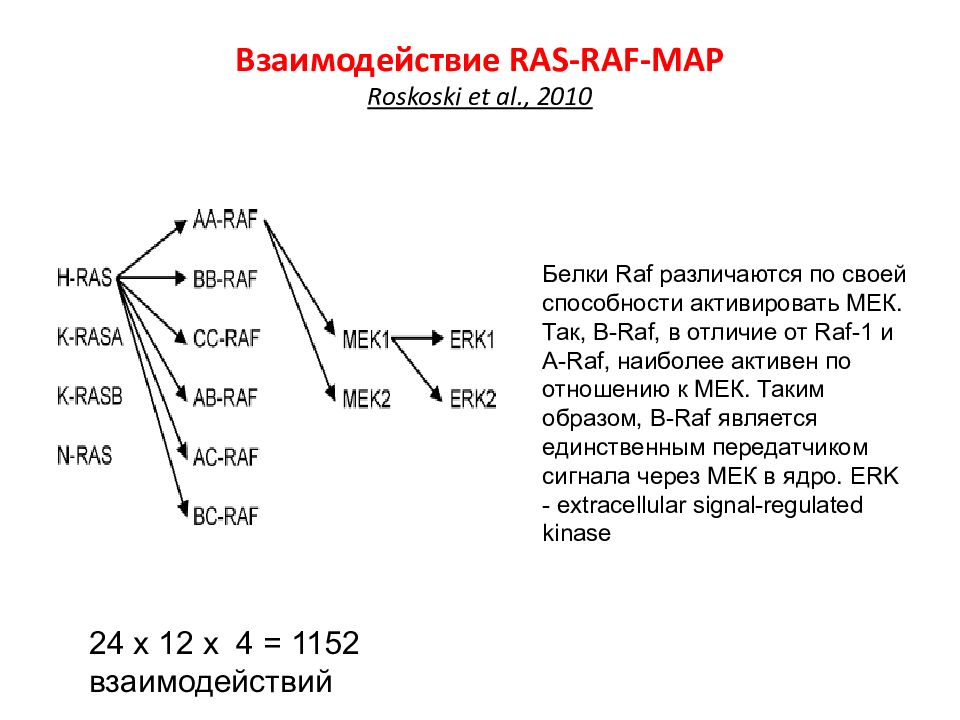
Слайд 45: Взаимодействие RAS-RAF-MAP Roskoski et al., 2010
24 х 12 х 4 = 1152 взаимодействий Белки Raf различаются по своей способности активировать МЕК. Так, B - Raf, в отличие от Raf -1 и A - Raf, наиболее активен по отношению к МЕК. Таким образом, B - Raf является единственным передатчиком сигнала через МЕК в ядро. ERK - extracellular signal-regulated kinase
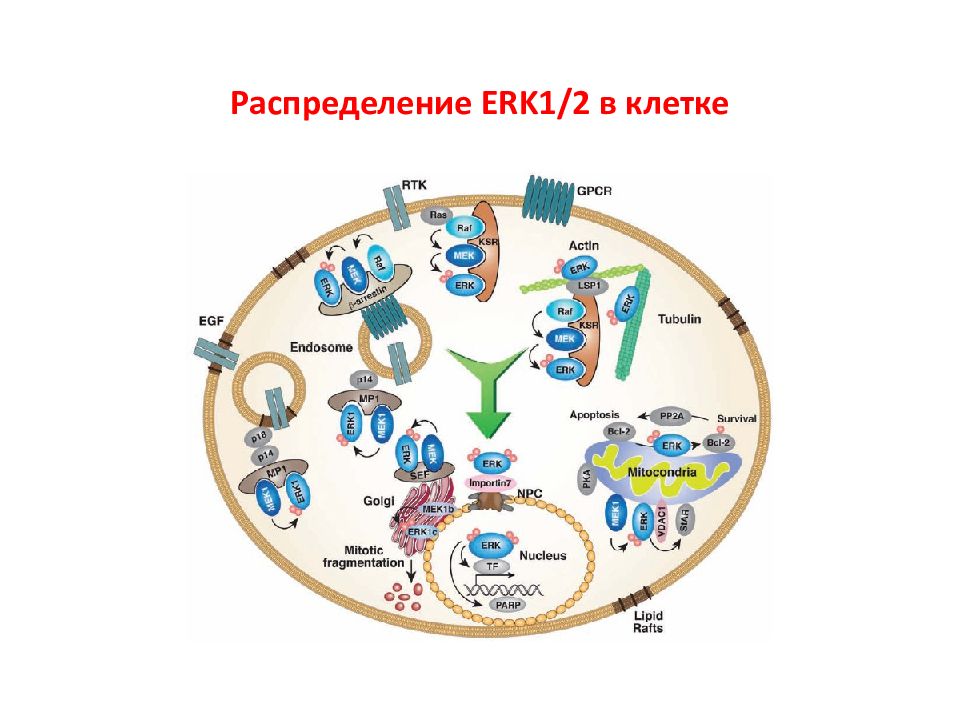
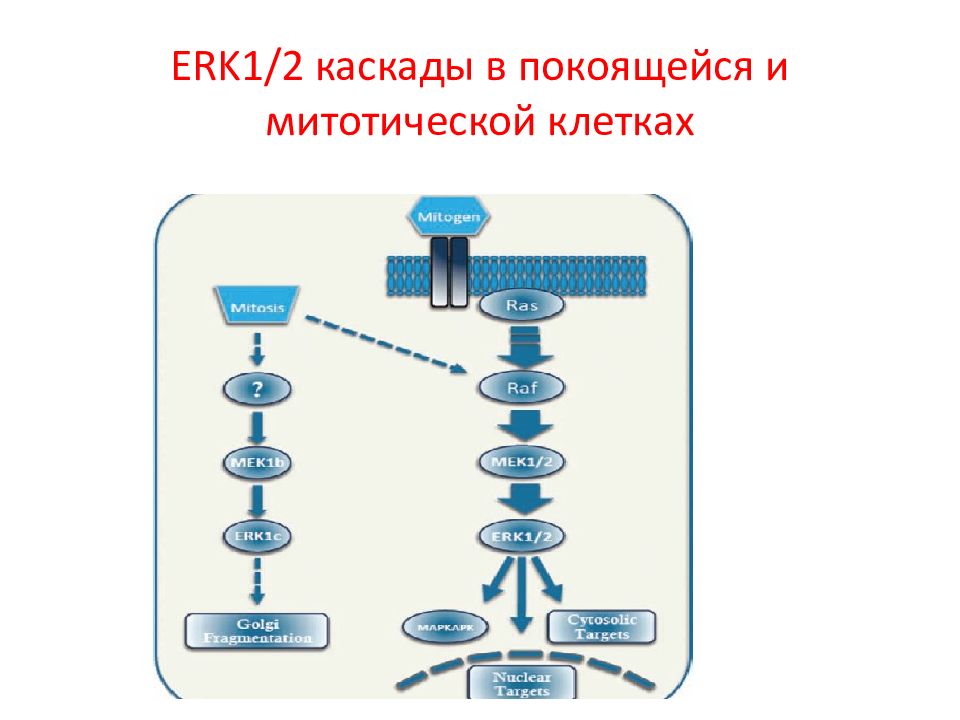
Слайд 46: ERK1/2 киназы
ERK1/2 – генные продукты ERK1 (MAPK3) и ERK2 (MAPK1). MEK1/2- опосредованное фосфорилирование ERK1/2 ( Thr и Tyr в последовательности Thr-Xaa-Tyr ) Известно более 200 субстратов ERK1/2, в том числе ФТ Elk1, c-Fos и c-Jun.
Слайд 58: Липидная киназа PI 3 K
Существует 3 класса киназ PI 3 K, различающихся по структуре и функциям. Класс IA PI 3 K чаще всего ассоциирован с возникновением рака. Известно 3 гена этого класса: PIK 3 R 1, PIK 3 R 2 и PIK 3 R 3, активирующие мутации в которых находят в опухолевых клетках человека.
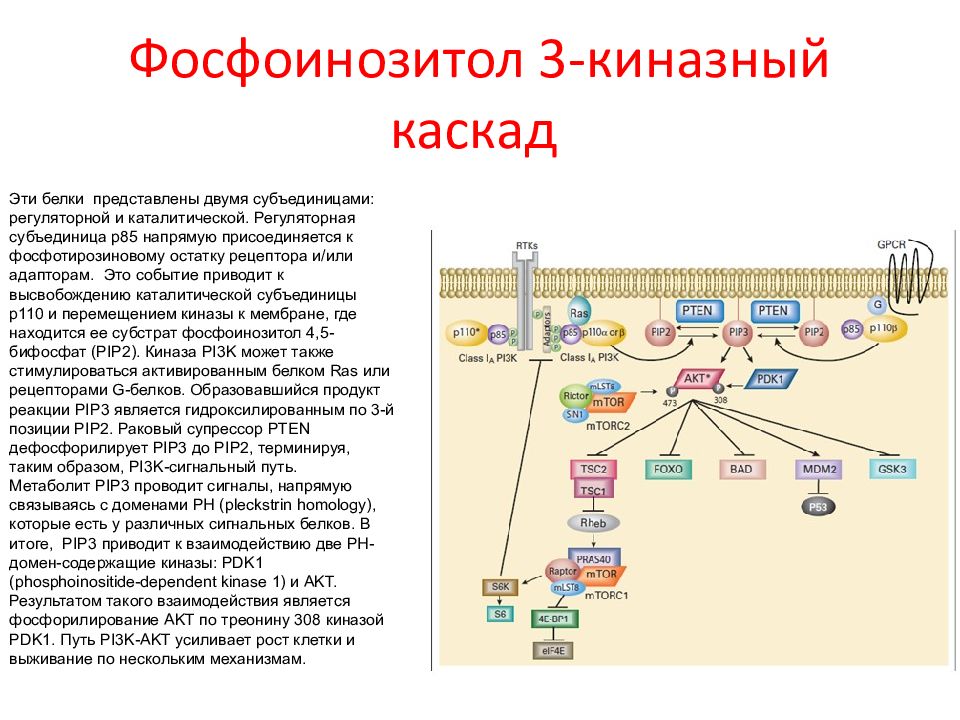
Слайд 59: Фосфоинозитол 3-киназный каскад
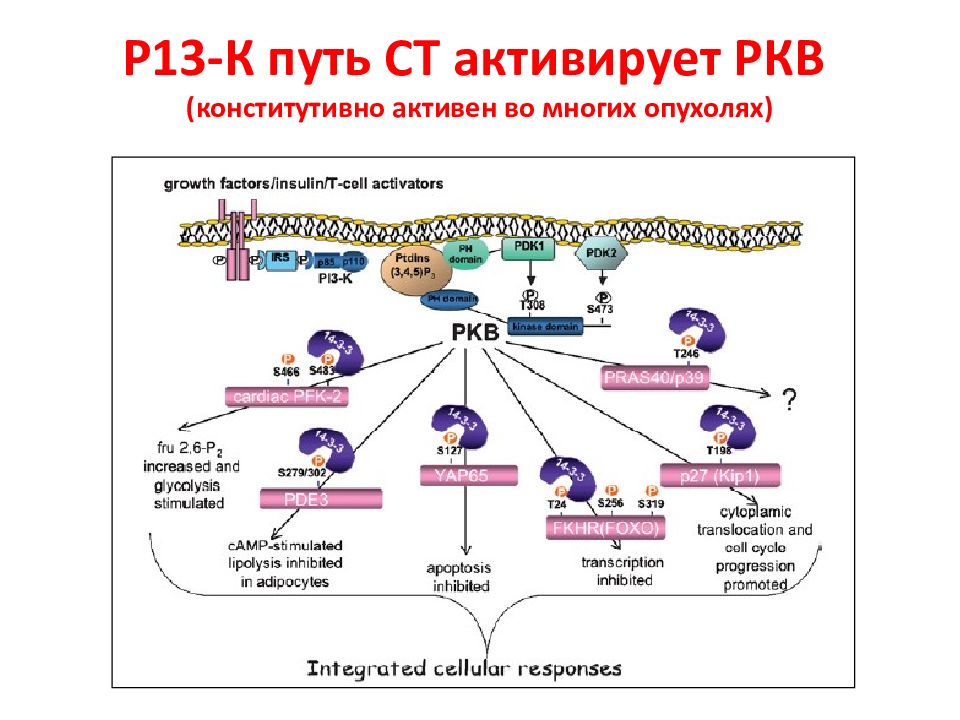
Эти белки представлены двумя субъединицами: регуляторной и каталитической. Регуляторная субъединица p 85 напрямую присоединяется к фосфотирозиновому остатку рецептора и/или адапторам. Это событие приводит к высвобождению каталитической субъединицы p 110 и перемещением киназы к мембране, где находится ее субстрат фосфоинозитол 4,5-бифосфат (PIP2). Киназа PI 3 K может также стимулироваться активированным белком Ras или рецепторами G-белков. Образовавшийся продукт реакции PIP 3 является гидроксилированным по 3-й позиции PIP2. Раковый супрессор PTEN дефосфорилирует PIP 3 до PIP 2, терминируя, таким образом, PI 3 K -сигнальный путь. Метаболит PIP 3 проводит сигналы, напрямую связываясь с доменами PH ( pleckstrin homology ), которые есть у различных сигнальных белков. В итоге, PIP 3 приводит к взаимодействию две PH -домен-содержащие киназы: PDK 1 ( phosphoinositide - dependent kinase 1) и AKT. Результатом такого взаимодействия является фосфорилирование AKT по треонину 308 киназой PDK 1. Путь PI 3 K - AKT усиливает рост клетки и выживание по нескольким механизмам.
Слайд 60: Р13-К путь СТ активирует РКВ (конститутивно активен во многих опухолях)
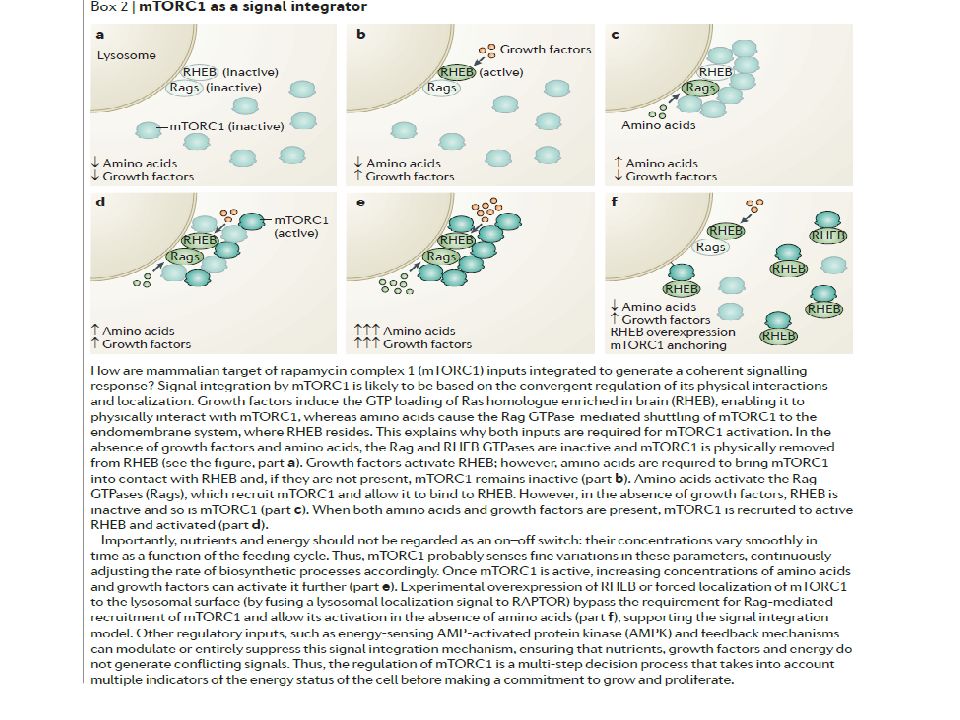
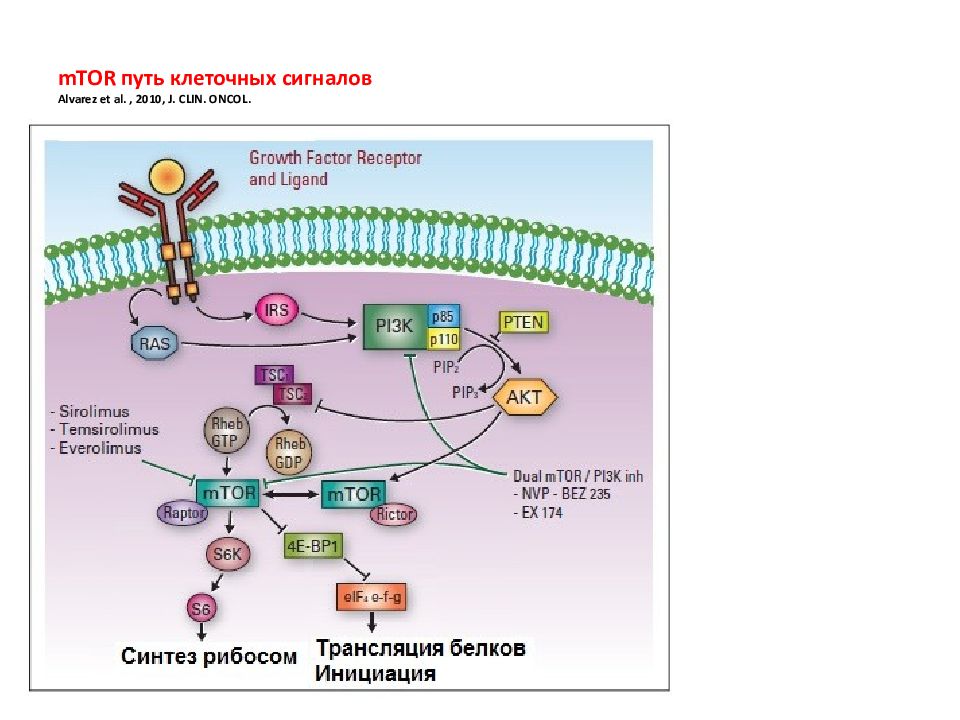
Слайд 62: mTOR
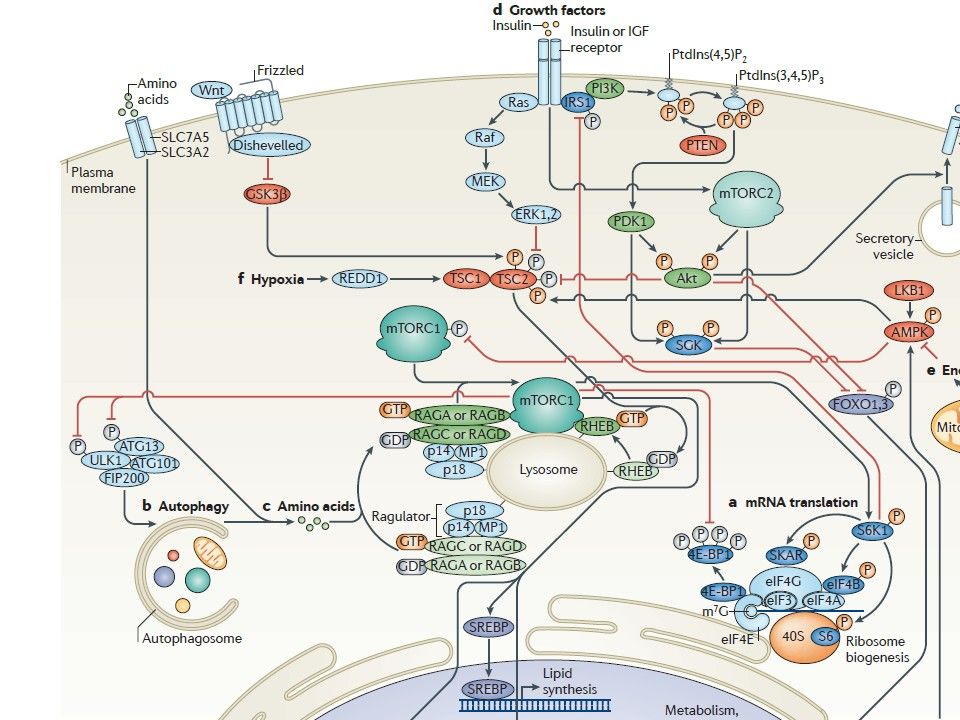
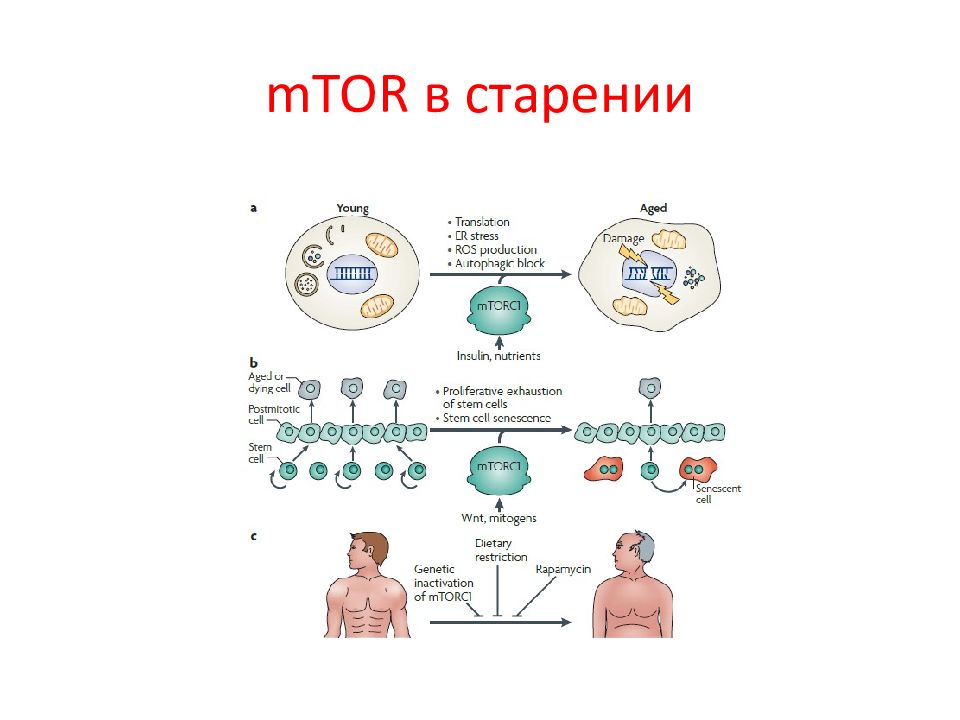
Этот путь играет ключевую роль в росте и питании клетки. Чтобы избежать дефицита энергии и гибель, клетки достаточно быстро ингибируют программы биосинтеза, увеличивая рециркуляцию «старых» белков и органелл как источников метаболитов, в результате чего пролиферация замедляется или вообще останавливается. Киназа TOR ( target of rapamycin ) является своеобразным интерфейсом между ростом и голодом клетки. Появление этой киназы у ранних эукариот сделало возможным для одноклеточных организмов реагировать на питательные вещества и расти в комфортных условиях. У многоклеточных организмов у TOR появилась еще одна функция: контролировать рост и гомеостаз. TOR млекопитающих ( mTOR ) играет ключевую роль в старении, а также в развитии таких болезней человека, как рак, метаболические болезни, включая диабет.
Слайд 63
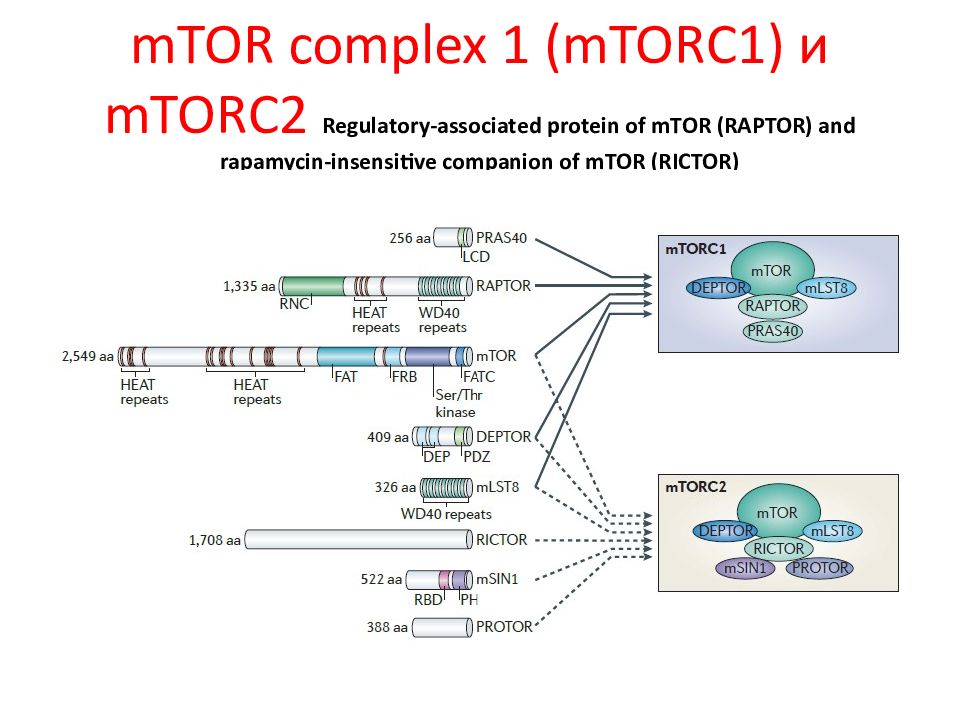
С помощью генетических и биохимических подходов TOR была открыта у дрожжей и млекопитающих как мишень для иммуносупрессора рапамицина, макролидного препарата, синтезируемого почвенной бактерией острова Пасхи. Белок TOR принадлежит к семейству phospho inositide 3- kinase ( PI 3 K )- related protein kinases ( PIKK ), которое представлено большим семейством белков, контролирующим стресс, вызванный метаболическими, генетическими нарушениями и нарушениями в окружающей среде. Установлено, что mTOR является каталитической субъединицей двух различных комплексов: mTOR complex 1 ( mTORC 1) и mTORC 2
Слайд 64: mTOR complex 1 (mTORC1) и mTORC2 Regulatory-associated protein of mTOR (RAPTOR) and rapamycin-insensitive companion of mTOR (RICTOR)
Слайд 65
У дрожжей и млекопитающих рапамицин ингибирует способность mTORC 1, но не mTORC 2 фосфорилировать субстраты. Рапамицин связывает небольшие молекулы с м.м. 12 kDa, такие как белок FKBP 1, и ингибирует связывание с белком RAPTOR
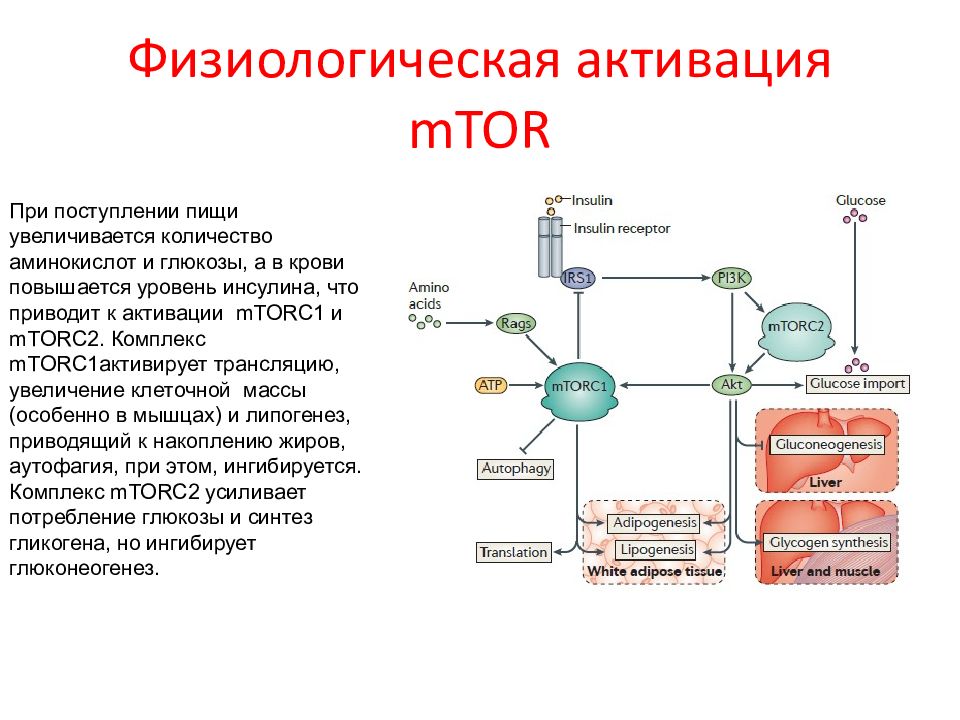
Слайд 68: Физиологическая активация mTOR
При поступлении пищи увеличивается количество аминокислот и глюкозы, а в крови повышается уровень инсулина, что приводит к активации mTORC 1 и mTORC 2. Комплекс mTORC 1активирует трансляцию, увеличение клеточной массы (особенно в мышцах) и липогенез, приводящий к накоплению жиров, аутофагия, при этом, ингибируется. Комплекс mTORC 2 усиливает потребление глюкозы и синтез гликогена, но ингибирует глюконеогенез.
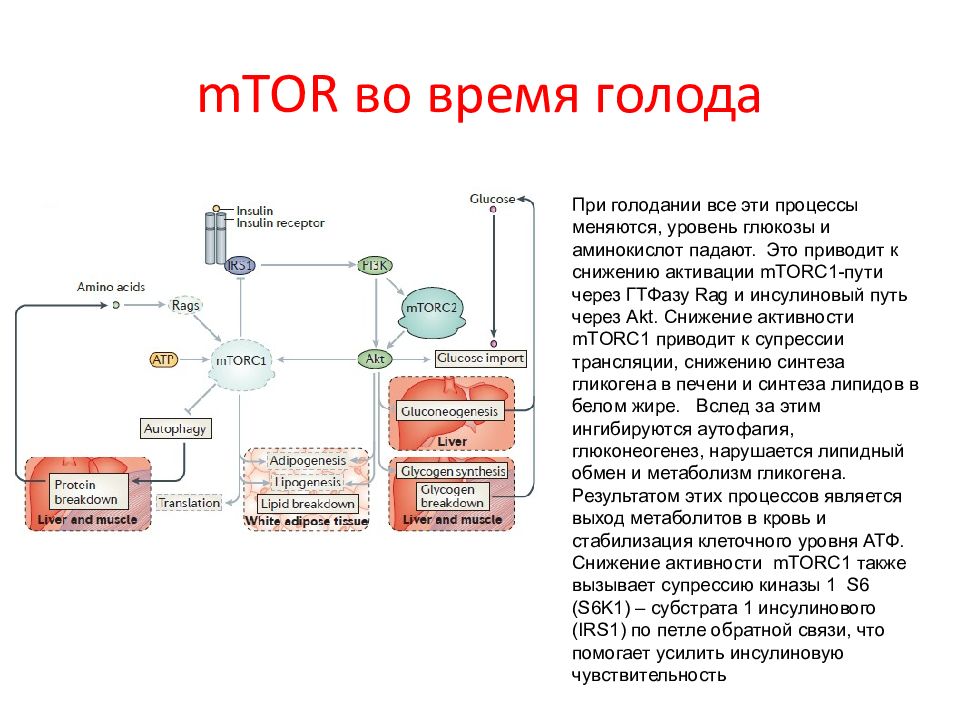
Слайд 69: mTOR во время голода
При голодании все эти процессы меняются, уровень глюкозы и аминокислот падают. Это приводит к снижению активации mTORC 1-пути через ГТФазу Rag и инсулиновый путь через Akt. Снижение активности mTORC 1 приводит к супрессии трансляции, снижению синтеза гликогена в печени и синтеза липидов в белом жире. Вслед за этим ингибируются аутофагия, глюконеогенез, нарушается липидный обмен и метаболизм гликогена. Результатом этих процессов является выход метаболитов в кровь и стабилизация клеточного уровня АТФ. Снижение активности mTORC 1 также вызывает супрессию киназы 1 S 6 ( S 6 K 1) – субстрата 1 инсулинового ( IRS 1) по петле обратной связи, что помогает усилить инсулиновую чувствительность
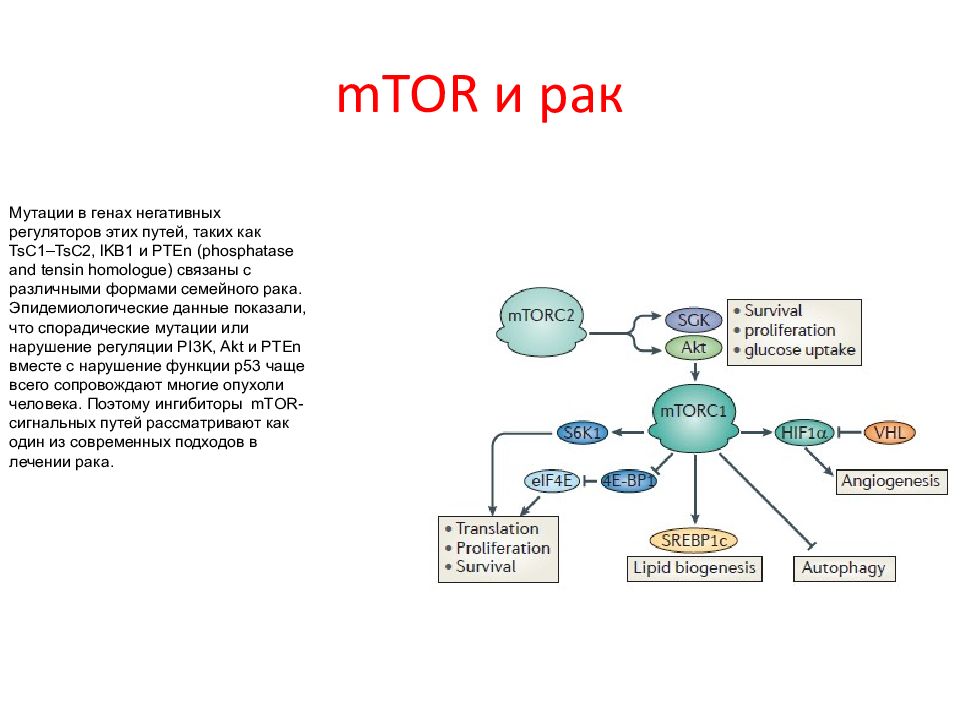
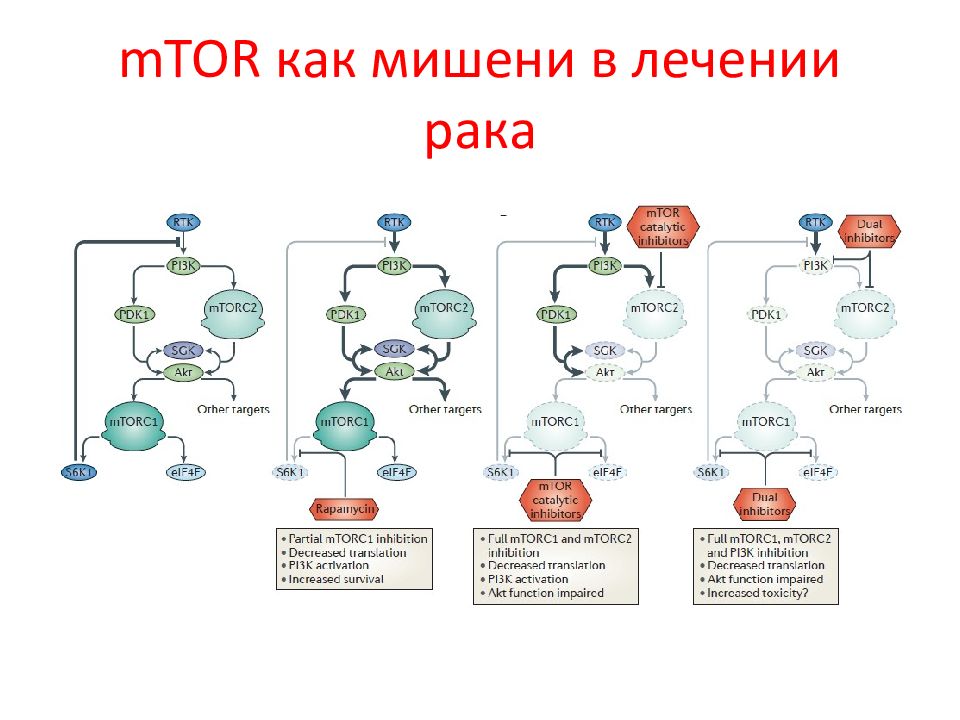
Слайд 71: mTOR и рак
Мутации в генах негативных регуляторов этих путей, таких как TsC 1– TsC 2, lKB 1 и PTEn ( phosphatase and tensin homologue ) связаны с различными формами семейного рака. Эпидемиологические данные показали, что спорадические мутации или нарушение регуляции PI 3 K, Akt и PTEn вместе с нарушение функции p 53 чаще всего сопровождают многие опухоли человека. Поэтому ингибиторы mTOR -сигнальных путей рассматривают как один из современных подходов в лечении рака.
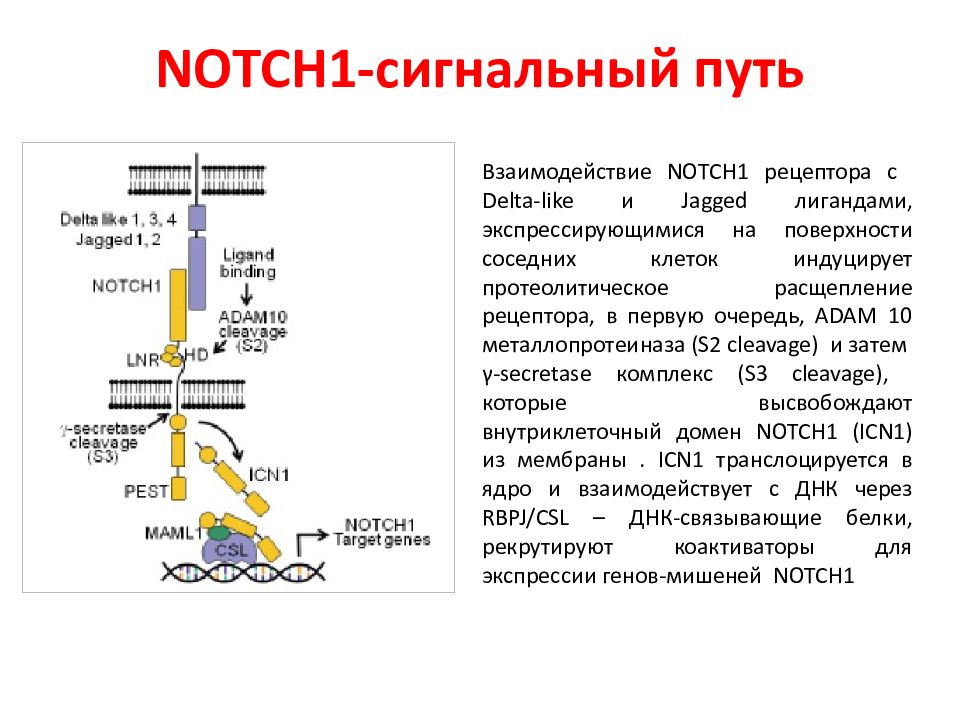
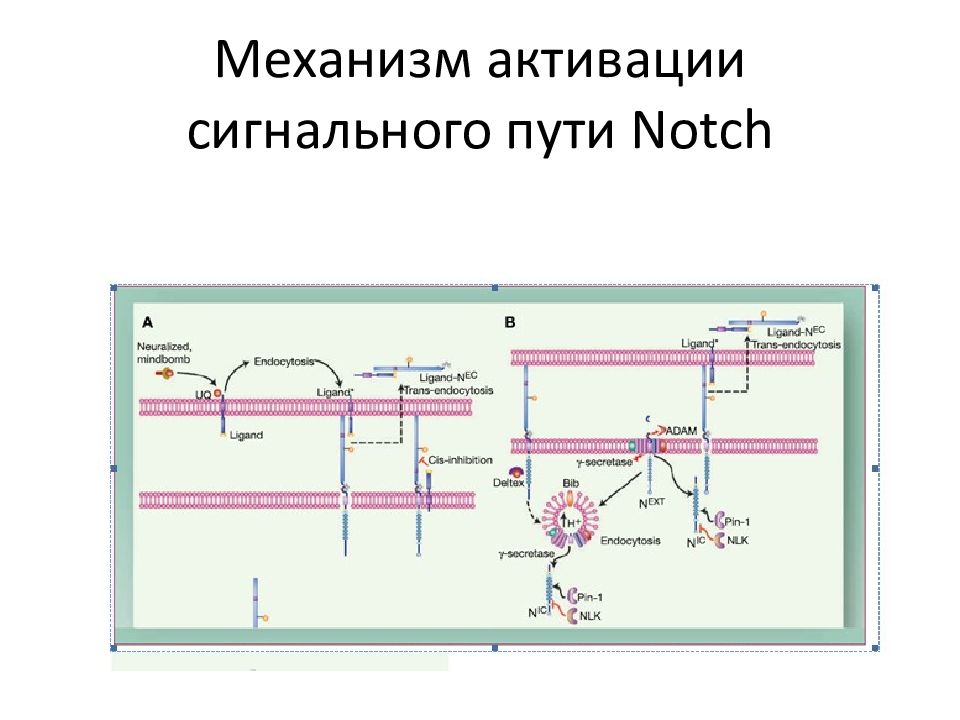
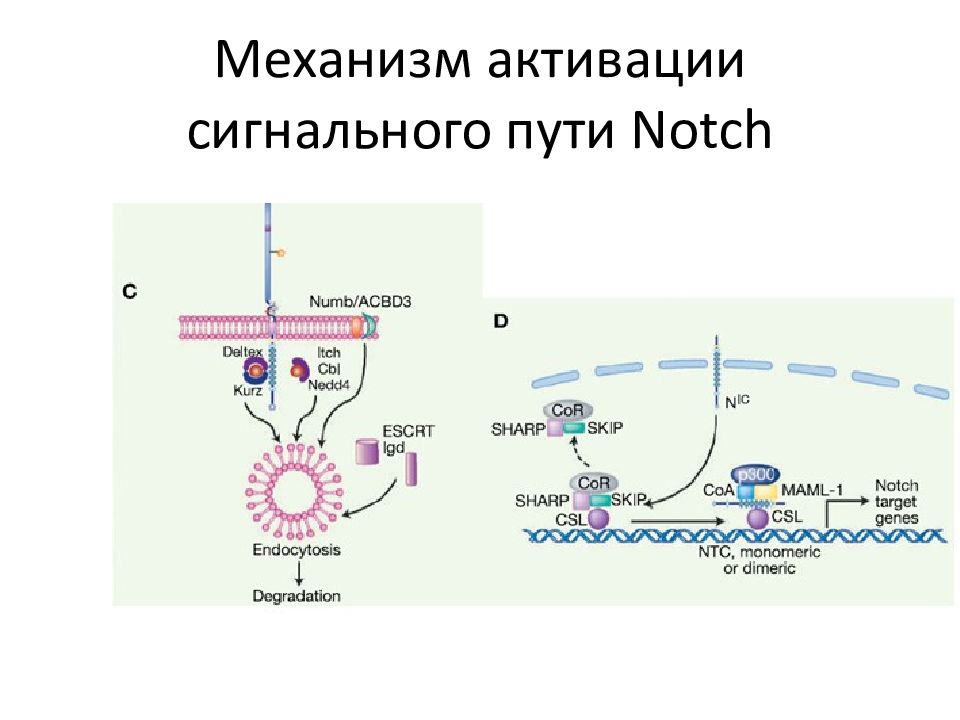
Слайд 77: NOTCH1 -сигнальный путь
Взаимодействие NOTCH 1 рецептора с Delta - like и Jagged лигандами, экспрессирующимися на поверхности соседних клеток индуцирует протеолитическое расщепление рецептора, в первую очередь, ADAM 10 металлопротеиназа (S2 cleavage) и затем γ- secretase комплекс (S3 cleavage), которые высвобождают внутриклеточный домен NOTCH1 (ICN1) из мембраны. ICN 1 транслоцируется в ядро и взаимодействует с ДНК через RBPJ / CSL – ДНК-связывающие белки, рекрутируют коактиваторы для экспрессии генов-мишеней NOTCH 1
Слайд 80: Онкогенные формы NOTCH1 при T-ALL
Аберрантная активация NOTCH может происходить из-за мутаций. (А) рецептор дикого типа; (b) Транслокация NOTCH1 в TCR локус индуцирует усеченные формы NOTCH1. (c) NOTCH1 HD мутации класса 1 дестабилизируют структуру HD-LNR повторов, ответственных за поддержание конфигурации рецептора (d) NOTCH1 H1545P мутации повреждают защиту от S2 расщепления у HD-LNR (e) NOTCH1 HD мутации класса 2 располагают S2 МР сайт расщепления вне HD-LNR комплекса (f) NOTCH1 JME усиливает выделение HD-LNR повторного комплекса из мембраны (g) NOTCH1 ΔPEST у C-конца рецептора нарушает деградацию активного NOTCH1 в ядре.
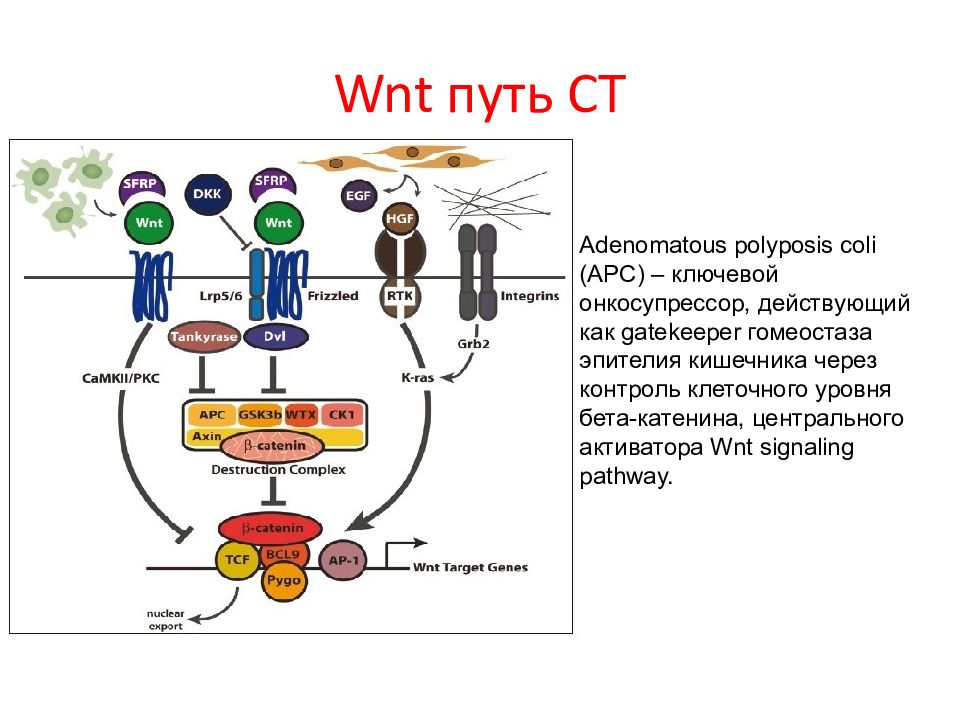
Слайд 83: Wnt путь СТ
Adenomatous polyposis coli (APC ) – ключевой онкосупрессор, действующий как gatekeeper гомеостаза эпителия кишечника через контроль клеточного уровня бета-катенина, центрального активатора Wnt signaling pathway.
Слайд 84
Канонический Wnts исгнал проходит через активатор транскрипции β-catenin. В отсутствие лигандов цитоплазматический β-catenin находтся в составе комплекса «деструктивных» белков: APC, glycogen synthase kinase 3-β (GSK-3β), Axin и др.В этом состоянии β-catenin фосфорилирован, убиквитинирован и деградирован, что предотвращает его транслокация в ядро и взаимодействие с семйеством ФТ семейства LEF/TCF (LEF-1/LEF1, TCF-1/TCF7, TCF-3/TCF7L1 и TCF-4/TCF7L2. Когда присутствуют лиганды Wnt, они связываются с рецепторным комплексом, состоящем из 7-ми трансмембранных белков Frizzled (Fz) и дного рецептора LRP5/6 (lipoprotein-related protein 5 or 6). Связывание с этими рецепторами рекрутирует скаффолд-белок Dishevelled (Dvl), что приводит к фосфорилированию LRP5/6 и рекрутированию Axin и GSK-3β в стороне от комплекса деструкции. Это событие ведет к освобождению β-catenin и накоплению его в ядре вместе с LEF/TCFs. Когда возрастает его ядерная концентрация, LEF/TCFs направляет β-catenin к генам-мишеням и способствует взаимодействию с корегуляторами Pygopus, BCL9/Legless и активации транскрипционных комплексов, таких как CDK8 module of Mediator и TRRAP.
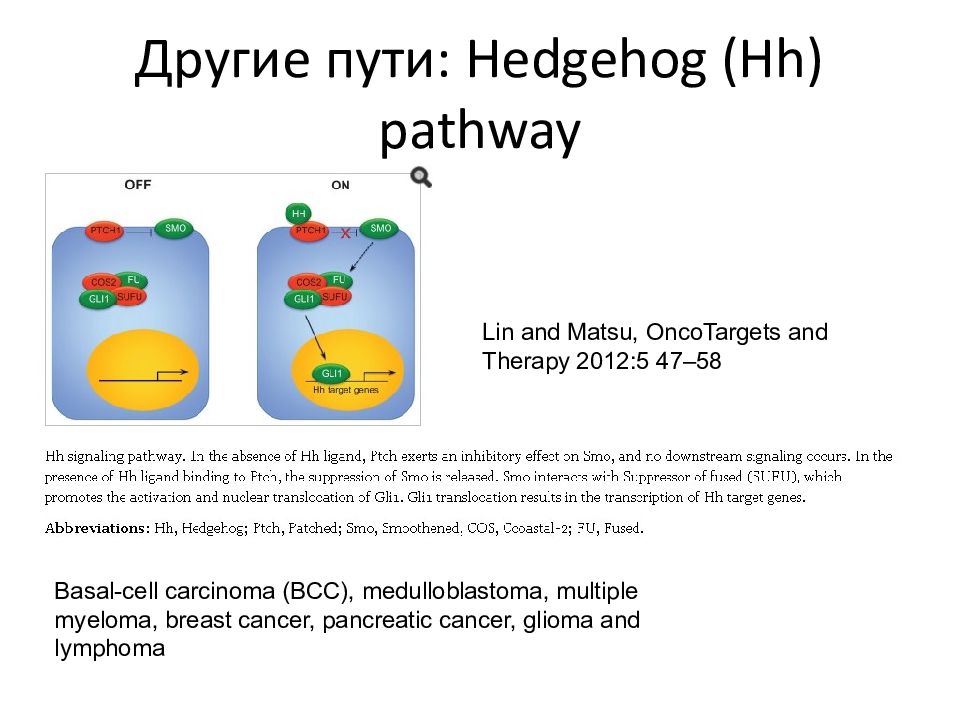
Слайд 87: Другие пути: Hedgehog (Hh) pathway
Lin and Matsu, OncoTargets and Therapy 2012:5 47–5 8 Basal-cell carcinoma (BCC), medulloblastoma, multiple myeloma, breast cancer, pancreatic cancer, glioma and lymphoma
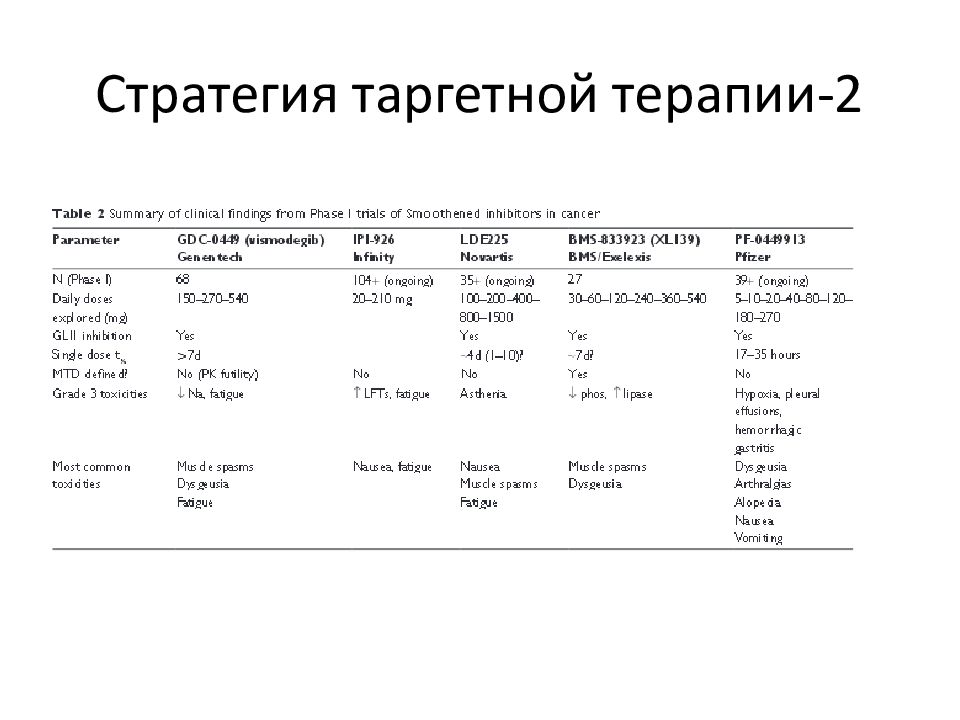
Слайд 88: Стратегия таргетной терапии
Currently a newer drug, vismodegib acting through inhibition of the Hh pathway has been approved by the US Food and Drug Administration's (US FDA) priority review program on January 30, 2012, for the treatment of advanced form of basal-cell carcinoma
Слайд 94
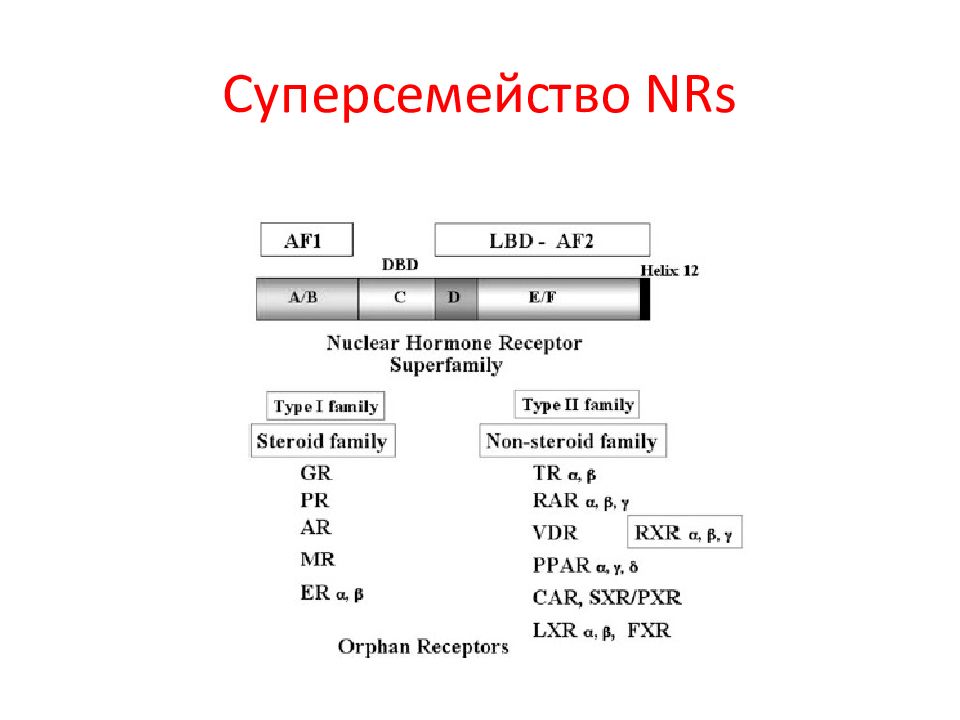
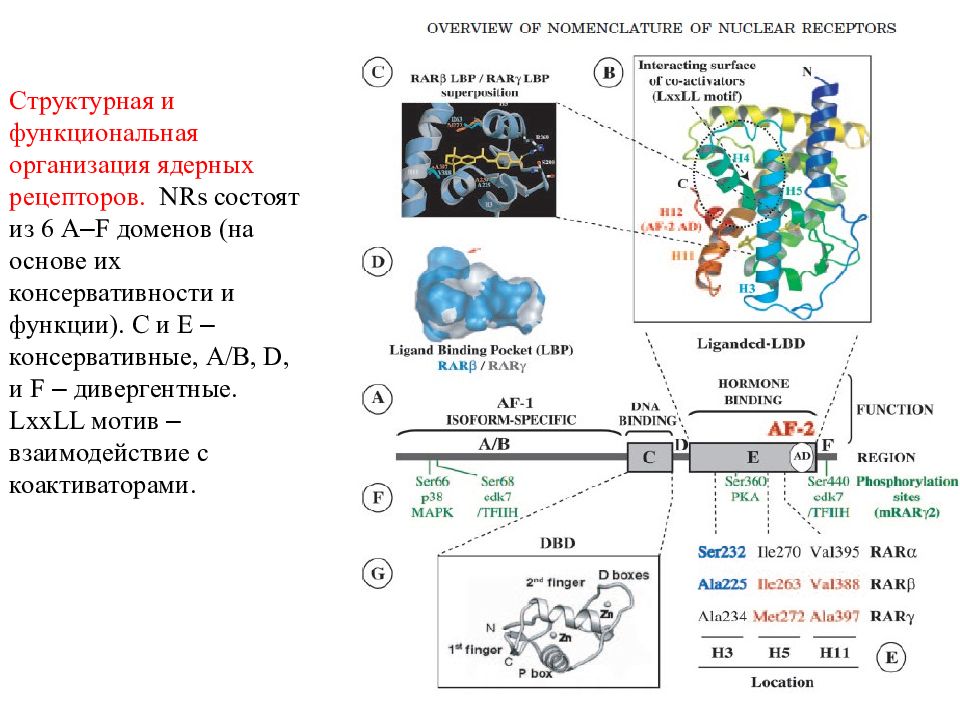
Структурная и функциональная организация ядерных рецепторов. NRs состоят из 6 A – F доменов (на основе их консервативности и функции). C и E – консервативные, A / B, D, и F – дивергентные. LxxLL мотив – взаимодействие с коактиваторами.
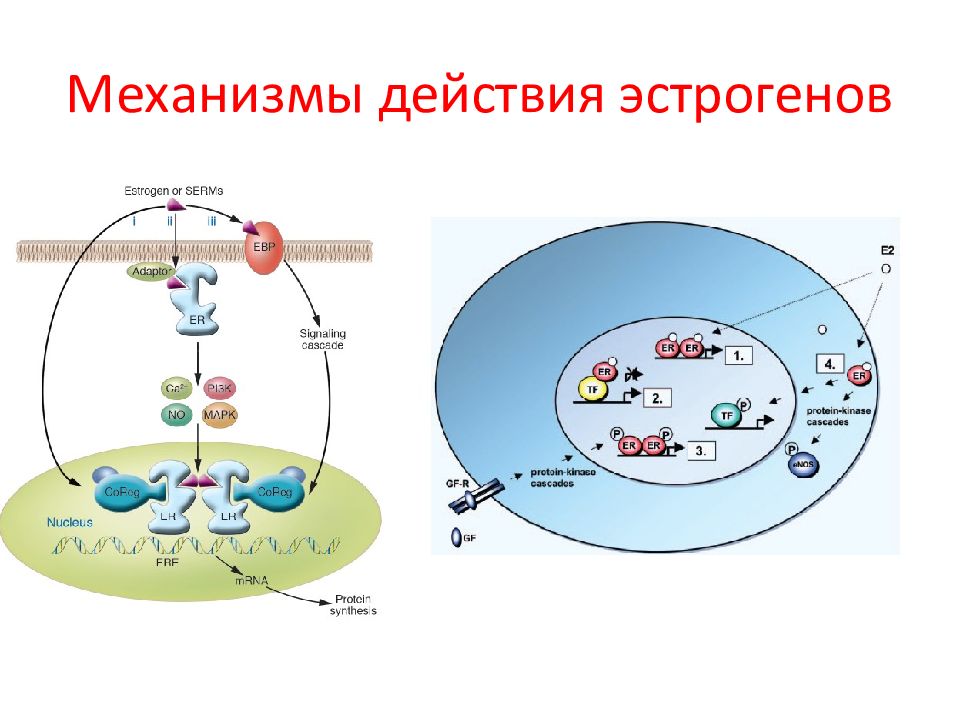
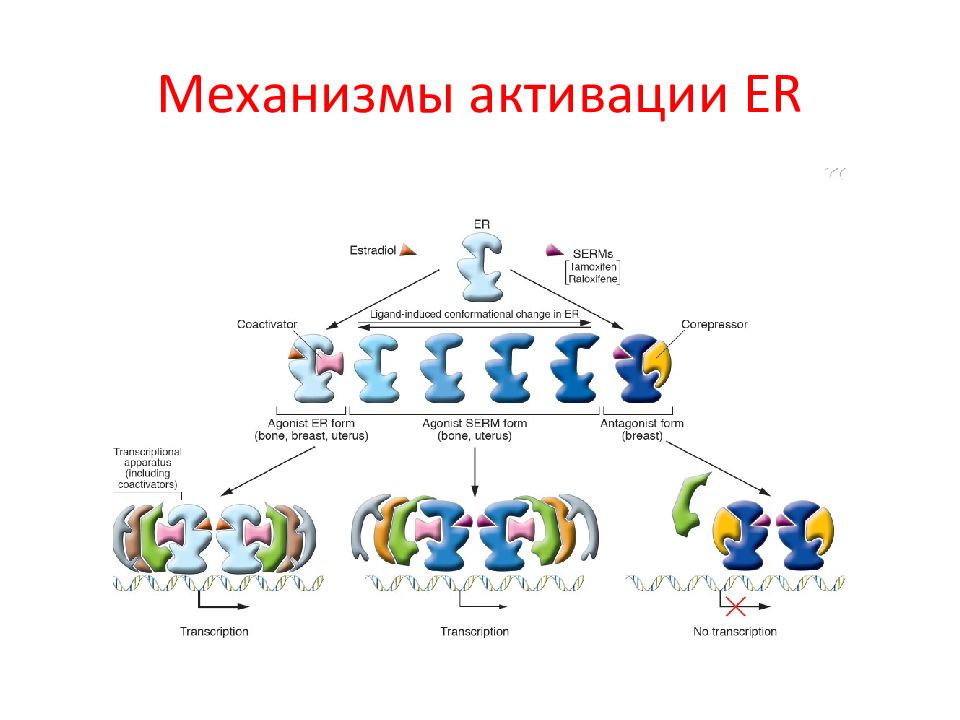
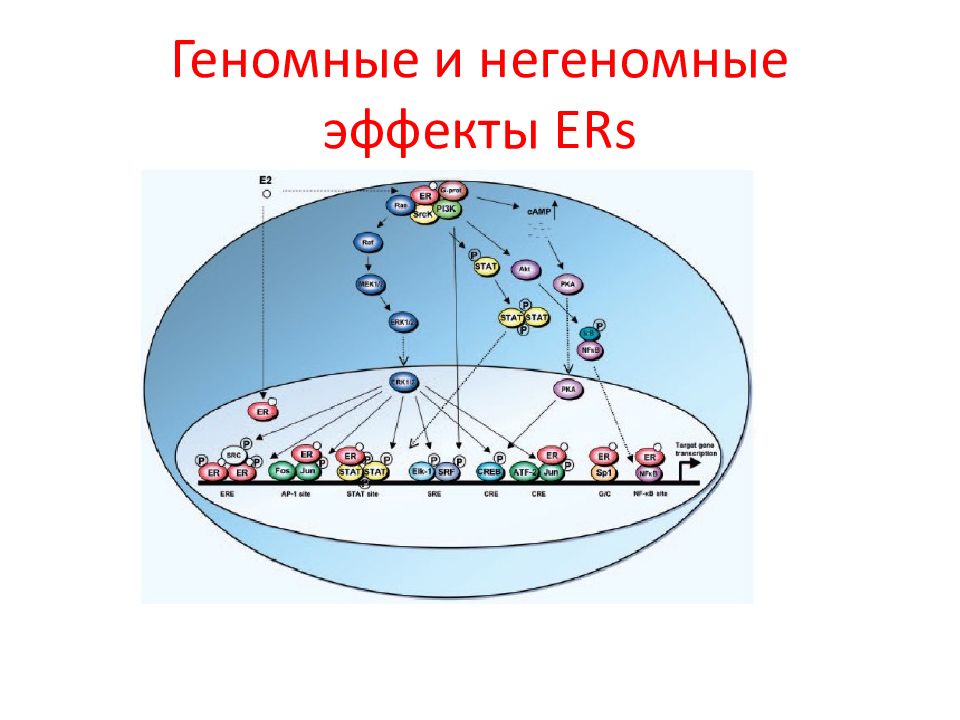
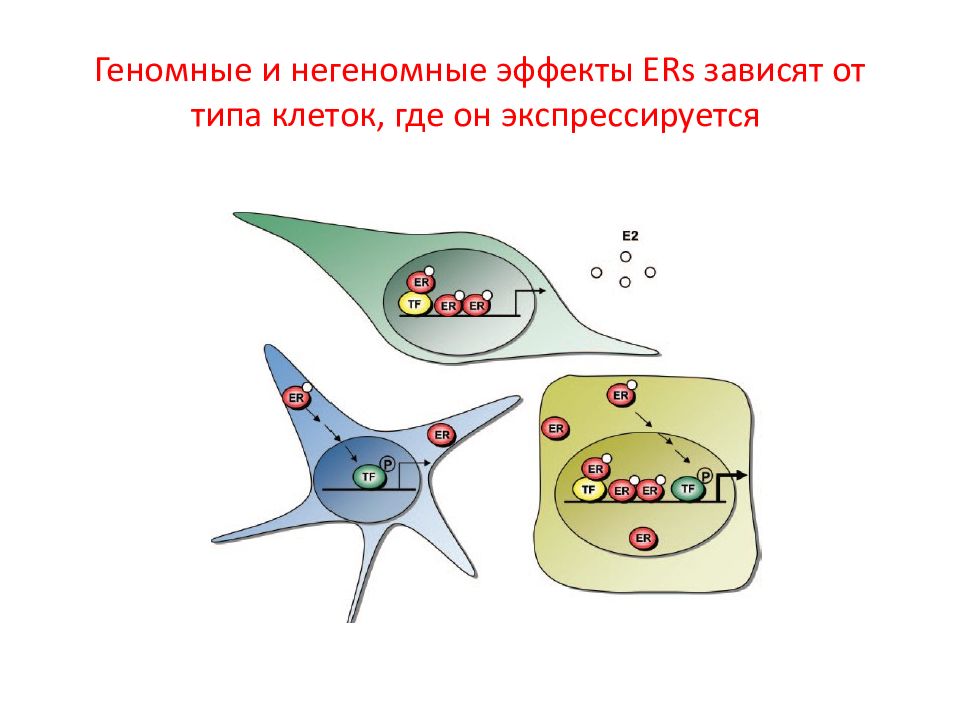
Слайд 101: Геномные и негеномные эффекты ERs зависят от типа клеток, где он экспрессируется
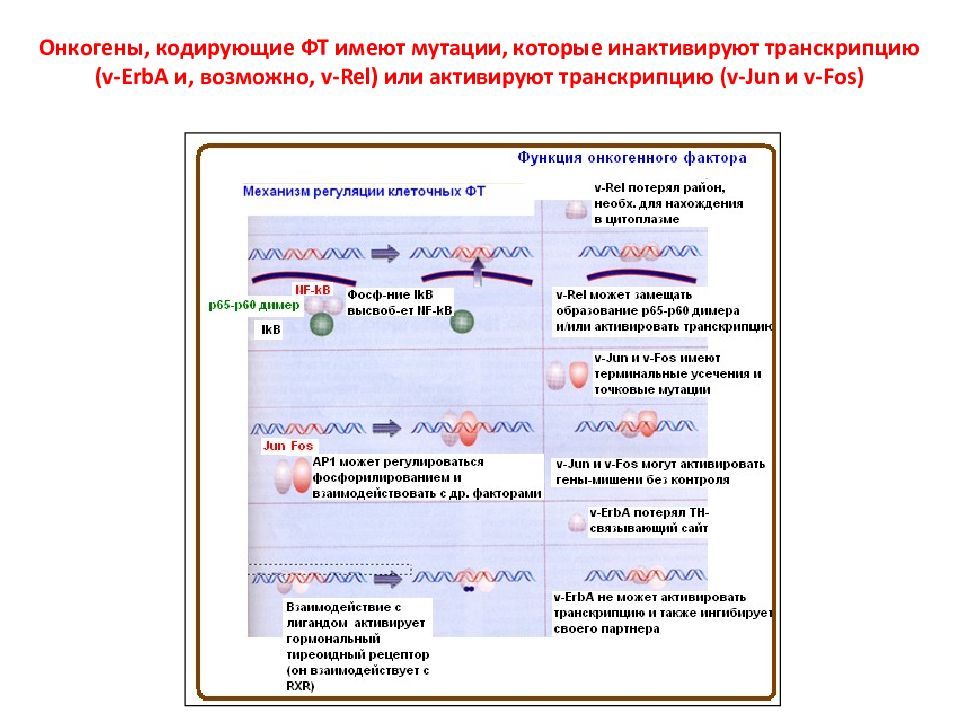
Слайд 104: Онкогены, кодирующие ФТ имеют мутации, которые инактивируют транскрипцию (v-ErbA и, возможно, v-Rel ) или активируют транскрипцию (v-Jun и v-Fos)
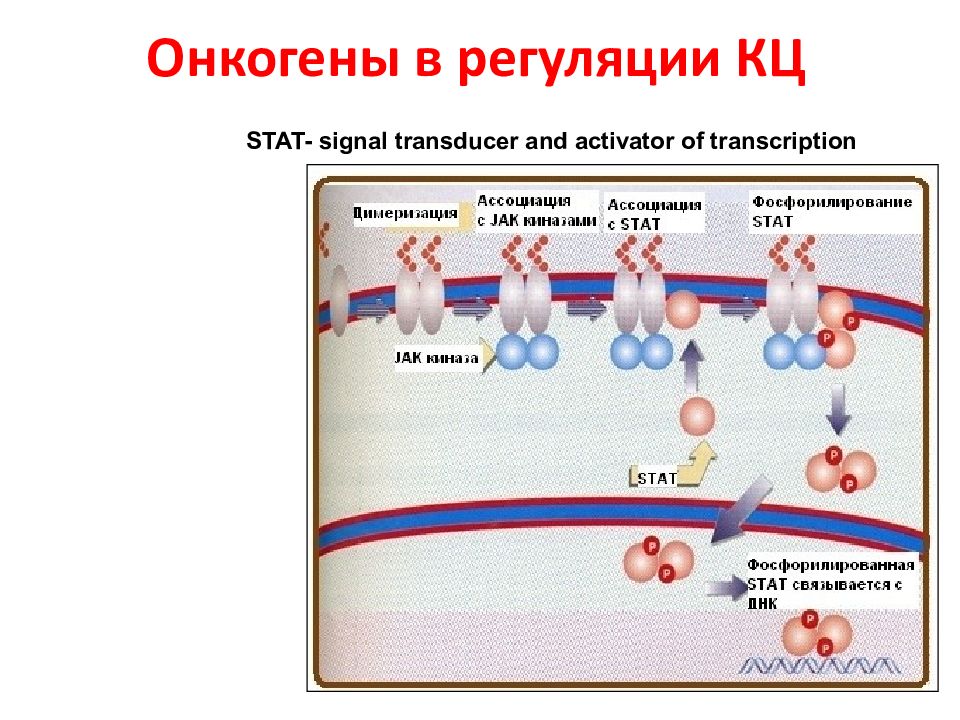
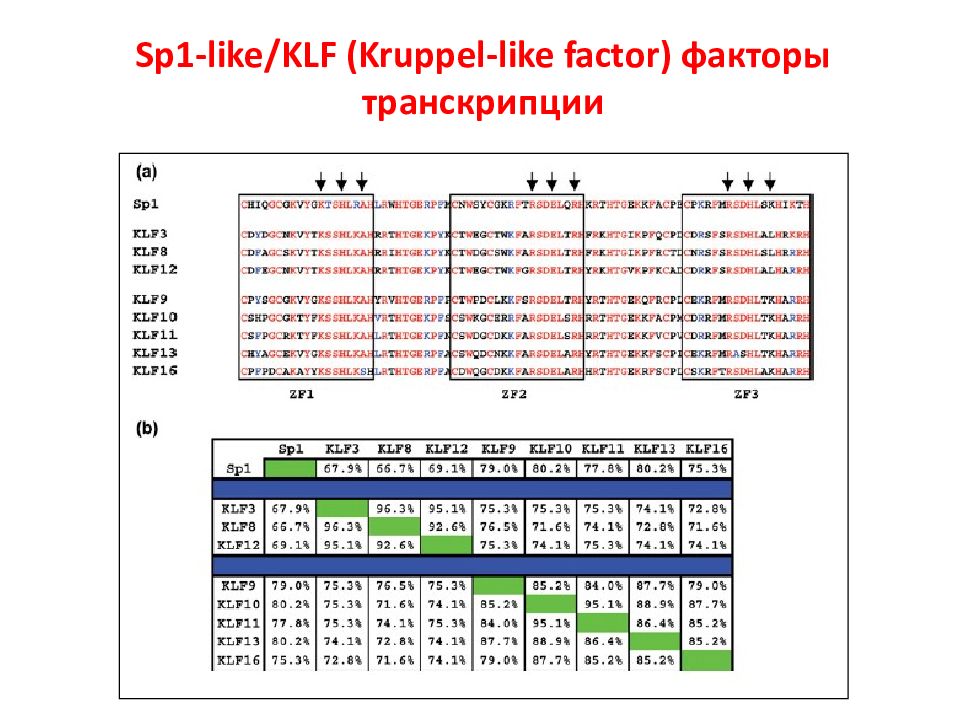
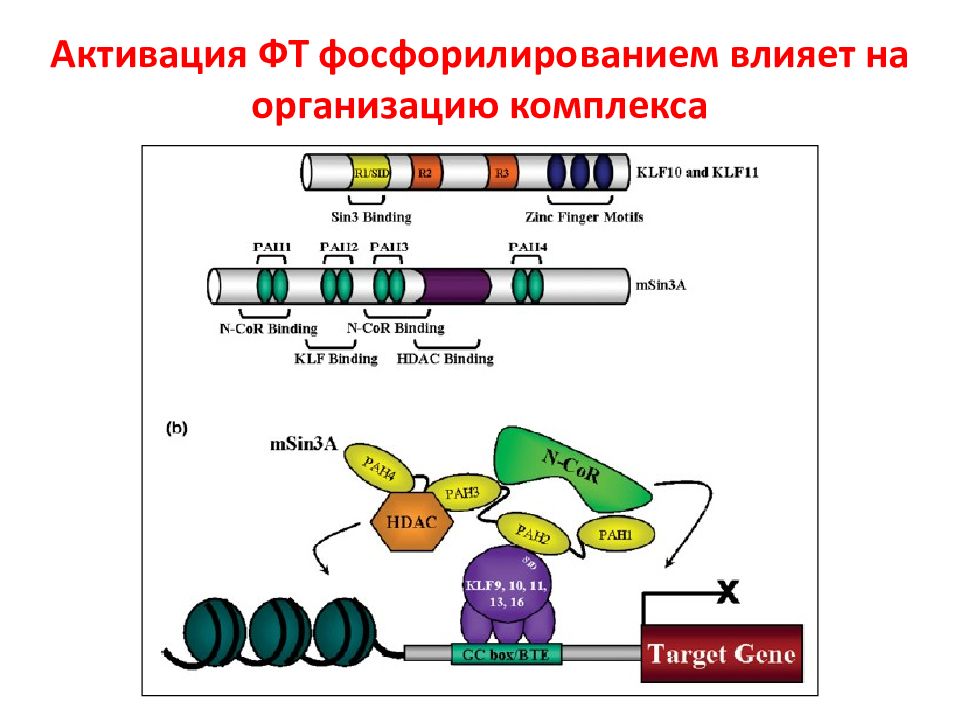
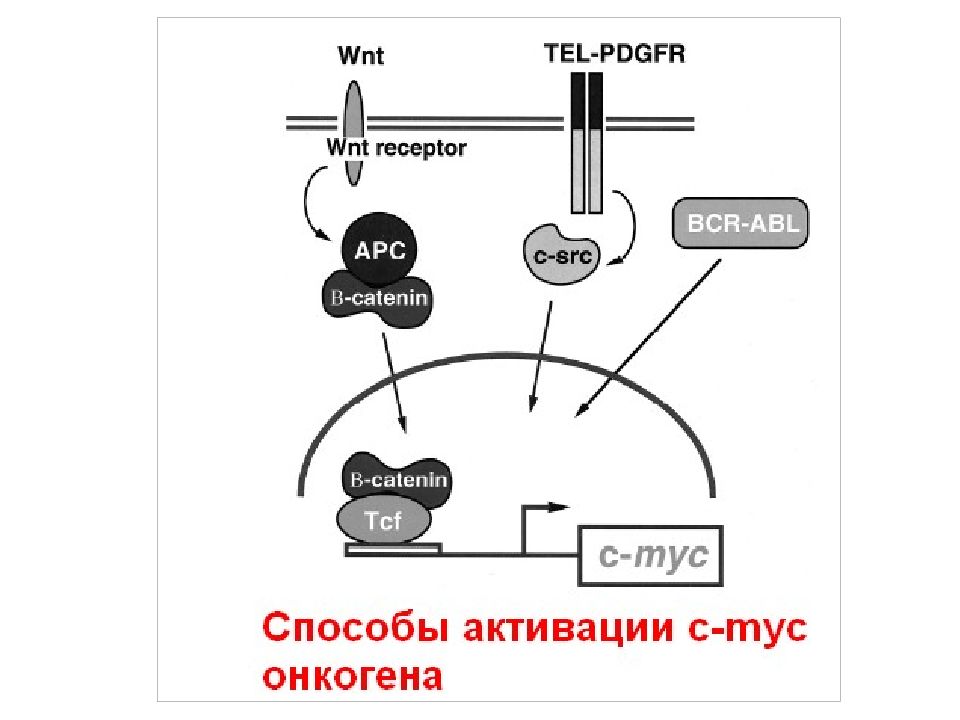
Слайд 106: Онкогены в регуляции КЦ
STAT- signal transducer and activator of transcription
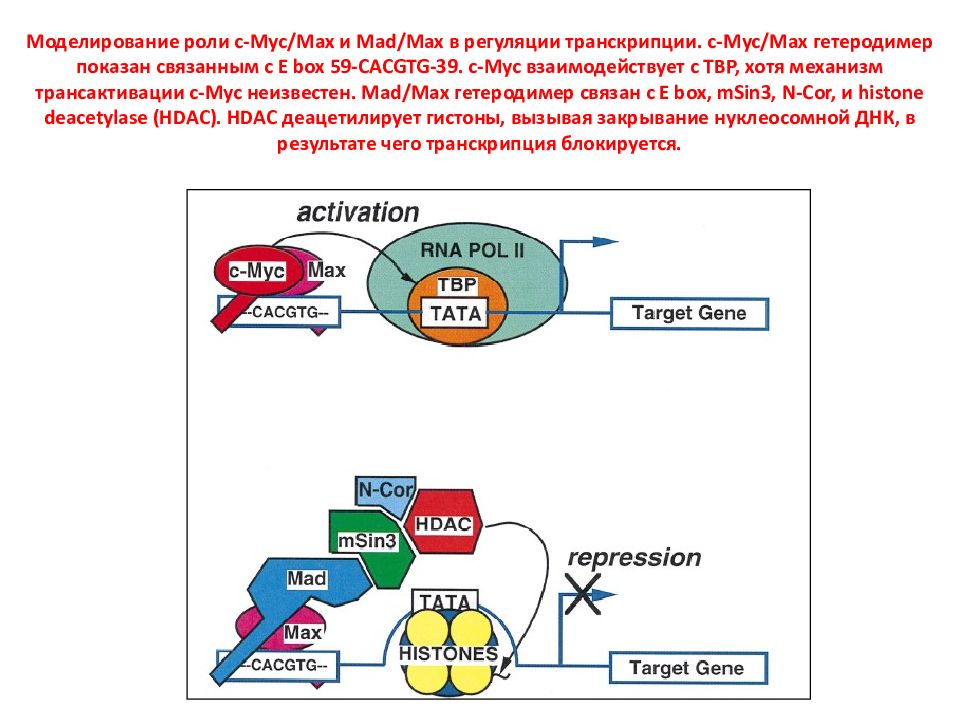
Слайд 110: Моделирование роли c - Myc / Max и Mad / Max в регуляции транскрипции. c - Myc / Max гетеродимер показан связанным с E box 59- CACGTG -39. c - Myc взаимодействует с TBP, хотя механизм трансактивации c - Myc неизвестен. Mad / Max гетеродимер связан с E box, mSin 3, N - Cor, и histone deacetylase ( HDAC ). HDAC деацетилирует гистоны, вызывая закрывание нуклеосомной ДНК, в результате чего транскрипция блокируется
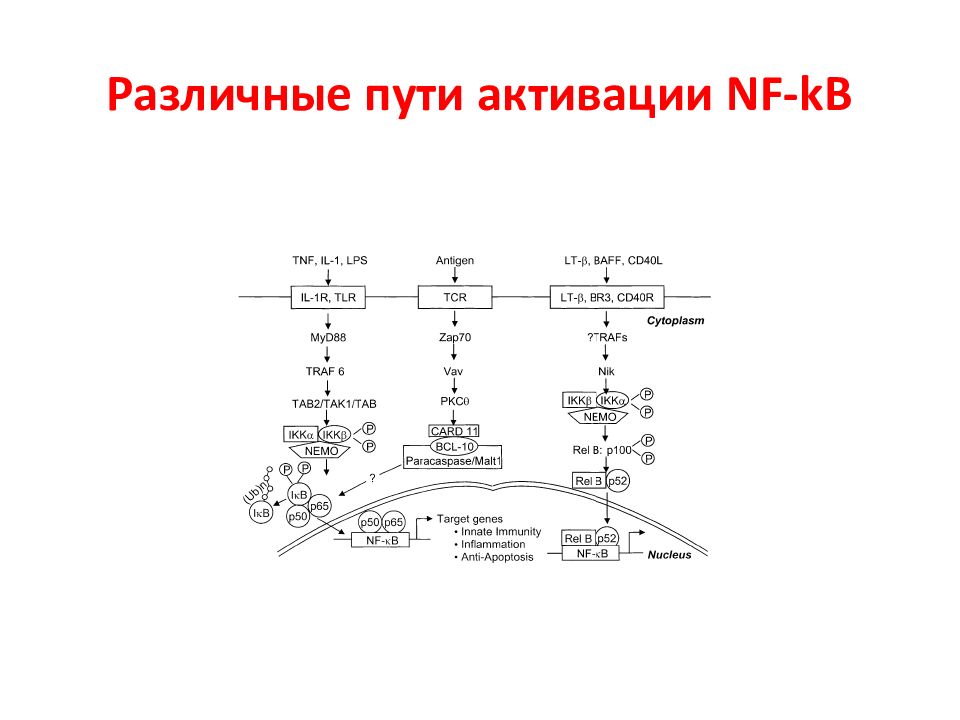
Слайд 114: NF- kB семейство
(p50/p105), NF-kB2 (p52/ p100), RelA (p65), Rel (c-Rel) и RelB. Для них характерно: Rel homology domain (RHD), который опосредует связывание с ДНК, димеризацию и связывание с группой ингибиторов IkB IkB киназный комплекс (IKK) состоит из 3-х субъединиц: IKKa, IKKb и IKKg/NEMO и убиквитина.
Слайд 115: Активация NF-kB
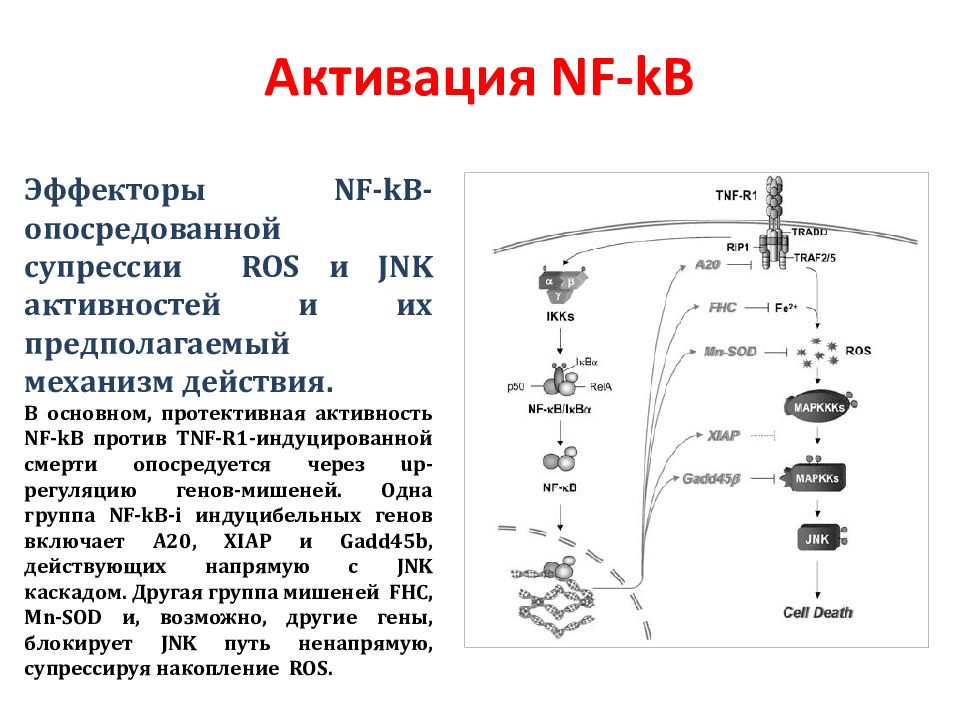
Эффекторы NF - k B -опосредованной супрессии ROS и JNK активностей и их предполагаемый механизм действия. В основном, протективная активность NF - k B против TNF - R 1-индуцированной смерти опосредуется через up -регуляцию генов-мишеней. Одна группа NF - k B - i индуцибельных генов включает A 20, XIAP и Gadd 45 b, действующих напрямую с JNK каскадом. Другая группа мишеней FHC, Mn - SOD и, возможно, другие гены, блокирует JNK путь ненапрямую, супрессируя накопление ROS.
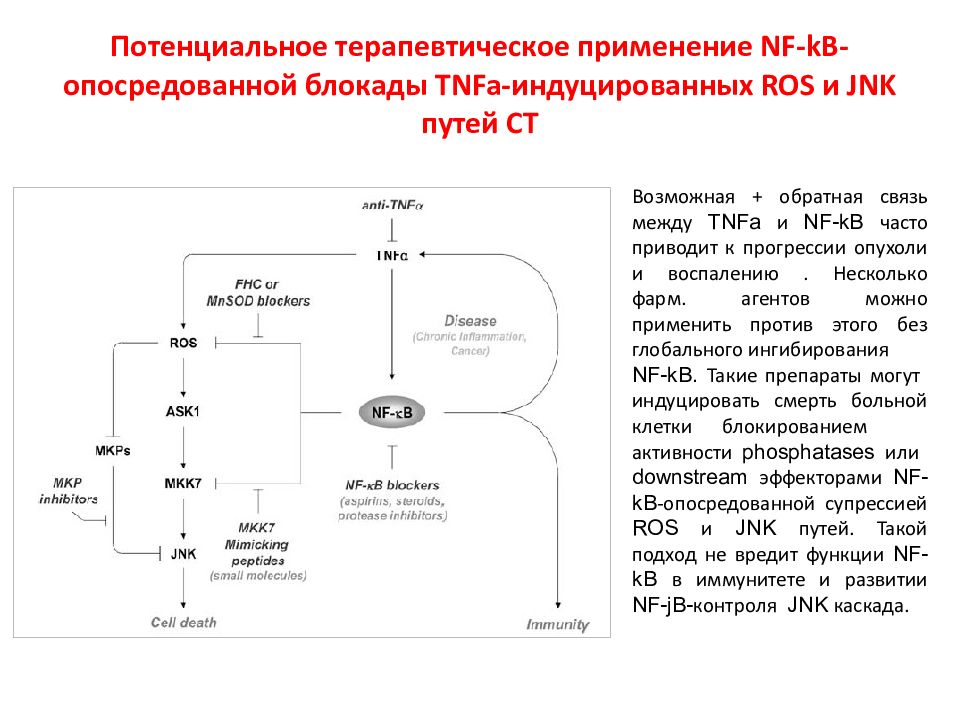
Слайд 118: Потенциальное терапевтическое применение NF-kB- опосредованной блокады TNFa- индуцированных ROS и JNK путей СТ
Возможная + обратная связь между TNF a и NF- k B часто приводит к прогрессии опухоли и воспалению. Несколько фарм. агентов можно применить против этого без глобального ингибирования NF - kB. Такие препараты могут индуцировать смерть больной клетки блокированием активности phosphatases или downstream эффекторами NF - kB -опосредованной супрессией ROS и JNK путей. Такой подход не вредит функции NF - kB в иммунитете и развитии NF - jB - контроля JNK каскада.
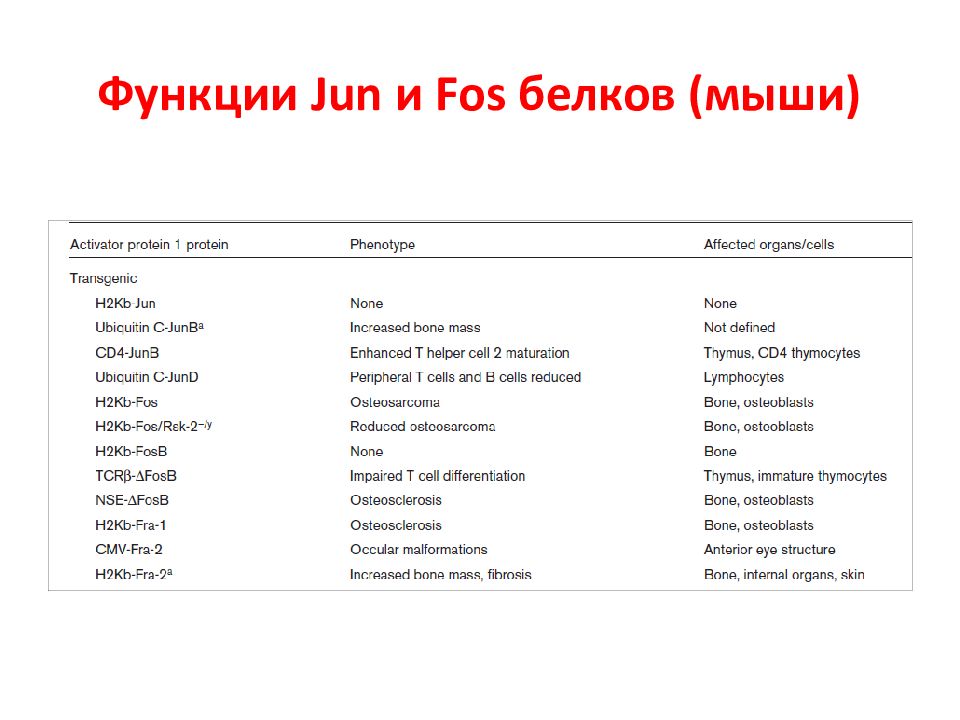
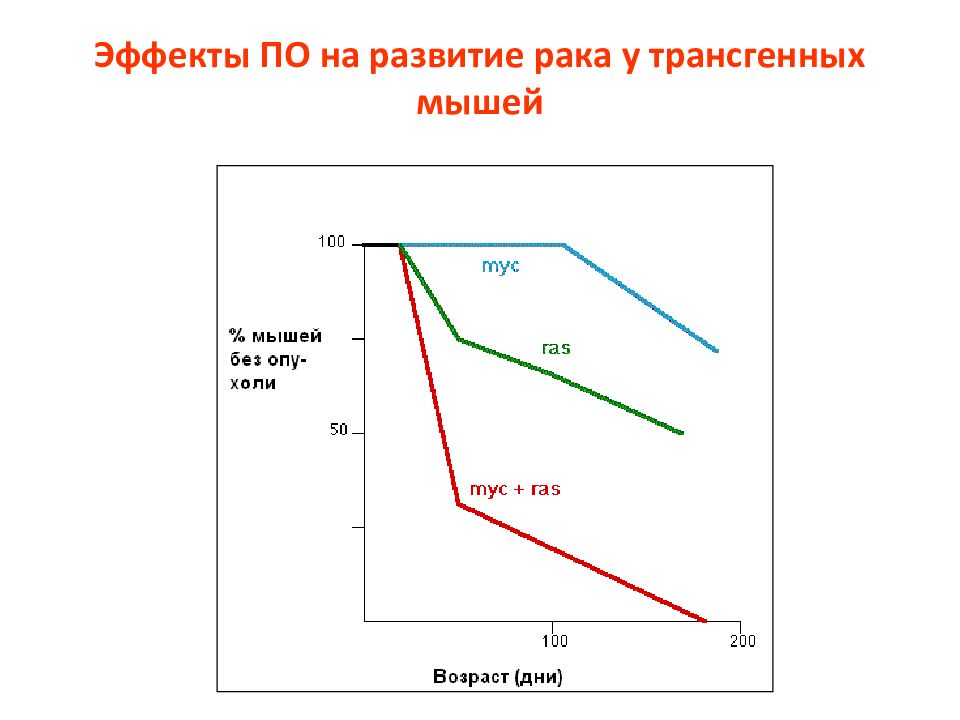
Слайд 119: АР1 семейство
Activator protein 1 (AP-1) семейство белков – содержат лейциновый зиппер (bZIP). Они регулируют многие клеточные процессы, включая пролиферацию, выживание, рост, дифференцировку, апоптоз, трансформацию. У млекопитающих это гомо- или гетеродимеры, которые формируются jun (c-jun, junB, junD), fos (c-fos, fra-1, fra-2) или atf белками.
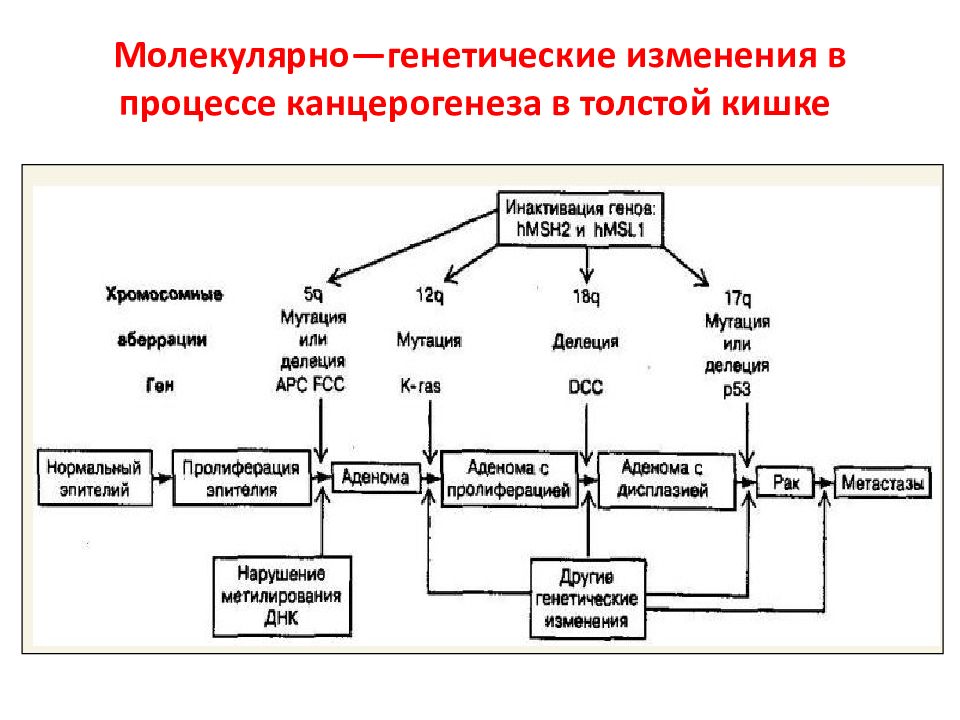
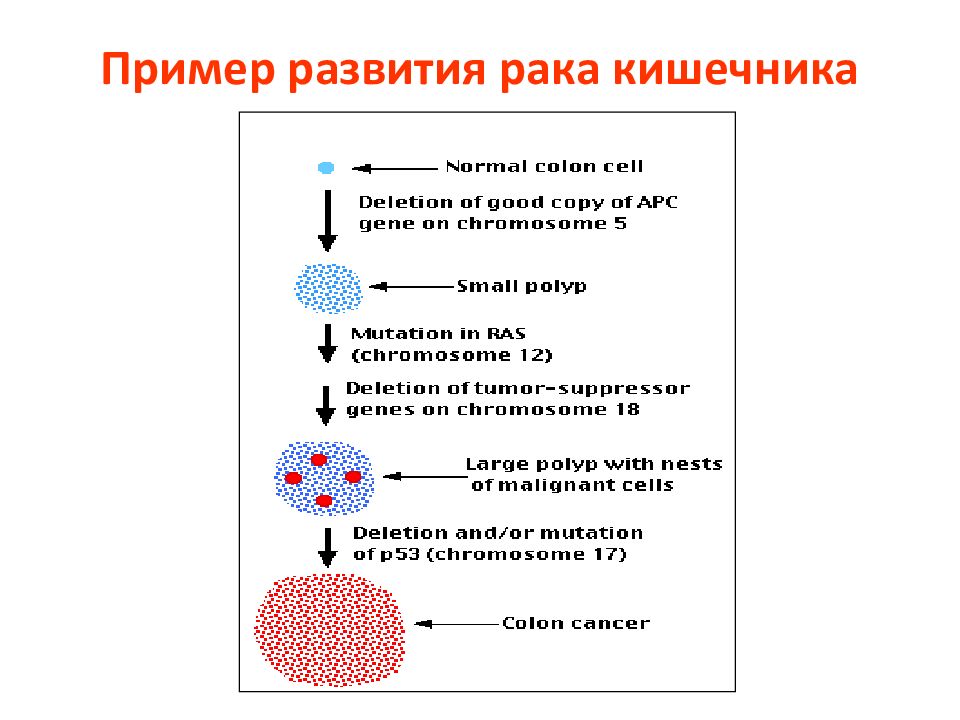
Слайд 130: Молекулярно—генетические изменения в процессе канцерогенеза в толстой кишке
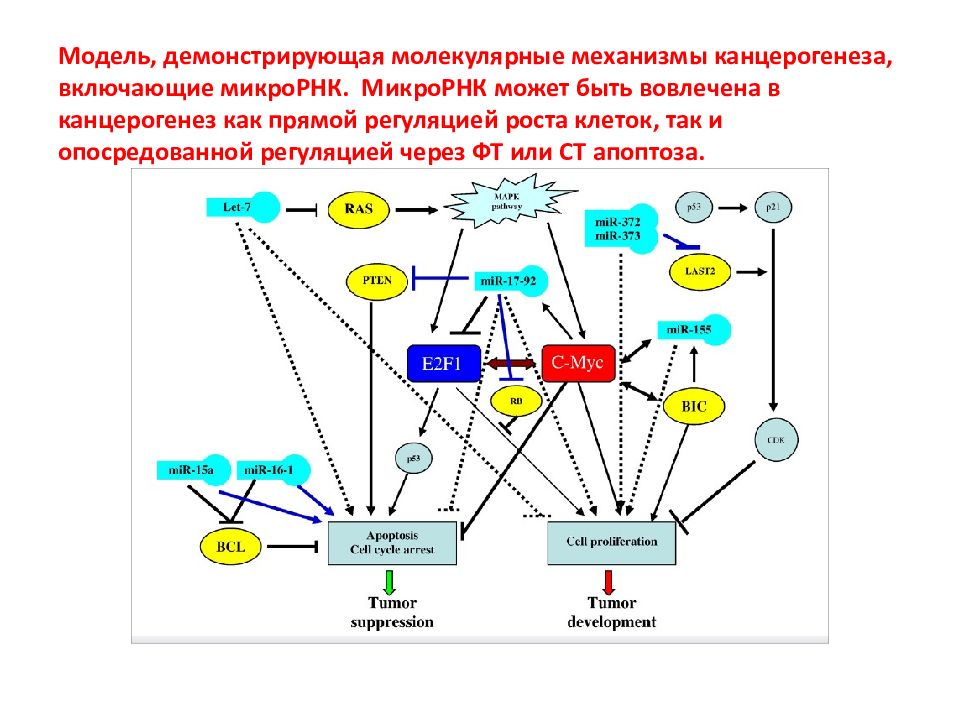
Слайд 133: Модель, демонстрирующая молекулярные механизмы канцерогенеза, включающие микроРНК. МикроРНК может быть вовлечена в канцерогенез как прямой регуляцией роста клеток, так и опосредованной регуляцией через ФТ или СТ апоптоза
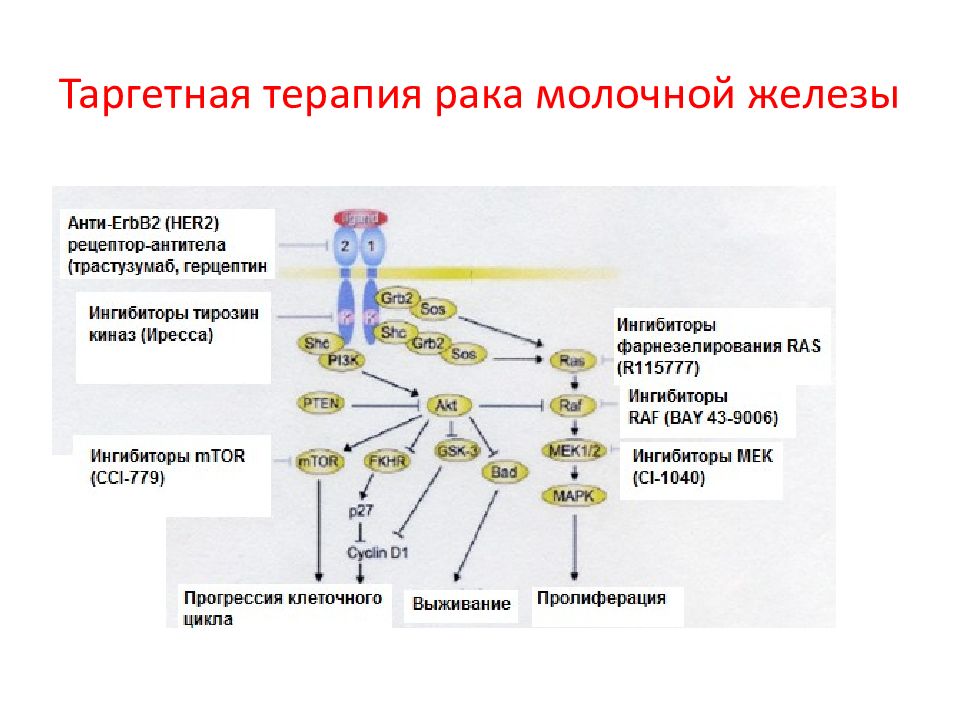
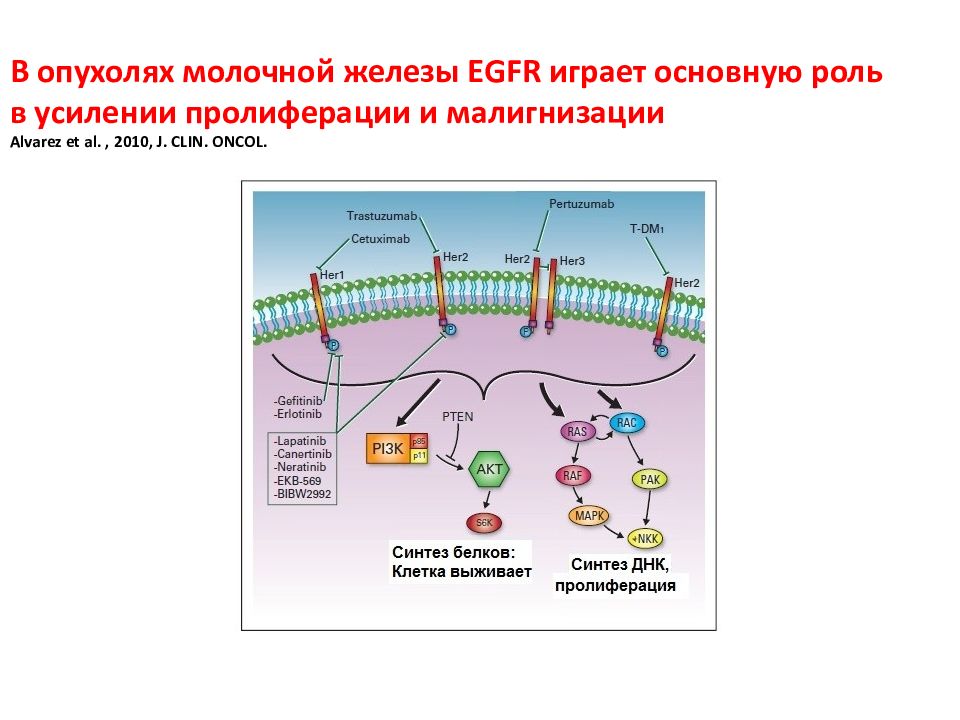
Слайд 137: В опухолях молочной железы EGFR играет основную роль в усилении пролиферации и малигнизации Alvarez et al., 2010, J. CLIN. ONCOL
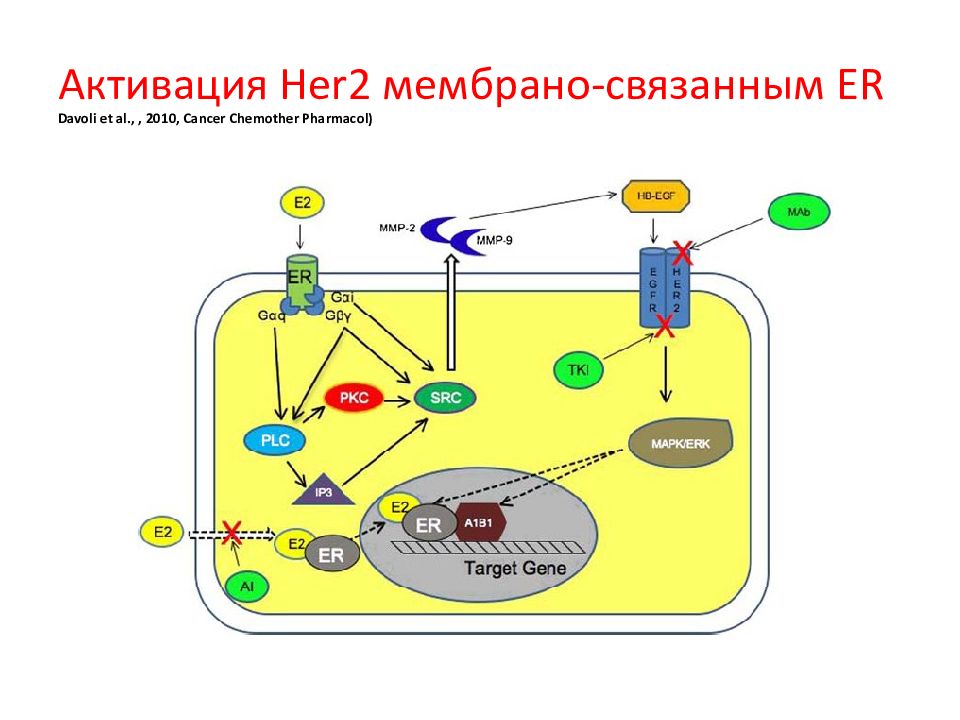
Слайд 138: Активация Her2 мембрано-связанным ER Davoli et al.,, 2010, Cancer Chemother Pharmacol)
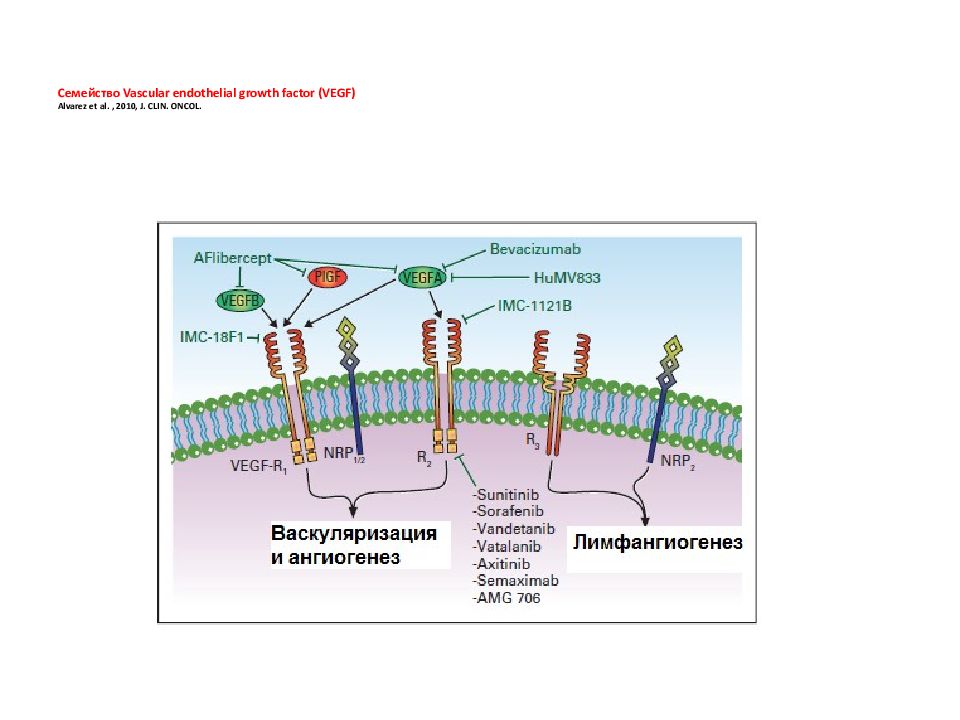
Слайд 139: Семейство Vascular endothelial growth factor (VEGF) Alvarez et al., 2010, J. CLIN. ONCOL
Слайд 141: Таргетная терапия в лечении рака легкого
NSCLC – немелкоклеточный рак легкого vascular endothelial growth factor (VEGF) Bevacizumab ингибирует VEGF Cetuximab – Mab против epidermal growth factor receptor (EGFR) Gefitinib и erlotinib - монотерапия
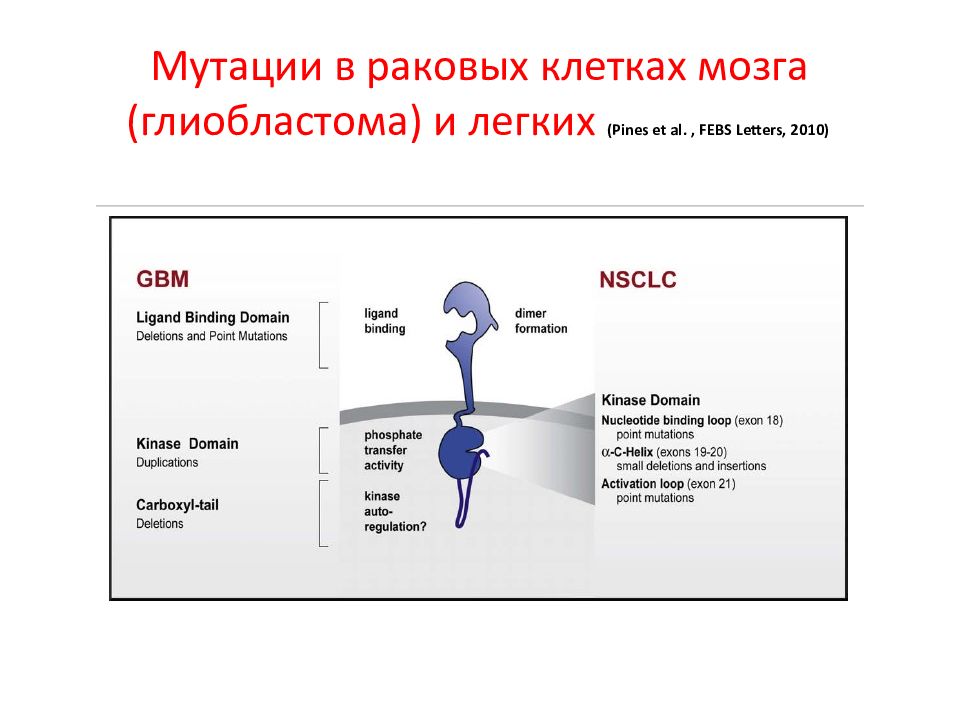
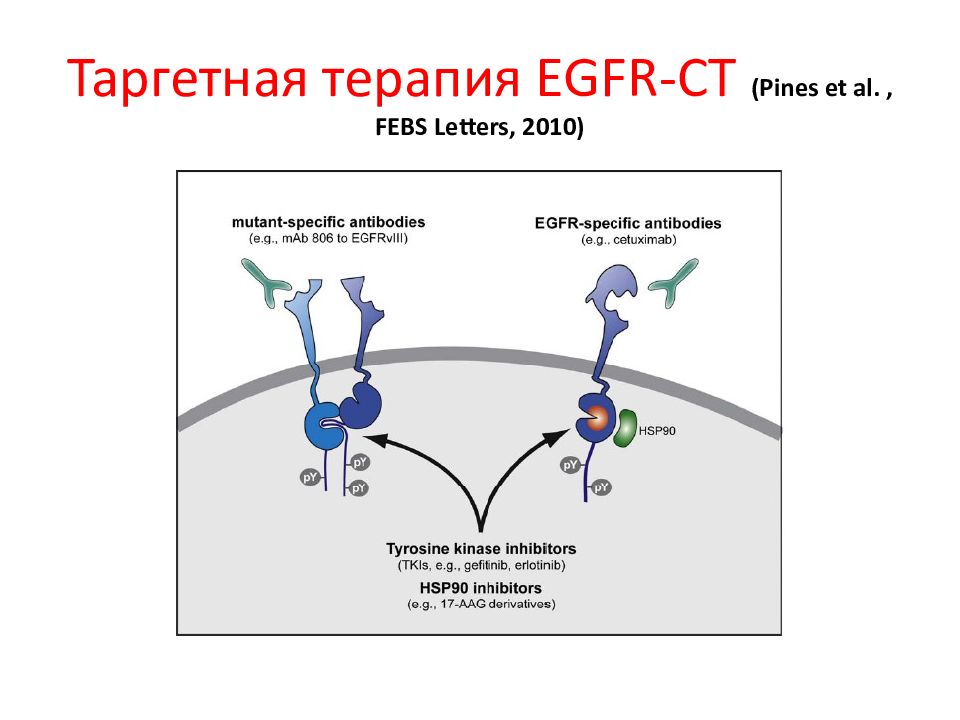
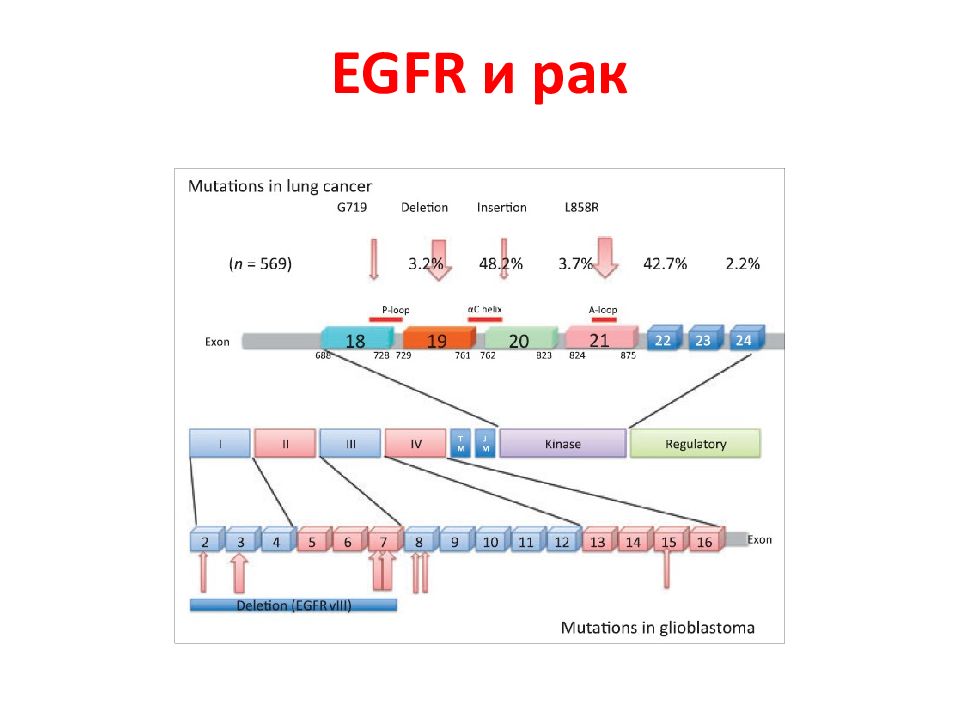
Слайд 142: Мутации в раковых клетках мозга (глиобластома) и легких ( Pines et al., FEBS Letters, 2010)
Слайд 145: Таргетная терапия в лечении рака кишечника
Panitumumab – антитела против EGFR, связывают лиганд-связывающий экстраклеточный домен, ингибируя димеризацию рецептора
Слайд 146: Мутации в опухолях кишечника (586 случаев) Kopper L. Pathol. Oncol. Res. (2010)
KRAS PIK3CA ( p110 каталитическая субъединица ) PI3K BRAF 35–45% <20%, < 15% Среди 208 больных, принимавших панитумумаб, 17% с диким типом KRAS показали объективный ответ, но не пациенты с мутациями (84 больных)
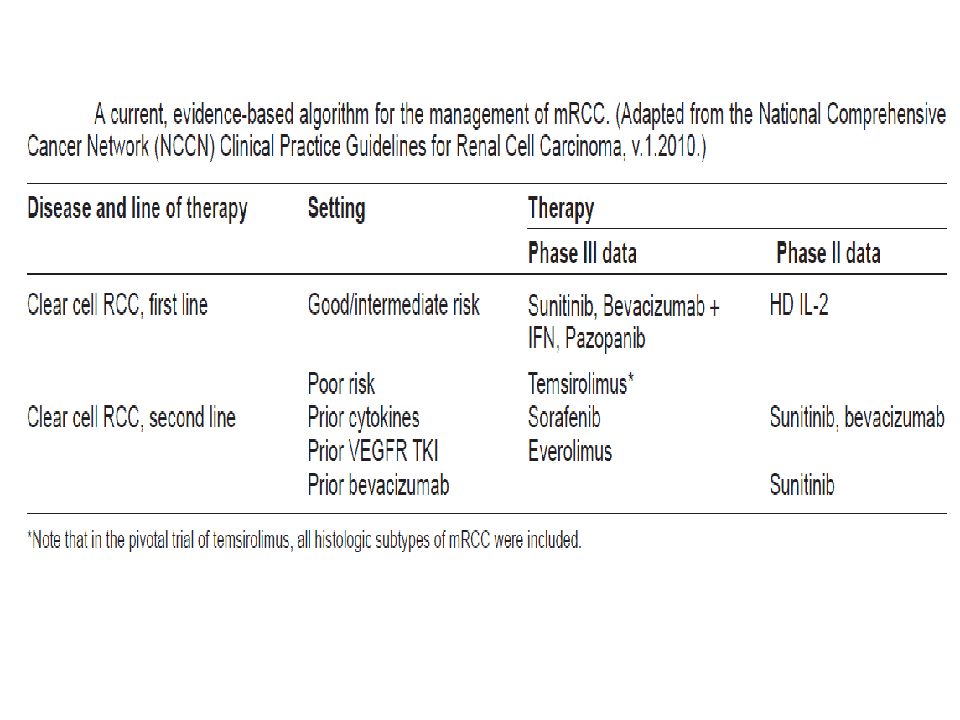
Слайд 147: Ренальная карцинома
2 категории терапии: (1) vascular endothelial growth factor receptor (VEGFR)- направленная терапия (2) Ингибиторы mTOR (аналоги рапамицина ).
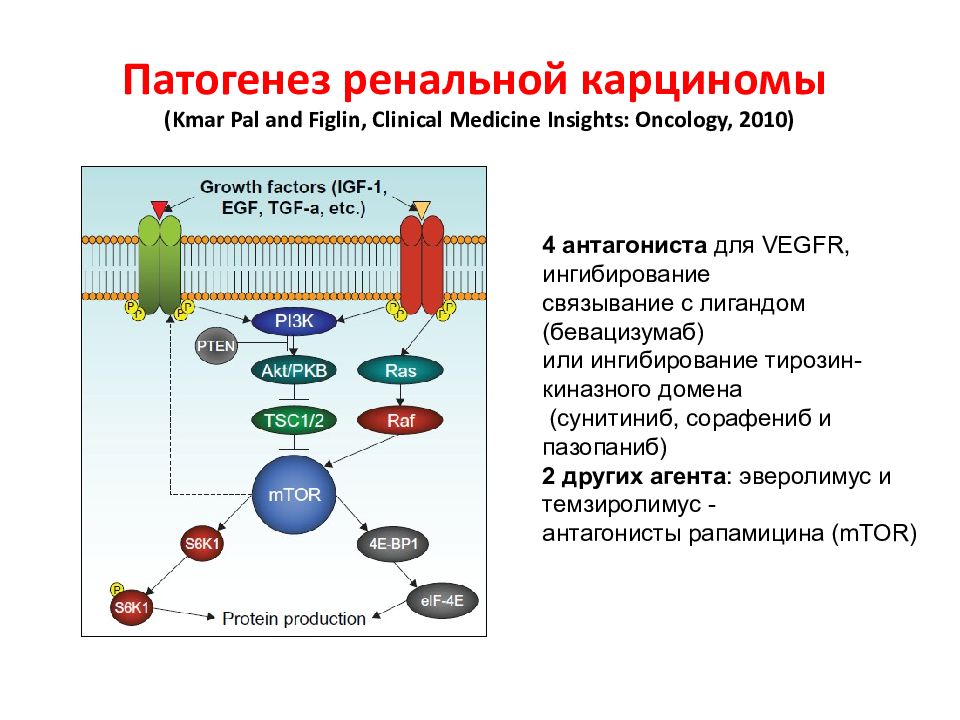
Слайд 148: Патогенез ренальной карциномы ( Kmar Pal and Figlin, Clinical Medicine Insights: Oncology, 2010)
4 антагониста для VEGFR, ингибирование связывание с лигандом (бевацизумаб) или ингибирование тирозин-киназного домена (сунитиниб, сорафениб и пазопаниб) 2 других агента : эверолимус и темзиролимус - антагонисты рапамицина (mTOR)
Слайд 151: Применение ингибиторов RAF
B-RAF мутации встречаются в 30–60% меланом, 30–50% тиреоидного рака, 5–20% рака кишечника Ингибиторы RAF киназ (Sorafenib) эффективно блокируют MEK1/2 и ERK1/2 активацию в клетках, содержащих онкогенный B-RAF Val600Glu (активирующая мутация). Ингибиторы RAF киназ приводят к парадоксальному увеличению активности RAF в клетках, содержащих дикий тип B-RAF или активированный мутантный RAS. C-RAF играет ключевую роль в усилении MEK-ERK активации.
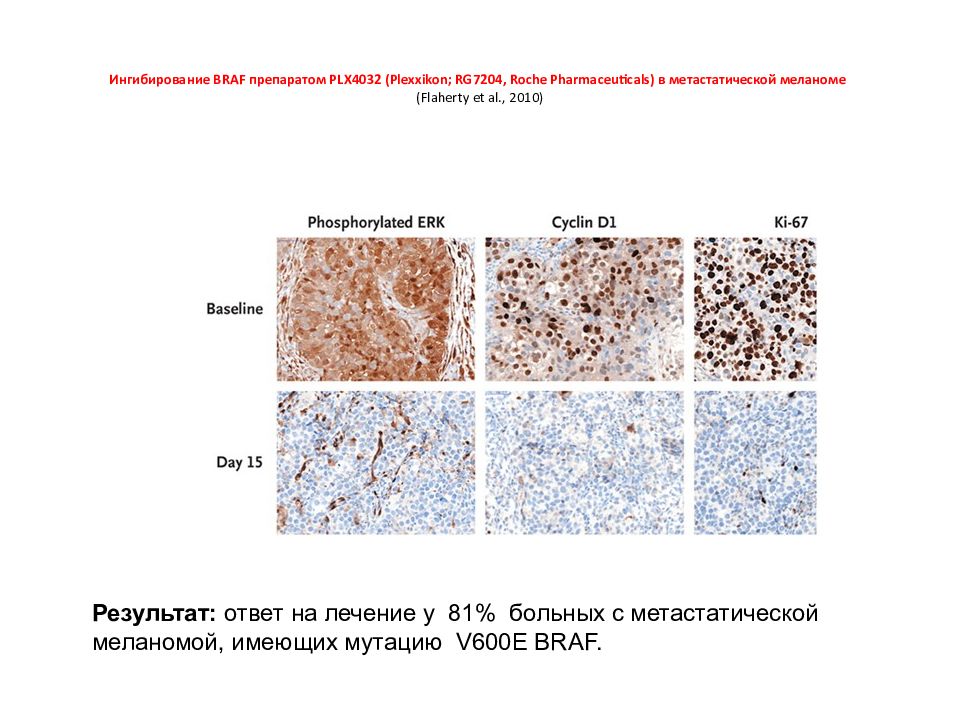
Слайд 152: Ингибирование BRAF препаратом PLX4032 (Plexxikon; RG7204, Roche Pharmaceuticals) в метастатической меланоме (Flaherty et al., 2010)
Результат: ответ на лечение у 81% больных с метастатической меланомой, имеющих мутацию V 600 E BRAF.
Последний слайд презентации: 5.2.1. Ассоциированные с мембраной белки (на примере RAS и SRC ): Перспективы изучения СТ
Сигнальная трансдукция Фундаментальные механизмы в клеточной биологии Патологии человека (рак, нейродегенеративные болезни и др.) Применение стволовых клеток в медицине